Кислородзависимая микробицидная активность. Кислороднезависимые механизмы уничтожения микробов.
Добавил пользователь Morpheus Обновлено: 17.01.2026
Клетки, выполняющие защитные функции - способны к фагоцитозу. В лейкоцитах много активных протеаз, расщепляющих чужеродные белки. В момент фагоцитоза увеличивается выработка перекиси водорода и увеличивается активность пероксидазы, что способствует окислению чужеродных частиц (антибактериальное действие).
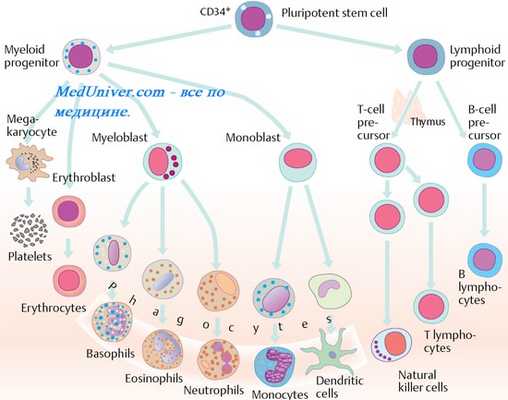
Лейкоциты богаты внутриклеточными низкоспецифичными протеиназами - катепсинами, локализованными в лизосомах. Катепсины способны к практически тотальному протеолизу белковых молекул. В лизосомах лейкоцитов в значительных количествах содержатся и другие ферменты: например, рибонуклеазы и фосфатазы. Способность некоторых клеток крови к фагоцитозу - одна из защитных функций крови. В фагоцитозе участвуют 2 типа лейкоцитов - нейтрофилы и моноциты.
Образование фагосомы начинается с взаимодействия специфических рецепторов фагоцитов с бактерией или комплексом антиген - антитело.
Активация рецепторов, передающих сигнал в клетку с участием инозитолфосфатной системы, инициирует процессы, определяющие фагоцитарный ответ клетки. Он включает в себя формирование фагосомы, слияние её с лизосомой, образование фаголизосомы, активацию кисло-родзависимых бактерицидных механизмов уничтожения микробов и выработку клетками токсичного для микробов оксида азота, а также действие кислороднезависимых механизмов уничтожения микроорганизмов.
Взаимодействие белков интегринов с рецепторами эндотелиальных клеток капилляров приводит к адгезии нейтрофилов, которые далее мигрируют в ткань. Моноциты также могут выходить из кровяного русла, и тогда их называют макрофагами.
Оба типа фагоцитов захватывают и разрушают бактерии. Макрофаги, кроме того, утилизируют старые повреждённые клетки и клеточные оболочки, в том числе эритроциты.
Активация кислородзависимых бактерицидных механизмов уничтожения микробов.
Ферментный комплекс мембраны фагосом - NADPH-оксидаза восстанавливает О2, образуя супероксидный анион: 2 О2 + NADPH → 2 O 2- + NADP + + H + .
Супероксидный анион спонтанно или при участии фермента супероксиддисмутазы превращается в пероксид водорода:
Под действием миелопероксидазы, проникающей в фагосому при её слиянии с лизосомой, из пероксидов в присутствии галогенов (йоди-дов и хлоридов) образуются дополнительные токсичные окислители - гипойодид и гипохлорид.
Все эти молекулы являются сильными окислителями и оказывают бактерицидное действие. Резкое увеличение потребления кислорода фагоцитирующей клеткой называется "респираторным взрывом".
Активные формы кислорода инициируют свободнорадикальные реакции, разрушающие липиды клеточных мембран поглощённых фагоцитами бактерий.
12. Особ метаболизма тромбоцитов, роль в гемостазе.
Тромбоциты имеют дисковидную форму диаметром от 2 до 5 мкм, толщиной около 0,5 мкм. В крови содержится 180-320 х 10 9 /л. Образуются в костном мозге.
Значение тромбоцитов в организме:
1) Участвуют в гемостазе (содержат тромбоцитарные факторы свёртывания).
2) Участвуют в транспорте креаторных веществ, важных для сохранения сосудистой стенки, стимулируют восстановление эндотелия.
3) Возможно, фагоцитируют низкомолекулярные соединения.
Мембрана тромбоцитов содержит рецепторы, необходимые для активации тромбоцитов, их адгезии (приклеиванию к субэндотелию) и агрегации. Мембрана содержит фосфолипидный фактор 3, формирующий активные коагуляционные комплексы с плазменными факторами свертывания крови. В мембрану встроены гликопротеины, ответственные за адгезию тромбоцитов к коллагену, имеются рецепторы к фактору Виллебранда. Гранулы цитоплазмы содержат АТФ, кальций, серотонин, катехоламины. Кальций регулирует адгезию, образование тромбоксана А2, АДФ, способствует агрегации. Серотонин и катехоламины обеспечивают сокращение сосудов в местах их повреждений.
Взаимодействие тромбоцитов и сосудистой стенки
В кровотоке постоянно содержится от 20 до 40% активированных "дежурных" тромбоцитов, готовых при появлении молекул адгезии моментально начать процесс свертывания крови. В процессе тромбоцитарно-сосудистого взаимодействия различают стадии адгезии тромбоцитов, их активации и агрегации.
При повреждении стенки сосуда обнажается коллаген базальной мемраны и создается чужеродная "тромбогенная" контактная поверхность. Одновременно из активированного эндотелия высвобождаются белки адгезии, в первую очередь фактор Виллебранда. Контактная поверхность адгезирует тромбоциты и запускает процесс свертывания.
Процесс адгезии заключается в прикреплении тромбоцитов, оказавшихся в зоне повреждения, к субэндотелиальным структурам. При этом происходит прямой контакт тромбоцитов и коллагена базальной мембраны через тромбоцитарные рецепторы GPIa/IIa. Одновременно выделенный из поврежденных эндотелиоцитов ф.Виллебранда связывается одной своей частью с тромбоцитарным рецептором GPIb, а другой -с коллагеном субэндотелия.
После прикрепления к поврежденной поверхности тромбоциты активируются. Активация
Адгезия тромбоцитов к коллагену (рецепторы GPIa/IIa) и взаимодействие с фактором Виллебранда (рецептор GPIb) приводит к их активации.
Связывание фактора Виллебранда с рецептором GPIb запускает кальций-фосфолипидный механизм передачи сигнала и это в итоге приводит к повышению внутриклеточной концентрации ионов Cа 2+ и активации протеинкиназы С. В результате:
ингибируется АТФ-зависимая аминофосфолипид-транслоказа, поддерживающая мембранную асимметрию фосфолипидов, и в результате на наружной поверхности мембраны появляется отрицательно заряженный фосфатидилсерин.
вместе с фосфатидилсерином на поверхность выходит особый гликопротеин (тканевой фактор), формируется комплекс тканевого фактора. Мембрана становится поверхностью для взаимодействия плазменных факторов свертывания, которая также называется тромбоцитарный тромбопластин.
происходит сокращение белка тромбостенина, в результате происходит дегрануляция и наружу высвобождаются факторы, активирующие адгезию и агрегацию,
изменяется форма тромбоцита, появляются псевдоподии, и он распластывается на контактной поверхности,
происходит активация фосфолипазы А2, которая от фосфатидилхолина мембраны отщепляет полиненасыщенную (например, арахидоновую) кислоту и из нее синтезируется тромбоксан А (например, тромбоксан А2) – сильный индуктор агрегации тромбоцитов и вазоконстриктор. Тромбоксан противодействует влиянию простациклинов, препятствуя активации аденилатциклазы и прерывая эффекты простациклинов.
Антагонизм действия простациклинов и тромбоксанов
Тромбоксан далее ускоряет высвобождение активных веществ (протромбина, PAF, АДФ, ионов Ca 2+ , серотонина, тромбоксана А и др.) из активированного тромбоцита, что поддерживает и усиливает активацию этого и соседних тромбоцитов. Активация усиливается также под действием АДФ, выделяющейся из поврежденных эритроцитови эндотелиоцитов сосудистой стенки.
Уже активированные тромбоциты имеют на своей поверхности рецепторы для активных и неактивных факторов V, VIII, IX, X, XI, протромбина и тромбина.
Процесс агрегации заключается в стабилизации тромба фибрином и в слипании активированных тромбоцитов друг с другом.
Любой пусковой сигнал приводит в активированном тромбоците к конформационным изменениям рецептора GPIIb/IIIa, который перемещается на мембрану. После связывания с этим рецептором фибриноген действует как мостик между прилегающими тромбоцитами и в зоне повреждения образуется тромбоцитарный тромб, армированный фибриногеном. Поначалу связь между тромбоцитами еще не прочна и такая агрегация является обратимой. Активация и агрегация поддерживается непрерывной секрецией содержимого гранул из связывающихся тромбоцитов.
Продолжающаяся дегрануляция тромбоцитов и секреция ими простагландинов (PgG2 и PgH2), тромбоксана А2, АДФ, превращение фибриногена в фибрин (катализируемое тромбином) делают агрегацию необратимой. Такой тромбоцит прочно связан с другими клетками, он потерял содержимое гранул и не может вернуться в исходное состояние.
Ретракция – это уплотнение сгустка крови с выделением из него избытка сыворотки. Стимулом для ретракции являются различные вещества, выделяемые тромбоцитом на этапах активации и агрегации. Ретракция осуществляется благодаря тому, что к внутриклеточной части рецепторов GPIIb/IIIa присоединен сократительный белок тромбостенин (подобен актомиозину мышечных волокон), который при накоплении в цитозоле ионов Ca 2+ сокращается и сжимает сгусток.
Сжатие сгустка обусловливает повышение давления внутри тромбоцита и вызывает дополнительный выброс веществ из его гранул, что еще более усиливает ретракцию и окончательно уплотняет тромб. В норме кровотечение из мелких сосудов продолжается не более 5 минут.
Кислородзависимая микробицидная активность. Кислороднезависимые механизмы уничтожения микробов.
Интерферон (ифн) первого типа. ИФН I. Функции интерферона (ифн) первого типа. Интерферон (ифн) второго типа. ИФН II (b-ИФН). Функции интерферона (ифн) второго типа.
Интерферон (ифн) первого типа. ИФН I. Функции интерферона (ифн) первого типа. Основной биологический эффект интерферона (ифн) первого типа — подавление синтеза вирусных белков; способны воздействовать на другие этапы репродукции вирусных частиц, включая отпочковывание дочерних популяций. «Антивирусное состояние» клетки развивается в течение нескольких часов после введения ИФН или индукции их синтеза.
При этом интерфероны (ифн) первого типа не влияют на ранние этапы репликативного цикла (адсорбцию, пенетрацию и «раздевание» вирусов) — противовирусное действие проявляется даже при заражении к.леток инфекционными РНК. Интерфероны (ифн) первого типа не проникают в клетки; а взаимодействуют со специфическими мембранными рецепторами (ганглиозиды или аналогичные структуры, содержащие олигосахара).
По связыванию интерферона (ифн) первого типа с рецептором и реализации его эффектов механизм активности напоминает действие некоторых гликопептидных гормонов. Интерферон (ифн) первого типа активирует гены, некоторые из которых кодируют образование продуктов с прямым антивирусным действием — протеинкиназы и 2'5'-олигоаденилат-синтетазы (рис. 10-5).
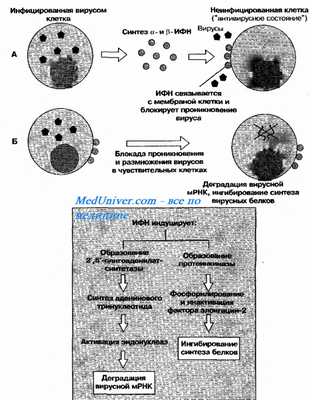
Рис. 10-5. Механизмы антивирусного действия ИФН I. A— в иеинфицированных вирусом клетках ИФН вызывает развитие «антивирусного состояния», блокируя проникновение в них вирусов. Б — после проникновения вируса в клетки, обработанные ИФН, вирусная РНК индуцирует образование РНК-проте-инкиназы. Фермент аутофосфорилируется, а затем фосфорилирует фактор элонгации 2, нарушая сборку белковой молекулы. Двухнитевая вирусная РНК индуцирует синтез 2'5'-олигоаденилатсинтетазы, катализирующей образование аденинового тринуклеотида с уникальными 2'5'-фосфодиэфирными связями. Последний активирует латентные эндонуклеазы, разрушающую вирусные мРНК.
Интерферон (ифн) второго типа. ИФН II (b-ИФН). Функции интерферона (ифн) второго типа
ИФН II (b-ИФН) также способны проявлять антивирусный эффект. Он связан с несколькими механизмами. Во-первых, активация интерфероном (ифн) второго типа NO-синтетазы приводит к повышению внутриклеточного содержания оксида азота, ингибирующего размножение вирусов.
Во-вторых, интерферон (ифн) второго типа активирует эффекторные функции NK-клеток, Т-лимфоцитов, моноцитов, тканевых макрофагов и гранулоцитов, проявляющих антителозависимую и антителонезависимую цитотоксич-ность. Кроме того, интерферона (ифн) второго типа блокирует депротеинизацию («раздевание») вирусов, высвобождение зрелых вирусных частиц из клетки, а также нарушает метилирование вирусной РНК. В смешанных культурах ИФН-чувствительных и ИФН-резистентных клеток «антивирусное состояние» чувствительных клеток распространяется и на популяции резистентных клеток.
Естественные AT («антигеннезависимые», «неспецифические» AT) составляют до 7% общего количества Ig в сыворотке крови неиммунизированных людей и животных. Их происхождение связывают с ответом иммунной системы на Аг нормальной микрофлоры. В эту же группу входят AT, длительно циркулирующие после выздоровления от инфекционного заболевания. Часть пула подобных AT синтезируется параллельно с образованием специфических AT. Необходимость в их появлении остаётся неясной. Эти AT низкоспецифичны, но способны перекрёстно реагировать с широким спектром Аг. Вызывают агглютинацию микробов, их разрушение (в присутствии комплемента), нейтрализуют вирусы и токсины, а также стимулируют фагоцитарные реакции (через опсонизацию возбудителей).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Факторы неспецифической резистентности организма. Система ИФН. Система интерферона (ифн). Функции интерферона (ифн). Механизм антивирусного действия интерферона (ифн).
Система интерферона (ифн) — важнейший фактор неспецифической резистентности организма человека. Следует отметить, что открытие интерферона (ифн) А. Айзексом и Ж. Линденманном (1957) было плодом блестящей случайности, по своей значимости сравнимой с открытием пенициллинов Флемингом: изучая интерференцию вирусов, авторы обратили внимание на то, что некоторые клетки становились резистентными к повторному заражению вирусами. В настоящее время ИФН относят к классу индуцируемых белков клеток позвоночных.
Функции интерферона (ифн)
Важнейшие функции интерферона (ифн): антивирусная, противоопухолевая, иммуномодулирующая и радиопротективная. Различают три интерферона (ифн):
а-ИФН синтезируют лейкоциты периферической крови (ранее был известен как лейкоцитарный ИФН);
b-ИФН синтезируют фибробласты (ранее известен как фибробластный ИФН);
у-ИФН — продукт стимулированных Т-лимфоцитов, NK-клеток и (возможно) макрофагов (ранее был известен как иммунный ИФН).
По способу образования различают ИФН типа I (образуется в ответ на обработку клеток вирусами, молекулами двухцепочечной РНК, полинуклеотидами и рядом низкомолекулярных природных и синтетических соединений) и ИФН типа II (продуцируется лимфоцитами и макрофагами, активированными различными индукторами; действует как цитокин).
ИФН видоспецифичны. Каждый биологический вид, способный к их образованию, продуцирует свои уникальные продукты, похожие по структуре и свойствам, но не способные проявлять перекрёстный антивирусный эффект (то есть действовать в условиях организма другого вида).
Механизм антивирусного действия интерферона (ифн)
Интерферон ( ИФН ) индуцируют антивирусное состояние клетки (резистентность к проникновению или блокада репродукции вирусов). Блокада репродуктивных процессов при проникновении вируса в клетку обусловлена угнетением трансляции вирусной мРНК. При этом противовирусный эффект интерферона (ифн) не направлен против конкретных вирусов; то есть ИФН не обладают вирусспецифтностъю. Это объясняет их универсально широкий спектр антивирусной активности. ИФН взаимодействует с интактными клетками ещё неинфицированными клетками, препятствуя реализации репродуктивного цикла вирусов за счёт активации клеточных ферментов (протеинкиназ).
21. Взаимодействие о2-зависимой и о2-независимой систем бактерицидности (бактериостатичности) в совершении киллинг эффекта фагоцитов
Конечное назначение фагоцитоза состоит в создании оптимальных условий для киллинга и цитолиза патогенов, т.е. в осуществлении внут- риклеточного цитолиза. Поэтому эффективность фагоцитоза обусловлена не столько поглощением патогена, сколько его разрушением внутри клетки. В зависимости от реализации бактерицидных свойств, различают завер- шенный и незавершенный фагоцитоз. Только первый отвечает своему био- логическому предназначению и может рассматриваться как эффективная защитная реакция — проявление врожденного иммунитета. Киллинг происходит в фаголизосомах фагоцитов. Фаголизосомы содержат факторы, разрушающие микроорганизмы (табл. 2.20). Выделяют несколько групп таких факторов:
кислородзависимые факторы: активные формы кислорода; галоидсодержащие соединения;
;кислород- и оксид азота-независимые факторы: факторы, обусловливающие локальное закисление; бактрицидные пептиды; катионные белки; ферменты; конкурентные ингибиторы метаболизма.
Все эти факторы проявляют свою бактерицидную и литическую актив- ность преимущественно в фаголизосомах, в которые они поступают из лизосом (ферменты, пептиды) или генерируются de novo (активные формы кислорода и азота). Некоторые из бактерицидных факторов (NO и его мета- болиты) могут формироваться и действовать вне гранулярного аппарата клеток. Все бактерицидные факторы могут проявлять свою активность также за пределами клетки, куда они попадают в результате дегрануля- ции или других форм секреции.
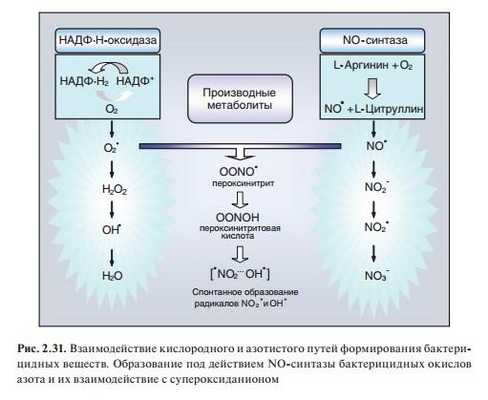
Кислородзависимые факторы бактерицидности. В обеспечении киллинга фагоцитированных микроорганизмов наибо- лее важна роль производных кислорода. Главное событие в образовании кислородзависимых бактерицидных факторов — кислородный взрыв — быстрое (реализуемое за секунды) и высокопродуктивное осуществление цепи реакций, приводящих к образованию активных форм кислорода. Активные формы кислорода включают высокореактивные свободные радикалы, ионы кислорода и кислородсодержащих химических групп. Образование активных форм кислорода катализируется ферментом NADPH-оксидазой (NADPH — восстановленная форма никотинамиддинуклеотидфосфата), называемой также оксидазой фагоцитов (Phоx). В результате респираторного взрыва образуются мощные бактерицидные агенты: супероксидный анион (О2 — ), перекись водорода H202), синглетный кислород ( 1 O2), гидроксильные радикалы (ОН — ). Сочетание перекиси водорода, миелопероксидазы и ионов галогенов создает мощную систему галогенирования, приводящую к появлению крайне агрессивных вторичных метаболитов: гипохлорной кислоты (НОСl), хлорамина, продуктов перекисного окисления липидов (ПОЛ). Ключевым считается супероксидный анион, с которого берет начало каскад активных форм кислорода и сопряженных с ним феноменов.
Кислороднезависимые механизмы. При дисмутации супероксидного аниона потребляются ионы водорода и слегка повышается рН, это создает оптимальные условия для функционирования семейства катионных белков. Эти белки, имеющие высокую изоэлектрическую точку, разрушают бактериальную стенку за счет протеиназного эффекта и за счет непосредственного присоединения к поверхности микроорганизма. Низкие значения рН, устанавливающиеся после слияния фагосомы с лизосомами, лизоцим и лактоферрин представляют собой Кислороднезависимые бактерицидные и бактериостатические факторы, которые могут действовать в анаэробных условиях. Убитые микроорганизмы расщепляются гидролитическими ферментами, и продукты деградации высвобождаются из фагоцитарной клетки.
Разные формы реактивности фагоцитов обеспечиваются и проявляются нередко независимо друг от друга. При хроническом грануломатозе макрофаги и нейтрофилы в связи с дефектом цитохромов b—245 не способны образовывать активные метаболиты кислорода. Это сопровождается тем, что бактерии фагоцитируются, но не уничтожаются в клетках. Кроме того, известно, что многие микроорганизмы содержат в большом количестве каталазу и могут легко инактивировать продуцируемую фагоцитами перекись водорода. Фагоциты, дефектные по глюкозо—6—фосфатдегидрогеназе, не способны продуцировать активные метаболиты кислорода и защищать организм от бактериальных инфекций.
Закисление внутренней среды фаголизосомы . При эндоцитозе содержимое эндосом закисляется. Для ранних эндосом характерны слабокислые значения рН (6,0–6,5). Кроме того, кислая среда способствует активации большинства ферментов (особенно из азу- рофильных гранул), обладающих бактерицидной и бактериолитической активностью. Продукты, выделяющиеся при разрушении микроорганиз- мов, усиливают закисление.
Ферменты Как известно, сначала с фагосо- мами сливаются специфические гранулы, содержащие ферменты, активные при нейтральных и слабощелочных значениях рН (именно такой pH имеет среда фагосом на данном этапе): щелочную фосфатазу и лизоцим, входящие в группу катионных белков (см. далее). Азурофильные гранулы — допол- нительный источник лизоцима и лактоферрина. Из азурофильных гранул в фаголизосому поступают также нейтральные протеазы, объединяемые в группу серпроцидинов, — еще одних представителей катионных белков. Большинство сосредоточенных в фаголизосомах ферментов участвуют в расщеплении убитых микроорганизмов.
Катионные белки . В составе катионных белков преобладают щелочные аминокислотные остатки (что и определяет их катионность). Среди катионных белков есть как обладающие ферментативной активностью (лизоцим и серпроцидины), так и конкурентные белки, бактерицидное действие которых основано на связывании жизненно важных для патогенов веществ (лактоферрин, вита- мин В12-связывающий фактор). Лизоцим — катионный белок. Лизоцим — фермент, обладающий активностью мурамидазы. Лактоферрин — катионный белок, служащий маркером специфических гранул.
Бактерицидные, или антибиотические, пептиды — наиболее интенсивно изучаемые бактерицидные факторы многоклеточных. Выделяют несколько групп бактерицидных пептидов, из которых наиболее известны дефензины и кателицидины. Дефензины — катионные пептиды.
ПЕРЕВАРИВАНИЕ ОФ.
Стадия переваривания возможна только в том случае, если фагоцитируемый объект утратил жизнеспособность.
Переваривание обусловлено выделением в фагосому содержимого лизосом фагоцита. Лизо-сомы содержат около 60 различных ферментов – гидролаз (протеазы, липазы, фосфолипазы, эластазы, коллагеназы, ДНК-азы, РНК-азы, амилазы, глюкозидазы и др.). В результате слияния лизосом и фагосом формируется фаголизосома, в которой происходит окончательная деградация компонентов чужеродного объекта.
Процесс, который заканчивается гибелью микроорганизмов или чужеродных агентов, называется завершенным фагоцитозом. Однако некоторые фагоцитированные микроорганизмы не погибают, например, гонококки, микобактерии туберкулеза и другие. Они не только сохраняют жизнеспособность, но и активно размножаются в лейкоцитах. Такой процесс называется незавершенным фагоцитозом или эндоцитобиозом. Он может возникать вследствие ферментативной недостаточности лейкоцитов, например, из-за их инактивации токсинами. Также возможен недостаточный или извращенный синтез ферментов, связанный с врожденными аномалиями (например миелопероксидазной системы); возможна устойчивость микробов к ферментам фагацитов. Итогом незавершенного фагоцитоза может стать генерализация инфекции (сепсис), в других случаях – персистенция инфекции и затяжное течение воспаления.
УМЕРЩВЛЕНИЕ ОФ. После завершения поглощения объекта фагоцитоза сформировавшаяся фагосома сливается с первичными лизосомами, первичными азурофильными и вторичными специфическими гранулами фагоцитов, образуя при этом фаголизосому. Из гранул в фагосому попадает большое количество бактерицидных веществ и ферментов. Умерщвление (киллинг) микробов в фагосоме осуществляется двумя путями: кислород - зависимым и кислород - независимым.
Кислород - зависимая антимикробная система реализует свою функцию с помощью активных форм кислорода либо с участием фермента миелопероксидазы (миелопероксидазной системы), высокоактивной в отношении бактерий, грибов, микоплазм и вирусов. Взаимодействие миелопероксидазы и перекиси водорода сопровождается окислением галоидов и галогенизацией, заключающейся в йодировании, хлорировании или бромировании бактериальных компонентов (мембран микроорганизмов), что повышает проницаемость наружной мембраны и приводит к гибели бактерий. Благодоря миелопероксидазной системе фагоциты (главным образом нейтрофильные гранулоциты) способны уничтожать многие грамположительные и грамотрицательные бактерии и вирусы.
В случае несостоятельности миелопероксидазной системы, например при врожднном ее дефекте в нейтрофильных гранулацитах развивается тяжелая патология с нарушение фагоцитоза. При этом патогенные микроорганизмы активно захватываются фагоцитами но не погибают в них, а остаются живыми и способными к размножению. Это приводит к последующему разрыву такого фагоцита и выходу микроорганизмов из него и дальнейшему распространению в организме (незавершенный фагоцитоз и генерализация инфекции).
Кислород - независимый механизм умерщвления микроорганизмов включает освобождение из гранул лейкоцита в фагосому бактерицидных веществ:
лизоцима, который расщепляет пептидогликаны клеточных мембран некоторых грамположительных бактерий;
лактоферрина, который связывает железо (ростовой фактор для многих микроорганизмов) и тем самым оказывает микробостатическое действие;
неферментных катионных белков, среди которых наиболее эффективными являются низкомолекулярные дефенсины. Эти белки не обладают ферментативной активностью, но содержат большое количество основных аминокислот (аргинина и лизина), обеспечивающих им положительный заряд, который противоположен заряду мембраны микроорганизмов. Это приводит к неспецифическому электростатическому взаимодействию с белками мембран микроорганизмов в результате которого изменяется структура мембран повышается их проницаемость и микроорганизмы становятся доступными воздействию на них лизосомных гидролаз.
Определенное бактерицидное действие оказывает закисление среды до рН 6,5 – 3,75 в фаголизосомах. Ацидоз также активирует лизосомные гидролазы, которые завершают деградацию умерщвленных бактерий. Микробоцидные системы действуют в кооперации и обладают надежностью и эффективностью.
23. Функционирование лейкоцитов в очагах острого и хронического воспаления.
(Спросите у ВВ, нужно ли описывать гранулему, как пример хронического воспаления. Если ДА – в конце файла!)
Воспаление - форма клеточного неспецифического иммунитета. Которая представляет собой локальную или системную, с одной стороны, патологическую, а с другой стороны, адаптационно-защитную реакцию, в результате которой организм ценой частичных утрат сохраняет себя как жизнедеятельную систему. Воспаление делят на острое и хроническое.
Эмиграция лейкоцитов связана с появлением в очаге воспаления специальных медиаторов хемоаттрактантов (эндогенные хемоаттрактанты: фрагменты активируемого при воспалении комплемента (С5а), лейкотриен В4, фактор активации тромбоцитов и каликреин). Нейтрофилы в процессе активации высвобождают хемотаксические факторы для моноцитов. Тем не менее порядок эмиграции клеток в очаге воспаления может изменяться. Лимфоциты могут первыми эмигрировать при вирусной инфекции и туберкулезе, а эозинофилы – при аллергических реакциях.
Острое воспаление – первыми эмигрируют нейтрофилы (в первые 6-24 ч). Через 24-48 ч наиболее активно эмигрируют моноциты, а лимфоциты немного позднее. Регулирующую функцию выполняют все виды гранулоцитов: эозинофилы, нейтрофилы и базофилы.
"Закон эмиграции" Мечникова или "стадии клеточной реакции при воспалении":
1) полинуклеарная (нейтрофилы и эозинофилы) до 2 суток,
2) мононуклеарная (моноциты и лимфоциты) до 5-6 дней,
3) фибробластическая, характеризуется скоплением в очаге воспаления гистиоцитов и фибробластов.
1. Нейтрофилы более чувствительны к влиянию хемотоксинов.
2. Иной механизм эмиграции у моноцитов: моноцит внедряется в тело эндотелиальной клетки в виде большой вакуоли, проходит через её тело и выходит наружу, а не через межклеточные щели.
Роль нейтрофилов в очаге воспаления:
1. Появляются в очаге воспаления через 10 мин. после начала реакции воспаления.
2. Количество нейтрофилов достигает максимума через 4 – 6 час. после начала воспалительной реакции.
3. Фагоцитоз бактерии, продуктов распада, чужеродных частиц.
4. Поставка ферментов, катионных белков, активных форм кислорода.
5. Разрушение нейтрофилов – их остатки есть стимул для поступления и активности моноцитов.
Активация нейтрофилов предусматривает необратимые изменения функции и структуры: повышение адгезивности, появление способности к хемотаксису, фагоцитоз, внутри- и внеклеточный лизис поврежденных тканей, которое сопровождается выделением биологически активных продуктов расщепления, а также свойство выделять биооксиданты.
Нейтрофилы способные в очаге воспаления образовывать большое количество перекиси водорода и активных форм кислорода. Этот процесс называется “респираторный взрыв” и считается мощном механизмом уничтожения микроорганизмов (аэробов), разрушения окружающих тканей и самых нейтрофилов, которые гибнут в этих условиях.
Экстрацелюллярная секреция веществ способствует саморегуляции процесса воспаления.
Моноциты и тканевые макрофаги считаются ключевыми клетками сложного межклеточного взаимодействия в очаге воспаления. Моноциты находятся в крови до 3 суток, уходят в ткани и находятся в них около 10 дней. Часть их дифференцируется в оседлые тканевые макрофаги, часть находится в неактивном состоянии и может вновь активироваться. Поэтому моноциты называют клетками многоразового пользования.
Роль моноцитов в очаге воспаления:
1.Появляются в очаге воспаления через 16 – 24 час. после начала реакции воспаления.
2.Количество моноцитов достигает максимума через 72 час после начала.
3.Постепенно трансформируются в макрофаги: - увеличивается объём цитоплазмы и органелл; - увеличивается количество митохондрий и лизосом; - образуются фаголизосомы;
- образуется медиаторы воспаления; - в результате активируется фагоцитоз!
Эмиграция и активизация моноцитов зависит от предыдущего выхода нейтрофилов. Вся масса клеток, которая накапливается в очаге воспаления, образует воспалительный инфильтрат. Этот инфильтрат есть причина припухлости в очаге воспаления.
Макрофаги не только способны фагоцитировать инородные агенты или поврежденную ткань, но и стимулировать специфические механизмы защиты организма – иммунный ответ. Фагоцитоз инородного объекта осуществляется благодаря электростатическому взаимодействию и наличию на цитолеммальной мембране специфических рецепторов: рецепторы к Fc-фрагменту Ig G – обеспечивают иммунное связывание и поглощение частичек, которые окружены этим иммуноглобулином, а также иммунных комплексов; рецепторы другого типа – для связывания С3 компонента системы комплемента. Связывание и поглощение частиц вызывает стимуляцию окислительных процессов в фагоците и выделение бактерицидных продуктов (лизосомальных ферментов, катионных неферментных белков). Все это обеспечивает уничтожение патогенного агента.
Лимфоцит. Важной клеткой, которая определяет завершение воспаления, в особенности спровоцированного вирусной инфекцией, является лимфоцит. Попаданию лимфоцита из крови в очаг воспаления способствуют монокины (биологически активные вещества, которые секретируются макрофагами). Одним из необходимых компонентов воспаления является активация иммунной системы, которая сопровождается взаимодействием фагоцитов, в частности макрофагов, с Т- и В-лимфоцитами и активацией системы комплемента. Образование антител и соединение с антигенами, которые или попадают в организм и вызовут воспаление, или образуются при повреждении тканей, способствует элиминации инородного агента из организма. Известно, что все эффекторные клетки воспаления имеют Fc-рецепторы иммуноглобулинов и С-рецепторы комплемента.
Хроническое воспаление
В очаге воспаления с самого начала накапливаются не сегментоядерные нейтрофилы, а моноциты.
- моноциты в очаге воспаления трансформируются в макрофаги
- макрофаги фагоцитируют м/о (микроорганизмы)
- м/о внутри макрофага не погибает, а продолжает жить и размножаться внутри макрофага
Макрофаг, котрый содержит живые м/о, называется активированным макрофагом.
Следующие стадии при хроническом воспалении:
4.Выделение хемотоксинов. Источник хемотоксинов – активированные макрофаги. Хемотоксины: лейкотриены С4 и Д4, простагландины Е2, продукты распада коллагена
5.Повышение проницаемости капилляров.
6.Заякоривание макрофагов. В очаге моноциты и макрофаги выделяют фибронектин, который прочно присоединяет их к соединительной ткани.
7.Кооперация между макрофагами и лимфоцитами. Скопление моноцитов. Макрофагов и лимфоцитов образует воспалительный инфильтрат (гранулема)
Возбудители поглощается макрофагами, но не уничтожаются, а остаются живыми внутри макрофага. Такой фагоцитоз называется незавершенным.
Взаимодействие макрофагов и лимфоцитов направлено на завершение фагоцитоза и уничтожение возбудителя. Для того, чтобы завершить фагоцитоз, макрофаги и лимфоциты взаимно стимулируют друг друга. Механизмы их кооперации :- макрофаги выделяют ИЛ-1, следовательно повышается активность лейкоцитов; - лейкоциты выделяют лимфокины, следовательно повышается активность макрофагов.
Различия между острым и хроническим воспалением
преобладает стадия альтерации S эксс-и
преобладает стадия пролиферации
ведущая клетка – эффектор нейтрофил
ведущая клетка – эффектор моноцит, точнее активный макрофаг
заканчивается быстро, в считанные дни
может продолжаться в течение жизни с периодическими обострениями
*Пример хронического воспаления - гранулема!
Некоторые инородные агенты, в частности неорганической природы, паразиты, черви, могут быть стойкими к такому влиянию и даже вызвать повреждение макрофага. Создаются условия, при которых элиминация повреждающего агента становится невозможной. В такой ситуации макрофаги выполняют свою защитную функцию другим способом. Они окружают частички, которые трудно перевариваются, и образовывают клеточное скопление – гранулему. В данном случае макрофаги могут использовать другой механизм блокирования действия инородного агента, а именно через синтез факторов свертывания крови (7, 10, 9, 2), вызывая тромбоз и нарушение кровообращения с последующим развитием ишемии участка, оккупированного патогенным агентом. Таким образом, главной клеткой, которая принимает участие в образовании и прогрессивном развитии гранулемы при гранулеоматозном воспалении является макрофаг. Очень важной функцией макрофага, которая определяет завершение воспалительной реакции, является способность секретировать факторы, которые стимулируют и ингибируют пролиферацию.
10. Роль афк в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Роль афк в антимикробной защите грудного молока.
Формирование АФК – важный защитный механизм, лежащий в основе неспецифического иммунитета: фагоцитоз приводит к многократному увеличению содержания АФК в фагоцитирующих клетках с одновременным повышением потребления кислорода в 20 и более раз ("дыхательный взрыв" Участие АФК в процессах фагоцитоза достаточно сложное.
Фагоцитирующая клетка активируется бактериальными клетками (или механическими частицами, лектинами и пр.), что сопровождается активацией фермента плазматической мембраны – НАДФ*Н-оксидазы с формированием из свободного молекулярного кислорода О2. В процессе генерации АФК участвуют ФАД-содержащий флавопротеин и цитохром b .
В конечном счете с участием ионов железа происходит дисмутация АФК до перекиси водорода.
Кроме того, миелопероксидаза нейтрофилов приводит к образованию гипохлорита, хотя последний не является главным в антибактериальной защите организма.
Высвобождние АФК в ходе "дыхательного взрыва" происходит как в фагосомы, так и в среду, что инактивирует как бактериальные клетки, так и может повреждать сами фагоциты, а также нормальные ткани.
Для защиты от АФК нейтрофилы содержат каталазу и глутатион-пероксидазу (Klebanoff, Clark, 1978).
Активация нейтрофилов сопровождается также при любых явлениях некроза ткани, в том числе микроинфарктах (Клебанов и др., 1984, 1987 ).
Считается, что начальным этапом в образовании биоцидных кислородных радикалов и метаболитов является восстановление молекулярного кислорода НАДФН-оксидазой с образованием супероксидного анион-радикала, который становится родоначальником других биоцидных соединений. Образовавшийся радикал кислорода не обладает бактерицидным свойством. Оно характерно для Н2О2, образующегося при дисмутации кислотного радикала и спонтанно.
Пероксид водорода может оказывать бактерицидное действие особенно в присутствии аскорбиновой кислоты и Fe , но это действие несравнимо с эффектом в присутствии миелопероксидазы. (МПО)
МПО- фермент, синтез которого происходит на стадии промиелоцита, после чего миелопероксидаза локализуется в азурофильных гранулах нейтрофильных гранулоцитах.
Механизм действия МПО объясняется двумя способами:
Под действием гипохлорида происходит хлорирование структур микробной мембраны, которые при этом нарушаются, а микробы гибнут.
Другой механизм основан наблюдением, что МПО может действовать как декарбоксилаза аминокислот.
На микробы губительное влияние оказывает как разрушение аминокислот их мембран, так и возникновение альдегидов, которые могут быть для них токсичны.
Хемилюминесценция, сопровождающая фагоцитоз, объясняется возникновением или супероксидного анион-радикала, или гидроксильным радикалом. Эта форма тоже высоко реактивна и уничтожает бактерии, если в их структуре присутствует молекула каротиноидов, которые связывают супероксидный радикал кислорода.
Гипохлоридный ион эффектно проникает в поверхностный фосфолипидный слой циркулирующих в крови липопротеинов низкой плотности (ЛПНП) и вызывает их окисление, они становятся токсичными индуцируя тем самым захват ЛПНП макрофагами через "сквэнджер-рецепторы".
Кроме перечисленных восстановленных дериватов кислорода, бактерицидное действие обеспечивается ещё рядом факторов. Прежде всего, это высокая концентрация Н, возникающа при диссоциации конечного продукта анаэробного гликолиза- лактата. В течение нескольких минут фагоцитоза рН в агосомах снижается до 4-5, что уже само по себе действует бактерицидно на некоторые микроорганизмы. С другой стороны, это создаёт оптимальные условия для действия гидролаз, находящихся в гранулах, которые устраняют погибшие микробные тела. В этом им помогает лизоцим (аминополисахаридаза), который расщепляет полисахаридные цепи протеогликанового слоя клеточной стенки.
Бактерицидным действием обладает и комплекс белков(катионные белки), называемых фагоцитином. Этот комплекс представляет собой смесь пептидов- дефензинов.
Различают специфические и неспецифические факторы антимикробной защиты грудного молока. К специфическим относят иммуноглобулины. В грудном молоке особенно в первые дни лактации довольно значительно содержание иммуноглобулинов А и С. К неспецифическим факторам относят ксантиноксидазу, лактопероксидазу, лактоферрин, лизоцим, компоненты комплемента, а также клеточные элементы, обладающие фагоцитирующей активностью и способностью вырабатывать бактерицидные вещества – нейтрофилы и макрофаги.
Это деление сугубо условно, ибо не отражает истинного положения дел, т.к. все эти факторы объединяются для выполнения антимикробной функции в единую антимикробную систему.
Следует сразу оговориться, что речь идёт не вообще об антимикробном действии грудного молока, а о целенаправленном уничтожении патогенных бактерий. Это необходимо отметить, потому что с первых минут контакта ребёнка с окружающей средой начинается заселение кишечного тракта ребёнка микроорганизмами, образующими так называемую, нормофлору кишечника (кишечная палочка, лактобациллы и другие микроорганизмы, принимающие в дальнейшем активное участие в жизнедеятельности микроорганизма).
Избирательность антимикробного действия грудного молока, конечно, обеспечивается специфическими иммунными белками-лактоглобулинами. Благодаря наличию специфических антигенных детерминант, лактоглобулины связывают патогенные бактерии, образуя иммунные комплексы. Иммунные комплексы, по-видимому, сами обладают способностью связывать ксантиноксидазу, лактопероксидазу и другие неспецифические факторы, либо подобная система образуется на поверхности фагоцитирующих клеток, благодаря наличию соответствующих рецепторов.
Именно эта система и обеспечивает единое антимикробное действие. Механизм заключается в том, что ксантиноксидаза окисляет ксантин либо гипоксантин и образует супероксидный анион-радикал – ведущую активную форму кислорода в процессах свободнорадикального окисления. Многие вирулентные бактерии в процессе эволюции выработали механизмы защиты от бактерицидных факторов и в случае супероксидного анион-радикала действует бактериальная СОД, превращающая анион-радикал в перекись водорода. Этот момент, вероятно, является кульминационным в борьбе микро- и макроорганизма. Нейтрализуя супероксидный анион-радикал путём образования перекиси водорода, патогенные вирулентные бактерии вызывают ещё больший огонь на себя, запуская в действие лактопероксидазу, для которой перекись водорода является необходимым субстратом. Используя перекись водорода, лактопероксидаза образует тиоционат-ионы, способные подобно гипохлорит-иона разрушать белковые молекулы. Лактоферрин освобождает двухвалентное железо и катализирует распад перекиси водорода с образованием гидроксильного радикала атакующего жирные кислоты бактериальных липидов. Благодаря сочетанному действию этих и других факторов (лизоцим разрушает полисахариды клеточной бактериальной стенки) важнейшие структуры бактериальных клеток подвергаются деструкции, что и приводит к гибели бактерии. Если эти процессы разыгрываются на поверхности нейтрофилов и макрофагов, последующее поглощение убитых бактерий завершается в фаголизосомах. Если же антибактериальные факторы действуют только в комплексе с иммуноглобулинами, убитые бактерии, уже не представляющие опасности для организма ребёнка, просто выводятся.
Для коррекции нарушений пищеварения при внешнесекреторной недостаточности поджелудочной железы наиболее эффективными оказались микрокапсулированные препараты ферментов, покрытые кислотоустойчивой оболочкой. В чём преимущество такой формы упаковки пищеварительных ферментов перед использовавшимися ранее порошками и таблеткам?
Микрокапсулы, содержащие ферменты поджелудочной железы, благодаря малому размеру лучше перемешиваются с химусом в желудке, а кислотоустойчивая оболочка предохраняет от денатурирующего действия соляной кислоты. Их последующее перемещение вместе с химусом в двенадцатиперстную кишку и растворение обеспечивают максимальный контакт действующего вещества с субстратами.
Читайте также:
