Рентгенограмма, КТ при аномалии Киммерле
Добавил пользователь Alex Обновлено: 28.01.2026
Рентгенограмма, КТ при аномалии Киммерле
а) Терминология:
1. Синонимы:
• Синонимы: дугообразное отверстие, сагиттальное отверстие, канал позвоночной артерии, ретроартикулярный канал, ретроартикулярное/замыщелковое кольцо позвоночной артерии, верхнее ретроартикулярное отверстие, заднее отверстие атланта
2. Определение:
• Костный мостик, соединяющий ретрогленоидальный бугорок с задней дугой С1
• Латынь: маленький задний мостик
б) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Костный мостик вдоль верхнего края С1 над позвоночной артерией
• Локализация:
о Отверстие позвоночной артерии в дуге С1
о С одной или обеих сторон
• Морфология:
о Замкнутое или незамкнутое «кольцо»
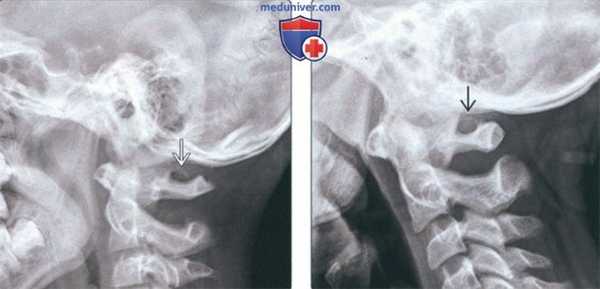
(Слева) На рентгенограмме верхних шейных позвонков в боковой проекции определяется незамкнутая костная дуга над отверстием позвоночной артерии в С1, типичная для аномалии Киммерле (неполный вариант).
(Справа) На рентгенограмме верхних шейных позвонков в боковой проекции визуализируется замкнутая костная дуга над отверстием позвоночной артерии в С1, характерная для классической аномалии Киммерле (полный вариант).
2. Рентгенография при аномалии Киммерле:
• Рентгенологические признаки:
о Полный или частичный костный мостик над отверстием позвоночной артерии в С1
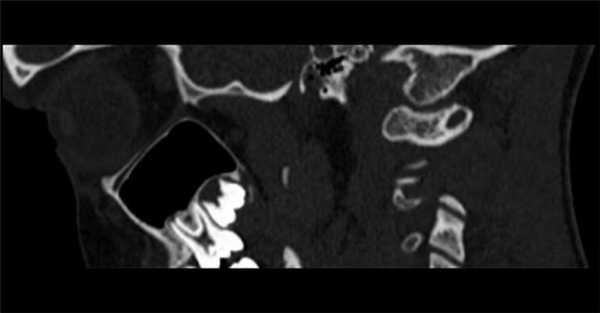
3. КТ при аномалии Киммерле:
• КТ в костном окне:
о Полный или частичный костный мостик над отверстием позвоночной артерии в С1
• КТА:
о Позвоночная артерия в костном туннеле
4. МРТ при аномалии Киммерле:
• Полный или частичный костный мостик над отверстием позвоночной артерии в С1
• МРА:
о В костном туннеле проходит ипсилатеральная позвоночная артерия
5. Рекомендации по визуализации:
• Лучший метод визуализации:
о Мультипланарная КТ в костном окне с 3D реформатированием
в) Дифференциальная диагностика аномалии Киммерле:
1. Широкая задняя дуга С1:
• Аномалию Киммерле можно спутать с широкой задней дугой С1 — повреждение позвоночной артерии при введении винтов в боковые массы С1
г) Патология:
1. Общая характеристика:
• Этиология:
о Считается, что аномалия Киммерле возникает вследствие окостенения латерального сегмента задней атланто-затылочной связки или суставной капсулы
• Сопутствующие нарушения:
о Отсутствуют
2. Стадирование, классификация аномалии Киммерле:
• Полная форма: замкнутое костное кольцо
• Неполная форма: незамкнутое костное кольцо
• Обызвествленная форма: линейные или аморфные кальцинаты
3. Макроскопические и хирургические особенности:
• Морфологически нормальная кость
• Может имитировать заднюю дугу С1
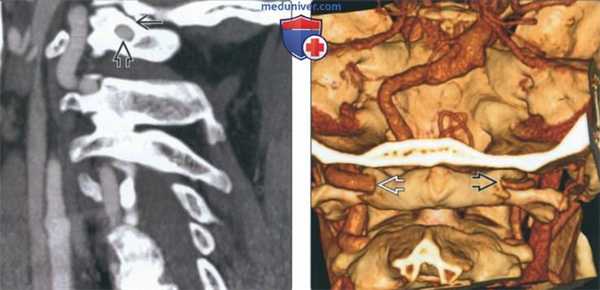
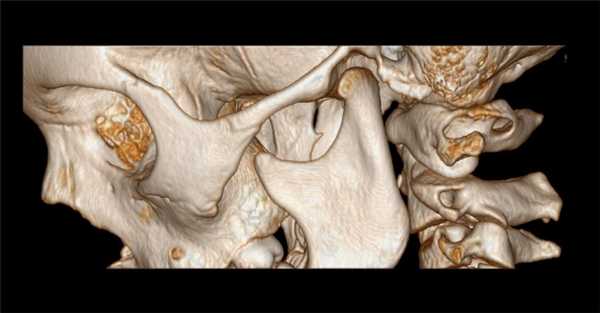
(Слева) На сагиттальной КТА визуализируется замкнутый костный мостик (аномалия Киммерле, полный вариант) над позвоночной артерией, расположенный вдоль верхнего края дуги С1.
(Справа) На трехмерной реформатированной КТА (вид сзади) визуализируются позвоночные артерии: левая (доминирующая) и правая (меньшего размера, недоминирующая). Обе артерии ограничены замкнутым костным мостиком вдоль верхнего края дуги С1.
д) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Отсутствуют
• Другие признаки/симптомы:
о Вертебробазилярная ишемия или инфаркт
о Головокружение
о Головная боль
о Боль в шее
о Боль в плече/руке
2. Демография:
• Возраст:
о Любой
• Пол:
о Ж>М
• Эпидемиология:
о 3-38%
е) Диагностическая памятка. Следует учесть:
• Позвоночные артерии склонны к повреждению при фиксации боковых масс позвонков шурупами
• Мультипланарная КТ в костном окне с 3D реформатированием: наилучший метод визуализации аномалии Киммерле
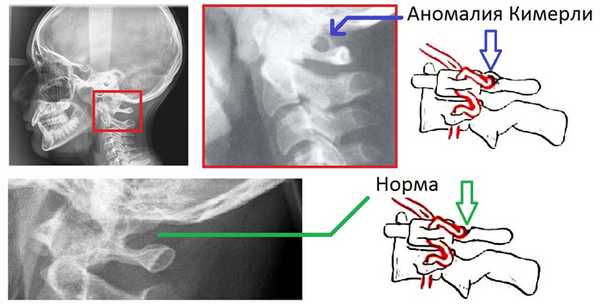
Аномалия Киммерле
Аномалия Кимерли — наличие в структуре первого шейного позвонка дополнительной костной дужки, ограничивающей движения позвоночной артерии и вызывающей синдром ее сдавления.
Эпидемиология
Частота аномалии или варианта Киммерле в популяции составляет около 8%.
История
A. Kimmerle (1930) при анализе рентгенограммы больного, страдающего гнойным лимфаденитом шеи, обратил внимание на строение задней дуги атланта. В литературе приводится ряд терминов, характеризующих данные изменения – foramen articulare atlantis, foramen retroarticulare superior, ponticulus posterior et ponticulus lateralis atlantis, canalis Bildunge; при неполном варианте строения – clinoid bridge. Термин аномалия Киммерле, как название данной патологии употребляется в зарубежной и отечественной литературе на протяжении последних 70 лет.
Патология
В настоящее время в литературе обсуждаются два варианта патогенетической аномалии: первый – кольцо образуется за счет оссификации косой атлантоокципи- тальной связки, второй – кольцо представляет собой крайнюю степень дисплазии бороздки, сочетающейся с другими диспластическими нарушениями краниовертебрального перехода.
Аномалия является по отношению к позвоночной артерии экстравазальным фактором, который, помимо механического воздействия на сосуд, ограничивает и резервные возможности V3 сегмента ПА при движениях головой, поскольку существует препятствие в виде костного мостика.
Ассоциация
Пороки анатомического развития головного мозга
- Арнольда–Киари
- Денди–Уокера
- Субарахноидальные кисты
- Агенезия мозолистого тела
- Микрогирия
Сосудистая аномалия
- гипоплазия задней соединительной артерии
- задняя трифуркация внутренней сонной артерии
- гипоплазия одной из позвоночных артерий
- патологическая извитость позвоночных артерий
Клиника
Клинические проявления типичные при аномалии Киммерле — это сочетание цефалгического синдрома, вегетативно‐вестибулярных нарушений и болевого (радикулярного) синдрома. Их выраженность варьировала в широких пределах, пароксизмы зависели от изменения позиции головы и тела и наличия физической и/или интеллектуальной нагрузки.
Головные боли имеют мигренозный характер и локализуются преимущественно в затылочной области с быстрой иррадиацией в передние отделы головы (лобно‐височную область).
Радиологические находки
Рентгенография
Определяется наличие замкнутого костного канала для позвоночной артерии или очень редко незамкнутого. В старшей возрастной группе возможны сопутствующие дегенеративно‐дистрофические изменения шейного отдела позвоночника.
МРТ
На МР-снимках обычно визуализируется в структурах головного мозга изменения диффузного или очагового характера. Диффузные изменения характеризуются наличием расширения субарахноидальных пространств, расширением и асимметрией боковых желудочков. Очаговые изменения обусловленны ишемией и локализуются, преимущественно в затылочной области.
УЗИ
Допплерография позволяет выявить асимметрию кровотока в позвоночных артериях (в основном за счет снижения скоростных показателей в экстракраниальных сегментах V3 и V4).
Признаки венозной дисциркуляции (в основном в виде затруднения венозного оттока по прямому синусу и позвоночным сплетениям).
Аномалия Кимерли
Аномалия Кимерли — наличие в структуре первого шейного позвонка дополнительной костной дужки, ограничивающей движения позвоночной артерии и вызывающей синдром ее сдавления. Аномалия Кимерли характеризуется головокружением, шумом в ушах, шаткостью походки и расстройством координации, «мушками» и потемнением в глазах, приступами потери сознания и внезапной мышечной слабости. Возможны двигательные и чувствительные расстройства, возникновение ТИА и ишемического инсульта. Диагностируется аномалия Кимерли при рентгенографическом исследовании краниовертебрального перехода, проведении магнитно-резонансной ангиографии, дуплексного сканирования и УЗДГ сосудов головы и шеи. Сосудистые нарушения, которыми сопровождается аномалия Кимерли, подлежат комплексному консервативному лечению. Операция по резекции аномальной дуги производится лишь в тяжелых случаях.
МКБ-10
Общие сведения
Наряду с аномалией Киари, платибазией и ассимиляцией атланта аномалия Кимерли относится к так называемым краниовертебральным мальформациям — врожденным нарушениям строения области сочленения черепа с первыми шейными позвонками. По некоторым данным аномалия Кимерли встречается у 12-30% людей. Вызывая сдавление позвоночной артерии, аномалия Кимерли сопровождается хронической ишемией в задних отделах мозга. Однако такая ситуация возникает далеко не всегда. Сама по себе аномалия Кимерли не является заболеванием и ее наличие не говорит о том, что именно она вызывает сосудистые нарушения в бассейне позвоночной артерии. При обследовании пациентов, у которых имеется синдром позвоночной артерии и аномалия Кимерли, лишь у 25% обнаруживается причинно-следственная связь между наличием аномалии и развитием синдрома.
Патогенез
Правая и левая позвоночные артерии отходят от соответствующих подключичных артерий. Каждая позвоночная артерия проходит вдоль шейного отдела позвоночника, находясь в канале, образованном отверстиями поперечных отростков его позвонков. Затем она входит в большое затылочное отверстие, попадая таким образом в полость черепа. Позвоночные артерии и их ветви образуют так называемый вертебро-базилярный бассейн, кровоснабжающий часть спинного мозга в шейном отделе позвоночника, мозжечок и ствол мозга. Выходя из шейного канала позвоночная артерия огибает шейный позвонок и горизонтально проходит в широкой костной борозде, где она может свободно перемещаться при движениях головы. Костная дужка, наличием которой характеризуется аномалия Кимерли, расположена над костной бороздой и ограничивает движения позвоночной артерии в этом месте.
Аномалия Кимерли может приводить к развитию синдрома позвоночной артерии двумя путями: за счет срабатывания периваскулярных вегетативно-ирритативных механизмов симпатической иннервации и за счет уменьшенного поступления крови в вертебро-базилярный бассейн из-за механического сдавления позвоночной артерии. Факторами, приводящими к тому, что аномалия Кимерли становиться клинически значимой, являются атеросклероз, поражение сосудистой стенки при васкулитах, шейный спондилоартроз, остеохондроз шейного отдела позвоночника, артериальная гипертензия, наличие других краниовертебральных мальформаций, рубцовый процесс, черепно-мозговая травма или травма позвоночника с повреждениями в области краниовертебрального перехода. К возникновению клинической картины синдрома позвоночной артерии у пациентов с аномалией Кимерли могут приводить травмы плеча, вызывающие повреждение ограниченной костной дужкой позвоночной артерии по хлыстовому механизму.
Классификация
В неврологии выделяют 2 вида аномалии Кимерли. Первая характеризуется наличием костной дужки, соединяющей суставной отросток атланта с его задней дугой. Во втором варианте аномалия Кимерли представлена костной дужкой между суставным отростком атланта и его поперечным отростком.
Аномалия Кимерли может иметь односторонний характер и ли наблюдаться с обоих сторон первого шейного позвонка. Кроме того, аномалия Кимерли может быть полной и неполной. Полная аномальная костная дужка имеет вид полукольца, неполная костная дужка представляет собой дугообразный вырост.
Симптомы аномалии Кимерли
Клинические проявления, которыми сопровождается аномалия Кимерли, обусловлены уменьшенным притоком крови к задним отделам головного мозга. В результате пациенты испытывают шум в ухе или обоих ушах (свист, звон, гул, шипение), мелькание «мушек» или мерцание «звездочек» перед глазами, внезапное преходящее потемнение в глазах. Указанные симптомы усиливаются при поворотах головы. Поскольку аномалия Кимерли сопровождается нарушением кровоснабжения мозжечка, то возникают головокружение и шаткость походки, которые также могут усугубляться при поворотах головой. На фоне некомфортного положения головы или перенапряжения мышц шеи при аномалии Кимерли у пациентов могут наблюдаться приступы потери сознания. Возможна внезапно возникающая мышечная слабость, приводящая к падению больного без потери сознания.
В случаях более тяжелого течения аномалия Кимерли может сопровождаться головной болью, тремором рук и ног, нистагмом, нарушениями координации, гипестезией и/или мышечной слабостью части лица или туловища, чувствительными и двигательными расстройствами одной или нескольких конечностей. Могут наблюдаться транзиторные ишемические атаки в вертебро-базилярном бассейне. Особо тяжелым осложнением наличия аномалии Кимерли является ишемический инсульт.
Диагностика
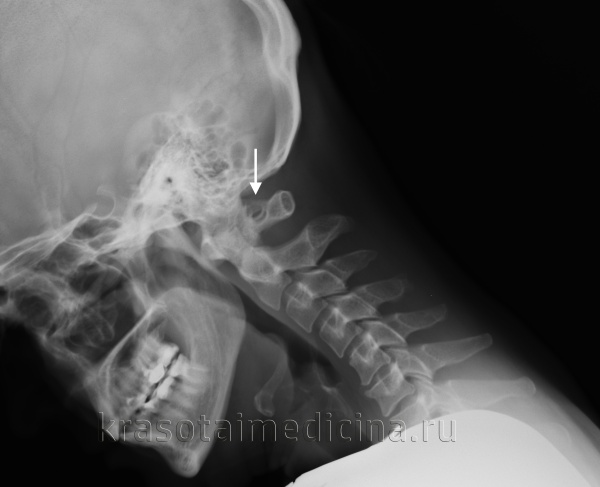
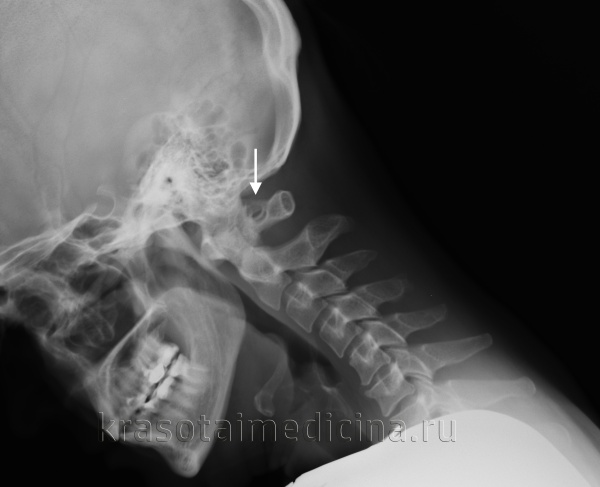
При обращении пациента с симптомами недостаточности кровообращения в вертебро-базилярном бассейне головного мозга в первую очередь производят рентгенографию черепа и рентгенографию позвоночника в шейном отделе. Аномалия Кимерли, как правило, достаточно четко визуализируется на боковых рентгенограммах области краниовертебрального перехода. При наличие ушного шума для исключения лор-патологии (кохлеарный неврит, хронический средний отит, лабиринтит) может потребоваться консультация отоларинголога, проведение аудиометрии и других исследований слуха. Производится также исследование вестибулярного анализатора (вестибулометрии, электронистагмографии, стабилографии).

Рентгенография ШОП (боковая проекция). Дополнительное костное кольцо в области задней дужки С1 (аномалия Кимерли)
Поскольку выявленная аномалия Кимерли может не являться причиной синдрома позвоночной артерии, неврологу необходимо исключить другие возможные причины вертебро-базилярной недостаточности. Выявить тромбоз, артерио-венозную мальформацию или аневризму сосудов головного мозга, сдавление сосуда объемным образованием (опухоль, киста или абсцесс головного мозга) способна контрастная ангиография. Определить насколько клинически значима аномалия Кимерли, т. е. степень ее влияния на кровообращение в вертебро-базилярном бассейне, позволяет применение целого ряда гемодинамических исследований: УЗДГ экстракраниальных сосудов, транскраниальной допплерографии, дуплексного сканирования и магнитно-резонансной ангиографии сосудов головного мозга. С их помощью при аномалии Кимерли возможно выявить локализацию сдавления позвоночной артерии и ее зависимость от положения головы и шеи.
Лечение аномалии Кимерли
Аномалия Кимерли требует лечения в случае наличия клинических и гемодинамических признаков нарушения кровообращения в вертебро-базилярном бассейне, связанного именно с данной патологией. Пациенты, у которых имеется аномалия Кимерли, должны соблюдать некоторые меры предосторожности в рамках охранительного режима. При аномалии Кимерли следует избегать форсированных физических нагрузок, резких околозапредельных поворотов головой, стоек на голове, кувырков, спортивных занятий и игр, связанных с ударами головой (борьба, футбол, спортивная гимнастика и пр.). При прохождении массажа или мануальной терапии шейного отдела позвоночника пациенту необходимо предупреждать массажиста и мануального терапевта о том, что у него аномалия Кимерли. Ухудшение состояния пациента является поводом к незамедлительному обращению к врачу.
В большинстве случаев аномалия Кимерли, приводящая к клиническим проявлениям сосудистой недостаточности, подлежит консервативному лечению. Проводится сосудистая терапия направленная на улучшение мозгового кровотока (ницерголин, винпоцетин, винкамин, циннаризин). По показаниям под контролем коагулограммы при аномалии Кимерли применяются препараты, улучшающие реалогические свойства крови (пентоксифиллин). В комплексную терапию включают также антиоксиданты, ноотропы, нейропротекторы и метаболические препараты (пирацетам, препараты гинкго билоба, никотиноил-гамма-аминобутировая кислота, мельдоний).
Аномалия Кимерли на сегодняшний день не является показанием для проведения хирургического лечения. Необходимость в оперативном лечении может возникнуть при декомпенсированном течении синдрома позвоночной артерии, приводящем к выраженной недостаточности кровообращения в вертебро-базилярном бассейне при отсутствии достаточного коллатерального кровоснабжения. Операция при аномалии Кимерли заключается в резекции аномальной дуги и мобилизации позвоночной артерии. В послеоперационном периоде пациентам необходимо ношение воротника Шанца сроком от 2 до 4 недель.
Краниовертебральные аномалии ( аномалии краниовертебрального перехода )
Краниовертебральные аномалии — отклонения в анатомическом взаиморасположении и строении структур области соприкосновения черепной коробки и позвоночника. Зачастую не имеют клинических проявлений. В клинически значимых случаях манифестируют синдромами внутричерепной гипертензии, поражения позвоночной артерии, сдавления корешка, спинного мозга или ствола; у маленьких детей возможны расстройства дыхания. Диагностируются краниовертебральные аномалии при помощи краниографии, МРТ или КТ краниовертебральной области. Необходимо наблюдение невролога, по показаниям — нейрохирургическое лечение.
Краниовертебральный переход включает образованное затылочной костью основание черепа и первые 2 шейных позвонка (атлант и аксис). Это зона соединения неподвижной черепной коробки и мобильного позвоночника. Нарушения правильного анатомического строения и положения костных образований, лежащие в основе краниовертебральных аномалий (КВА), зачастую отражаются на расположенных в этой области структурах головного и спинного мозга, что влечет появление соответствующей неврологической симптоматики. Последняя носит довольно вариативный характер, связана в основном с компрессией верхнешейных сегментов спинного мозга и спинальных корешков, ствола мозга, мозжечка, IX-XII черепно-мозговых нервов, позвоночных артерий; нарушением циркуляции цереброспинальной жидкости. Краниовертебральные аномалии легкой степени выраженности протекают субклинически, однако их выявление имеет важное значение в клинической неврологии, особенно, когда речь идет о проведении мануальной терапии.
Причины краниовертебральных аномалий
Врожденные аномалии краниовертебрального перехода возникают как результат нарушения эмбриогенеза при воздействии на плод вариабельных негативных факторов. К последним относят повышенный радиоактивный фон, внутриутробные инфекции, интоксикации при дисметаболических заболеваниях, профессиональных вредностях или зависимостях (наркомании, курении, алкоголизме) беременной. В ряде семей прослеживается значительно более высокая частота аномалий, чем в общем по популяции, что говорит в пользу наследственной передачи КВА, имеющей, вероятно, мультифакторный характер.
Приобретенные краниовертебральные аномалии могут формироваться в результате травм позвоночника в шейном отделе или черепно-мозговых травм, в том числе и родовых травм новорожденного. Кроме того, травмы часто служат триггером, провоцирующим клинические проявления ранее бессимптомно протекающей аномалии. Деформации краниовертебральной зоны возможны вследствие остеопороза, причиной которого могут выступать рахит, гиперпаратиреоз, деформирующий остеит, остеомаляция. Приобретенные краниовертебральные аномалии могут возникать в связи с разрушением костных структур краниовертебрального перехода при остеомиелите, опухолях костей, туберкулезе, актиномикозе, сифилисе.
Признаки краниовертебральных аномалий
Клиническая картина аномалий краниовертебрального перехода весьма вариабельна: от субклинического течения до возникновения грубых неврологических расстройств. Она обусловлена видом и степенью имеющихся костных дефектов. Визуальные признаки, характеризующие краниовертебральные аномалии, включают: низкий рост волос на затылке, укороченную шею, ограничение подвижности головы, увеличенный шейный лордоз, кривошею, измененную посадку головы. Манифестация клиники зависит от тяжести аномалии. При грубых деформация она, как правило, происходит в раннем детском возрасте, при умеренных и легких — возможна в любой возрастной период, но обычно является отсроченной.
Клиническая симптоматика бывает представлена синдромом позвоночной артерии и хронической ишемией головного мозга, обмороками, гидроцефалией и внутричерепной гипертензией, в тяжелых случаях — синдромом вклинения ствола и миндалин мозжечка в затылочное отверстие. У детей раннего возраста краниовертебральные аномалии могут быть причиной синдрома сонных апноэ, стридора и пр. дыхательных нарушений.
Виды краниовертебральных аномалий
Проатлант — рудиментарный костный элемент в области затылочной кости. Врожденная патология, связанная с нарушением редуцирования соединительнотканного тяжа, образующегося с вентральной стороны позвонков в ходе онтогенеза. При отсутствии сращений рудиментарного элемента с окружающими костными структурами говорят о свободном проатланте. При его слиянии с передним краем большого затылочного отверстия употребляют термин «третий мыщелок», при срастании с задним краем — термин «околозатылочный отросток».
Гипоплазия и аплазия задней дуги атланта. В первом случае клинические проявления отсутствуют, порок диагностируется рентгенологически. Аномалия встречается у 5-9% населения. Во втором случае в детском возрасте или пубертате возникает сдавление дистальной части ствола и верхних отделов спинного мозга. Характерно быстрое усугубление симптоматики. Встречаемость порока составляет 0,5-1%.
Ассимиляция атланта — сращение 1-го шейного позвонка и затылочной кости. Может быть полным и неполным, одно- и двусторонним. Частота аномалии не превышает 2%. Ассимиляция атланта манифестирует клинически после 20-летнего возраста головными болями с вегетативной симптоматикой. Возможен ликворно-гипертензионный синдром, легкие диссоциированные сенсорные нарушения, расстройства функции нижних черепно-мозговых нервов.
Аномалии зубовидного отростка по различным данным встречаются у 0,5-9% населения. Включают гипо- и аплазию, а также гипертрофию отростка, которые протекают без клинических проявлений. Неврологическая симптоматика возникает в случаях, когда зубовидный отросток не сращен с аксисом, а формирует отдельную зубовидную кость. В таких условиях отмечается хронический атланто-аксиальный подвывих, возможна компрессия проксимальных отделов спинного мозга.
Платибазия — уплощение основания черепной коробки. Клинически платибазия проявляется только при III степени уплощения, сопровождающейся существенным уменьшением размеров задней черепной ямки, влекущим за собой внутричерепную гипертензию, сдавление мозжечка и IX-XII пар черепных нервов.
Базилярная импрессия — вдавление основания черепа в его полость. В популяции встречается с частотой 1-2%. При базилярной импрессии симптомы, обусловленные уменьшением задней черепной ямки, сочетаются с признаками сдавления спинальных корешков первых шейных сегментов. В этих сегментах возможно возникновение компрессионной миелопатии с центральным тетрапарезом. Крайняя выраженность аномалии (вворачивание основания внутрь полости черепа) носит название конвексобазия.
Аномалия Киммерли связана с наличием дополнительной дужки атланта, ограничивающей позвоночную артерию. Аномалия Киммерли бывает полная и неполная, одно- и двусторонняя. Клинически значима лишь у четверти носителей порока. Проявляется синдромом позвоночной артерии, обмороками, ТИА, в тяжелых случаях вероятен ишемический инсульт.
Аномалия Киари — врожденный порок развития, при котором часть структур задней черепной ямки пролабирует в затылочное отверстие. У 80% пациентов имеется сирингомиелия. Выделяют 4 типа аномалии Киари, которые отличаются возрастом дебюта и клинической симптоматикой.
Синдром Клиппеля-Фейля — редкая врожденная аномалия (частота 0,2-0,8%) в виде уменьшения числа шейных позвонков и/или их сращении. Может иметь наследственный или спорадический характер. Синдром Клиппеля-Фейля часто сочетается с др. пороками развития (расщеплением позвоночника, полидактилией, волчьей пастью, аномалиями зубов, врожденными пороками сердца и т. п.). Характерна возникающая еще в раннем детстве мышечная слабость с исходом в парезы. В ряде случаев наблюдаются врожденная гидроцефалия и олигофрения.
Диагностика краниовертебральных аномалий
Наряду с клиническим обследованием важное значение в диагностике имеет выполнение рентгенографии черепа и рентгенографии шейного отдела позвоночника. С целью визуализации мягкотканных структур краниовертебрального перехода назначают МРТ головного мозга и МРТ позвоночника в шейном отделе. Исследование выполняется в режимах Т1 и Т2, в сагитальной и аксиальной проекциях. По показаниям проводят МРТ сосудов головного мозга. При невозможности МРТ-обследования, а также для более точной визуализации костных образований краниовертебральной зоны, выполняют КТ позвоночника и КТ головного мозга.
Дополнительно проводят консультацию офтальмолога с офтальмоскопией (осмотром глазного дна), консультацию отоневролога с аудиометрией, непрямой отолитометрией. При необходимости исследуют стволовые вызванные потенциалы. Наличие синдрома позвоночной артерии является показанием к сосудистым исследованиям — РЭГ с функциональными пробами, УЗДГ экстракраниальных сосудов. Для выявления наследственной патологии проводится консультация генетика и генеалогический анализ.
Лечение краниовертебральных аномалий
Пациенты с аномалиями краниовертебрального перехода должны соблюдать ряд предосторожностей, чтобы не спровоцировать и не усугубить клинические проявления аномалии. Не желательны резкие наклоны и повороты головы, стойки на голове, кувырки, занятия травматичным спортом и форсированные нагрузки. Наблюдение субклинических форм КВА и базисная терапия при умеренных проявлениях осуществляется неврологом. Традиционно основу базисного лечения составляют ноотропные, нейротрофические и вазоактивные фармпрепараты, хотя их эффективность при краниовертебральных аномалиях не доказана.
При выраженных клинических проявлениях решается вопрос о возможности нейрохирургической коррекции порока. Показаниями к хирургическому лечению являются симптомы компрессии ствола, мозжечка или спинного мозга, нарушение церебрального кровообращения. При базилярной импрессии и аномалии Киари проводится краниовертебральная декомпрессия, при аномалии Киммерли — резекция дополнительной дужки атланта, при ассимиляции атланта — ламинэктомия для декомпрессии спинного мозга и стабилизация позвоночника при помощи спондилодеза, при синдроме Клиппеля-Фейля — операция цервикализации.
Заболевания
Аномалия Киммерле представляет собой костный мостик над задней дугой первого шейного позвонка, образующий костное кольцо. Краниовертебральная область (КВО), представляя собой подвижную структуру шейного отдела позвоночника, одновременно является его наиболее ранимой зоной. Клинические проявления при повреждении КВО многообразны. В патологический процесс максимально включаются позвоночная артерия и сопровождающие ее нервные образования, которые и формируют основное патогенетическое ядро заболевания.
Одной из часто встречающихся аномалий КВО является костная перемычка, описанная в 1923 г. H. Hayek. Она располагается между задним краем суставного отростка атланта и задней границей его дуги и формирует отверстие, через которое проходят позвоночная артерия (ПА) и затылочный нерв. Более детально данная патология была описана в 1930 г. венгерским врачом А. Киммерле, обратившим внимание на то, что данное изменение может приводить к расстройствам мозгового кровообращения, и впоследствие получила его имя – аномалия Киммерле (АК).
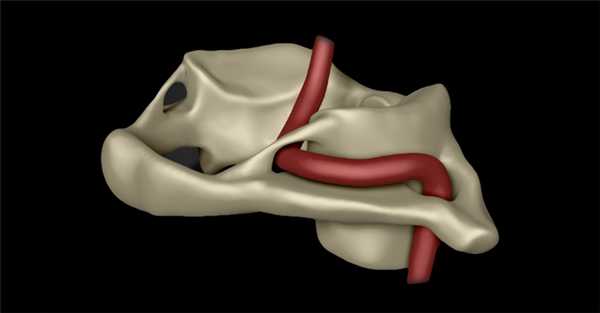
Эпидемиология
Заболеваемость составляет примерно у 8% населения, чаще встречается у женщин. В основе развития этой костной патологии лежит несоответствие нервных элементов спинного мозга и позвоночных тканей. К ним относятся окципитализация атланта либо остатки протоатланта с прогредиентным ростом, постепенным обызвествлением атлантозатылочной мембраны при микроповреждениях или микрокровоизлияниях, полученных во время травм КВО. В результате этих изменений ПА проходит не в борозде дуги атланта, а в отверстии, образованном с одной стороны бороздой, а с другой – оссифицированной атлантоокципитальной связкой, формирующей своеобразный костный мостик. Он ограничивает свободный ход ПА и затылочного нерва при движении головы, особенно при ее поворотах.
А.А. Луцик (1988) придает первостепенное значение рубцовому перерождению стенки артерии и периартериальной клетчатки вследствие длительной травматизации ПА в области АК, что приводит к развитию повреждения интимы, раннему формированию атеросклеротических бляшек, суживающих просвет сосуда, и/или диссекций. В результате резкие движения головы могут провоцировать процесс дестабилизации гемодинамики пораженной артерии и превращаться в источник нарушений кровоснабжения дистальных отделов вертебрально-базилярной системы (ВБС) по механизму Bow Hunter Stroke.
Таким образом, патогенез расстройств гемодинамики в ВБС при АК этиологически обусловлен развитием сложного компрессионно-стенозирующего ирритативного эффекта, вследствие чего наблюдается снижение объемного кровотока по ПА, развитие недостаточности кровообращения в той или иной степени в ВБС.
При анатомических исследованиях различные варианты АК выявляются примерно у 30% населения. У больных с клиникой вертебробазилярной дисфункции (кохлео-вестибулярные расстройства, атаксия, зрительные нарушения и др.) или с миофасциальными болями по типу синдрома Тонзика АК обнаруживается в 7,6% случаев. Мостик бывает неполным, одно- или двухсторонним, поэтому различают разные степени этой аномалии. Следует отметить, что толщина мостика и величина отверстия также значительно варьируют.
Клиническая картина
Она характеризуется многообразием симптоматики (головокружение, вегетативные дисфункции, головные боли, преходящие изменения зрения, боли в шее), что создает трудности в определении распространенности начальных проявлений АК, которые обусловлены тем фактом, что периодически возникающую головную боль на начальных этапах патологии пациенты, а зачастую и врачи не относят к серьезным заболеваниям. Таким образом, они длительное время наблюдаются с различными диагнозами, такими как «мигрень», «цефалгия», «головная боль напряжения», «ВСД» и т.д. у разных специалистов, получают разнородное обследование и лечение, что в результате не позволяет сформировать необходимую статистическую базу.
В развернутой стадии, развивающейся в 20% всех случаев АК, в клинической картине заболевания преобладают симптомы ишемии структур, питаемых ВБС, такие как начальные проявления недостаточности мозгового кровообращения и/или пароксизмальные нарушения мозгового кровообращения. НПНМК проявляются в виде головокружений, нарушений слуха, шума, звона в ушах, головной боли в области затылка, ощущений «точек или песка» перед глазами, иногда цветных фотопсий. В межприступный период больные жалуются на пелену перед глазами, давление в наружном слуховом проходе, шум, гиперакузию, утомляемость, нарушение сна. Очаговая неврологическая симптоматика отсутствует. Четко прослеживается зависимость каждого из симптомов от перемещения тела в пространстве. ПНМК характеризуются более выраженными симптомами: приступообразно возникающие несистемные головокружения, часто с тошнотой, рвотой (при разгибании и поворотах головы); нарушения слуха (шум, звон в ушах); головные боли (преимущественно в затылочной области); зрительные нарушения (затуманенное зрение, фотопсии, дефекты полей зрения); патологические пирамидные знаки; расстройства чувствительности; мозжечковые и бульбарные симптомы; моно-, пара- или тетрапарезы; внезапные падения без потери сознания (drop-attacks); внезапные падения с потерей сознания (синкопальный синдром Унтерхарншейдта). Все симптомы ПНМК должны сохраняться не более 24 ч.
Наиболее выраженным осложнением нарушений кровообращения в ВБС является ишемический инсульт в системе ВББ, при котором формируются небольшие очаги размягчения в области мозжечка и продолговатого мозга, что клинически проявляется стойкой неврологической недостаточностью в виде общемозговых и очаговых неврологических симптомов, поражения срединно-стволовых и мозжечковых структур, которые сохраняются у пациентов более 24 ч.
Гуляев С.А., Кулагин В.Н., Архипенко И.В., Гуляева С.Е. (2013) провели исследование с целью анализа частоты встречаемости АК в структуре неврологического стационара, разработки критериев ее диагностики и рациональных методов терапии. В исследовании использовались результаты скринингового обследования пациентов, госпитализированных в неврологическую клинику ГОУ ВПО ВГМУ за период 6 лет (всего 8 436 человек). Критерием исключения являлось наличие верифицированных черепно-мозговых травм и травм шейного отдела позвоночника, сосудистых аномалий, опухолей этой зоны. Комплекс обследований помимо клинико-неврологического включал рентгенографию позвоночника и черепа, КТ, МРТ головного и спинного мозга, ультразвуковое исследование сосудов шеи и головного мозга (УЗДГ, ДС), ЭЭГ. Все обследования проводились в динамике трехлетнего наблюдения с частотой от 2–х до 6 раз в год. В ходе исследования было выявлено 68 больных с АК в возрасте от 18 до 67 лет, среди них 42 (61,8%) женщины и 26 (38,2%) мужчин. В большинстве случаев (74,6%) клинические проявления неврологического дефекта приобретали стабильность к 20 – 25 годам. Однако исследования анамнеза показали, что у 43,8% обследованных и ранее возникали специфические жалобы, свидетельствующие о наличии патологии КВО, которые расценивались специалистами как спастическая кривошея, цервикобрахиалгия, синкопальные состояния, гемоликвородинамические нарушения и др.
Результаты исследования
Клиническая картина, выявленная у больных АК, характеризовалась многообразием симптоматики, но, учитывая ведущий клинический признак, было выделено 3 основных неврологических синдрома.
- Болевой синдром, характеризовавшийся половинным характером головной боли с локализацией преимущественно в затылочной области (91,6% наблюдений) с иррадиацией в глаз или слуховой проход, сопровождавшийся в 43,9% случаев фотопсиями, выпадениями полей зрения (34,6%) или метаморфопсиями (21,5%).
- Синдром сосудистой недостаточности, проявлявшийся в 42,6% случаев в виде головокружения (79,4%), шаткости при ходьбе, нестойких нарушений координационных проб (61,7%), сопровождавшихся в 54,4% наблюдений тошнотой и рвотой. Реже больные отмечали появление шумовых иллюзий в виде жужжания, шуршания, писка, свиста, локализующихся то в ухе, то в голове (45,8%). Характерной особенностью данного синдрома была его связь с поворотами головы, проявляющаяся в его нарастании при совершении движения, что вынуждало пациентов занимать определенную позу (так называемая позиционность головы).
- Вегетативный синдром (синдром панических атак) регистрировался у 41,1% обследованных, отличался внезапным развитием с возникновением чувства «прилива жара» к голове или шее, сопровождался немотивированным страхом, тревогой, чувством удушья с ярко выраженными дисфункциями автономной неравной системы (ознобоподобное дрожание, онемение рук, нестабильность АД и др.). По окончании приступа у пациентов наблюдались полиурия и панастения. Их длительность колебалась от десятков минут до нескольких часов.
Наблюдение за пациентами в динамике позволило выявить три степени тяжести заболевания:
- I легкая – характеризовалась только наличием болевого синдрома в сочетании с гемо-ликворо-динамическими нарушениями;
- II средняя – к проявлениям первой степени присоединялись вегетативные дисфункции перманентного и пароксизмального характера с частотой пароксизмов 3–4 раза в год;
- III тяжелая – при ней частота основных синдромов колебалась от ежемесячных до еженедельных.
Катамнестический анализ показал прямую зависимость тяжести течения от длительности заболевания и возможность постепенной и прогредиентной трансформации клинических форм заболевания от легкой через среднюю (68,7±0,3%, p<0,05) до тяжелой (31,3±0,2%, p<0,05).
Лечение
Выбор тактики лечения клинических проявлений АК базировался на патогенетическом принципе, потому что этиологическое лечение требует проведения оперативного вмешательства не только на самом костном образовании кольца атланта, но и проведения реконструктивной ангиопластики позвоночной артерии, что не всегда целесообразно на ранних стадиях заболевания, представляющих большинство клинических случаев. Поэтому предпочтение в выборе схемы лечения было отдано терапевтическим методам. Основная патогенетическая модель базировалась на принципах «порочного круга», в основе которого находится раздражение затылочного нерва, приводящее к возникновению болевого синдрома и защитного напряжения мышц шеи и скальпа. В свою очередь, формирующаяся миотония приводит к нарушению нормальных биомеханических соотношений, что вызывает еще большее раздражение затылочного нерва и соответствующую прогрессию боли с присоединением вегетативных нарушений из-за раздражения нерва Франка и сопровождающих позвоночную артерию сплетений, а также синдромов недостаточности кровоснабжения ВБС на более поздних этапах.
В основу терапевтического воздействия на данную патогенетическую модель были положены методы, позволяющие купировать болевой синдром, редуцировать миотонические симптомы и улучшить трофику сосудистых и нервных структур. В качестве базовых медикаментозных средств использовались нестероидные противовоспалительные препараты быстрого действия (лорноксикам и др.), миорелаксанты периферического действия (толперизон), комплексные витаминосодержащие препараты трофического и анаболического действия. Дополнительно в курс лечения включались лечебная физкультура, массаж. Лорноксикам, назначаемый для купирования болевого синдрома, был эффективен у всех пациентов. Кардиальные дисфункции, нарушения функций ЖКТ преобладали у пациентов старшей возрастной группы. Таким образом, исходя из полученных данных, НПВП лорноксикам показал себя как высокоэффективное обезболивающее средство у пациентов всех возрастных групп, однако из-за быстрого развития побочных эффектов препарат лучше назначать однократно для экстренного купирования болевого синдрома.
Оссификация атлантоокципитальной связки представляет собой нередкий вариант аномалии строения КВО. Данная аномалия встречается практически во всех возрастных группах с максимальной представленностью в возрасте 25 лет и старше. В клинической картине заболевания преобладают три основных синдрома: болевой синдром, синдром сосудистой недостаточности и синдром вегетативных дисфункций. Тяжесть клинических проявлений соответствует трем степеням, отражающим разные типы течения, – легкой, среднетяжелой и тяжелой, характеризуется частотой обострений и зависит от выраженности анатомического дефекта. Тесное расположение различных элементов, а также сочетание разных патологических процессов, развивающихся в шейном отделе позвоночника, в большинстве случаев затрудняет активные хирургические вмешательства, что требует разработки консервативных методов лечения, направленных на купирование болевого синдрома, редуцирование миотонического напряжения мышц шеи и скальпа, а также активацию репаративных процессов в пораженной зоне. Использование обезболивающих препаратов группы оксикамов, в частности лорноксикама, высокоэффективно у пациентов с АК в качестве экстренной помощи при развитии болевого синдрома в однократном применении. При необходимости более длительного использования данного препарата необходимо проводить защитные меры по профилактике поражения структур ЖКТ. Также препарат следует назначать с осторожностью лицам старших возрастных групп из-за риска развития кардиальной патологии. Применение в схеме лечения препаратов миорелаксирующего и репаративного (витаминного) действия позволяет эффективно убрать основные клинические проявления АК и ввести заболевание в состояние ремиссии на период до 9 месяцев.
Читайте также:
- Показания для операции комплексной травматической нестабильности локтевого сустава
- Пароксизмальная тахикардия. Предсердные и желудочковые формы пароксизмальной тахикардии
- Клиническая диагностика первично-множественных опухолей. Первично-множественный рак и метастазы
- Механизмы развития бронхиальной астмы. Патогенез
- Дифференциация пузырей на коже. Дерматит-экзема
