Классификация антиаритмических средств. Классификация Vaughan-Williams
Добавил пользователь Morpheus Обновлено: 30.01.2026
Необходимость в лечении аритмий Аритмии Введение (Overview of Arrhythmias) Здоровое сердце бьется регулярным, скоординированным образом благодаря тому, что электрические импульсы в сердце генерируются и распространяются миоцитами с уникальными электрическими свойствами. Прочитайте дополнительные сведения (ИКД), кардиостимуляторы Электрокардиостимуляторы Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведения или их комбинацию.
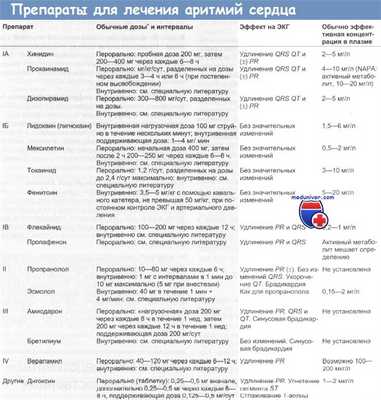
Большинство антиаритмических препаратов сгруппированы в 4 основных класса (классификация Воген – Вильямса) на основании их клеточного электрофизиологического действия (см. таблицу Антиаритмические препараты [классификация Vaughan Williams] Антиаритмические препараты (классификация Vaughan Williams) ).
Класс I Антиаритмические препараты Класс I Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведения : препараты I класса подразделяются на подклассы а, б и в. Класс І: блокаторы натриевых каналов (мембраностабилизирующие препараты) блокируют быстрые натриевые каналы, замедляя проведение в соответствующих участках миокарда (рабочие кардиомиоциты предсердий и желудочков, система Гиса – Пуркинье).
Класс II Антиаритмические препараты Класс II Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведения : препараты II класса –бета-блокаторы, которые преимущественно действуют на ткани с медленным проведением (синоатриальный [СА] и атривентрикулярный [АВ] узел), где они уменьшают частоту автоматизма, замедляют проводимость и увеличивают рефрактерность.
Класс IV Антиаритмические препараты Класс IV Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведения : препараты IV класса - это блокаторы кальциевых каналов, которые угнетают кальций-зависимый потенциал действия в медленных каналах, следовательно уменьшают автоматизм, замедляют скорость электрического проведения и увеличивают рефрактерность.
Дигоксин, аденозин и ивабрадин не были включены в оригинальную классификацию Вогана Уильямса. Дигоксин укорачивает предсердный и желудочковый рефрактерный период, удлиняя АВ проведение и его рефрактерность. Аденозин замедляет или блокирует атриовентрикулярное проведение и может предотвращать тахиаритмии, механизм которых поддерживается за счет работы АВ-соединения. Ивабрадин блокирует проведение импульсов в синусовом узле и замедляет частоту сердечных сокращений. Были предложены более всеобъемлющие обновления классификации Вогана Уильямса ( 1 Справочные материалы по антиаритмическим препаратам Необходимость в лечении аритмий зависит от симптомов и степени тяжести аритмии. Лечение направлено на причины заболевания. При необходимости проводится прямая антиаритмическая терапия, что включает. Прочитайте дополнительные сведения ).
Справочные материалы по антиаритмическим препаратам
Антиаритмические препараты Класс I
К антиаритмическим препаратам класса I относятся
Блокаторы натриевых каналов (мембраностабилизирующие препараты), которые блокируют быстрые натриевые каналы, замедляя проведение в соответствующих участках миокарда (рабочие кардиомиоциты предсердий и желудочков, система Гиса – Пуркинье)
На электрокардиограмме (ЭКГ) этот эффект может быть отражен расширением P-волны и QRS-комплекса, удлинением PR-интервала, или их комбинацией.
Разделение препаратов I класса основано на кинетических эффектах натриевых каналов:
Препараты класса Ib имеют быструю кинетику.
Препараты класса Ic имеют медленную кинетику.
Препараты класса Ia имеют промежуточную кинетику.
Кинетика блокаторов натриевых каналов определяется частотой сокращений сердца, при которых проявляется их электрофизиологическое действие. Так как препараты класса Ib имеют быструю кинетику, они проявляют свое электрофизиологическое действие только при быстром ритме сердца. Таким образом, ЭКГ, записанная в течение нормального ритма и нормальной ЧСС, обычно не показывает никаких признаков замедления проведения в миокарде. Препараты класса Ib не являются очень сильными антиаритмиками и имеют минимальное влияние на предсердный миокард.
Препараты класса Ic имеют замедленную кинетику, поэтому их электрофизиологические эффекты проявляются при любой частоте сердцебиения. Поэтому на ЭКГ при нормальной ЧСС и нормальном ритме обычно видно замедление проведения по миокарду. Препараты класса Ic более мощные антиаритмики
Препараты класса "Ia" имеют промежуточную кинетику, поэтому их влияние на проведение в быстрых каналах кардиомиоцитов может быть заметно или незаметно на ЭКГ, записанной на фоне нормального ритма и ЧСС. Препараты класса Ia также блокируют реполяризацию калиевых каналов, увеличивая рефрактерные периоды кардиомиоцитов с быстрыми каналами. На ЭКГ этот эффект отражается как удлинение интервала QT даже при нормальном ритме. Препараты класса Ib и класса Ic не блокируют калиевые каналы напрямую.
Основные показания к применению препаратов классов Ia и Ic – лечение суправентрикулярных тахикардий (СВТ); желудочковые тахикардии (ЖТ) – для всех препаратов I класса.
Побочные эффекты препаратов I класса включают в себя проаритмию – медикаментозную аритмию, возникающую в процессе лечения, которая является наиболее тревожным побочным эффектом. Все препараты класса I могут усугублять течение желудочковых тахикардий. Препараты I класса также имеют тенденцию к уменьшению желудочковой сократимости. Эти побочные эффекты более характерны у пациентов со структурной патологией сердца; класс I не рекомендован для лечения таких больных. Таким образом, эти антиаритмики обычно применяются у пациентов, которые не имеют структурных нарушений сердца или у пациентов со структурными наршениями, которые не имеют другой терапевтической альтернативы. Существуют другие побочные эффекты препаратов I класса, которые являются специфическими для подкласса или отдельного препарата.
Антиаритмические препараты Класс Ia
Препараты класса Ia имеют кинетику, занимающую промежуточное положение между быстрой кинетикой класса Ib и медленной кинетикой класса Ic. Их влияние на проведение в быстрых каналах кардиомиоцитов может быть заметно или незаметно на ЭКГ, записанной на фоне нормального ритма и ЧСС. Препараты класса Ia блокируют реполяризацию калиевых каналов, увеличивая рефрактерные периоды кардиомиоцитов с быстрыми каналами. На ЭКГ этот эффект отражается как удлинение интервала QT даже при нормальном ритме.
Препараты класса Ia используют для уменьшения предсердной экстрасистолии Предсердная экстрасистолия Различные ритмы могут происходить из суправентрикулярных очагов (обычно в предсердиях). Диагностируется по электрокардиографии. Многие случаи являются бессимптомными и лечения не требуют. (См. Прочитайте дополнительные сведения , желудочковой экстрасистолии Желудочковая экстрасистолия (ЖЭ) Желудочковые экстрасистолы (ЖЭ) – это единичные желудочковые импульсы, вызванные риентри в желудочке или возникающие по механизму анормального автоматизма кардиомиоцитов желудочков. Широко распространены. Прочитайте дополнительные сведения . Основные показания - это наджелудочковая и желудочковая тахикардии.
Препараты Ia класса могут стать причиной полиморфной желудочковой тахикардии. Прием препаратов класса Ia индуцирует и замедляет предсердные тахиаритмии, что является достаточным для осуществления атриовентрикулярной проводимости 1:1 с увеличением желудочкового ответа.
Антиаритмические препараты Класс Ib
Препараты класса Ib имеют быструю кинетику, они проявляют свое электрофизиологическое действие только при быстром ритме сердцебиения. Таким образом, ЭКГ, записанная в течение нормального ритма и нормальной ЧСС, обычно не показывает никаких признаков замедления проведения в миокарде. Препараты класса Ib не являются очень сильными антиаритмиками и имеют минимальное влияние на предсердный миокард. Препараты Ib класса непосредственно не блокируют калиевые каналы.
Препараты класса Ib используют для уменьшения желудочковой аритмии ( желудочковых экстрасистол Желудочковая экстрасистолия (ЖЭ) Желудочковые экстрасистолы (ЖЭ) – это единичные желудочковые импульсы, вызванные риентри в желудочке или возникающие по механизму анормального автоматизма кардиомиоцитов желудочков. Широко распространены. Прочитайте дополнительные сведения ).
Антиаритмические препараты Класс Ic
Препараты Ic класса имеют медленную кинетику: их электрофизиологическое действие заметно при любом ритме. Поэтому на ЭКГ при нормальной ЧСС и нормальном ритме обычно видно замедление проведения по миокарду. Препараты класса Ic более мощные антиаритмики, чем препараты класса Ia или Ib. Препараты класса Ic не блокируют калиевые каналы напрямую.
Препараты класса Ic могут индуцировать и замедлять предсердные тахиаритмии, что достаточно для осуществления АВ проводимости 1:1 с увеличением скорости желудочкового ответа.
Препараты класса Ic используются для подавления предсердных экстрасистол Предсердная экстрасистолия Различные ритмы могут происходить из суправентрикулярных очагов (обычно в предсердиях). Диагностируется по электрокардиографии. Многие случаи являются бессимптомными и лечения не требуют. (См. Прочитайте дополнительные сведения , желудочковых экстрасистол Желудочковая экстрасистолия (ЖЭ) Желудочковые экстрасистолы (ЖЭ) – это единичные желудочковые импульсы, вызванные риентри в желудочке или возникающие по механизму анормального автоматизма кардиомиоцитов желудочков. Широко распространены. Прочитайте дополнительные сведения .
Антиаритмические препараты Класс II
К антиаритмическим препаратам класса II относятся
Бета-блокаторы преимущественно действуют на ткани с медленным проведением (синоатриальный и атриовентрикулярный узлы), где они уменьшают автоматизм, замедляют проводимость и увеличивают рефрактерность. Таким образом, ритм сердца замедляется, увеличивается интервал PR, АВ-сое-динение уменьшает проведение быстрой предсердной активности.
Препараты II класса преимущественно применяется для лечения наджелудочковых тахикардий Пароксизмальная суправентрикулярная тахикардия (СВТ), включая синдром Вольфа-Паркинсона- Уайта В возникновении наджелудочковых тахикардий по механизму риентри (НЖТ) участвуют электрические проводящие пути, расположенные выше бифуркации пучка Гиса. У пациентов возникают эпизоды внезапного. Прочитайте дополнительные сведения , включая синусовую тахикардию, атриовентрикулярные узловые реципрокные тахикардии, фибрилляцию предсердий Фибрилляция предсердий Фибрилляция предсердий – это быстрый нерегулярный предсердный ритм. Симптомы включают: перебои в работе сердца и иногда – слабость, снижение толерантности к физической нагрузке, одышку, пресинкопальные. Прочитайте дополнительные сведения и трепетание предсердий Трепетание предсердий Трепетание предсердий – быстрый регулярный предсердный ритм, обусловленный циркуляцией предсердного возбуждения макрориентри. Симптомы включают: перебои в работе сердца и иногда – слабость. Прочитайте дополнительные сведения . Эти препараты также используются для лечения желудочковых тахикардий Желудочковая тахикардия (ЖТ) Желудочковая тахикардия это ≥ 3 последовательных желудочковых комплексов с частотой ≥ 120 ударов в минуту. Симптомы зависят от длительности и могут варьировать от их полного отсутствия до ощущения. Прочитайте дополнительные сведения , чтобы повысить порог фибрилляции желудочков Фибрилляция желудочков (ФЖ) Фибрилляция желудочков вызывает нескоординированное дрожание желудочков с отсутствием эффективного сокращения. Она вызывает незамедлительное синкопе и смерть в течение нескольких минут. Лечение. Прочитайте дополнительные сведения и уменьшить проаритмический эффект стимуляции бета-адренорецепторов.
Бета-блокаторы в целом хорошо переносятся; побочные эффекты включают усталость, нарушения сна и желудочно-кишечные расстройства. Эти препараты противопоказаны больным астмой.
Антиаритмические препараты III класса
Препараты класса III представляют собой
Препараты, стабилизирующие мембрану, прежде всего, блокаторы калиевых каналов
Препараты III класса увеличивают длительность потенциала действия и рефрактерность в тканях с медленными и быстрым каналами. Таким образом, способность мышечных волокон в сердце передавать импульсы на высоких частотах ухудшается, но скорость проведения значимо не изменяется. Поэтому удлиняется потенциал действия, автоматизм снижается. Преимущественный эффект на ЭКГ заключается в удлинении интервала QT.
Антиаритмические препараты Класс IV
Препараты класса IV это
Недигидропиридиновые блокаторы кальциевых каналов
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Классификация антиаритмических средств. Классификация Vaughan-Williams
Для любой совокупности объектов полезная классификация предоставляет относительно простую, логическую основу, облегчающую обучение и изучение, содействует их связи, практическим обобщениям и дает понимание существенной природы этих объектов. Две основные классификации антиаритмических препаратов — Vaughan-Williams, предложенная в 1971 г., и так называемый сицилианский гамбит (Sicilian Gambit), разработанный 20 лет спустя,— вкратце обсуждаются ниже.
На взгляд большинства клиницистов, более старая классификация Vaughan-Williams лучше выполняет главную цель классифицирующей системы для неспециалистов.
До конца 1960-х гг. существовало так мало антиаритмических препаратов, что необходимость в их классификации отсутствовала. Однако, когда число новых антиаритмических средств существенно возросло, были предложены несколько классификаций. Самую широкую популярность приобрела схема Vaughan-Williams.
Классификация Vaughan-Williams доказала свою пользу, так как она группирует препараты по их основному механизму действия, то есть в соответствии с локализацией связывания и блокирования каналов в мембранах сердечных клеток. Так, препараты I класса блокируют натриевые каналы клеточной мембраны (и замедляют скорость проведения), препараты II класса блокируют адренергические рецепторы (и подавляют эффект симпатической стимуляции на электрофизиологические свойства сердца), препараты III класса блокируют калиевые каналы (и увеличивают рефрактерные периоды), а препараты IV класса блокируют кальциевые каналы (и воздействуют на те области сердца, которые деполяризуются в основном посредством кальциевых каналов: СА- и АВ-узлы).
Учитывая некоторые очевидные различия препаратов I класса, классификация Vaughan-Williams разделяет их на три подгруппы. Препараты класса IA — хинидин, прокаинамид и дизопирамид — умеренно замедляют проведение (путем замедления деполяризации) и также умеренно увеличивают рефрактерные периоды (посредством удлинения потенциала действия); препараты класса IB — лидокаин, токаинид, мексилетин и фенитоин — не замедляют проведение и уменьшают длительность потенциала действия; препараты класса 1С — флекаинид, энкаинид, пропафенон и морицизин — вызывают выраженное замедление скорости проведения, но очень незначительно удлиняют рефрактерные периоды.
Препараты в классификации Vaughan-Williams распределены согласно их основным мембранным эффектам, что облегчает использование антиаритмических средств в соответствии с их электрофизиологическими свойствами.
Критики классификации Vaughan-Williams отмечают, что антиаритмические средства часто оказывают смешанное действие на сердечные клетки и что препараты одной и той же группы могут, с точки зрения клинициста, проявлять себя различным образом. Наиболее важным запутывающим моментом является то, как антиаритмические препараты влияют на натриевые и калиевые каналы. На самом деле, успех классификации в большей степени обусловлен ее способностью характеризовать различные эффекты препаратов I и III классов на натриевые и калиевые каналы, а значит, на скорость проведения и рефрактерные периоды.
Например, характеристики связывания препаратов, блокирующих натриевые каналы, весьма сложны. Хотя все препараты I класса обладают свойством соединяться с натриевыми каналами, этот эффект не постоянен (то есть они не «прилипают» к каналу, а непрерывно связываются с ним и отсоединяются от него). Фактическая блокада натриевого канала (и поэтому замедление деполяризации) наблюдается только тогда, когда препарат связывается с открывающимся каналом. Однако многие препараты I класса связываются с натриевым каналом только после того, как он уже открылся (то есть когда он находится в «активированном» состоянии).
Поэтому, для того чтобы вызвать блокаду натриевого канала, препарат I класса должен связаться с активированным каналом и затем оставаться в связанном с ним состоянии до тех пор, пока канал не начнет снова открываться (в этот момент блокада наконец произойдет). Таким образом, эффект препарата I класса на натриевый канал зависит от кинетики его связывания — от скорости, с которой препарат связывается и разъединяется с натриевым каналом (или, другими словами, эффект препарата зависит от того, насколько он «прилипает» к каналу, связываясь с ним). Если препарат «нелипучий» и быстро разъединяется с каналом (то есть имеет быструю кинетику связывания), блокада натриевого канала может быть минимальной.
Поэтому препараты с быстрой кинетикой связывания вызывают относительно малые изменения скорости проведения. Наоборот, липучие препараты, которые разъединяются с каналом медленно (то есть препараты имеют медленную кинетику связывания), вызывают существенную блокаду натриевых каналов, снижая таким образом скорость проведения. В целом, чем медленнее кинетика связывания препарата, блокирующего натриевые каналы, тем больший эффект он оказывает на скорость проведения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лечение аритмий. Классификация антиаритмических средств, разработанная Воганом Уильямсом
Автоматизм и проведение — мишени антиаритмической терапии. Цели лечения аритмий:
• восстановление ритма сердцебиений до нормы;
• предотвращение рецидива аритмии;
• устранение гемодинамические последствий аритмий;
• снижение риска возникновения более тяжелых аритмий, таких как фибрилляция желудочков. Хотя наиболее желательной целью является восстановление нормального синусового ритма, это не всегда необходимо. Так, при фибрилляции предсердий контроль частоты сокращений желудочков — такая же важная цель лекарственной терапии, как и восстановление нормального синусового ритма. Терапию аритмий проводят лекарствами, а также используют нефармакологические методы: электрическую дефибрилляцию, хирургическое вмешательство и имплантацию искусственного водителя ритма. Значение нефармакологических способов лечения возрастает. Главная цель лекарственной терапии — восстановить синусовый ритм, не вызывая побочных эффектов.
Многие лекарственные средства не отвечают полностью этой цели. При назначении многих из этих препаратов необходим мониторинг их концентрации в плазме.
Классификация антиаритмических средств, разработанная Воганом Уильямсом
Теоретически антиаритмические лекарственные средства можно классифицировать по механизму их действия на молекулярном, клеточном и тканевом уровнях. Со времени открытия первого антиаритмического препарата Венкебахом в 1914 г. перечень антиаритмических средств значительно расширился, однако система классификации долгое время оставалась несовершенной. Первая система классификации, разработанная Воганом Уильямсом в 1970 г., описывает отличительные свойства лекарственных средств, используемых в качестве антиаритмических препаратов, хотя эти свойства не обязательно соответствуют механизму действия.
Предполагается, что классификация антиаритмических средств поможет выбрать необходимый для лечения препарат. Однако лишь для небольшого числа аритмий средством выбора являются лекарственные средства только одного класса. Отчасти это обусловлено тем, что лекарственные средства не всегда эффективны. Для наджелудочковых аритмий это не так существенно, поскольку если препарат неэффективен, то можно применить другой. Выбор эффективного лекарственного средства становится более сложной проблемой в случае желудочковых аритмий, т.к. они могут серьезно осложнять состояние пациента или приводить к летальному исходу.
Антиаритмические средства особенно неэффективны при желудочковых аритмиях, поэтому выбор препарата часто основывается на данных последовательного тестирования способности лекарственных средств подавлять аритмии, индуцированные «запрограммированной» электростимуляцией желудочков у данного пациента в условиях клиники. Проведенные исследования показывают, что этот метод — не очень хороший предиктор улучшения выживаемости в отдаленном периоде. Тем не менее его продолжают использовать как ориентир при выборе терапии. Для профилактики желудочковых аритмий часто используют комбинацию антиаритмических средств разных классов. Наиболее важный нефармакологический метод лечения жизнеугрожающих желудочковых аритмий — применение автоматического имплантируемого дефибриллятора (АИД).
Классификация, разработанная Воганом Уильямсом, не помогает выбрать лекарственное средство, основываясь на механизме его действия. Так, РПД и re-entry могут быть мишенями для лекарственной терапии, однако препараты (в том числе и некоторые антиаритмические) могут содействовать появлению аритмии (проаритмии). Преобладающий эффект (про- или антиаритмический) лекарственного средства зависит от конкретного заболевания и дозы лекарства. В экспериментах на животных можно вызвать РПД с помощью антиаритмических средств класса III, но удается предотвратить reentry, применяя те же самые препараты.
Лекарственные средства класса I содействуют возникновению re-entry, замедляя скорость проведения, и блокируют re-entry, превращая однонаправленную блокаду проведения в двунаправленную. Таким образом, сложно предсказать, каким будет конечный эффект антиаритмического средства — положительным или отрицательным.
1. Классификация e.Vaughan-Williams (1969):
Основная идея классификации - подбор препарата каждому конкретному больному индивидуально, с учетом всех особенностей того или иного лекарства. Классификация создавалась не для заучивания, ее применение упрощается с использованием компьютера. Состоит она из двух таблиц. По первой, определив механизм развития аритмии, находим уязвимые параметры и группы препаратов, которые могут на них повлиять. По второй таблице, выбирают конкретный препарат с учетом его клинических эффектов и действия на каналы, рецепторы, транспортные ферменты.
3. Препараты, не вошедшие в классификацию, но обладающие антиаритмическими свойствами.
холинолитики (атропин, препараты красавки) - используют для увеличения ЧСС при брадикардиях, особенно велико их значение в лечении вегетативных дисфункций синусового узла.
сердечные гликозиды (дигоксин, строфантин) - традиционные средства урежения сердечного ритма.
аденозин (АТФ) - препарат для купирования реципрокных тахиаритмий.
электролиты (растворы калия, магния, пероральные препараты калия и магния) - препараты калия обладают урезающим действием. Действуя на патогенетические механизмы, электролиты способствуют нормализации ритма сердца.
дигидропиридиновые кальциевые блокаторы
лацидипин - успешно применяются для лечения брадизависимых аритмий, поскольку приводят к умеренному увеличению ЧСС.
ингибиторы ангиотензинпревращающего фермента
лизиноприл - доказан положительный эффект при желудочковых нарушениях ритма.
Показания к назначению ААП
В зависимости от эффективности действия на определенные виды аритмии антиаритмические препараты подразделяются на четыре группы :
1) преимущественно эффективные у больных с наджелудочковыми нарушениями ритма сердца: изоптин, кардил, анаприлин;
2) эффективные, в основном у пациентов с желудочковыми аритмиями: лидокаин, тримекаин, мекситил;
3) эффективные как при наджелудочковых, так и при желудочковых аритмиях: препараты 1А, 1С подклассов и III класса;
4) имеющие специфические показания: а) дифенин — для желудочковых аритмий, связанных или сочетающихся с интоксикацией сердечными гликозида-ми и/или электролитными нарушениями (гипокалиемией);
5) анилидин, фалипамин (селективные) — при наличии противопоказаний к В-блокаторам (бронхиальная астма, декомпенсированное легочное сердце, синдром перемежающейся хромоты, идиосинкразия).
Нежелательные эффекты ААП.
Любое действие ААП может вызывать как антиаритмический, так и аритмогенный эффекты. Вероятность проявления антиаритмического эффекта для большинства препаратов составляет в среднем 40–60%. Исключением является амиодарон, эффективность которого достигает 70–80%, даже при отсутствии эффекта от других ААП. Вероятность аритмогенного эффекта в среднем составляет около 10%, а у препаратов класса IС достигает 20% и более. При этом аритмогенный эффект может проявляться в виде возникновения опасных для жизни аритмий. При тяжелых желудочковых аритмиях у пациентов с выраженным органическим поражением сердца вероятность аритмогенного действия может превышать вероятность антиаритмического эффекта.
В нескольких крупных клинических исследованиях было выявлено заметное повышение общей смертности и частоты случаев внезапной смерти (в 2–3 раза и более) больных с органическим поражением сердца (постинфарктный кардиосклероз, гипертрофия или дилатация сердца) на фоне приема ААП I класса, несмотря на эффективное устранение аритмий. Наиболее известной работой, в ходе которой впервые было выявлено полное несоответствие клинической эффективности препаратов и их влияния на прогноз, является исследование Cardiac Arrhythmia Suppression Trial (CAST). Изучалось действие трех ААП: флекаинида, энкаинида и морицизина (этмозин). При промежуточном анализе обнаружилось резкое увеличение общей смертности и частоты внезапной смерти (соответственно в 2,5 и 3,6 раза) среди больных, принимавших флекаинид и энкаинид, несмотря на эффективное устранение желудочковых экстрасистол. В дальнейшем увеличение смертности было выявлено и на фоне приема морицизина (CAST-II). Результаты исследования CAST заставили пересмотреть тактику лечения не только больных с нарушениями ритма сердца, но и кардиологических пациентов в целом. Исследование CAST сыграло едва ли не основную роль в становлении доказательной медицины.
Единственными ААП, на фоне приема которых отмечается снижение смертности, являются
β-блокаторы и амиодарон. Поэтому в настоящее время β-блокаторы и амиодарон являются препаратами выбора при лечении аритмий у больных с органическим поражением сердца.
У всех ААП имеются нежелательные побочные эффекты. Как правило, их частота и выраженность зависят от дозы препарата. Подробный перечень побочных эффектов ААП занимает несколько десятков страниц. Перечень побочных эффектов каждого ААП приводится в аннотациях к препаратам.
Высокая частота аритмогенного действия и побочных эффектов ААП позволяют в качестве одного из основных принципов лечения аритмий предложить следующее: «Избегать назначения антиаритмических препаратов всегда, когда это возможно» (R. F. Fogoros, 1997).
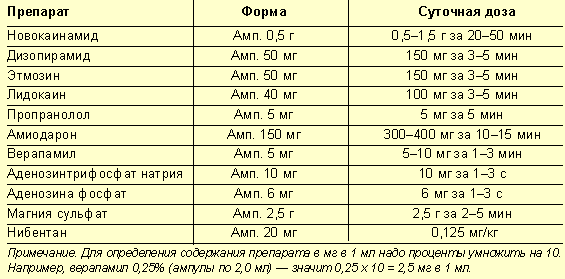
Применяемые для внутривенного введения ААП и рекомендуемые суточные дозы приведены в таблице
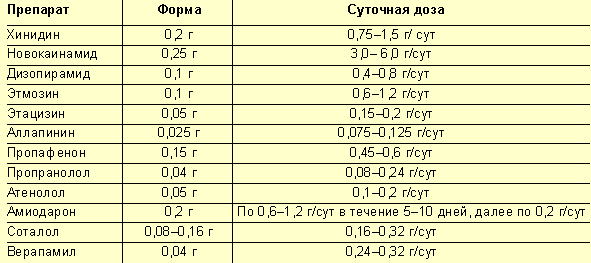
Применяемые внутрь ААП и рекомендуемые суточные дозы приведены в таблице
Краткая характеристика ААП. Из ААП I класса в России используют в основном четыре препарата: хинидин (кинидин дурулес), аллапинин, этацизин и пропафенон (ритмонорм, пропанорм). Эти препараты обладают примерно одинаковой эффективностью и переносимостью. Кроме этих препаратов I класса, в неотложных ситуациях используют внутривенное введение новокаинамида и лидокаина.
После исследования CAST и опубликования результатов метаанализа исследований по применению ААП I класса, в ходе которого было показано, что практически все ААП I класса способны влиять на увеличение смертности у больных с органическим поражением сердца, β-блокаторы стали самыми популярными ААП.
Антиаритмический эффект β-блокаторов обусловлен именно блокадой бета-адренергических рецепторов, т. е. уменьшением симпатико-адреналовых влияний на сердце. Поэтому β-блокаторы наиболее эффективны при аритмиях, связанных с симпатико-адреналовыми влияниями — так называемых катехоламинзависимых, или адренергических, аритмиях. Их возникновение, как правило, связано с физической нагрузкой или психоэмоциональным напряжением.
β-блокаторы являются препаратами выбора для лечения аритмий при врожденных синдромах удлинения интервала QT.
При аритмиях, не связанных с активацией симпатической нервной системы, β-блокаторы гораздо менее эффективны, но их добавление в схему лечения нередко значительно увеличивает эффективность других ААП и снижает риск аритмогенного эффекта ААП I класса.
Препараты 1класса в сочетании с β-блокаторами не влияют на увеличение смертности у больных с органическим поражением сердца (исследование CAST).
Дозы β-блокаторов регулируют в соответствии с антиаритмическим эффектом. Дополнительным критерием достаточной β-блокады является снижение частоты сердечных сокращений (ЧСС) до 50/мин.
Оригинальным препаратом является амиодарон. Он обладает свойствами всех четырех классов ААП и, кроме того, оказывает умеренное a-блокирующее и антиоксидантное действие. Амиодарон, несомненно, является самым эффективным из существующих ААП. Его даже называют «аритмолитическим препаратом». Вместе с тем отношение кардиологов к амиодарону с самого начала его использования для лечения аритмий вызывало наибольшие разногласия. Из-за высокой частоты возникновения экстракардиальных побочных эффектов амиодарон достаточно долго считали препаратом резерва: рекомендовали применять только при опасных для жизни аритмиях и лишь при отсутствии эффекта от всех остальных ААП (L. N. Horowitz, J. Morganroth, 1978; J. W. Mason, 1987; J. C. Somberg, 1987).
Однако после проведения CAST и других исследований стало ясно, что амиодарон является не только самым эффективным, но и самым безопасным (после β-блокаторов) ААП. В ходе многочисленных крупных контролируемых исследований эффективности и безопасности применения амиодарона не только не выявлено увеличения смертности, а, наоборот, наблюдалось снижение общей смертности и частоты аритмической и внезапной смерти. Частота возникновения желудочковой тахикардии типа «пируэт» на фоне приема амиодарона гораздо ниже, чем на фоне других ААП, удлиняющих интервал QT, и составляет менее 1%.
В результате из препаратов резерва амиодарон перешел в препараты первого выбора при лечении аритмий.
Основным недостатком препарата является высокая частота экстракардиальных побочных эффектов при длительном приеме (J. A. Johus и др., 1984; J. F. Best и др., 1986; W. M. Smith и др., 1986). К основным побочным эффектам амиодарона относятся: фотосенсибилизация, изменение цвета кожи, нарушение функции щитовидной железы (как гипотиреоз, так и гипертиреоз), повышение активности трансаминаз, периферические нейропатии, мышечная слабость, тремор, атаксия, нарушения зрения. Большинство этих побочных эффектов обратимы и исчезают после отмены или при уменьшении дозы амиодарона. Гипотиреоз можно контролировать с помощью приема левотироксина. Наиболее опасным побочным эффектом амиодарона является поражение легких («амиодароновое поражение легких»). По данным разных авторов, его частота составляет от 1 до 17%, а смертность в случае развития фиброза легких — от 10 до 20% (J. J. Heger и др., 1981; B. Clarke и др., 1985, 1986). Однако в большинстве случаев поражение легких развивается только при длительном приеме сравнительно больших поддерживающих доз амиодарона — более 400 мг/сут (до 600 или даже 1200 мг/сут). Такие дозы в настоящее время практически не применяют. Поддерживающая доза препарата в России обычно составляет 200 мг/сут или даже меньше (по 200 мг 5 дней в неделю). В настоящее время частота «амиодаронового поражения легких» составляет не более 1% в год (S. J. Connolly, 1999; M. D. Siddoway, 2003).
Амиодарон обладает уникальными фармакокинетическими свойствами. Для наступления антиаритмического эффекта от приема препарата необходим период «насыщения» — «кордаронизация».
После достижения антиаритмического эффекта дозу постепенно уменьшают до минимально эффективной. Эффективными поддерживающими дозами амиодарона могут быть 100 мг/сут и даже 50 мг/сут (M. Dayer, S. Hardman, 2002).
Действие и эффективность внутривенного применения амиодарона менее изучены по сравнению с пероральным приемом. При болюсном внутривенном введении препарат обычно вводят 5 мг/кг веса в течение 5 мин. Одна из наиболее популярных схем внутривенного введения амиодарона: болюс 150 мг за 10 мин, затем инфузия со скоростью 1 мг/мин в течение 6 ч (360 мг за 6 ч), далее инфузия со скоростью 0,5 мг/мин.
Опубликованные данные свидетельствуют о том, что при желудочковых тахиаритмиях внутривенное введение амиодарона более эффективно, чем применение лидокаина, бретилия тозилата и новокаинамида. Применение амиодарона эффективно при всех вариантах наджелудочковых и желудочковых аритмий. Даже при аритмиях, рефрактерных ко всем остальным ААП, эффективность препарата достигает 60–80%, как при внутривенном введении, так и при приеме внутрь.
При применении соталола (соталекса) средние суточные дозы составляют 240–320 мг. Начинают с назначения 80 мг 2 раза в день. На фоне приема соталола имеется повышенный риск развития желудочковой тахикардии типа «пируэт». Поэтому прием этого препарата желательно начинать в стационаре. При его назначении необходимо тщательно контролировать величину интервала QT, особенно в первые 3 дня. Корригированный интервал QT не должен превышать 0,5 с.
К новым ААП III класса относятся так называемые «чистые» ААП III класса — дофетилид, ибутилид и отечественный препарат нибентан. Эти лекарственные средства применяются преимущественно для лечения мерцательной аритмии. Они удлиняют интервал QT и их применение сопровождается повышенным риском возникновения желудочковой тахикардии типа «пируэт».
Дофетилид назначают внутрь по 0,5 г 2 раза в день. Частота возникновения тахикардии типа «пируэт» составляет около 3%, в основном в первые 3 дня приема препарата. Дофетилид отменяют при удлинении корригированного интервала QT более 0,5 с. Ибутилид назначают внутривенно для восстановления синусового ритма при мерцательной аритмии. Ибутилид вводят внутривенно струйно 1 мг в течение 10 мин. При отсутствии эффекта препарат вводят повторно. Эффективность ибутилида в купировании мерцания и трепетания предсердий составляет около 45%. Частота возникновения тахикардии типа «пируэт» достигает 8,3%.
Нибентан, ампулы по 20 мг (2 мл 1% раствора), отечественный препарат, наиболее эффективный при мерцательной аритмии. По опубликованным данным, нибентан намного превосходит все имеющиеся зарубежные аналоги. Его эффективность в восстановлении синусового ритма даже при постоянной форме мерцательной аритмии достигает 100%. Препарат вводится внутривенно в дозе 0,125 мг/кг (т. е. примерно 1 мл — 10 мг) в течение 3 мин (в 20 мл изотонического раствора натрия хлорида). В последние годы получены данные, что введение в 2 раза меньшей дозы (0,0625 мг/кг — примерно 0,5 мл — 5 мг), как правило, не менее эффективно. При отсутствии эффекта через 15 мин нибентан вводят повторно в той же дозе. Побочные эффекты (появление кислого или «металлического» вкуса во рту, ощущение «жара» или «холода», двоение в глазах, легкое головокружение, першение в горле) и аритмогенное действие нибентана (желудочковые экстрасистолы и желудочковая тахикардия типа «пируэт») наблюдаются сравнительно редко — примерно в 1% случаев.
Основным показанием для назначения верапамила и дилтиазема является купирование пароксизмальных реципрокных атриовентрикулярных узловых тахикардий. Эффективность верапамила и дилтиазема в купировании пароксизмальных наджелудочковых тахикардий составляет 80–100%. Вторым показанием для применения верапамила и дилтиазема служит урежение ЧСС при тахисистолической форме мерцательной аритмии. Следует отметить, что внутривенное введение верапамила противопоказано при мерцательной аритмии у больных с синдромом Вольфа–Паркинсона–Уайта, так как у некоторых больных после введения верапамила наблюдается резкое увеличение частоты сокращений желудочков до 300 в минуту и более. Существует вариант желудочковой тахикардии, при котором верапамил выступает в качестве препарата выбора и нередко единственного эффективного лекарственного средства. Это так называемая верапамилчувствительная желудочковая тахикардия — идиопатическая желудочковая тахикардия, при которой комплексы QRS имеют форму блокады правой ножки пучка Гиса с отклонением электрической оси влево.
Принципы выбора ААП. Как и при лечении других заболеваний, выбор ААП осуществляется прежде всего на основании данных об эффективности, безопасности, побочных эффектах и противопоказаний к его назначению. При наличии показаний для лечения того или иного варианта нарушения ритма выбирают препарат, наиболее приемлемый для данного больного. В дальнейшем при необходимости последовательно оценивают все имеющиеся ААП до тех пор, пока не будет обнаружено первое эффективное средство, или выбирают самый подходящий препарат из нескольких действенных. В случае отсутствия эффекта от монотерапии подбирают комбинацию ААП или применяют немедикаментозные способы лечения аритмий.
У больных с аритмиями, но без признаков органического заболевания сердца считается допустимым назначение любых ААП.
У пациентов с органическим заболеванием сердца (постинфарктный кардиосклероз, гипертрофия желудочков и/или дилатация сердца) препаратами первого выбора являются β-блокаторы и амиодарон. С учетом безопасности ААП оценку эффективности целесообразно начинать с β-блокаторов или амиодарона. При неэффективности монотерапии оценивают эффект сочетания амиодарона и β-блокаторов. Если нет брадикардии или удлинения интервала РR, можно сочетать с амиодароном любой β-блокатор. У больных с брадикардией к амиодарону добавляют пиндолол (вискен). Показано, что совместный прием амиодарона и β-блокаторов в значительно большей степени снижает смертность среди пациентов с сердечно-сосудистыми заболеваниями, чем каждый из препаратов в отдельности. Только при отсутствии эффекта от β-блокаторов и/или амиодарона применяют ААП I класса. При этом препараты I класса, как правило, назначают на фоне терапии β-блокатором или амиодароном.
Примерная последовательность подбора эффективной медикаментозной терапии у больных с рецидивирующими аритмиями:
β-блокатор или амиодарон.
Амиодарон + ААП IС класса.
β-блокатор + любой препарат I класса.
Амиодарон + β-блокатор + ААП IС класса.
Соталол + ААП IС класса.
В настоящее время непрерывное суточное Холтеровское мониторирование ЭКГ является самым распространенным и информативным неинвазивным методом диагностики и количественной оценки нарушений ритма, ставшим обязательным при обследовании большинства кардиологических больных.
1.Сколько классов антиаритмических средств по классификация E.Vaughan-Williams вы знаете?
2.Перечислите названия препаратов 1с класса.
3.Назовите схемы подбора эффективной медикаментозной терапии у больных с рецидивирующими аритмиями
Применение: подавление ПЭС, ЖЭ, НЖТ, ЖТ, ФП или ТП, ФЖ
Внутривенно: исходно 1,5 мг/кг на протяжении > 5 минут, после этого - инфузия 0,4мг/кг/час
Перорально, с немедленным высвобождением: 100 или 150 мг каждые 6 часов
Перорально, с контролируемым высвобождением : 200 или 300 мг каждые 12 часов
Антихолинэргические эффекты (задержка мочи, глаукома, сухость во рту, ухудшение зрения, кишечные расстройства), гипогликемия, двунаправленная ЖТ, отрицательные инотропные эффекты (которые могут усугублять течение сердечной недостаточности или приводить к гипотензии)
Препарат применять с осторожностью у пациентов с нарушением функции ЛЖ.
Дозировка должна быть уменьшена у пациентов с почечной недостаточностью.
Побочные эффекты могут возникать при нарушении схемы лечения.
При расширении комплекса QRS ( > 50%, если начальный интервал 120 миллисекунд, или > 25%, если исходный интервал > 120 миллисекунд), или если корригированный QT-интервал удлинен > 550 миллисекунд, скорость инфузии или доза должны быть уменьшены или приостановлено введение препарата.
В\в форма не доступна в США.
Внутривенно, 10-15 мг/кг, струйно (25-50 мг/минуту) с последующей постоянной внутривенно инфузией со скоростью 1-4 мг/минуту
Перорально: 250-625 мг (редко до 1 г) каждые 3 или 4 часа
Перорально с контролируемым высвобождением: для пациентов 91 кг, 1000 мг каждые 6 часов
Гипотензия (при в\в инфузиии), серологические аномалии (особенно АНА) возникают почти в 100% случаев при приеме препарата > 12 месяцев, медикаментозная волчанка (артралгия, лихорадка, превральный выпот) возникают в 15-20%, агранулоцитоз в 1% случаев, полиморфная ЖТ
Нет необходимости в частом дозировании, так как действующее вешество медленно выводится.
При расширении комплекса QRS ( > 50%, если начальный интервал 120 миллисекунд, или > 25%, если исходный интервал > 120 миллисекунд) или если корригированный QT-интервал удлинен > 550 миллисекунд, скорость инфузии или доза должны быть уменьшены или приостановлено введение препарата.
Перорально: 200-400 мг каждые 4-6 часов
Диаррея, колики, метеоризм, лихорадка, нарушения функции печени, желудочковая тахикардия "torsades de pointes", общая частота побочных эффектов - 30%
Если интервал QRS удлиняется ( > 50%, если начальный интервал 120 миллисекунд, или > 25%, если исходный интервал > 120 миллисекунд) или если корригированный QT-интервал удлинен > 550 миллисекунд, скорость инфузии или доза должны быть уменьшены или приостановлено введение препарата.
Применение: подавление желудочковых арритмий (желудочковые ЭС, ЖТ, ФЖ)
Внувенно: 100 мг на протяжении 2 минут, далее постоянная инфузия со скоростью 4 мг/минута (2 мг/минута у пациентов > 65 лет) и через 5 минут после введения 1 дозы – 2й болюс 50 мг препарата
Тремор, судороги; при слишком быстром введении – сонливость, бред, парестезии; возможно увеличение риска развития брадиаритмий после острого инфаркта миокарда
Для снижения риска интоксикации спустя 24 часов должна быть уменьшена доза или скорость введения до 2 мг/минуту.
Выраженный метаболизм в печении при первичном прохождении.
Перорально, с немедленным высвобождением: 100-250 мг каждые 8 часов
Пероральные медленного высвобождения: 360 мг каждые 12 часов
Внутривенно: 2 мг/кг при скорости 25 мг/минуту, затем введение 250 мг в течение 1 часа, 250 мг – в течение 2-го часа, поддерживающая доза – 0,5 мг/минуту
Тошнота, рвота, тремор, судороги
Формы для приема внутрь с медленным высвобождением и для парентерального введения недоступны для США.
Перорально: 100 мг каждые 8 или 12 часов
В/в: 1-2 мг/кг в течение 10 минут
Изредка нарушения зрения и парестезии
Если интервал QRS удлиняется ( > 50%, если исходный интервал 120 миллисекунд, или > 25%, если исходный интервал > 120 миллисекунд), доза должна быть уменьшена или приостановлено введение препарата.
Формы для внутривенно введения не доступны в США.
Внутрь: исходно от 150 мг 3 раза в день с титрацией дозы до 225-300 мг 3 раза в день при необходимости
Внутривенно: 2 мг/кг, струйно; в последующем - введение с скоростью 2 мг/минуту
Бета-блокирующая активность, возможно возникновение дыхательных расстройств; редко желудочно-кишечные расстройства
Фармакокинетика нелинейная; увеличение дозы не должно быть более чем на 50% от предыдущей.
Биодоступность и связывание с белками различно; препарат обладает накопительным действием.
В\в форма не доступна в США
Класс II (бета-блокаторы)
Применение: наджелудочковые тахиаритмии (ПЭС, синусовая тахикардия, НЖТ, трепетания и фибрилляция предсердий) и желудочковые тахиаритмии (часто для профилактики)
Внутрь, 200 мг 2 раза в день
Бета-блокаторы не имеют рекомендованной дозировки; титрация осуществляется до уменьшения частоты сердечных сокращений более чем на 25%
Как правило, при приеме бета-блокаторов возникают желудочно-кишечные расстройства, бессонница, страшные сновидения, вялость, эректильная дисфункция, возможны нарушения АВ проводимости
Бета-блокаторы противопоказаны пациентам с бронхоспастическими расстройствами.
Внутрь: 50-100 мг, 1 раз в день
Внутрь: 20 мг, 1 раз в день
Внутривенно: 5–10 мг, 1 раз в день
Перорально: исходно 6,25 мг 2 раза в день с последующей титрацией до 25 мг 2 раза в день
Внутривенно: 50–200 мкг/кг/минута
Внутривенно: 50–100 мг, дважды в день
В/в: 5 мг каждые 5 минут до достижения 15 мг
Внутрь: 60-80 мг, 1 раз в день
Внутрь: 10-30 мг 3 или 4 раза в день
В\в: 1-3 мг (инъекция может быть повторена через 5 минут, если необходимо)
Перорально: 10-20 мг два раза в день
Класс III (мембраностабилизирующие препараты)
Применение: любые тахиаритмии кроме веретенообразной ЖТ
Амиодарон назначается в виде ударной дозы с последующим назначением поддерживающей дозы. Дозы и интервалы значительно варьируются в зависимости от вида аритмии†
Фиброз легочной ткани (до 5% пациентов, получавших лечение > 5 лет) может приводить к смертельному исходу; удлинение интервала QT; полиморфная ЖТ (редко); брадикардия; серая и синюшная пигментация кожи; фотосенсибилизация; нарушения функции печени; периферическая нейропатия; микро отложения на роговице (практически у всех пациентов) - обычно без серьезных нарушений зрения, они исчезают после прекращения лечения; изменения функции щитовидной железы; подъем уровня креатинина до 10% без изменений скорости клубочковой фильтрации; медленный клиренс, возможно, увеличивающий длительность побочных эффектов
Препарат обладает неконкурентным бета-блокирующим эффектом, свойствами блокатора кальциевых и натриевых каналов c отсроченным эффектом.
Хотя он продлевает рефрактерность, делает это более равномерно, чем другие препараты, удлинняющие QT, поэтому двунаправленная веретенообразная желудочковая тахикардия встречается реже
Внутривенно формы могут быть использованы для конверсии ритма.
Внутрь, 100-200 мг 1 раз в день
Внутривенно: исходно, 5 мг/кг, далее постоянная инфузия со скоростью 1-2 мг/минуту
В/м: исходно, 5-10 мг/кг, введение может быть повторено до достижения концентрации 30 мг/кг
В/м поддерживающая доза 5 мг/кг каждые 6-8 часов
Обладает свойствами препаратов класса II.
Эффекты могут сохраняться 10-20 минут.
Препарат применяют для лечения потенциально жизнеугрожающих устойчивых желудочковых тахиаритмий (некупируемых ЖТ, рецидивирующей ФЖ), при которых он обычно действует в течение 30 минут после введения.
Перорально: 500 мкг 2 раза в день если клиренс креатинина > 60 мл/минуту; 250 мкг 2 раза в день если клиренс креатинина составляет 40-60 мл/минуту; 125 мкг 2 раза в день, если клиренс креатинина составляет 20-40 мл/минуту
Препарат противопоказан, если корригированный QT-интервал > 440 милисекунд или клиренс креатинина
Внутрь: 400 мг 2 раза в день
Удлинение коррегированного интервала QT, двунаправленная желудного тракта (редко), брадикардия, желудочно-кишечные расстройства, возможное гепатотоксическое действие (редко), повышение уровня креатинина до 20% без изменений скорости клубочковой фильтрации
Препарат представляет модифицированную молекулу амиодарона (дейодированная) с более коротким периодом полураспада, меньшим объемом распределения, меньшим количеством побочных эффектов, и меньшей эффективностью.
Препарат лучше не использовать у пациентов с сердечной недостаточностью или постоянной формой фибрилляцией предсердий.
Внутривенно: для пациентов весом более или равным 60 кг, 1 мг инфузии или, для пациентов весом менее 60 кг, 0,01 мг/кг за 10 минут, с повторным введением через 10 минут, если первая инфузия неудачная
Веретенообразная ЖТ (в 2%)
Препарат применяют для купирования фибрилляции предсердий (успешен примерно в 40%) и трепетания предсердий (эффективен почти у 65% пациентов).
Перорально: 80-160 мг каждые 12 часов
Внутривенно: 10 мг через 1-2 минут
Подобно классу II; возможны ухудшение функции левого желудочка и веретенообразная ЖТ
Рацемическая [D-L] форма обладает свойствами класса II (бета-блокирующими), [D]-форма не обладает. Обе формы сходны по активности с классом III. Только рацемический Соталол доступен для клинического применения.
Препарат не должен быть использован у пациентов с почечной недостаточностью.
3 мг/кг внутривенно в течение 10 минут (максимум 339 мг)
Если преобразование в синусовый ритм не происходит, выполните вторую инфузию 2 мг/кг в течение 10 минут (максимум 226 мг)
Гипотензию (особенно у пациентов с сердечной недостаточностью)
Брадиаритмии (особенно при сопутствующей бета-блокаде)
Это лекарственное средство не доступно в США.
Класс IV (блокаторы кальциевых каналов)
Применение: купирование наджелудочковых тахикардий и контроль ЧСС при фибрилляции и трепетании предсердий
Пролонгированные форма для приема внутрь (Дилтиазем CD): 120-360 мг 1 раз в сутки
В/в: 5–15 мг/час на период до 24 часов
Возможно возникновение фибрилляции желудочков у больных с желудочковыми тахикардиями, отрицательный инотропный эффект
Внутривенная форма наиболее часто применяется для уменьшения частоты желудочквых сокращений при ФП и ТП.
Внутрь, 40-120 мг 3 раза в день; для пролонгированных форм, 180 мг однократно или 240 мг 2 раза день
В/в: 5-15 мг, через 10 минут
Пероральная профилактика: 40-120 мг 3 раза в день
В\в форма применяется для купирования тахикардий с узким комплексом QRS, включая узловую (эффективность практически 100% при введении внутривенно 5-10 мг за 10 минут).
Другие антиаритмические средства
6 мг быстро внутривенно струйно, повторяется дважды по 12 мг, если необходимо; струйно в 20 мг изотонического раствора
Преходящие нарушения дыхания, дискомфорт в груди, и (в 30-60%) преходящий бронхоспазм
Препарат замедляет или блокирут проведение в АВ соединении.
Длительность действия крайне мала.
Противопоказания включают астму и атриовентрикулярную блокаду высокой степени.
Дипиридамол усиливает действие препарата.
В\в нагрузочная доза: 0,5 мг
Внутрь, поддерживающая доза: 0,125-0,25 мг один раз в день
Анорексия, тошнота, рвота и, часто, серьезные аритмии (желудочковые экстрасистолы и тахикардии, предсердные экстраситолы и тахикардии, атриовентрикулярные блокады 2 и 3 степени, сочетания этих нарушений ритма)
Противопоказания включают наличие антеградно-проводящего дополнительного пути проведения (манифестирующий синдром Вольфа-Паркинсона-Уайта), так как возникновение фибрилляции предсердий приведет к выраженной тахисистолии желудочков (дигоксин укорачивает рефрактерный период дополнительного предсердножелудочкового соединения).
* Доступность не определена
† Ранее хинидин не был доступен в США, но был вновь введен в декабре 2019 года.
‡ Дозировка амиодарона сильно варьирует; должна быть проверена инструкция от производителя по применению препарата. Как правило, пероральная нагрузочная доза при стабильных наджелудочковых аритмиях составляет около 5 г в течение 1-2 недель в дозе от 200 мг два раза в день до 400 мг 3 раза в день. Пероральная нагрузочная доза при желудочковых аритмиях составляет 10 г, которая достигается в течение 1-4 недель. Как правило, пероральная поддерживающая доза составляет 200 мг один раз в день, хотя 100 мг один раз в день можно использовать для пожилых или ослабленных пациентов, а 300 или 400 мг один раз в день можно использовать для профилактики серьезных желудочковых аритмий.
Нагрузочная доза амиодарона внутривенно обычно составляет 150 мг в течение 10 минут с последующей инфузией 1 мг/мин в течение 6 часов, затем 0,5 мг/мин в течение 18 часов. Для МЖ или ЖТ без пульса вводят болюс 300 мг внутривенно, а затем, если необходимо, болюс для внутривенного введения 150 мг.
ФП = фибрилляция предсердий; АНА = антинуклеарные антитела: ПЭС = предсердная экстрастистола; АВ = атриовентрикулярный; CrCl = клиренс креатинина; GFR = уровень клубочковой фильтрации; GI = желудочно-кишечный; ЛЖ = левый желудочек; QTк = корригированный интервал QT; НЖТ = наджелудочковая тахикардия; ФЖ = фибрилляция желудочков; ЖЭ = желудочковая экстраситстола; ЖТ = желудочковая тахикардия.
Читайте также:
- КТ, МРТ при метастазах в основание черепа
- Врожденные системные пороки костной ткани. Дисхондроплазия - болезнь Оллье
- Лечение ГЛПС. Тактика врача при ГЛПС
- Изучение обмена андрогенов в простате. Обмен тестостерона у млекопитающих
- Влияние холода на декомпрессию организма. Влияние холода на работоспособность
