Изучение обмена андрогенов в простате. Обмен тестостерона у млекопитающих
Добавил пользователь Cypher Обновлено: 10.01.2026
ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону, Россия
Чувствительность к андрогенам: за пределами общеизвестного
Журнал: Проблемы эндокринологии. 2018;64(5): 315‑320
Гонадные и внегонадные эффекты тестостерона у мужчин активно исследуются в последние годы. На сегодняшний день не вызывает сомнения увеличение рисков ожирения, сахарного диабета 2-го типа, артериальной гипертензии и атеросклероза у мужчин с дефицитом тестостерона. Одним из механизмов, посредством которых реализуется действие тестостерона, является чувствительность к андрогенам, определяемая длиной CAG-повторов в гене андрогенного рецептора. Увеличение количества CAG-повторов снижает их активность и проявляется низкой чувствительностью к тестостерону. Напротив, уменьшение числа тринуклеотидных повторов сопровождается повышением чувствительности рецепторов к андрогенам. В этом обзоре рассмотрены данные о влиянии полиморфизма гена андрогенного рецептора на эмбриогенез и дифференцировку пола, регуляцию сперматогенеза, прогрессирование рака и доброкачественной гиперплазии предстательной железы, симптоматику гипогонадизма, контроль углеводного и липидного обменов, минеральную плотность костной ткани, эндотелий сосудов, ответ на заместительную терапию тестостероном, а также на психосоциальные аспекты личности мужчин. Внедрение исследования полиморфизма гена рецептора андрогенов в клиническую практику позволит не только прогнозировать фертильность мужчины или риск развития рака простаты, но и подбирать индивидуальную терапию дефицита тестостерона.
Действие андрогенов затрагивает практически все органы и системы. Формирование половых признаков в процессе эмбриогенеза, становление и функционирование репродуктивной системы и обеспечение фертильности — это лишь малая часть эффектов тестостерона (Т) и его метаболитов. Гораздо шире внегонадное действие андрогенов, представленное их влиянием на сердечно-сосудистую систему, липидный и углеводный обмены, минерализацию костной ткани, стимуляцию кроветворения, формирование и функционирование когнитивных функций, психосоциальную адаптацию и сексуальность. Одним из наиболее важных вопросов клинической практики является различная выраженность симптомов гипогонадизма, а также разный ответ на заместительную терапию у пациентов с одинаковым уровнем сывороточного Т. Ответ на этот вопрос кроется в определении чувствительности к андрогенам и является на сегодняшний день крайне малоизученным. Данный обзор содержит анализ наиболее актуальных исследований, опубликованных в рецензируемых журналах баз данных PubMed и eLibrary.
Структура и функции андрогенного рецептора
Многогранное действие Т реализуется через андрогенные рецепторы (AR), расположенные внутриклеточно и структурно относящиеся к рецепторам стероидных гормонов. AR присутствуют в клетках семенников, простаты, кожи, нервной системы и других тканей. Генетический контроль за активностью этих рецепторов осуществляется геном AR, который и обусловливает чувствительность к андрогенам и реализацию действия Т. Широта и разносторонность эффектов, реализуемых через ген AR, впечатляют — от дифференцировки пола в эмбриогенезе, регуляции сперматогенеза, прогрессирования рака и доброкачественной гиперплазии предстательной железы (ДГПЖ), симптоматики гипогонадизма до влияния на углеводный и липидный обмены, минеральную плотность костной ткани, эндотелий сосудов и даже психосоциальные аспекты личности.
Ген AR локализован на длинном плече Х-хромосомы и состоит из 8 экзонов, кодирующих 3 структурно-функциональных белковых домена. N-концевой домен участвует в гомодимеризации рецептора и связывании с ко-активаторами или ко-репрессорами и представлен экзоном 1. Второй — ДНК-связывающий домен содержит петлевой участок из двух «цинковых пальцев» (экзоны 2 и 3). С-концевой домен обеспечивает связывание со стероидными гормонами и представлен экзонами 4—8 [1].
В последние годы внимание исследователей особенно сосредоточено на изучении первого экзона гена AR, для которого характерны повторы последовательности из трех нуклеотидов — цитозина, аденина и гуанина — CAG. Триплет CAG кодирует аминокислоту глутамин, поэтому от числа тринуклеотидных повторов зависит количество глутамина в белке. Так, меньшему числу CAG-повторов соответствует меньшая степень конформационных изменений рецептора, что делает связь гормона и рецептора прочнее и приводит к повышению транскрипционной активности AR. Напротив, с увеличением числа CAG-повторов связь между андрогенами и рецептором становится слабее и транскрипционная активность AR снижается. Таким образом, чем больше длина CAG-повторов, тем слабее оказывается эффект андрогенов при одинаковым уровне Т [2]. Слабая активность андрогенов, вызванная удлинением триплета, находит отражение в механизме обратной связи в пределах гипоталамо-гипофизарно-гонадной оси. У здоровых мужчин удлинение CAG-повторов сопровождается усилением секреции лютеинизирующего гормона (ЛГ) [3], что при интактных клетках Лейдига вызывает повышенную продукцию Т и, следовательно, компенсирует ослабление действия андрогенов. Результатом гипертестостеронемии будет повышенная ароматизация Т в эстрадиол, концентрация которого возрастет. По-видимому, именно с этим связана гинекомастия у пациентов с увеличенным числом CAG-повторов [4]. Высокие концентрации эстрадиола у мужчин с удлинением CAG-повторов и сохраненной обратной связью в оси гипоталамус-гипофиз-гонады может усиливать эффекты этих гормонов в эстроген-зависимых тканях, например в костной [3]. Рядом исследователей обнаружена отрицательная корреляция между длиной CAG-повторов и минеральной плотностью костной ткани [5—7]. Эта связь прослеживалась и у молодых субъектов, но с увеличением возраста мужчин негативное влияние полиморфизма гена AR на минеральную плотность костной ткани усиливалось.
Для мужчин европейской популяции нормальным считается количество CAG-повторов от 9 до 37. Однако в этом нормативе существуют популяционные различия. Так, среднее число CAG-повторов в гене AR у мужчин-европейцев составляет 21, у африканцев — 17, у азиатов — 23. При этом, например 25 CAG-повторов хотя и укладывается в нормативные значения, зачастую бывает связано с ослаблением действия андрогенов, проявляющимся соответствующей клинической симптоматикой [8].
Эмбриогенез и дифференцировка пола
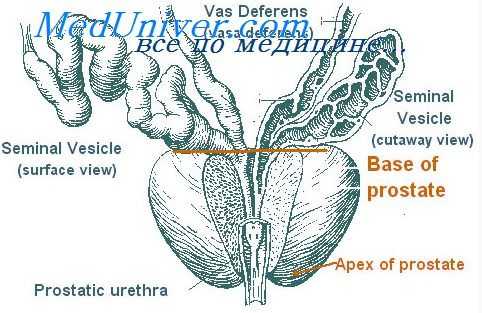
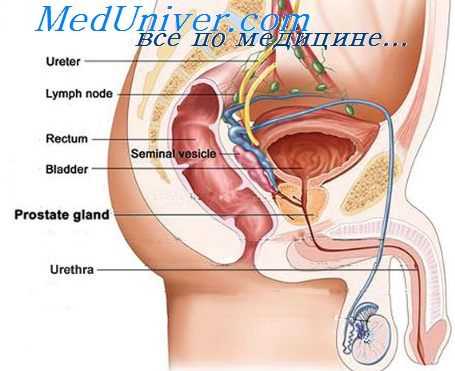
Предстательная железа
Одним из наиболее андроген-чувствительных органов является простата, имеющая большое число рецепторов к андрогенам. Предполагается, что полиморфизм гена AR с его способностью моделировать эффекты андрогенов влияет на долю злокачественных клеток в предстательной железе (ПЖ) [9]. Согласно метаанализу множества исследований [10], отношение шансов возникновения рака ПЖ при снижении частоты тринуклеотидных повторов составляет 1,19.
Возможная связь между ДГПЖ и CAG-полиморфизмом гена AR имеет также другой аспект: ДГПЖ представляет собой разрастание ткани переходной зоны и периуретральной области ПЖ (эпителиальная и фибромышечная гиперплазия). В 2 крупных исследованиях сравнивали сопоставимые когорты здоровых добровольцев и пациентов с ДГПЖ. Отношение шансов увеличения размеров простаты до необходимого хирургического вмешательства в группе с частотой CAG-повторов 24 составляло 1,92. Более того, при снижении длины CAG-повторов увеличивалась частота средних и тяжелых обструктивных симптомов нижних мочевых путей. Также была найдена обратная корреляция между частотой аденом и размером простаты, с одной стороны, и длиной CAG-повторов — с другой [11, 12]. Помимо этого, была выявлена связь полиморфизма гена AR с сексуальной активностью мужчин с ДГПЖ [13].
Фертильность
Установлена связь числа CAG-повторов в гене AR с олигозооспермией [14, 15]. Хорошо известно, что для осуществления сперматогенеза необходима стимуляция клеток Сертоли фолликулостимулирующим гормоном (ФСГ). Так, интратестикулярная активность андрогенов опосредуется важным кофактором, положительно влияющим на функцию клеток Сертоли. Установлена отрицательная связь числа CAG-повторов с эффективностью сперматогенеза [16]. Наиболее тяжелые формы нарушений сперматогенеза наблюдаются у пациентов со спинобульбарной атрофией Кеннеди — редким наследственным заболеванием, характеризующимся яркой неврологической симптоматикой в сочетании с гипогонадизмом и бесплодием. При этом число тринуклеотидных повторов в гене AR достигает 36 и более [17].
Клинические проявления гипогонадизма и психосоциальные аспекты личности
Анализируя клинические проявления андрогенного дефицита, следует подчеркнуть их тесную связь с полиморфизмом гена AR. Так, среди пациентов с нормальными концентрациями Т у мужчин с большим числом CAG-повторов увеличен риск развития симптомов андрогенного дефицита [18, 19]. Регрессионный анализ данных международного опросника Aging Males’ Symptoms выявил нарастание симптомов дефицита Т по двум шкалам (психологической и соматической) по мере увеличения длины CAG-повторов в гене AR, тогда как симптомы сексуальной шкалы были связаны непосредственно с уровнем эндогенного Т [18]. Азиатское исследование с участием 702 мужчин, не выявив связи между уровнем Т и распределением в популяции полиморфизма гена AR, показало, что при уровне Т выше 340 нг/дл пациенты с числом CAG-повторов более 25 имели достоверно более высокий риск развития симптомов андропаузы, чем лица со значением тринуклеотидных повторов менее 22 [19]. Иными словами, мужчины с нормотестостеронемией, имеющие большую длину CAG-повторов в гене AR, подвержены более высокому риску возникновения симптомов андрогенного дефицита.
Кроме того, установлена связь между длиной CAG-повторов в гене AR с неспецифическими проявлениями андрогенного дефицита, такими как тревожность и депрессия [20, 21]. Регрессионный анализ выявил положительную связь числа CAG-повторов с выраженностью депрессии у мужчин старше 50 лет. Это демонстрирует нарастание симптомов депрессии синхронно с увеличением длины тринуклеотидных повторов по мере ослабления чувствительности рецепторов к андрогенам независимо от уровня эндогенного Т [21]. Показано также, что генетически детерминированное удлинение CAG-повторов в гене AR является независимым фактором риска высокой тревожности, панических атак и фобических расстройств [20].
Удивительными кажутся данные о связи полиморфизма гена AR с интеллектуальной одаренностью мальчиков [22]. Так, установлено, что высокий уровень интеллекта (IQ более 130) у мальчиков ассоциирован с малой длиной CAG-повторов в гене AR, даже при допубертатно низких уровнях Т. Другими словами, высокая чувствительность к андрогенам является фактором, предрасполагающим к интеллектуальной одаренности вне зависимости от уровня самого Т.
Представляют интерес данные о полиморфизме гена AR у мужчин с синдромом Клайнфельтера, имеющих дополнительную Х-хромосому, на которой и расположен обсуждаемый ген [23]. Длина тринуклеотидных повторов имела положительную связь с ростом, но в то же время была отрицательно связана с минеральной плотностью костной ткани и отношением размаха рук к росту, что отражает негативное влияние андрогенов на эпифизарные зоны роста кости. Кроме того, удлинение CAG-повторов способствовало развитию гинекомастии и уменьшению размеров тестикул, тогда как укорочение длины триплета ассоциировалось со стабильными партнерскими отношениями и профессиями, требующими более высокого уровня образования.
Поразительно, что чувствительность к андрогенам может обусловливать и такое явление, как транссексуализм. Установлено, что удлинение цепи CAG-повторов в гене AR является одной из трех изученных генетических причин мужского транссексуализма [24].
Метаболический статус
Выявлена положительная независимая корреляция числа CAG-повторов в гене AR с содержанием жировой ткани тела, уровнем лептина и инсулина. Малое число CAG-повторов было независимо ассоциировано с протективными параметрами (низкая жировая масса, низкий уровень инсулина плазмы), но одновременно и с нежелательными факторами (низкий уровень липопротеинов высокой плотности) [25]. Сходные данные в отношении дислипидемии были получены и в исследовании больных сахарным диабетом 2-го типа [26].
Еще одним интереснейшим аспектом влияния полиморфизма гена AR является эффективность заместительной терапии тестостероном (ЗТТ) у пациентов с различными формами гипогонадизма. Крупное исследование TIMES 2 показало, что высокая чувствительность к андрогенам, моделируемая малым числом CAG-повторов в гене AR, независимо положительно связана с более значимой динамикой уровня инсулина натощак, триглицеридов, диастолического артериального давления и индекса инсулинорезистентности НОМА на фоне ЗТТ. Однако связи полиморфизма гена AR с уровнем гликированного гемоглобина, другими показателями липидограммы, ожирением или распределением жировой ткани не выявлено [10]. Негативное влияние удлинения CAG-повторов было обнаружено и в другом исследовании [27], показавшем более высокие цифры артериального давления и худшие значения липидограммы на фоне ЗТТ в сочетании с более низкими значениями гематокрита, находящегося под контролем андрогенов. Еще одним параметром, реагирующим на ЗТТ, является размер ПЖ [28]. Выявлена негативная связь между длиной тринуклеотидных повторов и изменением объема ПЖ на фоне терапии Т [10]. Причем 20 триплетов гена AR и менее повышают риск увеличения размеров ПЖ и темпы роста уровня простат-специфического антигена (ПСА) [27].
Терапия Т у пациентов с синдромом Клайнфельтера при коротких триплетных повторах вызывает более глубокое подавление уровня ЛГ, выраженный рост концентрации ПСА и повышает уровень гемоглобина [23].
Эндотелий
Одной из важнейших точек приложения внегонадного действия Т является эндотелий, причем данное взаимодействие моделируется полиморфизмом гена AR. Этот вопрос наименее изучен. Ранее у здоровых добровольцев была обнаружена связь низкого числа CAG-повторов в гене AR с нарушениями артериальной вазореактивности вне зависимости от уровня общего и свободного T [29]. Некоторыми исследованиями [30, 31] доказано ухудшение функции эндотелия у больных сахарным диабетом 2-го типа. В то же время существуют данные о негативном влиянии дефицита Т на сердечно-сосудистую систему у мужчин [32, 33]. При исследовании влияния полиморфизма гена AR на формирование нарушений функции эндотелия у мужчин с сахарным диабетом 2-го типа [34] было установлено, что большее количество CAG-повторов в гене рецептора AR через ослабление чувствительности к андрогенам обусловливает снижение выраженности эндотелий-зависимой вазодилатации в ходе пробы с реактивной гиперемией одновременно с усилением продукции таких маркеров дисфункции эндотелия, как P-селектин и резистин. Таким образом, увеличение числа CAG-повторов в гене AR ухудшает как сосудодвигательную, так и секреторную функцию эндотелия и может рассматриваться как предиктор развития и прогрессирования сердечно-сосудистых поражений у мужчин с сахарным диабетом.
Заключение
Нарастающий интерес исследователей к изучению биохимических и молекулярных механизмов действия Т диктует необходимость расшифровки генетических аспектов функционирования AR. Изучение чувствительности к андрогенам, определяемой длиной тринуклеотидного повтора CAG в гене AR, не только объясняет феномен различного ответа на ЗТТ у пациентов с одинаковым уровнем эндогенного Т, но и необходимо для понимания половой дифференцировки, психологического статуса, сексуальности и репродуктивного потенциала, а также рисков развития рака ПЖ и ДГПЖ, остеопороза, нарушений углеводного, липидного обменов и даже сердечно-сосудистых заболеваний у мужчин. Наиболее важной в клинической практике является возможность прогнозирования ответа пациента на ЗТТ. У лиц с малым числом CAG-повторов в гене AR из-за высокой чувствительности к андрогенам могут быть использованы более низкие дозы препаратов Т, тогда как неэффективность стартовой дозы ТЗТ у мужчин с большим числом тринуклеотидных повторов, свидетельствует о необходимости повышения дозы вводимого Т. На сегодняшний день определение CAG-полиморфизма гена AR не рекомендовано для рутинной практики, однако в ближайшем будущем оно может быть использовано, в частности для подбора индивидуальной терапии андрогенного дефицита.
Дополнительная информация
Источник финансирования. Работа выполнена при поддержке Российского научного фонда (грант РНФ № 14−25−00052).
Конфликт интересов. Авторы статьи заявляют об отсутствии финансовой заинтересованности и других потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов:
Сбор и анализ материала, написание текста — Хрипун И.А.; написание и редактирование текста — Воробьев С.В. Оба автора внесли существенный вклад в проведение поисково-аналитической работы и подготовки статьи, прочли и одобрили финальную версию текста перед публикацией.
Изучение обмена андрогенов в простате. Обмен тестостерона у млекопитающих
Андрогены - синтез, метаболизм. Андрогеновые рецепторы
Клетки theca яичников секретируют множество андрогенов (19-углеродных стероидов), в том числе андростендион, тестостерон и ДГЭА. Андростендион — основной из них. В клетках theca содержится фермент 17р-гидроксистероиддегидрогеназа, превращающий андростендион в тестостерон. У женщин в пременопаузе по меньшей мере 60% циркулирующего тестостерона происходит из яичников за счет такого превращения или непосредственной секреции.
Андростендион и тестостерон могут превращаться в гранулезных клетках под воздействием ФСГ в эстрогены путем ароматизации. В периферических тканях андростендион может превращаться в эстрон или тестостерон. В отличие от тестостерона и дегидротестостерона андростендион не обладает высокой аффинностью к андрогеновым рецепторам (АР).
Расщепление боковой цепи холестерина с превращением его в прегненолон — одновременно и начальная точка, и определяющая скорость стадия стероидогенеза. В яичнике расщепление боковой цепи холестерина контролируется ЛГ. Главным источником холестерина для стероидогенеза в яичнике человека служат липопротеины низкой плотности. Увеличение образования цАМФ вследствие активации аденилатциклазы ЛГ стимулирует транскрипцию мРНК рецептора липопротеинов низкой плотности и соответственно повышает их захват.
После этого цАМФ-активируемый стероидогенный активный регуляторный протеин обеспечивает увеличение внутриклеточного транспорта холестерина к внутренней мембране митохондрий, где и происходит расщепление его боковой цепи.
В преовуляторном фолликуле предпочтительный путь синтеза андрогенов/эстрогенов — путь превращения прегненолона в 17-гидроксипрегненолон, так называемый d-путь. Клетки theca яичников способны ферментировать прегненолон в андрогены, но не могут превращать андростендион или тестостерон в эстрогены путем ароматизации. Этот процесс может происходить только в гранулезных клетках под действием ФСГ. В отличие от преовуляторных фолликулов в желтом теле стероидогеиез идет преимущественно по d-пути с первоначальным превращением прегненолона в прогестерон.
Андрогеновые рецепторы по строению сходен с эстрогеновым. Он активирует экспрессию гена-мишени через ту же последовательность связывания лиганда, ядерной транслокации, связывания с ДНК и комплексообразования с корегуляторами и факторами транскрипции гена. Известна ключевая роль андрогенных рецепторов в развитии мужских половых органов и вторичных половых признаков, однако их физиологическое значение для женской репродуктивной системы остается неясным. Недавние исследования на животных с андрогенной недостаточностью позволяют предположить важную роль андрогенов в созревании гранулезных клеток.
У этих животных также были отмечены снижение фертильности с нарушениями фолликулогенеза, патология созревания желтого тела и снижение чувствительности матки к гонадотропинам.
Обмен андрогенов
Андростендион в равных количествах синтезируется яичниками и надпочечниками. Его сывороточные концентрации повторяют таковые эстрадиола, колеблясь в диапазоне от 0,5 до 3 нг/мл. Содержание андростендиона повышается в период от средней до поздней фолликулиновой фазы, достигая максимума непосредственно перед пиком ЛГ. Во время овуляции оно снижается, вновь затем повышаясь до пиковой концентрации в среднюю лютеиновую фазу и падая до минимальной ко времени начала менструации.
В противоположность этому концентрация тестостерона в течение менструального цикла изменяется мало, лишь слегка повышаясь во время овуляции. Концентрация тестостерона в сыворотке крови колеблется в диапазоне 1,5-60 нг/дл.
Обмен андрогенов в предстательной железе собак изучен в эксперименте in vitro (Gloyna и Wilson, 1969; Gloyna и соавт., 1970; Griffiths и соавт., 1970; Groom и соавт., 1971; Harper и соавт., 1971). Giorgi и соавторы (1976) пришли к выводу, что в основном связывание и метаболизм андрогенов в предстательной железе собаки протекают таким же образом, как и в предстательной железе человека. Согласно их данным, большая часть тестостерона, входящая в ткань, превращается в восстановленные производные.
Превращение тестостерона в 5а-ДГТ выше, чем взаимопревращение андростендиона и тестостерона. Об этом свидетельствует исследование Morfin (1970), который после введения физиологических доз меченого тестостерона в концевой отдел аорты или в среднюю крестцовую артерию обнаружил в венозной крови, оттекающей от предстательной железы, 1—5 % меченого вещества — 5а-восстановленных соединений (ДГТ и 5а-андростандиолы).
Haltmeyer и Eik—Nes (1972) у половозрелых собак выделяли предстательную железу с сосудами и перфузировали с артериальной донорской кровью Н3-тестостерон. В оттекающей венозной крови аорты наблюдали увеличение содержания ДГТ и других 5а-редуцированных метаболитов.
Представление об аналогичном обмене андрогенов у собаки и человека не подтвердилось данными Evans, Pierropoint (1976) и Jacobi, Wilson (1976). Авторы показали, что у собак основным активным метаболитом в предстательной железе является не ДГТ, а 5-а-андростан-3а,17Р-диол. Sinowatz и Pierropoint (1977) пришли к выводу, что только в присутствии 5а-андро-стан-3а,17Р-диола были в пределах нормы высота эпителия и секреторная активность при минимальном развитии элементов стромы.
Другие же эпимеры-андростандиола не обладали аналогичным действием. Именно 3а-андростандиол (а не ДГТ) стимулировал рост предстательной железы у собак (Jacobi и соавт., 1978), поскольку он является более сильным андрогеном в отношении стимуляции роста придаточных половых органов (Vergans и соавт., 1977).
Jacobi и Wilson (1979) инкубировали гомогенаты предстательной железы человека, собаки, кошки, гвинейской свинки, кролика, опоссума, крысы, мыши в среде, содержащей ДГТ и НАД-H2 либо НАДФ-Н2, и изучали образование 5а-андростандиолов. Гомогенаты предстательной железы человека, собаки, крысы, мыши и опоссума в основном вырабатывали 3а-андростандиол, а гомогены предстательной железы кошки, кролика и гвинейской свинки— в основном 3бета-андростандиол.
Эти данные подтверждают точку зрения об аналогии метаболизма андрогенов в предстательной железе у собаки и человека, но ставят под сомнение факт преимущественного образования 3бета-андростандиола в предстательной железе человека.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Метаболизм гормонов в простате. Обмен тестостерона в предстательной железе
5а-редуктаза является ключевым ферментом в процессе превращения тестостерона в клетках предстательной железы. Способность различных стероидов вызывать рост предстательной железы зависит от их способности усиливать 5а-редуктазную активность. Тестостерон у кастрированных крыс восстанавливает активность 5а-редуктазы (Jamanaka и соавт., 1975; Johnsonbaugt и соавт., 1976), эпитестостерон, 20а-гидрокси-5-он-3-он и прогестерон не повышают ферментативную активность, а эстрогены у интактных животных уменьшают ее (Leav и соавт., 1971).
5а-редуктаза обнаруживается в значительных количествах в цитоплазме и ядрах предстательных клеток. Активация энзима заканчивается к периоду полового созревания. Реакция 5а-восстановления тестостерона ускоряется при добавлении НАД-Н (Hussein и Kochakian, 1968; Morfin, 1970; Ellis, 1972; Shida и соавт., 1972). В отсутствие этого кофермента увеличивается уровень 11-гидроксилированных стероидов и снижается образование 5а-восстановленных метаболитов, в том числе и ДГТ (Milewich и Axelrod, 1972).
Обнаружение радиоактивной метки в цитоплазме и ядрах предстательных клеток, ассоциированной с ДГТ либо с 5а-андростандиолами, свидетельствует о наличии специфических рецепторов для этих метаболитов. Впервые о связывании ДГТ в ядрах предстательной железы сообщили Anderson и LiacT (1968), Bruchovsky и Wilson (1968), Mainwaring (1969). Существует высокая специфичность ядерного связывания по отношению к ДГТ. Глюкокортикоиды, минералокортикоиды и 5Р-ДГТ не являются конкурентами 5а-ДГТ (Mangan и Mainwaring, 1972), тогда как андростендион и прогестерон в известной мере являются таковыми. Эстрогены (стильбэстрол и 17р-эстрадиол) оказались относительно слабыми конкурентами и вытесняли 5а-ДГТ только в том случае, если содержались в избытке (Fang, 1969). Механизм связывания ДГТ обеспечивает удержание этого активного метаболита в ядрах в течение 12—16 ч (Tveter и Attramadal, 1968; Mainwaring и Peterken, 1971).
В настоящее время установлены основные физико-химические характеристики для ядерных и цитоплазматических рецепторов, связывающих андрогены в предстательной железе.
Wilson и Gloyna (1970) сформулировали представление о пути превращения тестостерона в предстательной железе следующим образом: тестостерон -> ДГТ -> андростандиолы.
Описанные биохимические реакции лежат в основе морфологических и функциональных изменений предстательной железы.
Между массой предстательной железы и скоростью образования ДГТ существует зависимость (Gloyna и Wilson, 1969), однако ее не наблюдается между массой предстательной железы и экскрецией андрогенов и эстрогенов (Scoldefors и соавт., 1976).
У человека основным продуктом обмена тестостерона в предстательной железе является ДГТ (Treter и соавт., 1971; Becker и соавт., 1973). По данным Ito и Horton (1971), 70% циркулирующего в крови тестостерона превращается в ДГТ. Продуктами метаболизма андрогенов (преимущественно тестостерона и андростендиона) являются также 5а-андростан-3а,17Р-диол и 5а-андростан-ЗР, 17Р-диол.
Основным местом трансформации андрогенов в 5а-редуцированные метаболиты у человека является предстательная железа. В норме концентрация ДГТ в предстательной железе составляет в среднем (0,13±0,05) мкг/100 г (Siiteri и Wilson, 1971). Harper и соавторы (1974) изучали обмен андрогенов в предстательной железе человека. При инфузии тестостерона увеличивался уровень ДГТ как основного метаболита тестостерона в предстательной железе. После инфузии андростендиона в предстательной железе обнаруживался эпиандростерон и андростерон, после инфузии ДГЭА—ДГЭА. Характерно, что в предстательной железе человека ДГЭА не превращается в тестостерон, лишь 0,7 % его превращается в андростендион (Collins и соавт., 1970).
Представляет интерес и тот факт, что предстательная железа человека способна расщеплять сульфат тестостерона и глюкуронид тестостерона и восстанавливать конъюгированный тестостерон также в 5а-метаболиты (Collins и соавт, 1970).
ДГТ проникает в ядра предстательных клеток и связывается с ядерным хроматином. Под влиянием ДГТ в предстательной железе человека значительно увеличивается содержание ДНК (Ghanadian и соавт., 1975).
Научная электронная библиотека

Среди половых гормонов ключевая роль в регуляции мужской половой функции принадлежит андрогенам. В свою очередь, из андрогенов наиболее активен тестостерон. Другие мужские половые гормоны – андростендион, андростерон в 6–10 раз менее активны а дегидроэпиандростерон и эпитетостерон – в 25–50 раз.
Физиологическое действие андрогенов выражено в двух критических периодах – эмбриональном и пубертатном. Именно в этих периодах отчетливо выявляется их морфогенетическое и активационное воздействие. Морфогенетическое воздействие андрогенов начинается еще в эмбриональном периоде: семенники зародыша мужского пола очень рано (к 12-й неделе) продуцируют андрогены, которые и определяют развитие плода цо мужскому типу. С окончанием эмбрионального формирования как внутренних, так и наружных гениталий (к 32-й неделе) морфообразующая роль половых стероидов редуцируется и остается на таком уровнё до пубертатного периода.
Источником образования стероидных гормонов является холестерин. В результате окисления данного соединения образуются женские и мужские половые гормоны. Предшественником андрогенов является женский половой гормон – прогестерон, а образование эстрогенов в организме происходит в основном из андрогенов. Таким образом, биосинтез половых стероидов, как мужских (андрогенов), так и женских (прогестинов и эстрогенов), является единым взаимосвязанным процессом. У мужчин преобладают андрогены, а у женщин прогестерон и эстрогены.
Регуляция секреции андрогенов в организме связана с двумя системами: гипофиз – половые железы и гипофиз – кора надпочечников, поскольку источниками секреции андрогенов являются половые железы и кора надпочечников. Исследованиями М.В. Корякина и соавт. (1998) показано, что вышеуказанные системы не имеют единого механизма регуляции.
В организме существует многокомпонентная система белков – переносчиков стероидных гормонов к органам-мишеням. В свободной, несвязанной с какими-либо носителями форме, в крови циркулируют лишь 2–3 % от общего количества стероидов, и, согласно довольно распространенному мнению, именно они определяют биологические эффекты гормонов. Основную роль в комплексировании гормонов выполняет тестостерон-эстрадиолсвязывающий глобулин (ТЭСГ). Он с высоким сродством связывает дигидротестостерон и тестостерон и с более низким – эстрадиол. Синтез осуществляется в печени и регулируется эстрогенами (индукторы) и андрогенами (супрессоры). В этой связи ТЭСГ играет первостепенную роль в регуляции уровня половых гормонов, особенно их свободных фракций. В отношении половых гормонов этот белок выполняет транспортную, регулирующую и защитную от деградации и выведения из организма функции. Некоторое количество андрогенов взаимодействует с сывороточным альбумином, который преимущественно участвует только в транспорте гормонов, ввиду низкого сродства.
Характерной особенностью большинства органов-мишеней андрогенов является способность осуществлять превращение тестостерона в более активное производное – 5а-дигидротестостерон (5а-ДГТ). Превращение тестостерона в дигидротестостерон обеспечивается 5а-редуктазой, активность которой особенно велика в простате и эпидермисе и практически отсутствует в семенниках и мышечной ткани у млекопитающих. Активность 5а-редуктазы в строме предстательной железы выше на 150 %, чем з эпителии (К. Voigt и W. Bartsch, 1985). Экспериментальные и клинические данные свидетельствуют о наличии стимулирующего влияния тестикулярных андрогенов на морфологическое развитие и функцию предстательной железы. Внутри клеток предстательной железы андрогенные эффекты тестостерона опосредуются его метаболитом – 5а-ДГТ, который связывается со специфическим рецептором на эпителиальных железистых клетках предстательной железы. Предполагается, что образование дигидротестостерона в простате является одним из важных механизмов, регулирующих ее рост. Получены данные о значении эстрадиола для нормальной функции железы, в частности, обнаружены рецепторы этого гормона в простате.
Не всегда 5а-ДГТ принимает участие в формировании андрогенного ответа. Многие виды биологического ответа могут быть вызваны только самим тестостероном и его метаболитами, кроме 5а-ДГТ (У. Мейнуо-ринг, 1979). В отличие от ядер клеток добавочных половых желез, преобладающим рецептируемым андрогеном является 5а-дигидротестостерон (5а-ДГТ), ядра других андрогенчувствительных тканей связывают в равной мере тестостерон и его 5а-воссгановленный метаболит (гипоталамус, гипофиз, семенник) или только тестостерон (почки, мышечная, костная и другие ткани). J. Minguell и W. Sieralta (1975) выделили три основных типа тканей’: с высокий уровнем 5 редуктазной активности, при которой более 50 % тестостерона превращается в 5а-дигидротсстостерон (добавочные половые железы и йркцатки семенников), со средним уровнем – 5–50 % тестостерона метабозируётся в 5а-ДГТ (мозг, аденогипофиз, почки, кожа . Гидротестостерон и 3а-диол (после обратного превращения в 5 а-дигид- ротестостерон) регулируют деление клеток и поддерживают их величину, в то время как эстрадиол обеспечивает регуляцию функциональной активности клеток, то есть управляет процессами секреции. Второй путь метаболизма тестостерона сводится к его ароматизации с образованием эстрадиола. Это весьма важная реакция для клеток ЦНС, принимающих участие в гормональной регуляции полового поведения, и их дифференцировки (Дж. Теппермен и X. Теппермен, 1989). У мужчин небольшое количество эстрадиола секретируется клетками Сертоли, но 87 % образуется за счет периферической ароматизации андрогенов, происходящей преимущественно в жировой ткани. Угнетение ароматизации стимулирует секрецию лютеинизируюицего гормона и тестостерона. Отмечается, что ароматизация андрогенов в эстрогены играет важную роль в регуляции секреции ЛГ по принципу отрицательной обратной связи и поддержании нормального уровня тестостерона у взрослых самцов приматов. Уровень эстрогенов у мужчин составляет от 2 до 30 %, а уровень прогестерона – от 6 до 100 % от уровня у женщин (в зависимости от стадии менструального цикла). По третьему пути тестостерон модифицируется 5p-редуктазой, превращающей его в 5Р-ДГТ и другие 5 [3-редуцированные стероиды], такие как этихолонолон. Последние не обладают андрогенным действием на мужскую репродуктивную систему, но стимулируют образование эритроцитов в красном костном мозге. Так же андрогены метаболизируются в основном в печени в относительно неактивные сульфаты и глюкурониды стероидов. Физиологическое значение функционального метаболизма тестостерона заключается в усилении или качественной модификации гормонального сигнала.
Читайте также:
- Вегетативные расстройства при повреждении нервов кисти
- Лучевая терапия аденокарциномы яичника по стадиям
- Инфекционные осложнения послеоперационного периода. Оксигенотерапия в послеоперационном периоде
- Диагностика плодов паразитов. Дифференциация плодов в плоде
- Плечеголовной ствол. Топография плечеголовного ствола. Левая общая сонная артерия. Левая подключичная артерия.
