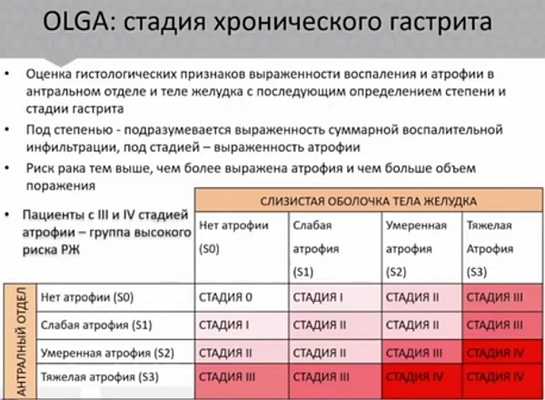
Классификация хронического гастрита в таблице
Добавил пользователь Morpheus Обновлено: 22.01.2026
Эволюция взаимоотношений инфекции Helicobacter pylori (НР) и человечества насчитывает не одно тысячелетие [1]. За этот период сформировались механизмы взаимодействия инфекта и хозяина [2], позволяющие бактерии модулировать уровень кислотной продукции, под
Эволюция взаимоотношений инфекции Helicobacter pylori (НР) и человечества насчитывает не одно тысячелетие [1]. За этот период сформировались механизмы взаимодействия инфекта и хозяина [2], позволяющие бактерии модулировать уровень кислотной продукции, поддерживая воспаление слизистой оболочки желудка. Насколько важно для клинициста правильно интерпретировать данные о воспалении в слизистой оболочке желудка, ассоциированном с НР? С одной стороны, наличие и выраженность воспалительного инфильтрата не определяет наличие у больного клинических симптомов диспепсии, возникающих вследствие нарушений желудочной секреции, гастродуоденальной моторики, висцеральной чувствительности, нередко обусловленных нервно-психическими факторами. Неслучайно поэтому ни одна из трех современных классификаций хронического гастрита («Сиднейская», 1990; «Хьюстонская», 1994; классификация OLGA, 2008) не содержит раздела, касающегося оценки клинических проявлений. Почему же тогда внимание клинициста сосредоточено на данных заключения патолога? Почему в процессе создания классификации хронического гастрита стало необходимым участие клиницистов? Ответ кроется в целевых установках классификационной системы — оценить состояние слизистой оболочки, дать характеристику воспалительного процесса для прогноза, на основе стандартизированного подхода дать возможность клиницисту персонифицировать программу наблюдения больного хроническим гастритом [3].
Сегодня можно с уверенностью сказать, что НР как один из представителей «медленных» инфекций — не новая угроза и не старый друг, и эрадикация бактерии рассматривается как фрагмент протокола лечения пациентов с НР-ассоциированной патологией [4, 5]. Однако специфическое хроническое воспаление слизистой оболочки желудка не исчезает вместе с элиминацией возбудителя [6].
Персистенция воспалительного инфильтрата в условиях элиминации инфекта не просто биологический феномен. Сохранение воспаления означает и сохранение риска повреждения слизистой оболочки желудка, что имеет практическое значение. Так, инфильтрация слизистой оболочки нейтрофильными лейкоцитами сопровождается выработкой активных форм кислорода («оксидативный стресс»), что приводит к прямому и опосредованному через цитокины повреждению эпителия слизистой и служит фактором риска образования язв и эрозий. С другой стороны, длительное воздействие активных форм кислорода приводит к необратимым повреждениям ДНК, которые накапливаются с течением времени и создают «стартовую площадку» для развития рака желудка. В норме нейтрофильная инфильтрация исчезает спустя лишь 1 месяц после успешной эрадикации хеликобактерной инфекции. Несколько позднее, путем активации апоптоза, уменьшается количество лимфоцитов и плазматических клеток. Последними подвергаются редукции лимфоидные фолликулы собственной пластинки: железы, раздвинутые воспалительным инфильтратом, занимают прежнее место, исчезает феномен «неопределенной атрофии». Эти процессы, развиваясь асинхронно, отличаются и разной скоростью редукции воспаления.
В проспективном когортном исследовании с включением 181 больного НР-ассоциированным гастритом, с синдромом диспепсии, период наблюдения с клинико-биопсийным контролем в динамике составил 1 год [7]. Уже через месяц после эрадикации НР было отмечено снижение прежде всего активности гастрита при более сдержанных темпах редукции мононуклеарной воспалительной инфильтрации. Выявлено, что выраженность признаков хронического воспаления в слизистой оболочке желудка уменьшалась медленнее у больных атрофическим гастритом, что согласуется с данными и других исследователей. В дальнейшем, наряду с регрессом воспалительного инфильтрата, происходило достоверное снижение индекса пролиферации и индекса апоптоза в эпителиоцитах слизистой оболочки желудка. С клинических позиций элиминация инфекта, способствуя нормализации темпов клеточного обновления, позволяет остановить прогрессирование предраковых изменений слизистой оболочки желудка, является мерой профилактики рака желудка.
Характерным для годичного постэрадикационного периода было «исчезновение» феномена неопределенной атрофии, что было связано с уменьшением плотности воспалительной инфильтрации и уходом пациентов в рубрику с истинной атрофией или без таковой. Вероятно, результаты ряда исследований, в которых у части пациентов обнаружено исчезновение атрофии слизистой оболочки желудка в течение 1–2 лет после эрадикации инфекта, обусловлены именно тем обстоятельством, что из наблюдения не были исключены пациенты с феноменом неопределенной атрофии. Вместе с тем имеются и данные исследований с более длительным периодом наблюдения (более 7–10 лет), обнадеживающие в отношении некоторой регрессии степени атрофии слизистой оболочки желудка при элиминации НР.
Анализ результатов гистологического исследования гастробиоптатов через 1 год от эрадикации инфекта позволил выявить три группы больных:
- восстановление структуры слизистой оболочки желудка (полная редукция воспалительных изменений слизистой оболочки желудка, содержание межэпителиальных лимфоцитов (1–5 на 100 эпителиоцитов) соответствует норме) отмечено у 24 (13,2%) пролеченных;
- частичный регресс воспалительных изменений при гистологическом исследовании гастробиоптатов выявлен у 106 (58,6%) больных;
- сохранение выраженности воспалительных изменений в слизистой оболочке желудка и спустя 1 год после элиминации возбудителя зафиксировано у 51 (28,2%) пациента.
Рис. 1. Персистенция мононуклеарного воспалительного инфильтрата впостэрадикационном периоде – фактор, определяющий темпы клеточного обновления эпителиоцитов слизистой оболочки желудка
Следует признать, что течение постэрадикационного периода хронического гастрита гетерогенно и определяется особенностями межклеточных взаимодействий воспалительного инфильтрата и эпителия слизистой оболочки желудка, сложившимися еще на этапе формирования системы «инфект–хозяин».
Успешно проведенная антихеликобактерная терапия приводит к патоморфозу хронического НР-ассоциированного гастрита, что требует указания факта эрадикации возбудителя при формулировке диагноза. Такая стратегия не вступает в противоречие с общепринятой МКБ-10, но позволяет расширить представление об НР-ассоциированном хроническом гастрите.
Безусловно, проведение эрадикации несет в себе потенциал нормализации клеточного обновления, что, собственно, и является мерой канцерпревенции. Вместе с тем сохраняющаяся определенное время воспалительная инфильтрация слизистой оболочки желудка ассоциирована с возможностью повреждения клеток [9], в том числе и за счет повышенной активности ферментов перекисного окисления липидов — циклооксигеназы-2 (COX-2) и индуцибельной синтазы окиси азота (INOS) — белков, участвующих в канцерогенезе в течение года после состоявшейся эрадикации [10].
Таким образом, для пациентов с экс-хеликобактерным гастритом необходимо в программу курации включать курсы муко/цитопротективной терапии, позволяющей защитить клетки слизистой оболочки желудка от повреждающего действия продуктов воспаления с целью профилактики прогрессирования гастрита [11].
Группа муко/цитопротекторов сегодня включает несколько лекарственных средств (табл.), среди которых следует отдельно выделить терапевтические возможности висмута трикалия дицитрата (Де-Нола). В многочисленных исследованиях показано, что висмута трикалия дицитрат образует защитный слой на пораженных участках слизистой оболочки, предохраняя ее от воздействия агрессивных факторов, стимулирует секрецию слизи и гидрокарбоната, ингибирует активность пепсина, предохраняет эпителиальные факторы роста от распада, способствуя регенерации клеток эпителия, улучшает микроциркуляцию, стимулирует секрецию гастрозащитных простагландинов.
Накопленный в течение десятилетий опыт проведения эрадикационной терапии и последующего наблюдения больных с различными стадиями гастрита в постэрадикационном периоде позволил выявить еще одну проблему. В условиях уже сформировавшейся атрофии слизистой оболочки желудка элиминация инфекта не позволяет решить проблему контаминации слизистой оболочки желудка не-НР микроорганизмами [12], в том числе Helicobacter spp. [13], Proteus mirabilis, Citrobacter freundii, Klebsiella pneumoniae, Enterobacter cloacae, Staphylococcus aureus, с дополнительным стимулом к персистенции воспалительного инфильтрата, активизации процессов перекисного окисления липидов и выработкой бактериями нитрозаминов, несущих проканцерогенный потенциал [14]. Аналогичная картина может сформироваться и при естественном течении гастрита, известном клиницисту в качестве «каскада P. Correa» (рис. 2).
Рис. 2. Каскад P. Correa (цит. по [15])
Как быть в этой ситуации клиницисту? Выбрать лишь наблюдательную тактику? Проводить повторные курсы антибактериальной терапии? Вероятно, проведение крупных перспективных мультицентровых исследований позволит в дальнейшем найти ответ и на этот вопрос, определить целесообразность, компоненты и сроки такой терапии, но каковы наши возможности уже сейчас? Мы полагаем, что в такой ситуации клиницисту следует рассмотреть включение в программу курации пациента наряду с клинико-биопсийным контролем и проведение курсов терапии препаратами висмута. Во-первых, не являясь антибиотиком, висмута трикалия дицитрат подавляет активность бактериальной флоры без риска формирования резистентности, что успешно применяется уже в течение многих лет в стандартной эрадикационной терапии. Во-вторых, в условиях персистенции воспаления становятся необходимыми свойства Де-Нола, влияющие на активность воспалительного процесса, а именно снижение содержания провоспалительных цитокинов и наличие антиоксидантного эффекта. Следует отметить, что эти свойства препарата успешно используются и при лечении других заболеваний, в т. ч. и кишечника. В-третьих, пациенты с атрофическим гастритом особенно нуждаются в мукоцитопротекторной терапии с повышением продукции слизи, простагландинов, улучшением микроциркуляции в слизистой оболочке желудка.
Таким образом, анализ данных литературы и результаты собственных исследований позволяют говорить о персистенции воспалительного инфильтрата после элиминации НР, при этом течение гастрита в постэрадикационном периоде определяется прежде всего сформировавшимся воспалением еще на этапе инфицирования хозяина НР. Сохранение воспалительного инфильтрата требует активной курации пациента для максимально полной и быстрой редукции изменений слизистой оболочки желудка и предотвращения прогрессирования гастрита. Для эффективной и безопасной терапии больных в постэрадикационном периоде следует рассматривать в качестве препаратов выбора, особенно при атрофии слизистой оболочки желудка и высокой степени гастрита, препараты висмута (Де-Нол).
Литература
- Amieva M. R. Host-bacterial interactions in Helicobacter pylori infection/M. R. Amieva, E.M. El-Omar // Gastroenterology. 2008. Vol. 134, № 1. P. 306–323.
- Ricci V., Romano M., Boquet P. Molecular cross-talk between Helicobacter pylori and human gastric mucosa. World J Gastroenterol 2011; 17 (11): 1383–1399.
- Dai Y. C., Tang Z. P., Zhang Y. L. How to assess the severity of atrophic gastritis. World J Gastroenterol 2011; 17 (13): 1690–1693.
- Malfertheiner P. Guidelines for the Management of Helicobacter pylori Infection Summary of the Maastricht-3 2005 Consensus Report / P. Malfertheiner, F. Megraud, C. O’Morain // Вusiness briefing: Еuropean gastroenterology review. 2005. Р. 59–60.
- Осипенко, М. Ф. Программа для участковых терапевтов «эффективная эрадикация» / М. Ф. Осипенко и др. // Гастроэнтерология Санкт-Петербурга. 2008. № 2–3. С. М91.
- Кононов А. В. Воспаление как основа Helicobacter pylori-ассоциированных болезней: от гастрита — до рака желудка / А. В. Кононов // Труды II съезда Российского общества патологоанатомов. М., 2006. С. 229–231.
- Ливзан М. А. Течение хронического гастрита, ассоциированного с Helicobacter pylori в постэрадикационном периоде / М. А. Ливзан, А. В. Кононов, С. И. Мозговой // Экспериментальная и клиническая фармакология. 2007. № 5. С. 116–123.
- Expression of HLA-DR, costimulatory molecules B7–1, B7–2, intercellular adhesion molecule-1 (ICAM-1) and Fas ligand (FasL) on gastric epithelial cells in Helicobacter pylori gastritis; influence of H. pylori eradication / A. Archimandritis [et al.] // Clin. Exp. Immunol. 2000. Vol. 119. P. 464–471.
- Yoshimura T., Shimoyama T., Tanaka M., Sasaki Y., Fukuda S., Munakata A. Gastric mucosal inflammation and epithelial cell turnover are associated with gastric cancer in patients with Helicobacter pylori infection. J Clin Pathol 2000; 53: 532–536.
- Sung Soo Kim, Young Jick Sung, Min Kyoung Park et al. The Change of Cyclooxygenase-2 and Inducible Nitric Oxide Synthase in the Gastric Mucosa One Year after Eradication of Helicobacter pylori Korean J Gastroenterol 2008; 52: 286–292.
- Tulassay Z., Herszenyi L. Gastric mucosal defense and cytoprotection. Best Pract Res Clin Gastroenterol. 2010 Apr; 24 (2): 99–108.
- Takako Osaki, Katsuhiro Mabe, Tomoko Hanawa and Shigeru Kamiya. Urease-positive bacteria in the stomach induce a false-positive reaction in a urea breath test for diagnosis of Helicobacter pylori infection Journal of Medical Microbiology (2008), 57, 814–819.
- Cinthia G. Goldman and Hazel M. Mitchell. Helicobacter spp. other than Helicobacter pylori 2010 Blackwell Publishing Ltd, Helicobacter 15 (Suppl. 1): 69–75.
- Correa P. A human model of gastric carcinogenesis. Cancer Res 1988; 48: 3554–3560.
- Correa P. Chronic gastritis as a cancer precursor. Scand J Gastroenterol Suppl. 1984; 104: 131–6.
М. А. Ливзан, доктор медицинских наук
С. И. Мозговой, доктор медицинских наук
А. В. Кононов, доктор медицинских наук, профессор
ГОУ ВПО «Омская государственная медицинская академия Минздравсоцразвития России», Омск
Хронический гастрит
Поражение СОЖ протекает с её структурной перестройкой и нарушением секреторной (кислото- и пепсинообразующей), моторной и инкреторной (синтез гастроинтестинальных гормонов) функций желудка.
Воспаление слизистой желудка при гастрите
Эти два заболевания не противоречат друг другу и на практике почти всегда сочетаются у одного и того же больного.
Классификация хронических гастритов
Существует три основных классификации ХГ.
- гастрит типа А (аутоиммунный), характеризующийся и преимущественным поражением тела желудка;
- гастрит типа В, развивающийся в результате инфицирования СОЖ бактерией Helicobacter pylori (Нр) и бактериального воспаления преимущественно антрального отдела желудка;
- гастрит типа С (химико-токсический), который развивается в результате заброса желчи в желудок из двенадцатиперстной кишки, так называемого дуодено-гастрального рефлюкса (ДГР), или воздействия на СОЖ некоторых лекарственных средств, в первую очередь нестероидных противовоспалительных средств (НПВС).
Преимущественная локализация различных форм хронического гастрита (слева направо): антральный гастрит; гастрит тела желудка; мультифокальный гастрит (пангастрит)
Таблица 1. Сиднейская классификация гастритов
| Тип гастрита | Локализация поражения | Морфологические изменения | Этиологические факторы |
| Острый |
- реактивный;
- лимфоцитарный;
- эозинофильный;
- гипертрофический;
- гранулематозный;
- другие.
Пангастрит (гастрит антрального отдела и тела желудка)
Атрофия желудочных желез
- аутоиммунные;
- алкогольный;
- постгастроре-зекционный;
- обусловленный приёмом НПВС;
- обусловленный химическими агентами.
- эриматозный/экссудативный гастрит (поверхностный гастрит);
- плоские эрозии;
- приподнятые эрозии;
- геморрагический гастрит;
- гиперпластический гастрит;
- гастрит, сопровождающийся ДГР (рефлюкс-гастрит).
В 1996 г. была предложена Хьюстонская классификация ХГ, являющаяся модификацией Сиднейской системы (табл. 2).
Таблица 2. Хьюстонская классификация хронических гастритов
| Тип гастрита | Этиологические факторы | Синонимы (прежние классификации) |
| Неатрофический | Helicobacter pylori |
Рабочая классификация хронических гастритов
- Неатрофический (поверхностный) гастрит.
- Атрофический гастрит (аутоиммунный атрофический и мультифокальный атрофический).
- Особые формы гастритов (реактивный, радиационный, лимфоцитарный, гранулематозный, эозинофильный, гигантский гипертрофический и др.).
- Антральный отдел желудка.
- Тело желудка.
- Пангастрит.
- Инфекционные факторы (Нр, другие бактерии, кроме Нр, грибы, паразиты).
- Неинфекционные факторы (аутоиммунные, алкогольный, постгастро-резекционный, воздействие желчи вследствие дуодено-гастральных рефлюксов, воздействие нестероидных противовоспалительных препаратов, воздействие химических агентов, воздействие радиации, нарушение питания, пищевая аллергия и др.).
- Неизвестные факторы.
- Поверхностный (эриматозный/экссудативный) гастрит.
- Эрозии.
- Атрофии.
- Метаплазия эпителия.
- Геморрагии.
- Гиперплазия слизистой.
- Наличие ДГР и др.
- Степень воспаления.
- Активность воспаления.
- Наличие атрофии желудочных желез.
- Наличие и тип кишечной метаплазии.
- Степень обсеменения слизистой Нр.
- Нормальная секреция.
- Повышенная секреция.
- Секреторная недостаточность (умеренная или выраженная).
- Фаза обострения.
- Фаза ремиссии.
- Кровотечения.
- Малигнизация.
Не удивляйтесь поэтому, что в диагнозе, который Вам установит врач, кроме слова гастрит будет ещё много терминов, уточняющих, а какой именно у Вас гастрит.
Материалы для пациентов
- .
- «Советы врачей» в разделе сайта «Пациентам»
- «Популярная гастроэнтерология» в разделе «Литература»
- «Популярная гастроэнтерология» в разделе «Видео»
Материалы для профессионалов здравоохранения, касающиеся хронического гастрита
Статьи, брошюры, руководства для врачей
Видео для врачей и студентов медицинских институтов
Статьи: К ЭНДОСКОПИЧЕСКОЙ КЛАССИФИКАЦИИ ХРОНИЧЕСКИХ ГАСТРИТОВ
К ЭНДОСКОПИЧЕСКОЙ КЛАССИФИКАЦИИ ХРОНИЧЕСКИХ ГАСТРИТОВ
Короткевич А. Г.1, Аксенов П. В.2
1 Новокузнецкий государственный институт усовершенствования врачей — филиал федерального государственного бюджетного образовательного учреждения дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации (Новокузнецк, Россия)
2 Государственное бюджетное учреждение здравоохранения Кемеровской области «Новокузнецкая городская клиническая больница № 29» (Новокузнецк, Россия)
TO ENDOSCOPIC CLASSIFICATION OF CHRONIC GASTRITISES
Korotkevich A. G.1, Aksenov P. V.2
1 Novokuznetsk State Institute for Further Training of Physicians — Branch Campus of the Federal State Budgetary Educational Institution of Further Professional Education “Russian Medical Academy of Continuous Professional Education” of the Ministry of Healthcare of the Russian Federation (Novokuznetsk, Russia)
2 Municipal Hospital Nr.29 (Novokuznetsk, Russia)
Для цитирования: Короткевич А. Г., Аксенов П. В. К эндоскопической классификации хронических гастритов. Экспериментальная и клиническая гастроэнтерология. 2018;152(4): 53–59.
For citation: Korotkevich A. G.1, Aksenov P. V. To endoscopic classification of chronic gastritises. Experimental and Clinical Gastroenterology. 2018;152(4): 53–59.
Короткевич А. Г.— Новокузнецкий государственный институт усовершенство-вания врачей — филиал федерального государственного бюджетного образо-вательного учреждения дополнительного профессионального образования
«Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации; Государственное бюджетное учреждение здравоохранения Кемеровской области
«Новокузнецкая городская клиническая больница № 29», д.м.н., профессор кафедры хирургии, урологии и эндоскопии, заведующий отделением эндо-скопии
Аксенов П. В.— врач патологоанатомического отделения ГБУЗ КО НГКБ № 29 г. Новокузнецка
Korotkevich A. G.— Novokuznetsk State Institute for Further Training of Physi-cians — Branch Campus of the Federal State Budgetary Educational Institution of Further Professional Education “Russian Medical Academy of Continuous Pro-fessional Education” of the Ministry of Healthcare of the Russian Federation, Municipal Hospital Nr.29, MD, Chair of surgery, urology and endoscopy, pro-fessor, Head of Endoscopy Department
Aksenov P. V.— Municipal Hospital Nr.29, doctor of Pathoanatomical Department
Резюме
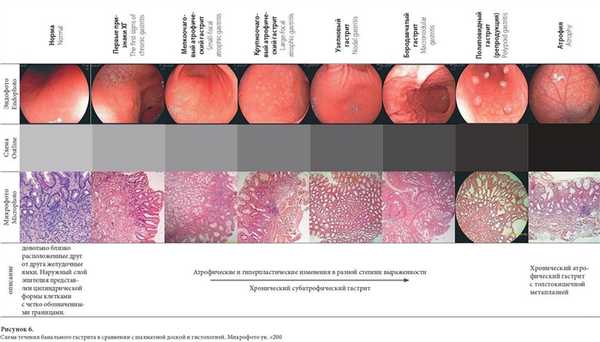
Статья посвящена анализу соответствия эндоскопических и гистологических исследований при разных формах хронического гастрита. Изучены в длительном динамическом наблюдении результаты обследования 3593 больных хроническим гастритом. Анализ эндоскопических признаков в описательной картине хронического гастрита независимо от давности заболевания выявил три основных общих показателя: пестрота, неровность, очаги атрофии слизистой оболочки желудка.
Анализ микроскопической картины выявил одинаковые атрофически-гиперпластические процессы разной степени выраженности при разных формах хронического гастрита (гипертрофическом — узелковом, бородавчатом, полиповидном, мелко и крупноочаговом атрофическом гастрите).
Предложена схема течения интерпретации хронического гастрита. Обосновано использование в практике эндоскописта заключения «хронический субатрофический гастрит» до стадии «хронический атрофический гастрит».
Ключевые слова: хронический гастрит, эндоскопическая диагностика, микроскопическая диагностика
Summary
Article is devoted to the analysis of compliance of endoscopic and histological studies of different forms of chronic gastritis. Results of inspection of 3593 pa-tients with chronic gastritis are studied in long dynamic observation. The analysis of endoscopic signs in a descriptive picture of chronic gastritis irrespective of prescription of a disease has revealed three main general signs: diversity, unevenness, foci of atrophy of gastric mucosa. Analysis of the microscopic picture showed the same atrophic-hyperplastic processes of varying degrees of severity in different forms of chronic gastritis (hypertrophic — nodular, verrucous, polypoid, small and large focal atrophic gastritis). There is high degree of correlation between the endoscopic and microscopic features. The scheme of development and interpretation of chronic gastritis is offered. Use in practice of the endoscopist the conclusion “chronic subatrophic gastritis” to a stage “chronic atrophic gastritis” is proved.
Keywords: chronic gastritis, endoscopic diagnosis, microscopic diagnosis
Введение
Проблема адекватной интерпретации хронического гастрита (ХГ), как и одинаковое понимание сути процесса, остается камнем преткновения между патологами, эндоскопистами и гастроэнтерологами. Попытки сопоставить эндоскопическую картину с гистологической показали превалирующую значимость микроскопии как в определении формы и стадии гастрита, так и риска малигнизации на его фоне [1, 2]. Предложенная в 1996 г. полуколичественная визуально-аналоговая шкала привела к признанию шкалы OLGA и OLGA-IM с высокой степенью согласованной оценки разными патологами [2–4], но эндоскопические описания хронического гастрита далеки от единства между собой и с патологами, а количество адекватно взятых биоптатов едва превышает 4%, в том числе из-за высоких трудозатрат на обеспечение такого исследования [5–8]. Смещение упора на этиологию ХГ, выявляемые детали патогенеза ХГ и превалирующая роль патоморфолога в определении как типа гастрита, так и степени атрофии слизистой оболочки в рамках канцеропревенции заставляют пересмотреть подходы к описанию эндоскопической картины в диагностике ХГ или адаптировать их для восприятия не эндоскопистами.
Целью работы явилось обобщение наблюдений за пациентами с хроническими гастритами, верифицированными при биопсии, для обоснования единой схемы эндоскопического заключения.
Материал и методы
С момента введения АРМ эндоскописта в 2000 г. по 2015 г. заключение «хронический субатрофический гастрит» (ХСГ) разной локализации, «хронический атрофический гастрит» (ХАГ), «хронический эрозивный гастрит» (ХЭГ), «хронический лимфоцитарный гастрит», «хронический узелковый гастрит» в качестве основной или сопутствующей патологии было дано в 59710 случаях 3593 пациентам, прикрепленным к ЛПУ и регулярно подвергавшимся гастроскопии в нашем отделении эндоскопии.
Использовали фиброэндоскопы и видеоэндоскопы Olympus серии GIF-Q10, 40, 160, с 2008 г. видеоэндоскопы Fujinon 590 серии и с 2011 г. видеоэндоскопы Karl Storz серии Black и Silver (PKS13801 и 13821). Биоптаты сразу погружались в нейтральный раствор 10% формалина, затем производилась автоматическая проводка в автомате гистологе карусельного типа, обработка 95% спиртом, спирт-ксилолом, чистым ксилолом, затем материал помещался в термостат на 15–20 минут в смесь ксилола и парафина. Полученный материал наклеивался на деревянные блоки, охлаждался в холодильной камере и производились ультратонкие срезы на микротоме санного типа. Окраска гематоксилин-эозином, при необходимости гематоксилин-пикрофуксином по методу Ван Гизона.
При микроскопическом исследовании оценивалась высота всей слизистой, высота валиков, длина ямок, количество желез, отмечалось наличие склеротических изменений в слизистой, характер и степень инфильтрации слизистой и эпителиального слоя, оценивался покровно-ямочный и железистый эпителий, степень дисплазии, если таковая имелась, изменения в собственной пластинке слизистой и подслизистом слое.
Статистическая обработка проведена с использованием пакетов программ Exel и Statistica 6.0. с использованием критерия χ2. Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
Результаты
Количество ЭГДС и выявленных ХГ за период наблюдения представлено на рисунке 1. Нет достоверных различий по частоте выявляемости ХГ за 15-летний период.
В среднем на 100 гастроскопий отмечено от 57 до 72 случаев выявления признаков ХГ.
Ежегодно от 300 до 1000 пациентов с установленным диагнозом ХГ подвергались повторной гастроскопии. Всего 3593 пациентов. Среднее количество ЭГДС в год у одного пациента при ХГ составило от 1,5 до 3,5.
Общее количество ЭГДС с получением материала для цитоморфологических исследований по годам, в сравнении с количеством биопсий при ХГ, представлено на рисунке 2.
Как видно, биоптаты брались не более чем в 55% эндоскопий. Из них подавляющая часть биоптатов предполагала микроскопию препарата для поиска хеликобактерий и оценку степени и качества воспалительной клеточной инфильтрации слизистой оболочки желудка. Основанием для прочих биопсий были хронические язвы, новообразования желудка и исключение очагов дисплазии/раннего рака. Единичные биопсии сопровождали течение хронических эрозий.
Эндоскопические признаки в расчете на 100 ЭГДС, использованные в протоколах описания эндоскопий при ХГ, представлены в таблице 1.
Как видно, в описательных признаках ХГ превалируют легко идентифицируемые независимо от площади поражения и локализации пестрота и неровность СОЖ. На основании этих признаков в своей практике мы использовали два основных заключения при ХГ: «хронический субатрофический гастрит» (ХСГ) при сохранных очагах СОЖ и «хронический атрофический гастрит» (ХАГ) в случаях диффузной атрофии СОЖ или поражения отдела желудка. Первым эндоскопическим признаком ХСГ считали появление разноразмерных желудочных полей и их неоднородное выступание над уровнем СОЖ. Встречаемость и структура ХГ в расчете на 1000 ЭГДС представлена на рисунке 3.
Эндоскопические признаки в расчете на 100 ЭГДС, использованные в протоколах описания эндоскопий при ХГ, представлены на рисунке 4. Не найдено корреляции между частотами эндоскопических признаков (Spearman R= –0,213057, р=0,484630), но частота эндоскопических признаков достоверно различалась в зависимости от выраженности атрофии (Chi-Square = 15330,83 df = 12 p < 0,000000).
Локализация ХГ зависела от стадии его существования (рисунок 5) и достоверно различалась по частоте поражения антрального отдела (Chi-square (df=1) =145,15; p=0,0000) и проксимальных отделов желудка (Chi-square (df=1) = 609,95; p=0,0000).
Основной целью анализа было оценить эффективность микроскопической диагностики в соответствии используемым эндоскопическим формам ХГ. Соответствие эндоскопических и морфологических заключений представлено в таблице 2.
Коэффициент корреляции между гистологическими исследованиями и их соответствием эндоскопическим заключениям ХСГ и ХАГ оказался высоким (Spearman Rank Order Correlations = 0,985610760609162; t(N-2)= 11,6619037896906; p=0,000309).
Основные микроскопические находки при ХСГ включали: снижение высоты и расширение валиков, уменьшение длины и расширение ямок, снижение зоны желез, уменьшение количества желез, гипермукоидность железистого и покровно-ямочного эпителия, диффузную лимфоплазмоцитарную инфильтрацию, наличие единичных фолликулоподобных структур. У пациентов с неравномерно расширенными желудочными полями и неровной СОЖ микроскопические признаки соответствовали ХСГ. При ХАГ: более выраженное (по сравнению с ХСГ) снижение высоты валиков, вплоть до полной сглаженности, более выраженное уменьшение длины ямок, наличие кистозно расширенных ямочных структур, значительное снижение зоны желез, значительное уменьшение количества желез, местами вплоть до полного исчезновения последних, выраженная гипермукоидность покровно-ямочного эпителия, наличие в отдельных случаях клеток типа бокаловидных, диффузная умеренная лимфоплазмоцитарная инфильтрация, наличие фолликулоподобных структур. Склероз собственной пластинки слизистой, в отдельных случаях всей слизистой.
При изучении эндоскопически нормальной СОЖ при микроскопии обнаруживалась неравномерная диффузно-очаговая скудная лимфоплазмоцитарная инфильтрация.
Предполагаемая схема течения любого гастрита, в равной степени, но с разной долей зависимости от бактериального, аутоиммунного и химического компонентов, присутствующих при любом виде гастрита, представлена в таблице 3.
Два типа изменений СОЖ выявлены при длительном динамическом исследовании – увеличение площади и степени атрофии СОЖ и/или замещение очагов атрофии очагами метаплазии с уменьшением площади видимых мелких сосудов – псевдовосстановление СОЖ.
Таким образом, генерация представлений о возникновении и течении ХГ привела к кардинальным изменениям в классификационных патоморфологических оценках процесса, их не только микроскопической, но и иммуногистохимической детализации [24, 25]. Возможно, настало время понять, что крен эндоскопической детализации и диагностики ХГ нужно сместить в сторону патоморфологов, а эндоскопическое восприятие ХГ если не упростить, то сделать рациональнее и унифицировать. Задачей эндоскопии в диагностике ХГ должны быть установление факта ХГ и его распространенности. Выявление раннего рака на фоне ХГ и соблюдение протокола OLGA – это следующий раздел исследований после выявления и подтверждения факта ХГ.
Список литературы:
1. Иммуногистохимическая детекция биомолекулярных маркеров метапластической атрофии слизистой оболочки в гастробиоптатах/ Кононов А. В., Мозговой С. И., Шиманская А. Г. и др.// Архив патологии. 2014; 76 (6): 44–50 Kononov A. V., Mozgovoi S. I., Shimanskaya A. G. et al. Im- munohistochemical detection of biomolecular markers for metaplastic mucosal atrophy in gastric biopsy specimens. Archive of pathology. 2014;76(6):44–50 2. Classification and grading of gastritis. The updated Sydney System. International Workshop on the Histopathology of Gastritis, Houston 1994/ Dixon MF, Genta RM, Yardley JH, Correa P. // Am J Surg Pathol 1996; 20: 1161–81. 3. Gastritis staging in clinical practice: the OLGA staging system/ Rugge M, Meggio A, Pennelli G, et al. // Gut 2007; 56: 631–636. 4. Мозговой С. И., Шиманская А. Г., Осинцева И.Л и соавт. Российский пересмотр международной классификации хронического гастрита: оценка нового диагностического подхода методами каппа-статистики/ Омский научный вестник, 2010.-№ 1 (94).– с. 84–88 Mozgovoy S. I., Shimanskaya A. G., Osintseva I. L. et al. Russian revision of the international classification of chronic gastritis: evaluation of a new diagnostic approach using kappa statistics./ Omsk Scientific Bulletin, 2010;1(94):84–88 5. McMahon RFT. Reporting gastritis – relevant and irrelevant information // BDIAP Meeting Ainley Top May 2010 6. Шиманская А. Г. Морфологические методы и экспертный подход при верификации атрофии слизистой оболочки желудка в биопсийной диагностике атрофического гастрита//Молодой учёный Апрель, 2012. -№ 4 (39) .-С.496–504 Shimanskaya A. G. Morphological methods and expert approach in verifying the atrophy of the gastric mucosa in the biopsy diagnosis of atrophic gastritis. Young Scientist. April, 2012;4(39):496–504 7. Kayaçetin S., Güreşçi S. What is gastritis? What is gastropathy? How is it classified?// Turk J Gastroenterol 2014; 25: 233–247 8. In vivo histopathology using endocytoscopy for non-neoplastic changes in the gastric mucosa: a prospective pilot study (with video)/ Sato H., Inoue H., Hayee B. H. et al.// Gastrointest Endosc 2015; 81: 875–881 9. Genta R M, Rugge M. Gastric precancerous lesions: heading for an international consensus// Gut 1999; 45 (Suppl I): I5–I8 10. Block B., Schachschal G., Schmidt H. Endoscopy of the Upper GI Tract: – Georg Thieme Verlag, 2004 11. Савельев В. С., Буянов В. М. Руководство по клинической эндоскопии, М., 1985 Saveliev V. S., Buyanov V. M. Guide to clinical endoscopy. Moscow; 1985 12. Эндоскопия желудочно-кишечного тракта/ Под ред. проф. С. А. Блашенцевой.– М.: ГЭОТАР-Медиа, 2009–520 c.: ил.– (Библиотека врача-специалиста). Endoscopy of the gastrointestinal tract / Ed. prof. S. A. Blashentseva. Moscow: GEOTAR-Media Publ., 2009. pp. 520: ill. (Library of the specialist doctor). 13. Рапопорт С. И. Гастриты (Пособие для врачей) – М.: ИД «Медпрактика-М», 2010.– 20 с. Rapoport S. I. Gastrites (Manual for doctors). Moscow, "Medpraktika-M" Publ., 2010. pp. 20 14. Desai H. G. Investigations Proposed to Accurately Classify Chronic Gastritis// JAPI April 2007; Vol. 55: 293–296 15. Волова А. В. Комплексное эндоскопическое обследование в диагностике хронического гастрита: автореф. дисс.к.м.н.– Москва, 2006 Volova A. V. Complex endoscopic examination in the diagnosis of chronic gastritis: author's abstract. diss. Ph.D., Moscow, 2006 16. Conventional videoendoscopy can identify Helicobacter pylori gastritis?/ Gomes A., Skare T. L., Prestes M. A. et al. // ABCD Arq Bras Cir Dig 2016; 29 (2): 73–76 17. Atlas of Gastrointestinal Endoscopy@Endoscopic Biopsis/Emory T.S., Carpenter H. A., Gostout C. J., Sobin L. H.: Armed Forces Institute of Pathology, American Registry of Pathology, Washington, 2000 18. Histologic intestinal metaplasia and endoscopic atrophy are predictors of gastric cancer development after Helicobacter pylori eradication/ Shichijo S., Hirata Y., Niikura R.et al.// Gastrointest Endosc 2016;84: 618–624 19. Аруин Л. И. Хронический гастрит / Л. И. Аруин, П. Я. Григорьев, В. А. Исаков, Э. П. Яковенко. Амстердам, 1993.– 308 с. Aruin L. I., Grigoriev P. Ya., Isakov V. A., Yakovenko E. P. Chronic gastritis: Amsterdam; 1993: pp. 308 20. Шестаков А. Г. Морфологическая характеристика и морфогенез хронического гастрита культи: автореф. дисс.к.м.н.– Челябинск, 2004 Shestakov A. G. Morphological characteristics and morphogenesis of chronic gastritis stump of the stomach: author's abstract. diss. Ph.D., Chelyabinsk, 2004 21. Маржатка З.– Эндоскопия пищеварительного тракта: Номенклатура OMEDМ.: Олимпас, 1996.– 136 с. Marzhatka Z.– Endoscopy of the digestive tract: Nomenclature OMED – M .: Olympus, 1996.– 136 p. 22. Atlas of GE and Related Pathology/ K.F.R. Schiller, R. Cockel, R. H. Hunt, B. F. Warren.– Blackwell Science, 2004 23. Kimura K, Takemoto T. An endoscopic recognition of the atrophic border and its signifiance in chronic gastritis// Endoscopy 1969;3:87–97. 24. Autoimmune Gastritis. A Clinicopathologic Study of 25 Cases/ Chlumská A., Boudová L., Beneš Z., Zámečník M.// Čes.-slov. Patol., 41, 2005, No. 4, p. 137–142 25. Кононов А. В., Мозговой С. И., Маркелова М. В., Шиманская А. Г. Биомаркерный принцип детекции атрофии слизистой оболочки желудка при хроническом гастрите/ Перпективы науки, 2013.-№ 10(49).С.58–61 Kononov A. V., Mozgovoi S. I., Markelova M. V., Shimanskaya A. G. Biomarker principle of atrophy detection of gastric mucosa in chronic gastritis. Prospects of Science. 2013;10(49):58–61
Классификация хронического гастрита в таблице
Хронический гастрит - диагностика
Хронический атрофический гастрит тела желудка возникает в связи с образованием антител к париетальным клеткам, уменьшением продукции кислоты и уровня внутреннего фактора Касла, что приводит к развитию пернициозной анемии и других аутоиммунных нарушений.
Для начальных стадий хронического гастрита, вызванного инфекцией Н. pylori, напротив, характерно вовлечение в воспалительный процесс антрального отдела желудка с незначительными изменениями кислотообразования и нормальным усвоением витамина В12, однако в дальнейшем возможно развитие атрофии, что, как и для атрофического гастрита в целом, связано с повышением риска возникновения рака желудка.
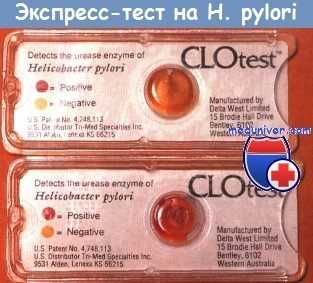
Выявить Н. pylori можно с помощью посева биопсийного материала из антрального отдела, гистологического исследования или одного из нескольких методов, основанных на высокой уреазной активности микроорганизма. Так, широко применяемые наборы для экспресс-диагностики позволяют определить изменение рН в содержащей мочевину среде при помещении в нее биопсийного материала, что связано с наличием в материале аммиаквырабатывающих бактерий.
Ложноотрицательные результаты обусловлены неудачным взятием биоптатов или действительным снижением количества бактерий после экспираторной пробы. Метод основан на приеме внутрь раствора меченой мочевины с последующим измерением меченого СО2 в выдыхаемом воздухе. В настоящее время предпочтение отдают нерадиоактивному [13С]-изотопу, измеряемому с помощью масс-спектрометрии, что в последнее время стало значительно доступнее.
Серологические методы также применяют, преимущественно для скрининга, при этом основной показатель — титр антител IgG в сыворотке.
Гастрит кроме Н. pylori могут вызывать и другие инфекционные агенты, однако это происходит только у пациентов с иммунодефицитом или со сниженной секрецией кислоты, находящихся в отделениях интенсивной терапии. Наиболее часто встречают цитомегаловирусную и криптоспоридиальную формы гастрита.
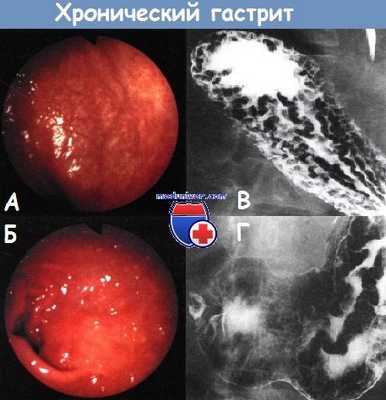
А - эндоскопическая картина xpoнического гастрита
Б - эндоскопическая картина антрального гастрита, вызванного инфекцией Helicobacter pylori
В - рентгенологическое исследование желудка с двойным контрастированием, при котором в области дна и тела видны умеренно утолщенные неровные складки, вызванные инфекцией Helicobacter pylori
Г - рентгенологическое исследование желудка с двойным контрастированием, при котором у больного с Helicobacter pylori, ассоциированным гастритом в области тела желудка определяются значительно утолщенные дольчатые складки (полипоидный гастрит). Подобная рентгенологическая картина характерна также для болезни Менетрие и лимфомы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Рентгенограмма, КТ при гастрите
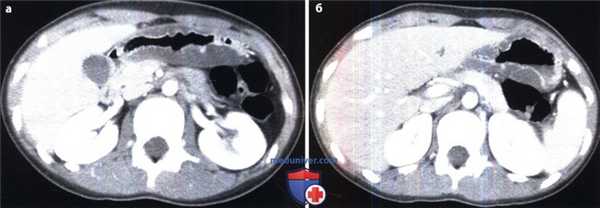
Гастрит, ассоциированный с Н. pylori: данные КТ.
(а, б) При КТ с контрастным усилением выявлено значительное утолщение стенки в области антрального отдела и тела желудка. Слизистая оболочка накапливает контраст в отличие от отечного подслизистого слоя, сигнал от которого приблизительно равен плотности воды.
а) Эрозивный гастрит. Наиболее характерный признак эрозивного гастрита — эрозии. Эрозия — это дефект слизистой оболочки, не достигающий ее мышечной пластинки. Аспирин и другие нестероидные противовоспалительные средства (НПВС) считают наиболее распространенной причиной эрозивного гастрита (50% всех случаев) (Levine, 2008b). Другие частые причины — употребление алкоголя, применение глюкокортикоидов, стрессы, травмы, ожоги, вирусные или грибковые инфекции, рефлюкс желчи или ферментов поджелудочной железы. По данным рентгенологических исследований, распространенность эрозивных гастритов составляет 0,5-26% (Chen et al,. 2001).
При рентгенографии с двойным контрастированием выявляют два типа эрозий: полную (вариолиформную, осповидную) и неполную (плоскую) эрозию. У большинства пациентов полная (осповидная) форма проявляется точечным или щелевидным накоплением бария, окруженным рентгенопрозрачным валом, который представляет собой отек слизистой оболочки (Levine, 2008b). Полные эрозии, как правило, локализуются в антральном отделе, располагаясь вдоль антральных складок (Levine, 2008b). Иногда НПВС провоцируют возникновение неполных (линейных) эрозий на слизистой оболочке тела желудка или вблизи большой кривизны. Это связано с тем, что таблетки, провоцирующие возникновение эрозий, благодаря силе тяжести оседают именно в этих отделах, и там же происходит их всасывание (Levine, 2008b).
При эрозиях небольших размеров, а также при заживших эрозиях можно выявить узелковый дефект наполнения или фестончатые антральные складки (Chen et al., 2001). Неполные эрозии выглядят как плоские дефекты слизистой оболочки. Такие эрозии составляют 5-19% всех эрозий, диагностируемых при рентгеноконтрастных исследованиях, и проявляются в виде линейных или точечных скоплений бария, которые гораздо труднее выявить, чем дефекты при полных эрозиях (Levine, 2008b). При рентгенографии с двойным контрастированием эрозии желудка могут быть ошибочно приняты за афтозные язвы при болезни Крона или «мишеневидные» поражения слизистой оболочки (Levine, 2008b).
б) Гастрит, ассоциированный с Н. pylori. Диагноз гастрита, ассоциированного с Н. pylori, может быть установлен при выявлении микроорганизма в образцах ткани, полученных при эндоскопической биопсии. Н.pylori, причина острых и хронических гастритов, представляет собой грамотрицательную палочку, которая располагается кластерно под слизистым слоем на поверхности эпителия или поверхностных фовеолярных клеток (Dixon et al., 1996; Levine, 2008b). Распространенность H. pylori зависит от возраста: 24% населения в возрасте 20-39 лет и 82% в возрасте 60 лет и старше инфицированы этим микроорганизмом (Chen et al., 2001).
В диагностике гастрита, ассоциированного с Н. pylori, используют неинвазивные методы с высокой чувствительностью и специфичностью (более 90%), например дыхательный уреазный тест (с пероральным употреблением мочевины, меченной радиоактивным изотопом 14 С или 13 С), или серологические исследования (Levine, 2008b). При хеликобактерном гастрите чаще отмечают поражение антрального отдела желудка, однако иногда происходит поражение проксимальной части или даже всего желудка. При рентгенографии с контрастированием чаще выявляют диффузное или местное утолщение складок антрального отдела или тела желудка (Levine, 2008b).
К другим возможным проявлениям относят неровность контура малой кривизны, язвы, бугристость слизистой оболочки, расширенные желудочные поля, полипы, сужение просвета, а также спазмы. Также могут появляться эрозии антрального отдела, но они редко связаны с основной патологией (Levine, 2008b; Chen et al., 2001; Dheer et al., 2002). Если при рентгенографии с двойным контрастированием у пациентов с хроническим гастритом, ассоциированным с Н. pylori, выявляют лимфоидную гиперплазию, должна быть заподозрена лимфома, ассоциированная со слизистой оболочкой желудка (MALT-лимфома).
Гипертрофический гастрит: данные КТ.
КТ-изображения в аксиальной (а) и коронарной (б) проекциях, полученные в венозную фазу контрастирования, демонстрируют выраженное равномерное утолщение складок желудка в области дна и тела с сохранными складками в антральном отделе.
(в) Эти изменения четко отображаются при проведении 3D КТ-реконструкции с воспроизведением поверхности. Гипертрофический гастрит: данные КТ.
(а) При КТ с контрастированием визуализированы имеющие ножку губовидные складки тела и дна желудка, выступающие в его просвет.
(б) При эндоскопии выявлены заметный отек и утолщение складок слизистой оболочки в области тела и дна желудка.
в) Хронический гастрит. Хронический гастрит — многофакторное заболевание, сопровождающееся хроническими воспалительными изменениями и атрофией, которые вызваны постоянным повреждающим воздействием на слизистую оболочку желудка. До настоящего времени существуют некоторые разногласия в классификации хронических гастритов, поскольку одновременно несколько терминов — поверхностный, атрофический и антральный гастрит — используют как синонимы этого понятия. В пересмотренной Сиднейской классификации выделяют различные группы хронических гастритов на основании топографии, морфологии и этиологии (Dixon et al., 1996). Выделяют хронический атрофический и хронический неатрофический гастриты с учетом наличия или отсутствия атрофии соответственно.
Согласно топографическому распространению атрофии, хронические атрофические гастриты подразделяют на гастрит типа А (аутоиммунный) и типа В (неаутоиммунный). Гастрит типа А поражает дно и может также распространяться на тело желудка. Антитела к париетальным клеткам служат причиной атрофии слизистой оболочки, приводящей к нарушению всасывания витамина В12, что клинически проявляется пернициозной анемией. У таких пациентов риск развития рака желудка в 3 раза выше, чем в общей популяции (Levine, 2008b). Рентгенологически, как правило, выявляют небольшие атрофические изменения. Характерные признаки при более выраженных атрофических изменениях — гладкая ровная слизистая оболочка и уменьшение или отсутствие складок желудка, преимущественно в верхней части желудка («лысое дно»). Форма желудка может становиться более вытянутой, с растянутым дном (симптом «водородной бомбы»).
Из-за потери париетальных клеток желудочные поля могут уменьшаться в размере и количестве (Chen et al., 2001; Rubesin et al., 2008). Гастрит типа В встречают чаще, чем гастрит типа А. При этом типе мультифокальные участки атрофии возникают преимущественно в антральном отделе с ограниченным распространением на тело и дно желудка. Инфицированность Н. pylori (наиболее часто) и другие причины (употребление алкоголя, рефлюкс желчи, применение НПВС, диетоспецифическое повреждение) также могут провоцировать атрофический гастрит типа В. Эти факторы независимо от инфицирования Н.pylori или совместно с ним могут индуцировать мультифокальную атрофию (Dixon et al., 1996). Потеря железистых структур приводит к истончению слизистой оболочки, что может провоцировать образование на ней эрозий или изъязвлений. И наконец, может произойти фиброзное замещение или деградация существующего поддерживающего матрикса. Атрофия слизистой оболочки тесно связана с уменьшением секреции кислоты и обычно ассоциирована с кишечной метаплазией (Dixon et al., 1996).
Кишечная метаплазия в свою очередь ассоциирована с увеличением риска развития рака желудка (Dixon et al., 1996). Атрофия может не сопровождаться развитием кишечной метаплазии (Dixon et al., 1996). Мультифокальная атрофия макроскопически чаще представлена плоскими очажками, поэтому ее трудно распознать при проведении рентгенографии с контрастированием (Rubesin et al., 2008). Фокальное увеличение желудочных полей или неоднородные узелки, разрушающие гладкую поверхность слизистой желудка, могут быть вызваны воспалением, метаплазией или злокачественной опухолью, например поверхностным раком желудка (Levine, 2008b; Chen et al., 2001; Rubesin et al., 2008).
г) Гипертрофический гастрит. Гипертрофический гастрит характеризуется выраженной гиперплазией желез желудка и увеличенной секрецией желудочной кислоты (Levine, 2008b). Отек и воспаление стенки желудка способствуют утолщению губовидных складок. Несмотря на то что патогенез этой патологии полностью не установлен, предполагают, что гиперплазию желудочных желез могут провоцировать гипофизарные и гипоталамические нарушения, а также патологическое влияние блуждающего нерва (Levine, 2008b). Поскольку при этой патологии в основном происходит поражение кислотопродуцирующей части желудка, при рентгеноконтрастных исследованиях выявляют утолщение складок главным образом тела и дна желудка. Также визуализируют истонченную слизистую оболочку с уровнями жидкости вследствие увеличенной продукции кислоты (Chen et al., 2001).
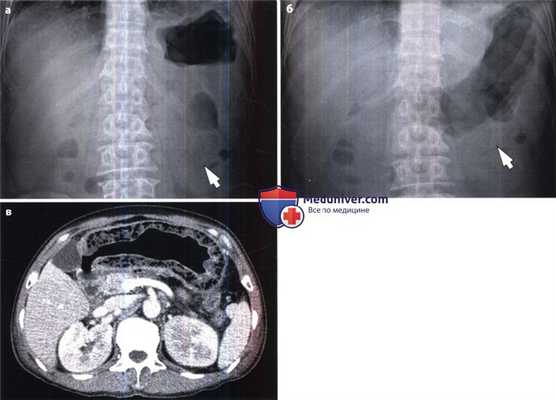
Эмфизематозный гастрит у пациента с сахарным диабетом.
(а) На рентгенограмме брюшной полости в прямой проекции выявлены прослойки и пузырьки газа (стрелка) в стенке желудка.
(б) При рентгенографии брюшной полости в положении лежа установлено, что скопление газа (стрелка) имеет одинаковую локализацию в желудке независимо от перемены положения тела. Это информативный признак, позволяющий отличить газ от остатков пищи, которые изменяют свою локализацию в зависимости от положения тела.
(в) При КТ с контрастированием выявлено диффузное утолщение стенки желудка со скоплением воздуха внутри нее, что служит характерным признаком эмфизематозного гастрита.
д) Эмфизематозный гастрит. Эмфизематозный гастрит — смертельно опасный редкий вид флегмонозного гастрита, при котором инфицирование газообразующими микроорганизмами (Escherichia coli, Proteus vulgaris, Clostridium perfringens и Staphylococcus aureus) приводит к накоплению газа в стенке желудка (Levine, 2008b). Данная патология возникает в условиях поражающего воздействия на желудок, например при желудочно-кишечных операциях, употреблении едких веществ, завороте желудка. Ишемия или некроз позволяют газообразующим микроорганизмам проникнуть в стенку желудка. Даже при интенсивном лечении смертность составляет 60% (Levine, 2008b).
Эмфизематозный гастрит необходимо отличать от другой редкой патологии — эмфиземы желудка, при которой газ проникает в стенку желудка через разрывы слизистой оболочки, вызванные увеличением внутрижелудочного давления (которое связано с обструкцией пилорического отдела) или ятрогенным повреждением (например, при эндоскопии или других инструментальных воздействиях). Эмфизему желудка в клинической практике встречают чаще, чем эмфизематозный гастрит, клинически она не проявляется и имеет тенденцию к спонтанному регрессу (Horton and Fishman, 2003). Эмфизематозные гастриты проявляются циркулярным или фокальным утолщением стенки желудка, что иногда имитирует рак желудка. В случае доброкачественного утолщения стенки желудка при проведении КТ с контрастированием выявляют гиподенсивность стенки и гиперемированную вследствие отека и воспаления слизистую оболочку (Horton и Fishman, 2003).
При утрате стратификации (слоистости) желудочной стенки на томограммах может быть заподозрен злокачественный процесс (Chen et al., 2010). В отличие от других доброкачественных заболеваний желудка эмфизематозный гастрит имеет специфические рентгенологические признаки: множественные полоски, пузырьки и «пестрые» скопления газа в стенке желудка, выявляемые при рентгенографии и КТ органов брюшной полости (Cruz et al., 1992).
Читайте также:
- Профилактика и лечение инфекционных осложнений острого лейкоза. Лечение инфекций при лейкозе
- Кости при синдроме Кушинга - лучевая диагностика
- Лучевая диагностика газа в желчных протоках
- Рак поднижнечелюстной железы - лучевая диагностика
- Диагностика чумы. Микробиологическая диагностика чумы. Выделение возбудителя чумы. Чумной бактериофаг. Биологическая проба при чуме. Аллергическая проба при чуме.
