Клетки влияющие на стволовые клетки. Генерационный цикл стволовой клетки
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Гематология: Стволовая кроветворная клетка (СКК) - свойства, функции, типы
Родоначальницей всех клеток крови является стволовая кроветворная клетка (СКК), которая может развиваться в различные виды зрелых клеток. Она способна к самоподдержанию, т. е. производству себе подобных клеток, не обязательно сразу после деления вступающих в дифференцировку.
Представление о наличии стволовой кроветворной клетки (СКК) и унитарной теории кроветворения, в соответствии с которой все клетки крови происходят из единой клетки-предшественницы, было сформулировано в 1909 г. профессором Военно-медицинской академии А. А. Максимовым в работе «Лимфоцит как общая постоянная клетка различных элементов крови в эмбриональном развитии и в последующей жизни млекопитающих».
Существование стволовой кроветворной клетки (СКК) в 1961 г. доказали J. E. Till и Е. A. A. McCullough с помощью культуральных исследований: было установлено, что при пересадке донорского костного мозга облученной мыши в ее селезенке развиваются очаги кроветворения, которые представляют собой потомство одной клетки (так называемой колониеобразующей единицы селезенки, или КОЕс), способной дифференцироваться по всем росткам кроветворения.
Основными свойствами популяции стволовой кроветворной клетки (СКК) являются: 1) полипотентность (возможность дифференцироваться по всем росткам кроветворения); 2) способность к самоподдержанию, которая является ключевой в концепции стволовой клетки.
В настоящее время имеются две теории, объясняющие этот феномен: 1) деление стволовой кроветворной клетки (СКК) асимметрично: из двух произведенных СКК одна является недифференцированной, другая — дифференцированной (продуцирующей зрелые клетки крови); 2) при делении стволовой кроветворной клетки (СКК) образуется либо две новых СКК, либо две более зрелых клетки (т. е. пул стволовой кроветворной клетки (СКК) поддерживается не асимметричным делением стволовых клеток, а равновесием между числом делений, увеличивающих количество СКК, и делений, связанных с появлением более зрелых клеток).
Различают два типа стволовых кроветворных клеток (СКК): первичные, или истинные, долгоживущие СКК, способные к самоподдержанию, и короткоживущие клетки, которые могут пролиферировать in vivo и воспроизводить все клетки крови, но не способны к самоподдержанию.
Изучение стволовой кроветворной клетки (СКК) затруднено в связи с их незначительным количеством — приблизительно 1 клетка на 104-106 миелокариоцитов и на 105-107 клеток периферической крови. Иммунофенотип стволовой кроветворной клетки (СКК) характеризуется экспрессией антигенов CD34, CD59, Thyl и рецептора для фактора стволовых клеток (kit), отсутствием антигенов CD33, CD38 и HLA-DR. В результате последовательных делений и дифференцировок из одной СКК образуется около 103 клеток-предшественниц и 106 зрелых клеток.
Кроме того, выделяют CD133+ гемопоэтические стволовые клетки, выявляемые среди CD34 негативных клеток. Этот маркер имеется также на ранних предшественниках эндотелиальных, мышечных и нервных клеток.
Культуральными исследованиями доказана высокая колониеобразующая способность стволовой кроветворной клетки (СКК) и их способность к длительному самоподдержанию. Направление дифференцировки стволовой кроветворной клетки (СКК) определяется кроветворным микроокружением.
Важное влияние на процессы самоподдержания и дифференцировки стволовой кроветворной клетки (СКК) оказывают гемопоэтические ростовые факторы. Некоторые из них (ИЛ-1, ИЛ-6) могут выступать как пусковой механизм, запускающий «дремлющие» СКК в пролиферацию; другие (гранулоцитарный КСФ, фактор стволовых клеток, ИЛ-3), напротив, способствуют длительному сохранению стволовой кроветворной клетки (СКК) в фазе G0.
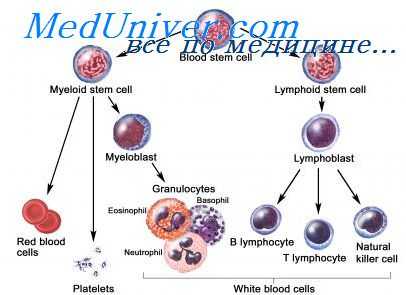
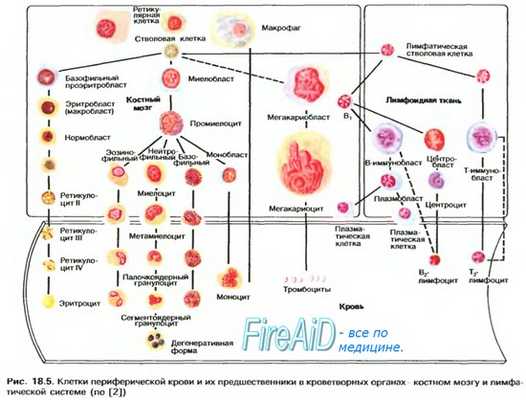
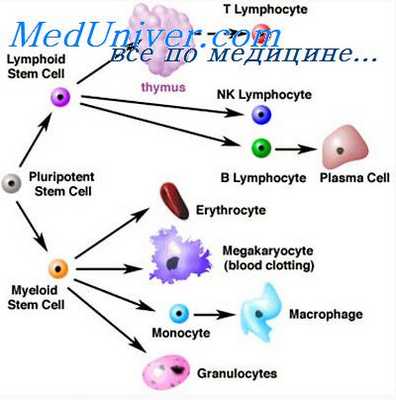
К ближайшим потомкам стволовой кроветворной клетки (СКК) относятся миелоидная и лимфоидная стволовая кроветворная клетка (СКК), которые могут дифференцироваться соответственно в клетки миелоидного и лимфоидного ряда. Следующим классом клеток-предшественниц в лимфоцитарном ряду являются пре-В- и npe-T-клетки, в миелоидном — смешанная клетка-предшественница, способная созревать в эритроидные, гранулоцитарные, моноцитарные и мегакариоцитарные клетки (КОЕ-ГЭММ).
Следующим этапом развития клеток-предшественниц являются клетки-предшественницы гранулоцитов и моноцитов (КОЕ-ГМ), гранулоцитов, эозинофилов (КОЕ-Эоз), базофилов (КОЕ-Баз), мегакариоцитов (КОЕ-Мег), эритроцитов (БОЕ-Э — бурстобразующие единицы, получившие название от английского слова «burst» — взрыв, в связи со способностью быстрого образования большого количества содержащих гемоглобин клеток), которые имеют все более низкий дифференцировочный потенциал. Морфологически все эти клетки также не отличаются от лимфоцита, и их наличие доказывается культуральными методами и иммунофенотипированием.
Самые ранние стволовые кроветворные клетки (СКК) обладают очень высоким пролиферативным потенциалом, выраженным самоподдержанием и способностью давать потомство многим направлениям дифференцировки. С возрастом общее число стволовых кроветворных клеток (СКК) не меняется. Стволовые клетки, вступившие на путь дифференцировки, называют коммитированными. Процесс коммитирования заключается в снижении способности клеток к самоподдержанию, полипотентности и определении направления дифференцировки, что приводит к образованию дифферонов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клетки влияющие на стволовые клетки. Генерационный цикл стволовой клетки
Представление о клеточных кооперациях, регулирующих кроветворение, в частности о взаимодействии стромальных клеток-источников со стволовыми клетками, кажется весьма привлекательным. Действительно, стромальные клетки существенно более устойчивы к самым разнообразным повреждающим воздействиям, чем стволовые, да и вообще любые кроветворные клетки.
Поэтому после повреждения, когда строма обнажена, для сохранившихся стволовых клеток возрастает вероятность контакта со стромальным источником, что и повышает долю пролиферирующих стволовых клеток. Менее ясен вопрос, почему одновременно снижается вероятность дифференцировки стволовых клеток.
Приходится либо допустить, что чем выше концентрация индуктора (т. е. чем ближе стволовая клетка находится к стромальной в развивающейся цепи стволовых клеток), тем ниже для нее вероятность дифференцировки, либо что повреждение так влияет на стромальные клетки, что они начинают вырабатывать особый индуктор, в норме не продуцируемый, который снижает вероятность дифференцировки в стволовых клетках.
Допустима и третья, наиболее привлекательная возможность. Значение вероятности Р = 0,5 при стабильном кроветворении обеспечивается средней стабильной величиной генерационного цикла. Индукция пролиферации стволовых клеток естественно снижает эту величину. За время сокращенного цикла меньшая доля стволовых клеток успевает принять решение о дифференцировке.
В этом случае регуляция величины Р может осуществляться автоматически — чем быстрее пролиферируют стволовые клетки, чем меньше их среднее время генерации, тем выше величина Р, тем быстрее растет общая величина отдела стволовых клеток. По мере увеличения числа стволовых клеток (а следовательно, и числа продуцируемых ими потомков) все больше индукторов оказываются блокированными, средний темп пролиферации стволовых клеток замедляется, величина Р снижается до стабильного (0,5) уровня. Как видно, такое предположение позволяет объяснить всю регуляцию отдела стволовых клеток одним естественным механизмом, достаточно просто и, следовательно, надежно функционирующим,— взаимодействием стромальных клеток кроветворного микроокружения и стволовых кроветворных клеток.
Общее число последних поддерживается на одном и том же уровне за счет стабильного размера величины кроветворного микроокружения. Отдел стволовых клеток увеличивается вплоть до момента, когда микроокружение оказывается занятым стволовыми клетками и их потомками.
Следующий важный вопрос, который возникает при рассмотрении принципов управления кроветворной системой, относится к регуляции дифференцировки стволовых клеток. Действительно, все сказанное выше относится лишь к проблеме, как регулируется осуществление стволовыми клетками выбора: останутся ли они стволовыми или начнут дифференцировку. Между тем дифференцировки вообще не бывает, она всегда конкретна.
Стволовая клетка полипотентна, т. е. способна к дифференцировке по многим направлениям. Как же осуществляется выбор между этими «разрешенными» для стволовой клетки (т. е. обеспеченными ее геном) путями?
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Происхождение стволовых кроветворных клеток в эмбриональном развитии
В организме взрослых млекопитающих кроветворение происходит главным образом в костном мозге. На протяжении всей жизни в нем поддерживаются стволовые кроветворные клетки (СКК), образующие все типы форменных элементов крови. В эмбриональном развитии кроветворение происходит в нескольких анатомических образованиях – желточном мешке, аорто-гонадо-мезонефральной области, плаценте и печени. Однако до сих пор не вполне ясно, где именно в ходе развития эмбриона впервые появляются клетки-предшественники, дающие начало СКК зрелого костного мозга. В обзоре рассмотрены современные представления об особенностях кроветворных клеток, образующихся в желточном мешке, аорто-гонадо-мезонефральной области и плаценте, и их вкладе в заселение печени зародыша, а впоследствии и костного мозга взрослого организма.
Костный мозг – основной орган кроветворения у взрослых млекопитающих, в котором на протяжении всей жизни воспроизводятся стволовые кроветворные клетки (СКК) и образуются зрелые клетки крови. СКК взрослого организма способны давать все типы форменных элементов крови (нейтрофилы, базофилы, эозинофилы, моноциты, лимфоциты, эритроциты, тромбоциты). Кроме того, после деления СКК воспроизводят самих себя, т.е. самоподдерживаются. Благодаря этому они обеспечивают кроветворение неопределенно долгое время. Основным функциональным критерием наличия в ткани СКК является способность к восстановлению кроветворения как после естественной гибели клеток, так и в ходе патологических процессов или действия повреждающих агентов. Полный набор этих свойств появляется у СКК только после рождения, в результате созревания их предшественников, так называемых пре-стволовых кроветворных клеток (пре-СКК), которые возникают в раннем развитии задолго до формирования костного мозга. Хотя процесс образования кроветворной системы изучается более 100 лет, остается не ясным вопрос, где впервые возникают клетки, дающие начало СКК, существующим во взрослом организме.
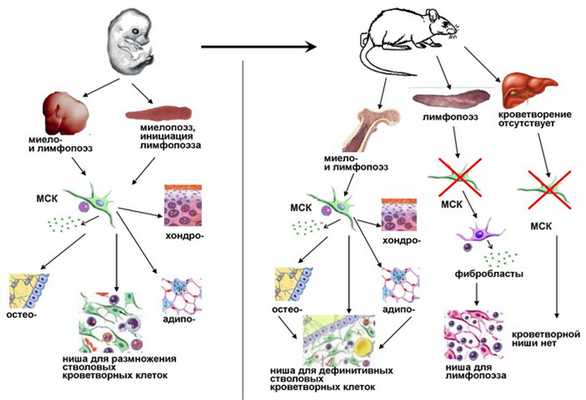
В эмбриональном развитии клетки крови образуются в нескольких органах, функционирующих в разное время, а именно в желточном мешке, области аорты, половых желез и почек (так называемом аорто-гонадо-мезонефросе или АГМ), плаценте и печени (заглавная иллюстрация). Иными словами кроветворение в ходе развития меняет свою локализацию. По-видимому, его переселение из органа в орган обусловлено не только анатомическими изменениями в процессе развития, но и тем, что в процессе становления кроветворной системы эти органы играют неодинаковую роль. Так, например, основная функция желточного мешка состоит в образовании первых клеток крови, в первую очередь эритроцитов, снабжающих развивающийся эмбрион кислородом. В то же время остается неясным, работает ли этот орган не только на текущие потребности зародыша, но и на перспективу, то есть участвует ли он в образо-вании полноценных, так называемых дефинитивных СКК, которые в дальнейшем заселят костный мозг и обеспечат кроветворение у взрослого организма. Дело в том, что образующиеся в желточном мешке кроветворные клетки-предшественники не соответст-вуют важнейшему функциональному критерию дефинитивных СКК – способности восстанавливать кроветворение при трансплантации реципиенту, у которого собственная кроветворная ткань разрушена облучением. Предшественники взрослого кроветворения, которые этой способностью обладают, появляются в ходе развития организма несколько позже и закладываются практически одновременно в нескольких независимых источниках – в стенке дорзальной аорты и других крупных сосудах, в сердце, а также в плаценте. В этих образованиях они возникают de novo , а затем перемещаются из них в печень. Функции этих источников, по-видимому, не идентичны. Так, в АГМ образуются лишь единичные СКК, способные заселять кроветворные органы взрослого реципиента, однако здесь массово размножаются их предшественники, пре-СКК, которые впоследствии и мигрируют в печень. Возможно, АГМ является главным поставщиком пре-СКК для первоначального заселения печени, где они дозревают до стадии СКК, размножаются и приобретают способность давать начало всем типам зрелых клеток крови. Параллельно с печенью размножение СКК идет и в плаценте, но в этом органе, в отличие от печени, они не дифференцируются. Очевидно, основная роль плаценты как кроветворного органа – это наработка СКК.
В печени зародыша собственные предшественники кроветворных клеток не образуются. Кроветворение в ней начинается и поддерживается только за счет миграции клеток, приходящих из желточного мешка, АГМ и плаценты. В печени СКК не только самоподдерживаются и размножаются, но и впервые в эмбриогенезе образуют все типы кроветворных клеток красного и белого рядов. Таким образом, печень является основным кроветворным органом развивающегося плода и обеспечивает его потребность как в стволовых, так и в зрелых клетках крови, что становится особенно важным на тех стадиях развития, когда желточный мешок уже прекращает выполнять кроветворную функцию. В конце внутриутробного периода печень переключается на выполнение специфических функций, свойственных ей во взрослой жизни, а кроветворная активность ней угасает. СКК при этом покидают печень и перемещаются в костный мозг, где к тому моменту уже складываются условия для их существования и самообновления. Попав в костный мозг, СКК прекращают интенсивно делиться и переходят в состояние покоя.
Ведущая роль в смене мест, где в ходе индивидуального развития происходит кроветворение, принадлежит микроокружению. В желточном мешке, АГМ, плаценте и печени оно неодинаково, и это обуславливает различия в поведении кроветворных клеток в этих органах. Так, под влиянием микроокружения плаценты СКК активно размножаются, а микроокружение печени благоприятствует не только их делению, но и дифференцировке. Ключевую роль в формировании микроокружения, или ниши для СКК, играют мезенхимные стромальные клетки (МСК). В ходе развития эмбриона МСК появляются в местах кроветворной активности, по-видимому, подготавливая «ложе» для кроветворных клеток, причем обе системы – мезенхимная и кроветворная – развиваются скоординировано. В индивидуальном развитии МСК претерпевают не только количественные, но и функциональные изменения, что отражает процесс созревания кроветворной ниши. Именно качественные изменения качества кроветворного микроокружения, происходящее параллельно с изменениями СКК, могут иметь определяющее влияние на приобретение последними дефинитивных свойств, присущих клеткам взрослого организма.
Таким образом, эмбриональное кроветворение осуществляется во многих анатомических образованиях, обеспечивающих на протяжении пренатального периода разные этапы формирования и созревания кроветворных клеток. Кроветворные функции этих образований частично перекрываются, но каждое из них имеет и уникальные особенности: желточный мешок служит первым местом продукции функционально активных клеток крови (примитивных эритроцитов), в АГМ закладываются de novo предшественники дефинитивных СКК, плацента обеспечивает размножение СКК, а печень – их поддержание и дифференцировку в множественных направлениях. Существование нескольких мест для кроветворения способствует, с одной стороны, быстрому образованию первых дифференцированных клеток крови, необходимых эмбриону для выживания и роста, а с другой – продукции множества СКК, которые потребуется организму в дальнейшем, уже после рождения. Однажды возникнув, СКК собираются в печени зародыша для размножения и дифференцировки, после чего заселяют костный мозг. На этом пути они попадают в различные ниши и подвергаются различным воздействиям, способствующим их размножению и функциональному созреванию, в результате чего приобретают свойства СКК взрослого организма.
Хотя эмбриональное развитие кроветворной системы изучается уже много лет, многие вопросы, связанные с происхождением клеток крови в эмбриогенезе, до сих пор остаются без ответа. Дальнейшее изучение клеточных и молекулярных механизмов формирования СКК в индивидуальном развитии имеет несомненную значимость не только для понимания фундаментальных аспектов функционирования кроветворной системы, но и для совершенствования методов лечения гематологических заболеваний.
Распределение стволовых клеток по организму после подкожного введения
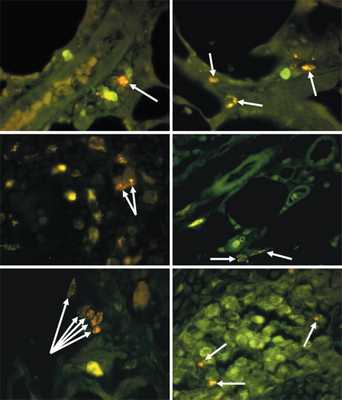
Рис. 1. Легкие и ЛУ животных в различные сроки после подкожного введения ММСК. Результат компьютерного совмещения изображений, полученных в люминесцентном режиме микроскопа с фильтрами Alexa 488 и для родамина. а – через 3 недели в периваскулярно расположенных клетках легкого многочисленные включения значительно ярче флюоресцируют при использовании фильтра для родамина (стрелка). б – в клетках альвеол легкого спустя 3 недели многочисленные включения значительно интенсивнее светятся на фоне применения родаминового фильтра (стрелки). в – аксиллярный ЛУ на 3-й неделе, в клетках в просвете мозгового синуса включения более интенсивно светятся при установке фильтра для родамина (стрелки). г – в клетках, расположенных паравазально рядом с капсулой подмышечного ЛУ, через 4 недели присутствуют единичные включения с несколько более яркой флюоресценцией при использовании родаминового фильтра (стрелки). д – спустя 3 недели отдельные клетки рядом с сосудами паранодальных тканей мезентериального ЛУ светятся более интенсивно на фоне применения фильтра для родамина (стрелки). е – в отдельных клеточных элементах в просвете мозговых синусов брыжеечного ЛУ на 3-й неделе присутствуют включения с более яркой флюоресценцией при установке родаминового фильтра. (Рисунок из обсуждаемой статьи)
Известно, что стволовые клетки применяют в косметологии для улучшения состояния кожных покровов. Считается общепринятым, что при локальном введении клетки остаются в месте применения, а при системном (внутривенном) введении происходит их распространение по всему организму. Российские ученые провели исследование распределения по организму лабораторных крыс стволовых клеток после подкожного введения. Оказалось, что через 1-2 недели после инъекции клетки попадают в кровоток и мигрируют в легкие, где поглощаются макрофагами организма. Несмотря на то, что в печени, почках и селезенке стволовые клетки, введенные подкожно, отсутствуют, в почках подопытных животных обнаруживается прогрессирование восходящей инфекции мочевых путей. Авторы полагают, что последнее может быть обусловлено иммуномодуляторным или даже иммуносупрессивным влиянием стволовых клеток.
Очень часто стволовые или, как их называют официально, мезенхимные стромальные клетки (МСК) применяют в косметологии для улучшения состояния кожных покровов, коррекции возрастных изменений и воздействия на рубцы, шрамы и стрии. Вместе с этим, остается неисследованной вероятность диссеминации введенных в кожу (дерму) или подкожно МСК по другим, удаленным, органам и тканям. Ранее была доказана миграция мультипотентных МСК костномозгового происхождения (ММСК) или их детрита в ближайшие регионарные лимфатические узлы (ЛУ). В связи с этим методом световой люминесцентной микроскопии изучали распределение ММСК по различным отдаленным органам после подкожного введения этих клеточных элементов, меченных Vybrant CM-Dil, в интактные ткани паховой области крыс и на фоне венозного застоя.
После простой инъекции ММСК попадают в кровь через 1–2 недели, о чем свидетельствует присутствие окрашенных Vybrant CM-Dil объектов, являющихся макрофагами, в легких (рис. 1). Количество подобным образом светящихся при воздействии ультрафиолетовым светом фагоцитов в легких нарастает с максимумом на 3 неделе, затем постепенно снижается. Это совпадает с данными литературы, которые сообщают о наиболее выраженном процессе элиминации (удалении) введенных извне ММСК и структур, из них созданных, у крыс через 2–3 недели после трансплантации этих клеточных элементов. Скорее всего, в остальные органы ММСК транспортируются с кровью и уже после фильтрации в легких. Об этом свидетельствует некоторое отставание появления меченых объектов и значительно меньшая их встречаемость в ЛУ. В подмышечных и брыжеечных ЛУ подобные объекты присутствовали в минимальном количестве, очень непродолжительное время и, чаще всего, в краевом синусе и рядом с сосудами околоузловой клетчатки, что указывает на поступление ММСК (или макрофагов с их детритом) в ЛУ как с током лимфы из региона лимфосбора, так и непосредственно из сосудов самих ЛУ и околоузловых тканей. После введения ММСК в ткани на фоне предварительно созданной венозной блокады, окрашенный детрит ММСК попадает в кровеносное русло позже и в меньшем объеме, чем после инъекции ММСК в интактные ткани. Возможно, что такие различия обусловлены венозным застоем и нарушениями микроциркуляции, как вследствие блокады магистральной вены, так и при асептическом воспалительном процессе после хирургического вмешательства. По-прежнему максимальный объем детрита из крови адсорбируется макрофагами легких, и только после прохождения легких дебрис (остатки) ММСК распространяется по всему организму и попадает в подмышечные и брыжеечные ЛУ.
В печени, почках и селезенке ММСК, введенные подкожно, отсутствуют независимо от состояния венозного оттока. По-видимому, эти объекты даже при попадании в кровоток или не доходят до указанных органов, так как оседают в капиллярной сети малого круга кровообращения – в легких, или органные макрофаги в силу каких-то причин не адсорбируют из крови такие антигены, как ММСК и их дебрис. Необходимо особо отметить обнаруженное в почках животных после применения ММСК прогрессирование восходящей инфекции мочевых путей, что может быть обусловлено иммуномодуляторным или даже иммуносупрессивным влиянием этих ММСК. На фоне венозного застоя бактериальная контаминация отмечена позже и не так значительна, что может быть связано с меньшим количеством ММСК, попавших в кровь в условиях нарушенной микроциркуляции. В связи с этим целесообразно тщательно обследовать пациентов перед проведением лечения с применением клеточных технологий для профилактики обострения хронических инфекционных процессов, в том числе и скрытых.
Зачем нужны стволовые клетки
Сердце бьется, мозг, почки, печень работают, волосы отрастают — мы настолько привыкли к этим процессам, что не задумываемся о том, как и почему они происходят в нашем организме. А ведь за каждым из них стоит неусыпная работа маленьких трудяг — клеток. И среди них есть особенные клетки — стволовые, из которых и произошли все клетки нашего организма. По сути мы, как любой многоклеточный организм, зародились из одной стволовой клетки.
Впервые термин «стволовая клетка» в начале ХХ века ввел в оборот российско-американский гистолог Александр Максимов на заседании гематологов в Берлине. Термин отлично передает суть того, как развиваются клетки любого организма (stem — это ствол/стебель, а cells — клетка). Подобно дереву, ствол — это родоначальная клетка, а ветки и листья — результат ее развития и изменения.
На ранних этапах эмбрионального развития стволовая клетка умеет производить разные типы клеток. Когда человек вырастает, стволовые клетки специализируются и могут производить только клетки определенных типов. Благодаря функции стволовых клеток наш организм постоянно обновляется.
— Например, постоянно гибнут миллионы лимфоцитов крови, они должны из чего-то восстанавливаться. — Из стволовых клеток крови. Мы сбрасываем очень много кожи, эпидермиса, целые граммы в день. А кожа должна восстанавливаться. Из чего? — Из стволовых клеток кожи, — поясняет доктор биологических наук, профессор, заведующий лабораторией эпигенетики Института общей генетики Российской академии наук Сергей Киселев.
Заменить больную иммунную систему на здоровую
Срок жизни различных тканей организма мал и если бы стволовые клетки не обновляли его, цивилизация попросту исчезла. Так, волосы на голове живут не больше семи лет, кровь обновляется каждые четыре месяца, а скелет — каждые 10 лет.
Используя способность стволовых клеток восстанавливать ткани, ученые сегодня способны лечить заболевания, которые еще пятьдесят лет назад считались приговором. Сегодня трансплантация костного мозга — одно из самых продвинутых направлений в медицине.
— Самые частые показания для проведения трансплантации — опухолевые заболевания системы крови. Даже после ремиссии на химиопрепаратах иммунная система человека с большой вероятностью снова не распознает опухолевую клетку и пойдет рецидив, что так или иначе со временем приведет к смерти. А трансплантация костного мозга — пожалуй, единственный метод, который позволяет достичь излечения, — уточняет научный сотрудник отделения трансплантации костного мозга национального медицинского исследовательского центра гематологии Михаил Дроков.
Донорство костного мозга — это опасно?
Химиотерапия убивает не только раковые, но и стволовые клетки, от чего страдает иммунная система организма. Трансплантация стволовых клеток — это вариант заменить больную иммунную систему на здоровую, которая будет в состоянии бороться с раковыми заболеваниями крови.
Как это происходит? Из кости таза донора берется пункция ста миллилитров костного мозга. Процедура рядовая и безопасная. Чаще всего донорами становятся родственники, но при условии иммунологической совмести, им может стать и посторонний человек. К 2012 году количество трансплантаций костного мозга в мире превысило один миллион операций.
А если несовместимость? Тогда велик риск осложнений, когда новая иммунная система начинает бороться не с болезнью, а с самим организмом пациента. Открытие системы HLA позволило адекватно подбирать доноров и создавать иммуносупрессанты,способствующие распознаванию иммунной системой донора не всего организма в целом, а только опухолевых клеток.
А что еще умеют стволовые клетки?
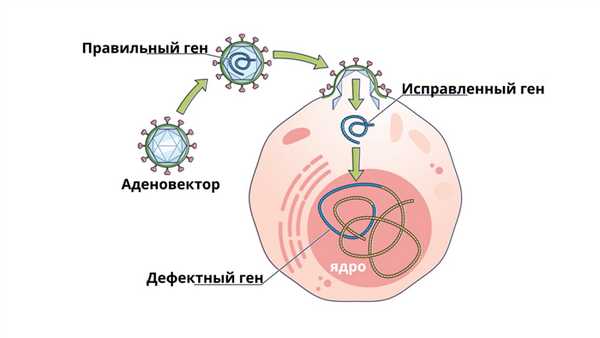
Генная терапия с использованием аденовирусного вектора. В некоторых случаях аденовирус вставляет новый ген в клетку. Если лечение успешно, то новый ген будет производить функциональный белок, что приводит к выздоровлению.
Сейчас медики думают, как можно научиться с помощью стволовых клеток костного мозга бороться с генетическими заболеваниями с самого рождения. Так, можно модифицировать стволовые клетки костного мозга пациента, взяв поврежденный ген и заменив его на здоровый. По замыслу ученых это поможет победить на генном уровне такие заболевания, как сахарный диабет, ВИЧ, бесплодие и дальтонизм.
Примечательно, что для того, чтобы проникнуть в клетку и встроить нужный ген, исследователи используют… вирус. Не цельный и не инфицирующий, а микроскопическую его часть, чтобы встроить нужный ген в геном. Это направление получило название генотерапия.
Органы в «пробирке»
Эмбриональные стволовые клетки способны формировать более 350-ти клеток костей, кожи, мозга и других органов. Но где их взять?
Настоящей сенсацией стали в 2006 году лабораторные исследования японского ученого Cинья Яманака, доказавшего, что можно взять любую клетку взрослого человека и путем генного перепрограммирования вернуть ее в состояние эмбриональной.
Российские ученые не отстают. Так, в московском медико-стоматологическом университете смогли вырастить из стволовых клеток …зубы. Для этого исследователи использовали стволовые клетки кожи и мезенхимальные — из жировой ткани и пульпы зубов. Первыми пациентами, у которых из подсаженных зачатков выросли искусственные зубы и на сколы старых зубов наросла эмаль, стали мыши. Приживаемость — почти 100%.
Следующий этап — адаптация технологии для человека и поиск решения, как вырастить зуб необходимого вида, например, передний резец или моляр.
— Это крайне важно, потому что из эмбриональной стволовой клетки мы потом можем получить любой специализированный тип ткани, из этой клетки получить и кровь, и кожу, и кости, и нейроны, и клетки-компоненты глаза, например, и все разнообразие тканей человека, — подтверждает д.б.н., профессор, заведующий лабораторией эпигенетики Института общей генетики РАН Сергей Киселев.
Параллельно российские ученые работают над проблемой алопеции. Они уже научились конструировать в пробирке волосяной фолликул для дальнейшей пересадки человеку обратно. Но в экспериментах, опять-таки на грызунах, столкнулись с неожиданной проблемой — пересаженные в холку лысым мышкам волосы выросли густым пучком, но в разных направлениях, куда им вздумается, и даже прорастали вовнутрь. И тут нашлись принципиально новые подходы — клонировать, мультиплицировать волосы для пересадки в поредевшие места или пересаживать даже не готовые луковицы, а их клетки, и давать фолликулам образовываться самим. К сожалению, применение этого метода возможно только, если хоть что-то от собственных волос осталось.
— Мы научились выделять специализированные клетки волосяного фолликула, которые также могут быть использованы для того, чтобы увеличить размер собственных волосяных фолликулов, то есть придать волосам толщину, а также, что самое главное, пробудить спящие волосяные фолликулы, которые смогут снова образовывать стержень, — поясняет заведующая лабораторией клеточной биологии института биологии и развития РАН, член-корреспондент РАН, д.б.н.Екатерина Воротеляк
Биопринтер — наше будущее?

А как выращивать более сложные, чем зубы и волосы, органы? Пока сосуды и органы, состоящие из различных типов тканей, вырастить в пробирке невозможно. Так появился метод биопечати.
— Это создание трехмерных ткане-инженерных или, как мы их еще называем, органных конструкторов с использованием клеточного материала, — это принципиально важно, из живых клеток по заданной трехмерной модели. Собственно, эта технология была разработана в начале 2000-х годов, много было взято из технологии классической 3D-печати, — рассказывает исполнительный директор компании-разработчика биопринтеров Юсеф Хесуани.
На 3D принтере стало возможным печатать не только чехлы для телефонов и бытовую технику, но и органы. К примеру, биопечатная щитовидная железа отлично прижилась в теле мыши и даже через несколько месяцев уровень гормонов зверька остался в норме. Это стало возможном благодаря специальным биочернилам, которые состоят из сфероидов — микроскопических шариков, в основе которых тысячи стволовых клеток нужной специализации.
Упрощенно суть биопечати выглядит так. Из кирпичиков-сфероидов, наполненных стволовыми клетками нужного типа, принтер выкладывает слои. Цементом служит гидрогель. Слои чередуются. В зависимости от того, какую функцию будет выполнять орган, специалисты по биопринтингу решают, нужно ли сохранить биологическую форму, или достаточно оставить лишь функцию. С примером щитовидной железы важна не форма, а внутренняя структура. А если дело касается сосудов или части трахеи, то здесь форма предопределена индивидуальными анатомическими особенностями, поэтому за основу 3D-модели берут, к примеру, файл компьютерной томограммы.
Конечно, квадратные почки и треугольное сердце вряд ли кому-нибудь нужны. Со временем точность и эффективность биопринтеров вырастет и специалисты научатся создавать точные копии поврежденных органов. Как внутренних, так и внешних. Человечество дождется момента, когда стволовыми клетками можно будет вылечить любой недуг.
Мифы и спекуляции
Во всем мире множество клиник предлагают лечение стволовыми клетками. И такие предложения надо очень внимательно проверять.
— Если у вас болит коленка, они вам введут клетки в коленку. Если у вас завтра заболит, голова, они введут в голову. Если заболит рука, введут и туда. Им все равно, куда вводить, им главное продать, стоимость процедуры от $5000 до $50 000. Все будет сделано по вашему желанию. И подобные клинике, к сожалению,найдутся в любой стране мира, — сетует Сергей Киселев.
В 2009 году история американца Джимма Гэсса всколыхнула научный мир. При обследовании в его теле обнаружили огромное новообразование, но не раковое, а гигантское бесформенное скопление клеток. другого человека! Оказалось, что ранее мужчина проходил терапию стволовыми клетками. Ученым все сразу стало понятно. Дело в том, что стволовые клетки, если их ввести в кровоток, не могут самостоятельно найти пораженное место и вылечить его. Для этого нужно подготовить условия. В противном случае они будут просто гулять по кровяной системе, и в результате, как в данном случае, скопятся в одном месте.
— Если мы возьмем стволовые клетки из костного мозга или из крови (это возможно сейчас) и введем просто человеку в вену, то получим …ровно ничего. Они исчезнут, уйдут в легкие, в печень и разрушатся. Они умрут, — генеральный директор ФГБУ «НМИЦ гематологии» Минздрава России, Валерий Савченко.
Именно поэтому сегодня исследования и эксперименты с использованием стволовых клеток во многих странах находятся под строжайшим контролем.
Тем не менее, клеточные технологии постепенно становятся одним из главных инструментов медиков. Стволовые клетки уже успешно применяются при лечении более сотни серьезных недугов — онкологических заболеваний крови, при лечении сосудов, кожных заболеваний, дистрофии сетчатки глаза.
Мы живем в эпоху открытий. И, возможно, человечество в скором времени забудет об институте донорства. А все нужные для трансплантации органы будет выращивать в пробирке из собственных клеток пациента или печатать.
Читайте также:
- Лечение повреждений почек и мочеточников. Лечение повреждений поджелудочной железы.
- Диагностика грибковых заболеваний. Лечение инфекционных болезней
- Сравнение контрастной эхокардиографии миокарда и стресс-эхокардиографии
- Острая воспалительная демиелинизирующая полирадикулонейропатия. Лечение острой полирадикулонейропатии.
- Влияние окклюзии верхней брыжеечной артерии на организм. Патогенез
