Коллатеральное кровообращение. Коллатеральный кровоток. Коллатерали. Анастомозы.
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
Коллатеральное кровообращение есть важное функциональное приспособление организма, связанное с большой пластичностью кровеносных сосудов и обеспечивающее бесперебойное кровоснабжение органов и тканей. Глубокое изучение его, имеющее важное практическое значение, связано с именем В.Н. Тонкова и его школы.
Под коллатеральным кровообращением понимается боковой, окольный ток крови, осуществляющийся по боковым сосудам. Он совершается в физиологических условиях при временных затруднениях кровотока (например, при сдавлении сосудов в местах движения, в суставах). Он может возникнуть и в патологических условиях при закупорке, ранениях, перевязке сосудов при операциях и т. п.
В физиологических условиях окольный ток крови осуществляется по боковым анастомозам, идущим параллельно основным. Эти боковые сосуды называются коллатералями (например, a. collateralis ulnaris и др.), отсюда и название кровотока «окольное», или коллатеральное, кровообращение.
При затруднении кровотока по основным сосудам, вызванном их закупоркой, повреждением или перевязкой при операциях, кровь устремляется по анастомозам в ближайшие боковые сосуды, которые расширяются и становятся извитыми, сосудистая стенка их перестраивается за счет изменения мышечной оболочки и эластического каркаса и они постепенно преобразуются в коллатерали иного строения, чем в норме.
Таким образом, коллатерали существуют и в обычных условиях, и могут развиваться вновь при наличии анастомозов. Следовательно, при расстройстве обычного кровообращения, вызванном препятствием на пути тока крови в данном сосуде, вначале включаются существующие обходные кровеносные пути — коллатерали, а затем развиваются новые. В результате нарушенное кровообращение восстанавливается. В этом процессе важную роль играет нервная система.
Из изложенного вытекает необходимость четко определить разницу между анастомозами и коллатералями.
Анастомоз (от греч. anastomos — снабжаю устьем) — соустье, всякий третий сосуд, который соединяет два других; это понятие анатомическое.
Коллатераль (от лат. collateralis — боковой) — боковой сосуд, осуществляющий окольный ток крови; понятие это анатомо-физиологическое.
Коллатерали бывают двух родов. Одни существуют в норме и имеют строение нормального сосуда, как и анастомоз. Другие развиваются вновь из анастомозов и приобретают особое строение.
Для понимания коллатерального кровообращения необходимо знать те анастомозы, которые соединяют между собой системы различных сосудов, по которым устанавливается коллатеральный ток крови в случае ранений сосудов, перевязки при операциях и закупорки (тромбоз и эмболия).
Анастомозы между ветвями крупных артериальных магистралей, снабжающих основные части тела (аорта, сонные артерии, подключичные, подвздошные и т. п.) и представляющих как бы отдельные системы сосудов, называются межсистемными. Анастомозы между ветвями одной крупной артериальной магистрали, ограничивающиеся пределами ее разветвления, называются внутрисистемными. Эти анастомозы уже отмечались по ходу изложения артерий.
Имеются анастомозы и между тончайшими внутриорганными артериями и венами — артериовенозные анастомозы. По ним кровь течет в обход микроциркуляторного русла при его переполнении и, таким образом, образует коллатеральный путь, непосредственно соединяющий артерии и вены, минуя капилляры.
Кроме того, в коллатеральном кровообращении принимают участие тонкие артерии и вены, сопровождающие магистральные сосуды в сосудисто-нервных пучках и составляющие так называемое околососудистое и околонервное артериальное и венозное русло.
Анастомозы, кроме их практического значения, являются выражением единства артериальной системы, которую для удобства изучения мы искусственно разбиваем на отдельные части.
Контрольные вопросы к лекции:
1. Понятие о коллатеральном кровообращении.
2. Роль отечественных ученых в развитии учения о коллатеральном кровообращении.
3. Этапы становления коллатерального кровотока после перевязки магистральной артерии.
4. Редуцированное кровообращение.
5. Роль отечественных ученых в развитии учения о редуцированном кровообращении.
122. Анастомозы артерий. Пути коллатерального кровотока (примеры).
Анастомоз (от греч. anastomos — снабжаю устьем) — соустье, всякий третий сосуд, который соединяет два других; это понятие анатомическое.
Анастомозы между ветвями круп-ных артериальных магистралей, снабжающих основные части тела (аорта, сонные артерии, подключичные, подвздошные и т. п.) и представляющих как бы отдельные системы сосудов, называются межсистемными. Анастомозы между ветвями одной крупной артериальной магистрали, ограничивающиеся пределами ее разветвления, называются внутрисистемными. Эти анастомозы уже отмечались по ходу изложения артерий.
Имеются анастомозы и между тончайшими внутриорганными артериями и венами — артериовенозные анастомозы. По ним кровь течет в обход микро-циркуляторного русла при его переполнении и, таким образом, образует коллатеральный путь, непосредственно соединяющий артерии и вены, минуя капилляры.
Анастомо́з артериа́льный (a. arterialis) — А. в виде артериальной ветви или артериальной сети, соединяющий два артериальных сосуда.
Анастомо́з артериа́льный внеор-га́нный (a. arterialis extraorganica) — А. а., соединяющий участки артерий, расположенные вне снабжаемого ими органа.
Анастомо́з артериа́льный внутриорга́нный (a. arterialis intraorganica) — А. а., соединяющий участки артерии внутри снабжаемого ею органа.
Анастомо́з артериа́льный внутрисисте́мный (a. arterialis intrasystemica) — А. а., соединяющий ветви одной магистральной артерии.
Анастомо́з артериа́льный межсис-те́мный (a. arterialis intersystemica) — А. а., соединяющий ветви разных магистральных артерий.
Анастомо́з артериовено́зный клу-бо́чковый (a. arteriovenosa glomeriformis LNH; син. гломус) — артериоловенулярный А. в виде клубка извитых сосудов, окруженного соединительной
Коллатеральное (окольное) кро-вообращение существует в физио-логических условиях при временных затруднениях кровотока по магистральной артерии (например, при сдавлении сосудов в местах движения, чаще всего в области суставов). В физиологических условиях колла-теральное кровообращение осуществляется по уже существующим сосудам, идущим параллельно основным. Эти сосуды называются коллатералями (например, a. collateralis ulnaris superior и др.), отсюда название кровотока — «коллатеральное кровообращение».
Коллатеральный кровоток может возникнуть и в патологических условиях — при закупорке (-окклюзии), частичном сужении (стенозе), повреждениях и перевязке сосудов. При затруднении или прекращении кровотока по основным сосудам кровь устремляется по ана-стомозам в ближайшие боковые ветви, которые расширяются, делаются извитыми и постепенно соединяются (анас-томозируют) с существующими коллатералями.
Таким образом, коллатерали существуют и в обычных условиях и могут развиваться вновь при наличии анастомозов. Следовательно, при расстройстве обычного кровообращения, вызванном препятствием на пути тока крови в данном сосуде, сначала включаются сущест-вующие обходные кровеносные пути, коллатерали, а затем развиваются новые. В результате кровь обходит участок с нарушением проходимости сосуда и кровообращение дистальнее этого участка восстанавливается.
Для понимания коллатерального кровообращения необходимо знать те анастомозы, которые соединяют между собой системы различных сосудов, по которым устанавливается коллатеральный ток крови в случае их ранения и перевязки или при развитии патологического процесса, ведущего к закупорке сосуда (тромбоз и эмболия).
"Микрохирургическая реваскуляризация
каротидного бассейна"
Глава 2
Анатомия, физиология и патофизиология окклюзирующих заболеваний ветвей дуги аорты
КОМПЕНСАЦИЯ КРОВООБРАЩЕНИЯ ПРИ ПОРАЖЕНИЯХ СОСУДОВ МОЗГА
Поражение одной или нескольких магистральных артерий мозга приводит к немедленному включению механизмов компенсации кровообращения. Во-первых, происходит увеличение притока крови по другим сосудам. Доказано, что при пережатии ОСА кровоток по противоположной сонной артерии увеличивается на 13-38%. Во-вторых, компенсация кровотока может быть достигнута увеличением минутного объема сердца.
Так, работами В.С. Работникова доказано, что у больных с окклюзирующими поражениями брахиоцефальных артерий отмечается ряд сдвигов в общей гемодинамике в виде увеличения объема циркулирующей крови (ОЦК), ударного индекса (УИ), минутного объема (МИ) за счет увеличения контрактильности желудочков.
Одним из важных факторов, обеспечивающих нормальное кровообращение головного мозга, является системное АД. Артериальная гипертензия, как приспособительная реакция организма, встречается у 20-30% больных с недостаточностью мозгового кровообращения. Кроме того, при изменении реактивности каротидного синуса (при атеросклерозе, артериите) включается его депрессорная функция, что также ведет к повышению АД.
Значительную роль в регуляции мозгового кровотока играет также содержание в крови углекислого газа (СО2). В артериальной крови всего лишь 1,3-1,7% вызывает расширение мозговых сосудов, тогда как для костно-мышечных сосудов пороговая величина Со2 крови равна 3%.
Работами Е.В. Шмидта, Bove были выявлены приспособительные изменения метаболизма в условиях ишемии (увеличение парциального давления СО2(Рсо2), снижение pH крови), которые направлены на уменьшение периферического сопротивления мозговых сосудов, улучшая этим мозговой кровоток. В то же время Holdt-Rasmussen установил, что у больных с нарушением мозгового кровообращения имеется извращенная реакция сосудов мозга на вдыхание СO2. Fieschi с помощью радиоактивного альбумина отметили, у части больных, отсутствие изменений мозгового кровотока при вдыхании СO2 с острыми нарушениями мозгового кровообращения.
Важнейшим фактором, определяющим компенсацию мозгового кровообращения при окклюзирующих поражениях брахиоцефальных артерий, является состояние коллатерального сосудистого русла, а точнее скорость его развития в момент мозговой катастрофы. Недостаточное его развитие приводит к нарушению мозгового кровообращения. При адекватном его состоянии клинические проявления окклюзирующих поражений брахиоцефальных артерий могут отсутствовать.
Процесс формирования коллатерального кровообращения имеет временные характеристики, и клинические проявления поражения магистральных артерий головного мозга будут зависеть в первую очередь от скорости формирования адекватного коллатерального кровообращения.
Уровень и степень эффективности коллатерального кровообращения зависят от ряда факторов. К ним относятся: состояние общей гемодинамики, темп развития и локализация окклюзирующего поражения, а также состояние сосудов, обеспечивающих коллатеральное кровообращение.
При поражении основного ствола магистральной артерии возникает компенсаторное расширение концевых ветвей в бассейне этой артерии, как в связи с возникновением перепада внутрисосудистого давления, так и в связи с падением напряжения О2 в ткани мозга, в результате чего нарушается аэробное окисление глюкозы и происходит накопление углекислоты и молочной кислоты.
Б.Н. Клосовский предложил различать 4 уровня коллатерального кровообращения головного мозга. Первый – уровень виллизиева круга, второй – уровень коллатерального кровообращения на поверхности мозга в субарахноидальном пространстве. В этих зонах сосредоточена основная масса наиболее крупных анастомозов между ветвями передней и средней, средней и задней, передней и задней мозговых артерий. Третьим уровнем коллатерального кровообращения являются анастомозы внутри какой-либо области, например полушарий головного мозга. Четвертый уровень – внутримозговая капиллярная сеть. Е.В. Шмидт, кроме того, различает внечерепной уровень коллатерального кровообращения за счет анастомозирования внутренней сонной артерии и позвоночной артерии с бассейном наружной сонной артерии.
Мы считаем достаточным для оценки кровообращения (магистрального, коллатерального и тканевого) подразделение на 2 уровня: первый – до уровня (и включая его) анатомически обусловленных и сформированных коллатералей (уровень виллизиева круга), второй – от уровня (исключая его) анатомически обусловленных и сформированных коллатералей. Принципиально это подразделение сходно с делением на проксимальное и дистальное поражение артерий.
Основным путем компенсации является кровоток через ПСА. В норме все три пути коллатерального кровообращения находятся между собой в гемодинамическом равновесии, дополняя и заменяя друг друга. При поражении ВСА в первую очередь включается противоположная ВСА через ПСА, которая участвует в формировании переднего отдела виллизиева круга. Уровень же кровотока по этой артерии в основном зависит от состояния контралатеральной (по отношению к пораженной) ВСА, как бы являясь пусковым механизмом для включения остальных путей. Так, при недостаточной степени развития перетока по передней соединительной артерии вследствие недоразвития ее, атеросклеротического поражения либо при поражении контралатеральной ВСА развивается коллатеральное кровообращение через глазничный анастомоз из системы ипси- или контралатеральной сонной артерии, и/или развивается коллатеральное кровообращение через ЗСА.
При окклюзирующем поражении ВСА анатомическое строение виллизиева круга имеет важное значение в осуществлении всех видов компенсации кровообращения. Однако не меньшее значение имеет функциональное состояние всех отделов виллизиева круга.
Окклюзия артерии, ее стеноз или извитость вызывают развитие коллатерального кровотока, обусловленное в первую очередь падением в той или иной степени перфузионного давления дистальнее места поражения. При этом степень компенсации может быть различной, и в достаточно большом количестве случаев (до 25-35%) перфузионное давление в дистальных отделах приближается или доходит до нормы (например наличие антеградного кровотока по глазничному анастомозу при изолированной окклюзии внутренней сонной артерии). Однако это не означает полной компенсации кровообращения. Так как мозгу в ряде случаев, для нормального функционирования необходимо увеличение общего мозгового кровотока на 40-60% другим важнейшим показателем будет являться потенциальная возможность компенсации увеличения потребляемой крови. Другими словами, двумя основными показателями степени компенсации мозгового кровотока будут уровень кровотока в покое и степень увеличения кровотока при дозированной нагрузке (функциональной пробе) по отношению к уровню кровотока в покое.
Сочетание различных по гемодинамической значимости поражений магистральных артерий головного мозга не означает простое суммирование этих величин. Суммарный дефицит мозгового кровотока зависит не только от объема поражения, но и от состояния гомеостаза пациента. Большую роль в нарушении кровотока играет так же и взаимовлияние поражений. Гораздо проще объяснить это взаимовлияние на некоторых примерах. У больного Х., ранее полностью асимптомного неврологически с незначительными стенозами ("гемодинамически незначимыми") обеих сонных артерий, после обнаружения патологии и назначения лечения (аспирин) развивается ишемический инсульт. На первый взгляд механизм развития инсульта непонятен. Однако с точка зрения гемодинамики произошло следующее – до назначения лечения у больного была относительно высокая вязкость крови. Число Рейнольдса (определяющее переход ламинарного потока крови в турбулентный) обратно пропорциональное вязкости крови, было низким, и в участке стеноза процент турбулентности был незначительный. Следовательно в этот период сонные артерии обеспечивали и достаточный кровоток, и достаточную потенциальную возможность увеличения кровотока (реактивность). Уменьшение вязкости крови повлекло за собой снижение объемного кровотока по сонным артериям за счет формирования высокотурбулентного потока дистальнее стеноза. Срыв кровотока по одной сонной артерии вызывает компенсаторное увеличение системного давления и увеличение объемного кровотока по противоположной сонной артерии, что влечет за собой аналогичное ограничение кровотока.
Необходимо отдельно остановиться на наружной сонной артерии, определить ее гемодинамическую роль в кровоснабжении головного мозга при окклюзиях ВСА, как источника коллатерального кровообращения.
В норме НСА в кровоснабжении головного мозга участия не принимает, но при окклюзии внутренних сонных артерий в мозговое кровоснабжение включается разветвленная коллатеральная сеть ветвей НСА, анастомозирующих с интракраниальными ветвями внутренних сонных и позвоночных артерий.
При анализе частоты окклюзионных поражений ветвей дуги аорты было обнаружено, что чаше всего поражается бифуркация обшей и проксимальный отдел внутренней сонных артерий. Рост атеросклеротической бляшки приводит к окклюзии (в 9-34% случаев окклюзионных поражений ветвей дуги аорты) внутренней и (в 3-6% случаев) общей сонных артерий. НСА поражается значительно реже, чем ВСА. Гемодинамически значимое поражение НСА при окклюзии ВСА встречается в 26,9-52,2%. По нашим данным у 36.8% пациентов при окклюзии ВСА имеется гемодинамически значимый стеноз наружной сонной артерии.
Ряд авторов утверждают, что роль НСА в осуществлении интракраниального кровообращения сомнительна, но большая группа специалистов, такие как, Ю.Л. Грозовский, F.F. Barnett, A.D. Callow и др. отмечают важную роль НСА в мозговой гемодинамике при окклюзии ВСА. По мнению Fields W.S. (1976), F.F. Barnett (1978), McGuiness (1988), при окклюзии внутренних сонных артерий НСА берет на себя до 30% мозгового кровотока . Восстановление адекватного, магистрального кровотока по НСА при ее стенозе или окклюзии ОСА и ВСА у больных с сосудисто-мозговой недостаточностью приводит к улучшению кровоснабжения мозга через системные анастомозы, что в свою очередь приводит к снижению проявлений нарушения мозгового кровообращения.
Однако настоящая работа не ставит целью показать значимость НСА в мозговой гемодинамике. Наружная сонная артерия нами рассматривается как донорская для формирования ЭИКМА. Состояние НСА обусловливает адекватность микроанастомоза. В зависимости от степени сужения различают три вида поражения НСА (рис. 9):
- отсутствие поражения НСА,
- стеноз НСА,
- окклюзия устья НСА при окклюзии ОСА и ВСА.
Состояние НСА определяется при помощи ультразвуковых методов исследования, дуплексного сканирования и рентгеноконтрастной ангиографии. В протокол обследования больных в обязательном порядке включено измерение артериального давления в височных артериях. Данное исследование высокоинформативно и у больных со стенозом НСА является основным для определения показаний к этапности к оперативным вмешательствам.
Особый интерес представляет ситуация когда окклюзированы как ВСА, так и ОСА – соответственно прекращается магистральный кровоток и по НСА. У этих больных возможна реваскуляризация мозга с использованием длинных шунтов – подключично-корковое шунтирование почти в 100% случаев закончились тромбозом шунта.
Сохранение проходимости НСА за ее первой ветвью позволило использовать ветви НСА в качестве донора после восстановления магистрального кровотока путем подключично-НСА протезирования.
При окклюзии ВСА и ОСА НСА остается проходимой дистальнее первой ветви, сохраняется циркуляция крови по анастомозам между ветвями НСА, что препятствует распространению тромбоза.
Подключично-наружно сонное шунтирование или протезирование создает следующую гемодинамическую ситуацию: кровь из шунта сбрасывается в НСА где распределяется между ее ветвями, за счет высокой возможности принять кровь увеличивается объемный поток крови по шунту, что является профилактикой его тромбоза.
При окклюзии ВСА причиной повторных нарушений мозгового кровообращения могут быть как гемодинамические факторы, обусловленные самой окклюзией ВСА, стенозом НСА, так и эмбологенные, причиной которых могут быть микроэмболии с изъязвленных бляшек в НСА или из культи ВСА.
Ringelstein E.B. с соавторами показали, что у больных с окклюзией ВСА повторные нарушения мозгового кровообращения были обусловлены в 41% случаев гемодинамическими факторами, в 40% – эмбологенными и в 19% случаев носили смешанный характер.
Первые операции на НСА начались в 60-х годах. Факт, что при выполнении эндартерэктомии (ЭАЭ) из НСА производят резекцию культи ВСА, то есть устраняют источник микроэмболий.
Для выявления градиента давления между ветвями НСА – донорскими артериями и интаркраниальными ветвями ВСА, в частности корковыми ветвями СМА, нами применен метод измерения АД в поверхностной височной артерии с помощью оригинальной манжетки и определения давления в центральной артерии сетчатки как характеристики давления в СМА и ее ветвях.
По мере деления СМА давление в ее концевых артериях должно несколько снижаться, иначе не было бы кровотока по градиенту давления и работы потока крови против сил гравитации. Этот фактор полезен, так как уменьшает давление в артерии реципиенте. Теменная и височная артерия, которые могут использоваться в качестве донорских артерий, являются ветвями НСА 2-го порядка, следовательно, падение давления в них будет меньше, чем в корковых ветвях СМА, являющихся артериями 3-го порядка. То есть создаются оптимальные гемодинамические условия, необходимые для работы ЭИКМА.
Коллатеральное кровообращение. Коллатеральный кровоток. Коллатерали. Анастомозы.
Автор: Цапаева Н.Л., руководитель группы гемореологии и микроциркуляции БелНИИ кардиологии, д.м.н., член Европейского общества кардиологов
Так от чего все-таки зависит течение ИБС?
Однако в человеческом организме, как биологическом объекте высшего порядка, имеется огромный резервный потенциал, который включается на любой патологический процесс. При стенозирующем атеросклерозе коронарных артерий основным механизмом компенсации является коллатеральное кровообращение, которое берет на себя функцию кровоснабжения сердечной мышцы в бассейне пораженной артерии.
Что же такое коллатеральное кровообращение?
Научное предположение о компенсаторных возможностях сосудистой системы при коронарной недостаточности имеет почти двухсотлетнюю историю. Первые сведения о наличии коллатералей получены A.Scarpa в 1813 году, но лишь диссертационная работа русского хирурга и исследователя Н.И.Пирогова положила начало учению о коллатеральном кровообращении. Однако от проведенных многочисленных патологоанатомических исследований до современного понимания механизма развития коллатеральных путей кровообращения прошла целая эпоха.
Коронарное русло, обеспечивающее жизнеспособность миокарда, состоит из левой и правой коронарных артерий. Бассейн левой коронарной артерии представлен передней межжелудочковой, огибающей и диагональной артериями. Когда речь идет о коронарном атеросклерозе, в большинстве случаев стенозирующий процесс развивается именно здесь — в одной или в нескольких артериях.
Кроме крупных магистральных артерий в сердце имеются сосудистые образования — коронарные анастомозы, пронизывающие все слои миокарда и соединяющие артерии между собой., Диаметр коронарных анастомозов невелик, от 40 до 1000 мкм. В здоровом сердце они находятся в "дремлющем" состоянии, представляют собой слаборазвитые сосуды и функциональное значение их невелико. Но нетрудно представить, что будет происходить с этими сосудами, когда магистральный кровоток встретит препятствие на своем привычном маршруте. В детстве все, наверное, любили наблюдать за ручьем после дождя: стоит перегородить его камнем или щепочкой, как вода тут же начинает искать новые ходы, пробивает их там, где "нащупает" малейший уклон, обходит препятствие и вновь возвращается в родное русло. Можно сказать: запруда заставила ручей искать свои коллатерали.
Немалое значение в поддержании коллатерального кровообращения имеют внутристенные анастомозы: тебезиевы сосуды и синусоидальные пространства. Они находятся в миокарде и открываются в полость сердца. Роль тебезиевых сосудов и синусоидальных пространств как источников коллатерального кровообращения в последнее время интенсивно изучается в связи с внедрением в клиническую практику трансмиокардиальной лазерной реваскуляризации у больных с множественным поражением коронарного русла.
Существуют внесердечные анастомозы — анатомические связи артерий сердца с артериями перикарда, средостения, диафрагмы, бронхиальными. У каждого человека они имеют свою неповторимую структуру, что и объясняет индивидуальный уровень защиты миокарда при различных воздействиях на сердечно-сосудистую систему.
Врожденная несостоятельность коронарных анастомозов может быть причиной ишемии миокарда без видимых изменений в магистральных коронарных артериях. Кроме анастомозов, имеющихся в сердце от рождения, выделяют коллатеральные связи, образующиеся при появлении и прогрессировании коронарного атеросклероза. Именно эти, вновь образованные артериальные сосуды представляют собой истинные колла-терали. От скорости их образования и функциональной состоятельности часто зависит судьба больного ишемической болезнью сердца, течение и исход ИБС.
Острая окклюзия коронарных артерий (прекращение кровотока из-за тромбирования, полного стенозирования или спазма) сопровождается появлением коллатеральных путей кровообращения в 80% случаев. При медленно развивающемся процессе стенозирования окольные пути кровотока выявляются в 100% наблюдений. Но для прогноза заболевания очень важен вопрос, насколько эффективны эти обходные пути.
Гемодинамически значимыми являются коллатерали, отходящие от неповрежденных коронарных артерий, а при наличии окклюзии — развившиеся выше стенозированного участка. Однако на практике формирование коллатералей выше стенотического участка встречается только у 20—30% больных ИБС. В остальных случаях окольные пути кровотока формируются на уровне дистальных (конечных) ветвей коронарных артерий. Таким образом, у большинства больных ИБС возможность миокарда противостоять атеросклеротическому поражению коронарных артерий и компенсировать физические и эмоциональные нагрузки обусловлены адекватностью дистального кровоснабжения. Развивающиеся в процессе прогрессирования коллатерали бывают иногда настолько эффективными, что человек переносит достаточно большие нагрузки, не предполагая о наличии поражения коронарных артерий. Это объясняет те случаи, когда инфаркт миокарда развивается у человека без предшествующих клинических симптомов стенокардии.
Этот краткий и, может быть, не совсем простой для восприятия обзор анатомо-функциональных особенностей кровоснабжения мышцы сердца — основного "насосного" органа, обеспечивающего жизнь организма, — представлен вниманию читателей не случайно. Для того чтобы активно противостоять ИБС, заболеванию "номер один" в печальной статистике смертности, необходима определенная медицинская информированность и абсолютная настроенность каждого человека на длительную борьбу с таким коварным и сильным противником, как атеросклероз. В предыдущих номерах журнала были подробно представлены необходимые методы обследования потенциального пациента с ИБС. Тем не менее представляется целесообразным напомнить, что лица мужского пола старше 40 лет и женщины в возрасте 45—50 лет должны проявить свою заинтересованность и настойчивость в проведении кардиологического обследования.
Алгоритм прост, при желании доступен и включает следующие диагностические методы :
- исследование липидного обмена (определение таких факторов риска, как гиперхолестеринемия и гипертриглицеридемия — о них шла речь в "ЗиУ" № 11 /2000г.);
- исследование микроциркуляции, позволяющей неинвазивным методом выявить ранние признаки поражения сердечно-сосудистой системы и косвенно оценить состояние коллатералей. (Об этом читайте в "ЗиУ" № 12/2000г.)
- определение коронарного резерва и выявление признаков ишемии миокарда на физической нагрузке. (Функциональные методы обследования должны обязательно включать проведение велоэргометрической пробы под ЭКГ-контролем)
- эхокардиографическое обследование (оценка внутрисердечной гемодинамики, наличие атеросклеротического поражения аорты и миокарда).
Результаты такого диагностического комплекса позволят с высокой степенью достоверности выявить ИБС и наметить тактику дальнейшего обследования и своевременного лечения. Если у вас уже имеется, возможно, не совсем "внятная" симптоматика в виде боли, неприятных ощущений или дискомфорта с локализацией за грудиной и иррадиацией в шею, нижнюю челюсть, в левую руку, которая бывает связана с физической и эмоциональной нагрузкой; если в вашей семье ближайшие родственники страдают ИБС или наследственной гиперхолестеринемией, кардиологическое обследование в указанном объеме должно быть проведено в любом возрасте.
Конечно, самым достоверным методом выявления поражения коронарного русла является коронарография. Она позволяет определить степень и протяженность атеросклеротического поражения артерий, оценить состояние коллатерального кровообращения и, самое главное, наметить оптимальную тактику лечения. Показания к проведению этой диагностической процедуры определяет кардиолог при наличии признаков ИБС. Это обследование для белорусских жителей малодоступно, проводится лишь в нескольких специализированных центрах Минска и Гомеля. В какой-то степени это объясняет позднее проведение коронарографии, в связи с чем на хирургическую реваскуляризацию миокарда в нашей стране, как правило, направляются больные ИБС с "тяжелым" классом стенокардии, часто имеющие в анамнезе инфаркты миокарда, в то время как в странах Западной Европы и США коронарография проводится после первой "коронарной атаки", документированной при проведении велоэргометрии. Однако возможность проведения коронарографии у нас в стране имеется и при показаниях она должна своевременно выполняться.
Арсенал лечебных воздействий и медицинских технологий у современной белорусской кардиологии достаточен, чтобы оказать адекватную помощь больному ИБС. Это классическая кардиохирургия — операции аортокорс нарного шунтирования как в условиях искусственного кровообращения, так и на "работающем" сердце. Это миниинвазивная кардиохирургия — баллонная дилатация (расширение) пораженного участка коронарной артерии с установкой специального устройства — стента, для повышения эффективности процедуры. Это трансмиокардиальная лазерная реваскуляризация миокарда, о которой упоминалось выше. Это медикаментозные схемы лечения с применением пентоксифиллина (трентал, агапурин) и немедикаментозные технологии, такие как селективный плазмаферез и низкоинтенсивная инфракрасная лазеротерапия. Они являются технологиями выбора у пациентов, которым по ряду причин не может проводиться хирургическая коррекция атеросклеротического поражения коронарного русла.
Эффективность сосудистых анастомозов в стимулировании коллатерального кровотока
Несмотря на достигнутые значимые успехи в сосудистой реконструктивной хирургии как за счет открытых операций, так и за счет эндоваскулярных методик, ограничивает дальнейший прогресс данной области медицины состояние "дистального русла", под которым понимается окклюзия артерий голени. У 25-30 % пациентов причиной критической ишемии является изолированное поражение артерий голени (в большинстве случаев всех трех артерий) [3]. Только 23-57 % из них удается выполнить реваскуляризацию, 16 % сразу производят первичную ампутацию на уровне бедра. 25 % больным с данной патологией выполняют усечение конечности, не смотря на попытки реваскуляризации [4]. При этом выполнение первичных высоких ампутаций сопровождается высокой смертностью, достигая 21-44 % [2]. Одной из альтернатив в лечении пациентов с такой тяжелой патологией являются методы, стимулирующие развитие коллатерального кровотока. Однако, не смотря на большое разнообразие в данной сфере, эффективность этих методик не превышает 20%, что подводит нас к поиску новых методов.
Цель исследования. Оценить эффективность артериовенозных анастомозов сосудов голени в стимуляции коллатерального кровообращения.
Материал и методы. Анастомоз между передней большеберцовой артерией (ПББА) и одноименной веной (ПББВ) был выполнен 27 пациентам (21 мужчин и 6 женщин, средний возраст - 63 года) с атеросклеротической окклюзией двух артерий голени, что клинически проявлялось в виде 3 степени хронической ишемии нижних конечностей по А.В. Покровскому у 20 человек и у 7 были акральные сухие некрозы дистальных фаланг пальцев стоп (4 стадия хронической ишемии).
Оперативное вмешательство, имеющее своей целью улучшение артериального коллатерального кровотока, в виде создания анастомоза между задней большеберцовой артерией (ЗББА) и веной (ЗББВ) было выполнено 39 пациентам с атеросклеротической окклюзией двух артерий голени, что клинически проявлялось в виде 3 степени хронической ишемии нижних конечностей по А.В. Покровскому у 28 человек и у 7 были акральные сухие некрозы дистальных фаланг пальцев стоп и у 4 пациентов с распространением сухой гангрены на плюсневый отдел стопы (4 стадия хронической ишемии).
Показания к операции. Для определения показаний к выполнению межберцового сосудистого анастомоза (МБА) руководствовались данными, полученными инструментальными методами диагностики, и в первую очередь, ультразвуковым дуплексным ангиосканированием (УЗДС).
В большинстве своем для определения и постановки показаний к межберцовым анастомозам пользовались стандартной методикой УЗДС, в редких случаях рентгенконтрастной ангиографией. При этом основной упор делали на состояние артерий голени. Все пациенты, которые попали в эту группу были безнадежны в плане открытой реконструктивной операции, так как у них отсутствовали пути оттока, а именно наблюдалась окклюзия двух или трех артерий голени. Соответственно всем канонам сосудистой хирургии данная ситуация является противопоказанием к оперативному лечению. Но что касается МБА, то эта ситуация как раз таки и будет показанием к выполнению данного хирургического пособия. Единственное дополнительное условие - наличие коллатерального кровотока в артериях голени на уровне голеностопного сустава, где и будет выполнятся само оперативное вмешательство. Причем достаточно даже минимального коллатерального шума.
Что касается хронической ишемии 4 стадии по А.В. Покровскому с наличием трофических нарушений, то здесь дело обстоит не однозначно. После проведенного исследования, считаем, что распространение гнойно-некротического поражения за пределы пальцев стопы является противопоказанием к выполнению сосудистого анастомоза. Объясняется это тем, что после реконструктивной операции на артериях, для полного восстановления трофики, за которую отвечает микроциркуляторное звено, требуется в среднем 21-30 суток. За это время гнойно-некротический процесс распространяется проксимально и, зачастую, оказывается в опасной близости от послеоперационной раны.
Суммируя вышесказанное, показаниями к выполнению оперативного вмешательства в виде сосудистого анастомоза между артерией и сопровождающей ее веной на голени можно считать:
- наличие окклюзии двух или трех артерий голени по данным ультразвукового дуплексного ангиосканирования;
- сохраненный коллатеральный кровоток на оперируемом сосуде в нижней трети голени (любой выраженности) по данным УЗДС;
- хроническая ишемия 4 стадии по А.В. Покровскому с наличием гнойно-некротических поражений, не выходящих за пределы пальцев стопы.
Техника выполнения оперативных вмешательств была стандартной. Доступы в проекции сосудистого пучка в нижней трети голени. Далее выделение сосудов, артериотомия и венотомия на протяжении 15-20 мм с наложением типичного анастомоза по типу бок-в-бок (рис. 1).
Для оценки полученных результатов пользовались методом полярографии, а так же лазерной допплеровской визуализации по предложенной нами методике [1].
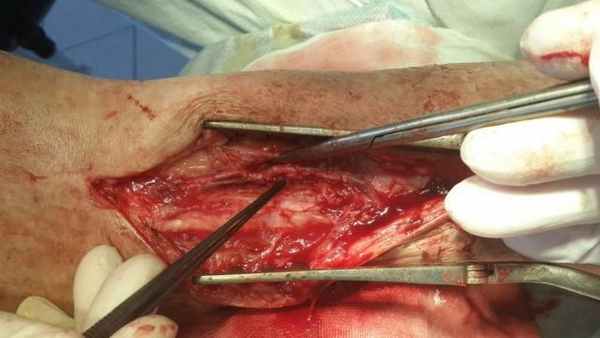
Рис.1. Сформированный анастомоз.
Послеоперационный период. Тактика ведения и результаты. В послеоперационном периоде пациенты находились в стационаре 30 суток с целью облегчить наблюдение за ними. Все они получали антикоагулянтую терапию: нефракционированнный гепарин 5000 ЕД 4 раза в сутки подкожно, либо низкомолекулярный гепарин (клексан) 0,4 1 раз в сутки подкожно и антиагрегантную терапию - тромбо АСС 100 мг в сутки, целью которой была профилактика тромбоза зоны анастомоза. Антикоагулянты отменяли через 10 суток. Так же в течение 14 суток назначали антибиотик широкого спектра действия так, как оперативное вмешательство проходило в ишемизированной зоне.
Контролировали проходимость анастомоза и изменения артериального кровотока нижних конечностей на 15 и 30 сутки послеоперационного периода с помощью УЗДС. В нескольких случаях выполняли с этой целью выполняли мультиспиральную компьютерную томографию. В те же самые сроки выполняли исследование микроциркуляции нижних конечностей путем лазерной допплеровской визуализации в ангиосомах голени и стопы, и дополняли данными индекса регионарной перфузии (ИРП) в первом межпальцевом промежутке, полученными путем проведения транскутанной оксиметрии (tpO2).
Показатели микроциркуляции представлены в табл.1.
Таблица 1. Уровень микроциркуляции ангиосом после создания анастомоза между ПББА и ПББВ
Из полученных результатов следует, что улучшение показателей микроциркуляции в кожных покровах наблюдалось в тех ангиосомах, кровоснабжение которых осуществляется за счет передней большеберцовой артерии и артерии тыла стопы, как ее продолжения. Несмотря на большое количество анастомозов между соседними ангиосомами, микроциркуляция в последних не имела тенденции к возрастанию. Можно сделать вывод, что анастомозов второго типа явно недостаточно, даже после подключения к ним анастомозов первого типа, часть из которых увеличивается в размерах из-за возросшего объемного и линейного кровотока. Для подтверждения достоверности данных, полученных с помощью метода лазерной допплеровской визуализации, проводили измерения в тех же самых условиях с помощью полярографии с индексом регионарной перфузии и стандартной контрольной точкой в области передней поверхности грудной стенки. При этом данные, говорящие о напряжении кислорода в тканях, были идентичны результатам, полученным с помощью метода лазерной допплеровской визуализации (табл. 2).
Таблица 2. Уровень микроциркуляции ангиосом после создания анастомоза между ЗББА и ЗББВ
Микроциркуляция в кожных покровах увеличилась в 3-5 раз по сравнению с исходными показателями и достигла 70 % от нормы в тех ангиосомах, за кровоснабжение которых компетентны задняя большеберцовая артерия и подошвенные артерии как ее продолжение. Ситуация в отношении микроциркуляции соседних ангиосом различается от перфузии кожи после создания анастомоза между ПББА и ПББВ. А, именно, значимо увеличилась микроциркуляция кожи в ангиосоме малоберцовой артерии. Вероятно, это связано с наличием относительно большого количества анастомозов первого типа в трехглавой мышце голени, в толще которой и проходит граница между указанными ангиосомами.
Улучшение коллатерального кровообращения голени и микроциркуляции после создания артерио-венозных анастомозов позволило в отсроченном периоде (через 30 суток) произвести малые ампутации на стопе у пациентов с гангреной пальцев с хорошим результатом, выражавшемся в первичном заживлении в 85 % случаев.
У всех пациентов, которым был выполнен анастомоз между ЗББА и ЗББВ на фоне сухой гангрены плюсневого отдела стопы, в том числе и после малых ампутаций на стопе, гнойно-некротический процесс распространился проксимально, вплоть до зоны оперативного вмешательства, в сроки на 14-20 сутки послеоперационного периода. В связи, с чем всем им была выполнена ампутация голени в верхней трети.
Отдаленные результаты. Дозирование физической нагрузки в комплексном подходе после сосудистого анастомоза.
Через 3 и 6 месяцев после создания артериовенозного анастомоза между ПББА и ПББВ на обследование явились 24 и 23 человека, соответственно. Из них 9 человек не выполняли рекомендации по ходьбе, данные им, что и позволило организовать контрольную группу сравнения. Для получения статистически достоверных результатов методика обследования осталось неизменной и ее результаты представлены в таблице (табл. 3).
Таблица 3. Отдаленные результаты без физической нагрузки после создания анастомоза между ПББА и ПББВ
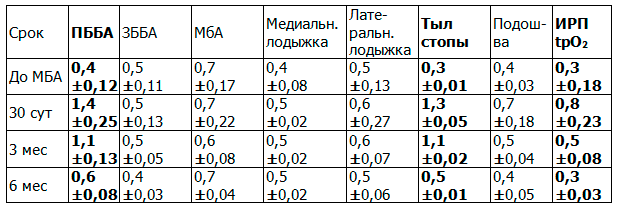
Полученные результаты свидетельствуют о том, что несмотря на возросший за счет создания артерио-венозного анастомоза кровоток, к 6 месяцу наблюдений микроциркуляция в коже практически вернулась к исходным показателям с превышением последних на 20 %. Данный спад наблюдался начиная с 3 месяца послеоперационного периода, когда микроциркуляция кожи ангиосом передней большеберцовой артерии и тыльной артерии стопы уменьшилась на 30 %. При этом перфузия в тех ангиосомах, кровоток в которых не был затронут после оперативного вмешательства осталась на изначальном уровне. Данные изменения укладываются в принятую в последние годы концепцию артериогенеза, в которой к основному стимулу развития коллатерального русла относят увеличение напряжения сдвига на стенку предсуществующих артериол. После достижения пика развития коллатерального русла (на 30 сутки), за счет компенсации артериального кровотока по нему, выравнивается внутрисосудистое давление. В связи с этим повышенный уровень напряжения сдвига возвращается к нормальным показателям и артериогенез на этом прекращается. Некоторый промежуток времени (1-2 месяца), развитая артериальная коллатеральная сеть остается без изменений. Однако, при отсутствии физической нагрузки 80-90 % капилляров в мышечной ткани находятся в закрытом состоянии, в следствие чего кровоток уменьшается не только в них, но и в предшествующих артериолах. Все эти изменения приводят к значимому падению напряжения сдвига и, как следствие, к запустению и дальнейшей облитерации большей части коллатералей.
Пациенты, строго соблюдавшие рекомендации по ходьбе, составили группу сравнения, коих было 13 и 12 человек через 3 и 6 месяцев, соответственно. Результаты перфузии кожи, измеренные методом лазерной допплеровской визуализации, с учетом ангиосомного подхода представлены ниже (табл. 4).
Таблица 4. Отдаленные результаты после ходьбы у пациентов после выполнения анастомоза между ПББА и ПББВ
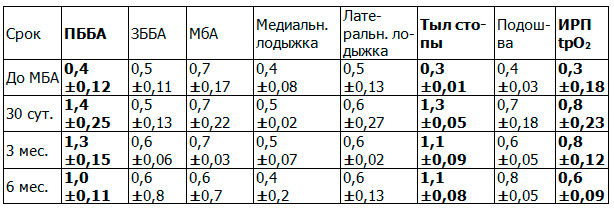
Результаты микроциркуляции в коже у пациентов, ежедневно соблюдавших рекомендации по дозированной физической нагрузке спустя 6 месяцев остались на 70 % от максимального уровня, достигнутого на 30 сутки послеоперационного периода в ангиосомах передней большеберцовой артерии и тыла стопы. Перфузия кожных покровов других ангиосом осталась либо на прежнем уровне, либо незначительно возросла.
Через 3 и 6 месяцев после выполнения анастомоза между ЗББА и ЗББВ удалось отследить результаты проведенного лечения у 34 и 31 пациента, соответственно. Из них 11 человек приняли самостоятельное решение не следовать рекомендациям в плане ежедневной ходьбы. В свою очередь, мы приняли решение включить их в контрольную группу, результаты исследования индекса региональной перфузии кожных покровов которой выглядят следующим образом (табл.5).
Таблица 5. Отдаленные результаты без ходьбы после выполнения анастомоза между ЗББА и ЗББВ
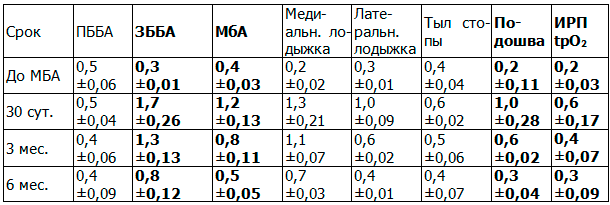
Микроциркуляция в коже ангиосом задней поверхности голени и подошвенной поверхности стопы спустя 6 месяцев после анастомоза между ЗББА и ЗББВ в нижней трети голени уменьшилась на 65-70 %. Снижение на 23-28 % наблюдалось нами уже к 3 месяцу наблюдений. Полученные результаты аналогичны таковым, наблюдаемым спустя 3 и 6 месяцев после анастомоза между ПББА и ПББВ для соответствующих ангиосом. Интересным дополнением к этому являются показатели микроциркуляции ангиосома малоберцовой артерии, питающегося за счет коллатералей в трехглавой мышце голени, в отдаленный период до 6 месяцев. В данной зоне наблюдалось аналогичное падение микроциркуляции, что говорит об универсальности влияния напряжения сдвига на сосудистое русло, одинаково распространяющееся и на приносящие артериолы, вновь развитые коллатерали и на артериовенозные анастомозы.
Пациенты, ежедневно проходившие по несколько километров на протяжении 3 и 6 месяцев, попали в исследуемую группу по 23 и 20 человек, соответственно. Используя разработанную методику определения индекса региональной перфузии с помощью лазерной допплеровской визуализации были получены указанные ниже результаты (табл.6).
Таблица 6. Отдаленные результаты после ходьбы у пациентов с анастомозом между ЗББА и ЗББВ
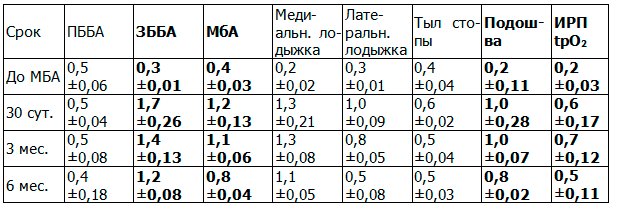
Подключение дозированной физической нагрузки положительно влияет на коллатеральный кровоток после выполнения анастомоза между одноименными сосудами голени. Результаты микроциркуляции сопоставимы после операций на ПББА и ПББВ с показателями спустя 3 и 6 мес после создания соустья меду ЗББА и ЗББВ. Это свидетельствует об общности законов физиологии коллатерального кровообращения, независимо от анатомических особенностей строения артерий голени и стопы.
Заключение. Артериовенозные анастомозы при протяженных окклюзиях артерий голени позволяют улучшить микроциркуляцию кожи голени и стопы в зоне оперированной артерии в 3,5 - 5 раз (0,7 от нормы) на 30-е сутки послеоперационного периода. Однако, данное оперативное пособие, применяемое для стимуляции коллатерального кровотока само по себе не позволяет достичь долгосрочного эффекта: возвращение к исходным показателям к 6 месяцу наблюдения. Дозированная физическая нагрузка (ходьба) способствует пролонгации достигнутого уровня микроциркуляции, который к 6 месяцу сохраняется на 50-70% от максимального значения (30 сутки).
Читайте также:
