Колонии фибробластов костного мозга. Функции фибробластов костного мозга
Добавил пользователь Дмитрий К. Обновлено: 25.01.2026
Колонии фибробластов костного мозга. Функции фибробластов костного мозга
Колонии фибробластов костного мозга относятся к медленно пролиферирующим клеткам. Находясь в составе костного мозга 6- и 14-дневных морских свинок, лишь 15 и 2% из них метятся 3Н-тимидином за 72 часа. У взрослых животных все стромальные предшественники остаются немеченными и не погибают в результате самоубийства при инкубации с 3H-тимидином высокой удельной активности.
В этом отношении они четко отличаются от кроветворных клеток, лимфоцитов и предшественников макрофагов. Содержание колоний фибробластов в кроветворных органах с возрастом характерным образом изменяется.
Клоногенные предшественники фибробластов присутствуют в относительно большой концентрации среди клеток брюшной и плевральной полостей. Их число (на 10s клеток) составляет в первой около 8, а во второй — около 27.
Колонии фибробластов костного мозга и тимуса относятся к категории быстро прилипающих к поверхности стекла клеток. В отсутствие сыворотки время, нужное для прикрепления 90% колоний фибробластов, составляет 90 мин, причем большинство из них прикрепляется к стеклу уже в первые 30 мин (Friedenstein, 1973). Потомки колоний фибробластов активно синтезируют коллаген. Это относится к колониям фибробластов костного мозга, селезенки и тимуса.
Данные о радиочувствительности стромальных - клеток-предшественников, полученные разными методами, практически совпадают. Радиочувствительность колоний фибробластов костного мозга и селезенки морских свинок, которая определялась по степени подавления колониеобразования после облучения клеток in vitro, характеризуется величиной Д0= 178 Р и п=1,4 (Friedenstein, 1973). Сходную радиочувствительность обнаруживают и КОКФ костного мозга человека. Радиочувствительность КОКФ костного мозга мышей характеризуется Д0 порядка 220 Р. Такая же величина Д0 была получена для клеток из плевральной полости мышей, образующих колонии фибробластов в агаровых культурах.
Методом клонирования стромальных клеток-предшественников in vitro было показано, что число колонии фибробластов резко возрастает в регионарном лимфоузле после первичного введения антигена: в 30 раз через одни сутки, в 40 раз — через 7 сут; через месяц оно возвращается к исходном) уровню. В контррегионарном узле также происходит увеличение числа колоний фибробластов, но оно менее выражено и наступает позже. При повторном ответе число колоний фибробластов растет быстрее и более резко.
Эти изменения не свидетельствуют еще, конечно, о том, что стромальные клетки лимфоузлов распознают антигены и сохраняют иммунологическую память. Реакции стромальной ткани могут быть результатом воздействия на нее иммуиологически компетентных клеток, распознающих антиген, которые, как известно, выделяют при этом целую гамму веществ, действующих на соседние клетки.
Приведенные сдвиги в численности колоний фибробластов показывают, что в клеточной популяции, населяющей лимфоидные органы, число колоний фибробластов может, очевидно, увеличиваться не только путем размножения самих колоний фибробластов, но и иным путем, а именно благодаря их дополнительному рекрутированию за счет приобретения колониеобразующих свойств теми клетками, которые в предшествующий момент ими не обладали, или (что менее вероятно) за счет репопуляции колоний фибробластов.
Заслуживают также внимания сведения об изменении числа колоний фибробластов в брюшной полости при образовании в ней воспалительного экссудата. Введение внутрибрюшинно тиогликогенного бульона вызывает у молодых свинок, кроме резкого увеличения числа макрофагов, также и нарастание числа клоногенных предшественников фибробластов. Через три дня общее содержание колоний фибробластов среди клеток перитонеального экссудата увеличивается в 10 раз, а их концентрация — в 20 раз. Таким образом, в ряде случаев, в том числе при иммунном ответе, удается показать, что перестройка лимфоидной ткани сопровождается изменениями численности содержащихся в ней стромальных клеток-предшественников.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Воспаление приводит к формированию фиброзных рубцов в ЦНС

Фиброзные рубцы, развивающиеся вследствие воспаления, — хорошо известное явление в периферических тканях, но роль его в ЦНС остается малоизученной. Результаты нового исследования, проведенного на модели рассеянного склероза (РС), свидетельствуют, что локальная пролиферация фибробластов в ЦНС в ответ на инфильтрацию циркулирующими воспалительными клетками приводит к образованию фиброзных рубцов, что может ограничивать восстановление нервной ткани.
Все больше растет понимание того, что инфильтрация периферических иммунных клеток в паренхиму ЦНС может иметь пагубные последствия при аутоиммунных заболеваниях, а также при таких патологиях, как ишемический инсульт, травматические повреждения и нейродегенеративные заболевания [1, 2].
Важным и общеизвестным следствием такого воспаления в других органах по всему телу является пролиферация стромальных клеток фибробластного происхождения, что приводит к образованию рубцов и фиброзу вследствие накопления белков внеклеточного матрикса, таких как коллагены [3, 4]. Механизмы, лежащие в основе фиброзного рубцевания, и его последствия хорошо изучены на примере многих тканей (не в ЦНС), и уже превратились в терапевтические цели при заболеваниях легких, сердца и суставов [5, 6]. Несмотря на то, что известно, что фиброзные рубцы образуются в эпицентре повреждений, вызванных травмой спинного мозга и инсультом [2, 7], существует относительно немного сведений о рубцевании стромальными клетками и последствиях этого процесса для ЦНС или о том, как взаимосвязаны воспаление и фиброз при патологиях ЦНС. При аутоиммунных заболеваниях, таких как РС, и в модели РС у грызунов, экспериментальном аутоиммунном энцефаломиелите (ЭАЭ), удалось различить фиброзные процессы (в форме отложения коллагена и других молекул внеклеточного матрикса), сопутствующие воспалению [8], но онтогенетическое происхождение и эффекты этого фиброза изучены недостаточно.
В новом исследовании, опубликованном в «Nature Neuroscience», проведенном Dorrier с соавт., ученые определили в качестве основного источника коллагена при фиброзировании резидентные для ЦНС локальные фибробласты при поражении ЭАЭ спинного мозга [9]. Генетически ориентированная профилактика этого фиброза, опосредованного фибробластами, привела к увеличению количества клеток-предшественников олигодендроцитов (КПО, обладают потенциальными репаративными свойствами) в областях воспаления и демиелинизации в нервной паренхиме [9].
В здоровой ЦНС клетки, вырабатывающие коллаген, и сам белок коллаген находятся только вдоль кровеносных сосудов и в мозговых оболочках и не обнаруживаются в нервной паренхиме. Dorrier с соавт. удалось показать, что при ЭАЭ, индуцированном у мышей иммунизацией гликопротеином миелина олигодендроцитов (ГМО), инфильтрация иммунных клеток из кровотока приводит к выраженному пролиферативному распространению клеток, вырабатывающих коллаген, и его отложению в нервной паренхиме, что связано именно с воспалительным процессом при ЭАЭ (рис. 1а). Такого распространения клеток, вырабатывающих коллаген, и фиброза не наблюдалось, когда инфильтрацию ЦНС циркулирующими иммунными клетками у мышей с ЭАЭ предотвращали путем воздействия финголимода, который останавливает выделение иммунных клеток из лимфатических узлов и используется для лечения РС. Кроме того, ученые обнаружили, что демиелинизация, опосредованная купризоном, которая не вызывает инфильтрации периферическими иммунными клетками, не связана с фиброзом, тогда как демиелинизация, опосредованная лизолецитином, вызывает и инфильтрацию периферическими иммунными клетками, и фиброз. Эти результаты представляют собой убедительные доказательства того, что фиброзные рубцы являются следствием, а не причиной инфильтрации иммунными клетками.
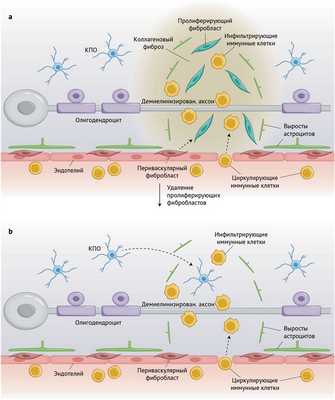
Рисунок 1 | Удаление пролиферирующих фибробластов ЦНС во время ЭАЭ снижает отложение коллагена и способствует мобилизации КПО в воспаленную паренхиму нервной ткани
а — схематическое изображение поражения при ЭАЭ; демиелинизация аксонов и инфильтрация иммунных клеток, пролиферация фибробластов (клетки цвета бирюзового цвета) и фиброз в виде отложения коллагена.
b — трансгенно нацеленное удаление пролиферирующих фибробластов при ЭАЭ значительно ослабляет фиброзный процесс и повышает количество КПО в воспаленных участках нервной паренхимы, несмотря на иммунокомпетентные клетки.
Чтобы найти клетки, стимулирующие фиброзирование вследствие воспаления, Dorrier с соавт. использовали стратегию отслеживания клонов клеток, в которой репортерный белок нацелен на определенный тип клеток с использованием трансгена, регулируемого тамоксифеном. Тамоксифен, временно вводимый взрослым мышам, активирует экспрессию репортерного гена в клетках, экспрессирующих трансген, который становится независимым от тамоксифена и передается всему поколению этих клеток. Используя эту экспериментальную модель, Dorrier с соавт. показали, что распространение клеток, выделяющих коллаген, в места поражения паренхимы при ЭАЭ происходит в подавляющем большинстве случаев из-за пролиферации местных фибробластов-резидентов ЦНС, которые экспрессируют коллаген уже в здоровой ЦНС, что согласуется с данными о повреждениях спинного мозга [10]. Напротив, совсем мало оказалось сведений от отслеживания клеточных линий клонов по пролиферации, индуцированной ЭАЭ. Также оказалось слишком мало доказательств для принятия факта (de novo) синтеза коллагена перицитами, экспрессирующими NG-2 [7], или гладкомышечными муральными клетками, экспрессирующими актин. Дополнительные эксперименты по трансплантации костного мозга подтвердили тот факт, что фиброзные клетки ЦНС происходят из клеток-резидентов ЦНС, а не из фиброцитов костного мозга или других циркулирующих иммунных клеток.
Чтобы изучить молекулярные характеристики клеток, вызывающих фиброз, Dorrier с соавт. провели РНК-секвенирование клеток, экспрессирующих коллаген, в здоровой ткани спинного мозга и после появления симптомов ЭАЭ. Выводы, полученные в ходе этого, соответствовали результатам теста отслеживания клеточной линии клонов. Исследователи обнаружили, что за синтез коллагена, выделяемого в большом количестве при ЭАЭ, отвечают те клетки, которые производят его еще в здоровой ткани, а также экспрессируют классические гены фибробластов. Те же клетки, которые экспрессировали коллаген, также экспрессировали гены, соответствующие пролиферации и повышенной экспрессии других генов внеклеточного матрикса при ЭАЭ. Напротив, менее 2 % синтезировавших коллаген клеток экспрессировали маркеры перицитов или гладкомышечных клеток, что указывает на то, что эти клетки незначительно влияют на фиброзное рубцевание при ЭАЭ.
Чтобы изучить потенциальное влияние фиброзного рубцевания, вызванного воспалением, на симптоматику ЭАЭ и внутриклеточную патологию, Dorrier с соавт. провели эксперимент по потере функции, в котором были удалены пролиферирующие фибробласты с помощью трансгенно нацеленной тимидинкиназы вируса простого герпеса в сочетании с ганцикловиром. Это экспериментальное лечение привело к значительному снижению отложения коллагена в очагах ЭАЭ, но с сохранением коллагена вокруг кровеносных сосудов. Начало проявления двигательных симптомов никак не изменилось, однако на стадии хронизации заболевания наблюдалось значительное уменьшение дегенерации двигательных функций задних конечностей. На клеточном уровне не удалось обнаружить никаких эффектов инфильтрации иммунных клеток, реактивного глиоза или иммунореактивности миелина. Однако исследователи выявили значительное увеличение Olig2-положительных КПО в областях поражения, что позволяет предположить, что фиброз может способствовать ограничению доступа КПО к воспаленной и демиелинизированной нервной паренхиме (рис. 1b). В соответствии с этим представлением эксперименты на клеточных культурах показали, что коллаген не влияет на пролиферацию или дифференцировку КПО, но значительно снижает их способность мигрировать сквозь сосудистую стенку.
Наконец, Dorrier с соавт. представляют доказательства того, что сигнализация посредством интерферона γ (IFN-γ) способствует фиброзному рубцеванию, вызванному инфильтрацией иммунных клеток. Транскриптомный анализ полногеномного РНК-секвенирования фиброзных клеток, экспрессирующих коллаген, после возникновения симптомов ЭАЭ свидетельствует об усилении воспалительных сигнальных путей (повысилась экспрессия рецепторов IFN-γ и индуцированных IFN-γ хемокинов и цитокинов). Селективная делеция рецепторов IFN-γ из фибробластов при ЭАЭ способствует значительному снижению образования фиброзных рубцов (но не до такой степени, как при абляции фибробластов). Тем не менее, самой по себе сверхэкспрессии IFN-γ, направленного на астроциты, во время демиелинизации купризоном было недостаточно для образования фиброзных рубцов. Эти данные свидетельствуют о том, что иммунные клетки взаимодействуют с фибробластами частично посредством сигнализации IFN-γ при фиброзе, вызванном ЭАЭ, но самого по себе IFN-γ недостаточно, чтобы вызвать фиброзное рубцевание.
Выводы Dorrier с соавт. углубляют понимание того, как взаимодействия между резидентными стромальными клетками ЦНС и инфильтрирующими иммунными клетками могут влиять на нарушения в ЦНС. Хорошо известно, что ремиелинизация неэффективна или недостаточна после демиелинизации, вызванной аутоиммунным заболеванием или некоторыми видами травматических повреждений. Механизмы, лежащие в основе этой патологии, включают недостаточную мобилизацию и дифференциацию КПО в демиелинизированных областях [11]. Выводы Dorrier с соавт. свидетельствуют о том, что фиброз, опосредованный фибробластами, в воспаленной нервной паренхиме может препятствовать мобилизации КПО в эти области. Тем не менее, иные недавние исследования предполагают, что фиброз может также влиять на нарушение дифференцировки КПО [12]. Интригующий вопрос: может ли снижение фиброзных процессов положительно повлиять на восстановление тканей и исход после воспаления в ЦНС.
Тем не менее, также важно помнить, что взаимодействия фибробластов с иммунными клетками могут иметь и адаптивный характер. Например, распространение фибробластов и отложение внеклеточного матрикса формирует важный тканевой «каркас», который как облегчает, так и контролирует инфильтрацию иммунных клеток во время образования вторичных лимфоидных фолликулов в ЦНС во время борьбы с вирусными инфекциями [13]. Такие наблюдения в сочетании с выводами Dorrier с соавт. подчеркивают важность более обширных исследований того, как стромальные клетки влияют на воспаление при различных заболеваниях ЦНС. Модуляция фиброза и взаимодействия стромальных клеток с иммунными клетками может задать новые цели терапии как в случае ЦНС, как и в иных жизненно важных органах.
Функции А-клеток. Механизмы участия А-клеток в иммунитете
Кроме А-клеток селезенки, способность взаимодействовать с неприлипающими клетками при синтезе антител имеют клетки перитонеального экссудата, а также радиорезистентные клетки лимфоузлов, но не тимуса и костного мозга. Морфологический анализ показывает, что главным клеточным компонентом популяции А-клеток являются макрофаги (80—90%). Используя лимитирующие разведения, удалось убедиться, что популяция А-клеток неоднородна, активными в смысле кооперации с неприлипающими клетками являются лишь 10-3—10-4 клеток из всех А-клеток.
Пока не вполне ясно, нужен ли непосредственный контакт А-клеток с неприлипающими клетками или А-клетки выделяют активирующий фактор в среду. Есть данные, что отделение А-клеток миллнпорным фильтром снимает их активность (Unanue, 1972) и, наоборот, что среда из культур А-клеток обладает активностью (Moller е. а., 1976). Показано (Calderon е. а., 1975), что среда из культур макрофагов содержит вещество, чувствительное к пепсину и хемотриисину с молекулярным весом 15000—21000, которое стимулирует образование IgM- и IgG-антител в культурах, увеличивает синтез ДНК тимоцитами.
Морфологическим субстратом взаимодействия А-клеток с неприлипающими клетками служат, очевидно, клеточные скопления, обычно образующиеся в суспензионных культурах и состоящие из единичных макрофагов, окруженных лимфоидными и плазматическими клетками. Манипуляции, предотвращающие образование таких скоплений, приводят к резкому снижению иммунного ответа. Ультраструктурный анализ скоплений выявил тесные межклеточные контакты лимфоцитов друг с другом и с макрофагами, что может указывать на наличие специфических микроусловий, обеспечивающих взаимодействие Т- и В-лимфоцитов с А-клетками и антигеном (Unanue, 1972). Антигензависимое прилипание лимфоцитов к макрофагам удается воспроизвести in vitro.
Является ли А-зависимым антителообразование ко всем антигенам, остается не вполне ясным. Существуют данные, что на поверхности А-клеток создается упорядоченная структура повторяющихся антигенных детерминант, необходимая для вовлечения в иммунный ответ лимфоидных клеток, и что Т-независимые антигены с повторяющимися детерминантами (такие, как полимеризоваииый флагеллин из Salmonella adelaidae) не нуждаются в помощи А-клеток.
Впрочем, есть данные, что культуральная среда из-под А-клеток так же активно действует на антителообразование, как и сами А-клетки, и что ответ на Т-независимые антигены также требует участия А-клеток.
Индукция in vitro реакций замедленной повышенной чувствительности, за которую ответственны Т-лимфоциты, также нуждается в участии А-клеток. Такие звенья этой реакции, как антигензависимая пролиферация сенсибилизированных лимфоцитов (Unanue, 1972; Rosenthal, Shevach, 1973; Schilling e. a., 1976), а также бласттрансформация в смешанных культурах лимфоидных клеток и образование лимфоцитов с цитотоксическими свойствами, являются А-зависимыми. Неоднократно была продемонстрирована необходимость присутствия А-клеток для пролиферации лимфоцитов тимусного происхождения в ответ на специфические для Т-клеток митогены.
Основным звеном в кооперации А-клеток и неприлипающих клеток следует считать взаимодействие А-клеток с тимуспроизводными лимфоцитами. Вопрос о возможности замены прилипающих клеток в культурах in vitro различными веществами (например, липополисахарид из Escherichia coli или 2-меркаптоэтанол), по-видимому, решается отрицательно, хотя в таких культурах эффект от удаления А-клеток и понижается (Bevan е. а., 1974).
Несмотря на обширный экспериментальный материал, который уже накоплен, конкретные функции А-клеток в иммунологических реакциях in vitro остаются неясными. Дело осложняется тем, что в разных реакциях и при различных системах культивирования эти функции могут не совпадать. При антнтелообразовании на разные антигены, при реакциях замедленной повышенной чувствительности и при действии митогенов, а также при использовании разных клеточных популяций (в том числе при разной плотности клеток в культурах) регулирующая роль А-клеток может зависеть от разных причин.
Роль А-клеток в переработке антигена. Морфология А-клеток
Наименее правдоподобно, что роль А-клеток сводится к переработке фагоцитируемого ими антигена, созданию суперантигена. Этому противоречит, в частности, то обстоятельство, что блокада фагоцитарной активности макрофагов не угнетает функции А-клеток.
Во многих случаях А-клетки способствуют выживанию лимфоидных клеток в культурах, реализации между ними клеточных контактов и тем стимулируют их пролиферацию. Эта активность А-клсток приводит к поликлональной, а не избирательной стимуляции иммунокомпетентных клеток.
А-клетки, как предполагается, могут фокусировать на своей поверхности антигены, введенные в культуру, и таким образом облегчить их восприятие Т-клеткам, а также специфическую кооперацию последних с соответствующими В-клетками. Несмотря на отсутствие иммонокомпетенции у А-клеток (А-клетки от толерантных и иммунных доноров проявляют такую же активность, как от нормальных доноров), такого рода подготовка антигена может приводить уже не к поликлональнои стимуляции, а к активации именно тех клеток, которые компетентны к присутствующим в культурах антигенам.
Не исключено, что А-клетки, подготавливая антиген и участвуя в клеточных кооперациях, регулируют соотношение Т-хелперных и Т-супрессорных клеток в культурах или регулируют качество того сигнала, который антиген вызывает в иммунокомпетентных клетках, подобно тому, как это наблюдается при индукции в популяциях лимфоидных клеток синтеза ДНК при разных концентрациях конко-навалина A (McClain, Edelman, 1976).
Генетический анализ взаимодействия А-клеток и лимфоцитов в ходе антигениндуцированной пролиферации сенсибилизированных лимфоцитов in vitro выявил необходимость совпадения макрофагов и Т-клеток по генам гистосовместимости. То же справедливо и для взаимодействия макрафгов с Т-клет ками in vivo (Biller e. a., 1976). Участие А-клеток необходимо для образования Т-хелнерных клеток при индукции антителообразования и на растворимые, и на корпускулярные антигены.
Однако в первом случае требуется совпадение макрофагов и Т-клеток по генам Н-2-комплекса (в особенности I-A-района, в котором находится и часть Ir-генов), тогда как во втором достаточно присутствия и аллогенных А-клеток. Следует предполагать, что взаимодействие А- и Т-клеток осуществляется с участием рецепторов, кодируемых генами гистосовместимости, создающими разнокачественность своего и чужого, и что продукты этих генов близки или во всяком случае эволюционно родственны продуктам V-генов, ответственных за иммунологическую разнока-чественность иммуноглобулинов и клеточных рецепторов.
Вопрос о морфологической принадлежности клеток, с которыми связана активность популяции А-клеток, до сих пор не решен. Эта популяция в высокой степени гетерогенна и по способности фиксировать антигены, и по морфологии и происхождению входящих в ее состав клеток.
Как уже указывалось, лишь незначительная часть клеток А-популяции является функционально активной при взаимодействии с неприлипающими клетками, число таких функционально активных клеток составляет от 1 до 10 на 10 000 прилипающих клеток, причем их распределение во фракциях клеток селезенки, разделенных в градиенте концентраций бычьего сывороточного альбумина, не соответствует распределению макрофагальных фагоцитирующих элементов. Наиболее существенным доводом в пользу макрофагальной природы А-клеток считается их инактивация антимакрофагальной сывороткой.
Однако такие сыворотки готовятся иммунизацией не чистыми макрофагами, а всеми прилипающими клетками, т. е. А-клетками. Поэтому инактивация этими сыворотками функции А-клеток не может считаться доказательством того, что А-клетки являются именно макрофагами. Все это лишает убедительности соображения о том, что функции А-клеток обеспечиваются просто клетками с высокой фагоцитарной активностью, т. е. макрофагами, хотя они действительно являются преобладающей формой в А-популяции. Следует, очевидно, искать среди А-клеток действительно активные, но уникальные субпопуляции.
В предыдущих работах выявлено, что число стромальных клоногенных клеток костного мозга и селезёнки (КОК-Ф) и эффективность их клонирования значительно снижается в культурах гетеротопных трансплантатов в случаях, когда и донором, и реципиентом служат старые животные (Ю.Ф. Горская с соавт., 2002). Количество ядерных клеток в трансплантатах костного мозга быстростареющих мышей (SAMP) увеличивается более чем в 2 раза, если реципиентом являются мыши с нормальным темпом старения (SAMR). Полученные данные позволили сделать вывод, что значительное воздействие на стромальную ткань оказывает весь стареющий организм, что может служить одной из причин развития сенильного остеопороза.
Цель данной работы - выяснить, как влияют возрастные изменения организма и самих стромальных клеток-предшественников (КОК-Ф) гетеротопных трансплантатов костного мозга и селезёнки на морфологию колоний, формируемых ими в культурах.
Для посадки гетеротопных трансплантатов ½ костного мозга бедра и 1/5 селезёнки от молодых (3 мес.) и старых (24 мес.) мышей линии СВА помещали под почечную капсулу им же в следующих комбинациях доноров и реципиентов. Клеточные суспензии трансплантатов эксплантировали в матрасы в 5 мл полной культуральной среды с добавлением фидера. Выращенные культуры фиксировали этанолом и окрашивали азор II-эозином. Учитывались колонии, содержащие не менее 50 фибробластов. Выделяли два основных вида колоний и подсчитывали процентное содержание каждого вида и проводилась статистическая обработка данных.
Компактные колонии состоят из фибробластов, типичных по форме, обладающих высоким пролиферативным потенциалом, что обусловливает их плотное расположение в одном или нескольких центрах. Диффузные колонии характеризуются наличием в своём составе фибробластов, разобщённых между собой и свободно располагающихся в пределах колонии. Два морфологических вида колоний отражают степень пролиферативной активности входящих в них клеток. Максимальная активность имеет место в колониях с многочисленными активными центрами. Снижение пролиферативной активности наблюдается в диффузном типе колоний.
В результате исследований установлено, что во всех вариантах трансплантатов костного мозга, когда донором или реципиентом служит молодой организм, в культурах преобладает компактный тип колоний, сформированных клоногенными предшественниками стромальных фибробластов (68,3-75,7%). Напротив, при пересадке костного мозга от старых мышей старым же животным соотношение типов колоний меняется на обратное - диффузные колонии составляют 66,7%, а компактные - 33,3% (p < 0,05). Данные показатели свидетельствуют о том, что на пролиферативную активность клеток стромы костного мозга оказывают влияние как возрастные изменения самих клеток-предшественников, так и в большей степени воздействие стареющего организма в целом.
Читайте также:
