Комплементация вирусов. Фенотипическое смешивание вирусов. Маскирование вирусов.
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Между вирусами наблюдаются негенетические взаимодействия, которые могут влиять на результаты генетических исследований. Эти негенетические взаимодействия часто приводят к фенотипическому маскированию истинного вирусного генотипа.
Гетерозиготность
При совместном культивировании двух штаммов вируса может происходить формирование вирионов, содержащих в своем составе два разных генома или по крайней мере один полный геном и часть второго генома. Это явление названо гетерозиготностью. У некоторых вирусов с гаплоидным геномом гетерозиготность обусловлена неправильной упаковкой геномов при созревании, приводящей к возникновению мультиплоидных частиц. Например, у вируса ньюкасльской болезни более 10% потомства, проанализированного при пассировании после скрещивания, содержало оба родительских типа; это указывает на то, что клоны получены из гетерозиготных мультиплоидных частиц. Действительно, в этих вирусных популяциях наблюдалось значительное число мультиплоидных частиц. Комплементация между геномами в гетерополиплоидных частицах была ошибочно интерпретирована как рекомбинация. Мультиплоидных частиц не наблюдали у вирусов без внешней оболочки, у которых структурные ограничения при упаковке делают маловероятным попадание двух геномов в один капсид. Соответствено гетерозиготность у этих вирусов не обнаружена.
В генетике высших организмов гетерозиготность означает состояние, при котором диплоидные хромосомы различаются по аллельным маркерам в одном или нескольких локусах. У вирусов животных гетерозиготность этого типа обычно не встречается, поскольку, за небольшими исключениями, геномы этих вирусов гаплоидны. Однако геномы ретровирусов полностью диплоидны — они состоят из двух молекул геномной РНК. Ретро-вирусы могут быть гетерозиготны по всем маркерам, и гетерозигота постулируется в качестве промежуточного этапа при рекомбинации.
Частично диплоидны ДНК-содержащие вирусы, в ДНК которых встречаются повторяющиеся последовательности. Возможна также гетерозиготность по диплоидным локусам. Гетерозиготность наблюдается в геноме НSV, у которого концевые и внутренние повторяющиеся последовательности допускают существование некоторых аллелей в двух копиях. Хотя аллели в диплоидных участках обычно идентичны, найдены области облигатной и необлигатной гомологии последовательностей. Выделены рекомбинанты НSV -1 и НSV -2, содержащие гетерозиготные концевые повторы. Гетерозиготность по концевым участкам влияет на изомеризацию генома, которая обычно происходит у герпесвирусов.
Фенотипичеокое смешивание
Фенотипическим смешиванием называют процесс, в результате которого индивидуальная вирусная частица, образовавшаяся при смешанной инфекции, получает структурные белки (капсида или оболочки), происходящие от обоих родительских вирусов. В крайнем варианте дочерний геном, генотипичеоки идентичный геному одного из родителей, упаковывается в капсид или оболочку, определяемую другим родителем. Смешивание геномов и структурных белков приводит к образованию вирусных частиц, в которых фенотипические свойства вирусов не отражают фенотипических потенций генома. Тем не менее при последующем заражении экспрессия генома приводит к образованию потомства, в котором фенотип соответствует генотипу. Таким образом, фенотипичеокое смешивание представляет собой преходящий феномен.
Фенотипическое смешивание довольно широко распространено у вирусов без оболочки, близкородственных между собой. Способность капсидных белков смешиваться и давать урожай инфекционного вируса предполагает, что смешанные белки должны играть весьма сходную структурную роль в вирионе.
Фенотипическое смешивание наблюдается при смешанной инфекции,многими вирусами, причем эти вирусы могут быть как близкими друг другу (например, вирусы гриппа А и В или разные серологические подтипы вируса гриппа А), так и весьма далекими (онковирусы и рабдовирусы).
Фенотипическое смешивание структурных антигенов наблюдали между близкородственными вирусами, такими как вирусы полиомиелита типов 1 и 2 и между более отдаленными родственниками, такими как вирусы ЕСНО 7 и Коксаки А9.
В некоторых случаях фенотипичеокого смешивания большая часть потомства имела полностью гетерологичный капсид (гранскапсидация). Патогенные вирусы, например вирус ящура и бычий энтеровирус или вирус полиомиелита и вирус КоксаКи , дают транскапсидацию in vitro, что может иметь эпидемиологические последствия в том случае, если транскапсидация происходит также и in vivo.
Фенотипическое смешивание свободно протекает у ряда РНК- и ДНК-сбдержащих вирусов с оболочкой. У этих вирусов фенотипическое смешивание часто происходит таким образом, что нуклеокапоид данного вируса оказывается заключенным в оболочку, определяемую другим вирусом; это явление получило название «образование псевдотипа». Комплементация, наблюдаемая между дефектными по репликации РНК-содержащими опухолеродными вирусами и их помощниками (см. выше), приводит к образованию псевдотипов, поскольку поверхностные гликопротеины обычно кодируются вирусом-помощником. Вирус везикулярного стоматита образует псевдотипы с рядом других вирусов, имеющих оболочку, включая вирус чумы птиц, группы птичьих и мышиных РНК-содержащих опухолеродных вирусов, и НSV. Тем не менее в процессе образования вирусов с оболочкой одних вирусов и нуклеокапсидами других существуют ограничения, на что указывает отсутствие фенотипического смешивания между вирусом везикулярного стоматита и вирусом Синдбис [12]. Не все фенотипичеоки смешанные частицы вирусов с оболочкой представляют собой псевдотипы. Может происходить также смешивание белков оболочки, что приводит к образованию вирионов, нейтрализуемых антисыворотками к обоим родителям.
Интерференция
У вирусов животных найдено несколько типов интерференции. Наибольший интерес для генетиков представляет гомологичная интерференция, которая проявляется только по отношению к гомологичному вирусу или к близкородственным вирусам.
Одной из форм хорошо изученной гомологичной интерференции является интерференция, наблюдающаяся при серийных пассажах вируса при высокой множественности заражения [65]. В этих условиях суммарный урожай вирусных частиц остается относительно постоянным, однако урожай инфекционного вируса снижается по мере пассирования. Таким образом, наблюдается интерференция в отношении роста инфекционной части вирусной популяции. Изучение этих интерферирующих вирусных популяций показало, что они содержат значительную долю вирусных геномов (геномных сегментов) с делециями.
Выдвинуто предположение, что делеционные мутанты интерферируют с ростом полного вируса, эффективно конкурируя за компоненты репликационного аппарата, например за полимеразу [65], что приводит к образованию все увеличивающейся доли дефектного интерферирующего вируса. В последнее время предполагают, что хотя дефектный интерферирующий вирус может конкурировать с полным вирусом за компоненты репликационного аппарата, он не обязательно мешает репродукции полного вируса. Гомологичная интерференция наблюдается не только с делеционными мутантами, но и с мутантами других типов.
Комплементация вирусов. Фенотипическое смешивание вирусов. Маскирование вирусов.
Вирусология:
Популярные разделы сайта:
Фенотипическое смешивание вирусов. Маскирование генов вирусами
В результате смешанного заражения клетки двумя вирусами, имеющими некоторые общие черты (такие, как тип капсида или способность созревать путем почкования на плазматической мембране), некоторая часть потомства может приобретать фенотипические признаки обоих родителей, хотя их генотип остается неизмененным.
Например, при смешанном заражении серологически различными штаммами вируса гриппа (Бёрнет и Линд, 1953), вирусами гриппа и ньюкаслской болезни (Граноф и Хёрст, 1954) или вирусом везикулярного стоматита и парамиксовирусом обезьян SV5 (Чоппин и Компанс, 1970) оболочки у некоторой части потомства содержат вирусные антигены, характерные для каждого из родительских вирусов.
Фенотипическое смешивание вирусов, имеющих оболочку, может сопровождаться перераспределением фрагментов генома (например, в опыте с двумя штаммами вируса гриппа А), но обычно вирион содержит геном только одного из родителей или же образуются гетерополиплоидные частицы со смешанным полным геномом.
По-видимому, в клетках, зараженных родственными вирусами, которые созревают путем почкования на одних и тех же клеточных мембранах, всегда происходит фенотипическое смешивание (вероятно, только на уровне пепломеров). Например, дефектные вирусы саркомы птиц и мышей всегда фенотипически сходны с использованным вирусом-помощником (псевдотип).

Кроме упомянутых выше случаев, фенотипическое смешивание было выявлено у альфа-вирусов (Бёрдж и Пфефферкорн, 1966с) и у мутантов вируса простого герпеса (Ройзман, 1965); наблюдалось оно и между вирусами кори и Сендай (Норрби, 1965).
Фенотипическое смешивание так же легко происходит и у некоторых икосаэдрических вирусов без оболочки. У энтеровирусов оно было обнаружено между разными серотипами полиовируса (Лединко и Хёрст, 1961), причем в особенно высокой степени—в наиболее рано созревающих вирионах; в конечном урожае при смешанной инфекции почти каждый вирион содержал капсомеры от обоих родителей.
Фенотипическое смешивание происходит и между неродственными энтеровирусами, например между ЕСНО-вирусом типа 7 и вирусом Коксаки типа А9 (Айтоу и Мелник, 1959), тюлиовирусом и вирусом Коксаки В1 (Холленд и Корде, 1964), вирусом ящура и одним бычьим энтеровирусом (Траутмен и Сатмоллер, 1971).
В последних двух случаях большая часть потомства, по-видимому, имела полностью гетерологичные капсиды; в этом случае обычно говорят о маскировке генома или — при иных обстоятельствах, характерных для опытов с аденовирусами и гибридами аденовирус — SV40 (Рапп и Мелник, 1966; см. выше)—о транскапсидации.
Маскировка генома вируса ящура может иметь важные эпидемиологические последствия. Фенотипическое смешивание у аденовирусов проявляется как в образовании гетерополимерных капсомеров-гексонов, содержащих полипептиды, кодируемые вирусами двух разных серотипов, так и в образовании капсидов, содержащих гомополимерные капсомеры обоих родителей (Норрби и Голмар, 1971).
Комплементация вирусов. Фенотипическое смешивание вирусов. Маскирование вирусов.
Комплементация вирусов. Фенотипическое смешивание вирусов. Маскирование вирусов.
Комплементация — функциональное взаимодействие двух дефектных вирусов, приводящее к появлению возможности их репродукции в условиях, при которых невозможно размножение каждого вируса в отдельности. При реализации подобных отношений вирусные геномы взаимодействуют косвенно, то есть на уровне кодирующих их веществ. Дефектные вирусы размножаются и передаются горизонтально (то есть от одной особи к другой, в отличие oт вертикального способа - от матери к плоду; рис. 5-7).
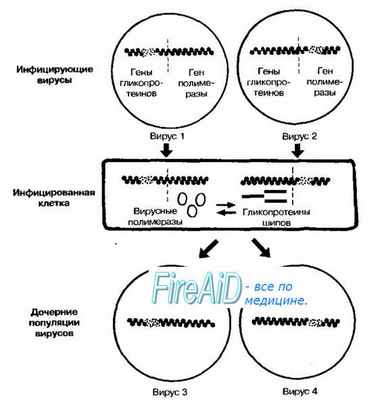
Рис. 5-7. Комплементация дефектных вирусов. Процесс может заканчиваться образованием дочерних популяций, способных инфицировать чувствительные к ним клетки. На рисунке представлено взаимодействие вирусов, один из которых лишён гена полимеразы, а у другого отсутствуют гены, кодирующие синтез гликопротеинов поверхностных шипов. У дочерних популяций сохраняются первоначальные дефекты обоих геномов.
Фенотипическое смешивание вирусов. Маскирование вирусов.
Фенотипическое смешивание и маскирование (псевдотипирование). Эти формы взаимодействий можно назвать генетическими лишь в контексте взаимодействия геномов, так как приобретаемые признаки обычно не закрепляются в потомстве, которому свойственны серологические свойства одного из «родительских* штаммов.
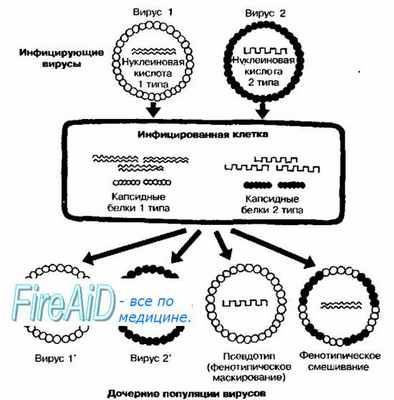
Рис. 5-8. Принцип образования псевдотипов (фенотипическое маскирование) и фенотипическое смешивание у вирусов.
Фенотипическое смешивание вирусов наблюдают при одновременном заражении клетки близкородственными вирусами (например, различными сероварами полиовирусов или вирусов Коксаки). В результате образуются вирионы с гибридными капсидами, в состав которых входят капсомеры, кодируемые геномами двух вирусов (рис. 5-8). Образование псевдотипов происходит при множественном инфицировании. Феномен заключается в образовании нуклеокапсида, состоящего из генома одного вируса и капсида близкородственного вируса. Генетические процессы, приводящие к образованию псевдотипов, известны как фенотипическое маскирование. Процесс может развиваться и в обратном направлении при коинфицировании вирусами идентичного псевдотипа. Если все вирионы попавшие в клетку, содержат геном типа 2 и заключены в капсид типа 1, то дочерние популяции будут включать капсид и геном типа 2, так как образование всех их структурных компонентов кодирует геном типа 2.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Генетические взаимодействия между вирусами
Заражение вирусами чувствительных к ним клеток носит множественный характер, то есть в клетку может проникнуть несколько вирионов, обычно идентичных или близкородственных. В подобных ситуациях геномы вирусных частиц в динамике репродуктивных циклов могут взаимодействовать или интерферировать. Независимо от типа нуклеиновой кислоты генетические взаимодействия между вирусами представлены несколькими формами: рекомбинация, обмен фрагментами генома, комплементация.
Рекомбинации и перераспределение генов между геномами приводят к перераспределению генетического материала в дочерних популяциях. Они отмечены во всех группах ДНК-содержащих вирусов, у всех РНК-содержащих вирусов с сегментированным геномом и лишь у немногих РНК-содержащих вирусов с несегментированным геномом (например, у полиовируса и вируса ящура).
• У ДНК-содержащих вирусов с дефектными геномами можно наблюдать рекомбинации, приводящие к образованию нормального дочернего генома (рис. 5–5, А).
• У РНК-овых вирусов при копировании плюс-цепи в минус-цепь полимераза может «переключаться» с одной плюс-цепи на другую, образуя гибридную минус-матрицу РНК (рис. 5–5, Б). Подобный механизм вызывает появление генетического непостоянства у ВИЧ. Геном ВИЧ образован +РНК, поэтому при транскрипции ДНК из РНК риск «переключения» обратной транскриптазы с одной цепочки на другую достаточно велик. Если обе молекулы идентичны, то подобное явление не приводит к последствиям, но при наличии двух вирусов-мутантов в клетке возможно появление рекомбинантов с иными геномами.
Ы Вёрстка Рисунок 5–5
Рис. 5–5. Рекомбинация ДНК- (А) и РНК-содержащих (Б) вирусов.
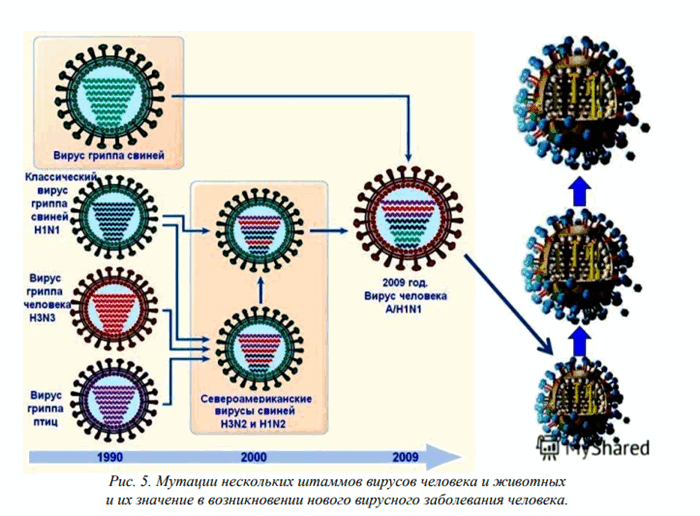
Обмен фрагментами генома наблюдают у РНК-содержащих вирусов с сегментированным геномом. В отличие от рекомбинации суть процесса состоит в обмене крупных блоков наследственного материала. Например, при множественном заражении клетки мутантами вируса гриппа с изменениями, закреплёнными в различных сегментах генома, возможно появление нормального штамма вируса; в образовании популяции последнего принимают участие геномы обоих вирусов (рис. 5–6). В частности, передача двух фрагментов генома вирулентного для цыплят штамма вируса гриппа авирулентному влечёт за собой приобретение последним вирулентных свойств. В результате обмена вирус гриппа типа А может получить новые и селективно ценные типы поверхностных Аг гемагглютинина и нейраминидазы, что обеспечивает антигенный шифт [от англ. shift, перемещение] в динамике инфекционного процесса.
Ы Вёрстка Рисунок 5–6
Рис. 5–6. Обмен фрагментами генома (А, Б, В, Г) у РНК-содержащих вирусов.
Комплементация — функциональное взаимодействие двух дефектных вирусов, приводящее к появлению возможности их репродукции в условиях, при которых невозможно размножение каждого вируса в отдельности. При реализации подобных отношений вирусные геномы взаимодействуют косвенно, то есть на уровне кодирующих их веществ. Дефектные вирусы размножаются и передаются горизонтально (то есть от одной особи к другой, в отличие от вертикального способа — от матери к плоду; рис. 5–7).
Ы Вёрстка Рисунок 5–7
Рис. 5–7. Комплементация дефектных вирусов. Процесс может заканчиваться образованием дочерних популяций, способных инфицировать чувствительные к ним клетки. На рисунке представлено взаимодействие вирусов, один из которых лишён гена полимеразы, а у другого отсутствуют гены, кодирующие синтез гликопротеинов поверхностных шипов. У дочерних популяций сохраняются первоначальные дефекты обоих геномов.
Фенотипические смешивание и маскирование (псевдотипирование). Эти формы взаимодействий можно назвать генетическими лишь в контексте взаимодействия геномов, так как приобретаемые признаки обычно не закрепляются в потомстве, которому свойственны серологические свойства одного из «родительских» штаммов.
Фенотипическое смешивание наблюдают при одновременном заражении клетки близкородственными вирусами (например, различными сероварами полиовирусов или вирусов Коксаки). В результате образуются вирионы с гибридными капсидами, в состав которых входят капсомеры, кодируемые геномами двух вирусов (рис. 5–8).
Образование псевдотипов происходит при множественном инфицировании. ФенЏмен заключается в образовании нуклеокапсида, состоящего из генома одного вируса и капсида близкородственного вируса. Генетические процессы, приводящие к образованию псевдотипов, известны как фенотипическое маскирование. Процесс может развиваться и в обратном направлении при коинфицировании вирусами идентичного псевдотипа. Если все вирионы, попавшие в клетку, содержат геном типа 2 и заключены в капсид типа 1, то дочерние популяции будут включать капсид и геном типа 2, так как образование всех их структурных компонентов кодирует геном типа 2.
Ы Вёрстка Рисунок 5–8
Рис. 5–8. Принцип образования псевдотипов (фенотипическое маскирование) и фенотипическое смешивание у вирусов.
Интерферирующие взаимодействия
Интерференцией вирусов обозначают состояние невосприимчивости к вторичному заражению клетки, уже инфицированной вирусом. Различают интерференцию гетерологическую и гомологическую.
Гетерологическая интерференция. Инфицирование одним вирусом полностью блокирует возможность репликации второго вируса в пределах одной клетки. Один из механизмов гетерологической интерференции связан с угнетением адсорбции другого вируса путём блокирования или разрушения специфичных рецепторов. Другой механизм связан с ингибированием трансляции мРНК любой гетерологичной мРНК в инфицированной клетке.
Гомологическая интерференция. Процесс типичен для многих дефектных вирусов, особенно для повторно пассируемых in vitro и с высокой множественностью инфицирования. Дефектные вирусы обычно не способны к самостоятельной репродукции. Их репродукция возможна лишь при заражении клетки совместно с нормальным вирусом. В подобных взаимодействиях последний называют вирусом-помощником. Иногда дефектный вирус может вмешиваться в репродуктивный цикл нормального вируса и образовывать дочерние дефектные интерферирующие (ДИ) вирусные частицы.
• ДИ-частицы содержат лишь часть генома полного вируса.
• По природе дефекта ДИ-частицы делеционны и их можно рассматривать как летальных мутантов.
• Основное свойство ДИ-частиц — способность к интерференции с нормальным гомологичным вирусом. Они способны играть роль помощников в репликации последних (например, за счёт раннего синтеза продуктов регуляции, задействованных в репродукции нормального вируса).
• Способность ДИ-частиц к адсорбции и проникновению в клетку связано с нормальной структурой капсида. Высвобождение и экспрессия дефектной нуклеиновой кислоты приводит к различным биологическим эффектам: тормозит синтетические процессы в клетке, а также ингибирует синтез и трансформацию белков нормальных вирусов (за счёт гомологичной интерференции).
• Циркулирование ДИ-частиц и коинфекция с нормальным гомологичным вирусом вызывают появление вялотекущих, длительных форм заболеваний, что связано со способностью ДИ-частиц реплицировать значительно быстрее (за счёт простоты генома), а созревание дефектных популяций сопровождается снижением выраженности цитопатического эффекта, характерного для «нормального» вируса.
Детерминанты патогенности вирусов и патогенез вирусных инфекций
Некоторые вирусы способны размножаться в самых различных клетках, тогда как другие проявляют специфичность и размножаются лишь в определённых тканях.
Факторы специфичности
• Количество специфических рецепторов, обеспечивающих взаимодействие вируса с клеткой, обычно ограничено.
• Наличие в геномах чувствительных клеток соответствующих промЏторов, обеспечивающих полноценную репродукцию возбудителя.
• В некоторых случаях сама природа клеток способствует проявлению вирулентности возбудителя. Например, G-белок (основной протеин оболочки) вируса бешенства обладает высоким сродством к ацетилхолиновым рецепторам нейронов, что обеспечивает его способность проникать в клетки нервной ткани. Следует отметить, что нейротропные вирусы вызывают особенно тяжёлые заболевания, так как нервные клетки не регенерируют. Более того, репродукция возбудителя делает их мишенями для цитотоксических иммунных реакций.
Мутации
Довольно часто вирулентность вирусов увеличивают мутации. Например, вирулентность вируса гриппа в значительной степени связана с активностью гемагглютинина, и изменения его структуры делают штаммы возбудителя авирулентными. Обратные мутации (реверсии) генов, кодирующих структуру белка, могут восстанавливать его строение и трансформировать ранее авирулентные штаммы в вирулентные.
Особенности макроорганизма
Возраст пациента — один из ведущих факторов, влияющий на проявления заболевания. Например, у детей младшего возраста такие заболевания, как грипп, гепатит В, а также инфекции, вызванные респираторно-синцитиальным вирусом (РС-вирусом) и вирусом Коксаки В, протекают гораздо тяжелее, чем у старших детей. С другой стороны, корь и ветряная оспа гораздо легче протекает у детей, чем у взрослых. Тем не менее, для значительного спектра вирусных инфекций группами риска принято считать детей младшего возраста и пожилых.
Питание. Практически все вирусные инфекции тяжелее протекают у ослабленных лиц на фоне дефицита питания, что связано с общими нарушениями гомеостаза организма.
Нарушения иммунного статуса. У лиц, страдающих нарушениями клеточных иммунных реакций, многие вирусные инфекции переходят в вялотекущие, хронические формы либо протекают более тяжело. Это связано с дефектами цитотоксических иммунных механизмов, направленных на прерывание репродуктивного цикла и удаление возбудителя из организма.
Наследственные факторы. Существует наследственная невосприимчивость к некоторым вирусным заболеваниям. Большой интерес представляют данные о роли некоторых наследственных факторов у ВИЧ-инфицированных лиц.
• Пациенты с клетками, несущими HLA-DR2, составляют группу риска быстрого развития оппортунистических инфекций.
• Наличие HLA-DR5 указывает на бЏльшую вероятность быстрого развития саркомы КЊпоши.
Вирусы и механизмы возникновения их мутаций
Вирусология занимает важное место среди биологических дисциплин. Современный медицинский или ветеринарный специалист должен знать не только клинико–патологическую сторону заболевания, но и иметь четкое представление о вирусах, их свойствах, методах лабораторной диагностики и свойствах постинфекционного и поствакцинального иммунитета.
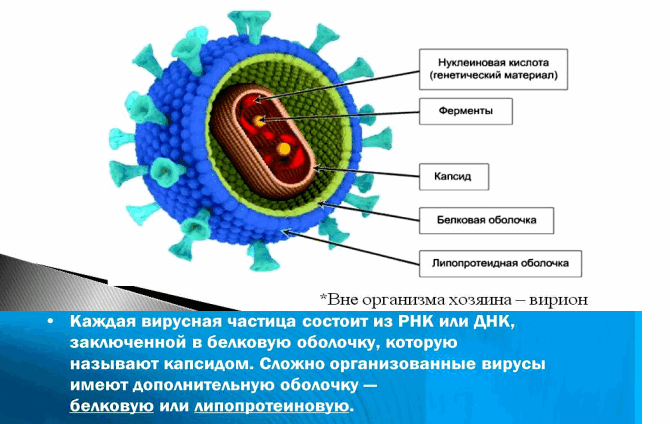
Вирус (от лат. virus — яд) является простейшей неклеточной формой жизни в виде микроскопической биологической частицы, представляющей собой молекулы нуклеиновых кислот (ДНК или РНК), заключённых в защитную белковую оболочку (капсид) и способные инфицировать живые организма.
- мутации, то есть изменении последовательности нуклеотидов в определенной области генома вируса, что приводит к фенотипически выраженному изменению свойства;
- рекомбинации, то есть обменом генетическим материалом между двумя вирусами, близкими, но различными по наследственным свойствам.
Мутации у вирусов
- спонтанные;
- индуцированные (вызванные).
Но точечные мутации не всегда приводят к изменению фенотипа. Существует целый ряд причин, по которым такие мутации не могут проявляться. Одна из них - вырождение генетического кода. Код синтеза белка вырождается, что означает, что некоторые аминокислоты могут быть закодированы несколькими триплетами (кодонами). Например, аминокислота лейцин может быть закодирована шестью триплетами. Поэтому, если молекула РНК заменяет триплет ЦУУ на ЦУЦ, ЦУА на ЦУГ, то синтезированная молекула белка все еще будет содержать аминокислоту лейцин.
Поэтому ни структура белка, ни его биологические свойства не нарушаются. Природа использует своего рода синонимичный язык и, заменяя один кодон другим, закладывает в них одно и то же понятие (аминокислоту), тем самым сохраняя естественную структуру и функцию синтезируемого белка.
Другое дело, если аминокислота кодируется только одним триплетом, например, синтез триптофана кодируется и заменяется только триплетом УГГ, то есть синонимом, который отсутствует. В этом случае в белок включается еще одна какаялибо аминокислота, которая может привести к появлению мутантного признака.
Аберрация в фагах вызвана делециями (потерями) различного числа нуклеотидов, от одной пары до последовательности, вызывающей одну или несколько функций вируса. Как спонтанные, так и индуцированные мутации также делятся на прямые и обратные мутации. Мутации могут иметь разные последствия. В некоторых случаях они приводят к изменению фенотипических проявлений в нормальных условиях.
Например, увеличивается или уменьшается размер бляшек под агарным покрытием; увеличивается или ослабевает вирулентность для определенного вида животных; вирус становится более чувствительным к действию химиотерапевтического агента и т. д.
В других случаях мутация является фатальной, поскольку она нарушает синтез или функцию жизненно важного вирусного белка, например, такого как вирусная полимераза. В некоторых случаях мутации являются условно летальными, так как вирусспецифический белок сохраняет свои функции при определенных условиях и теряет эту способность в неразрешающих (непермиссивных) условиях.
Типичным примером таких мутаций являются термочувствительные – ТS-мутации, при которых вирус теряет способность к размножению при повышенных температурах (+39-42°С), сохраняя эту способность при нормальных температурах роста (+36-37°С). Морфологические или структурные мутации могут влиять на размер вириона, первичную структуру вирусных белков и изменения в генах, определяющих ранние и поздние вирусные ферменты, обеспечивающие размножение вируса. Мутации также могут быть различными по своему механизму.
В одних случаях происходит делеция, то есть потеря одного или нескольких нуклеотидов, в других - встраивание одного или нескольких нуклеотидов, а в некоторых случаях один нуклеотид заменяется другим. Мутации могут быть прямыми или обратными. Прямые мутации меняют фенотип, а обратные мутации – реверсии) - восстанавливаются. Реальная реверсия возможна, когда обратная мутация происходит вместе с первичным повреждением, и псевдореверсия, когда мутация происходит в другой области дефектного гена (интрагенное торможение мутации) или в другом гене (экстрагенное подавление мутации).
Реверсия - не редкое явление, потому что ревертанты обычно лучше приспособлены к данной клеточной системе. Поэтому при создании мутантов с определенными свой ствами, например, вакцинных штаммов, следует ожидать возможного превращения их в дикий тип. Вирусы отличаются не только своими небольшими размерами, селективной способностью к размножению в живых клетках, особенностями строения наследственного вещества, но и значительной изменчивостью от других представителей живого мира.
Изменения могут влиять на размер, форму, патогенность, антигенную структуру, тканевую тропность, устойчивость к физико-химическим воздействиям и на другие свойства вирусов. Значение причин, механизмов и характера изменений имеет большое значение при получении необходимых вакцин для вирусных штаммов, а также для разработки эффективных мер борьбы с вирусными эпизодами, в ходе которых, как известно, свойства вирусов могут существенно изменяться.
Мутация вирусов может происходить в результате химических изменений цистронов или нарушения последовательности их расположения в структуре молекулы вирусной нуклеиновой кислоты. В зависимости от условий различают естественную изменчивость вирусов, наблюдаемую в нормальных условиях размножения, и искусственную изменчивость, получаемую в результате многочисленных специальных пассажей или воздействия на вирусы определенных физических или химических факторов (мутагенов). В обычных природных условиях изменчивость проявляется не во всех вирусах одинаково.
Этот признак наиболее заметен у вируса гриппа и вирус ящера. Значительная изменчивость отмечается у вируса гриппа. Об этом свидетельствует большое количество вариантов у разных типов этих вирусов, а также значительные изменения его антигенных свойств в конце почти каждой эпизоотии.
Частота мутаций и механизмы их возникновения
Мутации бактериофагов изучались очень интенсивно не только с целью генетического анализа, но и с целью получения информации о свойствах самих фагов. Частота появления мутантов в потомстве фагов варьируется очень сильно: например, одни мутанты образуются с частотой не более 10, а другие-с частотой 10 и выше. Неблагоприятное воздействие высокочастотных мутаций обычно компенсируется эффектом отбора. Например, мутантный фаг может быть заменен диким типом, что дает более высокий выход фага. Высокая частота вспышек обычно характерна для таких мутаций, которые могут происходить как во многих локусах, так в одном и том же локусе.
В тех случаях, когда нормальный признак соответствует функциональной форме гена, а мутант появляется в результате изменения в любой точке локуса, частота прямых мутаций окажется выше, чем частота обратных мутаций, так как обратные мутации должны приводить к восстановлению нормального состояния. Иногда ревертанты на самом деле являются псевдоревертантами: это происходит либо из-за изменений в другом гене (мутации-супрессоры), либо из-за изменений в том же гене, которые вызывают другую, но также активную форму продукта.
У зрелых фагов частота спонтанных мутаций очень мала, но они могут быть индуцированы под влиянием таких мутагенных факторов, как рентгеновские или ультрафиолетовые лучи, азотистая кислота, гидроксиламин или алкилирующие агенты. Азотистая кислота дезаминирует основания нуклеотидов, а этилметилсульфат их этилирует. Гидроксиламин превращает шитозин в урацил. В результате ошибок, допущенных при репликации химически модифицированной нуклеиновой кислоты, происходят мутации, и потомство фагов, полученное из бактерии, содержит как нормальные, так и мутантные частицы. Однако, как и при обработке мутагенного фага, содержащего одноцепочную ДНК, образуется чистый мутантный клон.
Изучение мутационного процесса, происходящего при размножении фагов, непосредственно связано с анализом развития фагов. Давайте рассмотрим процесс спонтанной мутации. В бактериальной клетке, в которой произошла мутация фага, 6 образуются как нормальный, так и мутировавший фаги. Количество мутантных фаговых частиц, содержащихся в популяции фагов, происходящих из этой отдельной бактериальной клетки, очевидно, определяется характером размножения фагов, поскольку новые гены могут быть сформированы только путем репликации уже существующих. Если вероятность мутации одинакова для каждой репликации, то число мутантов зависит от механизма репликации.
Например, если каждая новая копия гена формируется независимо от других, то распределение мутантных копий в потомках фагов от разных инфицированных бактерий будет случайным. Если же, наоборот, каждая из полученных копий воспроизводится, то в свою очередь мутантные копии будут разделены на группы или клоны, состоящие из мутантных "сибсов".
Индуцированные хозяином модификации бактериофагов
Помимо мутаций, бактериофаги подвержены негенетическим изменениям, в которых главная роль принадлежит клетке-хозяину. Это явление было названо модификациями, вызванными хозяином. Значение этих модификаций для молекулярной биологии состоит в том, что они показали способность внутриклеточной среды вызывать такие изменения в химической структуре генетического материала, которые могут быть использованы для идентификации клеточных линий, синтезирующих ДНК.
Подобные явления были впервые обнаружены на фаговой ДНК, но они также справедливы и для каждой бактериальной клеточной ДНК. Есть также наблюдения, при которых это явление относится и к эукариотическим клеткам. В особых случаях могут возникнуть более сложные ситуации. Двустороннее ограничение фага двумя хозяевами иногда наблюдается, но оно не обязательно. Фаги, отторгнутые клетками, способны адсорбироваться на них и проникать в их ДНК добавляя часть собственной ДНК. Однако последняя часть быстро разрушается, и репликация не происходит.
Деградация ДНК вызывается специфическими эндонуклеазами (рестриктазами или R-нуклеазами), которые могут обнаруживать и расщеплять определенные участки ДНК, если они не были модифицированы под влиянием М-ферментов. После этого ДНК расщепляется экзонуклеазами на отдельные нуклеотиды. Бактериальный штамм может иметь одну или несколько R-нуклеаз и в то же время M-ферменты, которые защищают собственную ДНК клетки. Предложена удобная номенклатура этих ферментов. Согласно ряду данных, области детекции R-нуклеазы не всегда совпадают с областями расщепления ДНК; возможно, что фермент может мигрировать по цепочке до того, как найдет область, где происходит расщепление ДНК. Функциональная роль индуцированных хозяином модификаций неясна.
Они способны защитить этот штамм бактерий от массового уничтожения фагами, растущими на различных бактериях. В более общем плане роль модификаций можно определить как защиту от проникновения неприемлемой чужеродной ДНК в бактериальную клетку и ее последующего «приживления». Бактерия А, которая отвергает фаги, размноженные на штамме В, также отвергает ДНК бактерии В, когда она вводится путем конъюгации или трансдукции.
Как видим, мутирование вирусов проходит достаточно сложный и тернистый путь в приобретении новых вирулентных свойств. Эти свойства могут быть как ослабляющими для развития инфекционного процесса, так и крайне агрессивными в своём новом виде.
Читайте также:
