Контрастная эхокардиография миокарда
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Контраст эхокардиография является улучшение визуализации сердца во время эхокардиографии путем инъекции микропузырьков воздуха.
Резюме
Исторический
Этот метод был разработан в конце 1980- х годов после первых испытаний в конце 1970- х годов для визуализации правого сердца и в 1990-х годах для исследования левого сердца.
Первые эксперименты с помутнением миокарда у животных (путем прямого введения в корень аорты) датируются началом 1980- х годов .
Принципы
Воздух - естественное препятствие для распространения ультразвука. Воздух в вену на руке попадает в правое предсердие через верхнюю полую вену , затем попадает в правый желудочек, а затем в легочные артерии. Теоретически его останавливает легочный капилляр, откуда он может эвакуироваться естественным путем. Следовательно, теоретически нет прохода в «большом круговороте» и, следовательно, в левых камерах сердца. Для визуализации последних необходимо создать пузырьки достаточно малых размеров, чтобы они прошли через легочный фильтр и защитили их небольшой оболочкой, чтобы продлить их жизнь.
Когда микропузырьки получают ультразвук, он улавливает его энергию и расширяется, пока его оболочка не взорвется. Это явление делает срок жизни пузырьков особенно коротким и подвергает риску расширение кровеносного сосуда, если размер пузырька близок к его диаметру. Это требует, с одной стороны, достаточно малого размера по сравнению с размером капилляра (кровеносного сосуда с наименьшим диаметром), а с другой стороны, чтобы контролировать подаваемую энергию в максимально возможной степени, т.е. количественно, или ограничивая максимальное временное окно ультразвукового обжига. На практике эта техника хорошо освоена и сопряжена с крайне низким риском.
После того, как пузырек разрушен, воздух быстро всасывается в кровь. Использование более тяжелых газов ( фторуглеродного типа , например октафторпропана ) обеспечивает большую стойкость пузыря, даже если его стенка разрушена. Их использование становится все более и более регулярным, и во многих других типах контрастного ультразвука заменяют использование пузырьков воздуха.
Производство
Больному не нужно голодать. Обследование может быть выполнено как с помощью обычной эхокардиографии, так и с помощью чреспищеводного ультразвукового исследования . Наличие контрастного вещества явно улучшает визуализацию сердца, поэтому в большинстве случаев предпочтительнее трансгрудное ультразвуковое исследование.
Обследование правых отделов сердца
Пузырьки образуются при интенсивном перемешивании одного миллилитра воздуха с обычным инфузионным раствором. Они более стабильны, если использовать макромолекулы или, возможно, кровь пациента. После образования они быстро вводятся под контролем УЗИ. Если требуется шунт (то есть аномальное прохождение крови между правой и левой камерами сердца), давление в первой может быть временно увеличено, если пациенту предложат кашлять или попросить его протолкнуть внутрь. Остановка дыхание ( маневр Вальсальвы ).
Обследование левого отдела сердца
Пузырьки состоят из микрогранул с биологической стенкой, смешанных с растворенным веществом, и вводятся путем контролируемой перфузии.
Показания
Обнаружение внутрисердечного шунта
Суть его состоит в поиске открытого овального отверстия . Последний свидетельствует о нормальном прохождении крови между правой и левой полостями эмбриона. При рождении это овальное отверстие теоретически закрывается навсегда, но может временно открыться снова, что может быть причиной нескольких проблем:
- ишемическая атака при парадоксальной эмболии : в венозной сети образуется сгусток ( флебит ). Он мигрирует и попадает в большой круг кровообращения через открытое овальное отверстие , вызывая окклюзию артерии. Более того, сосуществование открытого овального отверстия и аневризмы межпредсердной перегородки является фактором риска цереброваскулярных нарушений .
- рефрактерная деоксигенация крови ( гипоксия ) при хронической дыхательной недостаточности ;
- парадоксальная воздушная эмболия , либо во время декомпрессионной болезни во время подводного плавания, либо во время хирургического или медицинского вмешательства.
Поиск открытого овального отверстия осуществляется путем введения пузырьков, образующихся при перемешивании обычного раствора с небольшим количеством воздуха.
Улучшена визуализация контуров левого желудочка.
Контрастное ультразвуковое исследование все менее и менее полезно в этом показании из-за улучшения ультразвуковых аппаратов и качества изображений.
Оценка перфузии миокарда
Гранулы микропузырьков попадают в коронарные артерии, если они проницаемы. В случае окклюзии ультразвуковое исследование показывает часть сердечной мышцы без контраста.
Применение инструмента количественной оценки скорости инфузии на экспериментальных моделях позволило лучше понять патофизиологию микроциркуляторного русла . Феномены «рекрутирования» и «де-рекрутирования» капилляров при открытии или закрытии последнего были идентифицированы как регуляторный элемент метаболических обменов, но также как источник «дефектов» перфузии, наблюдаемых в случае коронарного стеноза . Большой интерес также представляет оценка целостности капилляров после повторной перфузии. Это позволяет лучше направлять новые терапевтические процедуры реперфузии.
Побочные эффекты
Несчастные случаи, некоторые из которых могли закончиться летальным исходом, были связаны с использованием контрастных веществ, что вынудило Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США в 2007 году выдать предупреждение относительно их использования. На практике этот риск остается крайне редким. Тем не менее, у всех контрастных продуктов для ультразвукового исследования были противопоказания:
- недавнее вмешательство на коронарных артериях или любой другой фактор, указывающий на клиническую нестабильность;
- острая сердечная недостаточность 3 или 4 стадии;
- инфаркт миокарда в процессе конституции или в прогрессировании.
В то же время следует отметить, что эти контрастные продукты представляют низкий или нулевой риск в большинстве случаев, наблюдаемых клинически. Однако количество исследований, изучающих их потенциальные воздействия и риски, ограничено, и их все еще необходимо продолжить.
Контрастная эхокардиография и Global longituninal strain как маркеры коронарного и миокардиального резерва у больных ишемической болезнью сердца
Мрикаев Д. В., Голухова Е. З., Машина Т. В., Джанкетова В. С.
ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» Минздрава России;
Предпосылки: Оценка систолической функции левого желудочка (ЛЖ) у больных ишемической болезнью сердца (ИБС) имеет большое значение при выборе тактики лечения. Современные ультразвуковые технологии - Speckle Tracking с расчетом Global longituninal strain (GLS) и контрастная эхокардиография (ЭхоКГ) являются высокоинформативными инструментами в оценке миокардиального и коронарного резерва у этой группы больных. Цель: Оценка систолической функции ЛЖ с использованием GLS и перфузии миокарда методом контрастной ЭхоКГ. Методы. В исследование вошли 14 пациентов с ишемической кардиомиопатией (ИКМП) (средний возраст составил 63±6 года) и 13 здоровых обследуемых контрольной группы (средний возраст составил 58±7 лет). Критерии исключения: пациенты с органическими клапанными пороками и после операций на сердце. Пациентам выполнена стандартная двухмерная ЭхоКГ с определением конечно-диастолического объема левого желудочка (КДО ЛЖ), конечно-систолического объема левого желудочка (КСО ЛЖ) и фракции выброса левого желудочка (ФВ ЛЖ), контрастная ЭхоКГ с использованием контраста Sonovue (Bracco), а также расчет GLS в режиме Speckle Tracking на УЗ – аппарте Philips Epiq. Проводилась оценка объемов и ФВ ЛЖ в режиме контрастирования Low Mechanical Index. По данным коронарографии все пациенты имели многососудистое поражение коронарного русла. Результаты. В группе больных с ИКМП средний КДО ЛЖ составил 219 мл ± 108.4 мл (p=0.02), КСО ЛЖ – 122 мл ± 87.4 мл (p=0.03), средняя ФВ ЛЖ - 43,2% ± 11.5% (p=0.02). В контрольной группе КДО ЛЖ составил 119 мл ± 25,4 мл (p=0.04), КСО ЛЖ - 42 ± 14,3 (p=0.02), средняя ФВ ЛЖ - 61,2% ± 8.5% (p=0.03). Средний GLS в группе ИКМП составил -10,55%±4,7% (р=0.04), в контрольной группе – - 19,7 % ± 7.4% (p=0.02). Среднее значение времени механической дисперсии (Time SD (standart dispersion)) в группе ИКМП составило 76.44 мс±33 мс (р=0.04), в контрольной группе – 33 мс ± 15 мс (p=0.02). Перфузия оценивалась качественным методом по трехбалльной шкале. Отсутствие перфузии (0 баллов) отмечалось у 3 больных, гипоперфузия (1 балл) - у 7 больных, нормальная перфузия (2 бала) – у 4 больных. Выявлена высокая корреляция показателей GLS и КДО ЛЖ (r= 0,78, p=0.01), GLS и КСО ЛЖ (r= 0,78, p=0.01), GLS и ФВ ЛЖ (r= -0,88, p=0.03), GLS и Time SD (r=0.53, p=0.04). Отмечена высокая достоверная корреляция GLS с перфузией миокарда (r= - 0,8, p=0.03). Выводы. При выборе тактики лечения у больных с ИКМП может быть полезными комбинированное применение показателей GLS и контрастной ЭхоКГ в режиме перфузии для определения миокардиального и коронарного резервов
Комментарии посетителей
Комментарии могут отправлять участники данного мероприятия или члены Ассоциации.
Преимущества членства в ассоциации
Контрастная эхокардиография миокарда
Контрастная эхокардиография миокарда
а) Оценка перфузии миокарда. Отныне, благодаря низко- и высокоэнергетическим методикам, можно эхокардиографически визуализировать перфузию миокарда на фоне внутривенного введения содержащего микропузырьки контрастного средства. Основным принципом здесь является сильная отражающая способность микропузырьков в крови, а также богатого капиллярами миокардиального сосудистого русла, так что повышение интенсивности сигнала от миокардиальных структур («окраска миокарда») после внутривенного введения контрастного средства служит доказательством миокардиальной перфузии.
Следовательно, при визуальной оценке локальный дефект окраски миокарда в покое может быть расценен как указание на окклюзию коронарной артерии, а при максимальной вазодилатации — на стенозирование коронарной артерии или на нарушение коронарной микроциркуляции. Эта оценка региональной негомогенности перфузии в принципе обусловливает возможность диагностики макроваскулярных нарушений кровоснабжения миокарда (коронарных стенозов).
Однако миокардиальная контрастная ЭхоКГ позволяет, кроме того, количественно определить объем и поток миокардиальной перфузии, так что эти исследования можно выполнять в группах пациентов с нарушениями микроциркуляции (например, при сахарном диабете или гипертонической болезни) с диагностической целью и для контроля эффективности терапевтических мероприятий.

б) Технические предпосылки. Как уже было указано выше, появление контрастной эхокардиографии миокарда с внутривенным введением контрастных средств является результатом многолетних проб и ошибок как в разработке контрастных средств, так и в применении традиционной, так называемой фундаментальной ЭхоКГ, что стало поводом для многочисленных физических исследований и технических изобретений.
Фактически до 1998 г. клинически пригодные изображения перфузии можно было получить только при помощи внутрикоронарного или, соответственно, внутриартериального введения контрастных средств. Поэтому современный прорыв в развитии физических представлений и технических возможностей обусловливает необходимость описания текущего положения дел или краткого технического введения для специалиста по ультразвуковой диагностике, который хотел бы начать работу с этой крайне интересной областью исследований.
Доступные сегодня контрастные средства соответствуют важнейшим условиям для успешного клинического применения: они обладают транскапиллярной стабильностью и достаточной сохранностью в акустическом поле.
в) Апробированные клинические области применения. Для пациентов с ишемической болезнью сердца исследование коронарной микроциркуляции при помощи контрастной эхокардиографии миокарда расширяет диагностические и прогностические возможности в нижеследующих клинических ситуациях.
1. Острый коронарный синдром:
- «Зона риска» и коллатеральный кровоток. При помощи внутривенного контрастирования можно перед плановой реваскуляризацией надежно определить зону риска, как это уже длительное время практикуется при помощи интракоронарного контрастирования. В дополнение можно исследовать коллатеральное кровоснабжение на территории окклюзированной коронарной артерии. В действительности, сегодня нет другой техники, которая способна была бы предоставить эту информацию настолько же быстро и с таким же хорошим пространственным разрешением. В опубликованном Sabia исследовании на 33 пациентах с подострым инфарктом миокарда размер области миокарда, снабжаемой из коллатеральных сосудов, оказался неожиданно высоким, до 50-100% от зоны инфаркта. Выделение пациентов с достаточным коллатеральным кровотоком в зоне острого инфаркта миокарда позволило бы отодвинуть реваскуляризирующее вмешательство на ближайший, но плановый срок, тогда как обнаружение недостаточной резидуальной перфузии, вероятно, приводило бы к необходимости экстренного вмешательства.
- Феномен невосстановления кровотока. После экстренной реваскуляризации оценивается, как это впервые описал Lang в 1986 г., функциональный успех этого вмешательства. Внутривенное контрастирование особенно хорошо позволяет диагностировать описанный впервые Ito неблагоприятный феномен невосстановления кровотока (no reflow), несмотря на макроскопически успешную реваскуляризацию и поток на уровне TIM 1-3.
Agati в исследовании AMICI показал, что величина дефекта перфузии после экстренной реваскуляризации лучше прогнозирует фракцию выброса левого желудочка и ремоделирование левого желудочка, чем оценка нарушения движения стенки миокарда.
2. Хронический коронарный синдром. Значимый стеноз коронарной артерии при нагрузке ведет к относительной гипоперфузии снабжаемой территории и, следовательно, от метаболических гипоксических реакций к нарушениям диастолического и систолического движения стенки. Тогда как последние изменения были доказаны уже около 10 лет назад при помощи традиционной ЭхоКГ с использованием тканевой допплерографии, внутривенное контрастирование вместе с низкоэнергетическими методиками делает возможной и визуализацию региональной гипоперфузии; при этом чувствительность и специфичность, составляющие для опирающихся только на перфузию методик 86 и 88% соответственно, в комбинации с анализом нарушений движения стенки миокарда повышаются до уровня точности, превосходящего точность нагрузочных тестов с использованием МРТ. Для дифференциального диагноза при острой боли в груди без подъема ST эхокардиографическая оценка движения сердечной стенки и перфузии миокарда у 1017 пациентов в покое дала важную диагностическую и прогностическую информацию.
3. Жизнеспособность и «гибернирующий миокард». Жизнеспособность связана с интактной микроциркуляцией. В связи с этим контрастная ЭхоКГ позволяет проводить прогностически важную дифференцировку между жизнеспособным и некротизированным миокардом, а также оценивать обусловленное коллатералями остаточное кровоснабжение в соотношении с дефектом перфузии в состоянии после инфаркта миокарда и визуализировать зону кровотока в соотношении с зоной «по-reflow» у пациентов после реваскуляризации. Кроме того, контрастная ЭхоКГ при хронической дисфункции миокарда помогает дифференцировать гибернирующий миокард от миокарда с необратимым нарушением функции.
4. Метаболический синдром без КБС и в сочетании с КБС. В последнюю очередь обратимся к далеко не последней по значимости, эндемически обширной и терапевтически полностью недоисследованной области нарушенной миокардиальной микроциркуляции из-за эндотелиальной дисфункции, которая по прежним патофизиологическим представлениям является основой как для коронарной болезни сердца, так и для традиционных сердечно-сосудистых факторов риска у пациентов с метаболическим синдромом. В действительности сегодня уже доказано, что обусловленное микроваскулярными изменениями снижение перфузии миокарда у пациентов с сахарным диабетом 2-го типа в целом выражено в той же степени, что и снижение макро-/микроваскулярной перфузии у пациентов с одно- или двухсосудистым поражением без диабета. Радует, что сегодня уже есть и первые публикации, основанные на контрастной ЭхоКГ, которые на фоне лечения показывают улучшение этой сниженной (о чем известно также по данным ПЭТ и ангиографии) перфузии у диабетиков, будь то в результате интенсивной терапии С-пептидом у пациентов с диабетом 1-го типа, будь то благодаря улучшению характеристик обмена веществ в течение 3 нед., будь то в результате профилактически назначенного сердечно-сосудистого препарата.
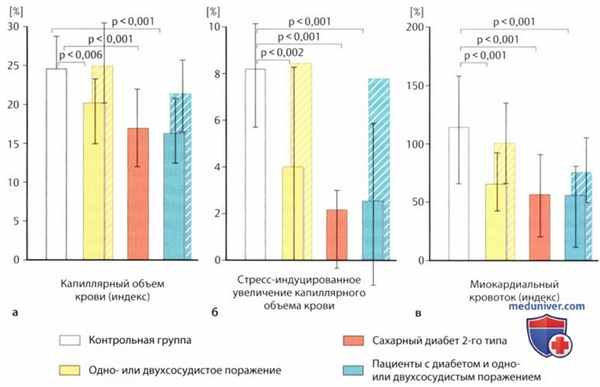
Глобальные (столбики с монотонной раскраской) параметры левожелудочковой перфузии во время максимальной вазодилатации в контрольной группе (белый цвет) в сравнении параметрами у пациентов с одно- или двухсосудистым поражением (желтый цвет), у пациентов с диабетом 2-го типа без ИБС (красный цвет) и у диабетиков с одно- или двухсосудистым поражением (зеленый цвет).
В трех группах пациентов видна одинаковая выраженность значимого снижения (см. соответствующие значения р) глобального капиллярного объема крови при максимальной вазодилатации (слева), его вызванного дипиридамоловым стрессом повышения в сравнении с состоянием покоя (в середине) и глобального миокардиального кровотока (справа). В обеих группах с ИБС была также исследована ангиографически нормальная коронарная территория (параметры изображены позади соответствующего столбика, штриховая раскраска) как аналоговая модель потенциально нормальной микроваскулярной перфузии; в группе без диабета параметры значимо не отличались от контрольной группы, однако даже в группе «диабет + ИБС» были значимо лучше, чему пациентов только с диабетом 2-го типа (р<0,02).
В группе с ИБС были отмечены значимо более высокие дозы приема бета-адреноблокаторов, статинов и аспирина, чем в группах контроля и диабета (из 23).
г) Итоги и перспективы. В целом можно установить, что отныне возможна качественная и количественная оценка миокардиальной перфузии с помощью контрастной ЭхоКГ после внутривенного введения ультразвукового контрастного средства. Многочисленные публикации подтверждают выраженную клиническую релевантность различных диагностических и терапевтических консервативных или интервенционных методик.
Тем не менее стремительный технический прогресс в техниках исследования и анализа требует процесса стандартизации и клинической валидации в мультицентровых исследованиях, прежде чем можно будет ожидать, что эти методики будут приняты в клиническую практику. Кроме того, имеется вынужденная задержка, пока ультразвуковые контрастные средства не поступят, наконец, на рынок с разрешением использования для визуализации перфузии.
Благодаря возможности диагностики у постели больного и произвольному числу повторов контрастной ЭхоКГ миокарда в медицине теперь есть инструмент, который позволяет экономически выгодно и без лучевой нагрузки получить новый взгляд на коронарную микроциркуляцию и тем самым служит для ранней диагностики нарушений перфузии и для контроля при тестировании новых перспективных препаратов и техник лечения. То, что от этих результатов выиграют не только пациенты с ИБС, но и пациенты с метаболическим синдромом, например, с сахарным диабетом 2-го типа, значительно увеличивает клиническое значение этой техники.
КОНТРАСТНАЯ СТРЕСС-ЭХОКАРДИОГРАФИЯ С ОЦЕНКОЙ МИОКАРДИАЛЬНОЙ ПЕРФУЗИИ КАК РЕШАЮЩИЙ НЕИНВАЗИВНЫЙ МЕТОД ДИАГНОСТИКИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА У ПАЦИЕНТА С ЧАСТОЙ ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИЕЙ И ПОГРАНИЧНЫМ СТЕНОЗОМ ПЕРЕДНЕЙ МЕЖЖЕЛУДОЧКОВОЙ АРТЕРИИ
Наличие пограничных стенозов (от 30 до 50% от диаметра артерии), по данным коронарографии, у пациентов с желудочковыми нарушениями ритма зачастую является сложной клинической задачей и требует дополнительного подтверждения ишемии миокарда. Представленный клинический пример демонстрирует возможности и потенциальные преимущества проведения контрастной стресс-эхокардиографии (ЭхоКГ) с оценкой миокардиальной перфузии в диагностике гемодинамической значимости пограничного поражения передней межжелудочковой артерии при частой желудочковой экстрасистолии (ЖЭ).
Ключевые слова
Об авторах
Тюменский кардиологический научный центр, Томский национальный исследовательский медицинский центр Российской академии наук
Россия
канд. мед. наук, научный сотрудник лаборатории инструментальной диагностики Научного отдела инструментальных методов исследования, врач рентгенэндоваскулярных методов диагностики и лечения № 1,
625026, Тюмень, ул. Мельникайте, 111
Тюменский кардиологический научный центр, Томский национальный исследовательский медицинский центр Российской академии наук
Россия
канд. мед. наук, заведующий отделением ультразвуковой диагностики, старший научный сотрудник лаборатории инструментальной диагностики Научного отдела инструментальных методов исследования,
625026, Тюмень, ул. Мельникайте, 111
Тюменский кардиологический научный центр, Томский национальный исследовательский медицинский центр Российской академии наук
Россия
д-р мед. наук, профессор, заслуженный деятель науки Российской Федерации, заместитель директора,
625026, Тюмень, ул. Мельникайте, 111
Тюменский кардиологический научный центр, Томский национальный исследовательский медицинский центр Российской академии наук
Россия
лаборант-исследователь лаборатории инструментальной диагностики Научного отдела инструментальных методов исследования,
625026, Тюмень, ул. Мельникайте, 111
Тюменский кардиологический научный центр, Томский национальный исследовательский медицинский центр Российской академии наук
Россия
канд. мед. наук, научный сотрудник отделения нарушений ритма сердца Научного отдела инструментальных методов исследования,
625026, Тюмень, ул. Мельникайте, 111
Тюменский кардиологический научный центр, Томский национальный исследовательский медицинский центр Российской академии наук
Россия
врач-кардиолог клинико-консультативного отделения,
625026, Тюмень, ул. Мельникайте, 111
Тюменский кардиологический научный центр, Томский национальный исследовательский медицинский центр Российской академии наук
Россия
врач кардиолог кардиологического отделения № 1,
625026, Тюмень, ул. Мельникайте, 111
Список литературы
1. Wang H., Abajobir A.A., Abate K.H., Abbafati C., Abbas K.M., Abd-Allah F., et al. Global Burden of Disease 2016 Mortality Collaborators. Global, regional, and national under-5 mortality, adult mortality, agespecific mortality, and life expectancy, 1970–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 2017;390:1084– 1150. DOI: 10.1016/S0140-6736(17)31833-0.
2. Шальнова С.А., Деев А.Д., Оганов Р.Г. Факторы, влияющие на смертность от сердечно-сосудистых заболеваний в российской популяции. Кардиоваскулярная терапия и профилактика. 2005;4(1):4–8.
3. Голицын С.П., Кропачева Е.С., Майков Е.Б., Миронов Н.Ю., Панченко Е.П., Соколов С.Ф. и др. Клинические рекомендации диагностика и лечение нарушений ритма сердца и проводимости Часть II. Кардиологический вестник. 2014;9(3):3–52.
4. Panizo J.G., Barra S., Mellor G., Heck P., Agarwal S. Premature Ventricular Complex-induced Cardiomyopathy. Arrhythmia & Electrophysiology Review. 2018;7(2):128–134. DOI: 10.15420/aer.2018.23.2.
5. Lin C.Y., Chang S.L., Lin Y.J., Chen Y.Y., Lo L.W., Hu Y.F., et al. An observational study on the effect of premature ventricular complex burden on long-term outcome. Medicine (Baltimore). 2017;96(1):e5476. DOI: 10.1097/MD.0000000000005476.
6. Priori S.G., Blomstrom-Lundqvist C., Mazzanti A., Blom N., Borggrefe M., Camm J., et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac Death. The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology. Eur. Heart J. 2015;36(41):2793–2867. DOI: 10.1093/eurheartj/ehv316.
7. Neumann F.J., Sousa-Uva M., Ahlsson A., Alfonso F., Banning A.P., Benedetto U., et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur. Heart J. 2018;00:1–96. DOI: 10.1093/eurheartj/ehy394.
8. Кузнецов В.А., Самойлова Е.П., Бессонов И.С., Гультяева Е.П., Зырянов И.П., Бердинских С.Г. и др. Отдаленные результаты чрескожных коронарных вмешательств в сравнении с медикаментозной терапией при лечении пациентов со стабильной ишемической болезнью сердца в реальной клинической практике. Российский кардиологический журнал. 2016;2:7–11. DOI: 10.15829/1560-4071-2016-2-7-11.
9. Al-Lamee R., Thompson D., Dehbi H.M., Sen S., Tang K., Davies J., et al. Percutaneous coronary intervention in stable angina (ORBITA): a double-blind, randomised controlled trial. Lancet. 2018;391(10115):31–40. DOI: 10.1016/S0140-6736(17)32714-9.
10. Wijeysundera H.C., Bennell M.C., Qiu F., Ko D.T., Tu J.V., Wijeysundera D.N., et al. Comparative-Effectiveness of Revascularization versus Routine Medical Therapy for Stable Ischemic Heart Disease: A Population-Based Study. J. Gen. Intern. Med. 2014;8:1–9. DOI: 10.1007/ s11606-014-2813-1.
11. Кузнецов В.А., Самойлова Е.П., Бессонов И.С., Гультяева Е.П., Бердинских С.Г., Горбатенко Е.А. и др. Чрескожные коронарные вмешательства в сравнении с медикаментозной терапией у пациентов с хронической ишемической болезнью сердца: результаты отдаленного наблюдения. Consilium medicum. 2018;1:33–37. DOI: 10.26442/2075-1753_2018.1.33-37.
12. Седов В.П., Алехин М.Н., Корнеев Н.В. Стресс-эхокардиография. М.: ЗАО «Информатик»; 2000:152.
13. Rieber J., Jung P., Erhard I., Koenig A., Hacker M., Schiele T.M., et al. Comparison of pressure measurement, dobutamine contrast stress echocardiography and SPECT for the evaluation of intermediate coronary stenoses. The COMPRESS trial. Int. J. Cardiovasc. Intervent. 2004;6(3–4): 142–147. DOI: 10.1080/14628840410030504.
14. Montalescot G., Sechtem U., Achenbach S., Andreotti F., Arden C., Budaj A., et al. ESC guidelines on the management of stable coronary artery disease. The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur. Heart J. 2013;34(38):2949–3003. DOI: 10.1093/eurheartj/eht296.
17. Даренский Д.И., Жарова Е.А., Матчин Ю.Г. Инвазивные методы определения функциональной значимости коронарных стенозов пограничной степени выраженности. Кардиологический вестник. 2016;11(2):80–89.
Эхокардиография (ЭхоКГ)
Эхокардиография (ультразвуковая кардиография, Эхо-КГ) – метод исследования сердца при помощи импульсного ультразвука. Метод основывается на регистрации ультразвуковых волн, отражённых на границе структур сердца, имеющих различную плотность.
Показания к эхокардиографии:
- приобретённых пороки сердца
- некоторые врождённые пороки сердца
- кардиомиопатии
- ишемическая болезнь сердца (стенокардия, инфаркт миокарда)
- загрудинные боли неясной этиологии
С помощью эхокардиографии определяют:
- объём желудочков сердца
- толщину сердечной стенки
- массу миокарда
- ударный объём сердца.
В дополнение к созданию двумерных изображений сердца, эхокардиография позволяет произвести точную оценку скорости кровотока и работы сердца в любой произвольной точке с помощью импульсных или непрерывных ультразвуковых волн (доплерография). Это позволяет оценить состояние клапанов и выявить любые патологические движения крови между камерами сердца, любые «утечки» через клапаны (регургитация), рассчитать объем и фракции сердечного выброса . Другие измеряемые параметры включают размеры сердца и его структур.
Эхокардиография была одним из первых применений ультразвука в медицине. В эхокардиографии также впервые применили внутривенный ультразвуковой контраст. Этот метод использует введение газовых микропузырьков в венозную систему для улучшения разграничения тканей и крови. Контрастная эхокардиография в настоящее время также используется для оценки перфузии миокарда. Она также может быть использована с допплерографией. Есть множество ситуаций, в которых может оказаться полезным контрастное вещество, для улучшения визуализации некоторых структур. Особенно важным становится контрастирование при эхокардиографии для определения ишемии миокарда и жизнеспособности миокарда.
Эхокардиография стала широко использоваться для диагностики болезней сердца и для наблюдения за пациентами с болезнями сердца. Это одно из наиболее широко используемых исследований в кардиологии. Эхокардиография может предоставить массу полезной информации: размер и форма сердца (объем внутренних камер), сила сокращения, локализация и объем повреждения тканей. Эхокардиография не только позволяет врачам оценить состояние клапанов сердца, но она способна обнаружить нарушения внутрисердечного кровотока (например, обратный ток крови при недостаточности клапанов). По сокращениям сердечной стенки эхокардиография помогает выявить наличие и оценить тяжесть ишемии миокарда. Эхокардиография также помогает подтвердить или исключить кардиальное происхождение загрудинных болей. Эхокардиография также может помочь обнаружить кардиомиопатии (например, гипертрофическая кардиомиопатия ). Самым большим преимущество для эхокардиографии является неинвазивность, отсутствие осложнений и риска для пациента.
Объемная ( 3D- эхокардиография) эхокардиография стала возможной благодаря использованию множества ультразвуковых излучателей и соответствующей системы обработки сигналов. 3D- эхокардиография дает подробное изображение сердца, в котором можно точнее оценить структурные нарушения (клапанные пороки и кардиомиопатии ). Трехмерная картина дает возможность получать виртуальные «срезы» сердца в любой плоскости и реконструировать трехмерные изображения анатомических структур в режиме реального времени. 3D- эхокардиография может быть использована для направления манипулятора во время биопсии правого желудочка (эндомиокардиальная биопсия).
Читайте также:
