Кости при гипертиреозе - лучевая диагностика
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Для цитирования: Шестакова Т.П., Комердус И.В. Диагностика редких заболеваний щитовидной железы. РМЖ. 2015;8:458.
В большинстве случаев изменения уровня тиреотропного гормона (ТТГ) и тиреоидных гормонов носят разнонаправленный характер, и диагностика заболевания не вызывает затруднений. Однако в некоторых случаях гормональные изменения не столь очевидны, и требуется дифференциальная диагностика редких заболеваний.
Клинический случай
Пациентка А., 70 лет, направлена в ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского» в связи с выявленным одновременным повышением уровней ТТГ и свободного (св.) Т4.
Из анамнеза известно, что у больной в течение 5 лет фибрилляция предсердий, по поводу чего она постоянно получает β-адреноблокаторы. Одновременно с выявлением нарушения ритма сердца на основании однократного повышения уровня ТТГ до 6,5 мкЕд/мл был диагностирован субклинический гипотиреоз и назначен левотироксин натрий в суточной дозе 50 мкг. Больная принимала препарат в течение 3 лет, после чего самостоятельно его отменила. Через 1 год после отмены левотироксина натрия были выявлены изменения в гормональном анализе крови: ТТГ – 10,3 мкЕд/мл (норма – 0,25–3,5), св. Т4 – 58,0 пмоль/л (норма – 10–26), св. Т3 – 10 пмоль/л (норма – 1,4–4,0), антитела к тиреоидной пероксидазе – 890 Ед/л (при норме <50). По данным УЗИ объем щитовидной железы (ЩЖ) – 42 мл с диффузным изменением структуры, без явных узловых образований.
При обследовании в ГБУЗ МО «МОНИКИ им. М.Ф. Владимирского» не было выявлено явных клинических признаков нарушения функции ЩЖ. Однако у больной сохранялась фибрилляция предсердий с частотой сокращения желудочков 67–125 ударов/мин. АД было в пределах нормальных значений (125/80 мм рт. ст.). При пальпаторном исследовании выявлялся зоб I степени по классификации ВОЗ, узлы в ЩЖ не пальпировались. Тремора рук в позе Ромберга не было. При лабораторном исследовании подтверждено повышение уровня ТТГ в 2,5 раза, св. Т4 – в 2 раза, общего (общ.) Т3 – в 3 раза (ТТГ – 10,2 мЕ/л (норма – 0,2–4,0)), св. Т4 – 47 пмоль/л (норма – 9–23), общ. Т3 – 6,64 нмоль/л (норма – 1–2,8) соответственно), повышенный уровень фолликулостимулирующего гормона соответствовал менопаузе. Были исследованы некоторые метаболические показатели, изменяющиеся при нарушении функции ЩЖ: холестерин, глобулин, связывающий половые гормоны (ГСПГ), КФК. Все показатели были в пределах нормы (холестерин – 4,5 ммоль/л (норма – 3,3–5,2), ГСПГ – 88,1 нмоль/л (норма – 28–112), КФК – 91 Ед/л (норма – 24–170)), что подтверждало эутиреоидное состояние больной, несмотря на повышенный уровень тиреоидных гормонов. У больной было подтверждено наличие зоба по данным УЗИ с сохранением диффузных изменений структуры. Для исключения тиреотропиномы была проведена магнитно-резонансная томография (МРТ) гипофиза, которая не выявила каких-либо изменений. При сцинтиграфии ЩЖ накопление радиофармацевтического препарата было достаточным, симметричным, неравномерным.
В представленном клиническом случае у пациентки, с одной стороны, имеются однонаправленные изменения уровня ТТГ и тиреоидных гормонов, а с другой – отсутствуют явные клинические проявления тиреотоксикоза или гипотиреоза. При выявлении у больного одновременно повышенных уровней ТТГ и тиреоидных гормонов необходимо исключить лабораторную ошибку, а также выяснить, касается ли повышение всех фракций тиреоидных гормонов или изолированно повышен уровень общей либо свободной фракции.
Причинами повышения общей фракции тиреоидных гормонов являются высокий уровень тиреоидсвязывающего глобулина (ТСГ) или семейная дисальбуминемическая гипертироксинемия. Причины повышения ТСГ приведены в таблице 1. На показатели тиреоидных гормонов могут влиять не только уровень ТСГ, но и изменение его аффинности, причем при ее повышении растет концентрация общей фракции тиреоидных гормонов, а при снижении повышается уровень свободной фракции. Описаны семейные формы высокой аффинности ТСГ, сопровождающейся высоким уровнем общ. Т4.
Семейная дисальбуминемическая гипертироксинемия проявляется значительным повышением уровней общ. Т4 и Т3 при сохранении нормального уровня ТТГ и эутиреоидного статуса пациента. Это состояние связано с доминантно наследуемой мутацией гена альбумина, при которой повышается его аффинность к тиреоидным гормонам. Для подтверждения диагноза необходимо определить свободные фракции Т4 и Т3 высокоточным методом равновесного диализа. Нормальные значения свидетельствуют о дефекте связывания тиреоидных гормонов в сыворотке, который может быть подтвержден измерением концентрации специфического белка или генетическим анализом.
Повышение свободных фракций тиреоидных гормонов может быть связано с приемом некоторых веществ и лекарственных препаратов, что требует тщательного сбора анамнеза. Так, в первые месяцы приема амиодарона может наблюдаться повышение ТТГ при одновременном повышении уровня св. Т4, что связано с воздействием препарата на дейодиназу типа 1. Эти изменения носят транзиторный характер, хотя длительный прием амиодарона может приводить к стойким изменениям тиреоидных гормонов, но связанным с другими механизмами. Повышение свободной фракции Т4 наблюдается при применении гепарина, который, как предполагается, влияет на связь тироксина с белком. В первые минуты после введения препарата уровень св. Т4 может повышаться в 2–5 раз даже после незначительных доз гепарина. В связи с этим не рекомендуется без веских причин исследовать уровень тиреоидных гормонов у больных, получающих гепарин, или выполнять анализ ранее чем через 10 ч после введения препарата.
Некоторые широко применяемые лекарственные препараты также могут влиять на связь тиреоидных гормонов с белками, приводя к транзиторному повышению свободных фракций. К таким препаратам относятся фуросемид (особенно при в/в введении доз более 80 мг), ацетилсалициловая кислота, нестероидные противовоспалительные препараты.
При исключении вышеперечисленных причин повышения уровня тиреоидных гормонов необходимо проводить дифференциальную диагностику между: а) синдромом резистентности к тиреоидным гормонам (РТГ), б) тиреотропиномой, в) наличием антител к ТТГ, г) наличием антител к тиреоидным гормонам.
РТГ – синдром, характеризующийся сниженным ответом тканей на действие тиреоидных гормонов.
Точная распространенность синдрома РТГ в популяции неизвестна, что связано с отсутствием каких-либо жалоб у большинства пациентов. В некоторых странах, где скрининг на врожденный гипотиреоз проводится путем определения св. Т4, синдром РТГ может быть выявлен сразу после рождения. Согласно этим данным, распространенность РТГ составляет 1:40000 с одинаковой встречаемостью у мальчиков и девочек. В России, как и в большинстве других стран, данная патология не выявляется при скрининге, т. к. диагностика врожденного гипотиреоза основана на определении уровня ТТГ, а в случае синдрома РТГ уровень ТТГ остается в пределах нормы или слегка повышен.
Причиной снижения чувствительности тканей к тиреоидным гормонам может быть нарушение транспорта гормонов внутрь клетки, процессов дейодинации и взаимодействия с рецептором.
Мутация МСТ8, осуществляющего транспорт тиреоидных гормонов внутрь клетки, является причиной развития синдрома Алана – Херндон – Дадли. Описано более 100 семей с этим синдромом. У больных наблюдаются умственная отсталость, нарушение глотания, спастическая тетраплегия, судороги, гипоплазия мышц. При гормональном обследовании выявляется значительное повышение уровня Т3, при этом уровень Т4 низко нормальный или немного снижен, рТ3 – снижен, а ТТГ – либо на верхней границе нормальных значений, либо немного повышен.
Нарушение процессов дейодинации, обусловленное снижением их синтеза, является крайне редким заболеванием (описано только 8 семей). У больных наблюдаются отставание в росте, задержка умственного развития легкой степени, нарушение моторики, мышечная слабость, снижение фертильности. При гормональном обследовании выявляются повышение уровней св. Т4 и рТ3, сниженный Т3 при нормальном или слегка повышенном ТТГ.
Наиболее частой причиной сниженной чувствительности тканей к тиреоидным гормонам является мутация генов рецепторов тиреоидных гормонов. Описаны более 1000 случаев и 350 семей. Выделяют 2 типа рецепторов: ТРα и ТРβ, гены которых локализуются на 17-й и 3-й хромосомах соответственно.
Разные виды рецепторов неравномерно экспрессируются в тканях организма. ТРα представлены в головном мозге, костной ткани и сердце. ТРβ подразделяют на 2 типа – 1 и 2. ТРβ1 представлены в печени, почках и ЩЖ, а ТРβ2 – в сетчатке, внутреннем ухе и гипофизе. Наибольшее значение в развитии синдрома РТГ имеют мутации гена ТРβ. Мутация может затрагивать более 50 аминокислот.
До выявления генетической основы РТГ подразделяли на генерализованную и гипофизарную формы на основании клинической картины и оценки биохимических параметров, отражающих ответ тканей на действие тиреоидных гормонов. При генерализованной форме РТГ пациенты находятся в эутиреоидном состоянии. Имеющийся у таких пациентов дефект тиреоидных рецепторов компенсируется высокими концентрациями тиреоидных гормонов в крови. При гипофизарной РТГ у пациентов имеются признаки тиреотоксикоза. При этом уровни тиреоидных гормонов высокие, а ТТГ не подавлен, в отличие от «классического» тиреотоксикоза, связанного, например, с диффузным токсическим зобом. В настоящее время классификация РТГ основывается на типе выявленной мутации.
В литературе описано всего несколько случаев мутации гена ТРα, причем это состояние имеет клинические особенности. У больных выявлялись симптомы гипотиреоза и аномалии органов, экспрессирующих ТРα (кости, ЖКТ, сердце, ЦНС, поперечно-полосатая мускулатура). При гормональном исследовании выявляются низкие уровни св. Т4 и рТ3, пограничное повышение Т3, нормальный или повышенный уровень ТТГ.
Большинство случаев синдрома РТГ связаны с мутацией гена ТРβ. При наличии мутации снижается чувствительность тиреотрофов к тиреоидным гормонам, вследствие чего увеличивается продукция ТТГ, который вызывает повышенный синтез тиреоидных гормонов и гипертрофию ЩЖ. При лабораторном исследовании уровни св. Т3 и св. Т4 в сыворотке крови превышают нормальные показатели, при этом уровень ТТГ либо нормальный, либо слегка повышен.
Несмотря на высокие концентрации тиреоидных гормонов, у пациентов с РТГ, как правило, нет жалоб. При объективном исследовании наиболее часто выявляется зоб. Однако в редких случаях могут присутствовать незначительные симптомы тиреотоксикоза, а в некоторых случаях – еще и гипотиреоза, что связано с распределением ТРα и ТРβ в организме (табл. 2).
Как было указано выше, ТРα преобладают в сердце, головном мозге и костях. При наличии мутации ТРβ ТРα не изменяется, и при высоком уровне тиреоидных гормонов органы, экспрессирующие α-рецепторы, испытывают «локальный» тиреотоксикоз, проявляющийся наиболее часто в виде тахикардии. Степень компенсации низкой чувствительности тканей к тиреоидным гормонам варьирует не только у разных пациентов, но и в разных тканях одного пациента. Именно поэтому у пациента могут наблюдаться одновременно незначительные проявления как тиреотоксикоза (например, тахикардия, гиперактивность), так и гипотиреоза (например, отставание в росте у детей, задержка созревания скелета).
Так как гормональные изменения схожи при синдроме РТГ и тиреотропиноме, требуется проведение их дифференциальной диагностики.
Некоторые биохимические показатели отражают периферическое биологическое действие тиреоидных гормонов и используются для выяснения тиреоидного статуса пациента. Например, уровни креатининфосфокиназы и холестерина повышены при гипотиреозе и снижены при тиреотоксикозе. Гормоны ЩЖ увеличивают синтез ГСПГ, поэтому его концентрация снижена при гипотиреозе и повышена при тиреотоксикозе. Уровень ферритина также повышен при тиреотоксикозе как результат влияния тиреоидных гормонов на эритропоэз. У больных с тиреотропиномой биохимические показатели соответствуют состоянию тиреотоксикоза, а при синдроме РТГ изменений, как правило, не наблюдается, т. к. больные находятся в состоянии эутиреоза.
Антитела к ТТГ и тиреоидным гормонам могут влиять на результат лабораторного обследования. При этом они могут приводить как к ложноположительным, так и ложноотрицательным результатам. К сожалению, определение таких антител не входит в перечень рутинных исследований, выполняющихся в диагностических лабораториях, и часто недоступно для практического врача.
Заключительным этапом обследования при подозрении на РТГ является генетическое исследование. Известно, что в большинстве случаев РТГ является наследственным синдромом с аутосомно-доминантным типом наследования, с локализацией мутации в 8–10 экзонах 3-й хромосомы. В настоящее время идентифицированы более 100 мутаций гена. Выявление мутации или наличие схожих гормональных изменений у родственников подтверждают диагноз РТГ. Однако у 10–15% больных мутация не выявляется. В 20–25% случаев мутация спорадическая, т. е. отсутствуют данные о наличии РТГ у ближайших родственников.
Пациентам с РТГ лечение не требуется. При наличии тахикардии назначают симптоматическую терапию β–адреноблокаторами или недигидропиридиновыми антагонистами кальция. Однако в клинической практике довольно часто пациентам с РТГ назначают лечение, направленное на устранение тиреотоксикоза. Причем в связи с неэффективностью консервативного лечения в некоторых случаях больные подвергаются радиойодтерапии и тиреоидэктомии. В этом случае для компенсации возникшего гипотиреоза назначается заместительная доза левотироксина натрия, которая может быть необычно высокой и в некоторых случаях достигает 1000 мкг/сут.
В случае выявления тиреотропиномы требуется оперативное лечение. В некоторых случаях, когда радикальная операция невозможна, прибегают к тиреоидэктомии с последующей заместительной терапией левотироксином натрия, а для контроля роста тиреотропиномы назначаются медикаментозное лечение аналогами соматостатина или лучевая терапия.
Таким образом, выявление у больного необычного сочетания повышенного уровня тиреоидных гормонов и неподавленного уровня ТТГ требует тщательного обследования больного и проведения дифференциальной диагностики для определения правильной тактики ведения.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Кости при гипертиреозе - лучевая диагностика
Кости при гипотиреозе и креатинизме - лучевая диагностика
а) Визуализация:
• Врожденный гипотиреоз: задержка развития скелета, эпифизы недоразвиты или отсутствуют, точечная дисплазия эпифизов, короткие, утолщенные кости
• Дебют в детском или подростковом возрасте: отставание костного возраста на 1-2 года, эпифизеолиз головки бедренной кости
б) Дифференциальная диагностика:
• Задержка развития скелета: обширный диапазон заболеваний; требуется исследование гормонов щитовидной железы
(Слева) Рентгенография таза в ПЗ проекции, выполненная у новорожденного. Отсутствие оссификации эпифиза головки бедренной кости указывает на задержку развития скелета. Выявление этого признака и его связь с гипотиреозом имеют ключевое значение в предотвращении осложнений этих заболеваний.
(Справа) Рентгенография левого тазобедренного сустава в ПЗ проекции, этот же пациент: определяется точечная дисплазия апофиза большого вертела - в этом случае не выраженная. Точечная дисплазия эпифизов - характерный симптом гипотиреоза. (Слева) Рентгенография таза в ПЗ проекции у четырехлетнего ребенка: определяется фрагментация эпифиза головки бедренной кости (обозначается термином «кретиноидное бедро»). Отмечается расширение пластинок роста в обоих тазобедренных суставах. Данные указывают на задержку развития скелета.
(Справа) Рентгенография кисти в ПЗ проекции, этот же пациент: определяются вспомогательные признаки - несколько пястных костей еще не визуализируются, отсутствуют эпифизы фаланг. Скелетный возраст кисти соответствует у новорожденному, а не четырехлетнему ребенку. Признаки характерны для гипотиреоза.
в) Патология:
• Врожденный гипотиреоз: чаще всего - йододефицит у матери - основная проблема общественного здравоохранения в слаборазвитых странах
• Дебют гипотиреоза в детском, подростковом, взрослом возрасте: чаще всего обусловлен аутоиммунным тиреоидитом (Хашимото); другие причины включают болезни гипофиза, подострый (вирусный) тиреоидит, идиопатический гипотиреоз
г) Клинические особенности:
• Более частые осложнения при дебюте в младенческом/детском возрасте или продолжительном гипотиреоидном состоянии
• Врожденный: умственная отсталость и задержка роста, вплоть до тяжелой степени:
о «Туповатое» лицо, толстый, высунутый язык, отечность лица, пупочная грыжа, сердечная недостаточность
о Желтуха, нарушение аппетита, хриплый крик, запор
о Предотвращение осложнений при начале лечения до 6-недельного возраста
о Ведущая причина предотвратимой умственной отсталости
• Юношеское начало: задержка роста скелета, позднее половое созревание, позднее прорезывание зубов
• Юношеское и взрослое начало:
о Отечное лицо, замедленная речь, птоз век
• Все заболевания: М < Ж
• Аутоиммунное заболевание: течение варьирует в зависимости от тяжести заболевания; дебют с гипертиреоза → эутиреоз → гипотиреоз (обычно в течение нескольких лет)
Тиреотоксикоз (гипертиреоз) - симптомы и лечение
Что такое тиреотоксикоз (гипертиреоз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., эндокринолога со стажем в 28 лет.
Над статьей доктора Курашова О. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Тиреотоксикоз (гипертиреоз) — гиперметаболический процесс, вызванный избытком тиреоидных гормонов в организме и их токсическим воздействием на различные органы и ткани. Клинически характеризуется увеличением щитовидной железы и поражением других систем и органов. [3] [5] [11]
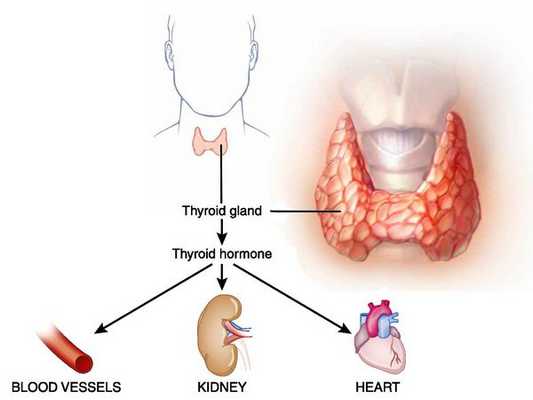
Первые описания этой патологии были найдены в работах персидского врача Джурджани, созданных в 1100 году. [5] [11]
Данный синдром встречается как у женщин (до 2%), так и у мужчин (до 0,2%). Чаще он возникает у людей в возрасте 20-45 лет.
Причины тиреотоксикоза
Причин возникновения тиреотоксикоза множество. К основным относятся:
- повышение продукции гормонов щитовидной железой вследствие различных заболеваний (диффузно-токсический, узловой зоб и другие);
- избыточный приём препаратов, содержащих гормоны щитовидной железы (нарушение назначенной схемы лечения гипертиреоза).
Факторы риска
Провоцирующим фактором синдрома является дополнительное количество йода, поступающее в организм при самостоятельном использовании йодных добавок.
Состояние тиреотоксикоза при диффузно-токсическом зобе является аутоиммунным заболеванием. Обычно оно развивается в результате избыточной выработки антител к рецептору тиреотропного гормона (ТТГ), производимого гипофизом.
Возникновение тиреотоксического состояния возможно при возникновении функциональной автономии уже существующего узла щитовидной железы — одно- и многоузлового зоба. Это заболевание развивается достаточно долго, в основном у людей, старше 45 лет. Так, в отсутствие воздействия ТТГ — основного физиологического стимулятора [7] [8] — узлы синтезируют количество тиреогормонов, превышающее потребность организма. [5] [6] [11]
Тиреотоксикоз при беременности
Во время беременности потребность организма женщины в тиреоидных гормонах возрастает на 30–50 %, поэтому изменение работы щитовидной железы происходит уже с первых недель беременности. Вследствие этого у 2 % беременных развивается гестационный гипертиреоз. Беременным рекомендуется вовремя обратиться к лечащему врачу, провести диагностику и подобрать необходимое индивидуальное лечение.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы тиреотоксикоза (гипертиреоза)
При опросе пациентов с подозрением на повышенную функцию щитовидной железы выявляются:
- непредсказуемая возбудимость, эмоциональная неустойчивость, беспричинная плаксивость;
- беспокойство и нарушение концентрации внимания, возникающее при нахождении в обществе;
- ежедневное нарушение сна;
- суетливость при выполнении любой работы;
- слабость во время ходьбы;
- повышенная потливость диффузного характера, не зависящая от физического или эмоционального напряжения, ощущение «жара»;
- периодические сердцебиения;
- дрожь в теле и нарастающая потеря веса (наблюдаются редко).
Эмоциональные расстройства сочетаются с двигательно-волевыми: появляется необходимость в постоянном движении и хореоподобные подёргивания. Причём тремор конечностей и тела - типичный симптом тиреотоксикоза. [2] [3] [5] [11]
Гиперпаратиреоз - симптомы и лечение
Что такое гиперпаратиреоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., эндокринолога со стажем в 28 лет.
Гиперпаратиреоз — это эндокринное заболевание, развивающееся при чрезмерном количестве паратиреоидного гормона (паратгормона) в организме, который выделяется околощитовидными железами.
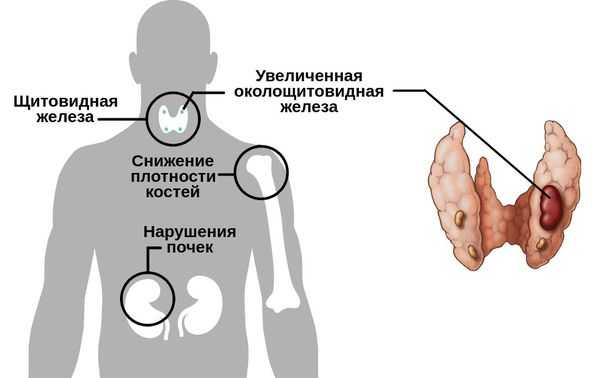
Существуют разные формы данного нарушения.
Первичный гиперпаратиреоз помимо нарушения околощитовидных желёз и избыточного выделения паратиреоидного гормона сопровождается верхне-нормальным или повышенным содержанием кальция в крови. Среди эндокринных заболеваний он встречается довольно часто: по распространённости эта форма гиперпаратиреоза находится на третьем месте после сахарного диабета и патологий щитовидной железы.
Ежегодная заболеваемость первичной формой составляет около 0,4–18,8% случаев на 10000 человек, а после 55 лет — до 2% случаев. [6] [12] У женщин эта патология возникает чаще, чем у мужчин — примерно 3:1. Преобладающее число случаев первичного гиперпаратиреоза у женщин приходится на первое десятилетия после менопаузы.
Первичный гиперпаратиреоз может быть как самостоятельным заболеванием, так и сочетаться с другими наследственными болезнями эндокринной системы. [1] [12] Он проявляется многосимптомным поражением различных органов и систем, что приводит к значительному снижению качества жизни с последующей инвалидизацией, а также к риску преждевременной смерти.
Причины возникновения связаны с развитием в одной или нескольких околощитовидных железах таких патологий, как:
- солитарная аденома — до 80-85% случаев;
- гиперплазия (диффузное увеличение желёз) — до 10-15 % случаев;
- рак — до 1-5% случаев;
- спорадические заболевания — до 90-95% случаев.
В 5% случаев на возникновение первичного гиперпаратиреоза влияет наследственность.
При вторичном гиперпаратиреозе кроме общих клинических признаков заболевания отличается снижением кальция и повышением фосфора в крови. Эта форма болезни обычно развивается как реакция компенсации и сочетает в себе усиленный синтез паратгормона и изменения в паращитовидных железах. Как правило, обнаруживается при синдроме недостаточного всасывания кальция в тонком кишечнике, дефиците витамина D и хронической почечной недостаточности.
Третичный гиперпаратиреоз развивается в случае аденомы околощитовидной железы и повышенном выделении паратгормона в условиях длительного вторичного гиперпаратиреоза.
Псевдогиперпаратиреоз развиваться п ри других злокачественных опухолях, которые способны продуцировать вещество, похожее на паратгормон.
Симптомы гиперпаратиреоза
Гиперпаратиреоз протекает длительно и бессимптомно и может быть выявлен случайно во время обследования по поводу другого заболевания.
У пациентов с гиперпарат иреозом одновременно возникают симптомы поражения различных органов и систем: язва желудка, остеопорозные проявления, мочекаменная и желчнокаменная болезни и другие. При пальпации шеи в зоне паращитовидных желёз можно нащупать достаточно большую "аденому".
Развивается быстрая утомляемость при физической повседневной нагрузке, мышечная слабость, ноющая головная боль, затруднение при ходьбе (особенно во время подъёма по лестнице или при преодолении больших расстояний), формируется как бы переваливающаяся походка.
У большинства людей с гиперпаратиреозом нарушено восприятие и память, они эмоционально неуравновешенны, тревожны, депрессивны.
При опросе пациенты с подозрением на нарушение функции околощитовидных желёз обычно жалуются на:
- длительно существующие боли в костях рук и ног, неровности и деформирующие изменения, возникающие при надавливании, частые судороги в ногах;
- эмоциональную неустойчивость, беспокойство и нарушение концентрации внимания, возникающее при нахождении в обществе;
- частое желание пить жидкость — вплоть до жажды с учащённым мочеиспусканием (не связанное с сахарным или несахарным диабетом);
- прерывистое нарушение сна и значительную утомляемость при выполнении любой работы;
- неуверенность и шаткость при ходьбе;
- повышенную потливость всего тела и конечностей;
- периодические сердцебиения днём и ночью;
- искривления и переломы (в основном трубчатых костей) при непредсказуемых обстоятельствах (даже при движениях лёжа в постели) — возникает в позднем периоде заболевания, сопровождается ноющими болями в позвоночнике.
Если патологический процесс в костях продолжает развиваться, это может стать причиной расшатывания и выпадения здоровых зубов, а также деформации костей скелета, в связи с которой пациенты становятся ниже ростом. Возникающие переломы очень медленно восстанавливаются, часто с деформациями р ук и ног и образованием непрочных суставов. На конечностях появляются кальцинаты — результат отложения солей.
У женщин с повышенной функцией щитовидной железы в менопаузе риск костных осложнений возрастает.
В большинстве случаев первые проявления гиперпаратиреоза сопровождаются:
- давно диагностированными нарушениями опорно-двигательного аппарата;
- хроническими заболеваниями почек (мочекаменная болезнь, отложение солей кальция в почках);
- нарушениями желудочно-кишечного тракта (панкреатит и кальцинат поджелудочной железы);
- выраженными, ранее нелеченными нейрокогнитивными и психическими расстройствами; в сочетании с гипертрофией миокарда левого желудочка (утолщением стенок сердца), а также нарушением проводимости и ритма сердца — зависят от уровня паратгормона.
При развитии поражения сосудов в виде кальциноза и склероза нарушается питание тканей и органов, а повышенный уровень кальция в крови способствует развитию и ухудшению ишемической болезни сердца.
Гиперпаратиреоз с нехарактерными симптомами и постепенным началом часто сопровождается:
- тошнотой, периодическими желудочными болями, рвотой, метеоризмом, снижением аппетита, резким падением веса;
- возникновением пептических язв с кровотечениями;
- поражением поджелудочной железы и желчного пузыря;
- на поздних стадиях — нефрокальцинозом, признаками прогрессирующей почечной недостаточности с последующей уремией (крайне опасным отравлением организма).
Патогенез гиперпаратиреоза
Кальций является важным компонентом, который влияет на прочность костей и обменные процессы в организме. В норме уровень кальция, а также фосфора поддерживает паратгормон, выделяемый околощитовидными железами.
При аденоме или ином нарушении этих желёз взаимосвязь кальция и паратгормона нарушается: если раньше повышенное содержания кальция сдерживало уровень паратгормона, то теперь развивается дефект рецепторов, чувствительных к кальцию, которые расположены на поверхности главных клеток паращитовидных желёз.
В связи с этим в организме происходит ряд нарушений:
- активируются остеобласты (молодые клетки костей) и увеличивается количество остеокластов (клеток, уничтожающих старые костные ткани), что приводит к ускорению естественного разрушения (растворения) костей и костеобразования — если уровень паратгормона повышен довольно длительно, то процессы разрушения начинают преобладать;
- снижается почечный порог обратного всасывания фосфатов (проявляется гипофосфатемией и гиперфосфатурией);
- в кишечнике всасывается дополнительное количество кальция; [2][7][9]
- в случае гиперплазии (увеличения количества клеток паращитовидных желёз) происходит нерегулируемая гиперпродукция паратгормона. [17]
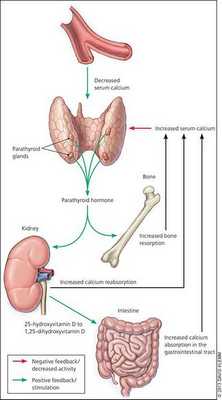
При избытке паратгормона усиливается выведение из костной ткани кальция и фосфора. Клинически это проявляется изменениями в костях: их искривлением и размягчением, возникновением переломов. При этом уровень кальция в костях снижается, а его уровень в крови заметно увеличивается, т. е. возникает гиперкальциемия. Она проявляется мышечной слабостью, избыточным выделением минералов с мочой при усиленном мочеиспускании и постоянной жаждой, что приводит к почечнокаменной болезни и нефрокальцинозу — накоплению и отложению солей кальция в главной ткани почек. Также избыток кальция в крови становится причиной нарушения тонуса сосудов и возникновения артериальной гипертензии. [1] [12]
У пациентов с первичным гиперпаратиреозом часто наблюдается острая нехватка витамина D, а после оперативного лечения заболевания повышается вероятность развития синдрома голодных костей — последствия гиперкальциемии. [15]
Классификация и стадии развития гиперпаратиреоза
Как уже говорилось, бывает первичный, вторичный и третичный гиперпаратиреоз. При этом первичную форму заболевания разделяют на три вида:
- субклинический — заболевание развивается без явных проявлений, можно заподозрить только по результатам биохимии крови;
- клинический — возникают выраженные симптомы болезни (нарушения опорно-двигательного аппарата, почек и ЖКТ);
- острый первичный — возникновение гиперкальциемического криза.
Согласно МКБ 10, выделяют четыре формы заболевания:
- первичный гиперпаратиреоз;
- вторичный гиперпаратиреоз;
- иные формы гиперпаратиреоза;
- неуточнённый гиперпаратиреоз.
Другая классификация гиперпаратиреоза, опубликованная в 2014 году, по степени выраженности симптомов разделяет заболевание на три формы:
- нормокальциемическую — определяется неизменными показателями общего и ионизированного кальция (с поправкой на альбумин), а также паратгормона за весь период наблюдения (двукратное определение этих показателей с интервалом в 3-6 месяцев);
- мягкую — можно установить при появлении жалоб (низкотравматичных переломов) и лабораторном подтверждении умеренно повышенного уровня кальция и паратгормона в крови;
- манифестную — возникает впервые, причём остро, сопровождается нарушениями костной ткани или внутренних органов, возникает риск развития гиперкальциемического криза.
В зависимости от того, какие именно органы или системы поражены, выделяют:
- костный гиперпаратиреоз — де формация конечностей, внезапные переломы, возникающие как бы сами по себе, остеопороз с возможными кистозными образованиями, болезнь Реклингхаузена;
- висцеральный гиперпаратиреоз — поражением внутренних органов:
- почечный — отличается тяжёлым течением, возникают частые приступы почечной колики, возможно развитие почечной недостаточности;
- желудочно-кишечный — холецистит, панкреатит, язвенная болезнь желудка и двенадцатиперстной кишки;
- смешанный гиперпаратиреоз — одновременное возникновение костных и висцеральных нарушений.
Осложнения гиперпаратиреоза
Длительное течение заболевания сказывается на формировании костей. Так, н а поздних стадиях вовремя не диагностированного гиперпаратиреоза наблюдаются:
- разрушение дистальных или концевых фаланг конечностей;
- сужение дистального отдела ключиц;
- очаги разрушения костей черепа;
- бурые опухоли длинных костей.
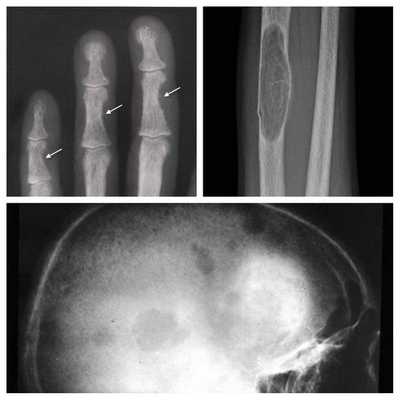
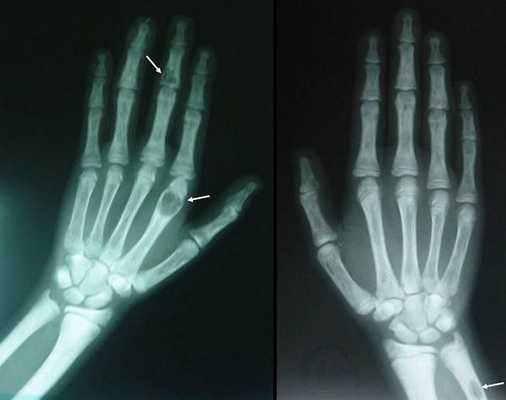
Самое тяжёлое осложнение гиперпаратиреоза — гиперкальциемический криз. Он возникает внезапно после резкого повышения уровня кальция в крови до 3,5-5 ммоль/л (в норме этот показатель составляет 2,15-2,50 ммоль/л). [17] Проявляется резким обострением всех симптомов гиперпаратиреоза.
Пусковые механизмы осложнения — острые инфекционные заболевания (чаще всего ОРВИ), внезапный перелом, длительный постельный режим, беременность, бесконтрольный приём препаратов, содержащих кальций и витамин D, а также тиазидных мочегонных средств.
Риск возникновения криза зависит от того, насколько повышен уровень кальция в крови. [17]
Эндокринная офтальмопатия - симптомы и лечение
Что такое эндокринная офтальмопатия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Сивова А. А., эндокринолога со стажем в 13 лет.
Над статьей доктора Сивова А. А. работали литературный редактор Вера Васина , научный редактор Сергей Цыганок и шеф-редактор Маргарита Тихонова
Эндокринная офтальмопатия (Endocrine ophthalmopathy) — это хроническое прогрессирующее аутоиммунное заболевание глаз. Чаще всего оно развивается из-за нарушений в работе щитовидной железы и проявляется воспалением тканей глаза, отёком, покраснением, выпячиванием глазного яблока и нарушением зрения.
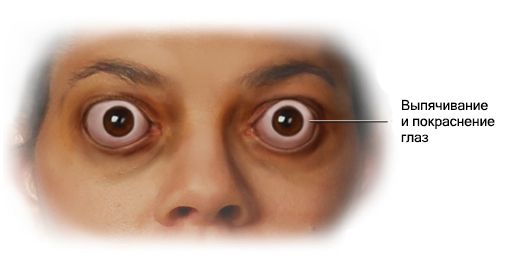
Эндокринную офтальмопатию ещё называют офтальмопатией Грейвса, тиреотоксическим или эндокринным экзофтальмом, инфильтративной, тиреоидной, эутиреоидной, дистиреоидной и аутоиммунной офтальмопатией.
Распространённость
Эндокринная офтальмопатия может развиться в любом возрасте, но чаще всего её выявляют:
- у женщин — в 40–44 и 60–64 года;
- у мужчин — в 45–49 и 65–69 лет.
Женщины болеют чаще, чем мужчины: ежегодно эндокринную офтальмопатию диагностируют у 16 женщин и у 2,9 мужчин на 100 000 населения [3] [6] .
Причины эндокринной офтальмопатии
В 80 % случаев заболевание развивается из-за болезни Грейвса (диффузного зоба), в 10 % — из-за аутоиммунного тиреоидита, и ещё в 10 % — на фоне нормального уровня гормонов и без аутоиммунной патологии (эутиреоидная болезнь Грейвса) [5] .
Факторы риска развития эндокринной офтальмопатии:
- — повышает риск развития тяжёлой эндокринной офтальмопатии, снижает эффективность лечения; и гипертиреоз;
- лечение гипертиреоза радиоактивным йодом — приблизительно у 15 % пациентов после такой терапии возникает или прогрессирует эндокринная офтальмопатия, но развитие болезни можно предотвратить, принимая курс глюкокортикостероидов [6] ;
- генетическая предрасположенность — обнаружены гены, связанные с развитием эндокринной офтальмопатии.
Симптомы эндокринной офтальмопатии
Обычно первыми жалобами при эндокринной офтальмопатии становятся чувство давления и ощущение песка в глазах, светобоязнь, иногда слезотечение или сухость глаз [11] . Пациентов может беспокоить двоение в глазах и ощущение пелены. Симптомы могут возникать спонтанно.
Характерные внешние признаки болезни — это отёк век и расширенные глазные щели (глаза «навыкат»).
Часто офтальмопатия развивается одновременно с тиреотоксикозом, поэтому часть симптомов связана с нарушением работы щитовидной железы. У пациентов дрожат руки и веки, возникают частые сердцебиения, вплоть до нарушения ритма (экстрасистолия, трепетание, фибрилляция предсердий и желудочков), снижается вес, часто меняется настроение, выпадают волосы и повышается потливость [11] .
Патогенез эндокринной офтальмопатии
До конца непонятно, какой именно фактор запускает развитие эндокринной офтальмопатии. Известно только, что в тканях щитовидной железы и глазницы есть одинаковые антигены, поэтому антитела при токсическом зобе (болезни Грейвса) атакуют не только щитовидную железу, но и глазницу.
Антиген — это любое вещество, которое организм воспринимает как потенциально опасное и против которого запускает иммунный ответ, т. е. вырабатывает антитела. В норме этот механизм защищает нас, например от вирусов и бактерий, но при аутоиммунных заболеваниях организм начинает разрушать собственные ткани.
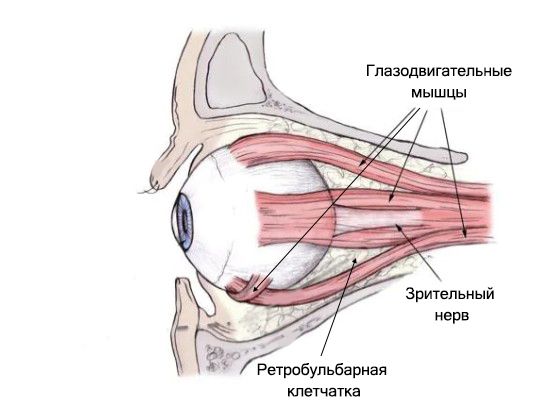
При эндокринной офтальмопатии обнаруживаются антитела к глазодвигательным мышцам, фибробластам и орбитальной клетчатке. Антитела к глазодвигательным мышцам есть не у всех пациентов, антитела к орбитальной клетчатке встречаются в 100 % случаев [11] .
Выделяют две фазы эндокринной офтальмопатии:
1. Активное воспаление. Ретробульбарная клетчатка воспаляется, её объём увеличивается, из-за чего выпячивается глаз (возникает экзофтальм) и может быть сдавлен зрительный нерв. Одновременно идёт воспаление в глазодвигательных мышцах. Оно протекает неравномерно, что может привести к двоению в глазах (диплопии), а иногда к стойкому косоглазию.
2. Неактивная фаза. На фоне лечения тиреотоксикоза воспаление уменьшается. Лёгкие формы офтальмопатии могут пройти без дополнительного вмешательства, при тяжёлых — понадобится специфическая терапия. Если тиреотоксикоз не лечить, то офтальмопатия не пройдёт, даже при лёгком течении.
Классификация и стадии развития эндокринной офтальмопатии
Клиническая картина эндокринной офтальмопатии разнообразна, поэтому единая классификация не разработана.
Формы эндокринной офтальмопатии
В российских рекомендациях выделяют три формы заболевания:
- Тиреотоксический экзофтальм — всегда сопровождается избытком тиреоидных гормонов, ткани орбиты обычно не поражены, зрение не ухудшается, но возникает синдром сухого глаза. Состояние улучшается после специального лечения и нормализации работы щитовидной железы.
- Отёчный экзофтальм — самая распространённая форма эндокринной офтальмопатии [8] . В зависимости от локализации выделяют три варианта:
- липогенный — поражена преимущественно клетчатка глазницы;
- миогенный — патологический процесс в основном протекает в глазодвигательных мышцах;
- смешанный вариант — одинаково страдают глазодвигательные мышцы и клетчатка.
- Эндокринная миопатия — может развиться самостоятельно или стать исходом отёчной формы. Чаще возникает при пониженном или нормальном уровне тиреоидных гормонов, более распространена среди мужчин [8] . Обычно поражены оба глаза, болезнь протекает достаточно быстро: уже через 3–4 месяца от начала заболевания развивается фиброз.
Стадии эндокринной офтальмопатии
Согласно классификации, рекомендуемой Европейской группой по офтальмопатии Грейвса (EUGOGO), выделяют три степени тяжести эндокринной офтальмопатии:
- Лёгкая — качество жизни снижено незначительно, смещение века (ретракция) < 2 мм, мягкие ткани орбиты изменены слабо, экзофтальм < 3 мм, диплопия отсутствует совсем или быстро проходит.
- Средняя — ретракция ≥ 2 мм, мягкие ткани орбиты изменены умерено, есть экзофтальм, непостоянная или постоянная диплопия, но риска потерять зрение ещё нет.
- Тяжёлая — оптическая нейропатия и/или повреждение роговицы, спонтанный вывих/подвывих глаза, пациент может потерять зрение и нуждается в экстренном лечении [11] .
Степень тяжести определяется по результатам осмотра офтальмолога.
Активность офтальмопатии — это показатель, который указывает на выраженность воспалительного процесса. Она не учитывается при определении стадии болезни, но важна для выбора методов лечения. Её определяют по шкале клинической активности (CAS) на основе семи основных и трёх дополнительных критериев, выделяя неактивную и активную эндокринную форму [11] .
- Спонтанная ретробульбарная боль (за глазным яблоком).
- Покраснение век.
- Боль при движении глаз.
- Отёк век.
- Воспаление и покраснение конъюнктивы (инъекция).
- Покраснение и отёк слёзного мясца и полулунной складки.
- Отёк конъюнктивы (хемоз).
Дополнительные критерии можно определить, только регулярно посещая окулиста. К ним относятся:
- Увеличение экзофтальма больше чем на 2 мм за последние 2 месяца.
- Уменьшение подвижности глаза больше чем на 8° в любом направлении за последние 2 месяца.
- Ухудшение зрения больше чем на 1/10 остроты зрения за последние 2 месяца.
Эндокринная офтальмопатия считается активной при наличии трёх и более критериев, неактивной — при 1–2 критериях [5] .
Осложнения эндокринной офтальмопатии
Основные осложнения эндокринной офтальмопатии:
- поражение роговицы, вплоть до изъязвления — развивается из-за экзофтальма, при котором глазное яблоко сильно смещается вперёд и не получается полностью закрыть глаз;
- необратимое снижение зрения, иногда до полной потери — возникает при отёчной форме из-за повреждения зрительного нерва и/или роговицы (оптическая нейропатия и/или кератопатия); — в основном развивается при поражении глазодвигательных мышц [7] .
Диагностика эндокринной офтальмопатии
Диагностические исследования при эндокринной офтальмопатии очень важны: от их результатов зависит тактика лечения.
Сбор анамнеза
Для установления диагноза необходимо тщательно собрать анамнез. Важны не только симптомы, но и данные обследований щитовидной железы, информация о предшествующих болезнях и травмах. Также нужно выяснить, есть ли нехарактерные для эндокринной офтальмопатии жалобы.
Осмотр
Во время офтальмологического осмотра обязательно определяют объём движения, расположение и подвижность глаз, измеряют ширину глазных щелей, исследуют остроту зрения и выявляют специфические для эндокринной офтальмопатии симптомы.
Также проводится экзофтальмометрия, которая позволяет определить степень смещения глазного яблока и наличие экзофтальма, но этого обследования не достаточно, чтобы поставить диагноз. Ещё может выполняться тонометрия, биомикроскопия, определение полей зрения, исследование цветного зрения и офтальмоскопия.
Лабораторная диагностика
Эндокринная офтальмопатия часто сопровождается заболеваниями щитовидной железы, поэтому необходимо проверить уровень гормонов: ТТГ, свободных Т3 и Т4.
Инструментальная диагностика
К инструментальным методам диагностики эндокринной офтальмопатии относятся:
- оптическая когерентная томография;
- компьютерная периметрия;
- цветовое допплеровское картирование (ЦДК), энергетическое картирование (ЭК) и импульсная допплерография для исследования кровотока в сосудах орбиты и глаза;
- компьютерная томография орбит в двух проекциях [11] .
Оптическая когерентная томография (ОКТ) — это новый вид обследования, с помощью которого можно получить изображения внутренних структур глаза в высоком разрешении. ОКТ позволяет детально рассмотреть все структуры глаза, оценить состояние глазного дна и глазного нерва, наличие макулярных отёков, определить отслойку сетчатки и микроаневризмы. Обследование безопасно, его можно проводить достаточно часто, чтобы отслеживать результаты лечения.
Компьютерная периметрия — это офтальмологическое исследование на приборе периметре. После обследования в специальной программе создаётся карта с границами полей зрения и отметками абсолютных и относительных «слепых пятен», если они есть. С помощью этого метода можно подробно изучить поля зрения при заболеваниях сетчатки или зрительного нерва.
Цветовое допплеровское картирование (ЦДК), энергетическое картирование (ЭК) и импульсная допплерография — это ультразвуковые методы, которые позволяют оценить нарушения кровотока. Его ухудшение может говорить о развитии ишемии в сетчатке глаза и оптической нейропатии. Также эти методы позволяют оценить, насколько высок риск, что при офтальмопатиии возникнет вторичная открытоугольная глаукома.
Компьютерная томография орбит — как правило, дополнительный метод исследования, который позволяет объективно оценить состояние глазницы и провести дифференциальную диагностику с другими патологиями. Также с помощью этого метода можно выявить толщину и плотность глазодвигательных мышц, что позволяет определить их поражение.
Дифференциальная диагностика
Экзофтальм при эндокринной офтальмопатии следует отличать от псевдоэкзофтальма при высокой степени близорукости, орбитальном целлюлите (флегмоне глазницы), опухолях (гемангиомах и саркомах орбиты, менингиомах и др.) [3] .
Лечение эндокринной офтальмопатии
Выбор методов лечения зависит от степени тяжести и активности офтальмопатии [5] .
Все методы лечения, приведённые в таблице, достаточно безопасны и эффективны. Их часто комбинируют, у каждого из них свои показания и недостатки. Например, основной недостаток терапии глюкокортикостероидами — это относительно частые рецидивы после прекращения лечения. Лучевая терапия при офтальмопатии помогает только в 60 % случаев, но при сочетании с глюкокортикостероидами эффективность достигает 95 % [1] .
При хирургическом лечении офтальмопатии необходимо соблюдать определённый порядок процедур:
- декомпрессия орбиты;
- операция на глазодвигательных мышцах;
- вмешательство на веках (одновременно или с последующей блефаропластикой).
Хирургическое лечение проводят через шесть месяцев после того, как состояние стабилизировалось. Однако в тяжёлых случаях, чтобы предотвратить слепоту из-за сдавления зрительного нерва, операция может быть проведена экстренно.
Орбитальная декомпрессия — это удаление части кости из глазницы, чтобы открыть одну или несколько пазух и освободить место для опухшей ткани. В результате глаз возвращается на место и освобождается сжатый зрительный нерв, который мог стать причиной серьёзных проблем со зрением.
Прогноз. Профилактика
Своевременно начатое лечение — основной фактор, который влияет на прогноз заболевания. Если офтальмопатия выявлена на ранних стадиях и выбрана правильная тактика лечения, то можно достичь ремиссии и предотвратить развитие осложнений. Примерно у 1/3 пациентов состояние улучшается, у 2/3 — стабилизируется, но в 5–10 % случаев заболевание может прогрессировать несмотря на лечение.
Пациентам с эндокринной офтальмопатией необходимо встать на диспансерный учёт к эндокринологу и офтальмологу. Через полгода после терапии следует пройти контрольное обследование у офтальмолога. Также потребуется регулярно наблюдаться у эндокринолога и при необходимости лечить основное заболевание. Частота посещения эндокринолога зависит от длительности заболевания и состояния щитовидной железы. В начале болезни доктора нужно посещать каждую неделю, затем раз в две недели, потом каждый месяц, а позже раз в квартал. Длительность наблюдения до отмены лечения обычно составляет 1,5–2 года.
При неактивной эндокринной офтальмопатии посещать офтальмолога нужно раз в 2–3 месяца, при активной офтальмопатии — раз в месяц в течение первого года и раз в шесть месяцев спустя год после лечения. Длительность наблюдения зависит от состояния глаз и щитовидной железы [11] .
Профилактика эндокринной офтальмопатии
Для профилактики нужно скорректировать факторы риска:
- бросить курить;
- при тиреотоксикозе принимать тиреостатики для восстановления нормального уровня гормонов, при рецидиве проводится радикальное лечение;
- при гипотиреозе показана заместительная гормональная терапия;
- при лечении радиоактивным йодом нужно профилактически принимать глюкокортикостероиды.
Воздействие на факторы риска — это первичная профилактика. Вторичная профилактика офтальмопатии — это раннее выявление заболевания, что осложняется отсутствием маркеров, по которым можно предположить развитие офтальмопатии. Пациентам с болезнью Грейвса нужно регулярно проходить осмотры у офтальмолога, даже если нет симптомов. Это поможет выявить заболевание на ранней стадии.
Для эндокринной офтальмопатии есть ещё третичная профилактика, которая позволит предотвратить прогрессирование заболевания. Для этого при выявлении офтальмопатии нужно бросить курить и следовать лечению, назначенному офтальмологом согласно современным рекомендациям.
Читайте также:
