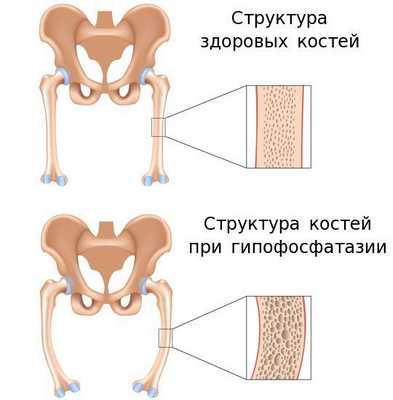
Кости при гипофосфатазии - лучевая диагностика
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Какой из лучевых методов диагностики костных метастазов при РПЖ является наиболее точным и объективным? Какие дополнительные методы можно использовать в случае затруднения диагностики метастазов? Cреди лучевых методов (рентгено-, остеосцинти-, томограф
Какой из лучевых методов диагностики костных метастазов при РПЖ является наиболее точным и объективным?
Какие дополнительные методы можно использовать в случае затруднения диагностики метастазов?
Cреди лучевых методов (рентгено-, остеосцинти-, томографии), широко используемых в современной урологической практике для ранней диагностики локализации и стадии течения метастатического процесса в костях, остеосцинтиграфия (ОСГ) в силу своей высокой чувствительности занимает приоритетное положение [3]. Невысокая специфичность данного метода значительно возрастает при дополнительном использовании других инструментальных методов (КТ, УЗИ, МРТ и т. д.), особенно при диагностировании смешанных и остеолитических очагов метастазов, а также когда визуальные рентгенологические признаки метастатического процесса отсутствуют [3].
Нами проведен ретроспективный анализ 8500 сканограмм больных (в возрасте 60-82 лет), полученных в отделении радиоизотопной диагностики ГВКГ им. Н. Н. Бурденко (1990-1998 годы). Из них изучено 450 (подробно 45) больных с подозрением на РПЖ (или с установленным раком простаты в анамнезе).
- Больные с подозрением на РПЖ, которым выполнена ОСГ.
- Больные c неинформативной картиной РПЖ на сканограммах, которые кроме ТР УЗИ и биопсии, подвергались МРТ для уточнения характера процесса.
- Больные с РПЖ, которым требуется уточнение стадии метастатического процесса и его характера.
- Больные, которым провели одновременное комплексное инструментальное обследование по схеме: ОСГ+МРТ+Ro-графия+ТР УЗИ +ПРИ+ ПСА (основная группа) .
В исследуемые группы не включали пациентов с болезнью Педжета, лимфогранулематозом, лейкозом, мраморной болезнью, а также консолидирующими переломами, воспалительными и врожденными деструктивными процессами в костях, симулирующих картину метастатического РПЖ. По показаниям выполняли ТР УЗИ, пункционную биопсию, пальцевое ректальное исследование предстательной железы (ПРИ), проводили серологическое определение уровня сывороточного общего простатспецифического антигена и применяли гистологические методы. Уровень накопления РФП в костной ткани < 30% принимался за верхний предел нормы или ассиметрии накопления, >30% относили к гиперфиксации, патогномоничной для ракового метастатического поражения костей. При наличии метастазов в симметричных отделах скелета (ребра, лопатки, кости таза и др.) уровень фиксации индикатора в данной зоне сравнивали с этим показателем в противоположной (симметричной) зоне (например, 6-е правое ребро — 6-е левое ребро и т. д.). При наличии несимметричных зон (тела позвонков и др.) степень накопления РФП сравнивали с ниже- или вышележащей зоной (позвонком).
Данная работа была выполнена с помощью гамма-камеры GCA-7200 A/di фирмы «Тошиба» (Япония). Методика исследования скелета предусматривала внутривенное введение 99m-Тс-технефора за три часа до сеанса. Сканирование производилось со скоростью 5 см/мин, общее время сеанса составляло 30-35 мин с обычной регистрацией радиоактивного излучения и системной обработкой полученных изображений на ПК с помощью операционной системы компании Unix. Использовали также рентгенаппарат «Сиреграф» (фирма «Сименс») и компьютерный томограф «Пиккер» (фирма «Пиккер», США).
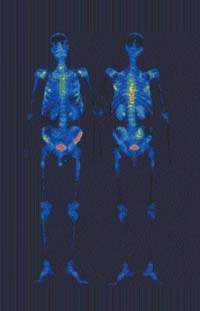 |
| Рисунок 1. При остеосцинтиграфии определяются очаги гиперфиксации РПФ в Th 6-12, L 1-2 позвонках, в углах обеих лопаток, в пояснично-крестцовом сочленении справа, в крыльях таза больше слева спереди, в ребрах |
Статистическая обработка материала осуществлялась стандартными методами. Были получены следующие результаты. Теоретической основой работы послужили широко известные данные о физико-химических особенностях метаболизма фосфатных комплексов, меченных Тс-99m РФП [6]. Данный индикатор интенсивно диффундирует из кровеносного русла и накапливается в остеобластах, а также в матрице вновь формирующейся остеоидной ткани в мета- и эпифизарных участках трубчатых костей, характеризующихся высоким уровнем васкуляризации и активности костного мозга [2, 3, 8].
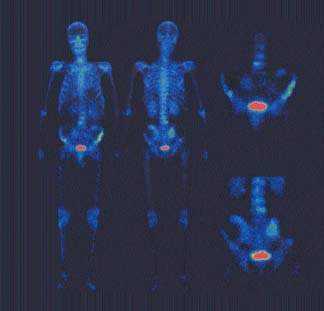 |
| Рисунок 2. На сцинтиграммах костей скелета сохраняются множественные очаги гиперфиксации РПФ, более интенсивные по сравнению с предыдущим обследованием |
В первой группе больных на сканограммах симметричных (ребра, лопатки) и несимметричных отделов скелета (тела позвонков, крестец, непарные кости черепа), полученных на ранних стадиях метастатического процесса, выявлялись единичные (рис. 1), а при повторном исследовании (спустя 2-6 месяцев) множественные зоны гиперфиксации РФП (45-76% ед. Н) [2]. Сканограммы с низкой степенью концентрации индикатора (<30%), которые по ряду признаков оказывались нехарактерными для злокачественного метастатического процесса, требовали для своего уточнения применения МРТ и неинструментальных методов (вторая группа).
У больных второй группы с помощью полученных сканограмм оценить признаки метастатического процесса в скелете было сложно, в диагностике предполагаемого РПЖ основывались на клинических (боль в костях, длительный андрологический анамнез) и рентгенографических данных, включая ТР УЗИ, пункционную биопсию простаты и ПРИ.
У больных третьей группы (с Т2-3 Н1М1) (n=15) на сканограммах отмечались очаги отсутствия накопления РФП, а на рентгенограммах —очаги активации остеолизиса и деструкции кости в зоне костных метастазов. При биопсии ПЖ гистологическая картина первичного очага, как правило, соответствовала аденокарциноме (темно- или светлоклеточной).
| Рисунок 3. При остеосцинтиграфии выявлены очаги гиперфиксации РПФ в Th 9 грудном позвонке, нижнем углу правой лопатки и в Th5 |
У больных четвертой группы (n=8) было проведено комплексное инструментальное обследование (ОСГ, МРТ, Rо-графия); подобный алгоритм оказался наиболее эффективным из всех подходов.
Полученные нами данные свидетельствуют о том, что ОСГ скелета позволяет выявить метастатические очаги на 6-12 месяцев раньше, чем это возможно при использовании обычного рентгенологического метода, что соответствовало результатам, полученным другими учеными [7, 9]. Объясняется этот факт тем, что введенные внутривенно радиоактивные атомы Р легко включаются в Са-Р-обмен в раннем периоде формирования неоостеоида. Остеобластическая стадия морфогенеза костного метастаза РПЖ характеризовалась активизированными остеобластами, продукцией атипичного остеоидного вещества, выраженным сосудистым компонентом и комплексами иммунных и раковых клеток. На макроуровне эти процессы были представлены сцинтиграфически признаками костной (остеобластической) перестройки, рентгенологически — признаками костной деструкции (остеолизиса). Практически важной особенностью ОСГ скелета является полная визуализация всего скелета, что недостижимо при использовании рентгенографии. При отсутствии сцинтиграфических признаков РПЖ наиболее эффективные результаты получены у четвертой группы больных. Совпадение данных ЛТ (ОСГ, Ro-графии) и цитогистологических методов исследований составило 70-80%. Совпадения по различным стадиям РПЖ колебались от 65 до 95%, что было связано со степенью злокачественности раковых клеток, их индуктирующим влиянием на остеобласты, активностью остеогенных деструктивно-репаративных и протекторных стромогенных процессов в метастатических очагах, а также гормональным фоном и характером оперативного вмешательства [3, 5, 6]. Точность ранней диагностики метастатической формы РПЖ достигала 80-95% при одновременном с ОСГ изучении сывороточной ПСА, что также отражено в литературе [1].
| Ранняя диагностика локализации и характера метастазов в костях при раке предстательной железы (РПЖ) с помощью лучевых методов — актуальная проблема современной онкоурологии [4, 6, 8]. Гематогенные метастатические очаги в костях при раке предстательной железы (РПЖ) встречаются в 50-70% случаев, а по данным сцинтиграфии (ОСГ) — в 12-62% (при отсутствии рентгенологических признаков) [3] |
Литература
Кости при гипофосфатазии - лучевая диагностика
Рентгенограмма костей при гипофосфатазии
а) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Перинатальная: тяжелая гипоминерализация скелета
о Инфантильная: тяжелые рахитоподобные изменения
о Детская: Рахитоподобные изменения различной тяжести
о Взрослая: изменения, сходные с остеомаляцией
2. Рентгенография при гипофосфатазии:
• Перинатальная летальная форма:
о Значительно сниженная минеральная плотность кости
- Скелет может выглядеть полностью неминерализованным
о Микромелия
о Остемаляция, приводящая к деформациям:
- Деформации грудной клетки → затруднения дыхания → смерть
о Костные шпоры Боулдера в диафизах локтевых и малоберцовых костей
о Ложное расхождение швов черепа с функциональным краниосиностозом
• Перинатальная доброкачественная форма:
о Скелетные изменения такие же, как при летальном типе
о Самостоятельное восстановление скелетных нарушений
• Инфантильная форма:
о Тяжелые рахитоподобные изменения
о Рентгенонегативные отростки распространяются в метафизы из пластинок роста
о Ложное расхождение швов черепа с функциональным краниосиностозом
о Изменение формы тел позвонков
о Низкорослость
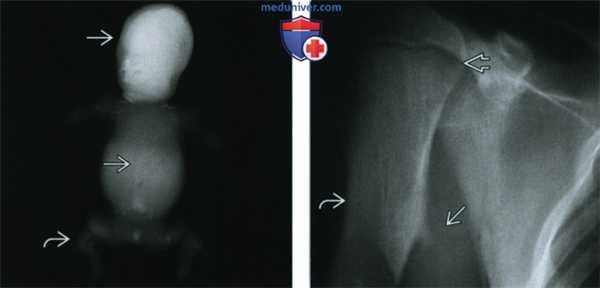
(Слева) Рентгенография в ПЗ проекции, мертворожденный младенец с крайне тяжелой летальной формой гипофосфатазии. Обратите внимание на практически полное отсутствие минерализации скелета и выраженную микромелию.
(Справа) Рентгенография плечевой кости в ПЗ проекции с типичными для детской формы гипофосфатазии изменениями. Отмечается небольшая угловая деформация диафиза плечевой кости и экзостоз. Подобные выросты, характерные для большеберцовой и локтевой костей, могут развиваться в любой кости. Отмечается незначительное расширение пластинки роста.
• Детская форма:
о Низкорослость
о Рахитоподобные изменения
о Шпоры Боулдера
о Ложное расхождение швов черепа с функциональным краниосиностозом
• Взрослая форма:
о Остеопения, изменения, сходные с остеомаляцией
о Псевдопереломы в латеральном проксимальном отделе компактного вещества бедренной кости:
- Псевдопереломы на фоне остеомаляции в компактном веществе медиальной поверхности
о ± отложения пирофосфата кальция
о Множественные стрессовые переломы, особенно в стопах
о Шпоры Боулдера, особенно в локтевой и малоберцовой костях
о Функциональный краниосиностоз
• Одонтогипофосфатазия: изолированное поражение зубов:
о Ранняя потеря молочных зубов
о Аномальное развитие коренных зубов
о Подвижность коренных зубов
3. УЗИ при гипофосфатазии:
• Пренатальное ультразвуковое исследование: III триместр:
о Четкая детализация головного мозга: ↓ минерализации черепа ↑ проведение ультразвука
о Микромелия
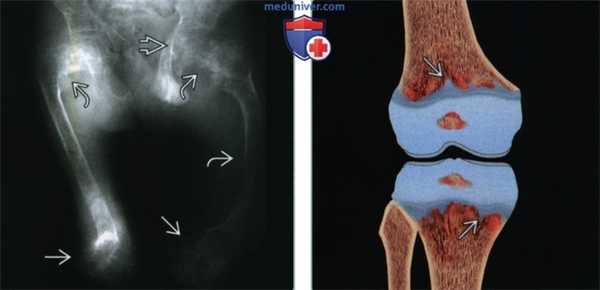
(Слева) Рентгенография в ПЗ проекции: визуализируются обе бедренные кости у ребенка с тяжелой формой гипофосфатазии. Имеются выраженные изменения пластинок роста (расширение и неровность контуров). Остеомаляция осложнилась угловыми деформациями в проксимальных отделах обеих бедренных костей, а также в диафизе левой бедренной кости. Имеются протрузионные деформации тазобедренных суставов, характерные для остеомаляции.
(Справа) На рисунке во фронтальной плоскости показана гипофосфатазия, характеризующаяся выраженной неровностью контуров пластинок роста и отростками суставных хрящей, распространяющимися в метафизы.
б) Дифференциальная диагностика гипофосфатазии:
1. Несовершенный остеогенез:
• Множественные переломы приводят к асимметричному укорочению конечностей; слабая оссификация черепа
2. Остеомаляция и рахит:
• Не столь выраженные деформации и гипоминерализация.
3. Ахондрогенез:
• Отсутствие минерализации преимущественно в позвонках, практически нормальная минерализация в добавочном скелете и костях черепа
в) Патология:
1. Общая характеристика:
• Этиология:
о Мутация гена ALPL → дефицит синтеза ТНЩФ (TNSALP, тканевая неспецифическая щелочная фосфатаза):
- Недостаточный гидролиз неорганического фосфата, накопление которого препятствует образованию гидроксиапатита (минерализованной кости)
• Генетические факторы:
о Инфантильная и перинатальная форма: аутосомно-рецессивные
о Менее тяжелые формы: аутосомно-рецессивные или доминантные
• Сопутствующие нарушения:
о Инфантильная форма: гиперкальциемия, обусловленная неспособностью включения кальция в кость
2. Микроскопия:
• Увеличение остеоидной ткани и неминерализованного хряща
• Пластинка роста: разрушение гипертрофической зоны, наблюдаемое при рахите, кальцинированная зона может полностью отсутствовать
г) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Проявления зависят от формы
о При всех формах отмечается ранняя потеря молочных зубов о Перинатальная летальная: мертворождение или смерть в первые несколько дней/недель вследствие нарушений дыхания
о Инфантильная: манифестирует в первые 6 месяцев жизни, симптомы обусловлены гиперкальциемией:
- Раздражительность, алиментарная недостаточность, рвота, нефролитиаз и почечная недостаточность, судороги
о Детская форма: задержка начала ходьбы, ковыляющая походка, боли в костях, проблемы с дыханием вследствие деформаций ребер
о Взрослая форма: боли в костях, деформации скелета, переломы
2. Демография:
• Пол: тяжелые формы: М = Ж
• Эпидемиология: тяжелые формы: 1:100000 новорожденных
3. Течение и прогноз:
• Перинатальная летальная: мертворождение или смерть в первые дни/недели
• Инфантильная: ограниченная продолжительность жизни
• Детская: возможно спонтанное разрешение и рецидив во взрослом возрасте
• Детская и взрослая: деформации и переломы различной выраженности
4. Лечение:
• Только симптоматическое: невозможность адекватного воздействия на основные пути метаболизма
о Проходит испытания заместительная ферментная терапия
д) Список использованной литературы:
1. Bianchi ML: Hypophosphatasia: an overview of the disease and its treatment. Osteoporos Int. 26(12):2743-57, 2015
УЗИ, рентгенограмма при гипофасфатазии у плода
а) Определения:
• Редкое врожденное нарушение костного метаболизма, вызванное утратой функции гена ALPL, кодирующего тканенеспецифичную щелочную фосфатазу
• Выделяют 3 формы заболевания:
о Перинатальная летальная:
- Микромелия и выраженная гипоминерализация
о Инфантильная:
- Рахитоподобная деформация скелета, переломы, раннее выпадение зубов
о Взрослая:
- Искривление костей, псевдопереломы, эктопическая кальцификация связок позвоночника и суставных хрящей, рахитические изменения ребер
б) Лучевая диагностика:
1. Общие сведения:
• Критерии диагностики:
о Перинатальная летальная: при УЗИ во II триместре - микромелия и выраженная гипоминерализация костей, включая череп
(Слева) Рентгенография грудной клетки новорожденного с перинатальной летальной гипофосфатазией. Выраженная генерализованная задержка оссификации. Ребра предельно истончены, переломы отсутствуют. Отсутствие оссификации ребра. Лопатки гипоплазированы. Метафиз плечевой кости изменен.
(Справа) УЗИ плода в III триместре. Перинатальная летальная гипофосфатазия. Задержка оссификации, головной мозг определяется «излишне отчетливо». Череп деформируется при нажатии датчиком. (Слева) Клиническая фотография новорожденного с перинатальной летальной гипофосфатазией. Микромелия и искривление трубчатых костей. Грудная клетка уменьшена.
(Справа) Рентгенография. Классические признаки перинатальной летальной гипофосфатазии: кости изогнуты, тела позвонков уплощены и не оссифицированы, задержка оссификации тазовой кости. Множественные очаги задержки оссификации. (Слева) УЗИ нижних конечностей плода в 28 нед. Перинатальная летальная гипофосфатазия. Большеберцовая кость изогнута кпереди. Определяется остеофит, что характерно для данного заболевания.
(Справа) Тот же случай. Клиническая фотография новорожденного. Углубление на коже в претибиальной области соотносится с пальпируемым остеофитом, определяемым при УЗИ.
2. УЗИ при гипофосфатазии у плода:
• Перинатальная летальная:
о Выраженная гипоминерализация «перепончатого черепа»
о Трубчатые кости:
- Микромелия
- Истончение, искривление костей (переломы не характерны)
- Выраженная задержка оссификации
- Остеофиты средней трети диафиза
о Позвоночник:
- Дуга ± тело позвонка не оссифицированы
3. Рентгенография при гипофосфатазии у плода:
• Инфантильная форма с задержкой оссификации черепа, ребер и трубчатых костей:
о Дефекты оссификации метафизов
о Искривление трубчатых костей
в) Дифференциальная диагностика гипофосфатазии у плода:
1. Несовершенный остеогенез:
• Ведущий признак несовершенного остеогенеза II—IV типа - переломы
• При несовершенном остеогенезе II типа - переломы ребер (в виде «рахитических четок»)
• Гипоминерализация черепа
2. Ахондрогенез типа 1А:
• Позвоночник не оссифицирован
• Множественные переломы ребер
• Задержка оссификации черепа
3. Гипофосфатемический рахит:
• Врожденный дефект транспорта фосфатов
• Карликовость, искривление трубчатых костей
4. Тяжелый неонатальный гиперпаратиреоз:
• Выраженная гиперкальциемия
• Респираторный дистресс-синдром
• Деминерализация скелета
(Слева) УЗИ плода в 35 нед. Перинатальная летальная гипофосфатазия. Бедренная кость изогнута, укорочена и гипоминерализована, особенно в области метафизов. Кость имеет вид «побитой молью». Подобная неоднородная оссификация - важный критерий диагностики данного заболевания.
(Справа) УЗИ того же плода. Лопатка имеет неровные очертания, оссификация значительно снижена, кость также выглядит «побитой молью». (Слева) УЗИ предплечья того же плода. Выраженное укорочение и почти полное отсутствие оссификации лучевой и локтевой костей.
(Справа) Рентгенография верхних конечностей новорожденного с перинатальной летальной гипофосфатазией. Выраженная задержка оссификации и нарушение строения трубчатых костей, предельное истончение ребер. Кисти практически не оссифицированы. (Слева) Рентгенограмма новорожденного с инфантильной гипофосфатазией, боковая проекция. Гипоминерализация черепа выражена в меньшей степени, чем при летальной форме.
(Справа) Рентгенограмма того же новорожденного. Кости истончены, искривлены. Отмечается гипоминерализация. Определяются тонкие прямые ребра без переломов. Неровность контуров метафизов менее выражена, чем при летальной форме. При менее явных находках диагностика может быть затруднена.
г) Патологоанатомические особенности. Общие сведения:
• Этиология:
о Мутации гена тканенеспецифичной щелочной фосфатазы (ALPL)
о Клиническая тяжесть заболевания отражает степень дефицита тканенеспецифичной щелочной фосфатазы
• Генетика:
о Перинатальная летальная, инфантильная: аутосомно-рецессивный тип наследования
о Взрослая форма наследуется как аутосомно-рецессивно, так и аутосомно-доминантно:
- У носителей - ↓, щелочной фосфатазы сыворотки крови и ↑ фосфоэтаноламина в моче
д) Клинические особенности:
1. Клиническая картина:
• Самые частые субъективные и объективные симптомы:
о Гипоминерализация и искривление костей
• Другие субъективные и объективные симптомы:
о Раннее выпадение зубов
о Снижение/отсутствие активности щелочной фосфатазы сыворотки крови
о ↑ пиридоксаль-5-фосфата плазмы крови
о Гиперкальциемия и гиперкальциурия
2. Демографические особенности:
• Эпидемиология:
о 1:100 000 родов (перинатальная летальная форма)
3. Естественное течение и прогноз:
• Перинатальная гипофосфатазия летальна
• Инфантильная гипофосфатазия:
о Гиперкалиемия: повышение нервной возбудимости, проблемы вскармливания, срыгивание, задержка развития
о Краниосиностоз: ↑ внутричерепного давления
о Нефрокальциноз
о Увеличение летальности: кардиореспираторные осложнения, ↑ внутричерепного давления
о Задержка моторного развития, нарушение походки
о Искривление костей может спонтанно уменьшиться
• Взрослая гипофосфатазия:
о Первым признаком могут быть стрессовые переломы плюсневых костей
о Карликовость
4. Лечение:
• Пренатальная диагностика:
о Измеряют активность щелочной фосфатазы в ворсинах хориона, культивируемых амниоцитах или крови плода
о Возможно обнаружение конкретной мутации
• Гиперкальциемия корректируется диетой:
о Ферментная заместительная терапия и кальцитонин малоэффективны
• Для сохранения зубов необходим интенсивный уход
• Для стабилизации переломов используют интрамедуллярный остеосинтез
• Трансплантация костного мозга
Редактор: Искандер Милевски. Дата обновления публикации: 1.11.2021
Гипофосфатазия - симптомы и лечение
Что такое гипофосфатазия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Боровиковой Ольги Игоревны, генетика со стажем в 7 лет.
Над статьей доктора Боровиковой Ольги Игоревны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Гипофосфатазия — это наследственное метаболическое заболевание, связанное со снижением активности либо с полным отсутствием тканенеспецифической щелочной фосфатазы. Эта редкая болезнь затрагивает многие органы и системы и является жизнеугрожающей для пациента. [20] [23]
Такой фермент, как щелочная фосфатаза, играет важную роль в минерализации тканей. Поэтому её дефицит становится причиной различных системных нарушений, проявляющихся недостаточной минерализацией костей и их деформацией. При тяжёлых формах гипофосфатазии у новорождённых также развивается дыхательная недостаточность и судороги.
Причиной заболевания является мутация в гене ALPL, кодирующем указанный фермент. Этот ген расположен на коротком плече первой хромосомы, которая содержит большее количество генетической информации о структуре организма человека по сравнению с остальными хромосомами.
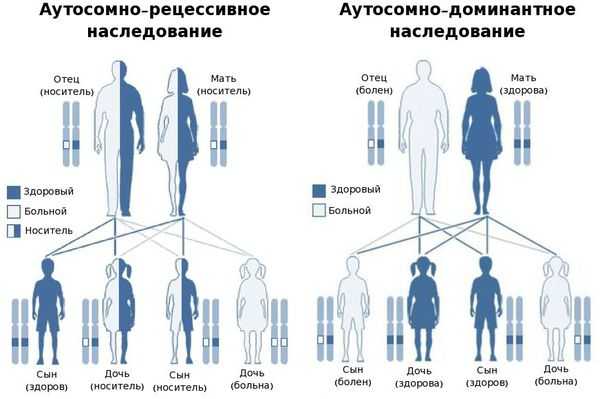
В большинстве случаев заболевание передаётся по аутосомно-рецессивному типу, т. е. при условии, что мутировавший ген передался к ребёнку от обоих родителей. Также описаны и случаи аутосомно-доминантного типа наследования — передача мутировавшего гена только от одного родителя. [25]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гипофосфатазии
Клиническая картина заболевания в значительной степени зависит от возраста пациента и формы заболевания. [1]
К основным проявлениям гипофосфатазии относят повреждения скелета в виде:
- значительной гипоминерализации костей — нарушения развития костной ткани;
- краниосиностоза — деформации черепа в связи с преждевременным закрытием черепных швов;
- рахитоподобной деформации скелета;
- остеомаляции — ухудшение прочности костей в связи с их недостаточной минирализацией;
- незаживающих переломов;
- повторяющихся переломов, требующих применения инвалидного кресла и других способов поддержки для передвижения. [23]
Боли в суставах, мышцах и костях — одно из значительных и прогрессирующих проявлений гипофосфатазии. [14]
Поражение дыхательной системы проявляется гипоплазией (недоразвитием) лёгких и дыхательной недостаточностью, при которой в некоторых случаях требуется применение кислородной поддержки. [23]
Со стороны центральной нервной системы наблюдаются судорожные приступы, повышение внутричерепного давления, различные внутричерепные кровотечения. [20]
Очень часто при гипофосфатазии встречаются тяжёлые поражения почек в виде нефрокальциноза и почечной недостаточности.
Патология мышечной системы проявляется различными миопатиями, хронической болью в мышцах, задержкой или полным отсутствием моторного развития. [22]
Характерны поражения суставов в форме хондрокальциноза (псевдоподагры) и прогрессирующего артрита.
Гипоминерализация костей приводит к раннему выпадению зубов у детей и потере здоровых зубов у взрослых. [20]
Ещё одним характерным проявлением гипофосфатазии является отставание костного возраста от паспортного по результатам рентгенологического исследования.
При перинатальной форме гипофосфатазии отмечается укорочение трубчатых костей, недоразвитие и укорочение рёбер, мягкие кости черепа, повышается вероятность поражения центральной нервной системы в процессе родов. [20]
Патогенез гипофосфатазии
Патогенез гипофосфатазии связан со снижением выработки либо активности щелочной фосфатазы, структура и функционирование которой нарушается п ри наличии мутации в гене ALPL .
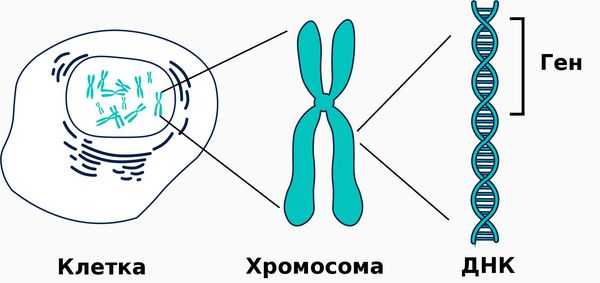
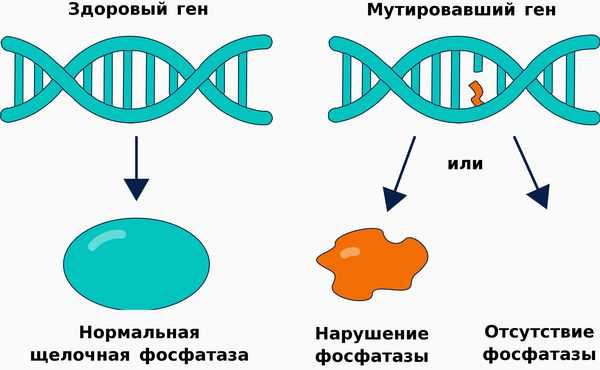
Щелочная фосфатаза принимает участие в метаболизме трёх важных субстратов:
- пиридоксаль-5-фосфат (витамин В6 , PLP);
- неорганический пирофосфат (PPi);
- фосфоэтаноламин (PEA).
Нарушение метаболизма пиридоксаль-5-фосфата приводит к повышению его циркуляции в крови и недостатку активной формы витамина В6. В циркулирующей форме витамин В6 не может проникнуть через гемато-энцефалический барьер. Недостаток активной формы витамина сопровождается поражением центральной нервной системы, что проявляется развитием судорожного синдрома, снижением мозговой активности и трудностями в усвоении информации. [23]
Неорганический пирофосфат является основным компонентом гидроксиапатита, входящего в состав костей. При нарушении метаболизма неорганического пирофосфата происходит повышение его концентрации в крови, гиперфосфатемия и гиперкальциемия, что приводит к отложению солей кальция в суставах, почках и других внутренних органах:
- отложение солей кальция в суставах является причиной артритов, в том числе, тяжёлых;
- поражение почек приводит к развитию почечной недостаточности и полиорганным нарушениям.
Неорганический пирофосфат накапливается и в швах черепа, что сопровождается развитием краниосиностоза, нарушением роста головного мозга, родовым травматизмом, внутричерепной гипертензией, мозговыми кровоизлияниями и отёком диска зрительного нерва. [23]
В результате этих процессов снижается содержание гидроксиапатита в костях, что приводит к деминерализации костей, их искривлению, укорочению и переломам. Патология цементирования зубов является причиной их раннего выпадения. [16] Из-за деформации грудной клетки развивается дыхательная недостаточность и гипоплазия лёгких. Снижение плотности и прочности костей черепа приводит к травмам головного мозга. Искривления позвоночника вызывают сдавление спинного мозга и нарушение осанки. [22]
Фосфоэтаноламин является промежуточным метаболитом, нарушение его метаболизма сказывается на различных реакциях.
Классификация и стадии развития гипофосфатазии
Выделяют четыре формы гипофосфатазии:
- пренатальная (предродовая);
- инфантильная;
- детская;
- взрослая.
При пренатальной форме клинические проявления развиваются ещё до родов и характеризуется задержкой внутриутробного роста плода, гипоксией, дефектами черепа ("мембранозный череп"), деформациями костей, тяжёлой патологией грудной клетки и гипоплазией лёгких. Такие дети в большинстве случаев погибают внутриутробно либо рождаются преждевременно, у них развивается дистресс-синдром (тяжёлое расстройство дыхания). [20] Ранее считалось, что 100% таких детей погибает, но в последнее время благодаря своевременной диагностике и лечению возможно выхаживание пациентов с пренатальной формой гипофосфатазии и продление их жизни. Данную форму заболевания можно диагностиравать во время ультразвукового исследования в период беременности по характерным эхографическим признакам. Тип наследования: аутосомно-рецессивный. [25]
Инфантильная форма проявляется в скором времени после рождения. Смертность таких пациентов без лечения достигает 40%. В неонатальном периоде дети с этой формой гипофосфатазии возбудимы, им характерен плохой аппетит, наблюдается повышенная реакция на внешние раздражители, судороги, диспепсия (нарушение пищеварения), обезвоживание, снижение мышечного тонуса, тяжёлые костные аномалии (мягкие кости, увеличенные черепные швы и роднички), повышение кальция в крови. Часто смерть наступает в неонатальном периоде в связи с тяжёлой дыхательной недостаточностью, но известны случаи спонтанного улучшения. [17] Деформация грудной клетки в 50% случаев приводит к развитию пневмонии . В 64% случаев пациентам требуется кислородная поддержка, 66% детей с этим заболеванием нуждаются в искусственной вентиляции лёгких, из которых 95%, к сожалению, умирают. [17] Тип наследования: аутосомно-рецессивный. [25]
При детской форме гипофосфатазии наблюдается постепенное развитие рахитоподобных скелетных изменений, ранняя потеря зубов, хондрокальциноз и артропатии. При данной форме заболевания очень часто ошибочно ставится диагноз "Рахит", что приводит к неправильному лечению и развитию осложнений. Тип наследования: аутосомно-рецессивный. [25]
При взрослой форме наблюдаются частые переломы и снижение минеральной плотности костей, [7] выпадение зубов, искривление конечностей, встречается изолированная фосфоэтаноламинурия. При рентгенографии выявляется уменьшение минеральной плотности костей черепа, трубчатых костей и отложение кальция в почках. Тип наследования: аутосомно-доминантный. [25]
Некоторые авторы выделяют отдельно зубную форму гипофосфатазии . Она характеризуется выпадением здоровых зубов и отсутствием другой симптоматики. Считается самым лёгким вариантом течения гипофосфатазии. [22]
Осложнения гипофосфатазии
Гипофосфатазия является жизнеугрожающим состоянием.
В раннем детском возрасте основными осложнениями заболевания, приводящими к смерти, являются дыхательная недостаточность, травмы головного мозга, внутримозговые кровоизлияния. [12]
В более старшем возрасте развивается почечная недостаточность, связанная с нефрокальцинозом (отложением солей кальция в почках). Это приводит к полиорганной недостаточности и смерти.
Инвалидизация пациентов происходит за счёт снижения мышечного тонуса и артропатий. Поэтому многие пациенты нуждаются в специальных устройствах для облегчения передвижения, в том числе, в инвалидных креслах. [22]

Недостаток биодоступного витамина В6 вызывает судороги, снижение когнитивных функций, задержку психического развития. [8] Эти осложнения лечат витаминами группы В, однако это приводит к избытку пиридоксаль-5-фосфата в крови.
Краниосиностоз приводит к нарушению роста головного мозга, повышению внутричерепного давления, многим пациентам требуется оперативное лечение.
Очень часто осложнения наступают по причине неправильно поставленного диагноза и соответствующего лечения. Так, детям с гипофосфатазией во многих случаях ошибочно ставится диагноз "Рахит" и проводится лечение витамином Д и препаратами кальция. Это приводит к гиперкальциемии, усиленному отложению солей в суставах и почках, а также к гипервитаминозу Д.
Диагностика гипофосфатазии
Диагностика гипофосфатазии основывается на выявлении снижения щелочной фосфатазы в крови.
Диагностика пренатальной и инфантильной гипофосфатазии
Диагностировать пренатальную форму гипофосфатазии возможно во время беременности. Ей характерны следующие ультразвуковые признаки:
- отсутствие оссификации костей (их окостенения);
- более чёткая визуализация структур головного мозга;
- положительный "тест надавливания"; [5]
- недостаточная оссификация, укорочение и деформация длинных трубчатых костей;
- специфическая картина метафиза (участка трубчатой кости);
- характерные акустические дорожки на ультразвуковом снимке. [22][24]
Отсутствие оссификации костей черепа и "мембранозный череп" являются проявлениями, общими для несовершенного остеогенеза и гипофосфатазии, поэтому необходима дифференциальная диагностика этих состояний. [17]
При ультразвуковом исследовании , как правило, трудно дать количественную оценку остеогенеза. Однако если на картине УЗИ внутренняя структура черепной коробки и поверхность мозга, которые обычно невидны у нормально развивающегося плода, визуализируются ярче обычного, то это можно принять в качестве особенности нарушенной формирования костей черепа. [24]
Далее, если провести "тест надавливания" — сильно нажать датчиком ультразвука на брюшную стенку матери — и посмотреть, насколько деформируется череп плода, то у нормально развивающегося малыша форма черепа сохранится (так как кости черепа твёрдые), а в случае выявленного нарушенного остеогенеза костей черепа и "мембранозного черепа" будет наблюдаться его деформация. [24]
Обычно считается, что для того, чтобы увидеть состояние костей, лучше прибегнуть не к ультразвуковой, а к рентгенологической диагностике . На рентгенограмме ясно видны укорочение и искривление длинных трубчатых костей, а также просветление "языков", которые выступают из метафиза в сторону диафиза, являющееся наиболее специфической диагностической картиной при гипофосфатазии. [24]
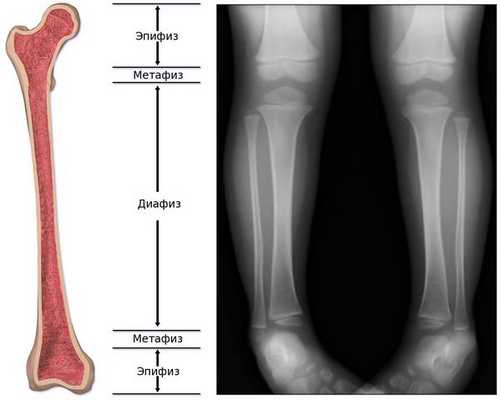
С другой стороны, на ультразвуковом снимке можно убедиться в таких особенностях, как укорочение длинных трубчатых костей, загибы и деформация, но при этом трудно определить, является ли искривление следствием перелома кости или изгиба, а также трудно визуализировать просветление пониженной плотности ("языки пламени" у более взрослых пациентов). [24]
При гипофосфатазии происходит относительно хорошее окостенение средней части диафиза (тела) длинных трубчатых костей, однако к периферии костей оссификация постепенно ухудшается, и на участках метафиза видна только поверхность костей. Поэтому на рентгенограмме это визуализируется как просветление "языков" пониженной плотности. [13]
На ультразвуковом снимке относительно окостеневшие средняя и периферическая части диафиза визуализируются как линии низкой плотности. [10] С другой стороны, рядом с метафизом на поверхности наблюдается незначительная оссификация, изображение поверхности кости нечёткое, под диафизом с обеих сторон появляются "пояски". Всё это является специфической ультразвуковой картиной недостаточно "окрепших" костей при гипофосфатазии и не наблюдается при нормальном развитии плода. [24]
Описание характерных акустических дорожек
Ультразвуковой луч, прошедший через мягкие ткани и достигший поверхности кости, на 90% отражается от её поверхности, что отображается на ультразвуковом снимке в качестве линии низкой эхогенности (плотности). Однако в перинатальном периоде эпифиз практически не заметен и даже у нормально развивающегося плода не визуализируется на ультразвуковом снимке.
В основном у льтразвуковой луч отражается от поверхности кости, а сквозь кость проходит лишь его незначительное количество, поэтому обычно непосредственно под костью визуализируется большая область чёрного цвета, кроме которой больше ничего не видно. Это явление называется "акустическая тень". [18]
На современном оборудовании для ультразвуковых исследований, чтобы визуализировать на снимке область чёрного цвета, находящуюся непосредственно под костью, определяют сильную отражающую волну, после чего автоматически усиливают возвращающийся ультразвуковой сигнал и пытаются визуализировать структуру, которая скрывается в акустической тени. [2] На ультразвуковом снимке длинных трубчатых костей при гипофосфатазии с обеих сторон диафиза в нижней части видны дорожки. Предполагается, что это происходит из-за того, что усиливается ультразвуковой сигнал от метафиза, через который проходит относительно большое количество ультразвуковых лучей. [21]
Диагностика детской и взрослой гипофосфатазии
В более старшем возрасте диагноз можно заподозрить по клиническим проявлениям.
При подозрении на гипофосфатазию определяется уровень щелочной фосфатазы в крови. Приняты следующие нормы щелочной фосфатазы:
Современные подходы к диагностике и лечению остеопороза
Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболи
| Рисунок 1. Микроархитектоника здоровой (слева) и остеопоретической (справа) трабекулярной кости. |
Методы диагностики остеопороза Денситометрия. Ультразвуковая сонография. Рентгенография. Исследование биохимических маркеров костного метаболизма.
Остеопороз — это системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, ведущими к повышенной хрупкости костей с последующим увеличением риска их переломов (рис. 1). Помимо наиболее распространенного постменопаузального остеопороза, в настоящее время в цивилизованных странах в связи с растущей продолжительностью жизни все чаще встречается сенильный остеопороз, а также вторичный остеопороз, обусловленный различными заболеваниями (эндокринная патология, ревматические болезни, заболевания желудочно-кишечного тракта и пр.) или связанный с длительным приемом некоторых лекарственных препаратов, например кортикостероидов.
В настоящее время для диагностики остеопороза используются преимущественно неинвазивные методы, которые легковыполнимы, безопасны и могут повторяться неоднократно у одного и того же больного. К таким методам относятся рентгенографическое исследование, костная денситометрия и исследование биохимических маркеров костного метаболизма. Каждый из этих методов занимает свою нишу в диагностике заболе-вания.
С целью ранней диагностики остеопороза применяются различные технологии, объединенные под общим названием «костная денситометрия», с ее помощью можно определить минимальную плотность костной ткани (МПК), являющуюся главным критерием прочности кости. В настоящее время выделяют четыре типа и два подтипа технологий для измерения МПК:
- моноэнергетическая рентгеновская абсорбциометрия (SXA);
- биоэнергетическая рентгеновская абсорбциометрия (DXA), включая периферическую DXA (pDXA);
- радиографическая абсорбциометрия (RA);
- количественная компьютерная томография (QCT), включая периферическую QCT (pQCT).
В данном перечне отсутствует фотонная денситометрия — предшественница рентгеновской денситометрии, в последнее время используемая весьма редко.
| Рисунок 2 |
Системы DXA являются наиболее изученными и широко применяются в клинической практике (рис. 2). DXA позволяет измерять МПК в центральных отделах скелета: в поясничном отделе позвоночника и в проксимальном отделе бедренной кости. В этих участках происходят наиболее тяжелые переломы. Кроме того, многие из этих приборов снабжены программой «все тело», позволяющей определить содержание минералов во всем скелете, а также исследовать мягкие ткани — мышечную и жировую. В новых модификациях приборов DXA имеется возможность латерального сканирования и морфометрического измерения позвонков,что значительно повышает информативность этого метода. Метод DXA также адаптирован для оценки состояния МПК в области периферических участков скелета, в частности в области предплечья и пяточной кости (рис. 3).
Радиографическая абсорбциометрия используется редко, поскольку требует специально оборудованного центра, где при помощи микроденситометра производится сканирование рентгеновских снимков фаланг и определяется их оптическая плотность.
 |
| Рисунок 3 |
Для определения МПК позвоночника можно использовать и QCT, которая является единственным методом, представляющим результаты исследования в трехмерном измерении. Возможность проведения измерений в поперечном сечении, заложенная в QCT, позволяет выделить этот метод среди других, так как он дает возможность дифференцированно оценивать МПК в трабекулярной и кортикальной костной ткани, фиксируя истинные значения МПК в г/см3 [1]. В отличие от DXA при QCT нет искажений МПК, связанных с тучностью пациента, а также вызванных сопутствующей патологией, например спондилоартритом и остеофитами, обызвествлением стенки аорты или участками остеосклероза, развивающимися в результате дегенеративных заболеваний или переломов позвонков. Но большие дозы облучения при QCT, а также высокая стоимость обследования ограничивают широкое применение этой технологии в диагностике остеопороза, использование ее оправданно лишь в ситуациях, требующих дифференциальной диагностики (рис. 4).
 |
| Рисунок 4 |
В последние годы активно развивается ультразвуковая сонография, которая, в отличие от рентгеновской денситометрии, позволяет обследовать другие характеристики костной ткани: SOS — скорость распространения ультразвука в кости и BUA — широковолновое рассеивание (затухание) ультразвуковой волны в исследуемом участке скелета. Эти параметры, по данным многих исследователей, отражают степень эластичности и прочности костной ткани и достаточно высоко коррелируют с МПК позвоночника и шейки бедра [2]. В настоящее время многие специалисты высказывают мнение о том, что с помощью ультразвуковой денситометрии можно предсказывать риск переломов, тем самым обосновывая ее значение как метода для скрининга. Вопрос о возможности применения этих приборов в диагностике остеопороза и оценке эффективности терапии продолжает дискутироваться.
Рентгенография довольно активно используется для диагностики остеопороза и его осложнений. Однако ее нельзя отнести к методам ранней диагностики, поскольку рентгенологические признаки остеопороза появляются тогда, когда 20 — 30% костной массы уже потеряно [3]. Наиболее сложно оценить выраженность остеопороза в позвоночнике, поскольку ни один из его рентгенологических признаков не является специфичным. Часто рентгенография позволяет выявить остеопороз лишь на поздней стадии, когда уже имеются остеопоретические переломы. Для объективной оценки степени снижения минерализации костей разработаны так называемые полуколичественные методы. В основе их лежит вычисление вертебральных, феморальных и метакарпальных индексов. Но они также не могут претендовать на достаточную точность и чувствительность при выявлении ранней стадии заболевания (остеопении), хотя успешно применяются при эпидемиологических исследованиях распространенности остеопороза в популяции [4, 5]. Таким образом, основной функцией ренгенографического метода в диагностике остеопороза является обнаружение переломов, динамическое наблюдение за появлением новых переломов и дифференциальная диагностика остеопоретических переломов от других типов деформаций позвоночника.
С помощью методов «костной денситометрии» можно судить об основных параметрах прочности костной ткани, однако эти методы не дают никакой информации об уровне костного метаболизма. Уровень формирования и резорбции костной ткани может быть оценен несколькими способами: путем измерения ферментной активности костных клеток (остеобластов и остеокластов) или определения продуктов деградации костного матрикса, которые высвобождаются в циркуляцию в процессе костного обмена (табл. 1).
Таблица 1. Биохимические маркеры костного метаболизма
Представленные в таблице костные маркеры являются предикторами потери костной массы, переломов костей скелета и используются для мониторинга антиостеопоретической терапии. По этим биохимическим показателям можно судить об эффективности терапии, об адекватности дозы препарата и о его переносимости. Особенно полезны костные маркеры для оценки эффективности терапии в сравнительно короткие промежутки времени, когда денситометрическое исследование еще не информативно (полагают, что повторные денситометрические исследования надо выполнять не чаще одного раза в год). Уровень маркеров костного метаболизма изучался в основном у женщин постменопаузального периода. Оказалось, что уровень почти всех маркеров, за исключением IPCP, повышен и коррелирует со снижением МПК [6]. Полагают, что сочетание денситометрии и исследования биохимических маркеров костного метаболизма позволит получить более полную информацию о риске развития постменопаузального остеопороза. По мнению P. Delmas (1996) увеличение скорости костной резорбции (по оценке уровней биохимических маркеров) существенно повышает риск развития переломов независимо от исходной костной массы пациентов [7]. Это связано с тем, что хрупкость кости при остеопорозе зависит не только от МПК, но и от нарушения микроархитектоники костной ткани, выраженность которой можно оценить с помощью биохимических маркеров костной резорбции. Это предположение подтверждается данными P. Garnero et al. (1996), полученными в рамках исследования EPIDOS [6]. Доказано, что увеличение уровня СТх или свободного диоксипиридинолина на 1SD от нормы ассоциировалось с 1,3- и 1,4-кратным увеличением риска переломов шейки бедра (рис. 5).
| Рисунок 5. Комбинированная оценка МПК и скрытой костной резорбции для определения риска перелома шейки бедра у пожилых. МПК определялась по критериям ВОЗ с учетом показателей ниже 2,5 SD от нормальных показателей МПК у молодых здоровых женщин (Ts core |
Многолетний опыт изучения остеопороза за рубежом показывает, что ни один из существующих в настоящее время лекарственных препаратов не может надежно восстановить количество и качество кости, поэтому основной мерой в борьбе с этим заболеванием является профилактика. Профилактику остеопороза надо начинать рано и уделять особое внимание средовым факторам, влияющим на достижение пика костной массы, который наступает примерно к тридцати годам. В числе этих факторов — питание и физическая активность, адекватное поступление в организм витамина D и инсоляция. К наиболее важным периодам относятся период роста кости (юношество), беременность, лактация и перименопауза. Пик костной массы может быть значительно улучшен за счет включения в рацион продуктов с повышенным содержанием кальция (прежде всего молочные и рыбные продукты). Суточное потребление кальция должно составлять в среднем 1000 — 1500 мг, предпочтительно с пищей. Регулярные физические упражнения с весовой нагрузкой в период роста кости приводят к увеличению пика костной массы. У взрослых после достижения пика костной массы адекватное потребление кальция, постоянная физическая нагрузка и наличие регулярного менструального цикла также способствует сохранению костной массы. Профилактику остеопороза среди взрослого населения нужно проводить в «группах риска».
Проблема лечения остеопороза за рубежом изучается давно, причем особенно активно в последнее десятилетие, что связано с введением денситометрии. Однако до настоящего времени не разработаны общепринятые терапевтические программы и режимы лечения этого заболевания, что, по-видимому объясняется его многофакторной природой и сложным патогенезом. Основная цель лечебных мероприятий — сбалансирование процессов костного метаболизма и сохранение или улучшение качества жизни пациента. Для этого необходимо добиться замедления или прекращения потери костной массы; уменьшить болевой синдром в позвоночнике и периферических костях; улучшить функциональное состояние больного и предотвратить возможные падения; восстановить трудоспособность и психоэмоциональное состояние. Наряду с этиопатогенетической терапией препаратами, направленными на нормализацию процессов ремоделирования костной ткани и на сохранение минерального гомеостаза, применяется и симптоматическая терапия, включающая в себя диету с повышенным содержанием солей кальция и фосфора, нестероидные противовоспалительные средства, анальгетики, миорелаксанты, которые позволяют уменьшить болевой синдром, мышечное напряжение и тем самым расширить двигательную активность пациента и ускорить начало реабилитационных мероприятий.
Реабилитация подразумевает лечебную физкультуру, ношение корсетов, плавание, курсы легкого массажа.
Все препараты для лечения остеопороза можно разделить на три группы:
- эстрогены;
- бисфосфонаты;
- кальцитонины;
- тиазидные диуретики;
- производные фтора;
- анаболические стероиды;
- фрагменты паратиреоидного гормона;
- гормон роста.
- активные метаболиты витамина D;
- иприфлавон (остеохин);
- оссеин-гидроксиаппатитный комплекс (остеогенон).
В этиопатогенетической терапии остеопороза предпочтение отдается группе препаратов, подавляющих резорбцию костной ткани, вследствие их более высокой эффективности и сравнительно небольшого побочного действия.
В целом терапия остеопороза должна быть комплексной и проводить ее следует длительно в виде непрерывного или курсового лечения. Поскольку в настоящее время нет идеального препарата для лечения остеопороза, перспективна комбинированная терапия, в которой сочетаются препараты с различным механизмом действия, что позволяет потенцировать их антиостеопоретическое действие, снизить частоту и выраженность побочных эффектов.
| Профилактика остеопороза заключается в сбалансированном питании, физической активности, и адекватном поступлении в организм витамина D |
При комбинированной терапии лекарственные средства назначают одновременно или последовательно. Их выбор осуществляется индивидуально для каждого больного в зависимости от формы остеопороза, скорости костного обмена, тяжести клинического течения, сопутствующих заболеваний. Основным критерием эффективности любого антиостеопоретического средства является снижение частоты переломов, однако в каждом конкретном случае надо ориентироваться в первую очередь на показатели МПК по данным костной денситометрии и на биохимические маркеры костного обмена. Увеличение МПК более чем на 1% и нормализация биохимических показателей, если они были изменены, свидетельствуют об эффективности проводимой терапии. Учитываться должна и положительная динамика клинической картины: уменьшение болевого синдрома, повышение функциональной активности.
Таким образом, в настоящее время имеется довольно большой выбор диагностических методов, позволяющих установить диагноз остеопороза на разных стадиях, а также эффективных лекарственных препаратов, влияющих на различные звенья патогенеза остеопороза, способных уменьшить или купировать клинически выраженные симптомы заболевания, а также предупредить развитие переломов.
Литература
1. Guglielmi C.C., Gluer S., Majumdar B.A., et al. Current methods and advances in bone densitometry. Eur/ Radiol., 1995; 5, 129 — 139
2. Njeh C.F., Boivin C.M., Langton C.M. The role of ultrasound in the assedment of osteoporosis: a review. Osteoporosis Int. 1997; 7, 7 — 22
3. Lachman E. Osteoporosis: the potentialities and limitations of its roengenologic diagnosis. Am. J. Roengenol., 1955; 74, 712 — 715
4. Genant H.K., Wu .Y., van Kuijik C. et al. Vertebral fracture assesment using a semiquantitative technique. J. Bone Miner. Res. 1993; 12, 1649 — 1662
5. Smith R.W., Rizk J. Epidemiological studies of osteoporosis in women in Puerto-Rico and southeastern Michigan with special reference to age, race, national origin and to other related or associated findings. Clin. Ortop., 1996; 45, 31 — 48
6. Garnero P., Hausherr E., Chapuy M.C. et. Al. Markers of bone resorption predict hip fracture in elderly women: The EPIDOS prospective Study. 1996; 11.10. 1531 — 1538.
7. Delmas P.D., Garnero P. Utility of biohemical markers in osteoporosis. In: Marcus R., Feldman D,. Kesley J. (eds). Osteoporosis. New York: Academic Press inc. 1996; 1075 — 1088.
Группы риска:
1. Женщины хрупкого телосложения со светлой кожей, бездетные или имеющие одного или двух детей, с семейным анамнезом переломов позвоночника или шейки бедра.
2. Женщины с ранней или искусственной менопаузой.
3. Женщины и мужчины с заболеваниями, вызывающими вторичный остеопороз (заболевания щитовидной железы, желудочно-кишечного тракта, ревматические болезни и т. д.).
4. Лица, принимающие лекарственные препараты, побочным эффектом которых является снижение костной массы.
Читайте также:
- Остеохондроз позвоночника у спортсменов. Хронические болезни позвоночника
- Внутриутробные вмешательства при врожденных пороках развития почек - показания
- Обмен тестостерона при аденоме простаты. Андрогены при аденоме предстательной железы
- Лихорадка при туберкулезе. Признаки туберкулеза органов у больного.
- Влияние операций на желудке, кровотечений из язвы на синтез стероидов, уропепсиногена
