КТ, МРТ при синоназальной аденокарциноме
Добавил пользователь Morpheus Обновлено: 29.01.2026
Вам поставили диагноз: опухоль полости носа и околоносовых пазух?
Наверняка Вы задаётесь вопросом: что же теперь делать?
Предлагаем Вашему вниманию краткий, но очень подробный обзор данного онкологического заболевания.
Его подготовили высоко квалифицированные специалисты Отделения лучевого и хирургического лечения заболеваний верхних дыхательных путей МРНЦ имени А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России под редакцией заведующего отделением к.м.н. Феликса Севрюкова.
Данная брошюра содержит информацию о диагностике и лечении опухоли полости носа и околоносовых пазух. Здесь собраны основные методики лечения данного заболевания, в том числе, последние разработки отечественных и зарубежных ученых-онкологов.
Филиалы и отделения, где лечат опухоль полости носа и околоносовых пазух
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
1. Введение
Особенностями опухолей полости носа и околоносовых пазух является их локализация, тесная, а иногда интимная, связь с жизненно важными органами и системами (головной мозг, глаз, среднее ухо, магистральные сосуды и т.д.).
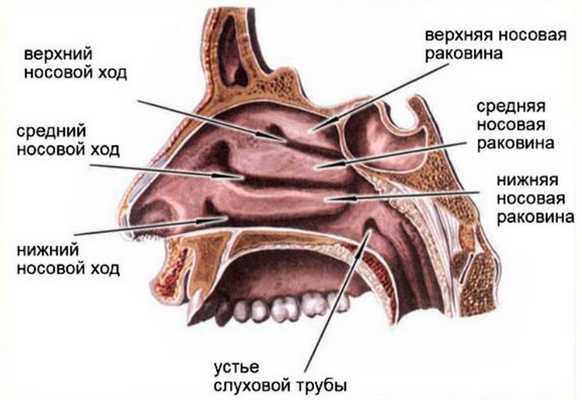
Полость носа состоит из носовых ходов (нижний, средний, верхний и общий); перегородки носа, делящей полость носа на две половины; и носовых раковин (нижняя, средняя и верхняя). Кзади полость носа посредством хоан сообщается с полостью носоглотки. На боковой стенке полости носа имеется выводные отверстия околоносовых пазух: верхнечелюстной, лобной, пазухи основной кости и клеток решетчатого лабиринта или решетчатой кости. Все элементы полости носа и околоносовых пазух покрыты слизистой оболочкой, элементы которой в большинстве случаев служат основой для возникновения опухолей данной локализации.
2. Статистика опухоли полости носа и околоносовых пазух (эпидемиология)
Злокачественные опухоли полости носа и околоносовых пазух встречаются приблизительно в 3% от всех злокачественных опухолей и до 20% от опухолей верхних дыхательных путей, после опухолей гортани, гортанноглотки и ротоглотки. Наиболее часто поражаются опухолью верхнечелюстные пазухи и собственно полость носа. Реже встречаются опухоли решетчатого лабиринта, лобной и основной пазух. Наиболее часто распространенные опухоли данной локализации поражают глазницу, включая все ее стенки и собственно глазное яблоко, кости основания черепа, иногда распространяясь и в полость черепа, особенно при поражении лобной, основной пазух и клеток решетчатого лабиринта. Опухоли данной локализации приблизительно в 2 раза чаще встречаются среди мужчин, чем у женщин, при этом заболевают чаще в наиболее трудоспособном возрасте – 40-60 лет, однако имеет место заболеваемость как в более раннем, так и старшем возрастах.
Мы хотим Вам помочь победить рак!
3. Морфологическая классификация опухоли полости носа и околоносовых пазух
Среди злокачественных опухолей полости носа и околоносовых пазух наиболее часто встречаются раковые опухоли разной степени дифференцировки.
• Плоскоклеточный ороговевающий рак – 50% и более,
• Плоскоклеточный неороговевающий – 10-13%,
• Низкодифференцированный рак 7-8%.
• Опухоли другого морфологического строения (саркомы, меланомы, цилиндромы, эстезионейробластомы, малигнизированные переходно-клеточные папилломы и др.) – 28%&
4. Стадии и симптоматика опухолей полости носа и околоносовых пазух
Подавляющее большинство пациентов имеют распространенные формы рака полости носа и околоносовых пазух. Так, пациенты с распространенностью опухоли T3N0M0 составили 22% случаев, T3N1-3M0 – 3,4%, T4N0 – 32,0% и с T4N1-3 – 9,6%. Только у 4,6% больных распространенность опухолевого процесса классифицировалась как T1-2N0.
Перечень симптомов, позволяющих заподозрить опухолевое поражение полости носа и околоносовых пазух:
1. быстро нарастающее одно редко двухстороннее нарушение носового дыхания;
2. упорные серозно-гнойные или кровянистые выделения из полости носа, чаще односторонние;
3. снижение обоняния;
4. нарушение конфигурации лица;
5. нарушение чувствительности кожи щеки или зубов верхней челюсти (как правило – одностороннее);
6. усиливающаяся подвижность зубов верхней челюсти;
7. смещение глазного яблока;
8. безболезненная припухлость щеки;
9. нарастающее нарушение зрения;
10. изменение конфигурации твердого неба или альвеолярного отростка верхней челюсти;
11. появление неприятного запаха.
5. Причины возникновения опухоли полости носа и околоносовых пазух и факторы риска
Как и для всех опухолей, причина возникновения злокачественных опухолей полости носа и околоносовых пазух, достоверно не установлена. Можно предполагать, что возникновению опухолей данной локализации способствуют ряд факторов, таких как хронические болезни полости носа и околоносовых пазух, полости рта, в частности зубов, производственные вредности, особенно пыль, в частности – асбестовая, древесная, вдыхание паров горюче-смазочных материалов, дыма – в частности, при сварочных работах, у работников никелевой промышленности и кожевенного производства.
Развитию опухолей может способствовать различные травмы (бытовые, производственные, спортивные и т.д.). К факторам риска может быть отнесена – генетическая предрасположенность, а также хроническая травма, например при пользовании зубными протезами.
6. Диагностика опухоли полости носа и околоносовых пазух
Перечень диагностических процедур подразделяется на обязательные и дополнительные. При этом особое значение имеет тщательный сбор анамнеза заболевания и анализ данных эндоскопического обследования ЛОР органов и данных СКТ и МРТ-исследований. Морфологическое подтверждение заболевания является обязательной процедурой для диагностики как первичной опухоли, так и ее метастазов. При этом особое значение имеют иммуноморфологические данные.
Перечень обязательных диагностических процедур:
•анкетные данные больного и анамнез заболевания
•врачебный осмотр (включающий ЛОР-осмотр)
•назофаринголарингоскопия
•ультразвуковое исследование шеи, печени, с пункцией лимфоузлов увеличенных более 1 см.
ультразвуковое исследование опухоли при разрушении опухолью костных структур и выходом в мягкие ткани лица
•СКТ головы с контрастированием (включая оценку инвазии в головной мозг) и шеи (до биопсии, шаг 3 мм)
•биопсия опухоли с последующим гистологическим, цитологическим исследованием, через полость носа, путем гайморотомии с использованием видеоассистированной техники, трепонобиопсии.
•рентгенологическое исследование органов грудной клетки при Т1-2 КТ грудной клетки при Т3 – Т4, или при подозрении на метастазы в легкие при рентгеновском снимке Т1-2
•ЭКГ стандартная
•консультация стоматолога
•совместный консилиум с участием ОНКОЛОГА, радиотерапевта, химиотерапевта
•консультация терапевта
•консультация анестезиолога для пациентов, планируемых для хирургического лечения
Дополнительные процедуры
•пункция лимфатических узлов шеи с последующим цитологическим исследованием (при подозрении на метастатическое поражение)
•гастроскопия
•КТ/МРТ шеи (до биопсии, шаг 3 мм) (по показаниям)
•компьютерная томография органов грудной клетки (при подозрении на метастатическое поражение легких)
•компьютерная томография органов брюшной полости (при подозрении на метастатическое поражение печени)
•магнитно-резонансная томография головного мозга (при наличии очаговой неврологической симптоматики)
•сцинтиграфия костей (при подозрении на метастатическое поражение)
•позитронно-эмиссионная томография /ПЭТ-КТ (при III-IV стадиях процесса, по показаниям)
•консультация специалистов (по показаниям)
•флуоресцентная диагностика (по показаниям)
•ЭХО-КГ, Холтеровское мониторирование – по показаниям
Специфических онкомаркеров для диагностики злокачественных опухолей данной локализации не существует. Скрининговых программ для диагностики этой патологии нет.
7. Лечение опухоли полости носа и околоносовых пазух
Основным методом лечения злокачественных опухолей полости носа и околоносовых пазух является хирургический. При этом объем хирургического вмешательства зависит от распространенности и локализации опухолевого поражения, которые определяются в результате клинического и инструментального обследований.
При начальных стадиях (Т1, Т2) опухолевого роста возможно выполнение щадящих органосберегающих хирургических вмешательств. При операбельных распространенных процессах (Т3, Т4), как правило, проводятся различные по объему расширенные, комбинированные операции, с включением в блок удаляемого препарата близ расположенных органов и тканей (глаз, стенки и ткани глазницы, клетчатка подвисочной и крылонебной ямок, скуловая кость, кожа и др.). Одновременно или отсрочено выполняются различные реконструктивно-пластические вмешательства, позволяющие минимизировать функциональные и косметические потери (пластики перемещенными кожно-жировыми и кожно-мышечными лоскутами, фрагментами мало-берцовой кости или гребня подвздошной кости на сосудистой ножке и др.). Наиболее часто изготавливаются либо разделительные пластины обеспечивающие разобщение возникшего послеоперационного дефекта и полости рта, или замещающие протезы с восстановленным зубным рядом.
Практически во всех случаях используется послеоперационная лучевая терапия в дозе ≈ 50-60 Гр. Предоперационное облучение применяется реже. Самостоятельная лучевая терапия проводится только в случаях неоперабельности опухоли или отказе пациента от хирургического лечения.
Лекарственная противоопухолевая терапия самостоятельного значения не имеет и применяется либо с предоперационной целью (неоадъювантная терапия), либо в послеоперационном периоде (адъювантное лечение), либо в сочетании с лучевой терапией (химиолучевое лечение). Применяются в основном препараты платины в сочетании с 5-фторурацилом, лучший эффект получается при использовании в данной схеме таксанов (таксотер и др.).
В предоперационном периоде проводится 2-3 цикла химиотерапии каждые 3 недели. В послеоперационном периоде возможно проведение до 6 циклов ПХТ (полихимиотерапии). При химиолучевом лечении применяется, в основном, цисплатин в дозе 100 мг/м2 1 раз в 3 недели или в дозе 75 мг/м2 каждую неделю. Для получения лучшего результата химио- или химиолучевой терапии иногда применяются таргетные препараты, в частности – Эрбитукс (Цетуксимаб).
8. Осложнения противоопухолевого лечения и их коррекция
Как уже было отмечено, хирургическое лечение злокачественных опухолей полости носа и околоносовых пазух ведет прежде всего к косметическим и функциональным нарушениям и касается в основном, возникновением обширных послеоперационных дефектов, разговорной речи и акта приема пищи. С целью минимизации таких осложнений осуществляются различные реконструктивно-пластические вмешательства, как неотсроченные (во время основного хирургического вмешательства), так и отсроченные (в разные периоды после операции), а также сложное зубное и разобщающее протезирование.
При проведении лучевой терапии при данной патологии наиболее часто возникают острые лучевые реакции (дерматиты) и поздние постлучевые осложнения (постлучевые отеки мягких тканей, фиброзы, постлучевые язвы и некрозы). При возникновении острых лучевых реакций проводятся в основном, противовоспалительные и противоотечные мероприятия. Возможно, при необходимости, назначение обезболивающих препаратов. Как правило, данные реакции купируются в течение 10-12 дней. Поздние лучевые осложнения требуют более сложных и длительных лечебных мероприятий, а иногда и сложных хирургических вмешательств.
При химиотерапии данной патологии наиболее частым нежелательным явлением оказывается возникновение гематологической токсичности разной степени выраженности, заключающейся в нарушении нормального кроветворения (анемии, нейтропении, тромбоцитопении и т.д.), приводящие к развитию инфекционных осложнений, кровотечениям (преимущественно носовым). Проводимое лечение может сопровождаться выпадением волос, развитием воспаления слизистой оболочки полости рта, глотки, желудка и кишечника. Вовремя и в необходимом объеме проведенные лечебные мероприятия позволяют купировать эти нежелательные явления и полностью завершить запланированный объем лечения.
9. Использование уникальных методик
В последнее время достаточно широкое применение получили такие методики как гипертермия (локальное нагревание опухоли СВЧ- или УВЧ – излучением); фотодинамическая терапии (либо при начальных формах опухолей, либо на ложе удаленного новообразования); химиоэмболизация питающих опухоль сосудов, видеоэндоскопическое удаление новообразований и др.
10. Особенности реабилитации
Как уже отмечалось, практически все больные с злокачественными опухолями полости носа и околоносовых пазух в той или иной степени требуют различных по сложности реабилитационных мероприятий. Эти мероприятия проводятся как в клиниках, занимающихся лечением данной категории больных, так и в специализированных учреждениях, занимающихся реконструктивно-пластическими операциями.
11. Прогноз заболевания
Прогноз эффективности лечения зависит как от локализации опухолевого поражения, так и от распространенности, морфологического строения опухоли, так и от проведенного лечения.
При правильном лечении у больных с начальными формами злокачественных опухолей полости носа и околоносовых пазух возможно излечение в течении 5 лет практически у 100% пациентов.
При распространенности опухоли Т3 излечение в этот период времени возможен более чем в 70% случаев, в зависимости от примененного вида лечения. Безусловно, лучший результат имеет место при использовании комбинированного лечения (операция + лучевое и химиолучевое лечение).
При опухолях, распространенностью Т4, 5-летний результат лечения не превышает 30-40% наличия метастазов в зонах регионарного метастазирования ухудшает результаты проводимой терапии.
Филиалы и отделения, в которых лечат опухоль полости носа и околоносовых пазух
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
КТ, МРТ при синоназальной аденокарциноме
а) Терминология:
1. Аббревиатура:
• Плоскоклеточный рак (ПКР)
2. Синонимы:
• Эпидеромидный рак, переходный рак, некератинизирующий рак, рак респираторного эпителия
3. Определение:
• Злокачественная эпителиальная опухоль с плоскоклеточной или эпидермоидной дифференцировкой, растущая из поверхностного эпителия пазухи в ее просвет
б) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Агрессивная мягкотканная опухоль пазухи с инвазией и деструкцией ее стенок
• Локализация:
о 75%: в пазухах; 30% в полости носа
- Верхнечелюстные (85%), решетчатые (10%), лобные/ основные пазухи (<5%)
о Рентгенолог создает карту распространения опухоли перед операцией:
- Кнутри: полость носа решетчатый лабиринт
- Кпереди: предчелюстные мягкие ткани щеки
- Кзади: ретроантральная жировая «подушка», крылонебная ямка (КНЯ) и жевательное пространство
- Кнаружи: скуловая возвышенность и подкожные ткани
- Кверху: в орбиту через ее дно или КНЯ и нижнюю глазничную щель
- Книзу: альвеолярный гребень верхней челюсти, щечное пространство, твердое небо
- Периневральное распространение опухоли (ПНРО): нижний глазничный нерв или КНЯ → V2 (круглое отверстие) → кавернозный синус
• Размер:
о Обычно заполняет верхнечелюстную пазуху
• Морфология:
о Хорошо (или плохо) отграниченное образование с неровными, лучистыми краями
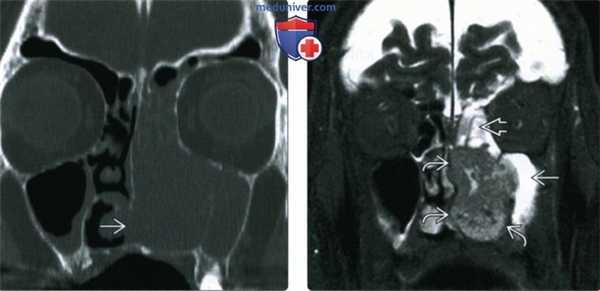
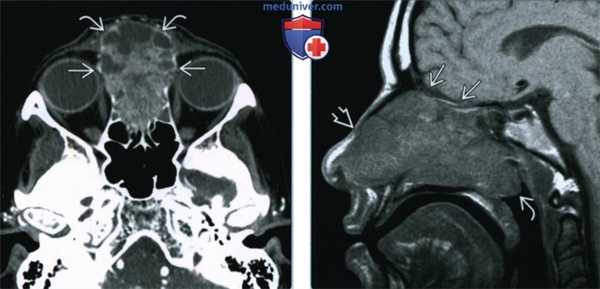
(Слева) При корональной КТ (реконструкция) визуализируется большое объемное образование, заполняющее полость носа слева, с эрозией ипсилатеральных носовых раковин. ПКР приводит к эрозии нижних отделов носовой перегородки. Края образования сложно определить.
(Справа) При корональной MPT STIR определяются края опухоли с гипоинтенсивным сигналом. «Запертый» секрет в верхнечелюстной и решетчатой пазухах гиперинтенсивен по сравнению с опухолью. Гипоинтенсивный сигнал (Т2) может быть обусловлен высоким Я:Ц соотношением.
2. КТ при синоназальном плоскоклеточном раке:
• КТ с КУ:
о Солидное, умеренно контрастирующееся образование; агрессивная деструкция костей
о Тенденция к неравномерному накоплению контраста
о Участки, не накапливающие контраст (некроз)
• «Костная» КТ:
о Характерный признак - деструкция костей
о Объемное образование мягкотканной плотности с неровными краями
3. МРТ при синоназальном плоскоклеточном раке:
• Т1 ВИ:
о Новобразование с промежуточным сигналом, схожим с таковым от мышц
о Кровоизлияния в опухоли: ↑ сигнал (Т1)
• Т2 ВИ:
о Промежуточный или гиперинтенсивный сигнал по сравнению с мышцами, менее интенсивный по сравнению с другими синоназальными злокачественными опухолями
- ↓ сигнал (Т2) из-за ↑ целлюлярности и ↑ ядерно-цитоплазматического (Я:Ц) отношения
о Т2: дифференциальная диагностика «запертого» секрета и опухоли
• ДВИ:
о Легкое ограничение диффузии из-за ↑ Я:Ц отношения
• Т1 ВИ С+:
о Легкое или умеренное контрастное усиление; диффузное, но неоднородное:
- Накапливает контраст меньше, чем аденокарцинома, эстезионейробластома, меланома
о Зоны некроза не накапливают контраст
о Т1 С+ FS оптимальная последовательность для выявления ПНРО
4. Сцинтиграфия:
• ПЭТ:
о Интенсивное накопление ФДГ с F-18 вследствие гиперметаболизма (стадирование, идентификация метастазов)
о И ПКР, и инвертированная папиллома, где возник ПКР могут интенсивно накапливать ФДГ
5. Рекомендации по визуализации:
• Лучший метод визуализации:
о Большая часть ПКР обнаруживается при рутинной КТ без КУ, выполняемой по поводу «синусита»
о Мультипланарная MPT С+ оптимальна для картирования опухоли, обнаружения ПНРО, заглоточных лимфоузлов
• Выбор протокола:
о Пре- и постконтрастная MPT (Т1) с жироподавлением от дна турецкого седла до подъязычной кости
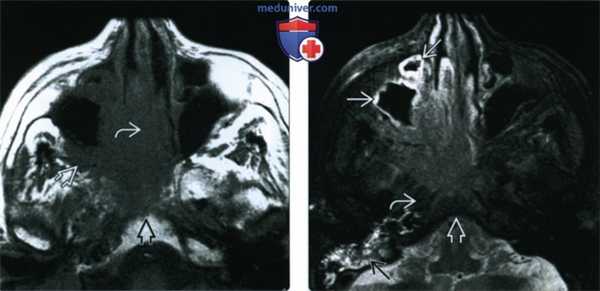
(Слева) При аксиальной МРТ Т1 определяется ПКР полости носа с вовлечением носовой перегородки, распространением кнаружи в крылонебную ямку и кзади в носоглотку, к основанию черепа.
(Справа) При аксиальной МРТ Т2 FS визуализируются края опухоли, отличной от утолщенной слизистой оболочки верхнечелюстной пазухи, превертебральных мышц и костного мозга ската с подавленным сигналом. Утолщение слизистой оболочки сосцевидного отростка связано с обструкцией евстахиевой трубы.
в) Дифференциальная диагностика синоназального плоскоклеточного рака:
1. Синоназальная аденокарцинома:
• Лучевые признаки могут быть аналогичны ПКР
• Чаще поражаются решетчатые пазухи
• Контрастное усиление выше по сравнению с ПКР
2. Синоназальная недифференцированная саркома:
• Саркому может быть невозможно отличить от ПКР
• Быстро растет
3. Инвазивный грибковый синусит:
• У пациента с иммунодефицитом
• Быстро прогрессирующий деструктивный процесс
• Может сочетаться с инвазией и тромбозом ВСА
4. Синоназальная неходжкинская лимфома:
• Однородное массивное новообразование носа/пазух (В-клеточный тип)
• Обуславливает деструкцию носовой перегородки (NK-клеточный тип)
• Может в точности имитировать гранулематоз Вегенера
5. Гранулематоз Вегенера:
• Септальная и внесептальная деструкция костей носа
• Сопутствующий хронический синусит
• Поражение пазух сочетается с поражением трахеи и бронхов, почек
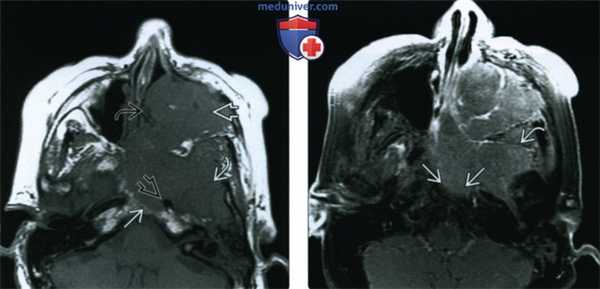
(Слева) При аксиальной МРТ Т1 определяется антральный ПКР очень большого размера с распространением в полость носа, подвисочную ямку и скат. Опухоль окружает левую внутреннюю сонную артерию но потоковое выпадение сигнала в ней сохранено.
(Справа) При аксиальной МРТ Т1 С+ FS определяется рак верхнечелюстной пазухи, равномерно накапливающий контраст, без явных зон некроза. Обратите внимание на инвазию ската и диффузную инфильтрацию жевательных мышц.
г) Патология:
1. Общая характеристика:
• Этиология:
о Факторы риска: вдыхание древесной пыли, частиц металла (никеля, хрома), химикатов, используемых в производстве кожи и текстиля; торотраст:
- Формальдегид и асбест: ↑ риск
- ВПЧ, предшествующая или сосуществующая инвертированная папиллома: ↑ риск
- Нет прямой связи с употреблением алкоголя или табака
2. Стадирование, классификация синоназального плоскоклеточного рака:
• Стадирование осуществляется в соответствии с таблицами АОКР (7-я редакция)
• Критерии стадирования первичной опухоли (Т) верхнечелюстной пазухи:
о Т1: только верхнечелюстные пазухи, нет деструкции костей
о Т2: инвазия костей (твердое небо, стенки носа); без поражения задней стенки верхнечелюстной пазухи или крыловидных пластинок
о Т3: инвазия костей задней стенки ± подкожных тканей ± дна, медиальной стенки орбиты ± крыловидной ямки ± решетчатых пазух
о Т4а (резектабельный): инвазия передних отделов орбиты, кожи, подвисочной ямки, крыловидных пластинок, решетчатой пластинки, лобных или основных пазух
о Т4b (нерезектабельный): вовлечение вершины орбиты, твердой оболочки, мозга, средней черепной ямки, ската, носоглотки, черепно-мозговых нервов (кроме V2)
3. Макроскопические и хирургические особенности:
• Рыхлое полиповидное, папиллярное или грибовидное мягкотканное образование
• Агрессивное поражение соседних структур
4. Микроскопия:
• Два основных подтипа: кератинизирующий (80%) и некератинизирующий (20%):
о Кератинизирующий: папиллярная или инвертированная архитектура, дискератоз, низкая или высокая дифференцировка
о Некератинизирующий: экзофитный характер; рост в виде перемежающихся лент, гиперцеллюлярность, плеоморфизм (переходноклеточный рак)
• Папиллярный вариант ПКР нетипичен
д) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Симптомы имитируют хронический синусит (поздняя диагностика)
о Первичные опухоли полости носа проявляются раньше обструкцией носа, кровотечением
• Другие признаки/симптомы:
о Большие опухоли верхней челюсти: односторонняя обструкция носа, носовые кровотечения, онемение щеки
о Зубная боль или расшатывание зубов, проптоз и диплопия, тризм, асимметрия лица
• Клинический профиль:
о Пожилой пациент мужского пола с односторонним синуситом, устойчивым к медикаментозной терапии
2. Демография:
• Возраст: 50-70 лет
• Пол:
о М>Ж
• Эпидемиология:
о 3% новообразований головы и шеи
о Самая частая злокачественная опухоль синоназальной области:
- ПКР: 80% всех злокачественных опухолей синоназальной области
о Злокачественная лимфаденопатия: 15% ПКР верхнечелюстных пазух:
- Заглоточные узлы/цепочки яремных лимфоузлов II уровня
о ↑ заболеваемости при облучении лица и шеи в анамнезе
о ↑ заболеваемости у пациентов с ослабленным иммунитетом
3. Течение и прогноз:
• Общая пятилетняя выживаемость: 60%
• Выживаемость тесно связана со стадией опухоли:
о ПКР Т1 при агрессивном лечении: 100% выживаемость (редко обнаруживается на стадии Т1)
о Пятилетняя выживаемость при ПКР на стадии Т4а: 34%
• Прогноз лучше при ПКР полости носа, начальных стадиях опухоли, ВПЧ-позитивных опухолях, инвертированной папилломе в анамнезе
• Прогноз хуже при распространении за пределы стенок пазух, поражении регионарных лимфоузлов, ПНРО, большой первичной опухоли
• Рецидив возникает в области первичной опухоли > регионарных лимфоузлов:
о При рецидиве выживаемость 90% < одного года
4. Лечение:
• Операция в сочетании с лучевой терапией:
о Резекция единым блоком или эндоскопическая резекция в зависимости от размера опухоли и пораженных структур
о ЛТ: традиционная, 3D-конформная, ЛТМИ
• По мере лучшего понимания генетики ПКР набирает популярность химиотерапия
е) Диагностическая памятка:
1. Следует учесть:
• ПКР-основной диагноз у взрослого мужчины с агрессивным мягкотканным образованием верхнечелюстной пазухи
2. Советы по интерпретации изображений:
• ↓ сигнал (Т2) и меньшее контрастное усиление по сравнению с другими синоназальными злокачественными опухолями
3. Рекомендации по отчетности:
• Прорастание в орбиту, жевательное пространство, небо:
о Оцените КИЯ и круглое отверстие на предмет ПНРО V2
1. Аббревиатура:
• Синоназальная аденокарцинома (СНАК)
2. Определение:
• Злокачественное новообразование с железистой дифференцировкой, возникающее из поверхностного эпителия или малых слюнных желез
1. Общая характеристика:
• Лучший диагностический критерий:
о Плохо отграниченное синоназальное объемное образование, накапливающее контраст, с поражением решетчатых пазух, полости носа, основания черепа
• Локализация:
о Преимущественное поражение полости носа и решетчатых пазух
• Размер:
о Из-за запоздалой диагностики может достигать больших размеров
(Слева) При аксиальной КТ с КУ визуализируется большая аденокарцинома, неравномерно накапливающая контраст, и заполняющая верхние отделы полости носа и решетчатые пазухи. Опухоль прорастает кпереди в мягкие ткани спинки носа и разрушает глазничную пластинку с обеих сторон.
(Справа) При сагиттальной МРТ Т1 ВИ визуализируется крупная аденокарцинома, заполняющая полость носа и распространяющаяся в носоглотку. Опухоль не прорастает через основание черепа, но распространяется в подкожную клетчатку спинки носа.
2. КТ при синоназальной аденокарциноме:
• КТ с КУ:
о Диффузное, чаще неоднородное контрастное усиление
• Костная КТ:
о Деструкция костей > ремоделирование
3. МРТ при синоназальной аденокарциноме:
• Т1 ВИ:
о Промежуточный сигнал; ↑ сигнал в очагах кровоизлияния
• Т2 ВИ:
о Вариабельный, обычно промежуточный или гиперинтенсивный
• Т1 ВИ С+:
о Диффузное, неоднородное контрастирование
4. Рекомендации по визуализации:
• Лучший метод визуализации:
о Мультипланарная MPT С+
• Выбор протокола:
о MPT С+ FS для картирования опухоли и выявления периневрального распространения
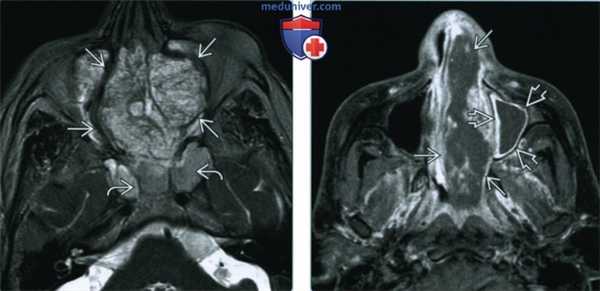
(Слева) При аксиальной МРТ Т2 ВИ FS: определяется большая гиперинтенсивная неоднородная аденокарцинома решетчатых пазух, заполняющая полость носа с объемным воздействием на обе орбиты. В сфеноидальных пазухах виден «запертый» секрет.
(Справа) При аксиальной МРТ Т1 ВИ С+ FS в полости носа слева определяется аденокарцинома, неравномерно накапливающая контраст. Обратите внимание на обструкцию левой верхнечелюстной пазухи с периферическим (не центральным) контрастированием секрета.
в) Дифференциальная диагностика синоназальной аденокарциномы:
1. Синоназальный плоскоклеточный рак:
• Обычно в верхнечелюстной пазухе; хуже отграничен
2. Эстезионейробластома:
• У подростка или пациента среднего возраста
• Возле решетчатой пластинки; интенсивно накапливает контраст
3. Синоназальный недифференцированный рак:
• Может выглядеть крайне похожей на СНАК
• Агрессивная, быстро растущая опухоль
4. Синоназальная неходжкинская лимфома:
• Предрасположенность к поражению полости носа
• Однородный, ↓ сигнал (Т2)
1. Общая характеристика:
• Этиология:
о Вдыхание древесной пыли имеет выраженную связь с интестинальным типом аденокарциномы
- Воздействие других веществ: вдыхание металлической пыли, химикатов, использующихся в производстве кожи и текстиля
2. Стадирование, классификация синоназальной аденокарциномы:
• Классификация TNM AJCC чаще всего используется для опухолей полости носа и решетчатых пазух
• Подтипы:
о Интестинальный: самая распространенная форма - ободочная (40%), солидная (20%), папиллярная (18%), муцинозный и смешанный тип (22%)
о Неинтестинальный: не зависит от вдыхания древесной пыли
3. Макроскопические и хирургические особенности:
• Коричневый, белый, розовый цвет; плоский, экзофитный или папиллярный рост, рыхлая или плотная консистенция
4. Микроскопия:
• Высокая дифференцировка:
о Без капсулы; одинаковые железы с кистозными участками; без стромы
• Низкая дифференцировка:
о Солидное новообразование с инвазивным характером роста, плеоморфизм, ↑ митозов
• Толстокишечный (интестинальный) тип: инвазия с различными типами роста (папиллярно-трубчатый, альвеолярно-слизистый, альвеолярно-бокаловидно-/перстневидноклеточный, смешанный)
1. Проявления:
• Типичные признаки/симптомы:
о Заложенность носа и обструкция
о Носовые кровотечения
2. Демография:
• Возраст:
о Чаще всего шестой десяток лет жизни (в среднем 64 года)
• Пол:
о М>Ж (3:1)
• Эпидемиология:
о 15% всех вариантов СН рака
3. Течение и прогноз:
• Низкая степень злокачественности: великолепный прогноз; высокая степень - неблагоприятный
• Пятилетняя выживаемость невысока (50%)
4. Лечение:
• Лечение: радикальная резекция
• Облучение и химиотерапия: изолированно или в сочетании с операцией
е) Диагностическая памятка. Следует учесть:
• Аденокарцинома при профессиональных воздействиях и поражении полости носа, решетчатых пазух
КТ с динамическим внутривенным контрастным усилением по-прежнему является методом выбора при диагностике и стадировании ПАК ПЖ [7, 8]. Данное исследование включает оценку самого новообразования, его размеров и распространенности на прилежащие органы и сосуды, а также выявление метастазов [9].
Kim и соавт. [6], проанализировав данные КТ 644 пациентов, установили, что ПАК ПЖ, изоденсные паренхиме ПЖ (вне границ опухоли) в артериальную и венозную фазы, характеризуются более высокой дифференцировкой, меньшей частотой развития центрального некроза и лучшими показателями выживаемости по сравнению с гиподенсными ПАК ПЖ.
Fukukura и соавт. [7], проанализировав данные КТ 92 пациентов, продемонстрировали схожие результаты. Согласно их исследованию, ПАК ПЖ низкой плотности на КТ с контрастным усилением во все фазы исследования были связаны с более низкими показателями выживаемости по сравнению с образованиями высокой плотности.
В то же время в литературе встречаются противоположные данные. Согласно результатам S. Vyas и соавт. [10], у пациентов с высокодифференцированными опухолями значительно более низкая плотность опухоли по сравнению с умеренно дифференцированными. При этом разница между высоко- и низкодифференцированными ПАК ПЖ статистически незначима.
Исходя из полученных данных, различия показателей плотности по фазам исследования при разных дифференцировках опухоли оказались статистически незначимыми. При этом при низкодифференцированных ПАК ПЖ отмечены более высокие средние значения плотности в артериальную фазу исследования вопреки данным литературы [11, 12], которые свидетельствуют о том, что, чем ниже дифференцировка опухоли, тем ниже накопление контрастного препарата в обе фазы.
Zhu и соавт. [13], проанализировав данные КТ 79 пациентов, показали, что абсолютные значения накопления контрастного препарата не всегда надежны, и предложили использовать относительное накопление контрастного препарата для прогнозирования показателей выживаемости. Авторы продемонстрировали, что КОН
Наше исследование показало схожие результаты: более чем в половине случаев высокодифференцированных опухолей КОН КВ составил более 1, а в большинстве умеренно и низкодифференцированных ПАК ПЖ данный показатель был менее 1. Снижение значений КОН КВ у умеренно и низкодифференцированных опухолей может быть обусловлено наличием центральной зоны некроза и более развитой фиброзной стромой [14]. Предположение о том, что высокие значения плотности в артериальную фазу среди низкодифференцированных новообразований могут быть связаны с тем, что в артериальную фазу плотность контрастирования аорты у них также выше, опровергнуто результатами факторного анализа корреляционной матрицы.
Данные литературы относительно гиперваскулярного ободка противоречивы: ряд авторов приводят данные, в которых при ПАК ПЖ он хорошо визуализируется и свидетельствует в пользу более низкой дифференцировки опухоли [15, 16]. Другие же считают, что данный признак не характерен для ПАК ПЖ и даже предлагают использовать его отсутствие в качестве дифференциально-диагностического признака ПАК ПЖ [17—19].
В 2018 г. опубликовано крупное исследование, в ходе которого проанализировали результаты МРТ 143 пациентов, 84 из которых была выполнена радикальная резекция. У 32 больных визуализировали гиперваскулярный ободок по контуру образования, который, согласно результатам данного исследования, свидетельствовал о более низкой степени дифференцировки опухоли и худших показателях выживаемости [15].
H. Imaoka и соавт. в своем исследовании отмечают, что наличие гиперваскулярного ободка является наиболее полезным признаком при определении аденосквамозной аденокарциномы — чувствительность и специфичность составляют соответственно 65,2 и 89,6% [16]. Аденосквамозная аденокарцинома является гистологическим подтипом ПАК, для которой характерен наиболее неблагоприятный прогноз [20].
Galia и соавт. в исследовании сравнили МРТ- и КТ-признаки ПАК ПЖ и вторичных очагов в ПЖ. При этом гиперваскулярный ободок на КТ-изображениях отмечался в 22 (41%) из 54 случаев вторичного поражения ПЖ, и только в 1 (3%) из 30 случаев ПАК ПЖ [17].
При сравнении КТ-признаков ПАК ПЖ с другими солидными образованиями периампуллярной зоны (нейроэндокринные опухоли, гастроинтестинальная стромальная опухоль и солидная псевдопапиллярная опухоль) Jang и соавт. ни в одном из 98 случаев ПАК ПЖ и 14 случаев солидной псевдопапиллярной опухоли гиперваскулярного ободка не выявили, притом данный признак определялся в 21 из 31 случая гастроинтестинальной стромальной опухоли и в 5 из 52 случаев нейроэндокринные опухоли [18].
Гиперваскулярный ободок также не выявили ни в одном из 28 случаев ПАК ПЖ в исследовании Hur и соавт. при сравнении МРТ-признаков ПАК ПЖ и аутоиммунного панкреатита. При аутоиммунном панкреатите данный признак установили в 4 (28,6%) из 14 случаев [19].
Напротив, данные российской литературы свидетельствуют, что при ПАК ПЖ гиперваскулярный ободок выявлен в 11,6% случаев, в то время как отличительной чертой аутоиммунного панкреатита являлся гиподенсный ободок равномерный шириной не более 5—7 мм по периферии железы [21].
Согласно полученным нами данным, среди высокодифференцированных ПАК ПЖ в 81,8% гиперваскулярный ободок не отмечался. При наличии гиперваскулярного ободка в 96,4% случаев опухоль была низко- или умеренно дифференцированной. Когда нельзя было однозначно высказаться в пользу отсутствия или наличия ободка, умеренно дифференцированная ПАК ПЖ отмечена в 85,7% случаев.
Таким образом, полученные результаты свидетельствуют о том, что отсутствие гиперваскулярного ободка говорит в пользу высокой дифференцировки опухоли. По нашим данным, достоверной разницы между умеренной и низкой дифференцировкой опухоли не выявлено.
Наши результаты не противоречат данным Lee и соавт., но следует отметить, что на КТ-изображениях данный признак отмечался в виде более тонкого кольца, чем приводили авторы в примерах МР-изображений в своей статье [15]. Данные различия могут быть связаны с более высокой контрастностью МР-изображений при диагностике мягких тканей [22].
У 15 из 81 пациента также выполнена МРТ с динамическим внутривенным контрастным усилением, при этом гиперваскулярный ободок в случае его наличия визуализировался более отчетливо, нежели на КТ, однако мы не установили ни одного случая столь интенсивного и соизмеримого по толщине ободка, как это отмечают Lee и соавт. [15].
Более высокие показатели плотности ПАК ПЖ в артериальную фазу и наличие гиперваскулярного ободка среди низкодифференцированных опухолей могут быть обусловлены более активным процессом неоангиогенеза по сравнению с высокодифференцированными опухолями. Детальное патоморфологическое исследование опухолей с наличием гиперваскулярного ободка при КТ, а также проспективный анализ данных КТ с целью прогнозирования дифференцировки ПАК ПЖ станут предметом наших дальнейших исследований.
Значения чувствительности и специфичности, которые мы получили, могут быть обусловлены небольшим количеством высокодифференцированных ПАК ПЖ по сравнению с умеренно и низкодифференцированными опухолями в нашем исследовании. Причиной тому может быть тот факт, что при высокодифференцированной ПАК ПЖ опухоль реже распространяется на прилегающие структуры и не вызывает клинических симптомов, например, желтуху вследствие инвазии холедоха, что зачастую и служит причиной обращения за медицинской помощью и выполнения диагностических исследований. Данные литературы говорят о том, что при морфологическом исследовании чаще (в 85% случаев) отмечаются умеренно и низкодифференцированные опухоли [23].
При анализе публикаций, посвященных связи размера ПАК ПЖ и ее дифференцировки, результаты Macı’as и соавт. показали, что у пациентов с ПАК ПЖ Grade 2 и 3 средний размер опухоли был больше (30 мм) по сравнению с пациентами с Grade 1 (25 мм) (p=0,009) [24]. По данным Jun Yu и соавт., у пациентов с высоко- и умеренно дифференцированными ПАК ПЖ отмечены меньшие средние размеры опухоли (3,7 и 3,6 см соответственно) по сравнению с низкодифференцированными ПАК ПЖ (4 см) (p=0,0001) [25]. В отличие от вышеупомянутых авторов мы оценивали размер опухоли в трех плоскостях, и наши данные не показали достоверной разницы между средними значениями объема ПАК ПЖ и дифференцировкой. Однако наибольшие значения объема ПАК ПЖ достоверно чаще определяли в группе низкодифференцированных ПАК ПЖ по сравнению с умеренно дифференцированными опухолями. При этом обращают на себя внимание 3 наблюдения с очень большим объемом опухоли при высокодифференцированной ПАК ПЖ, которые показывают, что делать выводы о дифференцировке ПАК ПЖ, опираясь только на ее размер, а также рассматривать развитие ПАК ПЖ как эволюцию от высокодифференцированной опухоли к низкодифференцированной с увеличением ее размеров не представляется возможным.
Ограничением нашего исследования явилось небольшое количество случаев высокодифференцированных ПАК ПЖ, при этом диагностика именно высокодифференцированной опухоли является приоритетной задачей, так как позволяет достичь наиболее высоких показателей выживаемости [6]. Кроме того, в нашем исследовании рассмотрены только опухоли головки ПЖ. ПАК данной локализации встречается наиболее часто и при прочих равных условиях реже оказывается резектабельной по сравнению с ПАК тела и хвоста ПЖ [26].
Таким образом, оценка наличия гиперваскулярного периопухолевого ободка и КОН КВ по данным КТ позволяет на дооперационном этапе предположить степень дифференцировки ПАК ПЖ, не прибегая к инвазивным диагностическим вмешательствам, и может стать полезным инструментом при прогнозировании показателей выживаемости.
Участие авторов:
Концепция и дизайн исследования — Г.Г.
Сбор и обработка материала — М.Ю., А.Б., Д.В., В.И., А.Г.
Статистическая обработка — А.И.
Написание текста — М.Ю.
Редактирование — Г.Г., Д.В., А.Г.
Финансирование. Исследование не имело спонсорской поддержки.
Аденокарцинома
Аденокарцинома – это опасная для жизни опухоль, которая развивается в клетках, выделяющих слизь, пищеварительные соки и другие жидкости. Она представляет из себя разновидность карциномы – самого распространенного типа рака. Ее клетки способны прорастать в окружающие ткани, разрушать их, распространяться по телу и создавать различных его частях метастазы – дополнительные онкологические новообразования.
Что такое аденокарцинома и как она развивается?
В организме человека есть более 30 триллионов клеток, каждая из которых действует согласно строго определенной встроенной «программе»: рождается, работает и умирает. Иногда из-за влияния некоторых заболеваний, химических веществ, радиации, наследственных особенностей или случайных сбоев в процессе их деления возникают ошибки. В результате чего в теле появляются мутировавшие, или измененные клетки, обладающие особыми свойствами:
- Бесконтрольно размножаются.
- Не погибают по окончанию нормального жизненного цикла.
- Со временем из их множества формируется опухоль, которая не раздвигает окружающие ткани, а прорастает в них и разрушает.
- Они отрываются от основного, так называемого первичного очага, попадают в сосуды кровеносной и лимфатической Лимфатическая система дублирует кровеносную. В ней циркулирует лимфа – межклеточная жидкость, которая омывает все клетки тела, доставляет в них необходимые вещества и забирает отходы. На всем протяжении ее сосудов расположены лимфоузлы – похожие на горошину маленькие органы, которые обезвреживают и выводят из организма опасные вещества. систем.
- С кровью и лимфой – жидкостью, омывающей все клетки организма, перемещаются в различные части тела.
- Закрепляются в других структурах и органах, таких как мозг, печень, легкие или кости, и создают в них метастазы – дополнительные раковые новообразования.
Со временем все большее количество жизненно важных тканей повреждается, а их работа нарушается.
Измененными могут стать и клетки желез, выделяющие различные жидкости. Чаще всего аденокарциномы возникают в:
- Желудке, в котором происходит накопление и расщепление пищи.
- Легких, и составляют около 40% всех видов опасных опухолей дыхательных путей. Они развиваются в клетках, которые производят слизь, необходимую для выведения из тела пыли и микробов, содержащихся в воздухе. Обычно медленно растут и чаще встречаются у курильщиков, в том числе бывших.
- Молочной железе, и составляют большинство видов рака данного органа. Формируются в клетках, производящих грудное молоко.
- Пищеводе – трубке, по которой пища проходит из рта в желудок. Как правило, измененными становятся клетки, которые выстилают ее нижнюю часть и создают смазывающую слизь.
- Поджелудочной железе, расположенной за желудком. Около 85% всех случаев ее онкологических заболеваний – это аденокарциномы, возникающие в протоках, переносящих необходимые для пищеварения вещества.
- Предстательной железе у мужчин, находящейся чуть ниже мочевого пузыря. Развивается в клетках, производящих защищающую сперматозоиды жидкость.
- Прямой кишке, выводящей остатки переваренной пищи из организма.
- Толстой кишке, в которой происходит всасывание воды и питательных веществ. Аденокарцинома – это самый распространенный тип рака данного органа. Обычно они начинаются с небольшого полипа – нароста ткани на внутренней стенки.
Причины развития аденокарциномы
Сегодня научное сообщество не знает, почему именно возникают все случаи онкологии. Врачам известны только так называемые факторы риска, которые увеличивают вероятность появления в организме измененных клеток. Наличие одного или даже нескольких из них не гарантируют того, что заболевание обязательно разовьется. У каждого типа аденокарциномы есть свой список возможных причин.
Легкое:
- Курение, в том числе пассивное, то есть вдыхание табачного дыма.
- Загрязнение воздуха и химические вещества, такие как радиоактивный газ радон, диоксид кремния, прочие тяжелые металлы и использующийся в строительстве и другой промышленности асбест.
- Семейный анамнез – наличие кровных родственников, у которых уже есть подобный диагноз.
- Облучение: радиация, полученная в ходе диагностики и лечения различных видов онкологических заболеваний при воздействии на область грудной клетки.
Предстательная железа:
- Риск развития рака увеличивается после 50 лет, при этом большинство случаев выявляется у мужчин старше 65 лет.
- Мутации, или изменения генов BRCA1 и BRCA2, которые отвечают за устранение ошибок в клетках и предотвращение развитие опухолей.
- Синдром Линча, повышающий вероятность возникновения опасных новообразований у людей в возрасте до 50 лет.
- Курение.
- Ожирение и лишний вес.
- Семейный анамнез - наличие кровных родственников с подобным диагнозом.
- Неправильное питание: лишние калории, избыток животных жиров и сахара в рационе, а также нехватка фруктов и овощей.
- Недостаточная физическая активность.
- Воспалительные заболевания простаты.
Поджелудочная железа:
- Вероятность развития аденокарциномы повышается с возрастом. Большая часть случаев выявляется у пациентов старше 65 лет, причем у мужчин чаще, чем у женщин.
- Наследственные генетические синдромы, увеличивающие риск возникновения опухолей.
- Мутации, или изменения, вызывающие панкреатит – воспаление поджелудочной железы.
- Некоторые факторы образа жизни: курение, лишний вес, нехватка физической нагрузки, злоупотребление алкоголем и диета с высоким содержанием жира и красного мяса.
Пищевод:
- Пол и возраст: большинство случаев новообразований выявляется у мужчин старше 55 лет.
- Травмы и повреждения пищевода, в том числе от кислоты, забрасываемой из желудка, алкоголя и горячих жидкостей.
- Другие виды рака: легких, ротовой полости или горла.
- Наследственность – наличие кровных родственников, у которых уже есть подобный диагноз.
- Тилоз – чрезмерное разрастание верхнего слоя кожи на ладонях и подошвах стоп, а также образование папиллом, которые представляют из себя небольшие наросты ткани в пищеводе.
- Питание: нехватка в рационе фруктов и овощей.
- Воздействие химикатов и раздражителей, таких как сажа, табачный дым, выхлопные газы, металлическая пыль и других.
Кишечник:
- Чаще всего колоректальные аденокарциномы встречаются у мужчин старше 50 лет.
- Воспалительные заболевания, приводящие к постоянному повреждению стенок органа.
- Ожирение.
- Сидячий образ жизни и отсутствие физической нагрузки.
- Употребление алкоголя и табака.
- Полипы – разрастания тканей на стенке кишечника.
- Диета с низким содержанием клетчатки и высоким – жира и полуфабрикатов из мяса.
Молочная железа:
- Семейный анамнез – наличие родственников с подобным диагнозом.
- Возраст от 55 лет.
- Мутации, или изменения генов BRCA1 и BRCA2, которые отвечают за устранение ошибок в клетках и предотвращение развитие опухолей.
- Ранние менструации – до 12 лет, и менопауза после 55 лет.
- Лучевая терапия – облучение области грудной клетки.
- Плотная ткань молочной железы.
- Употребление алкоголя.
- Ожирение.
- Наличие рака груди или яичников, в том числе находящихся в ремиссии Ремиссия – это полное отсутствие признаков заболевания.
- Нехватка физической активности.
- Отсутствие беременностей, грудного вскармливания и роды после 30 лет.
Желудок:
- Большинство пациентов – мужчины в возрасте от 60 лет.
- Избыточный вес.
- Алкоголь и табак.
- Полипы – разрастания ткани на стенке органа.
- Синдром Линча, повышающий вероятность возникновения опасных новообразований у людей в возрасте до 50 лет.
- Избыток красного мяса в рационе, употребление большого количества соленой, маринованной или копченой пищи.
- Инфекция Helicobacter pylori – бактерии, повреждающие слизистую оболочку желудка и приводящие к развитию язвы и гастрита Гастрит – это воспаление слизистой оболочки желудка. .
- Наличие родственников с подобным диагнозом.
- Группа крови А (II).
- Наследственные синдромы, провоцирующие разрастание тканей или возникновение опухолей.
Аденокарцинома развивается из-за ошибок в генах, которые контролируют рождение, работу и смерть клеток. Такие изменения происходят по нескольким причинам.
- Часть возникает при делении клеток.
- Некоторые из них вызваны воздействием вредных веществ и образом жизни.
- И в части случаев они наследуются от родителей.
Так называемые онкогены стимулируют развитие клеток, а супрессоры опухолей – замедляют их рост и вызывают гибель по окончанию жизненного цикла. Если в результате различных нарушений первые из них активируются, а вторые «выключаются», в организме человека появляется рак.

Диагностика аденокарциномы
Сегодня медицина предлагает множество различных методов, позволяющих выявлять раковые опухоли даже на самых ранних этапах.
- Биопсия – изъятие небольшого количества тканей для изучения свойств ее клеток. Данное исследование – единственный способ постановки точного диагноза. Материал забирается в ходе хирургической операции или прокола иглой, после чего передается в лабораторию, где специалисты выявляют в нем раковые клетки и определяют их тип. Эта информация необходима врачам для подбора правильного лечения и определения прогнозов пациента.
- Рентгенография грудной клетки, а также маммография, обнаруживающая новообразования в молочной железе.
- УЗИ, или сонография – оценка состояния внутренних структур с использованием звуковых волн. Процедура не наносит вреда организму пациента и часто выполняется для выявления очагов заболевания, расположенных в том числе в лимфатических узлах – органах иммунной системы, задерживающих и уничтожающих опасные вещества.
- Магнитно-резонансная томография, МРТ – создание крайне подробного и детализированного изображения мягких тканей, включая мозг, нервы и сосуды при помощи мощных магнитов и радиоволн. МРТ обнаруживает опухоли и определяет их точные размеры и границы. Она не назначается людям с несовместимыми трансплантатами и протезами и не дает возможности исследовать части скелета, в которые часто проникают измененные клетки.
- Компьютерная томография, или КТ. Специальный аппарат делает множество рентгеновских снимков и объединяет их в одну четкую черно-белую картинку. КТ позволяет изучать не только мягкие структуры, но и кости, а также содержащие большое количество воздуха органы, такие как легкие.
- Позитронно-эмиссионная томография.До начала процедуры человек получает небольшое количество радиоактивного сахара, который накапливается в быстро делящихся клетках, в том числе раковых. Затем проводится сканирование, выявляющее любые, даже самые маленькие их скопления. ПЭТ применяется для поиска в организме метастазов – дополнительных очагов онкологии, если врачи точно не знают, в какой именно области они могут находиться. Некоторое оборудование позволяет одновременно выполнять ПЭТ и КТ, благодаря чему доктор получает гораздо больше информации, чем дает каждое из данных исследований.
- Анализы крови. Назначаются для поиска онкомаркеров – белков, выделяемых некоторыми типами измененных клеток, а также для оценки качества работы внутренних органов, таких как почки и печень.
Пройти полную диагностику аденокарциномы можно в онкологическом центре «Лапино-2».
У нас есть высококвалифицированные специалисты и современное оборудование, которое позволяет выявлять опасные опухоли на самых ранних стадиях.
У пациентов нашей клиники нет необходимости тратить времени на поездки по разным медицинским учреждениям – все процедуры выполняются на территории Центра. Исследования проводятся без очереди, в максимально сжатые сроки, а результаты анализов мы получаем из собственной лаборатории.
Стадии аденокарциномы
После выявления рака врачи выясняют его стадию – количество пострадавших от измененных клеток тканей. Для определения этапа аденокарциномы используется международная система TNM, основанная на 3 ключевых моментах:
- Т: размере основной опухоли.
- N: количестве поврежденных лимфатических узлов.
- М: наличии или отсутствии метастазов – дополнительных очагов заболевания в различных областях организма.
Стадии:
В тканях присутствуют измененные клетки, но они есть только там, где впервые возникли.
I. Опухоль имеет минимальные размеры и находится в пределах органа, в котором она образовалась.
II. На этом этапе очаг разрастается до более крупных габаритов, но другие структуры здоровы.
III. Новообразование увеличивается еще сильнее и выходит за границы органа, в котором появилось. Либо неправильные клетки обнаруживаются в лимфатических узлах – «фильтрах» иммунной системы, задерживающих и обезвреживающих опасные вещества.
IV. Единственная стадия, в медицинском шифре которой рядом с буквой «М» стоит цифра «1», а не ноль. Это значит, что в теле пациента присутствуют метастазы – дополнительные раковые опухоли в других областях организма, расположенных далеко от первичного очага.

Лечение аденокарциномы
Тактика борьбы с раком зависит от большого количества факторов: количества пострадавших тканей, размера и расположения опухоли, возраста человека, наличия у него других тяжелых заболеваний и его общего состояния здоровья.
Часто основным методом лечения аденокарциномы является хирургия – удаление новообразования и небольшого количества окружающей ее здоровой ткани. Нормальные структуры изымаются для того, чтобы в организме не осталось ни одной измененной клетки, которая могла бы размножиться и сформировать новый очаг заболевания.
Операции проводятся как классическим способом – с выполнением крупных разрезов, так и лапароскопически – с использованием специального инструмента через небольшие проколы. Такие вмешательства позволяют повреждать минимум тканей и сокращают кровопотерю, болевые ощущения и сроки восстановления, но требуют большого опыта и мастерства хирурга.
Химиотерапия – применение препаратов для уничтожения неправильных клеток. Они вводятся в вену или принимаются внутрь, попадают в кровоток, распространяются по всему телу и действуют во всех его областях. Благодаря такому свойству их можно использовать в том числе на запущенных стадиях, при распространении рака и появлении метастазов Метастаз – это новая, дополнительная онкологическая опухоль, возникшая в тканях или органах, расположенных далеко от основного ракового очага. . «Химия» проводится циклами, каждый из которых чередуется с периодом отдыха, необходимого для восстановления организма.
Лучевая терапия – разрушение измененных клеток радиацией. Лечение предполагает 2 вида воздействия:
- внешнее – облучение из специального аппарата, расположенного вне тела;
- и внутреннее, или брахитерапию – размещение радиоактивных веществ в опухоли или близких к ней тканях.
Может назначаться совместно с химиотерапией. Проводится до операции для уменьшения размеров опухоли и облегчения ее удаления, а также после хирургического вмешательства для уничтожения всех оставшихся неправильных клеток.
Таргетная терапия – прием препаратов, которые воздействуют только на определенные изменения в клетках. С их помощью можно остановить рост новообразования или уменьшить его размеры. В отличие от обычной «химии», влияющей на любые быстро делящиеся клетки, такие вещества практически не повреждают здоровые ткани.
Гормональная терапия. Гормоны – это вещества, которые создаются железами, с кровью перемещаются в различные ткани и сообщают им, как действовать – работать или отдыхать, поглощать что-то или выделять. Данные соединения влияют на развитие некоторых видов аденокарцином. Контроль их количества или прекращение выработки с помощью специальных лекарств может замедлить или прекратить увеличение опухолей.
Иммунотерапия – средства, которые помогают собственной иммунной системе человека выявлять и разрушать измененные клетки. Такие препараты обычно назначаются пациентам с распространенным раком для сокращения размеров новообразований и остановки их роста.
В онкологическом центре «Лапино-2» проводится лечение различных типов аденокарцином на любой стадии.
У нас работают отличные специалисты – врачи с мировым именем и огромным опытом в области выявления и борьбы с онкологическими заболеваниями.
Мы применяем все современные методики и используем исключительно оригинальные препараты, дающие предсказуемый результат.
Нашим пациентам не приходится терять драгоценное время – у нас нет очередей, а все процедуры проводятся точно в срок, с максимальным комфортом для каждого посетителя.
Прогнозы и выживаемость при аденокарциноме
Прогноз индивидуален для каждого человека и зависит от множества факторов: возраста, наличия других тяжелых заболеваний, типа рака, его распространенности, свойств его клеток и реакции на проводимую терапию.
Врачи определяют примерные перспективы пациента, ориентируясь на данные «пятилетней выживаемости». Этот показатель представляет из себя статистическую выборку – количество больных, оставшихся в живых через 5 или более лет с момента постановки диагноза.
Для различных типов аденокарциномы общая для всех стадий цифра выглядит следующим образом:
Читайте также:
