Культуральные среды. Твердые и жидкие среды.
Добавил пользователь Владимир З. Обновлено: 21.01.2026
По происхождению – естественные(продукты растительного или животного происхождения) и искусственные(определенный хим состав и точное количественное содержание питательных веществ).
Среды делят также на простые(мясная и пептонная вода, бульон и агар) и сложные(к простым средам добавляют углеводы, кровь, сыворотку и т.д.)
В зависимости от свойств, состава и назначения П. с. делят на группы. По консистенции различают питательные среды твердые, полужидкие и жидкие. Примером твердых сред являются 1,5—2% агаровые среды (мясо-пептонный агар, агар Хоттингера), питательная желатина, свернутая сыворотка, свернутый яичный белок, картофель и др. Для приготовления твердых П. с. наиболее часто используют агар-агар, получаемый из морских водорослей. Агар-агар является веществом полисахаридной природы. В воде набухает, образуя студень. Разжижается при t° 70-100° и застывает при 40-50°.
Полужидкой средой является 0,5% агар мясо-пептонный (см.).
К жидким средам относят бульон мясо-пептонный (см.), пептонную воду сахарный бульон, бульон Хоттингера, представляющий собой разведенный (в 4—9 раз) мясной фильтрат.
По целевому назначению – основные(мпа, мпб); специальные(прим.,углеводы для роста стрептоккоков) они делятся , в свою очередь на: избирательные, дифферинциально-диагностические.
5.Техники посева бактерий на жидкие и плотные питательные среды.
Материалом для посева могут быть пересеваемые культуры бактерий, различные выделения животных и человека, ткани трупа, вода, почва, продукты питания. Жидкий материал для посева берут петлей или пипеткой. При взятии петлей жидкость должна образовать в кольце петли тонкую прозрачную пленку - “зеркало”. Пипетками пользуются в том случае, когда материал засевают в большом или точно отмеряемом объеме. Способ взятия плотного материала определяется его консистенцией. При посевах чаще всего пользуются бактериальной петлей. Все манипуляции, связанные с посевом и выделением микробных культур, производят над пламенем горелки. Бактериальную петлю прокаливают над пламенем непосредственно перед взятием материала, за
тем петлю остужают. Для этого при пересеве микробной культуры с пробирки горячую петлю погружают в конденсационную жидкость, а при пересеве с чашек Петри прикасаются к поверхности питательной среды, свободной от микробного роста. Достаточно остуженная петля не вызывает шипения конденсационной жидкости и не растапливает агар при соприкосновении со средой. После окончания посева петлю прожигают повторно для уничтожения находящейся на ней микробной культуры или инфицированного микроорганизмами материала Пипетки и шпатели, используемые для посевов и опускают в дезинфицирующий раствор.
После посева на чашках Петри со стороны дна, на пробирках в верхней трети надписывают название засеянного материала, ставят номер анализа и дату посева.
Техника посевов на плотные и жидкие питательные среды: 1. При посеве в жидкую питательную среду петлю с находящимся на ней материалом погружают в среду. Если материал вязкий и с петли не снимается, его растирают на стенке сосуда, а затем смывают жидкой средой. Жидкий материал, набираемый в пастеровскую или градуированную пипетку, вливают в питательную среду. 2. При посеве на скошенный мясопептонный агар
пробирку берут в левую руку между 1 и II пальцами, чтобы основание пробирки находилось на поверхности кисти руки и посев осуществлялся под контролем глаза. Пробку из пробирки вынимают правой рукой V и IV пальцами, не прикасаясь к той части пробки, которая входит внутрь пробирки. Остальные 3 пальца правой руки остаются свободными для взятия бактериальной петли, посредством которой производится посев. Петлю держат, как писчее перо. После вынимания пробки пробирку с питательной средой держат в наклонном положении во избежание попадания в нее посторонних микроорганизмов из воздуха. Петлю с находящимся на ней пересеваемым материалом вводят в пробирку до дна, опускают плашмя на поверхность питательной среды и скользящими движениями наносят штрих снизу вверх, от одной стенки пробирки к другой (рис.).
3. При посеве на поверхность плотной питательной среды в чашки Петри чашку держат в левой руке. Дно ее с одной стороны придерживают 1 и II пальцами, а с другой —IV и V пальцами. Крышку, приоткрытую настолько, чтобы в образовавшуюся щель свободно проходили петля или шпатель, фиксируют 1 и III или 1 и II пальцами (рис.). Небольшое количество исследуемого материала втирают бактериальной петлей в поверхность питательной среды у края чашки. Затем петлю прожигают, чтобы уничтожить избыток находящегося на ней материала. Линию посева начинают с того места, в котором находится материал. Бактериальную петлю кладут плашмя на питательную среду, чтобы не поцарапать ее поверхности, и проводят штрихи по всей среде или по секторам, разграфив предварительно дно чашки (при условии, что среда прозрачна) на несколько равных частей. Нужно стараться, чтобы штрихи, наносимые петлей, располагались как можно ближе друг к другу, так как это удлиняет общую линию посева и дает возможность Для равномерного распределения засеваемого материала по поверхности плотной питательной среды можно пользоваться вместо петли тампоном или шпателем. При обилии в засеваемом материале микробов они растут в виде пленки, покрывающей всю поверхность питательной среды. Такой характер микробного роста получил название сплошного, или газонного. Посев газоном производят, когда нужно получить большие количества микробной культуры одного вида. 4. Из материала, подлежащего посеву в толщу плотной питательной среды, готовят взвесь в стерильной водопроводной воде или в изотоническом растворе. Набирают 0,1—1 мл взвеси в пипетку (в зависимости от степени предполагаемого микробного загрязнения) и выливают в пустую стерильную чашку Петри. Вслед за этим чашку заливают 15 - 20 мл мясопептонного агара, расплавленного и остуженного до температуры 40 - 45 °С (при такой температуре пробирка со средой, приложенная к щеке, не должна вызывать ощущения ожога). Для равномерного распределения исследуемого материала в питательной среде закрытую чашку с содержимым слегка вращают по поверхности стола. 5. Посев уколом в столбик питательной среды производят в пробирку со средой, застывшей в виде столбика. Пробирку берут в левую руку, как обычно, и в центре столбика до дна пробирки вкалывают петлю с находящимся на ней материалом.
БИОЛОГИЯ Том 2 - руководство по общей биологии - 2004
Среда — это твердая или жидкая субстанция, содержащая питательные вещества для культивирования (роста) микроорганизмов, а также клеток животных или тканей растений. Культурой называют совокупность микробных клеток, растущих на среде (или в среде).
12.2.1. Твердые и жидкие среды
Микроорганизмы можно выращивать на твердой среде или в жидкой среде (бульоне).
Твердые среды очень удобны для выращивания бактерий и грибов; их готовят путем смешивания жидкого питательного раствора с гелеобразующим компонентом (обычно агаром) в концентрации 1—2%; при этом получается питательный агар. Агар представляет собой экстракт из красных водорослей. В концентрации 1—2% агар плавится при 90—100 °С и застывает примерно при 44 °С. Агар можно предварительно простерилизовать нагреванием (разд. 12.2.4) и затем остудить. Микроорганизмы рассевают по поверхности агара после его застывания, либо, если они выдерживают температуру около 44 °С, добавляют к агару непосредственно перед застыванием; тогда они равномерно распределяются по всей среде. Агар прозрачен и, будучи сложным полисахаридом, устойчив к разрушению микроорганизмами; это относится к его преимуществам. Примеры использования твердых и жидких сред будут приведены в последующих разделах. На твердых средах иногда выращивают и культуры тканей растений (гл. 22).
Жидкие среды часто используют для изучения роста популяции (разд. 12.5). Клетки помещают в пробирку, закрытую ватной пробкой или металлической крышкой, или в стеклянный флакон с завинчивающейся крышкой, такой как универсальный сосуд Маккартни (рис. 12.2), в который помещается около 25 см 3 среды — как раз для заливки одной чашки. Перед тем, как среда будет использована для выращивания культуры клеток, она должна быть простерилизована. Добавление небольшого количества клеток к среде называется посевом (или инокуляцией). После инокуляции среду оставляют в термостате при оптимальной для роста данного микроорганизма температуре. Растущие клетки распределяются в среде случайным образом.
При использовании больших объемов среды культуру перемешивают, чтобы предотвратить оседание клеток. Для этой цели приметают механические встряхиватели или магнитные мешалки. Кроме того, пропускают стерильный воздух через среду, чтобы обеспечить поддержание оптимальной концентрации кислорода по всей среде. Для фильтрации воздуха и его стерилизации используют имеющиеся в продаже фильтры либо фильтры из стеклянной или неабсорбирующей хлопковой ваты. Воздух поступает через распылитель — устройство с множеством маленьких отверстий, позволяющее получать идеальные пузырьки. Его крепят на конце трубки, идущей ко дну сосуда с культурой. Жидкие культуры можно выращивать в виде периодических культур или непрерывных культур (разд. 12.10).
Биологическая библиотека - материалы для студентов, учителей, учеников и их родителей.
Наш сайт не претендует на авторство размещенных материалов. Мы только конвертируем в удобный формат материалы, которые находятся в открытом доступе и присланные нашими посетителями.
Если вы являетесь обладателем авторского права на любой размещенный у нас материал и намерены удалить его или получить ссылки на место коммерческого размещения материалов, обратитесь для согласования к администратору сайта.
Разрешается копировать материалы с обязательной гипертекстовой ссылкой на сайт, будьте благодарными мы затратили много усилий чтобы привести информацию в удобный вид.
Культуральные среды. Твердые и жидкие среды.
Необходимые для роста питательные вещества.
Для роста, поддержания жизнедеятельности и размножения требуются самые разные вещества. Кроме того, нужен источник энергии. Для выращивания микроорганизмов используют так называемую питательную среду, обогащенную питательными веществами. Любая питательная среда должна содержать:
1. Источник углерода для роста. Большинство бактерий, все грибы и простейшие являются гетеротрофами, т. е. они нуждаются в органическом источнике углерода. Обычно таким источником являются глюкоза или соль органической кислоты, например ацетат натрия. Однако в целом бактерии могут использовать в качестве источника углерода широкий спектр органических веществ, включая жирные кислоты, спирты, белки, углеводы и метан. Некоторые почвенные бактерии и грибы, а также ряд бактерий, живущих в кишечнике травоядных (например, жвачных) животных, могут усваивать целлюлозу и используют ее в качестве источника углерода. Все болезнетворные бактерии являются гетеротрофами.
Водоросли и некоторые бактерии, например цианобактерии (сине-зеленые водоросли), являются автотрофами, т. е. источником углерода для них является диоксид углерода. Водоросли относятся к фотосинтезирующим организмам, тогда как среди бактерий встречаются как фотосинтезирующие, так и хемосинтезирующие.
2. Источник азота может быть органического происхождения, к примеру аминокислоты, пептиды и белки, или неорганического, например соли аммония или нитраты. Аминокислоты обычно добавляют в виде растворов частично переваренных белков, так называемых пептонов.
Относительно простая среда, используемая для роста бактерии Escherichia coli, которая обычно обитает в кишечнике человека
3. Факторы роста, или витамины, иногда необходимы для выращивания микроорганизмов. Факторы роста равнозначны витаминам, которые необходимы животным, и многие из них действительно являются витаминами. Это органические вещества, которые важны для роста и требуются в очень небольших количествах. К ним относятся некоторые витамины группы В (тиамин, или В1; рибофлавин, или В2; ниацин, или Вз и Вб), а также фолиевая кислота и парааминобензойная кислота. Для нормального роста требуются лишь следовые количества витаминов. Кроме того, могут потребоваться и другие органические вещества, такие как пурины и пиримидины.
Микроорганизмы различаются по способности к синтезу собственных факторов роста из более простых субстратов. Если микроорганизмы достаточно требовательны к условиям роста, то среды для их выращивания в лаборатории готовят на основе природных субстратов, на которых эти микроорганизмы обычно растут (к числу таких субстратов относятся кровь, почва, мясной или дрожжевой экстракты).
4. Минеральные соли. Чаше всего для роста требуются положительно заряженные ионы кальция, калия, натрия, железа и магния, а также отрицательно заряженные хлорид-, фосфат- (источник фосфора) и сульфат-ионы (источник серы). Как отмечалось выше, азот вносят в виде аммония или нитрата. Потребности для роста водорослей примерно такие же, как и для роста растений.
5. Источник энергии. Энергетические потребности живых клеток обсуждались в начале одной из статей. Энергия может поставляться в форме химической энергии или энергии света. Организм, потребляющий химическую энергию, называется хемотрофным; организм, использующий энергию света, называется фототрофным, или фотосинте-зирующим (табл. 2.3). К фотосинтезирую-щим микроорганизмам относятся водоросли и некоторые бактерии, например цианобактерии. Если необходима химическая энергия, то она обычно постаатяется в виде сахара, например глюкозы.
6. Вода. Несмотря на то, что она не является в прямом смысле питательным веществом, вода необходима всем живым клеткам. Обычно бактериям нужно больше влаги, чем дрожжам, а дрожжам — больше, чем плесневым грибам.
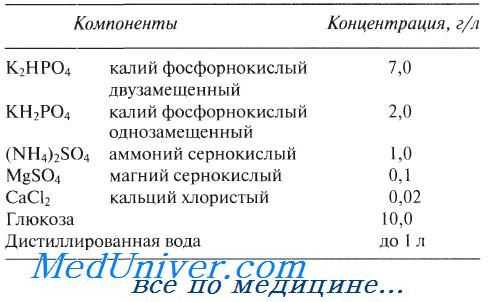
Пример относительно простой питательной (культуральной) среды приведен в таблице
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Кроме состава питательных сред, на которых развиваются бактерии, большое значение име ют условия культивирования и, прежде всего, температура, аэрация и концентрация водородных ионов в среде.
Культуральные среды для роста бактерий
Культуральные среды обычно компонуют, предварительно зная, рост каких именно физиологических групп микроорганизмов хотят обеспечить. Вначале целесообразно составить минеральную основу, содержащую все необходимые питательные вещества в неорганической форме. Затем в эту основу вводят источники углерода, энергии, азота и необходимые ростовые факторы.
В количественном отношении придерживаются простого правила: соотношение важнейших элементов, вводимых в воду, должно быть примерно таким же, как в бактериальной клетке (например, среднее соотношение углерод:азот:фосфор:сера:калий:кальций:магний:железо = 5:1:0,3:0,1:0,1:0,05:0,05:0,02. В граммах эти величины дают примерное содержание элементов на 1 л среды).
• Для культивирования некоторых бактерий применяют простые синтетические среды, то есть среды, содержащие только определённые химические соединения: источник углерода (например, глюкозу), аммонийный азот, а также фосфаты, хлориды и сульфаты, в то время как другим необходима комплексная, или сложная среда, дополненная различными веществами, химический состав которых полностью не определён (например, среда с экстрактами тканей сердца и мозга).

• По консистенции микробиологические среды разделяют на жидкие (бульон) и твердые (плотные), содержащие около 2% «уплотнителя» — агара (полисахарида, получаемого из морских водорослей). В некоторых случаях в качестве «уплотнителя» можно использовать желатину. Среды с небольшим содержанием агара (0,6%) обозначают как полужидкие.
Для промышленного выращивания и автоматизированной диагностики предпочтительна жидкая среда. Выращивание на агаризованных средах необходимо для выделения и дальнейшей оценки отдельных колоний бактерий.
• Элективные среды применяют для выделения определённых типов бактерий. Многие микроорганизмы легко обнаруживаются, так как вызывают заметные изменения в окружающей среде. Выделение этих микроорганизмов в чистой культуре (клоне) не представляет особые трудностей. Однако есть много других микроорганизмов, относящихся к разным физиологическим группам, выделение которых стало доступным лишь после разработки С.Н. Виноградским и М. Бейеринком метода накопительных культур, который подразумевает создание условий (источники энергии, углерода и азота, акцептор электронов, свет, температура, pH и т.п.), обеспечивающих преимущественный рост одного микроорганизма в сравнении с остальными.
В подобной элективной (селективной) среде наиболее приспособленные бактерии бурно растут, вытесняя контаминирующую микрофлору. Многократный пересев на предпочтительную для данного вида жидкую среду обеспечивает «обогащение» исходной пробы, часто контаминированной другими микроорганизмами. Последующий высев на плотную среда позволяет выделить необходимый штамм. Например, для выделения патогенных энтеробактерий используют элективные плотные среды, к которым добавляют соли висмута, а для обнаружения возбудителя дифтерии — среды с теллуритом. Выросшие на этих средах колонии патогенов, обладающих способностью восстанавливать ионы редких металлов, имеют металлический блеск.
• Некоторые бактерии практически не способны к росту in vitro (например, Mycobacterium leprae, хламидии), что считается проявлением крайней степени паразитизма и связано с утратой ряда важнейших ферментов, необходимых для самостоятельного роста и развития.
Среда — это твердая или жидкая субстанция, содержащая питательные вещества для культивирования (роста) микроорганизмов, а также клеток животных или тканей растений. Культурой называют совокупность микробных клеток, растущих на среде (или в среде).
Твердые и жидкие среды
Микроорганизмы можно выращивать на твердой среде или в жидкой среде (бульоне).
Твердые среды
Твердые среды очень удобны для выращивания бактерий и грибов; их готовят путем смешивания жидкого питательного раствора с гелеобразующим компонентом (обычно агаром) в концентрации 1—2%; при этом получается питательный агар. Агар представляет собой экстракт из красных водорослей. В концентрации 1—2% агар плавится при 90—100 °С и застывает примерно при 44 °С. Агар можно предварительно простерилизовать нагреванием и затем остудить. Микроорганизмы рассевают по поверхности агара после его застывания, либо, если они выдерживают температуру около 44 °С, добавляют к агару непосредственно перед застыванием; тогда они равномерно распределяются по всей среде. Агар прозрачен и, будучи сложным полисахаридом, устойчив к разрушению микроорганизмами; это относится к его преимуществам. Примеры использования твердых и жидких сред будут приведены в последующих разделах. На твердых средах иногда выращивают и культуры тканей растений.
Жидкие среды
Жидкие среды часто используют для изучения роста популяции. Клетки помещают в пробирку, закрытую ватной пробкой или металлической крышкой, или в стеклянный флакон с завинчивающейся крышкой, такой как универсальный сосуд Маккартни, в который помещается около 25 см3 среды — как раз для заливки одной чашки. Перед тем, как среда будет использована для выращивания культуры клеток, она должна быть простерилизована. Добавление небольшого количества клеток к среде называется посевом (или инокуляцией). После инокуляции среду оставляют в термостате при оптимальной для роста данного микроорганизма температуре. Растущие клетки распределяются в среде случайным образом.
При использовании больших объемов среды культуру перемешивают, чтобы предотвратить оседание клеток. Для этой цели применяют механические встряхиватели или магнитные мешалки. Кроме того, пропускают стерильный воздух через среду, чтобы обеспечить поддержание оптимальной концентрации кислорода по всей среде. Для фильтрации воздуха и его стерилизации используют имеющиеся в продаже фильтры либо фильтры из стеклянной или неабсорбирующей хлопковой ваты. Воздух поступает через распылитель — устройство с множеством маленьких отверстий, позволяющее получать идеальные пузырьки. Его крепят на конце трубки, идущей ко дну сосуда с культурой. Жидкие культуры можно выращивать в виде периодических культур или непрерывных культур.
Обогащенные и селективные среды
Обогащенная среда — это среда, компоненты которой составлены таким образом, чтобы максимально удовлетворить потребности определенных микроорганизмов; таким образом им обеспечивается предпочтительный рост по сравнению с другими. При внесении в среду смешанной культуры, которую чаще всего выделяют из «природы», обычно растет преимущественно один или несколько типов микроорганизмов. Используя подходящую среду, можно избирательно выращивать нужный микроорганизм. Изменяя условия, такие как температура, рН, источник углерода и источник энергии, можно подобрать такую их комбинацию, которая максимально подходит для данного организма. К примеру, бактерии рода Salmonella, являющиеся возбудителями тифа (Salmonella typhi), выделяют и идентифицируют, помещая образцы пищи или фекалий в сред>', содержащую селеновые производные (селен — элемент, по свойствам напоминающий серу). Обычные кишечные бактерии, например Е colt, которые тоже могут присутствовать в фекалиях, подавляются селеном. Обогащенная культура — один из наиболее мощных инструментов, используемых микробиологами для выделения микроорганизмов.
Селективная среда — это среда, в которую добавляются вещества, подавляющие рост всех организмов, за исключением одного или нескольких. Примером может служить добавление пенициллина к культуре с целью отбора устойчивых к нему организмов, или отбор гибридных клеток в процессе производства моноклональных антител.
Индикаторные среды
Индикаторные среды содержат индикатор, который позволяет визуально отличать одни организмы от других. К примеру, определенные бактерии разрушают («сбраживают») сахар лактозу до кислоты. В среде, получившей название агар Макконки, которая содержит рН-индикатор нейтральный красный и желчные соли, колонии, сбраживающие лактозу, будут выглядеть красными, а не сбраживающие лактозу — бесцветными или бледно-розовыми. Этот метод используют, например, для выявления загрязнения питьевой воды сточными водами. Сточные воды содержат кишечные бактерии, такие как Е. coli, которые сбраживают лактозу. Точно так же, если в образце кишечных бактерий присутствует Salmonella, то на агаре Макконки она будет образовывать бесцветные колонии.
Готовые среды
Сухие среды, содержащие агар и все необходимые компоненты, имеются в продаже. Обычно их выдерживают 15 мин в воде и затем, чтобы простерилизовать, автоклавируют в колбах или флаконах в течение 15 мин при 121 °С. В процессе автоклавирования среда перемешивается и растворяется. Внутри автоклава под давлением кипит вода. Автоклав закрывается крышкой с защитным клапаном, выпускающим пар, когда достигнуто необходимое давление. Чем выше давление, тем выше температура кипения воды. Так стерилизуют растворы и оборудование, например, стеклянную посуду. Чтобы убить всех бактерий и их устойчивые споры, обычно достаточно 15—20 мин инкубации при давлении 103 кПа (кН/м2). При таком давлении температура внутри автоклава достигает 121 °С.
Читайте также:
