Лангергансоклеточный гистиоцитоз: атлас фотографий
Добавил пользователь Alex Обновлено: 28.01.2026
Прогрессирующая оссифицирующая фибродисплазия: атлас фотографий
Прогрессирующая оссифицирующая фибродисплазия (синонимы: прогрессирующая костная гетероплазия, прогрессирующий оссифицирующией миозит, болезнь Мюнхмайера) — это редко аутосомно-доминантное наследственное заболевание, характеризующееся различными пороками развития первых пальцев стоп и прогрессирующей оссификацией крупных скелетных мышц, проводящей к значительной и прогрессирующей инвалидизации пациентов.
Частота заболевания составляет 1:2000000, болезнь распространена повсеместно независимо от расовой, этнической и географической принадлежности. Характерными скелетными изменениями является болезненный отек и фиброзирование мышц, проводящие к их оссификации. Дебют заболевания приходится на возраст от 0 до 15 лет.
Эффективных методов лечения не существует; к возрасту 30 лет пациенты уже обычно прикованы к инвалидному креслу в связи с выраженными контрактурами мягких тканей и ограничением подвижности суставов.
Внешний вид (а) и рентгенограмма (6) стоп 15-летней девушки с типичным укорочением первых лучей, вальгусо-подобной деформацией передних отделов стоп и отсутствием фаланг первых пальцев. Внешний вид (а) и рентгенограмма (б) кистей этой же пациентки: укорочение первых пальцев кистей. Этот порок развития наблюдается непостоянно. Заболевание начинается с оссификации верхних паравертебральных мышц шеи, которые видны при рентгенографии в виде отдельной линии (а, стрелка), в дальнейшем оссификация распространяется от центральной оси тела к периферии, от верхних отделов туловища в каудальном направлении, от проксимальных отделов конечностей к дистальным, также поражаются мышцы в области тазобедренного (б, стрелка) и других крупных суставов. Оссификаты развиваются в сухожилиях, связках, мышцах и соединительной ткани. В пораженной области фиброзированные мышцы постепенно замещаются костной тканью. МР-сканы этой же 15-летней девушки. Виден высокоинтенсивный сигнал, свидетельствующий о текущем патологическом процессе при прогрессирующем оссифицирующем миозите. На фронтальном скане груди (а) и аксиальном скане таза (б) визуализируется высокоинтенсивный сигнал в области межреберных мышц слева, а также наружной запирательной и подвздошно-поясничной мышц справа. В терминальной фазе заболевания наблюдается только оссификация и кальцинация мышц, отек тканей не характерен. Поэтому в терминальной фазе оссифицирующей дисплазии МРТ становится менее информативным исследованием. Четырехлетний мальчик (а, архивное фото). Обратите внимание на изъязвление кожи, вызванное оссификаци-ей мышц спины. Рентгенограммы грудной клетки этого же пациента в боковой (б) и прямой проекциях (в) свидетельствуют о тяжелой деформирующей оссификации мышц живота и спины. Рентгенограмма таза и деформированных тазобедренных суставов этого же пациента в возрасте 25 лет (г). Тот же пациент в возрасте 46 лет (архивное фото).
Лангергансоклеточный гистиоцитоз: атлас фотографий
а) Терминология:
1. Аббревиатура:
• Лангергансоклеточный гистиоцитоз (ЛКГ)
2. Синонимы:
• Гистиоцитоз X, идиопатический гистиоцитоз, лангергансоклеточ-ная болезнь, лангерансоклеточный гранулематоз, лангергансо-клеточная гранулема, эозинофильная гранулема (ЭГ)
3. Определение:
• Группа заболеваний ретикулоэндотелиальной системы, характеризующихся пролиферацией клеток Лангерганса
б) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Хорошо отграниченное («выштампованное») просветление без кортикальной пластинки по краю
о При поражении альвеолярного отростка зубы могут выглядеть «парящими в воздухе»
• Локализация:
о Поражения костей черепа, бедренной кости, челюстей, ребер, длинных костей, позвонков, таза
о 50% поражений костей наблюдаются в костях черепа
о Челюстно-лицевая область: поражение челюстей > мягких тканей (2:1):
- Поражение челюстей наблюдается в 10-20% всех случаев
- Нижняя > верхняя челюсть:
Задние > передние отделы, преимущественно тело и ветвь нижней челюсти
• Размер:
о Мелкие («выштампованные»)-крупные очаги неправильной формы
• Морфология:
о Округлые или овальные очаги в дебюте заболевания
о Возможно увеличение размеров и сливание очагов по мере прогрессирования
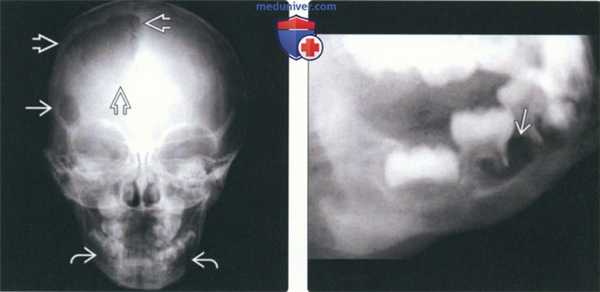
(Слева) На рентгенограмме черепа в прямой проекции визуализируются два очага ЛКГ в лобной кости: меньший (округлый с ровными контурами) и больший (неправильной формы). Для описания подобных поражений используется термин «географический череп». Очаги также определяются в нижней челюсти.
(Справа) На рентгенограмме в косой боковой проекции у этого же пациента определяется «выскобленный» очаг вокруг мезиального корня формирующегося 1-го моляра. Пациент страдает хроническим диссеминированным ЛКГ, клинически проявляющимся экзофтальмом.
2. Рентгенография при лангергансоклеточном гистиоцитозе челюсти:
• Интра- и экстраоральная рентгенография:
о Утрата костной ткани вокруг зуба на всем протяжении
о Может имитировать заболевание периодонта: следующие признаки могут помочь в дифференциальной диагностике:
- Заболевание периодонта начинается с альвеолярного гребня; очаги ЛКГ обычно центрированы возле средней трети корня
- В отличие от заболеваний периодонта кость может выглядеть «выскобленной»
о Зубы могут выглядеть «парящими»
о На панорамных изображениях могут обнаруживаться периостальные наслоения вдоль кортикальной пластинки
• Краниография:
о Позволяет обнаружить поражения черепа:
- «Выштампованные», относительно хорошо отграниченные
- Очаги могут иметь неправильную форму и больший размер, иногда создавая картину «географического черепа»
3. КТ при лангергансоклеточном гистиоцитозе челюсти:
• КТ в костном окне и КЛКТ:
о Оценка размеров остеолитических очагов в верхней и нижней челюсти
о На КЛКТ также могут обнаруживаться поражения черепа (в зависимости от поля зрения)
о Позволяют лучше идентифицировать периостальную реакцию
4. МРТ при лангергансоклеточном гистиоцитозе челюсти:
• Т1 ВИ:
о Изоинтенсивный мышцам сигнал, умеренное контрастирование
• Т2 ВИ:
о Гиперинтенсивный сигнал
4. Сцинтиграфия:
• Активное накопление Тс-99m в очагах помогает в оценке распространенности заболевания
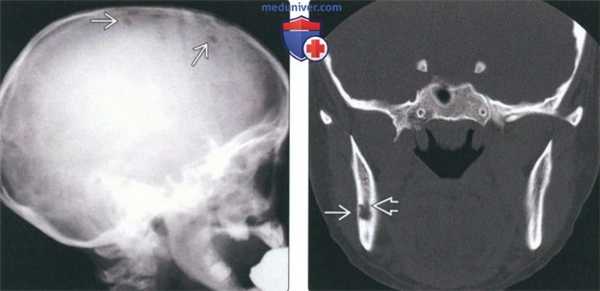
(Слева) На краниограмме в боковой проекции у ребенка с хроническим диссеминированным ЛКГ визуализируются типичные мелкие «выштампованные» просветления.
(Справа) На корональной КТ в костном окне у женщины 28 лет в ветви нижней челюсти справа визуализируются мелкие эозинофильные гранулемы с четкими контурами. Обратите внимание на истончение (но не перфорацию) щечной кортикальной пластинки. Патологический очаг, лежащий под нижнечелюстным каналом, распространяется в сторону щечной кортикальной пластинки.
в) Дифференциальная диагностика лангергансоклеточного гистиоцитоза челюсти:
1. Локальный агрессивный периодонтит:
• Локальное агрессивное заболевание периодонта:
о С преимущественным поражением первых моляров и резцов
о Дугообразные просветления вследствие утраты костной ткани в межзубных пространствах
• Пациенты моложе (подростки)
2. Плоскоклеточный рак:
• Солитарное плохо отграниченное просветление:
о Множественные поражения позволяют исключить этот диагноз
• Расшатывание зубов из-за деструкции костной ткани возле корней зубов
• Может обнаруживаться сопутствующая мягкотканная опухоль
• Возрастная группа обычно старше
3. Остеомиелит:
• Плохо отграниченный рентгенонегативный или смешанный очаг
• Часто можно обнаружить источник инфекции
• Ключевой признак-секвестрация
• Может наблюдаться периостальная реакция
4. Метастазы:
• Плохо отграниченные просветления
• Могут расти в пространстве перидонтальной связки
• Первичная опухоль обычно известна
5. Лимфома:
• Плохо отграниченное просветление
• Растет преимущественно в пространстве периодонтальной связки
• Может разрушать фолликул формирующегося зуба
• При наличии эозинофилов в небольшом количестве лимфома гистологически может напоминать ЭГ
6. Лейкоз:
• Мультифокальные просветления
• Расширение пространства периодонтальной связки
• Лихорадка, недомогание
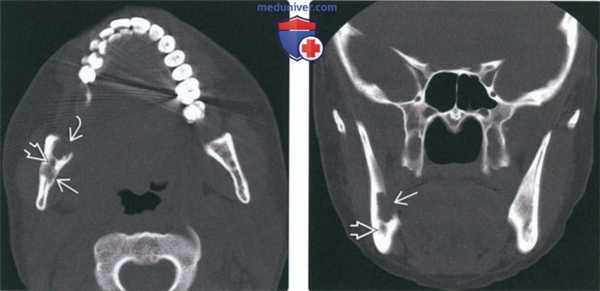
(Слева) На аксиальной КТ в костном окне у этой же пациентки визуализируется очаг в ветви и отдельно лежащий очаг спереди от него, хуже отграниченный и с более выраженной деструкцией. Между очагами визуализируется нижнечелюстной канал.
(Справа) На корональной КТ в костном окне у этой же пациентки определяется деструкция язычной кортикальной пластинки, обусловленная очагом большего размера. Обратите внимание на нижнечелюстной канал внизу. В этом случае имеет место моно-стотическая эозинофильная гранулема с изолированным поражением ветви справа: прогноз благоприятный.
г) Патология:
1. Стадирование, градации, классификация:
• Острый диссеминированный (болезнь Леттерера-Сиве): полиорганное поражение:
о Гепатомегалия, спленомегалия, кровоизлияния, анемия, лимфаденопатия, поражение тимуса и костного мозга, высыпания на коже
о Скорее всего, представляет злокачественный неопластический процесс
о 10% всех случаев ЛКГ
• Хронический диссеминированный (болезнь Хэнда-Шюллера-Крисчена):
о Триада: множественные поражения костей, несахарный диабет, экзофтальм о 20% всех случаев ЛКГ
• Хронический локализованный (эозинофильная гранулема): моностотическое или полиостотическое поражение костей без вовлечения внутренних органов:
о При полиостотической форме обычно поражаются 2-4 кости
о Эозинфильная гранулема составляет 60-70% всех случаев ЛКГ
2. Микроскопия:
• Скопления эозинофилов между клетками, напоминающими гистиоциты
• Иногда обнаруживаются плазматические клетки, лимфоциты, многоядерные гигантские клетки
• Для установления диагноза необходимо обнаружение клеток Лангерганса:
о Клетки Лангерганса: дендритные одноядерные клетки, обнаруживаемые преимущественно в эпидермисе и костном мозге:
- Представляют антигены Т-лимфоцитам
- Содержат гранулы Бирбека в цитоплазме:
Что отличает клетки Лангерганса от других одноядерных фагоцитов
- Иммуногистохимия: CD1 выраженная (+) реакция; S100 (+)
д) Клинические особенности:
1. Проявления:
• Типичные признаки/симптомы:
о Подвижность зубов:
- Отсутствие заживления дефектов после утраты зубов
о Интраоральная опухоль/отек
о Боль
• Другие признаки/симптомы:
о Гингивит/кровоточивость
о Язвы
о Нарушение заживления
о Галитоз
2. Демография:
• Возраст:
о Острый диссеминированный: дети < 3 лет
о Хронический диссеминированный: 1-е десятилетие
о Локализованный (эозинофильная гранулема): дети старшего возраста → взрослые
• Пол:
о М=Ж; согласно некоторым данным, М>Ж при локализованной форме (2:1)
• Эпидемиология:
о 2-5 случаев на миллион
о 50% < 15 лет
3. Течение и прогноз:
• Общий прогноз зависит от возраста дебюта заболевания и степени органной дисфункции
• Локализованная форма: благоприятный:
о Сообщается о спонтанной ремиссии эозинофильной гранулемы после биопсии
о А также о регенерации костной ткани в патологическом очаге и неправильном сращении после патологического перелома у взрослых в отсутствие оперативного вмешательства
• Хронический диссеминированный тип: достаточно благоприятный:
о Возможно прогрессирование с развитием летального диссеминированного заболевания (10%)
• Острый диссеминированный: неблагоприятный:
о В младенчестве всегда приводит к гибели
о Прогноз слегка улучшается в возрасте старше двух лет
4. Лечение:
• Эозинофильная гранулема: локализованные поражения нижней/верхней челюсти:
о Хирургическое (выскабливание)
о Низкодозовая лучевая терапия ± химиотерапия в случае поражений, недоступных для оперативного лечения:
- С целью достижения ремиссии у пациентов младшего возраста
- Лучевая нагрузка обычно о Уровень рецидивов: 1,6-25%
о После комбинированного лечения (операция+лучевая терапия) частота рецидивов ниже по сравнению с оперативным вмешательством
о При некоторых поражениях с успехом применяются кортикостероиды, вводимые в патологический очаг
• Хронический диссеминированный тип:
о Химиотерапия: винбластина сульфат, винкристин, этопозид ± кортикостероид (преднизон):
- Преднизон считается препаратом, снижающим частоту рецидивов
• Острый диссеминированный: полихимиотерапия
е) Диагностическая памятка. Следует учесть:
• Хотя очаги множественной миеломы (ММ) описываются аналогично (как «выштампованные»), пациенты с ММ намного старше
Гистиоцитоз Лангерганса – симптомы, диагностика, лечение

Выпускник медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 01.04.2022
- Reading time: 5 минут чтения
Гистиоцитоз клеток Лангерганса — гетерогенная группа заболеваний, характеризующаяся чрезмерным ростом гистиоцитов — клеток, принадлежащих иммунной системе.
В странах Европы ежегодно диагностируются сотни новых случаев гистиоцитоза. Патология классифицируется как онкологическое заболевание. В его основе лежит клональная пролиферация гистиоцитов (клеток Лангерганса). Причина заболевания не известна, клиническая картина часто не характерна, поэтому лечение затруднено.
Гистиоцитоз – что это?
Гистиоцитоз клеток Лангерганса (LCH) — редкое заболевание неясной этиологии, при котором наблюдается чрезмерная пролиферация и аномальная дифференцировка клеток Лангерганса. Клетки Лангерганса — защитные клетки кожи, иммуногистохимически и морфологически напоминающие дендритные клетки. Они несут совместную ответственность за правильное функционирование иммунной системы. Физиологически клетки Лангерганса находятся в небольшом количестве в коже и внутренних органах.
Предполагается, что неконтролируемый рост клеток Лангерганса возникает в результате аномального иммунного ответа организма или после воздействия пока еще неизвестных стимуляторов.
В ходе заболевания наблюдаются узловые поражения различных размеров, разрушающие посредством инфильтрации структуры тканей и органов. У взрослых чаще всего поражаются кости, легкие, кожа и гипофиз. У детей гистиоцитоз дополнительно затрагивает лимфопоэтические органы (лимфоузлы, селезенку), нервную и пищеварительную системы.
Заболевание может протекать в любом возрасте, но 75% случаев гистиоцитоза диагностируются до 10 лет. Мужчины болеют в 4 раза чаще, чем женщины.
Классификация гистиоцитоза
Современная классификация делит нарушения из спектра гистиоцитоза на 5 групп. Гистиоцитоз клеток Лангерганса (LCH) относится к группе L вместе с болезнью Эрдхейма-Честера (ECD), неопределенным клеточным гистиоцитозом (ICH), внекожной ювенильной ксантогранулемой (extra-cutaneus JXG), а также смешанными формами LCH и ECD.
Из-за клональной природы гиперплазии очаги классифицируются как раковые заболевания, хотя иногда клиническое течение предполагает иной патогенетический механизм.
Гистиоцитоз может затрагивать любой орган или систему. По этому признаку патологию квалифицируют следующим образом:
- Односистемный гистиоцитоз (SS-LCH – односистемный LCH). С одно- или мультифокальным вовлечением одного органа или системы: костей (один или несколько очагов в одной кости и множественных очагов в нескольких костях), кожи, центральной нервной системы (гипоталамуса, гипофиза), легких, других органов, например, щитовидной железы, кишечника.
- Мультисистемныйгистиоцитоз (MS-LCH – мультисистемный LCH). Заболевание поражает более одного органа или системы.
Легкие могут быть вовлечены в обе формы заболевания: изолированную или мультисистемную.
Симптомы гистиоцитоза
Наблюдаемые симптомы заболевания — результат накопления аномальных клеток в тканях и органах и продолжающегося воспалительного процесса. Клиническая картина зависит от возраста больного, локализации и степени поражения органов. Треть случаев течение гистиоцитоза протекает бессимптомно.
К общим симптомам относятся:
Изменения костей в виде костных дефектов чаще всего отмечаются в черепе, лопатках, ребрах, позвонках и бедренных костях. У некоторых больных над дефектом образуется болезненное возвышение мягких тканей, а изменения в орбитальной области могут быть причиной экзофтальма — смещения глазных яблок вперед.
Поражения кожи чаще всего выглядят как темно-коричневые твердые узелки с тенденцией к самопроизвольному стиханию. Изменения в полости рта: подвижность зубов, гипертрофия и болезненность десен, язвы на губах, языке, щеках.
У взрослых изменения в легких часто изолированы. Часто больных беспокоят:
При физикальном осмотре дыхательной системы могут присутствовать особенности пневмоторакса (скопление воздуха в плевральной полости), глушение альвеолярного шума.
Изменения в центральной нервной системе становятся причиной когнитивных и поведенческих расстройств. Могут присутствовать различные очаговые симптомы. Вовлечение гипофиза провоцирует гормональные нарушения, несахарный диабет (с поражением задней доли гипофиза). Иногда наблюдается увеличение шейных лимфатических узлов.
Таблица 1. Частота встречаемости симптомов у больных с гистиоцитозом
| Симптомы | Процент больных |
| Вовлечение костной системы | 77-80% |
| Кожные поражения | 25-39% |
| Лимфаденопатия | у 19% детей (чаще при сосуществовании изменений в костной системе) |
| Поражение слизистой оболочки | 13% |
| Инфильтраты в пределах центральной нервной системы | 6% |
| Инфильтраты в пищеварительной системе | 13% |
Это заболевание иногда может навсегда повредить ткани и органы, что приводит к их аномальной функции, сохраняющейся после окончания лечения (гормональные дефициты, легочный фиброз, нейродегенеративный синдром). Отсутствие лечения на достаточно ранней стадии заболевания значительно повышает вероятность возникновения опасных нарушений в рамках естественного течения болезни.
Симптомы при поражении органов
Рассмотрим симптомы, характерные для отдельных органов и систем.
- Поражение костей. Чаще всего это литическое изменение кости с часто пальпируемой или даже видимой опухолью вокруг и над измененной костью и болью. Изменения в костях не всегда болезненны, поэтому могут обнаруживаться случайно. В случае вовлечения позвоночника может образоваться плоский позвонок. При поражении костей черепа часто наблюдаются изменения в ухе. Костные изменения в нижней челюсти приводят к потере зуба.
- Поражение уха. Рецидивирующий средний отит, нарушение слуха, фонетические расстройства, боль, головокружение.
- Поражение кожи. Папулезные и/или эритематозные поражения, местами желто-коричневые, местами шелушащиеся, иногда это небольшие комочки розового или кожного цвета, гнойнички и/или везикулы. Частая локализация поражений – волосистая кожа головы, заушная область, складки тела, вокруг ануса и на туловище, реже конечности.
- Поражение кроветворной системы. Показатели крови показывают дефицит железа, лейкоциты ниже 4,0×109 или тромбоциты ниже 100×109.
- Поражение дыхательной системы. Кашель, нарушения дыхания, спонтанный пневмоторакс, цианоз. Возможно и бессимптомное течение. Последствия поражения дыхательных путей: постоянное повреждение и дыхательная недостаточность.
- Вовлечение пищеварительной системы. Неспецифические желудочные симптомы — метеоризм, боль в животе, аномальный стул.
- Поражение печени. Увеличение печени. Симптомы дисфункции органов: гипербилирубинемия, гипоальбуминемия, коагулопатия или асцит. Поражение печени может сопровождаться вовлечением селезенки. Одно из наиболее тяжелых осложнений — склерозирующий холангит.
- Вовлечение центральной нервной системы. Несахарный диабет, образующийся в результате инфильтрации задней части гипофиза. Может опережать появление других клинических проявлений. Иногда обнаруживается после окончания терапии, что может свидетельствовать о прогрессировании заболевания. Гистиоцитоз — частый диагноз, сопровождающий несахарный диабет неясной этиологии.
- Инфильтрация внутри черепа. Связана с более высоким риском развития нейродегенеративных синдромов и воспалительных синдромов с неясным патогенезом, приводящих к постоянному повреждению ЦНС. Один из первых симптомов этих изменений — нарушения памяти, влияющие на успеваемость или эффективность работы.
Диагностика и лечение гистиоцитоза
Диагностика гистиоцитоза из клеток Лангерганса основывается на гистопатологическом исследовании, наличии характерных симптомов и визуализационных тестах. Поскольку гистиоцитоз редкое заболевание, проявляющееся широким спектром клинических симптомов, постановка диагноза часто затягивается.
Перед началом лечения выполняются грейдинговые анализы (анализы крови и мочи, УЗИ, рентген, иногда КТ, МРТ, ПЭТ – решение о конкретном обследовании принимает онколог). Это дает возможность правильно оценить форму заболевания, что является основой для правильного подбора лечения. Слишком поверхностная или неполная диагностика приводит к неправильной оценке стадии патологии и соответственно влияет на прогноз и на качество жизни пациента после онкологического лечения.
Лабораторные анализы включают:
- анализ показателей периферической крови; и мочи (суточный анализ); ; .
Отклонения в результатах анализов зависят от локализации заболевания.
Визуальные тесты используются для оценки отдельных органов и систем, которые могут быть охвачены процессом заболевания.
- Рентгеновская или компьютерная томография легких. Выявляет изменения в дыхательной системе. Осмотр скелета позволяет визуализировать остеолитические очаги.
- УЗИ брюшной полости. Может показать поражение печени или селезенки.
- Магнитно-резонансная томография. Используется для диагностики структур головного мозга.
- ПЭТ-сканирование. Позитронно-эмиссионная томография — наиболее детальное обследование, способное выявлять очаги заболевания, не видимые при других визуальных тестах.
Рекомендуется проведение молекулярных тестов, определяющих возникновение характерных мутаций. Можно воздержаться от выполнения биопсии только при расположении очагов в центральной нервной системе, если нет возможности безопасно собрать материал, и при однозначных результатах томографических тестов.
У пациентов с симптомами LCH в гистиоцитах часто (66%) обнаруживается наличие мутаций в гене BRAF V600E. Вышеуказанная мутация обнаруживается и в аналогичном процентном соотношении у пациентов с болезнью Эрдхаима-Честера.
Подтверждает диагноз гистопатологическое исследование среза пораженной ткани, выявляющее наличие клеток Лангерганса, экспрессирующих поверхностные антигены CD1a, CD207 (лангерин) и нейропротеин S-100.
Лечение гистиоцитоза
Лечение односистемной кожной формы зависит от степени поражения. Назначается местное лечение, заключающееся в применении глюкокортикостероидов, мехлорэтамина или фототерапии. Поскольку возникают спонтанные ремиссии, отдельные очаги требуют только наблюдения.
Для больных с единичным костным очагом часто единственно лечение — биопсия очага поражения, иногда возникает необходимость в выскабливании очага и местном введении стероида или применении лучевой терапии.
Показания к системному лечению:
- односистемные мультифокальные и мультисистемные заболевания;
- изменения костей черепа и позвоночника (повышенный риск вовлечения центральной нервной системы);
- вовлечение органов высокого риска, т.е. костного мозга, селезенки, печени.
Для лечения часто используется винбластин (противоопухолевый препарат) в комбинации с преднизолоном, в некоторых случаях с 6-меркаптопурином. Курс лечения обычно длится 12 месяцев.
Если реакция на это лечение неудовлетворительна, наблюдается прогрессирование заболевания, используются другие цитостатики, например, цитарабин, кладрибин, винкристин, метотрексат или меркаптопурин.
При обнаружении мутации, на основе результата молекулярного теста, применяются таргетные методы лечения, значительно улучшающие прогноз в самых тяжелых случаях.
Гистиоцитоз – прогноз излечения
Прогноз при гистиоцитозе клеток Лангерганса у детей и взрослых может быть разным. Заболевание может исчезнуть спонтанно или перейти в диссеминированную форму, опасную для жизни.
В односистемной форме прогноз хороший, в случае мультисистемной формы он зависит от пораженных органов. Значительно ухудшает прогноз вовлечение центральной нервной системы, костного мозга, печени и селезенки.
Ученые разработали новый метод лечения неходжкинских лимфом – злокачественных опухолей лимфатической системы

- Запись опубликована: 26.04.2020
- Reading time: 1 минут чтения
Новая методика лечения была разработана в Университете округа Мэриленд Балтимор и опубликована в журнале «Cancer Cell». Ученые считают, что это открытие позволит разработать новые препараты для иммунотерапии рака.
Что такое неходжкинская лимфома
Неходжкинская лимфома (НХЛ) – группа раковых заболеваний, поражающих лимфатические узлы. Это рак лимфатической системы, вызванный злокачественным перерождением лимфоцитов – одного из типов белых кровяных телец.
При развитии такой онкопатологии лимфоциты выходят из-под контроля и создают опухоли в лимфатических узлах, селезенке или других тканях. Могут поражаться миндалины, тимус (вилочковая железа), лимфатическая система различных органов. По данным Американского онкологического общества, в 2020 году около 80000 человек заболеют лимфомами, а 20000 больных умрут от этого типа онкологии.
Белок мешает иммунитету разрушать раковые клетки
На сегодняшний день иммунотерапия является одним из наиболее перспективных методов лечения больных раком лимфатической системы. В отличие от радио- или химиотерапии, она направлена на «включение» собственного иммунитета пациента для атаки на злокачественную опухоль. Однако раковые клетки мутируют, становясь невидимыми для иммунной системы, и даже используют иммунную систему для своего роста.
Команда исследователей из Университета округа Мэриленд Балтимор определила, как именно злокачественным клеткам удается обмануть иммунитет. Ученые обнаружили, что раку в этом помогает мутироваший (измененный) белок катепсин S. Он разрезает белковые соединения на мелкие фрагменты, которые не могут бороться с лимфомой. Более того, катепсин S защищает опухоль от иммунной системы и помогает ей расти.
Выявление связи между раковыми клетками и катепсином S позволит создать вещества, которые будут блокировать его активность, не давая ему бороться с иммунитетом и «охранять» раковую опухоль. В результате клетки Т-клетки иммунной системы смогут уничтожить злокачественное новообразование.
В ходе исследования был разработан метод выявления мутирующего катепсина S, мешающего иммунной системе бороться с раком. Уже создан первый образец лекарства, угнетающего вредоносный мутировавший белок, но на лекарственное средство пока не получен патент. После завершения этого процесса начнутся клинические испытания, а затем при их успешности, врачи смогут использовать новое средство для иммунотерапии лимфом.
Саркоидоз — что это? Причины и механизм развития болезни Бенье-Бека-Шаумана

Врач ультразвуковой диагностики. Стаж 20+ лет. Принимает в Университетской клинике в Санкт-Петербурге. Стоимость приема 1300 руб.
- Запись опубликована: 15.06.2022
- Reading time: 4 минут чтения
Саркоидоз — это иммунное заболевание, возникающее в результате воспаления тканей. Патология может развиваться в любом органе, но обычно начинается в легких или лимфатических узлах. Процесс может затрагивать печень, кожу, сердце, нервную систему и почки. Характерная особенность саркоидоза — образование гранулем. В большинстве случаев эти изменения проходят спонтанно. Если этого не происходит, за счет воспаления образуется фиброз.
Вероятная причина саркоидоза — действие специфического фактора окружающей среды (фактора саркоидоза) на иммунную систему генетически предрасположенных людей, но этот фактор еще не обнаружен. Можно было только приблизительно оценить его свойства.
Что такое саркоидоз?
Саркоидоз – это воспалительное заболевание, характеризующееся образованием гранулем – скоплений воспалительных клеток – в одном или нескольких органах тела. Когда иммунитет слишком активен и образуется много гранулем, они нарушают структуру и мешают функциям органа. Неконтролируемое хроническое воспаление приводит к фиброзу, представляющему собой постоянное рубцевание ткани органа.
Специфика и тяжесть заболевания варьируются. Заболевание может развиваться внезапно и так же быстро исчезать. Иногда оно развивается постепенно, и симптомы рецидивируют на протяжении всей жизни. Трети больных требуется длительное лечение. Саркоидоз считается хроническим, если заболевание остается активным более 2-х лет.
Саркоидоз был впервые описан в 1877 году английским дерматологом Джонатаном Хатчинсоном, обнаружившим у больного многочисленные странные поражения кожи конечностей. Термин «саркоид» ввел чуть позже ученый Бек. Название болезни происходит от греческих слов сарк и оид., или «похожий на мясо». Этот термин относится к кожному саркоидозу, часто сопровождающемуся некрасивыми высыпаниями. Д. Хатчинсон также описал изменения в легких, лимфатических узлах, слюнных железах, костях, селезенке и слизистых оболочках.
Многоорганная природа этого заболевания, с особым упором на поражение легких и лимфатической системы, была хорошо раскрыта уч. Шауманом (1917), связавшего поражения кожи и органов в единое системное заболевание. Как и многие другие ученые, Шауман считал саркоидоз одной из форм туберкулеза. Термин «саркоидоз» был официально принят только в 1960-х годах, и болезнь стала называться болезнью Бенье-Бека-Шаумана (BBS).
Ещё одно важное открытие в этой области было сделано ученым С. Лефгреном в 1946 г. Он обнаружил, что на ранних стадиях саркоидоза может наблюдаться двустороннее увеличение лимфоузлов, узловатая эритема, повышение температуры тела и изменения в крупных суставах. Комплекс этих симптомов получил название синдрома Лефгрена.
Распространенность патологии
Саркоидоз — наиболее распространенное интерстициальное заболевание легких с ежегодной заболеваемостью в мире от 1 до 64 случаев на 100000 жителей. Максимальная заболеваемость наблюдается в странах Северной Европы и среди афроамериканцев в США, а самая низкая — в Сингапуре и Японии.
Статистика показывает, что патология затрагивает разные органы в зависимости от национальности или скорее места жительства: у людей с темной кожей часто наблюдается кожный саркаидоз, у японцев страдает сердце и нервная система.
В России саркоидоз также встречается даже в тяжелой форме. По статистике, от него умирает почти пол процента всех больных. Причины гибели — сердечно-лёгочная недостаточность, нейро- и кардиосаркоидоз.
Патология чаще всего возникает в возрасте от 20 до 40 лет. Более подвержены этому заболеванию женщины. Увеличивает риск возникновения патологии семейный анамнез.
Причины развития саркоидоза — теория и факты
Некоторые исследования показывают, что могут вызывать заболевание бактерии, вирусы или химические вещества. Такие триггеры, хотя обычно безвредны для большинства людей, могут раздражать иммунную систему людей с генетическим риском развития саркоидоза.
Существуют теории, что иммунный ответ на раздражитель может быть слишком активным или даже неуместным, что приводит к воспалению, образованию гранулемы, а в некоторых случаях рубцеванию или фиброзу. Появляется все больше доказательств того, что этот иммунный ответ на саркоидоз может также включать аутоиммунный ответ на «собственные» белки. Однако пока саркоидоз не считается преимущественно аутоиммунным заболеванием, как например, ревматоидный артрит или системная красная волчанка, хотя исследования и показывают, что некоторые иммунные реакции и генетические факторы у этих патологий схожи.
На самом деле, что именно вызывает саркоидоз, доподлинно неизвестно. Поэтому правильно говорить, что саркоидоз связан с действием саркоидного фактора окружающей среды на иммунную систему генетически предрасположенного человека. Сам фактор, запускающий иммунный ответ, пока не выявлен, поэтому его свойства можно оценить только приблизительно.
Саркоидозный фактор характеризуется плохими растворимостью и разлагаемостью внутриклеточными ферментами, кислотами, под воздействием высокой температуры, органических растворителей, нейтральных детергентов. Этот факт указывает, что речь идет о белке, способном выживать внутри макрофагов, вызывая хроническую стимуляцию.
Саркоидозный фактор характеризуется иммуногенностью, то есть способностью индуцировать олигоклональную пролиферацию CD + Т-клеток. Именно этот фактор является промотором (по крайней мере, в начальной фазе заболевания) воспаления с преобладанием Th1-лимфоцитов. Это приводит к увеличению активности цитокинов: IFN-γ, IL-2, TNF-α. Этот же фактор с участием Т-лимфоцитов, в основном CD+ стимулирует образование грануляционной ткани, состоящей из эпителиальных и гигантских клеток.
Предрасположенность к саркоидозу увеличивает наличие аллелей: HLA-DR3, HLAS-DR5, HLA-DR8, HLA-DR9, HLA-DR12, HLA-DR14, HLA-DR15, HLA-DR17, HLA-DPB1, HLA-DQB1. Известны также аллели, отвечающие за защиту: HLA-DR1, HLA-DR4.
Исследования связи молекул HLA с возникновением и течением саркоидоза показали, что в скандинавской популяции гаплотип HLA-DR17 связан с острой формой саркоидоза, а HLA-DR14 и HLA-DR15 — с хронической. Внелегочная форма у итальянского населения связана с гаплотипом HLA-B22.
Интересные факты дало и американское исследование ACCES с участием более 1400 человек. Ученые не нашли прямой связи между саркоидозом и инфекционными агентами: HHV-8, HCV, CMV, ретровирусом, вирусом Коксаки B и EBV. При этом они выяснили, что саркоидоз часто развивается у людей, подвергающихся воздействию пыли, газов и органических частиц.
В 1940-х годах было обнаружено, что сходные с саркоидозом симптомы дает хроническая гранулематозная болезнь (ХГБ), вызываемая воздействием металла бериллия. Для дифференциации этих заболеваний проводится тест на бласт-трансформацию лимфоцитов в присутствии соли бериллия.
К группам профессионального риска по ХГБ относятся: зубные техники, ювелиры, рабочие, занятые в процессах восстановления металлов и в оружейной промышленности. Саркоидоз чаще встречается у пожарных. Этиологический фактор — токсины, выделяющиеся при высоких температурах.
Группы риска
Наиболее высокие риски заболеть саркоидозом у следующих групп пациентов:
- Подвергшиеся инфекциям. Бактериальным, вызванным микобактериями, Propionibacterium acnes, возбудителем болезни Лайма. Вирусным — гепатиту С, герпесвирусу, вирусу Д. Каннингема.
- Находящиеся в загрязненной среде. Опасно воздействие микрочастиц металлов. Особенно часто саркоидоз связывают с бериллием, медью, алюминием, барием, лантаноидами, кобальтом, золотом, цирконием, титаном. Также опасна любая пыль, плесень, дым.
- Имеющие родственников с саркаидозом.
- Курящие. Саркоидоз у таких больных часто протекает в тяжелой форме.
Механизм образования гранулем при саркоидозе
Ранний саркоидоз характеризуется накоплением большого количества активированных макрофагов и CD4+ Т-клеток в легких. Так же образуются и внелегочные очаги с воспалительным и иммунным процессами. Лимфоциты Th1 продуцируют гамма-интерферон (IFN-γ), интерлейкин 2 (IL-2) и другие цитокины, запускающие воспаление.
Важную роль в воспалении при саркоидозе играют макрофаги — источник провоспалительных цитокинов TNF-α, IL-12, IL-17 и факторов роста. Это постоянная часть саркоидных гранулем, состоящих из эпителиальных клеток, окруженных неравномерным слоем Т- и В-лимфоцитов. CD4+-лимфоциты доминируют во всех участках, где образуются гранулемы. Соотношение лимфоцитов CD4+ к CD8+ может быть более 10.
По мере развития фибробласты они размножаются и производят коллаген, заменяющий всю опухоль. Иногда в узелке можно найти две микроскопические структуры: микроскопические астероидные тела внутри гигантских клеток и тела Шаумана – слоистые плотности, состоящие из кальция и белков. Эти структуры бесполезны в диагностике саркоидоза, так как они также присутствуют в гранулемах другого происхождения.
При саркоидозе иногда можно обнаружить центральный некроз, указывающий на воспалительный процесс. Серозный некроз, типичный для туберкулеза, при саркоидозе отсутствует. Воспаление происходит из-за перераспределения клеток из периферической крови в легкие и локальной пролиферации этих клеток.
Цитокины, ответственные за привлечение клеток к тканям: IL-8, IL-15, IL-16 и RANTES (хемотаксис лимфоцитов), синтезируемый Т-лимфоцитами. С другой стороны, IL-2 отвечает за пролиферацию клеток, действуя как местный фактор роста для Т-лимфоцитов, инфильтрирующих паренхиму легких и другие ткани, в которых происходит саркоидозная реакция.
В воспалительную саркоидную реакцию вовлечены четыре типа цитокинов:
- цитокины из лимфоцитов Th1: IFN-γ, IL-2, IL-12, IL-15, IL-18, IL-27;
- провоспалительные цитокины: TNF-α, IL-1, GM-CSF, IL-62;
- противовоспалительные цитокины: ИЛ-10, трансформирующий фактор роста β (TGF-β);
- профибротические цитокины: TGF-β, фактор роста тромбоцитов (PDGF), инсулиноподобный фактор роста 1 (IGF-1).
Наиболее важные клетки, определяющие развитие саркоидозного воспаления, — лимфоциты Th1. Процесс поражает многие органы и ткани, но в 90% случаев это легкие. Т-лимфоциты находятся в интерстициальной ткани и в воздушных пространствах.
Саркоидозные гранулемы образуются в ответ на постоянный антигенный раздражитель. Фазы формирования гранулем:
- Вовлечение Th1-лимфоцитов с фенотипом CD4+ в результате действия антигенпрезентирующих клеток;
- Секреция провоспалительных и профибротических цитокинов;
- Скопление иммунокомпетентных клеток в очагах воспаления, то есть в легких, лимфатических узлах, коже, печени, селезенке, слюнных железах, сердце, нервной системе, мышцах.
В первой фазе саркоидозного воспаления процесс обратим, потому что процессы фибриногенеза подавлены. Т-клетки устойчивы к апоптозу (запрограммированная гибель клеток) и накапливаются в тканях. Эта устойчивость — результат нарушения активности каспазы-3 и цистеинил протеазы, регулирующих внутриклеточный биохимический путь, ответственный за апоптоз.
У некоторых пациентов вырабатываются белки внеклеточного матрикса и вещества, активирующие фибробласты, что приводит к фиброзу. В воспаленном органе саркоидозные гранулемы остаются на разных стадиях развития, регрессии и фиброза. Вопрос, почему у некоторых больных воспаление развивается, а у других регрессирует, пока остается без ответа.
Механизмы фиброза — следствие нарушения баланса между металлопротеиназами MMP-8 и MMP-9 и тканевыми ингибиторами металлопротеиназ — TIMP-1, а также повышенной активности альвеолярных макрофагов, продуцирующих повышенное количество фибронектина и лиганда хемокина CC18 – CCL18, стимулирующего выработку фибробластов легочными фибробластами. В свою очередь, коллаген в результате положительной обратной связи стимулирует макрофаги к выработке CCL18.
Риск интерстициального фиброза подтверждается повышенным процентом эозинофилов и нейтрофилов, которые в результате окислительного стресса, протеолиза и высвобождения токсичных белков способствуют неблагоприятным изменениям в легких. Признаки фиброза встречаются примерно у четверти пациентов.
Читайте также:
