Лапаростомия. Показания к лапаростомии.
Добавил пользователь Евгений Кузнецов Обновлено: 27.01.2026
При необходимости устраняем выявленные патологические изменения со стороны органов брюшной полости (перфорации кишки, несостоятельности швов и т.д.). Обязательным этапом оперативного вмешательства является интестинальная интубация. Способ ее осуществления определяется конкретной хирургической ситуацией. Интестинальная интубация, по нашему мнению, выполняет функцию селективной детоксикации, дренирования и декомпрессии тонкой кишки, что способствует более раннему восстановлению моторики кишечника, а также позволяет осуществлять послеоперационную медикаментозную деконтаминацию тонкой кишки. Помимо этого, находящийся в просвете тонкой кишки зонд является своеобразной «шиной», препятствующей развитию ранней спаечной кишечной непроходимости. Дренирование брюшной полости не производим. После заключительного промывания брюшной полости (рис. 3.7) на кишечные петли укладываем перфорированную сетку «Prolene Mesh», размеры которой превышают размеры операционной раны на 5—6 см.
Сетку располагаем между кишечными петлями и передней брюшной стенкой таким образом, чтобы края сетки заходили на 5-6 см под переднюю брюшную стенку. Кроме «Prolene Mesh», можно использовать перфорированную поливи-нилспиртовую пленку «Виниплен», которая предназначена для укрытия донорских участков при пересадке кожи. Пленка «Виниплен» выпускается отечественными производителями, что в значительной степени снижает стоимость методики лапаростомии. По данным наших исследований, для отграничения кишечных петель необходимо использовать перфорированный материал. Механизм очищения брюшной полости при лапаростомии основан на спонтанном движении экссудата к лапаротомной ране за счет его вытеснения из брюшной полости. Для поглощения скапливающегося гнойного и токсичного экссудата операционную рану рыхло тампонируем салфетками, смоченными растворами антисептиков, либо мазями на полиэтиленоксидной основе, предназначенными для лечения гнойных ран. Кроме того, эти марлевые тампоны обеспечивают купирование гнойно-воспалительного процесса в ране передней брюшной стенки (рис. 3.8).
Для удержания салфеток в установленном месте на кожу операционной раны накладываем 3-4 кожных шва для сближения краев раны, которые завязываем на бантики. С целью продления поглощающих свойств тампонов операционную рану дополнительно укрываем несколькими слоями марлевых салфеток. Перевязки делаем 2—3 раза в сутки в зависимости от степени промокания повязки. Для этого развязываем кожные швы, удаляем все салфетки, оцениваем течение воспалительного процесса, укладываем новый перевязочный материал и завязываем кожные лигатуры на бантики. При необходимости после обезболивания наркотическими анальгетиками либо при наличии перидурального катетера можно провести аспирацию и отмывание скапливающегося экссудата из боковых каналов и других доступных отделов брюшной полости.
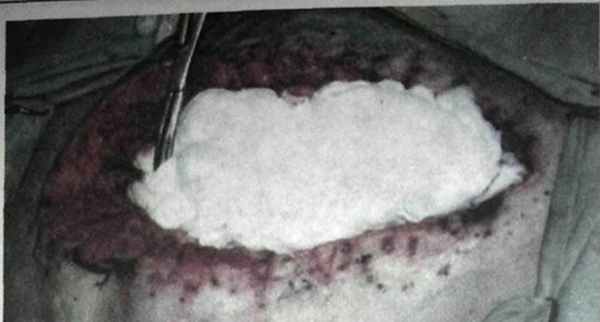
Рис. 3.8. Этап рыхлого тампонирования срединной раны марлевыми салфетками, пропитанными мазью «Левосин»
Лапаростомию в лечении послеоперационного распространенного перитонита использовали в следующих случаях (табл. 3.15).
Показания к лапаростомии
Показания к лапаростомии
Количество больных
абс.
Множественные перфорации тонкой кишки ± РГП*
4
20,0
Длительность гнойного перитонита более 2-3 суток
4
4
3
15,0
Крайне тяжелое состояние больного ± РГП
2
10,0
Флегмона передней брюшной стенки ± РГП
2
Угроза несостоятельности множественных швов кишечника ± РГП
1
5,0
гнойным экссудатом в отлогих местах брюшной полости. При этом у одного больного была выявлена несостоятельность швов культи червеобразного отростка. У 6 (30%) больных предпринимались дополнительные оперативные вмешательства в связи с развивающимися осложнениями. Характер операций представлен в табл. 3.16.
Закрытие лапаростомической раны производили при стихании воспалительного процесса в брюшной полости, уменьшении количества и бактериальной загрязненности экссудата, очищении брюшной полости от фибринозных наложений, уменьшении отека и воспалительных изменений кишечника и восстановлении его перистальтики, снижении проявлений эндогенной интоксикации в целом. Операция заключалась в бережной санации брюшной полости растворами антисептиков, преимущественно полости малого таза, боковых каналов и поддиафрагмальных пространств. В полость малого таза и боковые каналы устанавливали двухпросветные дренажи с множественными перфорациями. При возможности кишечные петли закрывали большим сальником. Накладывали узловые капроновые швы на апоневроз. На уровне подкожно-жировой клетчатки устанавливали сквозной перфорированный однопросветный дренаж для проточного промывания в послеоперационном периоде. Накладывали узловые швы на кожу, обеспечивающие ее герметичность.
Лапаростомия
Сущность метода открытого ведения брюшной полости при перитоните – лапаростомии – заключается в том, что после выполнения основных этапов оперативного вмешательства лапаротомная рана не ушивается, чтобы в послеоперационный период имелась возможность для систематической ревизии брюшной полости с оценкой её состояния и повторной санации. Окончательно закрывается брюшная полость и ушивается лапаротомная рана только после полного купирования перитонита.
Лапаростомию следует отнести к сложным методам дренирования брюшной полости, требующего не только высокой квалификации хирурга, анестезиолога и реаниматолога, но и высокого уровня организации работы всего лечебного учреждения.
Показания к лапаростомиям:
терминальной и токсической стадиях распространённого перитонита (фаза полиорганной недостаточности);
остром распространённом послеоперационном перитоните;
эвентрации в гнойную рану при распространённом перитоните;
Относительным показанием к лапаростомии можно назвать распространённый перитонит на фоне заболеваний, приводящий к снижению реактивных процессов в организме (анемия, сахарный диабет, раковая интоксикация и т.п.).
Программированная релапаротомия.
Суть метода состоит в том, что после одномоментной санации брюшной полости и её дренирования в отлогих местах трубками, отдельными швами ушивается только кожная рана. Через 24-48 часов кожные швы снимают и производят ревизию раны и повторную санацию брюшной полости. Число повторных санаций брюшной полости зависит от того, как быстро удаётся ликвидировать явления перитонита.
Показания к программируемым санационным релапаротомиям, оментобурсостомиям при абдоминальном сепсисе могут быть сформулированы следующим образом: 1. Распространенный гнойный, каловый перитонит, признаки анаэробного инфицирования. 2. Неустраненный на первой операции источник абдоминального сепсиса. 3. Сомнительная жизнеспособность участка кишечника. 4. Послеоперационный перитонит. 5. Гнойно-некротические формы панкреонекроза и панкреатогенного перитонита. 6. SAPS — 20-25 баллов. Программируемые санационные релапаротомии Преимущества:
полноценная санация брюшной полости;
своевременная диагностика и коррекция внутрибрюшных осложнений;
возможность активного дренирования брюшной полости;
отрицательные системные последствия повторных вмешательств (в том числе повторное развитие синдрома "медиаторной бури" и токсического шока);
повторная травма брюшной стенки и органов брюшной полости;
длительная интубация (ЖКТ, трахеи, мочевыводящих путей) с высоким риском развития нозокомиальной пневмонии и уроинфекции;
необходимость длительной катетеризации сосудов с высоким риском развития "катетерной инфекции" и ангиогенного сепсиса;
высокий риск внутрибрюшного кровотечения и образования кишечных свищей;
длительное пребывание в ОИТ и в стационаре.
Пути улучшения результатов программируемых санационных релапаротомий при АС у больных с перитонитом
Оптимизация показаний на основе оценки тяжести состояния больных и прогноза с помощью балльных систем (АРАСНЕ II, SAPS).
Оптимальный выбор лапаростомического устройства и интервала между повторными санациями.
Динамическая объективизированная оценка состояния органов брюшной полости и распространенности перитонита.
Сочетание оперативного лечения с рациональной антимикробной терапией (системной и селективной деконтаминацией ЖКТ).
Эффективная энтеральная и экстракорпоральная детоксикация.
Оптимизация транспорта кислорода и метаболическая поддержка.
2. ПРОФИЛАКТИКА И ЛЕЧЕНИЕ СИНДРОМА КИШЕЧНОЙ НЕДОСТАТОЧНОСТИ Синдром кишечной недостаточности при АС является не только важным компонентом, но и основным фактором патогенеза ПОН. Более того, нарушение барьерной функции ЖКТ при синдроме кишечной недостаточности создает условия для неконтролированной транслокации условно-патогенных микроорганизмов и их процессов и поддержания септического процесса даже при достаточно эффективной санации других очагов инфекции. Кишечная недостаточность, действительно, становится "мотором" танатогенеза АС, поскольку повреждение анатомо-физиологической целостности ЖКТ включается в порочный круг метаболического дистресс-синдрома и глубокого угнетения интестинальных механизмов противоинфекционной защиты. Именно поэтому профилактика и коррекция синдрома кишечной недостаточности является важнейшим направлением терапии АС. Пути лечения синдрома кишечной недостаточности Поддержание нормальной микроэкологии ЖКТ:
селективная деконтаминация ЖКТ;
оптимальная системная антибиотикотерапия.
Коррекция нарушений функций ЖКТ:
раннее энтеральное питание (и по возможности естественное);
восстановление моторики кишечника;
применение энтеропротекторов (соматостатина).
Коррекция метаболического дистресс-синдрома Оптимизация транспорта кислорода и микроциркуляции Особое значение имеет устранение увеличенного внутрикишечного давления, связанного с патологической секвестрацией в просвете кишечной трубки критических объемов жидкости и газов. В такой ситуации активное дренирование ЖКТ преследует цель активного удаления кишечного содержимого, обеспечивая тем самым эффект интестинальной декомпрессии. Снижение внутрикишечного давления обеспечивает восстановление процессов кровообращения в стенке кишечника и нормализацию его моторной, барьерной и метаболической функции. Учитывая данные о патогенезе синдрома функциональной недостаточности ЖКТ при АС с максимальной выраженностью нарушений в тонкой кишке, абсолютно показанным является преимущественное дренирование всей тонкой кишки либо проксимальных ее отделов. Надо отметить, что в настоящее время нет единого мнения в отношении выбора метода дренирования тонкой кишки. Так, большинство хирургов отдает предпочтение закрытым методам, когда зонд проводится в кишечник антеградно. В данном случае недостатками метода являются: низкая эффективность дренирования вследствие необходимости в постоянной активной аспирации по зонду против градиента давления, развитие дыхательных расстройств преимущественно у лиц старческого и пожилого возраста, дислокация зонда с развитием аспирации в дыхательные пути . Открытые методы дренирования (через гастро-, энтеро-, аппендикс-, цекостомы) не утратили своего практического значения и в наши дни, однако имеют ограниченное применение вследствие большого числа осложнений (отрыв стомы, образование кишечных свищей с развитием водно-электролитных и метаболических нарушений). Следует учитывать, что длительное применение назоинтестинального или назогастрального дренирования приводит к инфицированию вышележащих отделов ЖКТ и трахеобронхиального дерева, что в совокупности с длительным вынужденным горизонтальным положением больного и продолженной ИВЛ является причиной прогрессивного увеличения числа внутрибольничных гнойно-септических осложнений при АС. Особое значение в профилактике и лечении синдрома кишечной недостаточности при АС имеет своевременное назначение синтетического соматостатина (стиламин /Арес-Сероно/ или сандостатина /Сандоз Фарма/). Исследования проведенные в различных центрах, а также в нашей клинике (В.С.Савельев и сотр., 1996), позволяют считать этот препарат не только эффективным в лечении панкреатита, желудочно-кишечных кровотечений и свищей, но и системным энтеропротектором и адаптогеном пищеварительной системы.
Место соматостатина в лечении АС определяется его основными фармакодинамическими свойствами, которые включают:
подавление секреции кислоты и пепсина в желудке (профилактика стресс-язв);
подавление секреторной функции поджелудочной железы (профилактика панкреонекроза);
подавление выброса гастроинтестинальных тканевых гормонов;
снижение давления в портальной венозной системе;
Не имея возможности останавливаться подробно на других аспектах лечения синдрома кишечной недостаточности, подчеркнем, что его успех невозможен без адекватной метаболической поддержки и оптимального транспорта кислорода — как интегрального, так и спланхнического.
Лапаростомия. Показания к лапаростомии.
В связи с расширением показаний к оперативным вмешательствам на органах брюшной полости и их объема, особенно у лиц пожилого и старческого возраста, увеличилось число послеоперационных осложнений, требующих ранней (в первые 3 нед послеоперационного периода) релапаротомии. Частота их, согласно литературным данным, составляет от 0,5 до 7% [2, 5, 8, 10, 12].
Диагностика этих осложнений трудна, особенно перитонита, кишечной непроходимости, в результате чего релапаротомии выполняются поздно. Результаты повторных вмешательств зависят в первую очередь от их своевременности [9, 11]. Нередко возникшее в послеоперационном периоде осложнение приводит к развитию новых и, следовательно, к повторным чревосечениям. Релапаротомии характеризуются некоторыми техническими и тактическими особенностями, сложны, требуют большого хирургического опыта [1, 6]. Летальность после них высока - от 29,65 до 80%, а при послеоперационном перитоните достигает 90% [4, 8, 12, 13].
Этим объясняется непроходящий интерес хирургов к теме интраабдоминальных осложнений, идет поиск новых методов диагностики и лечения, совершенствуются уже известные, успешно внедряются малоинвазивные технологии [3, 11].
Целью работы является анализ структуры ранних послеоперационных осложнений, причин их развития и методов лечения за последние 5 лет по сравнению с данными 30-летней давности (1970-1980 гг.).
Материал и методы
За последние 5 лет (2005-2009 гг.) в клинике произведено 5286 лапаротомий по поводу различных заболеваний и травм органов брюшной полости. Ранняя релапаротомия (в первые 3 нед послеоперационного периода) выполнена 82 (1,55%) больным, которым сделано в общей сложности 95 повторных вмешательств.
В первый раз в экстренном порядке оперированы 74 (90,1%) пациента, из них 70 (85,4%) - в условиях перитонита. В диагностике заболеваний и возникших осложнений применяли современные лабораторные и инструментальные методы.
Результаты и обсуждение
По поводу послеоперационного перитонита оперированы 42 человека (0,79% общего числа лапаротомий и 51,2% повторно оперированных), причем 5 больным осуществлено по две релапаротомии и одному - 3. Это осложнение развивалось в основном после экстренных вмешательств, произведенных в условиях перитонита, лишь у 2 пациентов - после плановых. Показанием к релапаротомии в большинстве наблюдений была недостаточность швов анастомоза. В 3 наблюдениях к послеоперационному перитониту привели диагностические ошибки: неверная оценка жизнеспособности кишки при ущемленной грыже, мезентериальном тромбозе. Развития перитонита, связанного с тактическими врачебными ошибками (неадекватный объем вмешательства, недостаточная санация и неадекватное дренирование брюшной полости), не отмечено. Анализируя причины осложнений, следует указать, что 80% повторно оперированных больных были в возрасте старше 60 лет, более половины из них оперированы по поводу опухолей желудочно-кишечного тракта, тяжелой тупой травмы живота с повреждением внутренних органов, проникающих ранений брюшной полости. По сравнению с данными 30-летней давности частота послеоперационного перитонита среди всех интраабдоминальных осложнений увеличилась: в 1980 г. - 0,47% всех лапаротомий и 30% повторно оперированных, что отмечают и другие авторы [7-9, 11]. Увеличение частоты послеоперационных перитонитов обусловлено чрезвычайной тяжестью состояния больных острыми заболеваниями органов брюшной полости, поздними сроками поступления больных уже с клинической картиной распространенного перитонита, тяжестью сопутствующих заболеваний, ростом заболеваемости опухолями желудочно-кишечного тракта. Увеличилось число больных с перфорацией острых язв желудка, тонкой кишки, возникающей после операций у лиц пожилого и старческого возраста, длительно лечившихся гормонами, нестероидными противовоспалительными средствами. При бактериологических исследованиях в случае перитонита стала чаще встречаться микрофлора, резистентная к противомикробным препаратам (в 25,1% бактериологических посевов).
В диагностике послеоперационного перитонита применяли современные методы исследования - УЗИ, лапароскопию. Лапароцентез с шарящим катетером, широко использовавшийся ранее, с внедрением в практику лапароскопии применяли редко. Однако инструментальные исследования не исключают тщательного наблюдения за больными в динамике с констатацией и анализом нехарактерных для нормального течения послеоперационного периода клинических проявлений, особенно длительного пареза кишечника.
При распространенном гнойном послеоперационном перитоните с флегмоной передней брюшной стенки, каловом перитоните, у больных с декомпенсированным сахарным диабетом, опухолями желудочно-кишечного тракта, ведущими к резкому снижению резистентности организма, замедлению процессов регенерации, релапаротомию завершали формированием лапаростомы (20 наблюдений). После основных этапов операции на петли кишечника укладывали сальник, на него - салфетку, смоченную антисептической мазью. Вдоль краев операционной раны, отступя от них 5 см, пришивали блоковидными швами капроновой нитью с длинными концами отрезки силиконовых трубок. Между кожными краями раны помещали салфетку с антисептиком, длинные концы нитей завязывали на «банты» так, чтобы края раны не соприкасались друг с другом. При последующих санациях брюшной полости банты развязывали, после ее проведения вновь завязывали. Первую санацию осуществляли через 24 ч, последующие - с учетом состояния больного. Число санаций составило от 2 до 14. Считали необходимым трансназальное тотальное зондирование тонкой кишки. Кроме того, во время операции проводили фибробронхоскопию с санацией бронхиального дерева 0,5% раствором диоксидина для профилактики нозокомиальной пневмонии, играющей существенную роль в прогнозе лечения. Показаниями к прекращению санаций и ушиванию брюшной полости служили нормализация температуры тела, лабораторных показателей, включая лейкоцитарный индекс Кальф-Калифа, купирование пареза кишечника, отсутствие гнойного выпота в брюшной полости, воспалительных изменений брюшной стенки. Преимущества лапаростомии перед релапаротомией в случае развития осложнений очевидны: меньшая травматичность, поскольку не приходится каждый раз заново вскрывать брюшную полость; своевременная диагностика и коррекция развивающихся осложнений; плановый характер программных санаций, отсюда возможность выполнения их опытными хирургами. Общее обезболивание позволяет осуществить тщательный туалет брюшной полости (мы проводим его в гетеротермическом режиме в сочетании с ультразвуковой кавитацией аппаратом УРСК 7Н-18), вскрыть формирующиеся гнойники, ушить дефекты анастомоза.
Под контролем иммунологических исследований широко применяли иммуностимулирующую терапию (переливание свежезамороженной плазмы, ронколейкин, продигиозан). Наиболее информативным тестом в иммунологических исследованиях являлась фагоцитарная реакция нейтрофилов периферической крови, которая не только характеризовала состояние фагоцитоза у больных, но и была прогностическим критерием в оценке исходов повторных вмешательств.
Из 42 больных умерли 19 (45,2%). Причиной смерти 15 пациентов был перитонит, 4 - тромбоэмболические осложнения (тромбоэмболия легочной артерии - 3, инфаркт миокарда - 1). Прослеживается четкая зависимость результатов лечения от сроков выполнения релапаротомии с момента развития осложнения. По сравнению с показателями 30-летней давности (52,5%) летальность при послеоперационном перитоните снизилась, что мы склонны объяснять своевременной диагностикой, применением лапаростомии, современных антибактериальных препаратов, иммуностимулирующей терапии.
По поводу абсцессов брюшной полости релапаротомия произведена 8 из 15 больных с этим осложнением, что значительно меньше, чем 30 лет назад, так как широкое применение лучевой диагностики и пункционных технологий сократило число повторных операций. К релапаротомии прибегали при наличии множественных гнойников, глубоком их расположении, когда они были недоступны для пункции либо нельзя было исключить какое-то другое осложнение. При абсцессах малого таза, гнойниках, прилежащих к передней брюшной стенке, поддиафрагмальных и подпеченочных гнойниках, доступных для пункций, применяли малоинвазивные методики (пункции, дренирование под контролем УЗИ). Диагностика абсцессов брюшной полости обычно не представляла сложности. Гипертермия, признаки интоксикации, высокий лейкоцитоз со сдвигом влево позволяли заподозрить осложнение, а УЗИ подтверждало диагноз. Летальных исходов в этой группе больных не было.
В связи с послеоперационным кровотечением оперированы 22 больных, из них 1 дважды. Следует отметить, что основной его причиной у большинства больных было системное нарушение процессов свертываемости крови при интенсивной длительной желтухе, длительном приеме антикоагулянтов, после обширных резекций печени. Чаще стали встречаться кровотечения из острых лекарственных язв желудочно-кишечного тракта, они отмечались в послеоперационном периоде у пациентов с выраженными сопутствующими заболеваниями, вынужденных длительное время лечиться гормональными препаратами, антикоагулянтами. По-прежнему наблюдаются аррозионные кровотечения у больных, оперированных по поводу панкреонекроза с флегмоной забрюшинного пространства. В клинике разработан и применен новый способ дренирования забрюшинного пространства при инфицированном панкреонекрозе, осложненном флегмоной забрюшинной клетчатки, - ретроперитонеостомия. Она позволяет широко и адекватно дренировать ложе поджелудочной железы, забрюшинное пространство, что способствует быстрейшей ликвидации гнойного процесса. Аррозионные кровотечения при этом заболевании после внедрения ретроперитонеостомии не наблюдались. В 6 наблюдениях кровотечение в брюшную полость было связано с погрешностями гемостаза у больных с тупой травмой живота с размозжением печени, селезенки, поджелудочной железы, забрюшинными гематомами и проникающими ранениями брюшной полости (прорезывание, соскальзывание лигатур).
После релапаротомии по поводу послеоперационного кровотечения умерли 6 больных, но непосредственной причиной смерти это осложнение стало у 3 человек. В остальных 3 наблюдениях массивная кровопотеря способствовала развитию недостаточности швов анастомоза и перитонита, который не удалось купировать.
Резко сократилось число эвентраций: 4 (0,07%) на 5286 лапаротомий, а 30 лет назад среди причин релапаротомии они занимали второе место после перитонита (0,35%). При плановых вмешательствах в настоящее время эвентрации не наблюдается. Это объясняется принятой в клинике установкой: обязательным применением у «опасной» категории больных при ушивании брюшной стенки так называемых провизорных швов, которые накладывали через все слои (кроме брюшины), отступя от краев раны 2 см, в количестве 3-4 и снимали позднее обычных. К «опасной» категории относим пациентов старше 60 лет, истощенных, с онкологическими заболеваниями, сахарным диабетом, т.е. пациентов с нарушением процессов регенерации. Перед плановой операцией и после экстренной таким больным проводили иммуностимулирующую терапию. Естественно, для снижения числа эвентраций в последние годы имело значение широкое применение лапароскопических вмешательств, а у больных с перитонитом - лапаростомии. Общеизвестно, что высокая контаминация брюшной полости патогенной флорой, длительный парез кишечника способствуют инфицированию передней брюшной стенки, развитию ее флегмоны с последующим прорезыванием швов. Временное закрытие брюшной полости при лапаростомии по методу клиники с окончательным ушиванием ее после купирования воспалительного процесса предупреждает развитие эвентраций. В клинике разработан и метод ушивания брюшной стенки при этом осложнении: на силиконовых трубках швами через все слои брюшной стенки, кроме брюшины. Мы считаем обязательным при эвентрации осуществлять полноценную ревизию брюшной полости, чтобы не пропустить какого-либо другого осложнения, иначе простое ушивание раны было бы неадекватным вмешательством. В сочетании с иммуномодулирующей терапией такая тактика дает хорошие результаты - повторных эвентраций, кишечных свищей не наблюдалось.
Значительно уменьшилась частота послеоперационной кишечной непроходимости - 5 наблюдений (0,09% всех лапаротомий и 6,1% повторно оперированных против 0,28 и 18% соответственно 30 лет назад). В 4 наблюдениях она имела спаечный характер, у 1 больного с желчнокаменной болезнью и пузырно-дуоденальным свищом была вызвана миграцией в тонкую кишку желчного камня. Уменьшение частоты кишечной непроходимости как причины релапаротомии, безусловно, связано с широким внедрением лапароскопических операций. Поскольку это осложнение развивается в основном после вмешательств, произведенных в условиях перитонита, применение в его лечении лапаростомии, обязательным компонентом которой считаем назоинтестинальную интубацию, также играет положительную роль. Летальных исходов после релапаротомий по поводу послеоперационной кишечной непроходимости не было.
В последние годы не отмечалось релапаротомий в связи с развитием послеоперационного панкреатита. Объяснений этому несколько. Ранее это осложнение наблюдалось в основном после резекции желудка по поводу осложненной язвенной болезни, вмешательств на желчных протоках и поджелудочной железе. Количество резекций желудка в настоящее время резко снизилось, а четко выверенная хирургическая тактика при операциях на органах гепатопанкреатодуоденальной зоны, профилактическое применение современных антиферментных препаратов (соматостатина, октреотида), даларгина позволяют предупредить развитие послеоперационного панкреатита либо купировать его без оперативного пособия.
Механическая желтуха, обусловленная повреждением внепеченочных желчных протоков при экстренной лапароскопической холецистэктомии (иссечение участка общего желчного протока с клипированием проксимального отдела), стала причиной релапаротомии в одном наблюдении. Гепатикоэнтеростомия с выключением по Ру петли тощей кишки, произведенная через 2 сут после первой операции, способствовала выздоровлению больного.
В качестве положительного момента также следует отметить, что в результате применения новых эффективных методов исследования, прежде всего лапароскопии, исчезла необходимость в диагностических («напрасных») релапаротомиях при подозрении на внутрибрюшные осложнения, которые 30 лет назад составляли 2,7% всех повторных вмешательств.
Из 82 повторно оперированных умерли 25 (30,5%), 30 лет назад летальность после релапаротомии составляла 38,0%. У 21 больного причиной смерти послужил перитонит.
Таким образом, по сравнению с ситуацией 30-летней давности количество послеоперационных осложнений, требующих релапаротомии, остается на прежнем уровне, но изменилась их структура. Как и 30 лет назад, наиболее часто осложнения развиваются после операций на кишечнике, после вмешательств по поводу травм органов брюшной полости, что связано, как правило, с поздними сроками поступления больных, тяжестью состояния. В связи с применением новых оперативных технологий, профилактических мероприятий число некоторых осложнений (эвентрация, кишечная непроходимость) резко сократилось, процент же послеоперационных перитонитов, кровотечений возрос. О причинах этого уже шла речь выше. Снижение летальности после релапаротомии объясняется улучшением диагностики осложнений и своевременностью повторных вмешательств, применением в лечении послеоперационного перитонита - основной причины смерти больных - лапаростомии, позволяющей управлять течением послеоперационного периода.
Некоторые осложнения, развивающиеся после лапароскопических вмешательств (гематомы, желчные затеки), мы успешно ликвидировали с помощью релапароскопии через старые троакарные проколы (11 наблюдений), что, несомненно, менее травматично для больного и позволяет снизить количество релапаротомий. То же самое можно сказать о чрескожных, контролируемых УЗИ пункциях ограниченных жидкостных скоплений.
Таким образом, профилактика послеоперационных интраабдоминальных осложнений заключается прежде всего в своевременной диагностике и адекватном хирургическом лечении острых заболеваний органов брюшной полости и травм, так как они развиваются преимущественно после экстренных вмешательств, произведенных в условиях перитонита.
Лапаростомия. Показания к лапаростомии.
Лапаростомия. Показания к лапаростомии.
Открытое ведение инфицированной брюшной полости (лапаростомия) было основано на представлении о разлитом перитоните как о «тотальном» абсцессе брюшной полости. Вскоре, однако, стало ясно, что полного опорожнения брюшной полости при этом не происходит из-за наличия в ней множества карманов, межпетлевых пространств и отграничивающих сращений, которые способствуют локальным скоплениям инфицированного выпота.
Зачем же закрывать живот, если через 48 ч придется вновь открывать его? Поэтому лапаростомия сейчас стала едва ли не методом выбора в лечении подобных состояний. Ее потенциальные преимущества очевидны: удается избежать некроза краев раны при форсированном закрытии срединного разреза; обеспечивается лучшая экскурсия диафрагмы; в значительной степени удается предотвратить развитие АКС с его почечными, легочными и гемодинамическими проявлениями.
При этом методе, однако, не удается избежать осложнений: возникновения кишечных свищей, массивных потерь жидкости, гипотермии и риска эвентрации. Использование приспособлений для временного закрытия (ПВЗЖ) абдоминального дефекта (синтетической сетки или других средств) снижает уровень этих осложнений. Тем не менее техническое несовершенство этих приспособлений обусловливает необходимость последующей реконструкции брюшной стенки.
Лапаростомия показана в случаях, когда надежное закрытие брюшной стенки невозможно вследствие особенностей телосложения пациента, количества инфицированного экссудата, степени пареза кишечника, отека брыжеечных образований, состояния краев абдоминальной раны и количества предполагаемых релапаротомий. С практической точки зрения считайте, что лапаростомия показана, когда живот не может быть закрыт или не должен быть закрыт.

Показания к лапаростомии
Живот, который не может быть закрыт
• Из-за обширных дефектов брюшной стенки вследствие травмы или распространенного некротического фасциита.
• Из-за чрезмерного висцерального или ретроперитонеального отека после массивной травмы, реанимационных мероприятий или обширных абдоминальных вмешательств (например, при разрыве аневризмы брюшной аорты).
• Из-за плохого состояния апоневротических образований после множественных лапаротомий.
Живот, который не должен быть закрыт
• Планируемая через 1—2 дня повторная ревизия брюшной полости (зачем запирать ворота, через которые вскоре вновь придется проходить?).
• Предстоящее форсированное закрытие абдоминальной раны при высоком внутрибрюшном давлении и ослабленных апоневротических структурах в окружности раны.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лапаростомия. Показания к лапаростомии.
Новая технология в управляемой лапаростомии пациентов с распространенным гнойным перитонитом
Новая технология в управляемой лапаростомии пациентов с распространенным гнойным перитонитом
Наименование проекта:
Новая технология в управляемой лапаростомии пациентов с распространенным гнойным перитонитом
Организация/Руководитель:
ГБОУ ВО «Красноярский государственный медицинский университет
имени профессора В.Ф. Войно-Ясенецкого»
Министерства здравоохранения Российской Федерации
/ Черданцев Дмитрий Владимирович
________________________________________
ОБЩИЕ СВЕДЕНИЯ
________________________________________
________________________________________
ИНФОРМАЦИЯ ИЗ ЗАЯВКИ
________________________________________
Актуальность проекта:
В структуре хирургической заболеваемости перитонит и вызывающие его деструктивно-воспалительные процессы в брюшной полости занимают лидирующие позиции. Летальность при распространенном гнойном перитоните (РГП) остаётся на высоких уровнях и варьирует от 40 до 70%, а при тяжелых формах РГП и возникновении осложнений достигает 80-90%, зачастую это больные трудоспособного возраста, средний возраст по данным проведенного ретроспективного анализа составляет 49,6±15,9 лет. Арсенал имеющихся хирургических методик ведения пациентов с РГП не велик и не всегда эффективен. Бесспорными остаются основополагающие принципы лечения перитонита — максимально раннее хирургическое устранение источника воспаления брюшины и адекватная санация брюшной полости. Однако до сих не ясно, какому способу дальнейшего ведения больного с РГП отдать предпочтение и чем при этом руководствоваться.
Применение санирующих операций по традиционной методике имеет немало недостатков, что оставляет распространенные формы перитонита и летальность по его причине на лидирующих позициях. Такое положение дел требует разработки новых подходов к лечению пациентов с тяжелыми формами распространенного перитонита, совершенствования хирургической тактики, что позволит улучшить результаты лечение пациентов сданной патологией.
Цель и задачи проекта:
Цель — улучшить результаты лечения пациентов с распространенными формами гнойного перитонита путем разработки технологии управляемой лапаростомии и оптимизации санационных мероприятий.
Задачи проекта:
1. Оптимизировать методику санационных мероприятий у больных с РГП
с применением антисептиков нового поколения;
2. Отработать методику комплексного санационного лечения с вакуум-ассистированной лапаростомой;
3. Отработать методику комплексного санационного лечения с «сэндвич» конструкцией;
4. Определить показания и противопоказания для программированного хирургического лечения пациентов с РГП с использованием вакуум-ассистированной лапаростомы, а также разработанного оригинального способа временного закрытия лапаротомной раны при помощи «сэндвич» конструкции из полипропиленового сетчатого эндопротеза и коллаген-хитозановой пластины;
5. Разработать технологию хирургического лечения больных с РГП.
Преимущества проекта перед аналогами:
1. Вакуум-ассистированная лапаростома в сравнении с традиционной лапаростомой позволяет эффективно санировать брюшную полость в периоперационном периоде и способствует ускорению процесса очищения брюшной полости.
2. Метод локального отрицательного давления обладает детоксикационными свойствами. Непрерывное удаление экссудата из брюшной полости способствует нормализации показателей, характеризующих степень эндотоксикоза.
3. Оригинальная методика открытого ведения брюшной полости с помощью сочетанного применения локального отрицательного давления и оригинальной сэндвич-конструкции позволяет эффективно снижать внутрибрюшной давление, профилактировать повторное возникновение интраабдоминальной гипертензии и создает условия для эффективного закрытия лапаростомной раны после завершения санаций у больных с тяжелым распространенным гнойным перитонитом.
4. Применение локального отрицательного давления путём наложения вакуум-ассистированной лапаростомы уже после первой санации сопровождается статистически значимым снижением индекса брюшной полости, что позволяет в более короткие сроки купировать явления разлитого гнойного перитонита и сократить количество санирующих операций в 1,5 раза в сравнении с традиционной методикой лечения, а также увеличить периоперационный промежуток без потери контроля над перитонеальным выпотом. Более быстрое купирование воспалительных явлений брюшины и сокращение количества санирующих операций, по-видимому, способствуют уменьшению количества системных и местных осложнений и улучшению результатов лечения больных с тяжелым абдоминальным сепсисом, что позволяет рассматривать предложенную методику лечения как перспективную и рекомендовать её к более широкому применению.
Перечень юридических лиц, являющихся потребителями или заказчиками научно-технической продукции и результатов инновационной деятельности:
Заказчик – Краевое государственное бюджетное учреждение здравоохранения «Краевая клиническая больница».
Полученные результаты:
Предлагаемая в проекте методология хирургического лечения пациентов с РГП путём наложения вакуум — ассистированной лапаростомы с помощью аппарата VivanoTec S 042 NPWT и оригинального способа наложения лапаростомы с комплексным санационным лечением современными антисептиками позволила сократить: продолжительности пребывания пациента с РГП на стационарном лечении, количество санирующих операций брюшной полости, стоимость лечения пациентов с РГП путём сокращения количества санирующих оперативных вмешательства и уменьшения койко-дня, вероятность развития ранних и поздних послеоперационных осложнений, летальность и инвалидизацию больных с РГП.
Основные научные публикации коллектива по теме проекта (не более десяти):
1. Черданцев Д.В., Первова О.В., Шапкина В.А., Дятлов В.Ю., Трофимович Ю.Г. Опыт лечения распространенного гнойного перитонита с применением локального отрицательного давления. // Медицина и образование в Сибири. – НГМУ, 2015. — №6;
2. Черданцев Д.В., Первова О.В., Шапкина В.А., Дятлов В.Ю., Трофимович Ю.Г. Вакуум-ассистированная лапаростома при лечении распространенного гнойного перитонита. // В мире научных открытий серия «Естественные и технические науки». – Красноярск, 2015. — №12.
Перечень имеющихся у исполнителей по проекту объектов интеллектуальной собственности на научно-техническую продукцию, в том числе не защищенных:
—
Читайте также:
