Лечение гранулематоза Вегенера, химиотерапия опухолей орбиты глаза
Добавил пользователь Евгений Кузнецов Обновлено: 25.01.2026
Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова, Москва
НИИ глазных болезней РАМН, Москва
ФГБУ "НИИ глазных болезней" РАМН, Москва;
ГБОУ ВПО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Минздрава РФ
УКБ №3 Первого МГМУ им. И.М. Сеченова, ул. Россолимо, 11, стр. 5, Москва, 119021, Российская Федерация
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, 119021, Российская Федерация
ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» УКБ №3, клиника нефрологии, внутренних и профессиональных болезней, ул. Россолимо, 11, стр. 4—5, Москва, 119021, Российская Федерация
ГБОУ ВПО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Минздрава РФ
Рефрактерная форма гранулематоза с полиангиитом орбиты: клинико-морфологическое наблюдение
Журнал: Архив патологии. 2017;79(1): 56‑60
Гранулематоз с полиангиитом (гранулематоз Вегенера, ГПА) орбиты характеризуется развитием гранулематозного воспаления с васкулитом сосудов мелкого калибра, может развиваться при локальной и генерализованной формах заболевания. После введения современных схем иммуносупрессивной терапии прогноз заболевания улучшился, однако, сохраняются рефрактерные к терапии формы ГПА, морфология которых недостаточно изучена. Представлен клинический случай рефрактерного ГПА с поражением орбиты с гистологическим и иммуногистохимическим исследованием. Особенность заключается в развитии тяжелого фиброза с накоплением преимущественно коллагена III типа и персистенцией гранулематозного воспаления и продуктивно-деструктивного васкулита.
Гранулематоз с полиангиитом (ГПА), ранее известный как гранулематоз Вегенера, остается малоизученным, редким системным заболеванием, характеризующимся развитием гранулематозного воспаления и некротизирующего васкулита с поражением мелких сосудов. Поражаться может практически любой орган в зависимости от формы заболевания: от локального, при котором заинтересованы верхние дыхательные пути и/или органы зрения и слуха, до генерализованного варианта с мультисистемным поражением [1—4].
Наиболее частое офтальмологическое проявление ГПА, встречающееся в 5—63,2% случаев, — гранулематозное воспаление орбиты [5—8]. В исследовании J. Holle у 72,3% пациентов с поражением орбиты была ранняя системная и генерализованная форма ГПА, а у 27,5% — локальная [9]. Особую сложность с точки зрения диагностики составляет группа пациентов, у которых заболевание манифестирует с поражения органа зрения. Клиническая картина, как правило, малоспецифична: выраженный, болезненный экзофтальм, отек и покраснение периорбитальных тканей. Характерным признаком при компьютерной томографии (КТ) является сопутствующая патология полости носа и придаточных пазух, особенно при наличии костной деструкции, однако, это не является обязательным признаком [10], на ранних стадиях заболевание может протекать изолированно. В такой ситуации значительную роль играет результат гистологического исследования биоптата орбиты. Весьма актуальным остается поиск гистологических особенностей ГПА. Наш случай демонстрирует клинические и морфологические особенности гранулемы орбиты, рефрактерной к иммуносупрессивной терапии.
Приводим собственное наблюдение.
Пациент Г., 40 лет, наблюдался в НИИ глазных болезней. Впервые отметил отек верхнего века слева, быстро нарастающий экзофтальм и боль в области левой орбиты осенью 2010 г. На момент осмотра офтальмологами экзофтальм левого глаза составлял 5 мм, репозиция его была резко затруднена, подвижность ограничена в наружных отведениях. Острота зрения левого глаза снижена до 0,1, внутриглазное давление OD/OS 16/24 мм рт.ст. При проведении КТ выявлено ретробульбарное образование левой орбиты размером 22×19×20 мм с четким контуром, однородной структурой со средней плотностью до 36 ед. С целью верификации диагноза взята биопсия. При ревизии орбиты (сентябрь 2010 г.) по медиальной стенке выявлена плотная бугристая ткань с диффузным характером роста, распространяющаяся на окружающие мягкие ткани, включая внутреннюю прямую мышцу. При гистологическом исследовании обнаружены фрагменты фиброзно-жировой ткани, пронизанные воспалительным инфильтратом, состоящим из лимфоидных, макрофагальных элементов, плазматических клеток с примесью нейтрофилов. Воспалительный инфильтрат распространялся на поперечно-полосатую мышцу. Обнаружены явления продуктивно-деструктивного тромбоваскулита и продуктивного васкулита, некоторые с выраженными склеротическими изменениями вплоть до полной облитерации просвета (рис. 1, а).
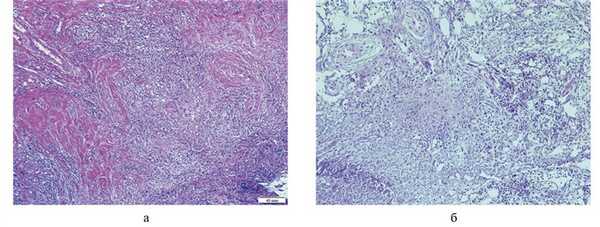
Рис. 1. Микроскопическая картина ГПА орбиты. а — до лечения: выраженная воспалительная реакция, пролиферативно-деструктивный васкулит; б — после иммуносупрессивного лечения спустя 1,5 года: воспалительная инфильтрация сохраняется, наблюдаются обширные очаги фиброза. Окраска гематоксилином и эозином. ×100.
Пациент был консультирован в Клинике нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева Первого МГМУ им. И.М. Сеченова. На основании результатов проведенного обследования в стационаре (июнь 2011 г.) не обнаружено признаков поражения других органов и систем (в том числе верхних дыхательных путей и органа слуха — осмотр ЛОР-врача и КТ околоносовых пазух носа, органов грудной клетки, исследование функции внешнего дыхания, почек, кожи, суставов, периферической и центральной нервной системы, сердечно-сосудистой системы). АНЦА к протеиназе-3 и миелопероксидазе в пределах нормальных значений. Данных, подтверждающих IgG4-связанное заболевание, также не обнаружено. На основании клинической картины объемного поражения левой орбиты и результатов морфологического исследования состояние расценено как локальная форма ГПА с поражением органа зрения. Учитывая высокую активность местного процесса, начата активная иммуносупрессивная терапия: внутрь метилпреднизолон в дозе 32 мг/сут и циклофосфамид в дозе 50 мг/сут с постепенным повышением до 150 мг/сут под контролем показателей крови. Переносимость лечения была удовлетворительной, отмечено постепенное уменьшение выраженности болевого синдрома.
После выписки из стационара продолжал лечение в прежнем объеме, однако, в течение месяца отмечено постепенное ухудшение самочувствия: появилось онемение стоп, лица и волосистой части головы, отмечено возобновление и нарастание болей. Спустя 4 мес активной иммуносупрессивной терапии констатирована ее недостаточная эффективность, и пациент был повторно госпитализирован (октябрь 2011 г.) для динамического обследования.
Результаты обследования подтвердили отсутствие других системных поражений (повторное исследование АНЦА также в пределах нормальных значений), обсуждали альтернативные диагнозы (в том числе опухоль орбиты, IgG4- связанное заболевание), а также ГПА, рефрактерный к стандартной терапии. В связи с отсутствием эффекта от проводимой терапии и появлением нежелательных эффектов (синдром Кушинга, повышение артериального давления) рекомендовано медленное снижение дозы метилпреднизолона до поддерживающей. При обследовании в НИИ глазных болезней экзофтальм слева составлял 8 мм, репозиция глаза практически отсутствовала. Левый глаз ослеп в результате атрофии зрительного нерва. Наблюдалось ограничение подвижности глазного яблока во всех отведениях (рестриктивная офтальмоплегия), лагофтальм 2 мм. В связи с сильными болями, нарастающим экзофтальмом, высоким риском развития экспозиционной кератопатии решено удалить часть гранулематозных разрастаний. В конце января 2012 г. произведено частичное удаление образования орбиты ретрокарункулярным доступом. На глубине 25 мм от плоскости разреза обнаружена ткань белесоватого цвета с неровной поверхностью, спаянная с окружающей жировой клетчаткой и экстраокулярными мышцами. Ткань имела исключительную плотность, не разрезалась ножом. Удалены фрагменты образования объемом около 2 см 3 с применением высокоэнергетического оборудования.
Проведено гистологическое и иммуногистохимическое исследование удаленного материала. В биоптатах обнаружена фиброзно-жировая ткань с обширными участками склероза и очаговыми воспалительными инфильтратами, состоящих из лимфогистиоцитарных элементов с примесью большого количества плазмоцитов и наличием сосудов с утолщенными склерозированными стенками и явлениями продуктивного васкулита (см. рис. 1, б). По сравнению с предыдущим исследованием отмечено усиление фиброза при сохранении воспалительной реакции. При иммуногистохимическом исследовании преобладают CD4 + -лимфоциты (45% клеток инфильтрата, рис. 2, а), обнаруживаются CD8 + -лимфоциты (8% клеток инфильтрата, см. рис. 2, б), единичные NK-клетки (CD56) (1%, см. рис. 2, в), макрофаги, лейкоциты, а также миофибробласты (37% клеток инфильтрата). Остальную часть клеточного инфильтрата составляют В-лимфоциты и плазматические клетки. В очагах склероза доминируют миофибробласты и фибробласты (см. рис. 2, г). В экстрацеллюлярном матриксе грануляционной ткани преобладает коллаген III типа (см. рис. 2, д). Коллаген IV типа в базальных мембранах стенок сосудов гранулематозной ткани. Коллаген I типа обнаруживается в небольших количествах преимущественно в зонах фиброза. Клетки грануляционной ткани и эндотелия сосудов обладают высокой экспрессией матриксной металлопротеиназы 2 и 9 и VEGF (см. рис. 2, е).
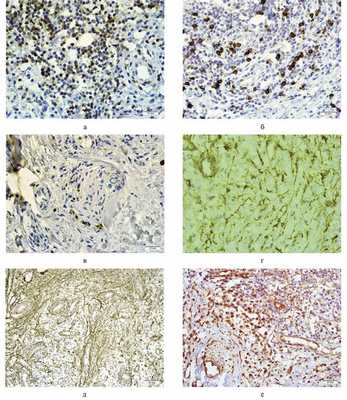
Рис. 2. Иммуногистохимическая картина ГПА орбиты. а — CD4+-лимфоциты в воспалительной ткани; б — CD8+-лимфоциты в воспалительной ткани; в — CD56 (NK-клетки) в воспалительной ткани; г — Vim (мезодермальная ткань); д — Col III в гранулематозной ткани; е — VEGF. Иммуногистохимическая реакция. а—г, е — ×200; д — ×100.
В феврале—марте 2012 г. пациент госпитализирован в Клинику нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева Первого МГМУ им. И.М. Сеченова для обследования и коррекции терапии, учитывая результаты повторного морфологического исследования. Очередное обследование подтвердило локальный характер патологического процесса, ограниченного поражением левой орбиты. Впервые обнаружено минимальное повышение АНЦА к протеиназе-3 (6 МЕ/л при норме до 5 МЕ/л). В качестве препарата выбора рассматривалось назначение ритуксимаба, однако, по административным обстоятельствам (необходимость получения препарата по месту жительства) принято решение о попытке назначения метотрексата, первоначально в дозе 10 мг/нед с рекомендацией постепенного повышения до 20—25 мг/нед под контролем анализов амбулаторно. Также было рекомендовано назначение глюкокортикоидов в повышенной дозе (пульс-терапия, назначение преднизолона внутрь в дозе 1 мг/кг), от чего пациент категорически отказался.
В последующем пациент наблюдался амбулаторно в течение 1,5 лет. Отмечали положительную динамику и отсутствие ухудшения состояния. В дальнейшем динамика состояния неизвестна.
Особенность анализируемого случая заключается в резистентности к иммуносупрессивной терапии и нарастании клинических проявлений ГПА орбиты. При этом отмечены увеличение фиброзных изменений с накоплением коллагена III типа и персистенция гранулематозного воспаления и васкулитов.
Механизм резистентности может быть связан с сохранением активации CD4 + -лимфоцитов, которые преобладают в гранулематозной ткани и выработки цитокинов, направленных на поддержание воспаления. Кроме того, васкулиты поддерживают ишемическое повреждение. Развивающийся в результате фиброз может препятствовать проникновению иммуносупрессивных препаратов в очаг воспаления, что и определяет резистентность к терапии. Возникают порочный круг и персистенция воспаления. Считается, что формирование гранулемы при АНЦА-ассоциированных васкулитах сопровождается нарушением Т-клеточного иммунного ответа, включающем выработку Т-хелперов 1-го и 17-го типов (Th1, Th17), аномальных Т-лимфоцитов, экспрессирующих NK-рецепторы, а также дисфункцию Т-регуляторного звена [11]. Нарушение взаимодействия Т-лимфоцитов и макрофагов приводит к недостаточному эффероцитозу (удалению клеточного дебриса) [12]. Происходят дополнительная активация лимфоцитов, повышение выработки провоспалительных цитокинов. Отдельную роль в поддержании длительно текущего воспаления играют В-лимфоциты и плазматические клетки, вырабатывающие большое количество иммуноглобулинов, в частности IgG4, ассоциируемого с выраженным фиброзом. Кроме того, известно, что выраженность фиброзных изменений прямо пропорциональна активности и агрессивности воспаления и последующему повреждению тканей. Перечисленные факторы объясняют чрезвычайно агрессивное, длительно персистирующее воспаление, характерное для ГПА, сопровождающееся выраженными фиброзными изменениями [13]. Наш пример подтверждает вышеизложенное, а также демонстрирует, что повреждение при ГПА имеет двойственное происхождение: во-первых, за счет первичной иммунопатологической реакции с вторичным повреждением в очаге воспаления под действием провоспалительных цитокинов, а во-вторых, за счет ишемии в результате васкулитов. Выраженный фиброз является следствием длительно текущего, непрекращающегося воспаления с накоплением коллагена III типа.
Заключение
Особенность клинико-морфологического наблюдения заключается в развитии тяжелого фиброза с накоплением преимущественно коллагена III типа и персистенцией гранулематозного воспаления и продуктивно-деструктивного васкулита. Представленные морфологические данные объясняют рефрактерное течение ГПА, а также крайнюю плотность орбитальный образований и целесообразность их удаления.
Лечение гранулематоза Вегенера, химиотерапия опухолей орбиты глаза
Гранулематоз Вегенера глаза (орбиты)
Гранулематоз Вегенера относится к группе заболеваний, в основе которых лежат иммунные нарушения. По неизвестным причинам при гранулематозе уровень IgA повышается, a IgM снижается. Заболевание характеризуется клинической триадой: некротизирующимся воспалением верхних отделов дыхательных путей, хроническим диффузным нефритом и системным поражением мельчайших сосудов (диффузный ангиит). Патоморфологически обнаруживают деструктивно-продуктивные и продуктивные васкулиты, полиморфно-клеточные гранулемы с многоядсрными гигантскими клетками. Гранулемы быстро подвергаются некрозу, страдают мелкие и средние артерии.
Обычно гранулематоз Вегенера начинается постепенно, выделяют три периода:
1) начальный — характеризуется локальным поражением верхних дыхательных путей, среднего уха, органа зрения;
2) генерализации, когда превалируют клинические признаки поражения внутренних органов, появляется лихорадочное состояние, больной теряет массу тела;
3) терминальный характерно появление легочпо-сердечной и почечной недостаточности.
В литературе подчеркивается трудность дифференциальной диагностики псевдотумора и гранулематоза Вегенера. По данным Е. Н. Семенковой, гранулематозом Вегенера одинаково часто болеют мужчины и женщины. Возраст больных колеблется от 3 мес. до 75 лет. Более чем у 50% больных гранулематоз может ограничиваться только орбитой.
Первый вариант клинической картины встречается чаще, подобен злокачественной опухоли орбиты. Морфологически в этот период обнаруживают интенсивное распространение гранулематозной ткани в орбите с генерализованным панваскулитом, большим количеством зон некроза, содержащих гигантские клетки. Экстраокулярные мышцы во время операции плохо дифференцируются.
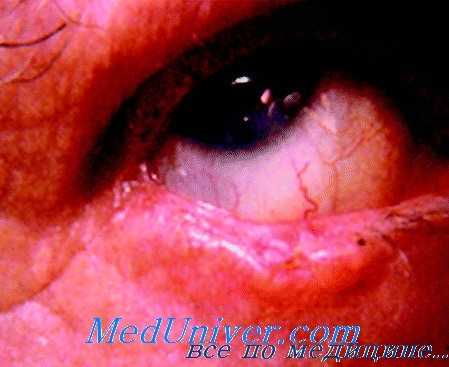
Клинически внезапно появляются односторонний, быстро прогрессирующий экзофтальм, напряженность тканей век, их плотный отек, красный хемоз. Глаз оказывается как бы ущемленным между плотными веками, подвижность его практически отсутствует, на роговице у лимба — инфильтраты, могут быть изъязвления роговицы. На глазном дне рано развивается оптическая нейропатия с ранним и неуклонным падением зрительных функций. Нарастание симптомов сопровождается сильнейшей распирающей болью в орбите. В течение нескольких недель (иногда месяцев) аналогичная картина появляется в парной орбите.
В этот период возможна обструкция носослезного канала, что обусловлено поражением слизистой оболочки носа по типу озены. Диагноз уточняют после диагностической орбитотомии и патогистологического исследования биоптата.
Второй вариант орбитального поражения гранулематоза Вегенера морфологически характеризуется наличием отдельных полей грапулематозной ткани со слабовыраженными участками некроза. В ходе операции в орбите выявляется плотная белесоватая ткань, практически бессосудистая ткань, частично замещающая орбитальную клетчатку.
При поражении орбиты на фоне генерализованного гранулематоза Вегенера диагноз не вызывает трудностей, но если процесс начинается с орбиты, что встречается не столь уж редко, дифференциация псевдотумора, злокачественной опухоли и гранулематоза Вегенера чрезвычайно сложна. Ведущим следует признать иатогистологическое исследование биоптата.
Лечение гранулематоза Вегенера орбиты заключается в длительном приеме глюкокортикоидов, циклофосфана, азатиоприпа. При рефрактерных формах пробуют применять ритуксимавон.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Цель терапии — удалить циркулирующие иммунокомплексы из сосудистой стенки, подавить воспалительные явления, вызванные их отложением и модулированием иммунного механизма, лежащего, по мнению Е. Н. Семенковой, в основе развития васкулита. Используют плазмаферез, глюкокоргикоиды, цитостатики. Наибольшее распространение получила следующая схема лечения.
При острой форме 3-4 дня назначают циклофосфан внутривенно из расчета 3-4 мг/кг массы тела, с 5-го дня — перорально 2 мг/кг в течение 6-39 мес. Возможна комбинация 2 мг/кг циклофосфана и 1 мг/кг преднизолона в течение 2-4 нед. Затем больного переводят на интермиттирующий курс лечения преднизолоном (через день) в течение 6- 12 мес. Дозу циклофосфана рекомендуется снижать только после получения полной ремиссии, но не ранее чем через 12 мес. При использовании циклофосфана в качестве иммуносупрессора отмечен более стойкий эффект.
В качестве составляющей комбинированного лечения используют комбинацию глюкокортикоидов и азатиоприна. Но, по мнению Е. Н. Семенковой, схемы лечения у каждого больного должны быть индивидуализированы.
Прогноз при нелеченом гранулематозе Вегенера крайне неблагоприятный. Имеются данные о том, что продолжительность жизни больных не превышает 5 мес, а смертность в течение года достигает 80 %. При систематическом лечении удается достичь достаточно длительной ремиссии, а при локализованной форме (поражение орбиты) — даже некоторой профессиональной и социальной реабилитации. Однако при поражении орбиты (орбит) прогноз для зрения все же остается очень неблагоприятным из-за угрозы утраты зрения. По данным литературы, на фоне лечения 4 года переживают 93% больных.
Лечение саркоидоза орбиты глаза
Хирургическое лечение саркоидоза глаза комбинируют в последующем с глюкокортикоидной терапией в течение длительного времени до достижения стойкой ремиссии. Периодически рекомендуют поддерживающие дозы. В связи с этим оперированные больные должны находиться под постоянным диспансерным контролем у офтальмолога.
Химиотерапия опухолей орбиты глаза
При злокачественных опухолях орбиты химиотерапию следует рассматривать как один из компонентов комбинированного лечения. Первые сведения об использовании цитостатиков при злокачественной опухоли орбиты принадлежат J. Roff. Он провел виутриартериальную перфузию метотрексата. Неплохие результаты получили при лечении злокачественных лимфом, орбитальной фиброзной гистиоцитомы R. Ellsworth, D. Larkin и соавт.
В связи с развитием микрохирургической техники, внедрением лазерного скальпеля, криодеструкции опухоли появилась возможность проводить сберегающие операции и при злокачественных опухолях орбиты. Показания к экзен-терации орбиты резко сократились, и одновременно расширились показания к комбинированному лечению, которое включает хирургическое вмешательство, полихимиотерапию и наружное облучение пораженной орбиты.
Однако не все злокачественные опухоли орбиты одинаково отвечают на полихимиотерапию. Собственный и накопленный в литературе опыт свидетельствует, что более эффективна она при рабдомиосаркоме орбиты. В клинической практике на протяжении многих лет использовались европейские и американские протоколы лечения. Оценивая результативность лечения рабдомиосаркомы орбиты по европейскому протоколу (ранняя лучевая терапия и полное удаление опухоли), P. Oliver и соавт. признают преимущество американского протокола, включающего и обязательную полихимиотерапию.
Сочетание полихимиотерапии и телегамматерапии позволяет у большинства больных избежать экзентерации орбиты и добиться 5-летней выживаемости в 55-70% случаев.
Прогноз хуже у детей до 10 лет, что обусловлено большей частотой у них эмбриональной рабдомиосаркомы. Среди немалого арсенала противоопухолевых препаратов при рабдомиосаркоме на протяжении длительного времени остается стандартной комбинация дактиномицина, винкристипа и циклофосфамида.
Имеется опыт использования других, более агрессивных схем полихимиотерапии, описание которых имеется в специальной онкологической литературе.
Гемосорбция при эндокринной офтальмопатии. Лечение псевдотумора
Гемосорбция — один из методов экстракорпоральной эфферентной терапии, обладает широким спектром действия. Во время гемосорбции:
- происходит детоксикация организма,
- деблокируется ретикулоэндотелиальная система,
- ускоряется фагоцитоз,
- происходит иммуномодуляция и, что очень важно,
- повышается чувствительность рецепторов клеток к глюкокортикоидам.
Перфузия крови с использованием сорбентов проводится со скоростью 80-100 мл/мин в течение 1—1,5 ч доступом к сосудам вена-вена с общей гепаринизацией (30-40 тыс. ЕД гепарина на процедуру). В целях увеличения терапевтического ответа гемосорбцию целесообразно комбинировать с глюкокортикоидной терапией. Первое введение метилпреднизолона рекомендуется начинать в конце первого сеанса гемосорбции. Курс лечения состоит из 2-3 сеансов, интервал между которыми может варьировать от одной и более недель. Клиническая эффективность комплексной терапии с включением гемосорбции у больных отечным экзофтальмом, как показывают наши наблюдения, неоднозначна — от выраженного положительного эффекта до незначительных признаков улучшения со стабилизацией патологического процесса в орбите. При положительном эффекте разница в оценочных баллах до и после лечения достигает 9,7, а при умеренном терапевтическом ответе этот показатель не превышает 6,5 балла. К положительному эффекту гемосорбции следует отнести и удлинение сроков стабилизации процесса, которые мы наблюдали у подавляющего числа больных. Ремиссия заболевания при комбинации гемосорбции с глюкокортикоидной терапией удлиняется более чем в 2 раза.
Показанием для гемосорбции являются тяжелые формы отечного экзофтальма с упорным прогрессирующим течением или случаи, резистентные к кортикостероидам. Наш опыт показывает, что назначать гемосорбцию целесообразно и тем больным, которые ранее получали бесконтрольное длительное лечение глюкокортикоидами малыми дозами.
При псевдотуморе лечение направлено прежде всего на купирование воспалительного процесса, особенно острого, и на подавление иммунной активности. Основным морфологическим субстратом псевдотумора, прежде всего первичного идиопатического миозита, является массивная лимфоцитарная инфильтрация вокруг сосудов, отдельных мышечных волокон. В биоптатах пораженных мышц обнаруживают их инфильтрацию лимфоцитами, локализующимися в эндомизии, исчезновение поперечной исчерченности в мышечных фибриллах. Глюкокортикоидная терапия направлена в первую очередь на подавление элементов воспаления. Современные представления о патогенезе псевдотумора обосновывают применение и иммунодепрессантов, в частности циклофосфана, с помощью которого осуществляется активная корреляция иммунного статуса путем воздействия на В-лимфоциты.
Схему лечения псевдотумора можно представить следующим образом.
1) глюкокортикоидная терапия:
— иммуносупрессивное действие
— иммуномодуляция
2) экстракорпоральное лечение:
— усиление фагоцитоза
— повышение чувствительности рецепторов клеток к глюкокортикоидам
Схема глюкокортикоидной терапии должна быть индивидуальной. В среднем дневная доза равна 1,5 мг/кг массы тела. Как и при эндокринной офтальмопатии, в первые дни назначают большую дозу, в последующие дни ее постепенно снижают. В тяжелых случаях, с трудом поддающихся лечению или при резистентных к глюкокортикоидам формах, целесообразно использовать один из видов экстракорпоральной терапии, например гемосорбцию, которая, как показали исследования Ю. М. Лопухина и В. И. Шумакова, временно регулирует метаболические процессы, тем самым восстанавливая нормальную деятельность регуляторных систем организма.
Наши собственные наблюдения свидетельствуют о том, что комбинация гемосорбции с пульс-терапией значительно уменьшает число больных со стероидоустойчивыми формами псевдотумора и повышает эффективность лечения. Циклофосфан в качестве иммунодепрессаита мы начали применять с 1980 г. Первоначально использовали небольшие дозы препарата (1,5 мг/кг массы тела больного) по интермиттирующей схеме, затем перешли на пероралыюе применение циклофосфана по 1—2 мг/кг в сутки на протяжении 2 нед. Сочетание цитостатиков с глюкокортикоидами дает более благоприятный терапевтический эффект: уменьшается экзофтальм, объем экстраокулярных мышц приближается к норме, нормализуется их функция, что подтверждается КТ. На фоне комбинированного лечения нормализуется офтальмотонус, который в острой стадии псевдотумора бывает, как правило, резко повышен.
Как указывалось выше, при псевдотуморе патологический процесс часто локализуется вокруг мелких сосудов или же в их стенках, появляются поражение эндотелиальпых клеток, некроз, капиллярный тромбоз. Подобное проявление васкулита связывают с повышенным содержанием IgG и IgA, следовательно, определенную роль отводят уровню В-лимфоцитов. Учитывая, что в отличие от глюкокортикоидов циклофосфан контролирует уровень В-лимфоцитов, J. Garrity и соавт. предложили высокие разовые дозы циклофосфамида при псевдотуморе с выраженным сосудистым компонентом и значительным количеством плазматических клеток, нейтрофилов и эозинофилов. Препарат в дозе 1000 мг в растворе вводят внутривенно 1 раз в неделю или I раз в 2 нед., контролируя уровень лейкоцитов. На курс требуется 4 5 инъекций.
Как правило, у больных отмечается хороший эффект: уже после двух инъекций наряду с исчезновением болевого симптома уменьшается экзофтальм, исчезает хемоз, ослабевает отек зрительного нерва, резко увеличивается объем движений экстраокулярных мышц. Однако циклофосфан может давать побочный эффект: угнетать костный мозг, вызывать кровоточивость слизистых оболочек, в т. ч. и геморрагический цистит. В подобных случаях дозу следует корректировать. Увеличение дозы глюкокортикоидов способствует уменьшению гранулоцитопении. Обильное (не менее 3 л в сутки) питье, особенно на ночь, показано при появлении микрогематурии. Возможность подобных осложнений заставляет четко определить показания к включению цитостатиков в комбинированное лечение псевдотумора. Рекомендуемая схема подходит, прежде всего, для острой формы псевдотумора, и в первую очередь васкулита. И конечно, показанием служит отсутствие явного эффекта от применения глюкокортикоидной терапии.
Трудной проблемой является терапия псевдотумора, перешедшего в стадию фиброза. По мнению J. Kennerdell и S. Dresner, любое лечение в подобной ситуации не приводит к положительному результату. На протяжении многих лет мы проводили месячные курсы лечения индометацином (метиндолом): в течение 3-5 дней назначали препарат по 25 мг 3 раза в день, затем в зависимости от индивидуальной переносимости суточную дозу повышали до 100-125 мг. Следует иметь в виду, что индометацин характеризуется отсутствием кумуляции: он полностью выводится из организма через 24 ч. Курсы повторяли после 1-2-месячного интервала.
Обоснованием для использования метиндола при явлениях фиброза в орбите послужили его фармакологические свойства. А. Вихтер и Г. Глезер показали эффективность индомстацииа при склсрозирующей форме гломерулоиефрита, когда глюкокоргикоиды не оказывали терапевтического действия. Конечно, при курсовом лечении не удавалось полностью купировать процесс у всех больных с фиброзной формой псевдотумора, но подавляющее большинство (до 75%) отмечали субъективное улучшение: исчезало чувство напряжения и скованности в орбите, заметно активнее становилась функция экстраокулярных мышц. Ремиссия тем устойчивее, чем длительнее и постояннее курсы лечения.
Следует, однако, помнить о побочных действиях препарата. Возможны диспептические явления, вплоть до развития желудочно-кишечных язв, тошнота, головокружение, боль в поджелудочной области. Все эти осложнения можно предупредить, индивидуально подбирая суточную дозу, принимая препарат во время или после еды, запивая молоком или щелочным раствором.
В последние годы появилось много новых, современных нестероидных противовоспалительных средств. Однако лечение псевдотумора в стадии склероза все еще остается неразрешимой проблемой.
Рак носоглотки - симптомы и лечение
Что такое рак носоглотки? Причины возникновения, диагностику и методы лечения разберем в статье доктора Опря Анны Николаевны, онколога со стажем в 12 лет.
Над статьей доктора Опря Анны Николаевны работали литературный редактор Вера Васина , научный редактор Татьяна Остринская и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
Рак носоглотки (Nasopharyngeal cancer) — это злокачественная опухоль верхней части глотки. На ранних стадиях болезнь протекает бессимптомно или маскируется под другие заболевания, например под острые респираторные инфекции. Одним из первых проявлений рака носоглотки могут стать увеличенные шейные лимфоузлы.
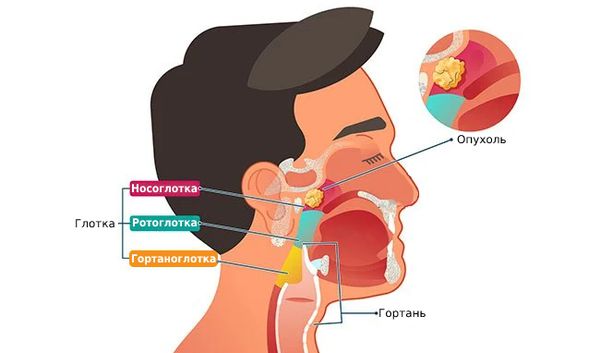
В 70 % случаев в носоглотке развивается плоскоклеточный рак — опухоль, исходящая из клеток эпителия слизистой оболочки [3] .
Но могут встречаться и другие злокачественные новообразования:
- исходящие из малых слюнных желёз (аденокарцинома);
- из мягких тканей (саркома);
- из лимфоидной ткани (лимфома);
- из нейроэпителия (эстезионейробластома) [1] .
Распространённость рака носоглотки
В России на рак носоглотки приходится 0,1–0,2 % от всех онкологических болезней. Самая высокая заболеваемость в двух возрастных группах: в 15–25 и 40–60 лет. Мужчины болеют раком носоглотки примерно в пять раз чаще, чем женщины [2] [3] .
Причины рака носоглотки
Причины заболевания до конца не изучены, но известно, что основным фактором развития болезни является вирус Эпштейна — Барр [6] . Этим вирусом заражено более 90 % населения планеты, зачастую заболевание протекает без симптомов и не вызывает осложнений. Лишь у немногих заражённых инфекция становится хронической, что впоследствии может привести к раку [15] .
К другим факторам развития рака носоглотки относятся:
- Хронические воспалительные процессы, вызывающие гиперплазию и метаплазию слизистой оболочки носоглотки, т. е. разрастание и преобразование тканей.
- Анатомические особенности некоторых рас. Рак носоглотки чаще встречается среди народов Юго-Восточной Азии, Африки и Индокитая.
- Профессиональные факторы. Риск развития заболевания выше при работе, связанной с воздействием тепла, пара и пыли. Чаще заболевают сварщики, печники, пекари, кочегары, кузнецы, операторы кузнечных прессов, работники деревообрабатывающей и текстильной промышленности [6] .
- Частое потребление солёной консервированной рыбы. Предположительно, если есть её ежедневно, риск развития рака повышается в несколько раз. Потребление других консервированных продуктов также может повышать риск развития болезни [6] .
В исследовании, проведённом в США, две трети случаев рака носоглотки I типа были связаны с курением, но для II и III типа такую взаимосвязь не выявили [6] . Также не доказано, что рак носоглотки чаще возникает при употреблении алкоголя.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы рака носоглотки
На ранних стадиях рак носоглотки протекает бессимптомно или скрывается под маской острых респираторных инфекций, ринофарингита и аденоидных вегетаций. Кроме того, опухоль не видна и не прощупывается, поэтому часто её выявляют только на поздних стадиях.
Симптомы рака носоглотки зависят от расположения опухоли и направления её роста.
Можно выделить следующие проявления болезни:
- Со стороны полости носа — периодические носовые кровотечения, примесь крови в слюне и прогрессирующая заложенность носа.
- Ушные — пощёлкивание и боли, заложенность уха, ухудшение слуха, односторонний рецидивирующий средний отит.
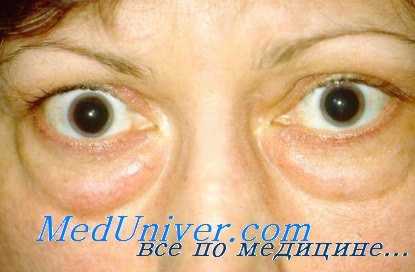
- Офтальмологические — выпячивание и смещение глазного яблока, опущение верхнего века, косоглазие, снижение остроты зрения и двоение в глазах.
- Расстройство глотания и произношения звуков, провисание мягкого нёба, гнусавость.
- Неврологические — поражение черепно-мозговых нервов может привести к онемению лица, неподвижности половины гортани, отклонению языка в сторону и другим симптомам, связанным с параличом черепно-мозговых нервов. Чаще всего поражаются 3, 5, 6 и 12-й черепные нервы [1][16] .
Боль и затруднения при глотании, возникающие при других видах рака головы и шеи, редко встречаются на ранней стадии рака носоглотки, поскольку очаг находится выше ротоглотки.
Для рака носоглотки характерны метастазы, поражающие шейные лимфоузлы. Нередко первым и единственным симптомом становится их увеличение с одной или обеих сторон шеи, по поводу таких лимфоузлов пациент и обращается к врачу.
Неврологические, офтальмологические и другие симптомы, как правило, возникают на III–IV стадиях. К поздним проявлениям также относят спазм жевательной мускулатуры и головную боль [16] .
Патогенез рака носоглотки
Вирус Эпштейна — Барр связан с несколькими злокачественными опухолями: раком носоглотки, лимфомой и карциномой желудка. Инфекция передаётся через жидкости организма, особенно через слюну, а также половым путём.
Считается, что ядерный антиген вируса Эпштейна — Барр, т. е. его специфический белок, может поражать эпителиальную оболочку носоглотки и приводить к злокачественному перерождению тканей [16] .
Раковые опухоли носоглотки, связанные с вирусом Эпштейна — Барр, представляют собой недифференцированные карциномы с выраженной лимфоидной инфильтрацией — это означает, что опухоль содержит много лимфоцитов . Взаимодействие раковых клеток с лимфоцитами приводит к тому, что клетки опухоли распространяются через лимфоток и развиваются метастазы [1] .
Чаще всего ведущая роль в развитии рака носоглотки при вирусе Эпштейна — Барр принадлежит геномным изменениям, при которых активируется сигнальный путь NF-κB [5] . Этот путь связан с развитием воспаления, делением клеток и программируемой клеточной гибелью. Особую роль он играет в развитии B-лимфоцитов: при недостаточной активности NF-κB созревающие лимфоциты гибнут раньше времени, а при повышенной — могут развиваться злокачественные опухоли.
Вирус Эпштейна — Барр способен активировать путь NF-κB, а также механизмы уклонения от иммунитета, что приводит к неконтролируемому делению клеток и развитию рака [5] .
Связь потребления солёной рыбы с развитием рака объясняется тем, что консервирование в соли неэффективно и может приводить к частичному разложению рыбы. В результате в ней накапливаются нитрозамины. Считается, что они вызывают повреждение ДНК и хроническое воспаление в слизистой оболочке носоглотки, что способствует развитию рака [17] . Такая рыба содержит и другие вещества, которые активируют вирус Эптштейна — Барр и могут повышать риск развития рака [6] .
Классификация и стадии развития рака носоглотки
Согласно классификации Всемирной организации здравоохранения, выделяют три подтипа карциномы носоглотки:
- Ороговевающая плоскоклеточная карцинома, или кератинизирующий плоскоклеточный рак. В 85 % этот тип рака связан с вирусом Эпштейна — Барр.
- Неороговевающая плоскоклеточная карцинома. Бывает дифференцированной и недифференцированной, причём второй тип такой карциномы — самая распространённая форма рака носоглотки.
- Базалоидная плоскоклеточная карцинома — редкий тип опухоли [1][16] .
Международная классификация рака носоглотки по системе TNM (2017 г.) [7]
Наглядно это можно показать так:
Осложнения рака носоглотки
Характер осложнений зависит от распространения рака:
- При прорастании опухоли в область глазницы пациент может потерять зрение.
- При опухолях в области ротоглотки возникает спазм жевательных мышц, нарушается жевание и глотание, что способствует истощению и потере веса.
- Распространение опухоли в кости черепа и головной мозг может вызывать сильную головную боль. При сдавливании нервной ткани может нарушиться дыхание и речь.
- Массивная опухоль проявляется интенсивными носовыми кровотечениями. При распаде опухоли появляется неприятный гнилостный запах изо рта.
- При выраженном поражении шейных лимфоузлов затруднена подвижность шеи, возникает боль в ней, из-за чего нарушается сон[4] .
При распространённом онкологическом процессе, наряду с сильной болью в области головы и/или шеи, может развиться кахексия, анорексия и анемия, что проявляется, прежде всего, выраженной слабостью [18] [19] .
Диагностика рака носоглотки
Лабораторная диагностика
При первичной диагностике, а также для дальнейшей оценки эффективности лечения может проводиться анализ крови на вирус Эпштейна — Барр (количественное определение ДНК методом ПЦР) [9] . С помощью этого анализа можно быстро и недорого оценить эффективность лечения.
Инструментальная диагностика
- Эндоскопия носоглотки — для постановки диагноза проводится осмотр первичной опухоли. Наилучший обзор достигается с помощью гибкого или жёсткого носового эндоскопа. При заполнении опухолью всей полости носоглотки наиболее информативен осмотр через полость рта с помощью 30 ° или 70 ° жёсткого гортанного эндоскопа [1] . Если эндоскопа нет, может использоваться носоглоточное зеркало [11] .
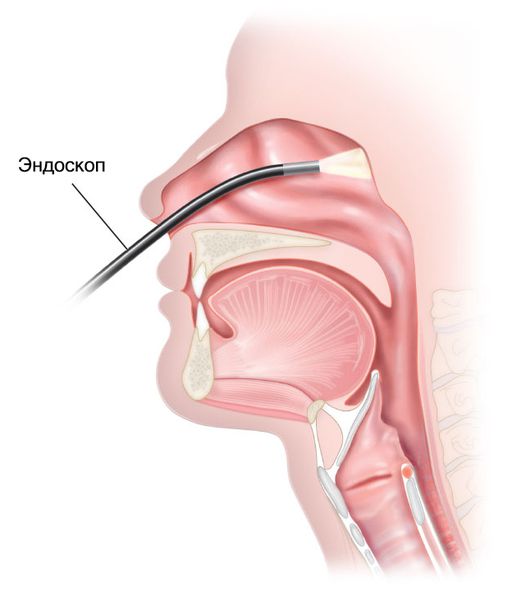
- МРТ (предпочтительно) и/или КТ носоглотки с контрастом — позволяют оценить распространение опухоли и определить стадию болезни.
- УЗИ шейных лимфоузлов — можно выявить изменённые лимфатические узлы. В сочетании с биопсией позволяет подтвердить или исключить метастазы в лимфоузлах.
- УЗИ брюшной полости и забрюшинного пространства — позволяет выявить метастазы в печени и сопутствующие патологии (кисту, мочекаменную болезнь, аденому надпочечников, цирроз печени и др.). Если обнаружены узловые образования, то для уточнения их характера проводится КТ или МРТ брюшной полости с контрастом.
- КТ грудной клетки — позволяет выявить или исключить метастазы в лёгких и сопутствующие болезни (туберкулёз, пневмонию, саркоидоз и др.).
- ПЭТ-КТ — показана при подозрении на распространённый процесс. Также это обследование проводят после лучевой или химиолучевой терапии, чтобы подтвердить полное рассасывание метастазов, выявить возможный рецидив и понять, нужна ли операция по удалению лимфоузлов (лимфаденэктомия) [1][3] .
Биопсия
Для гистологического подтверждения диагноза выполняется биопсия. Образец ткани берут через нос или через рот.
Консультации других врачей
До и после лечения пациентам потребуются консультации смежных специалистов:
- Стоматолог — обучает правильной гигиене полости рта и при необходимости проводит лечение зубов и дёсен. Санация полости рта, проведённая до начала лучевой терапии, позволяет снизить частоту и тяжесть лучевых мукозитов. При выраженном мукозите приходится делать перерыв в лучевой терапии, что плохо влияет на результаты лечения.
- Эндокринолог — консультация проводится после лучевой терапии. Она необходима, потому что после лечения, в среднем через 6–12 месяцев, может развиться постлучевой гипотиреоз. Врач оценивает уровень тиреотропного гормона (ТТГ) через 6, 12,18, 24 месяца после лечения. Также может потребоваться УЗИ щитовидной железы.
- Репродуктолог — консультирует молодых пациентов перед химиотерапией по вопросам фертильности [11] .
По показаниям может потребоваться консультация офтальмолога, оториноларинголога, сурдолога и логопеда.
Оценка нутритивного статуса
Нутритивная поддержка — это лечебное питание, цель которого обеспечить организм всеми необходимыми веществами. Нутритивная поддержка позволяет скорректировать уровень макро- и микронутриентов, улучшить переносимость и ослабить побочные эффекты химио- и лучевой терапии, повысить качество жизни.
Онколог оценивает нутритивный статус как до лечения, так и на всех этапах терапии.
Необходимость нутритивной поддержки определяется по следующим показателям: индекс массы тела (ИМТ) меньше 20, похудение более чем на 5 % за полгода, невозможность есть через рот, среднее или тяжёлое поражение тонкого кишечника, уровень белка в плазме крови менее 60 г/л, уровень альбумина менее 30 г/л. При лечении эти показатели желательно оценивать раз в 7 дней.
Дифференциальная диагностика
Рак носоглотки следует отличать:
- от плоскоклеточной и инвертированной папилломы;
- доброкачественных и злокачественных заболеваний малых слюнных желёз (онкоцитомы, полиморфной аденомы, аденокарциномы, цистаденокарциномы);
- доброкачественных и злокачественных новообразований мягких тканей (юношеской ангиофибромы, нейрофибромы, шванномы, хемодектомы, фибросаркомы, рабдомиосаркомы, нейрофибросаркомы);
- опухолей лимфоидной и кроветворной ткани (лимфосаркомы, ретикулосаркомы, плазмоцитомы, болезни Ходжкина);
- опухолей смешанного происхождения (солидной тератомы, дермоидной кисты, гипофихарной аденомы, менингиомы, хордомы, краниофарингиомы); ;
- эстезионейробластомы;
- метастазов других опухолей в носоглотку, но такие случаи очень редки;
- опухолеподобных состояний (псевдоэпителиальной гиперплазии, онкоцитарной метаплазии и гиперплазии, кисты, гемангиомы, фиброматоза, амилоидоза, инфекционной гранулёмы, гранулёмы Стеварта, гранулематоза Вегенера); и полипозного риносинусита [4] .
Лечение рака носоглотки
Злокачественные опухоли носоглотки высокочувствительны к химио- и лучевой терапии, поэтому эти методы предпочтительны для первичного лечения [11] .
При I стадии рака носоглотки показана лучевая терапия [3] . На этой стадии её проводят без химиотерапии: не доказано, что химиолучевое лечение повышает выживаемость по сравнению с лучевой терапией, но побочных эффектов возникает больше.
При II–IVA стадиях рекомендуется провести химиолучевую терапию с последующей химиотерапией или химио-, а затем химиолучевую терапию [3] . Если после проведённого лечения останутся метастазы в шейных лимфоузлах, потребуется операция. Хирургически удалить опухоль носоглотки очень сложно, поэтому в качестве первичного лечения операция не рассматривается [1] .
При IVB стадии (наличии отдалённых метастазов) назначается химиотерапия с препаратами платины [8] . После химиотерапии может проводиться лучевая и химиолучевая терапия, симптоматическое лечение, операция (при единичном метастазе) [3] .
Основной побочный эффект лучевой терапии в области головы и шеи — это мукозит (эпителиит), который проявляется болью и воспалением слизистой оболочки полости рта. При заболевании затруднён приём пищи, тяжело говорить, иногда трудно открывать рот. Полностью предотвратить это осложнение нельзя, но его течение можно облегчить. Для этого до лечения нужно обратиться к стоматологу, чтобы провести санацию полости рта, а также соблюдать рекомендации врача во время терапии.
Самым грозным осложнением лучевой терапии является остеомиелит. Как правило, заболевание развивается при удалении зуба после лучевой терапии. Удалять плохие зубы нужно за 14 дней до лучевой терапии, в течение двух лет после лечения следует избегать манипуляций, затрагивающих кость челюсти.
Прогноз. Профилактика
Прогноз зависит от времени постановки диагноза, степени распространения опухоли в носоглотке и наличия метастазов [16] . Пятилетняя выживаемость при I стадии составляет 98 %, при II стадии — 92 %, при III стадии — 83 %, при IVA стадии —71 % [12] .
Высокие изначальные или сохраняющиеся к концу лучевой терапии уровни ДНК вируса Эпштейна — Барр являются признаком неблагоприятного прогноза [14] [16] .
Профилактика рака носоглотки
Первичная профилактика. В некоторых исследованиях выявлено, что риск развития рака носоглотки снижается при употреблении фруктов и овощей: моркови, китайской капусты, зелёных листовых овощей, свежих соевых продуктов, апельсинов и мандаринов. Также риск развития болезни был ниже при приёме витаминов Е, С, А по отдельности или в сочетании. Защитное действие фруктов и овощей можно объяснить тем, что они оказывают антиоксидантный эффект и предотвращают образование нитрозаминов [6] .
При наличии профессиональных факторов риска снизить вероятность развития рака носоглотки можно с помощью средств защиты.
Не существует стандартных скрининговых тестов для определения рака носоглотки. Скрининг с тестом на антитела к вирусу Эпштейна — Барр или на ДНК вируса не помог снизить смертность от рака носоглотки [13] .
Вторичная профилактика заключается в знании симптомов, своевременном обращении за медицинской помощью и онконастороженности врачей — повышенной бдительности к симптомам, которыми может проявляться рак.
Во время лечения важно предотвратить развитие побочных эффектов, чтобы не пришлось прерывать цикл терапии. При прохождении химиотерапии рекомендуется заниматься ЛФК, будет полезна психологическая поддержка и курс массажа для уменьшения слабости. Также следует лечить стоматит, гематологические осложнения, ксеростомию и спазм жевательных мышц [3] [10] [20] .
Курильщикам необходимо бросить курить, а бывшим курильщикам воздержаться от курения [11] .
После завершения лечения нужно посещать врача:
- в первый год — раз в 1–3 месяца;
- во 2-й год — раз в 2–6 месяцев;
- на 3–5-й год — каждые 4–8 месяцев, далее раз в год.
При возникновении новых симптомов необходимо сразу же обратиться к врачу.
Читайте также:
