Лечение острых лучевых поражений. Принципы
Добавил пользователь Валентин П. Обновлено: 31.01.2026
Радиационными (лучевыми) поражениями называются патологические изменения в организме, возникающие в результате воздействия на него ионизирующего излучения. В мирное время радиационные поражения могут наблюдаться в случаях нарушения техники безопасности при работе с радиоактивными источниками.
Под влиянием ионизирующего излучения в организме образуются вещества, обладающие высокой химической активностью, в первую очередь продукты радиолиза воды, возникают нарушения молекулярных связей на клеточном уровне, прежде всего в клетках кроветворения, кишечного эпителия, половых желез. Характер и выраженность радиационных поражений зависит от вида ионизирующего излучения, его дозы, времени облучения, возраста и пола пациентов.
Какова клиническая картина радиационного поражения в начальном и латентном периоде?
Начальный период проявляется местными и общими реакциями, которые продолжаются от нескольких часов до нескольких суток. В этот период наблюдается покраснение кожи, тошнота, рвота, слабость, головная боль, повышение температуры тела. При высокой дозе облучения наблюдаются расстройства сознания.
Последующий латентный (скрытый) период длительностью от 2 до 4-5 недель протекает на фоне улучшения самочувствия больных, сопровождаясь, однако, патологическими изменениями в органах и тканях.
Какова клиническая картина радиационного поражения в период выраженных клинических проявлений?
Период выраженных клинических проявлений характеризуется тяжелым поражением кроветворной системы, кишечника, подавлением иммунитета, интоксикацией, повторными кровотечениями, присоединением инфекционных осложнений и сменяется при благоприятном течении через 2-3 недели периодом восстановления функций пораженных органов и улучшением состояния больных.
Радиационные поражения, возникающие при действии высоких доз ионизирующего излучения (свыше 600 рад.) протекают значительно тяжелее, приводя нередко к смертельному исходу иногда уже в первые сутки после облучения.
Каковы основные принципы оказания первой помощи пострадавшему при радиационных поражениях?
Первая помощь при радиационном поражении заключается в выводе пострадавшего из зоны радиационного заражения, проведения (в случаях радиоактивного загрязнения) полной санитарной обработки. С целью выведения попавших в организм радиоактивных изотопов (радионуклидов) промывают желудок, ставят очистительные клизмы. В качестве специфических антидотов используют вещества, образующие прочные комплексы с радионуклидами. Так при попадании внутрь радиоактивных нуклидов радия и стронция применяют сульфат бария, для профилактики поражения радиоактивным йодом используют йодид калия.
Как проводится оказание неотложной помощи в остром периоде радиационного поражения?
В остром периоде лучевого поражения для уменьшения тошноты и рвоты назначают инъекции атропина и аминазина, а при явлениях сердечно-сосудистой недостаточности - введение адреналина, сердечных гликозидов, кровезамещающие препараты. Для профилактики инфекционных осложнений применяют антибактериальные препараты под контролем содержания лейкоцитов в крови, для борьбы с интоксикацией организма - внутривенное капельное введение изотонического раствора хлорида натрия, 5 % раствора глюкозы, гемодеза, реополиглюкина, а для повышения содержания лейкоцитов, эритроцитов и тромбоцитов - переливание крови, лейкоцитарной, эритроцитарной и тромбоцитарной массы. В тяжелых случаях ставят вопрос о пересадке (трансплантации) костного мозга.
Каковы особенности ухода за больными, подвергшимися лучевому поражению?
Большое значение имеет организация правильного ухода за больными с радиационными поражениями. Учитывая высокую частоту возникновения у них инфекционных осложнений, таких пациентов размещают в изолированные боксированные палаты, в которых систематически проводят обеззараживание воздуха с помощью бактерицидных ламп. При входе в палату медицинский персонал навевает дополнительный халат, марлевые респираторы, а также обувь, находящуюся на коврике, смоченном 1 % раствором хлорамина. Предупреждению инфекционных осложнений способствует тщательный уход за полостью рта и кожными покровами пострадавшего. На пораженные участки кожи накладывают повязки, смоченные раствором фурацилина или риванола. Поскольку после воздействия ионизирующего излучения, как правило, наблюдаются тяжелые поражения пищеварительного тракта, включая слизистую оболочку рта и глотки, для кормления таких больных часто применяют зонд, вводимый через носовые ходы, а также используют парентеральное питание.
Лечение острых лучевых поражений. Принципы
В условиях нынешней политической обстановки в мире вероятность нанесения ядерного удара конечно же ниже, чем во времена холодной войны. Однако, учитывая изложенные выше факты о пропажах компонентов ядерного оружия, всегда необходимо быть готовым к худшему сценарию. Спектр острых и отсроченных поражений в результате ядерного взрыва будет включать взрывные, термические, механические и проникающие ранения, а также острые и отдаленные последствия радиоактивного облучения.
В отличие от ядерного взрыва и следующего за ним облучения в довольно значительных дозах, использование устройств для рассеивания радиоактивных материалов скорее всего не вызовет значительного радиоактивного загрязнения окружающей среды и развития у пострадавших острой лучевой болезни. При взрыве такого устройства у пациентов будут наблюдаться в основном взрывные ранения и последствия ранений первичными снарядами, содержащими радиоактивные изотопы. Лечение таких пациентов должно осуществляться согласно стандартам лечения закрытых и проникающих ранений.
При выборе между оперативным и консервативным лечением проникающих ранений следует принимать во внимание риск продолжающегося облучения тканей, связанного с наличием в организме радиоактивных изотопов. Результаты лечения пациентов с комбинированными — механическими и радиационными — поражениями хуже, чем при изолированных механических или радиационных поражениях. Термические ожоги, возникающие в результате радиоактивного облучения, имеют более серьезный прогноз, чем обычные ожоги.

При развитии описанных выше сценариев радиоактивного загрязнения в ходе и/или после стабилизации состояния пострадавших необходимо выполнить их стандартную деконтаминацию. Объем и инвазивность деконтаминации определяются физическими свойствами источника радиации, наличием или отсутствием открытых ранений и потенциальным риском длительного наружного или внутреннего облучения.
Как правило, снятие с пострадавшего загрязненной одежды и обуви позволяет снизить степень наружного радиоактивного заражения на 90%. Использование портативных детекторов радиации позволяет оценить степень остаточного радиоактивного загрязнения. Деконтаминация должна снизить уровень радиоактивного загрязнения более чем в два раза от фонового уровня радиации окружающей среды.
Риск радиационного поражения медицинского персонала также нивелируется проведением адекватной деконтаминации: «пациент прекращает быть источником излучения». В случаях же, когда выполняется внутренняя деконтаминация и удаление зараженных и радиоактивных объектов и материалов, необходимо соблюдать меры предосторожности, рекомендованные специалистами по радиационной защите медицинского учреждения. Назначение слабительных и лаваж трахеи и бронхиального дерева позволят удалить из организма радиоактивные частицы, попавшие туда алиментарным или воздушным путем.
После проведения деконтаминации необходимо обратить внимание на открытые ранения и ожоги. Загрязнение ожоговых и обычных ран радиоактивными материалами несет в себе гораздо более высокий риск неудовлетворительного результата лечения и даже летального исхода таких повреждений, тогда необходима адекватная обработка этих ранений. Закрытие таких ран или оставление их открытыми является спорным вопросом, решение которого должно приниматься путем тщательного взвешивания рисков замедленного заживления ран и развития инфекции в условиях закрытой раны у пациента со скомпрометированным иммунологическим статусом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
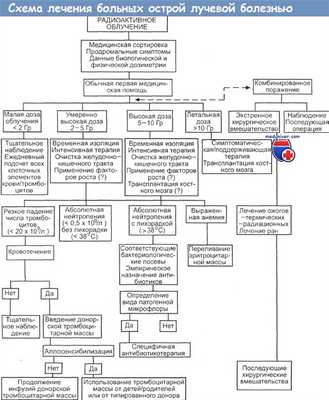
Принципы и схема лечения больных острой лучевой болезнью
а) Распределение пораженных по трем группам. На первом этапе основное внимание следует уделять не конкретному диагнозу радиационного поражения, а распределению пораженных на три категории: вряд ли подвергшихся облучению вообще; вероятно, получивших определенную дозу облучения и тяжело пораженных.
б) Лица, вряд ли подвергшиеся облучению. Отсутствие каких бы то ни было симптомов лучевой болезни. Возвращение к обычным обязанностям, если нет других травм и заболеваний.
в) Лица, вероятно, получившие дозу облучения. Отмечаются анорексия, тошнота и рвота. Число лимфоцитов в периферической крови является индикатором, позволяющим оценить состояние пациента. Никакой терапии по поводу лучевой болезни в первые дни не требуется. Ведение таких больных в первую очередь подразумевает лечение травм.
Следить нужно за функцией желудочно-кишечного тракта и за проявлениями гематологического синдрома.
г) Лица, тяжело пораженные. Очень раннее появление тошноты, рвоты, анорексии, профузного поноса, гипотензии и неврологических расстройств. Доза потенциально смертельная. Подтверждение можно получить, если произвести подсчет числа лимфоцитов. Назначается симптоматическая терапия при наличии условий для ее проведения.
- 50 Гр (5000 рад) — смертельный исход наступает неизбежно в течение 24—48 ч.
- От 30 до 50 Гр (3000—5000 рад) — с первых минут до нескольких часов: тяжелый продромальный период с неукротимой рвотой, диареей, лихорадкой, дегидратацией, комой. Смерть наступает через несколько дней. Больные погибают до того, как в периферической крови появятся признаки угнетения функции костного мозга. Показаны кровезаменители, анальгетики, симптоматическая терапия.
- От 5 до 20 Гр (500—2000 рад) — выживание возможно. Рано появляются признаки поражения ЦНС и сердечно-сосудистой системы. Течение пролонгировано. Продрома длится от 1 до 2 дней. Латентный период равен 1—2 нед. Острая лучевая болезнь (гематологический и желудочно-кишечный синдромы). Самая активная терапия, направленная на сохранение жизни пострадавшего: показаны кровезаменители, электролиты, антибиотики, переливание тромбомассы и эритромассы, трансплантация совместимого аллогенного костного мозга полное типирование тканей и перекрестное сопоставление признаков (crossmatching) до того момента, когда разовьется глубокая лимфоцитопения.
- От 2 до 5 Гр (200-500 рад). Летальная доза, если не проводится никакого лечения. При оптимальной терапии многие выживают. Объективные признаки и симптомы такие же, как в перечисленных выше группах, но они отмечаются в более отдаленные сроки и не столь резко выражены. Фаза угнетения костного мозга составляет 3—4 нед. Если больной выздоравливает, то этот процесс начинается на 6-й неделе и занимает от 2 до 3 нед.
Самая активная терапия, направленная на сохранение жизни: лечение бактериальных инфекций, борьба с синдромом кровоточивости, электролитными нарушениями, восполнение кровопотери. Пересадка костного мозга не рекомендуется, поскольку пострадавший в состоянии выжить без нее. Донорский костный мозг не может прижиться без индукции еще большей иммуносупрессии.
- От 1 до 2 Гр (100-200 рад). Пострадавший выживает. Требуется лишь небольшое лечебное вмешательство или необходимости в нем может совсем не возникнуть. У 15 % пациентов возможно появление объективных признаков и симптомов при уровне дозы, равном 1 Гр (100 рад) [Thomas]. Минимально выраженные или отсутствующие рвота и диарея, легкие симптомы на поздних стадиях. Небольшие изменения в формуле крови при наблюдении в динамике.
Генетические последствия и патология внутренних органов наблюдаются только при облучении в относительно больших дозах [обычно >1 Гр (> 100 рад)]. Никаких данных о развитии биологических эффектов у человека при воздействии низких уровней радиации нет.
- Низкие дозы облучения. Однократное воздействие радиации в дозе 0,1 Гр (10 рад) или немного большей за много дней рассматривается как слабое облучение. В Соединенных Штатах на уровне моря фоновое излучение колеблется от 0,7 до 1,5 мГр (от 70 до 150 мрад в год). Катание на лыжах или подъем в горы на большие высоты увеличивает интенсивность воздействия радиации в 2 или 3 раза. Еще более высокие уровни действуют при воздушных перелетах.
Оказывается, что даже разрешенный в настоящее время уровень облучения, равный 5 рем за год, при воздействии на все тело для работающих на атомных электростанциях фактически нельзя считать "безопасным".
Когда речь идет о воздействии слабого излучения, актуальная патология редка и, как в случае с раком, начало болезни отдалено по времени более чем на тридцатилетний период, выявление всех значимых причинно-следственных связей сильно затруднено. На сегодняшний день невозможно точно определить взаимосвязь между ионизирующим облучением малой мощности и развитием злокачественных опухолей, и вряд ли данную проблему удастся разрешить в ближайшем будущем.
Введение
Материал и методы
В Центре накоплена информация о 232 больных с МЛП, которые находились на лечении в этом учреждении в остром периоде лучевого поражения, а также наблюдались в отдаленные сроки после радиационной аварии. Длительность наблюдения колебалась от 1 до 43,5 (в среднем 13,3 ± 1,3) лет. Периодом отдаленных последствий считался период, начинавшийся спустя 1 год после лучевого воздействия. 75 человек пострадали в результате воздействия гамма‑ бета‑излучения, 99 – от гамма‑излучения, 16 – от гамма‑нейтронного, 18 – от рентгеновского, 12 – от бета‑излучения, 8 – от воздействия пучка электронов, 4 – от воздействия пучка протонов.
МЛП I (легкой) степени тяжести выявлены у 74 больных, МЛП II (средней) степени – у 132 больных, МЛП III (тяжелой) степени – у 127 больных и МЛП IV (крайне тяжелой) степени – у 49 больных (табл. 1). Необходимо отметить, что у одного больного, как правило, наблюдались очаги поражения разной степени тяжести (например, МЛП I–IV или МЛП I, II степени), поэтому в приводимых таблицах число случаев МЛП различной степени тяжести может превышать количество больных в группе.
Количество случаев МЛП различной степени тяжести в компьютерной базе данных Центра
Из 232 больных у 72 человек наряду с МЛП была диагностирована острая лучевая болезнь (ОЛБ) различной степени тяжести (табл. 1). Среди больных, у которых была диагностирована ОЛБ, наблюдалось 49 случаев МЛП I, 34 – МЛП II, 26 – МЛП III, 17 – МЛП IV степени тяжести. Среди них 45 человек пострадали от гамма‑бета‑, 13 – от гамма‑, 14 – от гамма‑нейтронного воздействия. В работе использованы методы вариационной статистики (программа для ПК Biostat).
Результаты
Клиническая картина МЛП различной степени тяжести в периоде основных клинических проявлений
Клинические признаки МЛП, соответствующие различным степеням тяжести раневого процесса, приведены в табл. 2.
Основные клинические проявления по периодам развития и уровни поглощенных доз (кратковременное гамма-облучение) при МЛП различных степеней тяжести
Минимальные клинические проявления в виде гиперемии и слабого отека характерны для МЛП легкой степени тяжести. При подобном поражении эпителизация наступает всегда. развитие раневого процесса заканчивается сухим шелушением.
При средней, тяжелой и крайне тяжелой степенях МЛП на фоне отёка и гиперемии возникает отслойка эпидермиса и формируются пузыри. Пузыри вскрываются самостоятельно, обнажается язвенная поверхность. Самопроизвольная эпителизация происходит при МЛП средней степени тяжести. При тяжелой и крайне тяжелой степени поражения язвы превращаются в некротические, инфицируются и практически не заживают при консервативном лечении.
В отдаленном периоде на месте бывших острых лучевых язв и эрозий можно наблюдать выраженные рубцово‑атрофические изменения с пигментацией, множественными телеангиоэктазиями, гиперкератозом, поздними лучевыми язвами. В отдельных случаях возможно злокачественное перерождение тканей, особенно при гиперкератозе [5–8]. Однако следует указать, что развитие лучевого рака более характерно для последствий многолетнего хронического переоблучения [9–11].
Отдаленные последствия МЛП
Последствия МЛП являются основной причиной стойкой инвалидизации в отдаленные сроки у пострадавших в радиационных авариях.
Частота и клинические проявления отдаленных последствий МЛП различной степени тяжести (I–IV), вызванных действием различных видов ионизирующего излучения, по данным компьютерной базы данных клиники Центра, представлены на рис. 1–4.
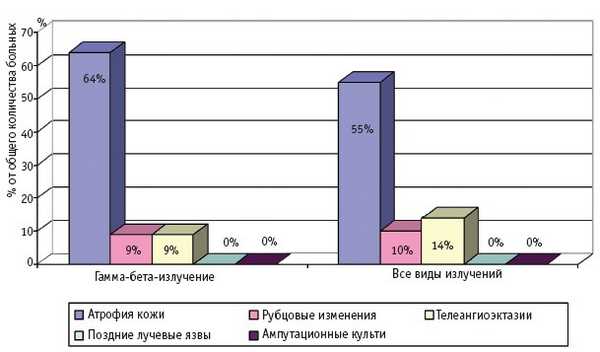
Рис. 1. Отдаленные последствия МЛП I степени тяжести
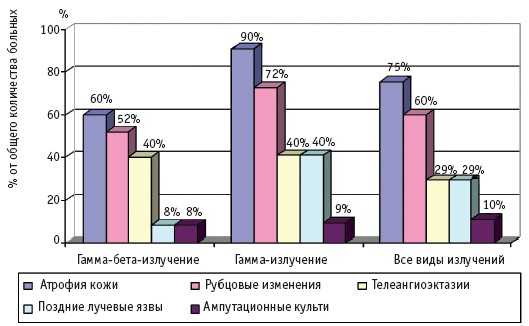
Рис. 2. Отдаленные последствия МЛП II степени тяжести
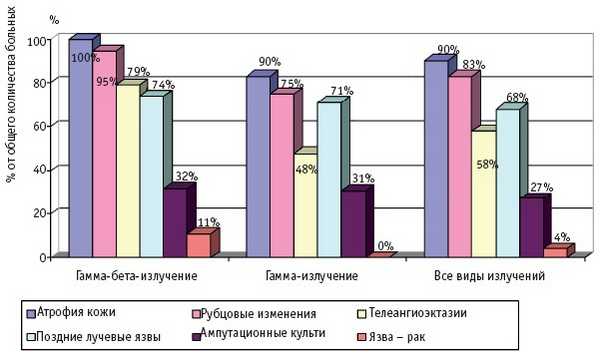
Рис. 3. Отдаленные последствия МЛП III степени тяжести
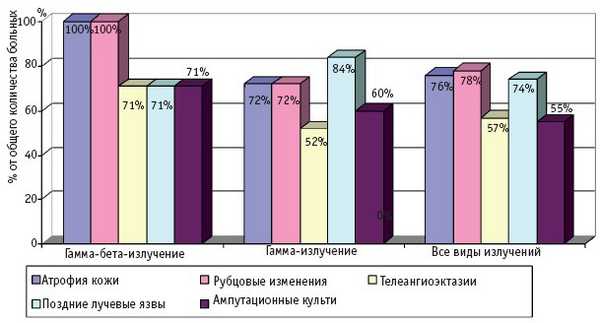
Рис. 4. Отдаленные последствия МЛП IV степени тяжести
Интересной находкой явилось обнаружение в периоде отдаленных последствий новообразований кожи: у 4 больных (у двух больных с МЛП, у двух с сочетанием ОЛБ и МЛП) в области длительно существовавших, не леченных хирургическим путем поздних лучевых язв был обнаружен высокодифференцированный плоскоклеточный рак кожи (рис. 3); у 5 больных – базальноклеточный рак кожи. Базалиомы были обнаружены у больных, перенесших ОЛБ I–IV степени и МЛП IV. Надо отметить, что появление базалиом отмечено на коже вне зоны последствий МЛП, поэтому эта нозология не вынесена на рис. 4.
Лечение МЛП и их отдаленных последствий
Несмотря на более чем столетнюю историю изучения МЛП, вопрос выбора тактики лечения остается очень сложным. С целью оценки эффективности лечения МЛП были проанализированы все группы больных с поражениями различной степени тяжести. Из исследования исключены пострадавшие, которые находились в клинике только в остром периоде и не наблюдались в периоде последствий.
Выбор методов лечения производится в зависимости от локализации МЛП, стадии развития раневого процесса, состояния окружающих тканей и площади МЛП.
Консервативное лечение в той или иной степени проводилось у всех 232 больных. На разных стадиях развития раневого процесса оно включало применение противоожоговых средств (лиоксазоль, пантенол), ингибиторов протеаз (контрикал, гордокс, октреотид), обезболивающих препаратов, антибиотиков, пентоксифиллина, средств, стимулирующих регенерацию (метилурацил, солкосерил, актовегин), антисептических растворов, различных перевязочных средств с нанесенными лекарственными препаратами и др.
Консервативными методами ограничивалось лечение только при МЛП легкой степени тяжести. Проанализированы случаи МЛП I степени тяжести от воздействия различных видов ионизирующего излучения. Условием подбора группы было наличие у пациентов только МЛП легкой степени. При наличии у одного пациента очагов МЛП различной степени тяжести больной включался в группу по максимальной степени тяжести (например, при МЛП II–III степени тяжести – в группу МЛП III степени), так как считалось, что наиболее выраженные последствия МЛП у данного пациента будут следствием острого МЛП наибольшей степени тяжести.
Консервативное лечение при МЛП легкой степени не требовало большой активности и в острой фазе приводило к полной эпителизации дефекта. Хирургическое лечение у этих больных не проводилось. У 16 из 30 пациентов отдаленные последствия МЛП легкой степени тяжести были представлены трофическими изменениями в виде легкой атрофии и сухости кожи, единичных телеангиоэктазий, которые также не требовали никакого лечения. У 14 больных последствия МЛП легкой степени отсутствовали.
Проанализированы медицинские сведения о лечении 59 больных с последствиями МЛП II (средней) степени тяжести. У 47 из 59 больных с МЛП II степени лечение также ограничивалось консервативными средствами. В результате его применения была достигнута полная эпителизация раневой поверхности. Однако у 12 больных в дальнейшем потребовалось проведение оперативного вмешательства, при этом консервативные методы лечения использовались для ускорения заживления раневой поверхности, либо для профилактики развития поздних лучевых язв.
У больных с МЛП III–IV степени тяжести основным видом лечения являлось хирургическое. Консервативная терапия использовалась для ускорения заживления раневой поверхности и для профилактики развития лучевого фиброза и поздних лучевых язв. тяжесть исходов и отдаленных последствий МЛП, несомненно, зависит от дозы лучевого воздействия, площади (табл. 3) и анатомического расположения МЛП. Последнее также определяет возможность использования близко расположенного к очагу поражения аутолоскута.
Большинство больных с МЛП тяжелой степени, пострадавших от всех видов ионизирующего излучения, подвергались хирургическому лечению. Самопроизвольное заживление без развития поздних лучевых язв наблюдалось только при малых площадях МЛП. Среди 41 пострадавшего от гамма‑излучения с МЛП III степени хирургическое лечение не проводилось у 8 (19,5 %) человек. У этих пациентов поражения имели малую площадь – менее 0,25 % поверхности тела. Отдаленные последствия были представлены выраженной атрофией кожи и мягких тканей, лучевым фиброзом, нарушением пигментации, телеангиоэктазиями, рубцами, остеопорозом, наличием контрактур. У остальных 33 больных хирургическое лечение проводилось в связи с появлением незаживающих поздних лучевых язв.
Критерии прогноза непосредственных и отдаленных последствий МЛП (гамма – бета облучения) в зависимости от объема (степени тяжести и площади) поражения
При МЛП IV степени тяжести уже в остром периоде течения раневого про‑ цесса может потребоваться проведение инвалидизирующих больного операций (некрэктомия тканей и инфицированных язв, ампутация пальцев или конечностей, аутодермопластика для закрытия раневого дефекта) с целью удаления очага некроза, инфекции и интоксикации, нередко для спасения его жизни.
Ампутация в области здоровых тканей дает стойкий эффект, профилактируя развитие поздних лучевых язв, но приводит к инвалидизации больного и снижению качества его жизни.
Если некрэктомия и ампутация проводятся не в границах здоровых тканей (II гистологическая зона МЛП [12]), то возникает рецидив поздних лучевых язв с необходимостью реампутаций и повторных аутодерматопластических операций (свободным лоскутом или филатовским стеблем), что требует повторных госпитализаций, перевязок, сопровождается болевым синдромом и приводит к глубокой десоциализации пациентов.
В группе из 6 пациентов с МЛП IV степени тяжести от гамма‑нейтронного излучения у трех больных острые лучевые язвы с большими дефектами самопроизвольно эпителизировались с последующим развитием гиперкератоза, индуративного отека, гиперпигментации, сухого некроза, и рубцов, которые постепенно увеличивались. Через несколько месяцев или год на фоне прогрессирования этих проявлений развились незаживающие поздние язвы, приведшие к необходимости ампутаций двух и более конечностей. У трех пациентов ампутации конечностей были произведены в остром периоде, в некоторых случаях были произведены реампутации конечностей из‑за развития поздних лучевых язв на культях с септическими осложнениями (септический эндокардит, амилоидоз почек и т.д.). таким образом, у всех больных IV ст. МЛП от гамма‑нейтронного излучения были произведены ампутации 2–3 конечностей.
У 5 человек МЛП IV степени тяжести от гамма‑бета‑излучения возникли в результате радиационных аварий, произошедших до 1987 г. раневой процесс у этих больных характеризовался развитием незаживающих острых лучевых язв или медленного заживления язв с последующими дефектами в виде гиперкератоза, лучевого фиброза, нарушения пигментации, телеангиоэктазий, контрактур. Больным проводилось хирургическое лечение в виде повторных некрэктомий, пластики свободным лоскутом, ампутаций и реампутаций пальцев верхних и нижних конечностей, пластики мостовидным лоскутом, ампутации кисти. У одного пациента из этой группы произошла малигнизация длительно существующей поздней лучевой язвы.
После 1988 г. у 10 пострадавших для сохранения целой конечности или ее большего сегмента, оптимального для дальнейшего протезирования, при МЛП III и IV cтепени тяжести, наряду с некрэктомией и ампутациями, кроме аутотрансплантаций свободным лоскутом, сотрудники Центра вместе с коллегами из отделения микрохирургии рЦХ им. Б.В. Петровского начали проводить трансплантации микрохирургическим полнослойным лоскутом на сосудистой ножке или другими васкуляризированными лоскутами, что позволило сократить объем ампутации и некрэктомии и избежать множественных реампутаций.
Если у 13 пострадавших с МЛП IV ст. от гамма‑излучения было проведено от 3 до 12 реампутаций и аутопластических операций свободными и стебельчатыми лоскутами, то среди 10 пострадавших, которым были произведены экономные некрэктомии и микрохирургическая аутодермопластика на сосудистой (питающей) ножке в 1–2 этапа, у одного пациента конечность была полностью сохранена, в других 9 случаях наблюдался стойкий эффект без рецидива поздних лучевых язв и с хорошей функцией конечностей.
Три человека с МЛП IV степени пострадали от рентгеновского излучения во время аварийных ситуаций после 2005 г. Всем пациентам в остром периоде произведены экономные некрэктомии и ампутации отдельных фаланг со сложными пластиками микрохирургическими полнослойными аутолоскутами с сосудистыми питающими ножками или реваскулизированной фасцией (рис. 5). Всем троим пациентам удалось сохранить конечности или большие их фрагменты (рис. 6). Одному – конечность (правую руку) с полной функциональной состоятельностью (9 лет наблюдения). Второму и третьему пациентам удалось сохранить правую и левую кисти, за исключением концевой фаланги I и средней фаланги II пальца и II и III левой кисти с формированием сухожилий разгибателей пальцев правой кисти из разгибателей правой стопы с частичным восстановлением функций (10 лет наблюдения).
Рис. 5. Хирургическое вмешательство при МЛП III–IV степени тяжести
от рентгеновского облучения
Рис. 6. Восстановление функции правой кисти после хирургического лечения
При сравнении эффективности различных видов операций, применяемых при МЛП, в двух группах больных с аналогичной степенью тяжести и площадью поражения аутотранспланция с применением микрохирургической техники дает явные преимущества перед аутотрансплантацией свободным лоскутом, значительно сокращая число повторных операций (табл. 4). Больные, включенные в это исследование, были подобраны по полу, возрасту, степени тяжести МЛП, площади поражения.
Кроме того, аутопластические операции с применением микрохирургической техники позволяют сохранить большие сегменты конечности, что важно для дальнейшего функционирования ее культи, в том числе и для использования протеза.
Количество повторных оперативных вмешательств при Млп в зависимости от типа первичных операций
Примечания: * – некоторые больные имели МЛП 2 и 3 конечностей
** – отдельным больным проводилось до 20 операций – повторные реампутации с последующей аутопластикой свободным лоскутом
Необходимо отметить, что в связи с закономерными изменениями в последние годы структуры лучевых поражений в виде сокращения доли лиц с ОЛБ и увеличением количества пострадавших с МЛП, меняется и контингент больных. если многие десятилетия основным «поставщиком» пострадавших с лучевыми поражениями была атомная промышленность, то позднее мы стали чаще видеть среди больных работников нефтегазовой отрасли (дефектоскописты). В последнее десятилетие среди наших больных появились пациенты с осложнениями медицинского облучения. тяжелый соматический статус этих больных не позволяет проводить адекватное хирургическое лечение. В связи с этим с 2007 г. в лаборатории успешно применяется методика лечения поздних лучевых язв с помощью мезенхимальных стволовых клеток.
Заключение
Таким образом, правильный и своевременный диагноз при МЛП является очень важным звеном в системе оказания помощи пострадавшим в радиационных авариях, так как от этого зависит выбор адекватной схемы лечения.
Лечение МЛП легкой степени является исключительно консервативным. Может проводиться в любом лечебно‑профилактическом учреждении. Однако, учитывая частое сочетание МЛП с ОЛБ достаточно часто возникает необходимость в проведении обследования и лечения в условиях специализированного стационара.
Хирургическое лечение в комплексе с консервативным применяется у 30 % больных с МЛП средней степени при наличии поздних лучевых язв и практически у всех больных с поздними лучевыми язвами как последствиями МЛП тяжелой степени.
Методом выбора при тяжелых и крайне тяжелых МЛП в остром периоде и при рецидивирующих поздних лучевых язвах в отдаленном периоде являются оперативные вмешательства, основой которых является аутопластика толстыми лоскутами на сосудистой ножке с применением микрохирургической техники, что значительно улучшает исходы и минимизирует тяжелые отдаленные последствия. Кроме того, для профилактики развития поздних лучевых язв больным назначается каждые 6 месяцев внутривенное введение пентоксифиллина и актовегина.
При МЛП крайне тяжелой степени хирургическое лечение является основным методом не только в периоде отдаленных последствий, но уже и в остром периоде течения раневого процесса. Из видов оперативных вмешательств применяются все возможные: некрэктомии, ампутации, аутопластики полнослойным микрохирургическим лоскутом на питающей ножке, сдвижные лоскуты, реваскулизированные лоскуты, свободные для временного закрытия дефекта или на реваскулизированную фасцию, филатовским стеблем, мостовидным лоскутом. Для сохранения больших сегментов, иногда и целой конечности, методом выбора является применение полнослойных лоскутов на питающей ножке, полученных микрохирургическим методом или реваскулизированные лоскуты (фасциальные), т.е. способные нормализовать трофику в области пораженных тканей. Консервативное лечение является вспомогательным.
Лечение МЛП средней и тяжелой степени должно проводиться в специализированном стационаре, обладающим полным арсеналом диагностических и лечебных методов.
Радиационные поражения легких
Радиационные поражения легких возникают при рентгенора- диотерапии по поводу рака легкого, пищевода, молочной железы и других злокачественных новообразований груди. Опасность их возникновения обусловлена относительно невысокой толерантностью легких к воздействию ионизирующих излучений, лежащей в пределах суммарной дозы облучения порядка 3000-4000 рад, которая нередко превышается в период радиационной терапии. Внедрение в практику источников высоких энергий позволяет щадить окружающие ткани, однако частота повреждений легочной паренхимы, особенно в области локализации опухоли, остается высокой [Павлов Л. С. и др., 1979]. Степень риска зависит от величины применяемой дозы и объема облучаемой легочной ткани. Имеют значение также наличие соответствующих изменений легких (например, туберкулеза), пожилой возраст, факторы индивидуальной чувствительности пациента.
Патогенез (что происходит?) во время радиоционных поражений легких:
Патогенез развивающегося радиационного пневмонита определяется: а) поражением бронхов, вызывающих развитие ателектазов с последующей соединительнотканной организацией;
б) серозна-фибринозным альвеолитом с десквамацией эпителия;
в) поражением сосудов, особенно мелких, с пролиферацией эндотелия и частичной закупоркой их просвета; г) повышенной проницаемостью капилляров с выхождением белков плазмы; д) присоединением инфекции, могущей вызвать обострение процесса и увеличение участка повреждения, которое из очагового в этом случае подчас становится диффузным.
Наиболее рано вследствие радиационного воздействия в легких повреждаются лимфоциты и лимфоидная ткань, обладающие высокой митотической активностью. Достаточно чувствительны к ионизирующим излучениям также альвео- циты I типа, которые, как известно, образуют эпителиальную выстилку альвеол и являются ответственными за газообмен. Под влиянием радиации они подвергаются некрозу и замещаются в последующем пролиферирующими альвеоцитами II типа и гранулированными альвеоцитами [Phillips Т., Wyati J. — К кн.: Fishman А., 1980].
Симптомы радиоционных поражений легких:
Различают 2 стадии: острую, или воспалительно инфильтративную, и хроническую, или фиброзную. Острая воспалительная стадия лучевых реакций легочной тканй проявляется обычно кашлем, одышкой, субфебрильной температурой. При рентгенологическом исследовании могут наблюдаться повреждения альвеолярных структур (мелкоочаговая дольковая пневмония), периброихиальные и иериваскулярпые изменения (усиление прикорневого и легочного рисунка). Эти изменения чаще появляются к концу лечения или после него и сохраняются в течение 1-4 мес.
Наблюдаются и более тяжелые повреждения легких с возникновением высокой лихорадки (до40°С), цианоза, резких нарушений дыхания и острой дыхательной недостаточности, на фоне которой могут наступать смертельные исходы. Тяжелое течение радиационного пневмонита, отмеченное у 33 % облученных пациентов (6 % из них погибли), описано, например, при проведении повторных курсов лучевой терапии, а также при тотальном облучении всего легкого вследствие метастазирования опухолей [Phillips Т., Wyatt J. - В кн.: Fishman А., 1980].
При менее тяжелых поражениях изменения острой фазы лучевой реакции могут подвергаться обратному развитию или переходить в хроническую, фиброзную, стадию. Ведущим симптомом последней является кашель, иногда боли в груди вследствие ограниченного плеврита. При физикальном исследовании резких изменений дыхания обычно не наблюдается. Иногда над областью поражения выслушиваются нестойкие разнокалиберные влажные хрипы. Рентгенологически определяется ограниченное (на стороне поражения) усиление легочного рисунка. Однако нередко процесс продолжает прогрессировать. При рентгенологическом исследовании в этих случаях обнаруживаются местная или общая деформация легочного рисунка, фиброзные изменения легких, которые подчас сопровождаются бронхоэктазами и деформацией бронхов. Может выявляться цирроз или карнпфикацня отдельных сегментов или долей. Средостение смещается в сторону пораженного легкого, нередко наблюдается деформация диафрагмы. Могут регистрироваться плевродиафрагмальные сращения, линейные тени по ходу междолевых щелей, иногда выпот в полость плевры, отражающие плевральную реакцию па облучение.
При исследовании функции внешнего дыхания обнаруживаются изменения преимущественного рестриктивного типа, а также уменьшение диффузионной способности легких [Crofton J., Douglas А., 1974; Sylla А., 1978].
Процесс фиброзировапия продолжается от 6 мес до 2 лет. Учитывая относительно небольшие сроки жизни больных после облучения, в общем, можно считать, что степень фиброза легочной ткани зависит от длительности жизни после проведенной радиационной терапии.
Диагностика радиоционных поражений легких:
Диагностика основывается на данных анамнеза о проводившейся радиационной терапии, площади и локализации облученного поля легких, числе сеансов и их продолжительности. Важным признаком служит односторонность поражения. Следует учитывать также общие симптомы лучевой реакции: слабость, головную боль, потерю аппетита, раздражительность, различные расстройства сердечно-сосудистой системы, лейкопению, тромбо« цитопению и пр., которые нередко предшествуют местным легочным проявлениям лучевого воздействия. Диапюз осложняется в случае присоединения вирусных и бактериальных пневмоний, возникающих вследствие подавления иммунологической защиты организма ионизирующей радиацией.
Лечение радиоционных поражений легких:
Лечение в острую стадию лучевых реакций легочной ткани заключается в приеме кортикостероидов, антибиотиков, антикоа- гулянтов, которые назначаются ввиду угрозы тромбоза легочных капилляров как одного из проявлений повреждающего действия радиации на легкие.
Благоприятное действие кортикостероидов проявляется уже к 3-4-му дню лечения - воспалительный процесс постепенно стихает. Однако если в указанный срок положительный эффект гормональной терапии отсутствует, дальнейшее применение кортикостероидов бесполезно, и, постепенно снижая дозу, их следует отменить. Применение этих препаратов в подострую и хроническую стадии пневмонита неэффективно.
Профилактика радиоционных поражений легких:
Профилактика радиационных повреждений легких состоит прежде всего в индивидуальном определении локализации, объема и конфигурации участков облучения («фигурные поля облучения»). На примере лучевой терапии рака молочной железы показано, что подобный подход к лечению сократил количество осложнений в виде радиационного пневмонита с 70 %, наблюдавшихся ранее, до нескольких процентов. Важное значение имеет также наблюдение за общим состоянием больного - прекращение облучения при появлении стойкой лейкопении и тром- боцитопении, а также при появлении кашля и кровохарканья. Назначение кортикостероидов и антибиотиков в период проведения лучевой терапии не предотвращает развитие патологиче« ского процесса.
К каким докторам следует обращаться если у Вас Радиационные поражения легких:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о радиоционных поражений легких, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Читайте также:
