Лечение отравления нервно-мышечными блокаторами (миорелаксантами)
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Вспомогательные вещества: натрия хлорид, вода для инъекций.
Лекарственная форма
Раствор для инъекций.
Основные физико-химические свойства: прозрачная жидкость, практически свободная от частиц.
Фармакологическая группа
Средства, применяемые при деменции. Ингибиторы холинэстеразы. Галантамин.
Код АТХ N06D A04.
Фармакологические свойства
Галантамин относится к третичных алкалоидов, группы парасимпатомиметики непрямого действия. Он является селективным конкурентным и обратным ингибитором фермента ацетилхолинэстеразы. Приводит к повышению уровня ацетилхолина в центральной нервной системе. Кроме его действия в качестве ингибитора ацетилхолинэстеразы он аллостерическим лигандом наиболее распространенных в центральной нервной системе никотиновых ацетилхолиновых рецепторов субтипа альфа 4 / бета 2, прямым путем стимулируя никотиновые рецепторы. Также повышает чувствительность постсинаптических рецепторов ацетилхолина. Галантамин проникает через гематоэнцефалический барьер, облегчает проведение импульсов в ЦНС и ускоряет процессы возбуждения. Повышает активность холинергической системы, в результате чего улучшаются когнитивные функции. По сравнению с Неостигмин галантамин имеет значительно более слабое действие на мускариновые рецепторы. Улучшает и облегчает проведение возбуждения в нервно-мышечных синапсах и восстанавливает нейромышечную проводимость в случаях ее блокады недеполяризующими нервно-мышечными блокаторами. Повышает тонус гладкой мускулатуры, усиливает секрецию пищеварительных и потовых желез, вызывает миоз.
Считается, что при применении парасимпатомиметики существует риск развития судорог (несмотря на то, что они не наблюдались при применении галантамина). Это требует тщательного наблюдения за пациентами с болезнью Альцгеймера, у которых риск появления судорог увеличен.
Резорбция: галантамина гидробромид быстро всасывается после подкожного применения. В исследованиях фармакокинетики галантамина не установлено статистически значимые различия в средних величинах плоскостей под фармакокинетической кривой (AUC) при пероральном и парентеральном введении дозы 10 мг. Максимальная концентрация в плазме крови при подкожном введении достигается через 1 - 2:00.
Распределение галантамин в низкой степени связывается с белками плазмы крови - до 18%. Он легко проникает через гематоэнцефалический барьер и оказывается в тканях мозга в концентрациях в 2-3 раза выше, чем в плазме крови. Объем распределения составляет примерно 175 л.
Метаболизм 75% дозы галантамина метаболизируется в печени с помощью системы цитохрома P450 (изоферментами CYP3A4 и CYP2D6). В исследованиях in vitro установлено, что изофермент CYP2D6 участвует в образовании О-дезметилгалантамину, а CYP3A4 - в образовании N-оксид-галантамина. Метаболизм галантамина медленная и незначительное, происходит путем деметилирования до 5-6%. У людей с низкой активностью фермента ( «плохие метаболизаторы») проявляются высшие уровни (до 50%) в неизмененном галантамина по сравнению с нормальной ферментной активностью ( «хорошие метаболизаторы»). Метаболиты галантамина - епигалантамин, галантаминон и норгалантамин оказываются в плазме крови и мочи, но нет данных об их фармакологической активностью.
Вывод : период полувыведения составляет около 5:00. Центральный компартмент выводится быстрее, чем периферическое. Галантамин выводится в неизмененном виде и в виде метаболитов (галантаминон, епигалантамин), в основном путем клубочковой фильтрации (до 74 ± 23% за 72 часа). Почечный клиренс галантамина составляет 1,4 мл / мин / кг. Неизмененный галантамин и его метаболиты выводятся с мочой после подкожного введения. Установлено, что почечный клиренс галантамина составляет примерно 100 мл / мин, что близко к клиренса инулина в соответствии креатинина. Галантамин НЕ конъюгируется в печени, его экскреция с желчью слабая - 0,2 ± 0,1% в течение 24 часов.
Фармакокинетика галантамина имеет линейный характер в терапевтическом дозовой диапазоне. Не наблюдается кумуляции галантамина при многократном его применении. Не установлена корреляция между плазменными концентрациями и терапевтическими или побочными реакциями галантамина.
У пациентов с функциональной недостаточностью печени средней степени клиренс галантамина уменьшается примерно на 25%.
У пациентов с функциональной недостаточностью печени средней и тяжелой степени значимости AUC увеличивается на 37-67%.
Данные исследований показывают, что у пациентов с пониженным клиренсом креатинина возможно замедление выведения галантамина. У пациентов пожилого возраста (старше 65 лет) концентрация галантамина в плазме крови может быть выше на 30-40%.
Не наблюдалось различий в фармакокинетике галантамина между мужчинами и женщинами, а также у представителей разных рас.
Показания
- Заболевания периферической нервной системы (полирадикулоневрит, радикулоневрит, неврит, полиневрит, полиневропатии)
- лечения состояний, связанных с повреждениями передних рогов спинного мозга (после полиомиелита, миелита, спинальной мышечной атрофии)
- церебральный паралич (состояния после инсульта мозга, детского церебрального паралича, после травм ЦНС);
- нарушения нервно-мышечного синапса (миастения гравис, мышечная дистрофия);
- когнитивные нарушения при различных заболеваниях ЦНС (травма, интоксикация, множественный склероз, аутизм).
Анестезиология и хирургия.
Для снятия действия недеполяризующих нервно-мышечных блокаторов (миорелаксантов) и при лечении послеоперационных парезов тонкого кишечника и мочевого пузыря.
Ионофорез при неврологических поражениях периферической нервной системы, ночном недержании мочи.
При отравлении антихолинергическими средствами.
Противопоказания
Повышенная чувствительность к компонентам препарата
ишемическая болезнь сердца;
тяжелая сердечная недостаточность (III-IV степень по NYHA)
механическая кишечная непроходимость;
механические нарушения проходимости мочевыводящих путей
тяжелая почечная недостаточность (клиренс креатинина ниже 10 мл / мин)
тяжелая печеночная недостаточность (классификация Чайльд-Пью ( Child-Pugh) > 9).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Фармакодинамические лекарственные взаимодействия.
Галантамин антагонизуе ингибирующее действие морфина и его аналогов на дыхательный центр.
При одновременном применении галантамина с другими холиномиметиками (такими как амбеноний, донепезил, неостигмин, пиридостигмин или пилокарпин, который применяется системно) можно наблюдать усиление их холиномиметических действия, в связи с чем они не должны применяться одновременно.
Галантамин антагонизуе действие антихолинергических средств (атропина и подобных субстанций), гексаметонию и других ганглиоблокаторов, недеполяризующих миорелаксантов (тубокурарин).
При одновременном применении возможны аддитивные взаимодействия галантамина с лекарственными средствами, которые замедляют сердечный ритм, такими, например, как дигоксин, бета-блокаторы, блокаторы кальциевых каналов и амиодарон, и усиление эффекта последних.
Прокаинамид, терапевтический эффект которого частично обусловлено антихолинергическим активностью, нельзя применять одновременно с галантамином, поскольку он может уменьшить его терапевтический эффект.
Аминогликозиды (гентамицин, амикацин) могут уменьшить терапевтическое воздействие галантамина на нейромышечную проводимость, а также уменьшить терапевтический эффект галантамина при заболевании миастения гравис.
Возможно усиление действия деполяризующих нервно-мышечных блокаторов (суксаметоний) при одновременном применении с галантамином и особенно в случаях дефицита псевдохолинэстеразы.
Фармакокинетические лекарственные и другие взаимодействия
Галанатамин метаболизируется печеночными изоферментами CYP3A4 и CYP2D6. Ингибиторы CYP2D6 (хинидин, пароксетин, флуоксетин) или CYP3A4 (кетоконазол, зидовудин, ритонавир, эритромицин) могут влиять на метаболизм галантамина и вызвать повышение его концентрации в плазме крови и повысить его биодоступность. Лекарственные средства, которые подвергаются метаболизму этими самыми изоферментами, могут взаимодействовать с галантамином на фармакокинетическом уровне. В этих случаях существует повышенный риск возникновения побочных реакций, в связи с чем рекомендуется снижение поддерживающей дозы галантамина.
Циметидин может повысить биодоступность галантамина.
Галантамин не влияет на фармакокинетику варфарина.
Особенности применения
В результате фармакологического действия парасимпатомиметики могут повлечь ваготоническое действие на сердечный ритм (брадикардия, AV-блокада). Поэтому галантамин необходимо назначать с осторожностью пациентам с синдромом слабости синусового узла или другими наджелудочковую нарушениями сердечной проводимости пациентам, которые одновременно применяют препараты, значительно замедляют сердечный ритм, такие как дигоксин или бета-блокаторы, или пациентам с некорригированной электролитным балансом (гипер- или гипокалиемия).
Препарат с осторожностью назначать пациентам с язвенной болезнью желудка, поскольку ингибиторы холинэстеразы (включая галантамин) могут повышать и усиливать желудочную секрецию кислоты в результате повышенной холинергической активности и вызвать побочные реакции со стороны желудочно-кишечного тракта. Для таких пациентов необходим контроль появления соответствующей симптоматики. Более высокий риск существует у пациентов с язвенной болезнью в анамнезе, в восстановительном периоде после операции на желудке и у пациентов, которые лечатся одновременно НПВП. При лечении галантамином у таких пациентов необходимо контролировать состояние больного, в связи с возможностью острой желудочно-кишечного кровотечения.
Галантамин следует использовать с осторожностью пациентам с острыми и хроническими заболеваниями легких (хроническая обструктивная болезнь легких).
Назначение галантамина пациентам с затрудненным мочеиспусканием, после недавней резекции предстательной железы или мочевого пузыря не рекомендуется.
Парасимпатомиметики могут усиливать действие миорелаксантов типа сукцинилхолину во время анестезии.
Лечение холинестеразнимы ингибиторами, включая и галантамином, может сопровождаться уменьшением массы тела, поэтому необходимо периодически контролировать массу тела пациентов.
Парасимпатомиметики имеют известную свойство вызывать судороги. Повышенная судорожная активность наблюдается у пациентов с болезнью Альцгеймера. В отдельных случаях парасимпатомиметики могут повысить холинергический тонус и вызвать ухудшение симптомов паркинсонизма.
При лечении пациентов с легкой формой почечной недостаточности следует применять Нивалин в низких дозах, учитывая показатели клиренса креатинина.
Лекарственный препарат Нивалин, раствор для инъекций 1 мг / мл, 2,5 мг / мл и 5 мг / мл содержит менее 1 ммоль натрия (23 мг) в одной дозе, то есть практически не содержит натрия.
Применение в период беременности или кормления грудью
Экспериментальные исследования на подопытных животных не выявили прямого или косвенного влияния на беременность, эмбриональное / фетальный развитие, роды или постнатальное развитие.
Нет данных о проникновении галантамина в грудное молоко. Не проводились клинические исследования у женщин, кормящих грудью.
В связи с отсутствием клинических данных препарат не рекомендуется применять во время беременности и в период кормления грудью.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами
Нивалин проявляет влияние от слабого до среднего степени выраженности на способность управлять автотранспортным средством и работать с механизмами, которые требуют быстрых психических и физических реакций. Может привести к нарушению зрения, головокружение, сонливость, особенно в начале лечения. В этих случаях рекомендуется прекратить вождения и работать с механизмами.
Способ применения и дозы
Нивалин в форме раствора для инъекций предназначен для подкожного, внутримышечного, внутривенного применения.
Дозировка и длительность лечения галантамином зависят от характера и течения заболевания, а также эффективности лечения.
Нивалин в форме раствора для инъекций применять для непродолжительного лечения и для пациентов, для которых невозможно пероральное применение. При первой возможности переходят на применение препарата Нивалин в форме таблеток.
Обычно Нивалин , раствор для инъекций, применяют в дозе 0,03-0,28 мг / кг.
Рекомендуется начальная доза 2,5 мг в сутки. Суточную дозу постепенно увеличивают через 3-4 дня на 2,5 мг, разделенную на 2-3 равные части.
Максимальная разовая доза для взрослых составляет 10 мг подкожно, а максимальная суточная доза - 20 мг.
У детей дозирования Нивалин , раствор для инъекций устанавливает врач в зависимости от массы тела ребенка. Препарат применять подкожно в следующих суточных дозах:
дети от 1 до 2 лет 0,25-1 мг (0,02-0,08 мг / кг);
детям от 3 лет Нивалин, раствор для инъекций применять в дозе 0,03-0,28 мг / кг или:
детям от 3 до 5 лет 0,5-5 мг
детям от 6 до 8 лет: 0,75-7,5 мг
детям от 9 до 11 лет 1-10 мг
детям от 12 до 15 лет: 1,25-12,5 мг
детям старше 15 лет: 1,25-15 мг.
Продолжительность лечения зависит от особенностей и сложности заболевания. Чаще всего она составляет 40-60 дней. Курс можно повторять 2-3 раза с интервалом 1-2 месяца. Более высокие лечебные дозы, как правило, делятся на 2 приема.
Анестезиология, хирургия и токсикология.
Как антикурарний средство и антидот при передозировке периферическими недеполяризующими нервно-мышечными блокаторами Нивалин вводится внутривенно в дозе 10-20 мг / сут. При послеоперационных парезах желудочно-кишечного тракта и мочевого пузыря вводится подкожно, внутримышечно или внутривенно в дозе соответственно возрасту, распределенных на 2-3 применения в сутки.
Детям дозировку препарата Нивалин , раствор для инъекций устанавливает врач в зависимости от массы тела ребенка. Препарат применять внутривенно в следующих суточных дозах:
дети от 1 до 2 лет 0,25-1 мг (0,03-0,08 мг / кг);
детям от 15 лет и взрослые: 1,25-15 мг.
Ионофоретично Нивалин применять в дозе 2,5-5 мг галантамина (при величине электрического тока от 1 до 2 мА) продолжительностью 10 минут в течение 10-15-дневного периода.
Продолжительность курса лечения колеблется в широких пределах - от нескольких недель до нескольких лет и зависит от заболевания и индивидуальной переносимости лечения. При появлении побочных реакций дозу препарата необходимо уменьшить или прекратить лечение на 2-3 дня, после чего продолжить лечение более низкими дозами. Если есть необходимость прекратить лечение на более длительный период, повторное применение препарата необходимо начинать с низкой дозы и постепенно увеличивать ее до оптимальной поддерживающей.
Пациенты с нарушениями функции печени.
У пациентов с середньовираженимы нарушениями функции печени (тяжесть 7-9 степени по классификации Чайльд-Пью ( (Child-Pugh) ) концентрации галантамина в плазме крови могут быть повышены, поэтому необходимо уменьшить суточную дозу галантамина данной группе пациентов до 15 мг.
Пациенты с нарушениями функции почек.
Галантамин и его метаболиты выводятся в основном почками.
У пациентов с умеренной степенью почечной недостаточности суточная доза галантамина не должна превышать 15 мг.
Препарат не применять для лечения детей в возрасте до 1 года.
Передозировка
Симптомы: симптомы передозировки галантамина подобные симптомов передозировки других парасимпатомиметики. Эти эффекты обычно касаются ЦНС, парасимпатической нервной системы и нейромышечных связей. Кроме мышечной слабости или фасцикуляции возможно развитие некоторых или всех признаков холинергического кризис: выраженная тошнота, рвота, желудочно-кишечные колики, диарея, слюноотделение, слезотечение, потливость, брадикардия, гипотензия, коллапс и судороги. Увеличена мышечная слабость вместе с трахеальному гиперсекрецией и бронхоспазмом могут привести к острому дыхательного эпизода.
Лечение: при передозировке необходимо контролировать функции дыхательной и сердечно-сосудистой систем, проводить общеукрепляющие мероприятия и симптоматическое лечение. При передозировке препаратом при приеме внутрь, если пациент находится в сознании, проводить промывание желудка. Как антидот применять атропин в дозе 0,5-1 мг, дозу можно повторить в зависимости от клинического состояния.
Побочные реакции
Побочные действия классифицируются по частоте и в соответствии с поражения органов и систем органов. Частота распределяется по MedDRA следующим образом: очень часто (> 1/10 назначений), часто (> 1/100 до 1/1 000 до 1/10 000 до
Наиболее частые побочные реакции галантамина связанные с его фармакодинамики и могут быть выражены в основном в виде никотиновых или реже мускариновых эффектов, характерных для фармакологического класса.
Со стороны сердечно-сосудистой системы: брадикардия, блокада I степени, синусовая брадикардия, стенокардия, сердцебиение, наджелудочковая экстрасистолия, артериальная гипотензия или АГ, приливы.
Со стороны нервной системы: головокружение, головная боль, бессонница, сонливость, летаргия (летаргический сон), синкоп (обморок), галлюцинации, зрительные и слуховые галлюцинации, депрессия, тремор, парестезии, дисгевзия (извращение вкуса), гиперсомния.
Со стороны органа зрения: затуманивание зрения, миоз, увеличение слезной секреции.
Со стороны органов слуха и лабиринта: тиннитус (шум в ушах).
Дыхательные декабре и медиастинальные нарушения : тахипноэ, бронхоспазм, увеличение назальной и бронхиальной секреции.
Со стороны желудочно-кишечного тракта : ощущение тошноты, рвота, диарея, увеличена саливация, усиление кишечной перистальтики, боль в животе, диспепсия, желудочно-кишечный дискомфорт.
Со стороны печени и желчевыводящих путей: гепатиты.
Со стороны обмена веществ и питания: потеря аппетита, анорексия, дегидратация (обезвоживание).
Со стороны кожи и подкожной клетчатки: гипергидроз (повышенная потливость).
Со стороны костно-мышечной системы и соединительной ткани: мышечные спазмы, мышечная слабость, боль в месте введения, возможны местные реакции при парентеральном введении.
Со стороны иммунной системы : зуд, сыпь, крапивница, ринит. В единичных случаях острые реакции гиперчувствительности, включая анафилаксии с потерей сознания.
Общие расстройства и нарушения в месте введения: астения, утомляемость, слабость, снижение массы тела.
Лабораторные и инструментальные данные: уменьшение массы тела, повышение уровня ферментов печени.
Травмы, интоксикации и осложнения манипуляций: падения.
При усиленных парасимпатомиметичних эффектах при применении галантамина суточную дозу следует уменьшить или лечения прекратить на 2-3 дня и после этого продолжить ниже дозами.
Лечение отравления нервно-мышечными блокаторами (миорелаксантами)
Клиника отравления нервно-мышечными блокаторами (миорелаксантами)
а) Атракурий. Атракурий может повысить среднее артериальное давление и частоту сердечных сокращений. Эти реакции лечения не требуют. Передозировка атракурия увеличивает риск высвобождения гистамина.
б) Галламина триэтиодид. Случайная подпаутинная инъекция галламина одному взрослому обусловила мышечные спазмы нижних частей конечностей и состояние тревоги; через 3 ч увеличились артериальное давление и частота пульса, после чего наблюдались гипертермия, профузное потоотделение, интенсивная гиперестезия, потеря сознания и точечные зрачки. Через 24 ч мышечные спазмы ослабли. Лечение включало:
(а) помещение в темную палату;
(б) максимальный покой;
(в) диазепам;
(г) гидрокортизон;
(д) дексаметазон.
Два пациента, получив галламин интратекально, умерли после развития судорог.
в) Панкуроний. Мужчине в возрасте 79 лет ввели 105 мг панкурония без мониторинга нервно-мышечной функции. Он умер от циркуляторного шока. Одновременно наблюдалась послеоперационная почечная недостаточность. Взрослый человек совершил самоубийство, инъецировав себе панкурония бромид (1 мг/мл). Плазменный уровень бромида быстро падает; пиковые плазменные концентрации колеблются от 1,0 до 1,5 мкг/мл, но снижаются на 60 % за 5 мин.
г) Пипекурония бромид. Один пациент случайно получил пипекурония бромид из расчета 520 мкг/кг, что примерно в 11 раз выше эффективной дозы. У него на 70 ч наступил паралич. Неостигмин и пиридостигмин блокаду снять не смогли. Диализируется пипекуроний плохо.
д) Тубокурарин. Мужчине в возрасте 20 лет случайно ввели 4 мг тубокурарина. У пациента возникли жалобы на сильную боль, а после внутриартериальной инъекции гиалуронидазы и 8 % лидокаина — на слабость. Мышечная сила руки полностью восстановилась через 45 мин.
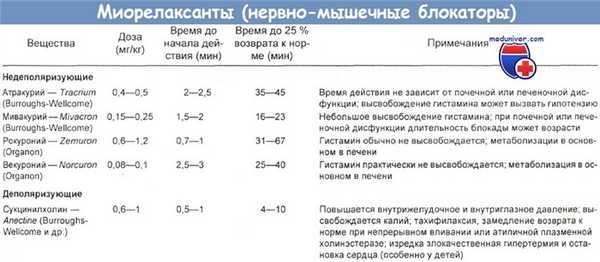
е) Векуроний. Ребенок в возрасте 23 мес с массой тела 9,7 кг, страдающий синдромом Дауна и врожденной болезнью сердца, получил 37 мг векурония за 1 ч внутривенно (383 мг/кг в час).
Гемодинамические показатели в ближайшие 24 ч не менялись. Ребенок умер от сепсиса через 5 сут. Скорость введения ему медикамента почти в 50 раз превышала рекомендованную изготовителем (0,5 — 0,8 мг/кг в час).
ж) Клиническое течение отравления нервно-мышечными блокаторами. Отравление курареподобными блокаторами характеризуется полным параличом скелетной мускулатуры, который начинается с быстрого сокращения мышц ушей и пальцев рук и ног, затем распространяется на лицо и шею, переходит на конечности и, наконец, на диафрагму и межреберные мышцы. Сознание может сохраняться. Смерть наступает в результате гипоксии, вызываемой параличом дыхательной мускулатуры.
- Анафилактоидные реакции. Деполяризующие и недеполяризующие миорелаксанты изредка приводят к опасным для жизни анафилактоид-ным реакциям, выражающимся в сосудистом коллапсе, бронхоспазме и приливе крови к коже. Кожные пробы положительны примерно в 1/3 случаев. По-видимому, сукцинилхолин непосредственно действует на чувствительные мастоциты без участия FgE.
Сукцинилхолин и тубокурарин могут привести к повышению плазменного уровня гистамина у нормальных пациентов во время анестезии.
Анафилактоидные реакции наблюдались и при применении векурония.
- Миастения. Аномальная чувствительность к недеполяризующим миорелаксантам типична для страдающих миастенией и проявляется в пролонгированной нервно-мышечной блокаде.
- Гиперкалиемия. Индуцированная сукцинилхолином гиперкалиемия возможна в следующих ситуациях:
1) обширные ожоги;
2) массивные мышечные травмы;
3) патология дистальных двигательных нейронов, включая травматическую дегенерацию, демиелинизирующую болезнь (например, синдром Гийена — Барре) и полиомиелит;
4) патология проксимальных двигательных нейронов, включая поперечное рассечение спинного мозга, поражение сосудов головного мозга и энцефалит;
5) столбняк.
У 20 — 50 % пациентов, получавших сукцинилхолин, наблюдались повышение внутриглазного давления, злокачественная гипертермия (см. соответствующую статью) и мышечная боль.
з) Лабораторные методы диагностики нервно-мышечными блокаторами:
- Аналитические методы. Атракурий. Жидкостная хроматография высокого разрешения определяет атракурий с чувствительностью 0,2 мкг/мл, а лау-данозин — 0,01 мкг/мл.
Галламин. Общую (свободная и связанная формы) концентрацию в плазме измеряют с помощью флюориметрического анализа, нижний предел чувствительности которого составляет 0,05 мкг/мл.
Панкуроний. Кровь, сыворотку и мочу анализируют путем экстракции ионных пар и флюориметрии.
Сукцинилхолин. Анализ мочи проводят путем образования ионных пар этого вещества с бромтимоловым синим, а затем тонкослойной хроматографии, гидролиза выделенного соединения до янтарной кислоты, ее этерификации до одного или более производных и количественной газовой хроматографии.
Тубокурарин. Чувствительный радиоиммунологический анализ с использованием тритиевой метки требует всего 10 мкл сыворотки и мочи, а его чувствительность достигает для d-тубокурарина 5 нг/мл. После его введения внутривенно в дозе 0,3 мг/кг через 24 ч сывороточная концентрация варьирует от 25 до 83 нг/мл. Описан также метод жидкостной хроматографии с ультрафиолетовой детекцией.
- Уровни в крови. После суицидальной внутривенной инъекции 10 мг пан-курония вскрытие показало его уровни в крови и моче 1,6 и 1,5 мкг/мл соответственно. Обнаружен был также тиоридазин, однако в терапевтической концентрации (0,7 мкг/мл).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Отравление нервно-мышечными блокаторами и их побочные эффекты
Передозировка как деполяризующих, так и недеполяризующих нервно-мышечных блокаторов чревата продолжительным параличом скелетной мускулатуры, гиперкалиемией, высвобождением гистамина, гипотензией, остановкой сердца и смертью.
а) Структура и классификация. Миорелаксанты классифицируют в зависимости от механизма ослабления ими эффекта ацетилхолина. Они бывают деполяризующими или недеполяризующими (конкурентными) нервно-мышечными блокаторами. Сукцинилхолин образован двумя молекулами ацетилхолина, связанными между собой через метильные группы ацетатов. Панкуроний и векуроний — стероидные нервно-мышечные блокаторы, структурно близкие к кортикостероидам.
б) Источники. Атракурий, галламин, панкуроний, сукцинилхолин и векуроний представляет собой синтетические продукты, метокурин является полусинтетическим продуктом, а тубокурарин экстрагируют из растений рода Chonododendron.
в) Токсичные дозы миорелаксантов:
- Галламина триэтиодид. Одному взрослому пациенту случайно ввели 1,4 мл (30 мг) галламина в субарахноидальное пространство. Он выжил.
- Панкурония бромид. Один взрослый пациент самостоятельно ввел себе внутривенно 10 мл панкурония бромида (1 мг/мл) и тиопентал натрия, после чего был найден мертвым. Пациенту в возрасте 79 лет с почечной недостаточностью ввели внутривенно 105 мг панкурония за 4 дня. Через 6 сут он скончался от циркуляторного шока.
- Тубокурарина хлорид. Случайная внутриартериальная инъекция тубокурарина в левый локтевой сгиб обусловила боль и слабость в руке. Полное выздоровление наступило через 45 мин. Случайная передозировка (30 мг) тубокурарина приводит к остановке дыхания у большинства взрослых пациентов за 2 — 3 мин. После двух случайных передозировок, равных 80 и 100 мг, пострадавшие выздоровели.
- Векурония бромид. Ребенку, страдающему синдромом Дауна, с массой тела 9,7 кг в возрасте 23 мес ввели внутривенно 37 мг векурония в течение 1 ч (3,83 мг/кг в ч). Он умер через 5 сут от обширного сепсиса. Введенное количество соответствовало пятикратному превышению рекомендованной изготовителем скорости вливания (0,5 — 0,8 мг/кг в ч). Гемодинамических нарушений во время инфузии и в следующие за ней 24 ч не было.
г) Летальные дозы миорелаксантов. Одна летальная доза панкурония составила 10 мг внутривенно, другая смерть последовала через 6 сут после введения 105 мг этого средства за 4 дня. Передозировка векурония (37 мг) привела к смерти через 5 дней от сепсиса.
д) Токсикокинетика нервно-мышечных блокаторов. Обзор токсикокинетических свойств недеполяризующих миорелаксантов показывает, что они умеренно связываются с белками, быстро (за считанные минуты) распределяются по организму, характеризуются низким кажущимся объемом распределения и периодом полувыведения, составляющим несколько часов.
- Метаболизация. Сукцинилхолин быстро метаболизируется, главным образом плазменной псевдохолинэстеразой, до сукцинилмонохолина и холина. Сукцинилмонохолин как недеполяризующий блокатор примерно в 20 раз менее активен, чем сукцинилхолин. Он может накапливаться и вызывать тяжелое апноэ у пациентов с нарушенной почечной функцией. Примерно 2 — 10 % выводится с мочой в неизмененном виде.
- Токсичность. Применение сукцинилхолина у пациентов с генетически детерминированной атипичной псевдохолинэстеразой или у тех, кто получал холинэстеразные ингибиторы, чревато продолжительным апноэ.

ж) Взаимодействие миорелаксантов с лекарствами. Средства, изменяющие эффект миорелаксантов, могут действовать проксимальнее нервно-мышечного синапса в центральной нервной системе или в кровотоке, в зоне этого синапса или дистальнее него на уровне мембраны мышечной клетки\. В синаптической зоне они влияют либо на нервное окончание, либо на постсинаптиче-скую мембрану.
Средства, взаимодействующие с недеполяризующими миорелаксантами:
- Антибиотики. Антибиотики, например аминогликозиды (амикацин, дигидрострептомицин, гентамицин, канамицин, стрептомицин, тобрамицин) и полипептиды (полимиксина А, В и С), не только потенцируют действие недеполяризующих миорелаксантов, но и сами по себе вызывают нервно-мышечную блокаду. Тетрациклины также обладают слабыми свойствами нервно-мышечных блокаторов и потенцируют недеполяризующие миорелаксанты.
- Анестетики для внутривенного введения. Кетамин потенцирует действие альфа-тубокурарина, но не панкурония. Мидазолам усиливает индуцированную векуронием блокаду. С другими внутривенными анестетиками существенного взаимодействия почти нет. Хроническое применение трициклических антидепрессантов может предрасполагать пациента, получающего панкуроний, к желудочковой тахикардии.
- Диуретики. У человека фуросемид в дозе 1 мг/кг облегчает снятие вызванной панкуронием блокады. Высокие дозы этого диуретика могут противодействовать индуцируемой панкуронием блокаде у нейрохирургических пациентов.
- Бета-блокаторы. Бета-блокаторы противодействуют связыванию ацетилхолина с постсинаптической мембраной. Они могут усилить или демаскировать миастению и индуцировать миастенический синдром.
- Антиаритмические средства. У человека прокаинамид обостряет миастению и индуцирует мышечную слабость у здоровых индивидов. d-Tyбокурариновая нервно-мышечная блокада у кошки может усилить это его действие на 25 %. Хинидин усиливает блокаду, вызываемую недеполяризующими миорелаксантами.
- Блокаторы кальциевых каналов. Верапамил и нифедипин потенцируют нервно-мышечную блокаду, индуцируемую d-тубокурарином, панкуронием, атракурием и векуронием.
- Сульфат магния. Магний потенцирует нервно-мышечную блокаду, создаваемую панкуронием и векуронием. У пациентов, получающих вливания сульфата магния, дозу векурония нужно снижать. Магний ослабляет пресинаптическое высвобождение ацетилхолина, снижает чувствительность постсинаптической мембраны к нему и ослабляет возбудимость мембраны мышечного волокна.
- Метилксантины. Аминофиллин и теофиллин играют роль антагонистов панкурония. Непрерывное вливание аминофиллина может не позволить ему индуцировать нервно-мышечную блокаду. Вероятно, это связано с вызываемым ами-нофиллином ингибированием фосфодиэстеразы, приводящим к повышению уровня циклического аденозинмо-нофосфата и, по-видимому, ацетилхолина.
- Фенитоин. Долговременная терапия фенитоином может создать резистентность к метокурину, панкуронию и векуронию, но не к атракурию. Фенитоин способен на 50 % сократить продолжительность нервно-мышечной блокады. Вероятно, он дает пресинаптический эффект, близкий к производимому недеполяризующими миорелаксантами.
- Карбамазепин. Пациенты, получающие карбамазепин, бывают резистентными к панкуронию. Продолжительность действия панкурония и векурония у них может сократиться на 65 %.
- Карбонат лития. Литий способен потенцировать панкурониевую блокаду и индуцировать миастеническую реакцию. Он ослабляет синтез и выделение ацетилхолина нервными окончаниями.
- Азатиоприн. Азатиоприн выступает в роли относительно слабого и транзиторного антагониста нервно-мышечной блокады.
- Циклоспорин. Циклоспорин в растворителе кремофоре и сам кремофор могут потенцировать нервно-мышечную блокаду, индуцируемую векуронием и атракурием.
- Кортикостероиды. Индуцируемую панкуронием блокаду можно ослабить у пациентов, получающих долговременную стероидную терапию. Кортикостероиды повышают также вероятность пареза при введении вместе со стероидным миорелаксантом, например панкуронием или векуронием.

и) Механизм действия нервно-мышечных блокаторов (миорелаксантов).
- Деполяризующие миорелаксанты:
Сукцинилхолин. Природный нейромедиатор ацетилхолин действует не только на никотиновые рецепторы в нервно-мышечных синапсах и вегетативных ганглиях, но и на мускариновые рецепторы в гладких мышцах, миокарде и экзокринных железах.
Сукцинилхолин, обладая сходной структурой, проявляет активность в тех же самых местах.
Сердце. Брадикардия после первой инъекции сукцинилхолина может быть вызвана стимуляцией парасимпатических ганглиев или мускариновых рецепторов синусово-предсердного узла.
Высвобождение гистамина. Все основные соединения способны разрушать тучные клетки, приводя к высвобождению гистамина. Обычная доза 1 мг/кг может вызвать прилив крови к лицу, бронхоспазм, гипотензию и другие анафилактоидные реакции.
Гиперкалиемия. После сукцинилхолиновой деполяризации возможно небольшое увеличение плазменной концентрации ионов калия (около 0,5 ммоль/л, т. е. 0,5 мэкв/л). Если их уровень достигнет 7 — 8 ммоль/л, не исключены желудочковая фибрилляция и остановка сердца.
Нервно-мышечные эффекты. Возможны фасцикуляции, мышечная боль, миоглобинурия, повышение внугрижелудочного и внутриглазного давления.
- Недеполяризующие миорелаксанты:
Вегетативные эффекты. Большинство недеполяризующих миорелаксантов имеет в молекуле 2 положительно заряженные четвертичные аммонийные группы, которые присоединяются к отрицательно заряженным холинергическим рецепторам, создавая блокаду за счет конкурентного антагонизма с нейромедиатором.
Высвобождение гистамина. Миорелаксанты обычно непосредственно действуют на тканевые мастоциты и приводят к высвобождению ими гистамина без активации антителом или комплементом (анафилактоидная реакция). Выделение гистамина зависит от дозы и скорости введения миорелаксанта. Оно проявляется эритемой верхней части грудной клетки и лица, транзиторным повышением кровяного давления и учащением сердечных сокращений. Возможен бронхоспазм. Тяжелая реакция чревата сосудистым коллапсом.

Лечение отравления наружными анестетиками
а) Стабилизация состояния при отравлении наружными анестетиками. У всех пациентов проверяют проходимость дыхательных путей, стабилизируют вентиляцию и кровообращение. Предназначенные для наружного применения (нанесения на кожу и слизистые оболочки) анестетики в достаточно высокой дозе могут вызывать припадки, угнетение сердечно-сосудистой функции и дыхания, а также бронхоспазм. Лечение симптоматическое и поддерживающее. Необходимы кардиомониторинг. доступ в вену и кислород. Всем пациентам с помраченным сознанием назначают налоксон, глюкозу и тиамин.
б) Очистка пищеварительного тракта. Системные уровни введенного перорально или наружно (через слизистые оболочки) лидокаина и его метаболитов МЭГК и ГК быстро снижаются после применения активированного угля. Наружные анестетики, нанесенные на кожу, можно быстро удалить, несколько раз обмыв кожу водой с мылом.
Промывание желудка проводят после эндотрахеальной интубации. Возможность припадков требует тщательного сопоставления пользы и риска (например, аспирационного пневмонита) при таком промывании.
в) Усиление выведения. Данных, подтверждающих эффективность форсированного диуреза, гемодиализа и гемоперфузии после токсической реакции, индуцированной наружными анестетиками, слишком мало.
г) Антидоты наружных анестетиков. Тяжелая метгемоглобинемия после наружного применения анестетиков (лидокаина, бензокаина) быстро купируется внутривенным введением метиленового синего (1—2 мг/кг в виде 1 % раствора в течение 5 мин). Желательно держать этот препарат под рукой в бронхоскопическом кабинете.
Для других токсических реакций на наружные анестетики (угнетение дыхания, сердечно-сосудистой функции, припадки) антидоты не известны.

д) Поддерживающая терапия при отравлении наружными анестетиками:
1. Применение сукцинилхолина требует осторожности, поскольку, подавляя периферические судороги, он маскирует наступление припадка на уровне центральной нервной системы. Кроме того, он может усилить или пролонгировать гипотензию, нервно-мышечную блокаду, апноэ и припадочную активность, особенно при интоксикации сложноэфирными анестетиками, поскольку они, как и сукцинилхолин, для метаболизации требуют псевдохолинэстеразы.
2. При сердечно-сосудистом коллапсе, вызванном наружными анестетиками, лучшее средство — дофамин, поскольку он оказывает инотропное действие как на сердце, так и на общее периферическое сопротивление сосудов, функции которых могут заметно нарушаться всосавшимися анестетиками.
3. Припадки, вызванные лидокаином, купируют диазепинами (например, лоразепамом, диазепамом или сходными противосудорожными средствами).
4. Необходимо вспомогательное дыхание с интубацией.
5. Угнетение сердечно-сосудистой функции может потребовать хронотропных средств и инфузионной терапии.
6. С точки зрения снижения токсичности наружных анестетиков очень важны профилактические меры. Когда эти средства наносят на слизистую оболочку полости рта, надо требовать от пациента, чтобы он отхаркивал их избыток для уменьшения всасывания.
Поскольку дети в возрасте младше 7 лет не умеют отхаркивать, если их специально этому не научили, такая анестезия представляет для них особую опасность.
7. Изготовитель ксилокаинового геля (2 %) не рекомендует применять его против зубной боли.
8. Для снижения риска бензокаиновой метгемоглобинемии необходимо следующее:
а. Управление FDA должно изменить маркировку препаратов, а также стандарты, ограничивающие концентрацию активного вещества и доступность бензокаиновых средств без рецептов.
б. Все продукты, содержащие более 8 % бензокаина, на упаковке должны иметь предупреждение о риске метгемоглобинемии, пропорциональной дозе этого средства, и рекомендации по дозам метиленового синего, необходимого в качестве антидота.
в. Все фармацевтические справочники для врачей должны содержать информацию о риске метгемоглобинемии при использовании продуктов с содержанием бензокаина выше 8 % и рекомендуемые дозы метиленового синего для экстренного лечения этого побочного эффекта.
г. Бензокаиновые аэрозоли, гели и мази не следуют применять при анестезии у младенцев и пациентов с анемией и другими болезнями, при которых особую опасность представляет снижение кислородной емкости крови. Бензокаин не следует наносить на кожу и слизистую оболочку с нарушенной барьерной функцией, т. е. с повышенной способностью к всасыванию препарата.
Импульсная оксигемометрия, хотя и выявляет метгемоглобинемию, недооценивает ее величину примерно вдвое при низких концентрациях метгемоглобина и может показывать снижение насыщения крови кислородом всего до 80 — 85 % при 70 % метгемоглобинемии.
Применяя наружную анестезию бензокаином, желательно давать чистый кислород пациенту с риском гипоксии.
9. Не рекомендуется наносить ТАК на слизистые оболочки и поврежденную кожу. Компетентные органы, например Управление FDA и/или Фармацевтический комитет Американской педиатрической академии, должны изучить данные по этому комплексному препарату и выпустить рекомендации по его применению.
10. При мониторинге течения лидокаиновой интоксикации полезно следить за уровнем анестетика в крови. Существуют методы определения в ней концентраций кокаина и тетракаина (например, при использовании ТАК). В целом лечение основано прежде всего на клинической картине, а лабораторные данные используются в основном для подтверждения диагноза и результатов предпринимаемых мероприятий.

а) Стабилизация состояния при отравлении нервно-мышечными блокаторами (миорелаксантами):
1. Немедленно проверяют проходимость дыхательных путей и по показаниям обеспечивают вспомогательное дыхание.
2. Дают пациенту 100 % кислород, подключают кардиомонитор и обеспечивают доступ в вену.
3. Следует учитывать, что такие применяемые при хирургическом вмешательстве медикаменты, как общие анестетики, опиатные агонисты и барбитураты, могут усиливать и продлевать угнетение дыхания.
4. Если появляются признаки злокачественной гипертермии, требуется ее экстренное лечение (см. соответствующий раздел выше), включая дантролен (1—2 мг/кг внутривенно) и охлаждающие меры.
5. Поскольку антагонисты сукцинилхолина не известны, поддержку дыхания продолжают до спонтанного исчезновения мышечного паралича.
6. Когда нарушена сердечно-сосудистая функция, пациенту придают оптимальное положение, вводят жидкости и применяют по показаниям сосудосуживающие средства.
7. Незапланированно долгая нервно-мышечная блокада может свидетельствовать о передозировке. Для оценки возврата к норме полезен мониторинг реакции мышечного подергивания в ответ на стимуляцию периферического нерва.
б) Снятие нервно-мышечной блокады. Нервно-мышечная блокада проходит самопроизвольно по мере диффузии миорелаксанта из мест его действия. Деполяризующие средства (сукцинилхолин) связываются с рецепторами неконкурентно, поэтому в большинстве случаев фармакологически повлиять на них невозможно.
Ингибиторы ацетилхолинэстеразы (эдрофоний, неостигмин и пиридостигмин) повышают уровень ацетилхолина, доступного для конкуренции за места связывания, поэтому в принципе ускоряют возврат к норме. Все эти средства, как и ацетилхолин, дают никотинергический и мускаринергический эффекты. Мускариновую стимуляцию, чреватую слюнотечением, брадикардией, слезотечением, миозом и бронхоспазмом, можно свести к минимуму благодаря предварительному введению антихолинергического средства, например атропина или гликопирролата.
4-Аминопиридин усиливает пресинаптическое высвобождение ацетилхолина. Антагонисты обычно не применяют, пока не начинается спонтанное ослабление нервно-мышечной блокады.
Если снятие блокады идет неадекватно из-за сильного ослабления организма, обширного карциноматоза, действия угнетающих дыхание средств или присутствия других веществ, влияющих на нервно-мышечное проведение импульсов, показаны симптоматическое лечение и ручная или механическая вспомогательная вентиляция, пока состояние не нормализуется.
- Химическая структура средств, снимающих нервно-мышечную блокаду:
Эдрофоний — синтетическое четвертичное аммонийное соединение.
Неостигмин — синтетическое четвертичное аммонийное соединение.
Пиридостигмин — синтетическое четвертичное аммонийное соединение.
Атропин — алкалоид (третичный амин).
Гликопирролат — синтетическое четвертичное аммонийное соединение.
4-Аминопиридин — производное пиридина.
в) Пролонгированный паралич. Продолжительное применение недеполяризующих нервно-мышечных блокаторов (НМБ), особенно векурония и панкурония, чревато пролонгированной слабостью. Наблюдалось 2 типа такой нервно-мышечной дисфункции. Во-первых, пролонгированная блокада и слабость (несколько часов — недель) после завершения лечения, вероятно, обусловленные накоплением активных метаболитов НМБ; во-вторых, миопатия, приводящая к слабости, которая сохраняется в течение нескольких недель — месяцев.
г) Миопатия. Клиническая картина может включать вялый паралич, сильную — тяжелую слабость (проксимальные мышцы часто поражены больше дистальных), трудности с переходом на самостоятельную вентиляцию, нормальные сознание и сенсорные функции, нормальную работу черепных нервов или гипофункцию лицевого нерва, офтальмоплегию и в тяжелых случаях аспирацию. Симптомы исчезают через несколько недель — месяцев.
Электромиография показывает пониженную амплитуду вызванных двигательными нейронами потенциалов при сохранности скорости проведения и сенсорных реакций, стабильную или постепенно затухающую реакцию на ритмическую стимуляцию, спонтанные слабые положительные волны/фасцикуляции и кратковременную низкоамплитудную полифазную реакцию двигательных единиц при введении игольчатого электрода. Уровень креатинфосфокиназы в норме или повышен. Мышечная биопсия демонстрирует атрофию волокон типов I и II и некроз волокон в отсутствие воспаления.
Этот синдром бывает обусловлен долговременным применением одних лишь НМБ, а также их сочетаний с кортикостероидами, с другими средствами (например, антибиотиками-аминогликозидами, клиндамицином в высоких дозах, литием, тетрациклинами, производными полимиксина/линкомицина) или с некоторыми расстройствами (ацидозом, повышенным сывороточным уровнем магния, печеночной и почечной недостаточностью).
Дифференциальная диагностика включает полиневропатию при критическом заболевании, атрофию вследствие бездействия, расстройство центральной нервной системы, синдром Гийена — Барре, ботулизм и миастению.
д) Векуроний. Индуцированный векуронием пролонгированный паралич сочетался с почечной недостаточностью и высокими плазменными концентрациями его активного метаболита 3-дезактинеорония. Почечная функция при этом обычно в норме.
Лечение. Лечение в основном симптоматическое и поддерживающее. Обычно наступает полное выздоровление.

Читайте также:
