Лечение ювенильного дерматомиозита. Прогноз
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Дерматомиозит (ДМ) у ребенка: причины, клиника, диагностика, лечение
Воспалительные миопатии — гетерогенная группа приобретенных заболеваний мышц. Некоторые из них вызываются специфическими агентами; в основе других лежат аутоиммунные механизмы. Последнюю группу, самую большую среди приобретенных, т.е. неинфекционные воспалительные миопатии, можно разделить на три большие подгруппы: дерматомиозит, полимиозит и спорадический миозит с включенными тельцами. Они различаются клинически, патогенетически и иммунологически, это имеет значение при выборе тактики лечения.
Дерматомиозит у детей встречается относительно часто, имеет четкую клиническую картину и обычно не вызывает больших затруднений при диагностике. Полимиозит, наоборот, встречается резко, и его часто ошибочно принимают за неспецифическое вторичное воспаление, сопутствующее таким заболеваниям, как, например, дистрофии. Спорадический миозит с включенными тельцами у детей встречается редко. В обзоре Dalakas (2004) рассматриваются достижения в изучении этих заболеваний.
Дерматомиозит (ДМ) — это системная гуморально опосредованная микроангиопатия, поражающая в основном мелкие сосуды, капилляры, артериолы и венулы (Dalakas, 2006а). Микроангиопатия является причиной всех патологических изменений мышц, мелких нервов, желудочно-кишечного тракта, соединительной ткани и кожи. Хотя провоцирующий фактор до сих пор остается неизвестным, иммунопатогенез обусловлен активацией системы комплемента и отложением агрессивных мембранолитических комплексов на эндомизии мелких кровеносных сосудов.
В отличие от взрослых, паранеопластический дерматомиозит (ДМ) у детей встречается крайне редко (Martini et al., 2005). Дерматомиозит (ДМ) может развиться у пациентов с Х-сцепленной агаммаглобулинемией, обычно вместе с поражением ЦНС, а также в результате реакции отторжения трансплантата (Urbano-Marquez et al., 1986). Описан ДМ-подобный синдром, спровоцированный инфекцией Toxoplasma gondii (Topi et al., 1979; Schroter et al., 1987; Harland et al., 1991).
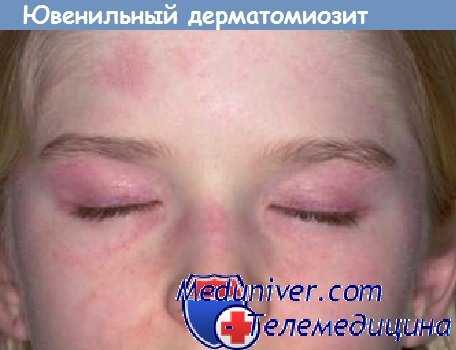
Дерматомиозит у детей - ювенильный дерматомиозит
а) Клинические проявления и диагностика. Дебют обычно в возрасте 5-15 лет. В одной трети случаев заболевание манифестирует остро или подостро, с повышением температуры, болями в мышцах и суставах. У остальных пациентов дебют протекает скрыто, и сопровождается слабостью, утомляемостью, анорексией и иногда небольшим повышением температуры. В одном исследовании средний интервал между манифестацией симптомов и постановкой диагноза составил три месяца, разброс от 0,5 до 20 месяцев (Pachman et al., 1998). Диагноз может быть выставлен с опозданием, особенно когда заболевание манифестирует преимущественно системными нарушениями или расстройствами поведения, или же если кожные проявления и мышечная слабость отсутствуют или остаются нераспознанными.
Кожные проявления вариабельны. Красно-лиловая (гелиотропная или фиалковая) диспигментация появляется на верхних веках, в периорбитальной и скуловой областях. Возможен периорбитальный отек. Такая же сыпь, часто чешуйчатая, может появиться на разгибательных поверхностях суставов пальцев, локтей, коленей и лодыжках. Иногда кожные изменения, которые могут быть светочувствительными, распространены более широко и возникают также на туловище. Сыпь может быть малозаметной и остаться необнаруженной при недостаточно тщательном осмотре. Иногда заметны маленькие инфаркты кожи. Мышечная слабость симметрично поражает главным образом мышцы проксимальных отделов, часто — разгибатели шеи и сопровождается неопределенными мышечными болями и скованностью, иногда поражаются глазодвигательные мышцы.
В одной большой серии наблюдений более чем у 40% детей на момент постановки диагноза отмечалась дисфагия и хрипота (Pachman et at., 1998). Рано развиваются контрактуры суставов. В некоторых случаях больные быстро теряют способность к самообслуживанию.
Симптомы поражения жеудочно-кишечного тракта развиваются примерно у 20% пациентов, изъязвление толстой кишки угрожает летальным исходом (Bowyer et al., 1983). У некоторых детей наблюдаются ретинальные экссудаты. Могут отмечаться бессимптомные нарушения функций легких (Trapani et al., 2001), но респираторный дистресс вследствие поражения паренхимы легких у детей развивается реже (Al-Mayoufet al., 2001), чем у взрослых (Arakawa et al., 2003). Часто отмечаю тся ЭКГ-изменения (Pachman 1990). Описаны редкие случаи васкулопатий и васкулита, связанные с ЦНС (Ramanan et al., 2001).
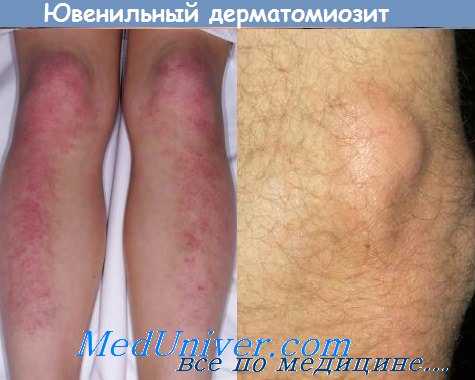
Хронизация процесса проявляется генерализованным истончением мышц и тяжелыми контрактурами. Кожа над суставами пальцев становится толстой и обесцвеченной. Может развиться генерализованная, частичная или локализованная липодистрофия (Ramanan и Feldman, 2002). Кальциноз подкожных тканей развивается в 25-50% случаев, но обычно длительное время остается незамеченным, и задержка диагностики и лечения увеличивает вероятность его развития (Pachman et al, 1998). Он может локализоваться под деколорированными участками кожи или быть более выраженным вдоль фасций (системный кальциноз, calcinosis universalis). Отторжение отложений кальция через хронические гнойные изъязвления («кальциевое молоко») является сложной терапевтической проблемой. Часто через много лет после стихания воспаления мышц именно кальцификация и контрактуры суставов становятся основной длительно существующей проблемой (Ramanan и Feldman, 2002).
Ранняя диагностика ДМ иногда вызывает трудности до появления высыпаний и выраженной слабости, поэтому нужно всегда помнить об этом заболевании при обследовании ребенка со сниженной двигательной активностью и болями (Dubowitz, 1995). Но при наличии типичных высыпаний, слабости проксимальных отделов конечностей, повышенного уровня КК или положительных маркеров воспаления клинический диагноз обычно не вызывает сомнений. Нормальный уровень КК не исключает ДМ. При ЭМ Г, необходимой только в неясных диагностических случаях, может наблюдаться повышенная активность введения с миопатическими потенциалами, фибрилляции и положительные острые волны в покое. УЗИ мышц и МРТ выполняются при постановке диагноза и дальнейшем наблюдении (Collison et al, 1998; Maillard et al., 2004).
Обычно выполняется скрининг на различные антитела, даже такие крайне высокоспецифичные как анти-Jol антитела, но в педиатрической практике его результаты, как правило, мало влияют на диагностику и лечение. Подробно этот вопрос рассмотрен Garlepp и Mastaglia (2000).
Даже в клинически типичных случаях диагноз должен подтверждаться исследованием биоптата мышечной ткани. Исчезновение капилляров вызывает поражение мышечных волокон, ишемические микроинфаркты, развитие воспаления и выраженную перифасциальную атрофию (Dalakas, 2004). Обычно выявляются периваскулярные инфильтраты, но в небольших образцах они могут остаться незамеченными. Дальнейшее уточнение диагноза требует иммуноцитохимического исследования для выявления таких аномалий, как отложение агрессивных мембранных комплексов (Sakuta et al., 2005).

Дерматомиозит:
а - несмотря на разрешение кожного воспаления и миозита после приема системных кортикостероидных препаратов (КСП), телеангиэктазии прогрессируют на лице у этой 6-летней девочки.
б - обширный кальциноз кожи, особенно над костными выступами, привел к развитию хронических болезненных дренирующих язв и панникулита у этого 12-летнего мальчика с разрешившимся дерматомиозитом.
Обратите внимание на белые, напоминающие мел, отложения кальция у основания язвы на колене.
б) Лечение. При систематическом обзоре литературы было выявлено отсутствие высококачественных рандомизированных контролируемых исследований эффективности и токсических эффектов иммунотерапии, даже у взрослых (Choy et al., 2005), но общепринята первичная терапия кортикостероидами. При отсутствии лечения смертность составляет около 30%, при лечении она снижается до 10% и ниже (Bowyer et al., 1983). Существуют различные подходы к лечению, но общим правилом является назначение достаточно высокой начальной дозы кортикостероидов с целью достичь выраженного увеличения мышечной силы, после чего дозу постепенно снижают, чтобы уменьшить побочное действие, но в то же время сохранить достигнутый эффект. Традиционно начальная доза преднизолона составляет приблизительно 2 мг/кг/день, которую постепенно снижают в течение периода длительностью до двух лет, что соответствует средней продолжительности активной фазы заболевания.
Некоторые авторы эффективно применяют меньшие дозы в 1,0-1,5 мг/кг/день (Miller et al., 1983; Dubovitz, 1995), постепенно снижая дозу после начала эффекта терапии; таким образом, общая длительность лечения уменьшается до 3-6 месяцев. Заметные улучшения в виде повышения двигательной активности и в показателях мышечной силы обычно отмечаются через 2-4 недели после начала терапии. Скорость уменьшения дозы препарата определяется скоростью развития терапевтического эффекта и необходимостью минимизации побочных явлений. Некоторые авторы предлагают снижать дозу со скоростью 5-10 мг в месяц, но окончательное решение о скорости снижения дозы должно приниматься индивидуально на основании соотношения эффективность/побочное действие. Часто отмечаются рецидивы, требующие временного повышения дозы (Spencer et al., 1984).
Редко наблюдается нормализация состояния пациента после пульс-терапии высокими дозами метилпреднизолона внутривенно, что значительно снижает выраженность побочных эффектов, наблюдаемых при длительном приеме пероральных кортикостероидов, но у большинства больных при применении только такой схемы лечения наблюдается прогрессирование заболевания (Lang и Dooley, 1996). Этот метод можно применять в резистентных случаях (Laxer et al., 1987).
У 10-20% пораженных детей не развивается удовлетворительного эффекта терапии кортикостероидами и требуется применение других видов иммуносупрессивной терапии. Внутривенное введение иммуноглобулина в контролируемом исследовании оказалось эффективным у взрослых (Dalakas, 1998) и предлагается в качестве терапии второй линии (Dalakas, 2006b). В стероид-резистентных случаях с различной эффективностью применяются метотрексат (Hanissian et al., 1982), циклоспорин (Heckmatt et al., 1989), азатиоприн и циклофосфамид (Riley et al., 2004). Исследований их относительной эффективности при ювенильном ДМ не проводилось. Плазмаферез в стероид-резистентных случаях оказался неэффективным (Miller et al, 1992).
Результаты лечения кальциноза и по сей день неудовлетворительны, и часто кальциноз остается серьезной проблемой даже после исчезновения или хотя бы стабилизации мышечной слабости. У одного ребенка описан лечебный эффект алендората (Mukamel et al., 2001), но сведения о единичных случаях применения этого и других препаратов отрывочны.
Несмотря на лечебный эффект проводимого лечения, длительный результат не может быть гарантирован. В мультицентровом исследовании на материале 65 пациентов с ювенильным ДМ при среднем сроке наблюдения семь лет у 47 пациентов (72%) отмечалась минимальные нарушения дееспособности или не отмечались вовсе (Huber et al., 2000). Однако у значительного числа пациентов заболевание остается хронически активным, часто наблюдаются побочные эффекты терапии, например задержка роста (Ramanan и Feldman, 2002). Требуются мультидисциплинарный подход и совместные усилия медицинских работников и смежных специалистов, имеющих опыт лечения этого заболевания. Физиотерапия, направленная прежде всего на профилактику развития контрактур, является важной частью лечения, так как пожизненная нетрудоспособность часто развивается вследствие контрактур и кальциноза.
Еще предстоит выяснить, приводит ли специфическая целевая иммунотерапия к значительным улучшениям результатов лечения (Dalakas, 2004).
Клинические и некоторые неспецифические патологические проявления миозита встречаются не только при ДМ. Несмотря на успехи в понимании иммунопатогенеза воспалительных миопатий, смешанные заболевания соединительной ткани и другие перекрывающие синдромы все еще препятствуют выделению этих расстройств в отдельные подгруппы. Разработаны диагностические критерии склеромиозита детей с миалгией — миозитом, артралгией — артритом, склеротическими пальцами и феноменом Рейно (Blaszczyk et al., 1991).
Лечение ювенильного дерматомиозита. Прогноз
Ювенильный дерматомиозит. Причина
Ювенильный дерматомиозит, самая частая форма воспалительных миопатий у детей, представляет собой системную ангиопатию с характерными кожными проявлениями и очаговым миозитом, который приводит к прогрессирующей слабости проксимальных групп мышц и требует быстрого начала иммуносупрессивной терапии.
Ювенильный дерматомиозит, по-видимому, провоцируется антигенной стимуляцией у генетически предрасположенных детей — носителей антигена HLA-DQA1*0501. Провоцирующим фактором могут быть эпизодические заболевания, поскольку после них обнаруживаются новые случаи ювенильного дерматомиозита. Свежие случаи этого заболевания связывают с заражением энтеровируса (вирусом Коксаки В).
В Великобритании у больных найдена соответствующая РНК, а в США повышение титра комплементфиксирующих нейтрализующих антител. Развитие ювенильного дерматомиозита наблюдалось и после заражения стрептококками группы А. Серологические исследования не обнаруживают связи этого заболевания с инфекциями, вызываемыми Toxoplasma gondii, ВПГ или гепатита В. При исследовании экспрессии генов в мышечной ткани нелеченных больных ювенильным дерматомиозитом (носителей HLA-DQA1*0501) найдена усиленная реакция на ИФН-а и ИФН-b.
Это подтверждает мнение о роли антигенной стимуляции иммунного ответа в развитии этоого заболевания.

Ювенильным дерматомиозитом ежегодно заболевают 3,2 из 1 млн детей. Колебания этого показателя от года к году, по-видимому, одинаковы среди всех расовых групп, но 73% всех случаев приходится на детей белой расы. В среднем заболевание проявляется в 6,7 года. У детей, заболевших до 7-летнего возраста, ювенильный дерматомиозит обычно протекает менее тяжело. В США среди заболевших общее соотношение девочек и мальчиков равно 2,3:1.
Предрасположенность к болезни связана, очевидно, с HLA II класса DQA1*0501, который обнаруживается более чем у 80 % больше детей в США. Хроническое течение болезни ассоциируется с заменой G на А в положении 308 промоторной области гена ФНО-а. У детей с аллелем ФНО-а 308А, по сравнению с больными без этого аллеля, часто повышена клеточная продукция ФНО-а, болезнь носит хронический характер, но необходима иммуносупрессивная терапия продолжительностью более 36 мес, чаще наблюдается патологическое обызвествление.
Повреждение эндотелиальных клеток предполагаемым антигеном или иммунными комплексами сопровождается активацией комплемента и выпадением антигена vWF из поврежденных клеток. Патологическим подтверждением диагноза служит окклюзия капилляров и артериол с очаговым инфарктом ткани, атрофией волокон по периферии мышечных пучков и лимфоцитарной инфильтрацией. В свежих случаях в мышцах обнаруживается в 4 раза больше NK-клеток (CD56), чем в крови, что указывает на их роль в патогенезе ювенильного дерматомиозита. В пораженных мышцах присутствуют и другие Т-лимфоциты.
Количество моноцитов/макрофагов (CD14) коррелирует с уровнем неоптерина (фактора, выделяемого макрофагами и действующего на Т-лимфоциты) в сыворотке крови. Выраженный фиброз мышц приводит к ограничению подвижности. В пораженных участках кожи наблюдаются истончение эпидермиса, отек и воспалительные изменения сосудов дермы.
Полимиозит
Полимиозит — системное воспалительное поражение мышечной ткани преимущественно поперечно-полосатой мускулатуры конечностей с развитием болевого синдрома, прогрессирующей слабости и атрофии пораженных мышц. Возможно появление патологических изменений в легких и сердце. Диагностика полимиозита включает консультации ревматолога и смежных специалистов, лабораторные исследования, электромиографию, биопсию мышечной ткани, обследование соматических органов (ЭКГ, УЗИ, рентгенографию). Лечение полимиозита проводят стероидными гормонами и иммунодепрессантами.
МКБ-10
Общие сведения
Полимиозит относится к системным аутоиммунным заболеваниям и входит в группу идеопатических воспалительных миопатий. Случаи возникновения полимиозита наблюдаются у людей любого возраста, однако пик заболеваемости отмечается среди детей от 5 до 15 лет и среди взрослых в возрасте от 40 до 60 лет. Примерно 70% случаев полимиозита приходится на лиц женского пола. Довольно часто возникновение полимиозита наблюдается на фоне другой аутоиммунной патологии и у пациентов со злокачественными новообразованиями.
Причины возникновения полимиозита
На сегодняшний день этиологические факторы полимиозита находятся в стадии изучения. Предполагается провоцирующая роль некоторых вирусов (например, цитомегаловируса, вирусов Коксаки) в запуске аутоиммунного механизма заболевания. Немаловажная роль в этом отводится антигенному сходству отдельных видов вирусов и мышечной ткани. Проведенные в последние годы генетические исследования обнаружили у некоторых пациентов маркеры наследственной предрасположенности к возникновению полимиозита.
Среди триггерных факторов, возможно запускающих развитие полимиозита, выделяют переохлаждение, повышенную инсоляцию, хроническую инфекцию, травмы, лекарственную аллергию (крапивница, медикаментозный дерматит, токсикодермия, синдром Стивенса-Джонсона).
Классификация полимиозита
Согласно одной из классификаций, которыми пользуется клиническая ревматология, выделяют 6 форм полимиозита. Первичный полимиозит — проявляется поражением мышц проксимальных отделов конечностей и шеи, а также глотки, гортани и пищевода. В некоторых случаях сопровождается артралгией. Первичный дерматомиозит — полимиозит, сопровождающийся кожными проявлениями в виде эритематозных пятен на лице и в области суставов. Возможны поражения слизистой глаз (конъюнктивит), ротовой полости (стоматит), и глотки (фарингит).
Полимиозит при злокачественных процессах — чаще всего наблюдается у лиц старше 40 лет. Наиболее часто он развивается на фоне рака легкого, молочной железы, желудка, толстого кишечника, предстательной железы, яичников. Возможно его появление при лимфоме. Детский полимиозит — в большинстве случаев сопровождается кожными проявлениями, появлением внутрикожных и подкожных кальцификатов. Характеризуется прогрессирующим течением с образованием мышечных атрофий и контрактур; поражением сосудов ЖКТ с развитием васкулита и тромбоза, приводящих к появлению острых болей в животе, желудочно-кишечных кровотечений, иногда — изъязвлений и перфораций стенки кишечника.
Полимиозит при других аутоиммунных болезнях — может возникать при системной красной волчанке, болезни Шегрена, ревматоидном артрите, склеродермии. Миозит с включениями — является редко встречающейся формой полимиозита и отличается поражением мышц дистальных отделов конечностей. Свое название эта форма полимиозита получила благодаря тому, что при исследовании биоптата пораженных мышц в мышечных волокнах наблюдаются включения.
Симптомы полимиозита
Для полимиозита наиболее типично подострое начало с постепенно развивающимся поражением мышц тазового и плечевого пояса. Зачастую к мышечному синдрому присоединяются различного рода поражения соматических органов: ЖКТ, сердца, легких. У 15% больных полимиозитом наблюдается суставной синдром.
Мышечный синдром проявляется в первую очередь болями в мышцах при движении, прощупывании и даже в покое. Боли сопровождаются прогрессирующей мышечной слабостью, из-за которой пациент не может полноценно осуществлять активные движения: поднять и удержать конечность, держать предметы в руках, поднять голову с подушки, встать, сесть и т. п. Наблюдается уплотнение и отечность пораженных мышц. Со временем при полимиозите в пораженных мышцах развиваются атрофии, миофиброз и контрактуры, в некоторых случаях - кальциноз. Выраженное и распространенное поражение мышц может приводить к полной обездвиженности пациента.
Возможно течение полимиозита с поражением гладкой мускулатуры глотки, гортани и пищевода. В таких случаях развивается дисфагия (трудности при проглатывании пищи, поперхивания во время еды) и дизартрия (нарушение речи). При распространении процесса на глазодвигательные мышцы может отмечаться опущение верхнего века (птоз), двоение предметов (диплопия), косоглазие. При вовлечении в процесс мимической мускулатуры лицо пациента с полимиозитом принимает обездвиженный маскообразный вид.
Суставной синдром характеризуется поражением лучезапястных суставов и мелких суставов кисти. Реже при полимиозите наблюдается поражение плечевых, локтевых, голеностопных и коленных суставов. В области пораженного сустава отмечаются типичные признаки его воспаления: отечность, болезненность, покраснение, ограничение движений в суставе. В коже над суставами возможно отложение кальцификатов. Артрит у больных полимиозитом, как правило, протекает без деформации сустава.
Поражения внутренних органов у половины пациентов с полимиозитом проявляются различными желудочно-кишечными симптомами: боли в животе, анорексия, запор или понос, симптомы кишечной непроходимости. Возможно эрозивное поражение слизистой ЖКТ с развитием кровотечения, прободной язвы желудка или перфорации кишечника. Возникновение пневмонии при полимиозите обусловлено гиповентиляцией легких из-за слабости дыхательной мускулатуры и попаданием пищи в дыхательные пути при поперхиваниях. Со стороны сердечно-сосудистой системы у пациентов с полимиозитом может наблюдаться синдром Рейно, аритмии, миокардит, гипотония, развитие сердечной недостаточности.
Течение полимиозита
Острое течение полимиозита развивается на фоне лихорадки и интоксикации. Характеризуется быстро прогрессирующим поражением мышц, сопровождающимся дисфагией и дизартрией. Очень скоро наступает обездвиженность больного, развиваются сердечно-легочные поражения. При отсутствии лечения высока вероятность смертельного исхода заболевания.
Подострое течение полимиозита отличается более плавным течением с периодами улучшения. Однако оно сопровождается неуклонным прогрессированием мышечной слабости от обострения к обострению, присоединением поражений соматических органов. Хроническое течение полимиозита является наиболее благоприятным и отличается поражением отдельных мышечных групп, что позволяет пациентам длительное время сохранять трудоспособность.
Диагностика полимиозита
При подозрении на полимиозит пациенты направляются на консультацию ревматолога. Для дифференциации мышечного синдрома от миастении может потребоваться консультация невролога. Наличие симптомов со стороны сердечно-сосудистой системы, легких, органов ЖКТ являются показанием для консультации соответственно кардиолога, пульмонолога, гастроэнтеролога.
В клиническом анализе крови у пациентов с полимиозитом выявляются признаки воспалительного процесса: ускорение СОЭ и лейкоцитоз. Данные биохимического анализа крови свидетельствуют о повышении уровня «мышечных ферментов» (АЛТ, АСТ, КФК, альдолазы). При полимиозите их используют для оценки степени активности происходящего в мышцах воспалительного процесса. В 20% случаев полимиозита наблюдается наличие антинуклеарных антител, у небольшой части пациентов выявляется ревматоидный фактор.
Электромиография при полимиозите проводится для исключения других нервно-мышечных заболеваний. Она определяет повышенную возбудимость и спонтанные фибрилляции, низкую амплитуду потенциалов действия. Оценку состояния внутренних органов проводят по данным копрограммы, УЗИ органов брюшной полости, гастроскопии, ЭКГ, УЗИ сердца, рентгенографии легких.
Большую диагностическую ценность при полимиозите представляет собой гистологическое исследование мышечных волокон, для получения которого проводится биопсия мышц. Забор материала чаще производят из участка двуглавой мышцы плеча, бицепса или квадрицепса. Гистологическое исследование выявляет характерное для полимиозита наличие в мышечной ткани полостей (вакуолей), дегенерацию и некроз мышечных волокон, лимфоцитарную инфильтрацию мышечной ткани и стенок проходящих в ней сосудов.
Лечение полимиозита
Базовая терапия пациентов с полимиозитом заключается в назначении глюкокортикостероидов (преднизолон) с постепенным снижением дозы до поддерживающего уровня. Однако такое лечение не всегда эффективно. Терапия глюкокортикостероидами дает результат лишь у 25-50% пациентов и оказывается вовсе неэффективной при миозите с включениями.
Отсутствие улучшения в состоянии пациента спустя 20 дней от начала лечения является показанием к назначению иммунодепрессантов. В первую очередь это парентеральное введение метотрексата. Препаратом запаса является азатиоприн. Лечение этими препаратами требует ежемесячного проведения биохимических проб печени. В терапии полимиозита также возможно применение хлорамбуцила, циклоспорина, циклофосфамида или их комбинаций.
Прогноз полимиозита
Наиболее неблагоприятный прогноз имеет острая форма полимиозита, особенно в случаях, когда пациент не получает адекватного лечения. Летальный исход может быть обусловлен развитием легочно-сердечной недостаточности или аспирационной пневмонии. Развитие полимиозита в детском возрасте является ухудшающим прогноз признаком, так как в этих случаях заболевание, как правило, неуклонно прогрессирует и приводит к обездвиженности больного. Пациенты с хронической формой полимиозита в большинстве случаев имеют благоприятный прогноз как для жизни, так и для трудовой деятельности.
Все дети с ювенильным дерматомиозитом должны даже зимой использовать солнцезащитные средства (без парааминобензойной кислоты), обеспечивающие максимальную защиту от ультрафиолета А и В. Прием витамина D в дозах, рассчитанных на массу тела ребенка, и диета с достаточным содержанием кальция уменьшают степень остеопении и частоту переломов.
Лечебные мероприятия проводят по указаниям опытного педиатра-ревматолога. При одних только легких кожных проявлениях, в отсутствие иммунологических и серологических признаков активного заболевания и цветовой слепоты у родственников можно назначать гидроксихлорохин (максимальная доза — 5 мг/кг/сут) или малые дозы (примерно 1 мг/кг/сут) кортикостероидов внутрь. Чтобы не пропустить начала поражения мышц, необходимо тщательно наблюдать за такими детьми, периодически проверяя их мышечную силу и определяя иммунные показатели и уровень мышечных ферментов в сыворотке крови. Новые очаги поражения мышц можно обнаружить с помощью МРТ.
При минимальном поражении мышц часто достаточно назначать кортикостероиды внутрь (преднизон в дозе 1-2 мг/кг/сут). Однако для быстрой нормализации активности мышечных ферментов используют периодическое внутривенное введение метилпреднизолона. Дополнительная терапия необходима и в тех случаях, когда остаются повышенными показатели воспаления (процент CD19 В-лимфоцитов, уровень неоптерина и антигена vWF). Во избежание желудочного кровотечения обычно назначают и ингибиторы секреции соляной кислоты. Сначала в течение 3 сут проводят внутривенную пульс-терапию кортикостероидами (метилпреднизолон в дозе 30 мг/кг/сут, но не более 1 г/сут); затем метилпреднизолон вводят реже (от 3 до 1 раза в неделю), пока не нормализуются показатели воспаления. Между внутривенными введениями метилпреднизолона больной должен ежедневно получать малые дозы (0,5 мг/кг/сут) преднизона внутрь.
Если лабораторные показатели снижаются медленнее, чем ожидалось, можно добавить метотрексат (15-20 мг/м2) в сочетании с фолиевой кислотой (1 мг в сутки). При отсутствия эффекта метилпреднизолона и метотрексата иногда используют циклофосфамид в дозе 500 мг/м3. Иммуносупрессия может приводить к снижению уровня IgG (< 300 мг%), и в этих случаях для предотвращения инфекций внутривенно вводят иммуноглобулин (0,4 г/кг в месяц).
Высокие дозы иммуноглобулина вначале могут ослаблять кожные симптомы, но не ясно, сказывается ли это на общем течении заболевания. В упорных случаях иногда помогает циклоспорин, который такда может ослаблять первичные кожные проявления болезни. Ингибиторы ФНО-а при хроническом течении заболевания помогают преодолеть скованность движений.
При дисфагии используют мягкую пищу или кормление через назогастральный зонд, пока лечение не восстановит защиту дыхательных путей. В редких случаях приходится прибегать к ИВЛ и трахеостомии или даже к экстракорпоральной мембранной оксигенации. Обширный васкулит ЖКТ может нарушать всасывание питательных веществ и лекарственных средств. В этих случаях требуется парентеральное питание и внутривенное введение лечебных препаратов. Повреждение почек, связанное с выведением больших количеств креатинина, устраняют инфузионной терапией.
Физио- и трудотерапия на ранних стадиях заболевания обеспечивает пассивное растяжение мышц, а после устранения активного воспаления помогает восстановить их силу и объем движений. Постельный режим не показан — вертикальная поза способствует сохранению плотности костей. Психологические проблемы, связанные с ограничением движений, преодолеваются с помощью социальных работников.
Главным осложнением часто бывает аспирационная пневмония, связанная с нераспознанным нарушением глотания жидкой пищи. Инфаркты кишечника могут приводить к перфорации и смерти. Кортикостероиды могут усугублять нарушения ЦНС, проявляющиеся депрессией и перепадами настроения.
Уже в момент постановки диагноза примерно у 20% больных имеются очаги обызвествления, что служит плохим прогностическим признаком. По-видимому, это обусловлено хроническим течением болезни и связано либо с поздним началом лечения, либо с недостаточным подавлением воспалительного процесса. Кальций в виде творожистой массы вначале откладывается в подкожных тканях и фасциях; эти отложения могут рассасываться, но иногда служат очагами инфекции (чаще всего — стафилококковой), которая может приводить к септицемии и смерти. Активная терапия, начатая сразу после установления диагноза, позволяет снизить частоту этого осложнения, Более чем в 10% случаев хронического ювенильного дерматомиозита развивается частичная липодистрофия. Она также ассоциирована с аллелям ФнО-а308А и характеризуется:
1) атрофией жировой ткани на конечностях, что придает им чересчур мускулистый вид;
2) acanthosis nigricans;
3) слабостью абдоминальных мышц с выпячиванием живота;
4) нарушением углеводного и жирового обмена.
У девочек могут прекращаться менструации; если заболевание начинается до периода полового созревания, не исключено бесплодие.
До внедрения кортикостероидной терапии 30 % больных детей погибали, а еще 30 % становились инвалидами. В настоящее время смертность составляет примерно 1 %. Хотя ювенильный дерматомиозит относят к хроническим заболеваниям, о последствиях постоянного воспаления сосудов известно очень мало. Активная иммуносупрессивная терапия сократила период выраженных симптомов с 3,5 до менее 1,5 года.
В отличие от многих взрослых с воспалительной миопатией, у детей с ювенильным дерматомиозитом, по-видимому, может восстанавливаться нормальное состояние сосудов и мышц, хотя результаты биопсии в отдаленные сроки болезни еще ждут своего анализа. Влияет ли частичная липодистрофия на смертность в зрелом возрасте, неизвестно. В целом новые способы мониторинга воспаления и более активная терапия значительно улучшили прогноз этого заболевания.
Ювенильный дерматомиозит ( Юношеский дерматомиозит )
Ювенильный дерматомиозит – это воспалительная миопатия детского возраста с преимущественным поражением проксимальных мышц конечностей, развитием системного васкулита и характерными изменениями кожи. Наблюдаются специфические кожные проявления в виде эритематозной сыпи вокруг глаз, а также в области шеи и крупных суставов (коленных и локтевых). Сопровождается прогрессирующей мышечной слабостью, в том числе – гладкой мускулатуры органов дыхания и пищеварения, а также поперечно-полосатой мышечной ткани сердца. Отмечается поражение суставов и кальциноз. Ювенильный дерматомиозит подтверждается после обнаружения миозитных антител в крови. Проводится терапия кортикостероидами и цитостатиками.
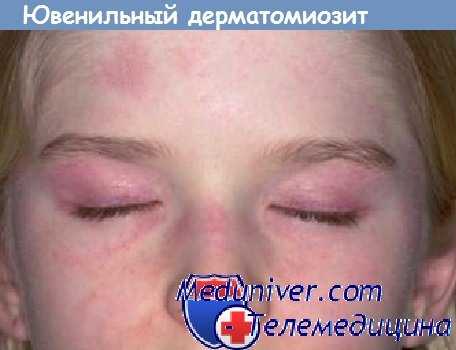
Ювенильный дерматомиозит занимает третье место по распространенности среди диффузных заболеваний соединительной ткани в детском возрасте. Частота встречаемости составляет 2-3 случая на 1 000 000 детей. Девочки заболевают примерно в 2 раза чаще мальчиков. Пик заболеваемости приходится на 3-5 и 7-9 лет. Успехи педиатрии в последние годы привели к значительному снижению уровня смертности от ювенильного дерматомиозита.
Несмотря на это, заболевание продолжает оставаться актуальным для детских болезней и ревматологии в связи с развивающейся атрофией мышц, которая может стать причиной детской инвалидности. Кроме того, представляют опасность случаи ранней заболеваемости с острым началом, когда дети в течение одного или нескольких лет погибают от сердечно-легочной недостаточности.
Причины
Этиология заболевания в настоящее время остается неизвестной. Обнаружение семейных случаев позволяет говорить о возможной генетической предрасположенности. Определенную роль играет вирусная инфекция, поскольку некоторые вирусы (вирусы Коксаки групп А и B, пикорнавирусы) часто обнаруживаются в крови у заболевших детей. Кроме того, ювенильный дерматомиозит может дебютировать на фоне вирусного заболевания либо спустя недолгое время после выздоровления. Основная роль в патогенезе отводится аутоиммунной реакции организма к собственным миоцитам, а также к гладкомышечным клеткам сосудистой стенки.
Симптомы ювенильного дерматомиозита
Заболевание обычно начинается подостро. Первым симптомом может быть мышечная слабость. Ослабление мышечной силы при ювенильном дерматомиозите характерно больше для проксимальных мышц конечностей, поэтому сначала ребенку становится тяжело поднимать руки (например, чтобы расчесаться) и подниматься по лестнице.
Со временем слабость иногда прогрессирует настолько, что пациент не может сесть из положения лежа и даже оторвать голову от подушки. Надавливание на мышцы при этом вызывает дискомфорт и является болезненным. Мышечная слабость может распространиться и на гладкую мускулатуру внутренних органов, из-за чего возникают сложности с дыханием и глотанием, возможны случаи поперхивания.
Примерно у половины больных ювенильный дерматомиозит дебютирует с поражения кожи. Кожные проявления очень специфичны. Так, характерны эритематозные высыпания на веках и вокруг глаз – симптом «дерматомиозитных» очков. Подобное поражение кожи отмечается в зоне суставов, как правило, коленных и локтевых, а также вокруг шеи и в области мелких суставов кисти. Часто в местах поражения отмечается истончение эпидермиса и поверхностный некроз участков кожи. Здесь же могут возникать телеангиэктазии как признак системного васкулита. Для ювенильного дерматомиозита характерно поражение сосудов, что проявляется симптомами со стороны кишечника: задержкой стула, эзофагитом, гастритом, изредка возможны прободения.
Над воспаленными мышцами нередко формируются участки липодистрофии, на фоне которых рельеф мышц становится более заметным. Также наблюдается синовиальный отек вокруг измененных мышц. Кожа над пораженными местами выглядит пастозной. Отек отмечается и во внутренних органах, например, в сердечной сумке (перикардит) и вокруг легких. Очень часто ювенильный дерматомиозит сопровождается явлениями кальциноза. Кальцинаты располагаются между мышечными волокнами либо подкожно, часто обнаруживаются вокруг суставов. Сами суставы обычно также поражаются, однако полиартрит быстро купируется на фоне терапии.
Осложнения
Часто при ювенильном дерматомиозите встречается сердечная слабость и миокардит. Впоследствии возможно развитие дилатационной кардиомиопатии с явлениями застойной сердечной недостаточности. Диагностируемая пневмония может быть связана со слабостью межреберных мышц (гипостатическая пневмония) и со случайным попаданием пищи в легкие в связи со сложностями при проглатывании. В основе столь разнообразной клинической картины ювенильного дерматомиозита лежит все тот же васкулит с поражением мышечной ткани. Таким образом, воспалительные изменения могут наблюдаться в мышечных волокнах, располагающиеся в любых органах.
Диагностика
Некоторые симптомы заболевания являются патогномоничными и значительно упрощают постановку верного диагноза. К таким признакам относится характерное поражение периорбитальной области, кожи вокруг шеи и над крупными суставами. Однако, как уже было сказано выше, кожные проявления при ювенильном дерматомиозите выражены лишь у половины заболевших детей.
В то же время, мышечная слабость является весьма неспецифическим симптомом, характерным для многих заболеваний соединительной ткани и для неврологических патологий. В частности, она отмечается при миастении, прогрессирующих мышечных дистрофиях. Кроме того, на фоне вирусных заболеваний мышечная слабость может быть следствием общей интоксикации. Для подтверждения диагноза ювенильного дерматомиозита необходимо:
- Исследование крови. Производится выявление в крови специфических антител, определение концентрации продуктов рабдомиолиза и воспалительного процесса в мышцах. К таким показателям относятся уровень креатинфосфокиназы и альдолазы в сыворотке крови. Кроме того, в крови всегда присутствуют признаки общей воспалительной реакции с повышением количества лейкоцитов, C-реактивного белка и СОЭ.
- Исследование мышечной системы. Мышечная слабость инструментально подтверждается при помощи электромиографии, обнаруживающей характерные для ювенильного дерматомиозита изменения.
Лечение ювенильного дерматомиозита
Госпитализация показана в острой фазе заболевания. Терапия проводится детским ревматологом при помощи высоких доз кортикостероидов короткого действия. В тяжелых случаях используется пульс-терапия стероидными гормонами. Имеется успешный опыт подключения к лечению цитостатиков. Поскольку ювенильный дерматомиозит относится к аутоиммунным заболеваниям, отмечается положительный эффект плазмафереза.
В фазе ремиссии необходим регулярный контроль состояния мышц, мышечной силы. Кожные проявления уменьшаются благодаря приему витамина D и использованию солнцезащитных кремов. Кортикостероиды ребенок продолжает принимать на постоянной основе. Также показана физическая активность и гимнастика.
Прогноз
Прогноз заболевания сомнительный. В последние десятилетия уровень смертности от ювенильного дерматомиозита значительно снизился и в настоящее время не превышает 1% среди заболевших детей. Известны также случаи практически полного восстановления мышечной силы. При этом постоянный прием кортикостероидов может приводить к хроническим патологиям желудка и кишечника, а также к развитию депрессивных состояний (влияние стероидных гормонов на нервную систему). Неблагоприятный прогноз имеют случаи раннего дебюта и непрерывно-рецидивирующего течения ювенильного дерматомиозита. Вместе с тем, своевременная диагностика заболевания обеспечивает 90% вероятность успешного лечения.
Читайте также:
