Лекарства для лечения опухоли - цитостатики
Добавил пользователь Skiper Обновлено: 30.01.2026
Лекарства для лечения опухоли - цитостатики
Опухоль (новообразование) состоит из клеток, которые пролиферируют независимо от, образно выражаясь, врожденного «строительного плана» организма. При злокачественной опухоли (рак) опухолевая ткань прорастает в здоровые окружающие ткани, разрушая их, или отделившиеся опухолевые клетки образуют вторичные опухоли (метастазы) в других органах. Лечение требует удаления всех злокачественных клеток (радикальная терапия).
Если это невозможно, замедляют рост опухоли, что приводит к увеличению жизни пациента или улучшению качества жизни (паллиативная терапия). Химиотерапия осложнена тем, что злокачественные клетки являются эндогенными и почти не обладают специфическими метаболическими свойствами.
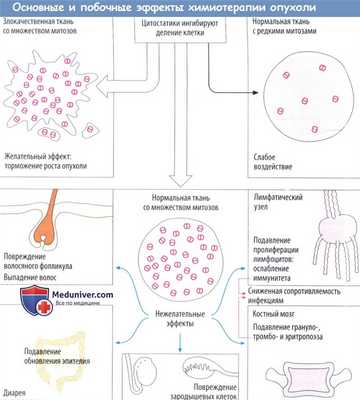
Цитостатики — это цитотоксические вещества, которые поражают в основном пролиферирующие или делящиеся (митотические) клетки. Повреждаются преимущественно быстро делящиеся злокачественные клетки. Нарушение митотических процессов не только замедляет рост опухоли, но и приводит к апоптозу (запрограммированная гибель клетки). Ткани с низкой скоростью митоза практические не поражаются, как и большинство здоровых тканей. Тем не менее это касается и злокачественных опухолей, состоящих из медленно дифференцирующихся клеток.
Цитостатическая терапия, несомненно, оказывает повреждающее действие на ткани с физиологически высокой частотой митозов. Следовательно, развиваются типичные побочные эффекты.
Выпадение волос происходит в результате повреждения волосяных фолликулов; расстройства со стороны ЖКТ, например диарея вследствие недостаточного восполнения энтероцитов, период жизни которыхограничен несколькими днями; тошнотой рвота в результате стимуляции хеморецепторов самого заднего поля ромбовидной ямки рвотного центра; снижение резистентности к инфекции в результате ослабления иммунной системы. Кроме того, цитостатики вызывают миелосупрессию. Восполнение клеток крови зависит от митотической активности стволовых и дочерних клеток костного мозга.
При остановке пролиферации миелоидного ростка в первую очередь поражаются гранулоциты с коротким периодом жизни (нейтропения), затем — тромбоциты крови (тромбопения) и, наконец, эритроциты с большим периодом жизни (анемия). Бесплодие вызвано подавлением сперматогенеза или созревания фолликула. Большинстве цитостатиков нарушает метаболизм ДНК. Это повышает риск повреждения генома здоровых клеток (мутагенный эффект). Возможно, с ним связано развитие лейкоза через несколько лет после цитостатической терапии (корциногенный эффект). Более того, весьма вероятно появление врожденных пороков развития при необходимости использовать цитостатики во время беременности (тератогенный эффект).
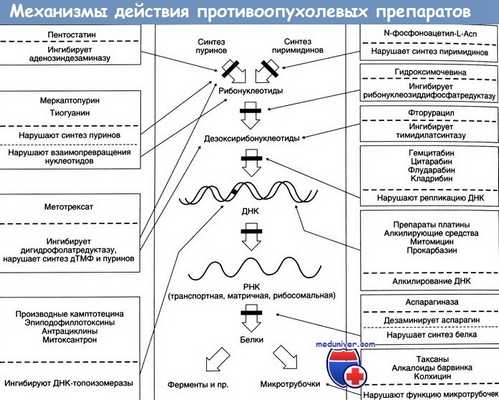
Цитостатики имеют разные механизмы действия:
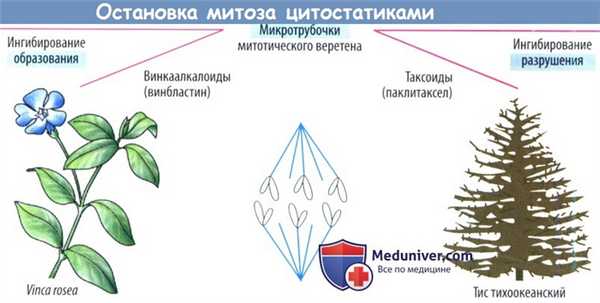
а) Повреждение митотического веретена. Сократительные белки веретенного аппарата разводят реплицированные хромосомы перед делением клетки. Данный процесс нарушают так называемые яды митотического веретена (см. также колхицин), которые останавливают митоз в метафазе за счет нарушения превращения микротрубочек в веретенные нити. Они состоят из белков α- и β-тубулина. Излишние трубочки отрезаются, давая возможность субъединицам тубулина рециркулировать.
Винка алкалоиды винкристин и винбластин (получаемые из барвинка розового, Vinca rosea) ингибируют полимеризацию субъединиц тубулина в микротрубочки. Повреждение нервной системы является ожидаемой нежелательной реакцией в результате нарушения управляемыми микротрубочками аксональных транспортных механизмов.
Паклитаксел, получаемый из коры тиса тихоокеанского (Taxus brevifolia), ингибирует расхождение микротрубочек и индуцирует образование атипичных микротрубочек, что препятствует повторному сбору тубулина в правильно функционирующие микротрубочки. Полусинтетическим производным является доцетаксел.
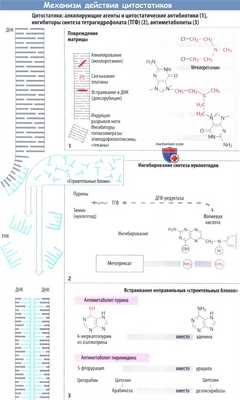
б) Ингибирование синтеза ДНК и РНК. Митозу предшествует репликация хромосом (синтез ДНК) и повышенный синтез белка (синтез РНК). Имеющаяся ДНК (серый цвет) служит в качестве матрицы для синтеза новой ДНК (голубой цвет) или РНК. Синтез новых нуклеиновых кислот ингибируется следующими механизмами.
в) Повреждение матрицы. Алкилирующие цитостатики являются реактивными веществами, которые переводят алкильные остатки на ДНК через ковалентную связь. Например, мехлоретамин (азотистый иприт) способен образовывать перекрестную связь между двумя цепями ДНК, отдавая атомы хлора. Правильное считывание генетической информации поэтому становится невозможным. Другими алкилирующими агентами являются хлорамбуцил, мелфалан, циклофосфамид, ифосфамид. ломустин, тиотепа, митомицин, прокарбазин, дакарбазин и темозоломид.
К специфическим нежелательным реакциям относятся необратимый фиброз легких у бусульфана и геморрагический цистит, вызванный метаболитом циклофосфамида акролеином (предупреждается месной, натрия 2-меркаптоэтансульфонатом). Платиносодержащие противоопухолевые средства (цисплатин, карбоплатин и оксалиплатин) высвобождают платину, которая связывается с ДНК.
г) Цитостатические антибиотики встраиваются в двунитевую ДНК, что приводит к разрыву нити (как у блеомицина). Антрациклиновые антибиотики даунорубицин и адриамицин (доксорубицин) вызывают кардиомиопатию. Кроме того, блеомицин вызывает фиброз легких. Эпирубицин и идарубицин разработаны с целью снижать кардиотоксичность. Трабектин, который тоже встраивается в двунитевую ДНК, не является антибиотиком; его получают из асцидии.
д) Разрыв нити вызывает ингибирование топоизомеразы. Эпиподофиллотоксины этопозид и тенопозид взаимодействуют с топоизомеразой II,в функции которой входят расщепление, перенос и вторичное закрытие нитей ДНК. Эти препараты вызывают разрыв нити за счет ингибирования повторного закрытия. «Теканы» топотекан и иринотекан являются производными камптотецина, получаемыми из фруктов китайского дерева (Camptotheca acuminata). Они ингибируют топоизомеразу I, которая вызывает разрыв однонитевой ДНК.
е) Ингибирование синтеза нуклеотидного основания. Тетрагидрофолиевая кислота (ТГФ) необходима для синтеза как пуриновых оснований, так и тимидина. ОбразованиеТГФ из фолиевой кислоты происходит при участии ДГФ-редуктазы. Аналог фолата метотрексат ингибирует активность фермента. Клеточные запасы ТГФ истощаются. Эффект этих антиметаболитов можно устранить путем введения фолиевой кислоты (5-формил-ТГФ, лейковорин, фолинат кальция).
Гидроксимочевина (гидроксикарбамид) ингибирует рибонуклеотидредуктазу, которая обычно превращает рибонуклеотиды в дезоксирибонуклеотиды, которые затем используются как «строительные блоки» ДНК.
ж) Встраивание ложных «строительных блоков». Неестественные нуклеотидные основания (6-меркаптопурин, 5-фторурацил) и патологические нуклеозиды с измененными сахарами (цитарабин, гемцитабин) измененным основанием (кладрибин) или с обоими измененными компонентами (флударабин, капецитабин) действуют как антиметаболиты. Они ингибируют синтез ДНК/РНК или вызывают синтез ложных нуклеиновых кислот.
6-меркаптопурины образуются в результате биотрансформации неактивного предшественника азатиоприна. Урикостатик аллопуринол ингибирует распад 6-меркаптопурина, поэтому при одновременном введении двух препаратов требуется снижение дозы последнего.
з) Комбинированная терапия. Цитостатики часто применяются по сложным терапевтическим схемам разработанным для улучшения эффективности и переносимости лечения.
и) Поддерживающая терапия. Химиотерапия рака поддерживается адъювантными препаратами. Следующие препараты используются против рвоты, вызванной цитостатиками:
1) дексаметазон в качестве основного препарата;
2) антагонист 5-НТ3 ондонсегрон (при ранней рвоте);
3) антагонист NK1-рецепторов апрепитант, который эффективен против поздней рвоты с началом более чем через 24 ч. При угнетении костного мозга используют гранулоцитарный и гранулоцитарно-макрофагальный колониестимулирующие факторы (филграстим и ленограстим). Поврежденную слизистую оболочку восстанавливают палифермином, рекомбинантным человеческим фактором роста кератиноцитов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Препараты для химиотерапии
В настоящее время существует более сотни препаратов для химиотерапии рака (химиопрепаратов). Они различаются по химической структуре и механизмам действия, благодаря этому врач-химиотерапевт может подобрать наиболее оптимальное сочетание препаратов для конкретного пациента, в зависимости от типа, стадии рака и других факторов.
Как работают химиопрепараты?
Несмотря на разные механизмы действия, все химиопрепараты работают в одном направлении: они нарушают клеточный цикл, останавливают размножение раковых клеток и вызывают их гибель.
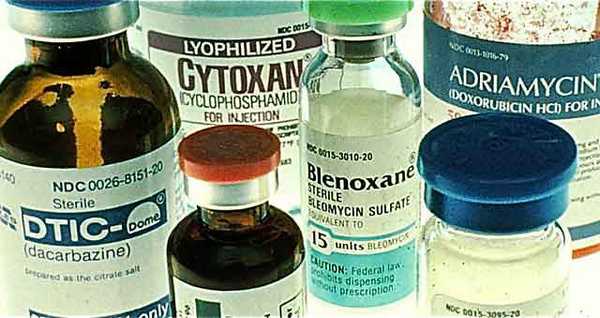
Противопоказания к химиотерапии
Несмотря на потенциальную пользу, которую способны принести химиопрепараты, некоторым пациентам они противопоказаны из-за высокого риска тяжелых побочных эффектов. К основным противопоказаниям относят тяжелую тромбоцитопению, острые инфекции с высокой температурой, тяжелые нарушения со стороны сердечно-сосудистой системы, легких, печени, почек, первый триместр беременности, перенесенные серьезные операции, пожилой возраст, сильное истощение.
Перед началом курса химиотерапии врач должен тщательно оценить состояние пациента, выявить имеющиеся у него проблемы со здоровьем и связанные с ними потенциальные риски.
Противопоказания к применению противоопухолевых препаратов бывают не только абсолютными, но и относительными. Химиотерапию проводить можно, но только с соблюдением некоторых условий:
- Снизить дозы, подобрать препараты, которые наиболее безопасны.
- Использовать один препарат химиотерапии вместо комбинации из двух и более.
- Перед началом курса провести лечение и устранить имеющиеся проблемы со здоровьем.
- Выждать некоторое время, например, после перенесенной операции или пока не стихнет инфекция.
В каждом случае требуется индивидуальный подход.
Типы химиопрепаратов
Препараты для химиотерапии делят на группы, в зависимости от химической структуры и механизма действия. Один и тот же препарат может работать разными способами и относиться к разным группам. Зная, к какой группе относится химиопрепарат, врач может прогнозировать лечебные и побочные эффекты, правильно спланировать курс лечения.

Цитостатики и цитотоксические препараты
Традиционно противоопухолевые препараты делят на две группы:
- останавливают размножение раковых клеток и запускают в них процесс запрограммированной клеточной смерти — апоптоз. К этой группе относят, в частности, фторурацил, цисплатин, доксорубицин.
- Цитотоксические (цитотоксины) повреждают ядро, оболочку и другие компоненты клетки, приводят к её гибели.
Также в настоящее время существуют таргетные препараты, которые нарушают жизнедеятельность и размножение опухолевых клеток путем воздействия на определенные молекулы-мишени, и иммунопрепараты, которые задействуют ресурсы противоопухолевого иммунитета.
Алкилирующие агенты
Самая старая группа средств для химиотерапии. Они так названы потому, что могут алкилировать различные молекулы, включая ДНК, РНК и белки. Препарат связывается с молекулой ДНК и приводит к ее разрыву во время удвоения в процессе деления клетки. В итоге запускается процесс запрограммированной клеточной гибели — апоптоз.
Алкилирующие агенты атакуют клетки на любой стадии клеточного цикла. Химиотерапия данными средствами эффективна при многих типах рака: легких, яичников, молочной железы, а также при саркомах, множественных миеломах, болезни Ходжкина, лимфоме, лейкемии.
Представители группы: цисплатин, карбоплатин, дакарбазин, хлорамбуцил, оксалиплатин, темозоломид.
Антиметаболиты
Эти препараты атакуют опухолевые клетки на стадии удвоения хромосом во время деления. Они нарушают синтез новых РНК и ДНК, занимая места нуклеотидов — «звеньев», из которых состоят цепочки нуклеиновых кислот. Антиметаболиты эффективны в качестве химиотерапии при раке кишечника, яичников, молочной железы, лейкемии.
Представители группы: 5-фторурацил, 6-меркаптопурин, капецитабин, гемцитабин, метотрексат.
Противоопухолевые антибиотики
Напоминают антибактериальные препараты, которые используются для лечения инфекций. Эти химиопрепараты повреждают ДНК опухолевых клеток и нарушают их размножение. Существуют разные группы антибиотиков для химиотерапии, одна из них — антрациклины. Эти препараты нарушают функции ферментов, которые необходимы для удвоения ДНК.
Представители антрациклинов: доксорубицин (адриамицин), эпирубицин, даунорубицин, идарубицин.
Представители противоопухолевых антибиотиков, не являющихся антрациклинами: блеомицин, митоксантрон, митомицин-С, актиномицин D.
Ингибиторы топоизомеразы
Молекула ДНК состоит из двух цепочек, закрученных в спираль. Для того чтобы скопировать ее во время деления клетки, спираль нужно «распутать». За эту функцию отвечает особый фермент топоизомераза. Существуют средства для химиотерапии, которые блокируют его, тем самым нарушая процессы клеточного деления. Ингибиторы топоизомеразы эффективны при раке желудка и кишечника, яичников, легких, при лейкозах.
Представители группы: топотекан, иринотекан, этопозид, тенипозид, митоксантрон.
Ингибиторы митоза
Средства для химиотерапии из этой группы имеют растительное происхождение. Они блокируют деление клеток, нарушая функцию микротрубочек и некоторых белков-ферментов. Ингибиторы митоза применяют для лечения рака молочной железы, легких, миеломы, лимфомы, лейкозов.
Представители группы: доцетаксел, паклитаксел, винбластин, винкристин.
Винкаалкалоиды
Первые ингибиторы митоза из этой группы — винбластин и винкристин — были выделены из растения барвинок розовый (Vinca rosea). Затем на основе винбластина были созданы полусинтетические соединения для химиотерапии — винорелбин и виндезин. Основной механизм действия этих препаратов состоит в том, что они связывают с белком тубулином в составе микротрубочек и не дают ему полимеризоваться. Деление клеток останавливается.
Также винкаалкалоиды нарушают другие клеточные процессы: изменяют обмен аминокислот и некоторых других веществ, влияют на синтез нуклеиновых кислот, жиров, клеточное дыхание.
Таксаны
Эти препараты начали широко применяться для химиотерапии с 90-х годов прошлого столетия. Первым был получен 1960-х годах паклитаксел из экстракта тихоокеанского тиса (Taxus brevifolia). В 1980-х годах из экстракта хвои европейского тиса (Taxus baccata) удалось выделить более мощный препарат — доцетаксел.
Таксаны тоже влияют на микротрубочки, но не так, как винкаалкалоиды. Они, напротив, ускоряют полимеризацию тубулина, впоследствии препятствуют его деполимеризации и распаду микротрубочек. Из-за этого также нарушается деление клеток.
Глюкокортикостероиды
Глюкокортикостероиды, или глюкокортикоиды, представляют собой препараты гормонов коры надпочечников. Они обладают многими функциями, в частности, принимают участие в регуляции обмена веществ, подавляют иммунные реакции и воспаление. Также эти препараты обладают противоопухолевыми свойствами. Иногда глюкокортикоиды используют для поддерживающей терапии. Они помогают устранить вызванную противоопухолевыми препаратами тошноту и рвоту, предотвратить аллергические реакции.
Представители группы: метилпреднизолон, преднизон, дексаметазон.
Лекарства для химиотерапии, которые не относятся к каким-либо группам
Некоторые химиопрепараты не входят ни в одну группу и обладают собственными механизмами действия. Например, ингибитор протеосом бортезомиб, фермент L-аспарагиназа.
Принципы применения препаратов для лечения рака
Для того чтобы обеспечить необходимую эффективность химиотерапии, нужно придерживаться некоторых правил:
- Как можно более раннее начало лечения. Пациент должен начать получать химиопрепараты сразу же, как только выявлены показания к их применению. К сожалению, в российских государственных клиниках дела с этим обстоят не лучшим образом. Зачастую не сразу удается попасть на прием к врачу и пройти необходимые обследования. Крупные онкологические центры постоянно сильно загружены, и пациентам приходится ждать своей очереди, чтобы начать лечение. Но рак не станет ждать, он прогрессирует, и со временем прогноз может ухудшиться. В «Евроонко» доступны все группы препаратов, и мы всегда начинаем терапию в кратчайшие сроки.
- Применение комбинаций препаратов. Обычно назначают 2–3 химиопрепарата с разными механизмами действия.
- Правильный подбор схемы химиотерапии. Разные типы рака обладают неодинаковой чувствительностью к тем или иным противоопухолевым препаратам. Врачи ориентируются на протоколы лечения. Эти документы составлены на основе результатов научных исследований с участием тысяч пациентов по всему миру, и в них расписаны сочетания препаратов, которые с наибольшей вероятностью будут эффективны при тех или иных злокачественных опухолях. На случай, если терапия первой линии не помогает, предусмотрены «запасные» варианты.
- В максимально короткие сроки нужно создать в тканях оптимальную концентрацию химиопрепарата и затем поддерживать её. Для этого важно правильно определиться с дозировками и частотой введений. Химиотерапию проводят циклами: больному вводят препараты, а затем дают некоторое время (обычно 1–3 недели) на «передышку». Курс может состоять из нескольких циклов.
- При неоперабельном раке лечение продолжают, пока препараты работают или не начинают вызывать тяжелые побочные эффекты.
- Пациент должен переносить химиотерапию комфортно. В «Евроонко» постоянно контролируют его состояние, проводят необходимые исследования и анализы, вводят противоопухолевые препараты под прикрытием поддерживающей терапии.

Дозировки
Подбор оптимальной дозы химиопрепаратов можно в какой-то степени сравнить с хождением по канату. Если дозировка будет слишком низкой, лечение станет недостаточно эффективным и ухудшится прогноз, а если слишком высокой, можно получить тяжелые осложнения. Ситуация осложняется тем, что «канат» у каждого пациента разной «толщины» — это зависит от размеров тела, индивидуальной способности организма метаболизировать лекарство.
Обычно дозировку химиопрепаратов рассчитывают, основываясь на площади поверхности тела или весе пациента. Также нужно учитывать общее состояние здоровья, сопутствующие заболевания.
Способы введения в организм
Чаще всего химиопрепараты вводят внутривенно или перорально (от латинского per os — «через рот»). Но существуют и другие пути введения:
- Подкожные и внутримышечные инъекции.
- Интратекально — в спинномозговую жидкость.
- Внутрибрюшинно — в брюшную полостью. При канцероматозе брюшины применяется современная методика HIPEC (гипертермическая интраперитонеальная химиотерапия), когда после удаления из брюшной полости всех крупных очагов её промывают подогретым раствором химиопрепарата, чтобы уничтожить оставшиеся мелкие очаги.
- Внутриплеврально — в плевральную полость, окружающую легкие.
- Внутриартериальная химиотерапия — непосредственно в артерию, питающую опухоль. При этом можно использовать высокие дозы химиопрепаратов: они почти не проникают в системный кровоток и не вызывают серьезных побочных эффектов.
- Введение в мочевой пузырь с помощью катетера.
Когда больному требуется лечение в течение длительного времени, в «Евроонко» применяют имплантируемые венозные порт-системы. Под кожу подшивают небольшой резервуар, одна из стенок которого представлена специальной мембраной, и соединяют его катетером с веной. В дальнейшем лекарства вводят с помощью иглы, которой прокалывают кожу и находящуюся под ней мембрану.
Эффективность препаратов, применяемых при химиотерапии
Для того чтобы судить об эффективности химиотерапии, обычно нужно провести не менее 2–3 циклов лечения. Затем выполняют исследования, которые помогают визуализировать и измерить опухоль, проводят анализы на онкомаркеры. Возможен один из четырех результатов:
- Полный ответ. Опухоль исчезла, уровень онкомаркера снизился и находится в пределах нормы.
- Частичный ответ. Опухоль уменьшилась, уровень онкомаркера при этом также может снизиться.
- Стабильное состояние: размеры и количество опухолей, уровень онкомаркера не изменились.
- Прогрессирование на фоне лечения: опухоль продолжает расти, появляются новые очаги, уровень онкомаркера повышается.
Если лечение эффективно, его продолжают по прежней схеме. В противном случае комбинации химиопрепаратов нужно менять.
Побочные эффекты применения химиопрепаратов
Химиотерапия вызывает различные побочные эффекты. Симптомы могут возникать спустя некоторое время после начала лечения и даже по завершении курса. Одни из них быстро проходят, другие сохраняются в течение длительного времени. Степень их выраженности тоже бывает разной, это зависит от многих факторов, таких как возраст, состояние здоровья пациента, тип, доза и способ введения химиопрепарата, параллельный прием других лекарств.
Вы можете подробно узнать о возможных побочных эффектах химиопрепаратов на этой странице.
Что такое персонализированная химиотерапия?
За последние годы подходы к классификации злокачественных опухолей несколько изменились. Раньше ученые могли лишь рассматривать раковые клетки под микроскопом, сейчас появилась возможность изучать их молекулярно-генетические характеристики. Клетки могут выглядеть одинаково, но иметь разный набор изменений в генах. В них вырабатываются разные вещества, которые по-разному помогают им выживать, размножаться, защищаться от агрессии иммунитета.
Если рассматривать рак на молекулярно-генетическом уровне, то окажется, что двух одинаковых опухолей практически не существует. Каждый пациент индивидуален, каждому нужен свой подход при выборе комбинации химиопрепаратов. Такое лечение называется персонализированным. Оно наиболее эффективно, так как в нем реализован важнейший принцип медицины: «лечить не болезнь, а больного».
Сейчас молекулярно-генетические исследования, которые помогают назначить персонализированную химиотерапию, доступны далеко не в каждой клинике. Но за ними — будущее онкологии.
Таргетная терапия и иммунотерапия: «усовершенствованные» химиопрепараты
Возможность изучать молекулярно-генетические характеристики рака привела к появлению относительно новой группы противоопухолевых средств — таргетных препаратов. Эти «снайперы» действуют на конкретные молекулы, которые необходимы злокачественным опухолям для роста, выживания, защиты от иммунитета. В отличие от классических химиопрепаратов, таргетные препараты не действуют на здоровые клетки, реже вызывают тяжелые побочные эффекты.
Большие надежды современные ученые и врачи-онкологи возлагают на иммунопрепараты. Эти лекарственные средства используют возможности иммунной системы, чтобы уничтожать раковые клетки.
Развитие онкологии не останавливается. Ученые продолжают работать над созданием новых противоопухолевых препаратов. Некоторые лекарства сейчас проходят клинические испытания. К сожалению, создание и проверка новых препаратов — процесс долгий и недешевый. Тем не менее, прогресс есть, а значит, есть и надежда для онкологических больных.
Препараты для восстановления после химиотерапии
Как мы уже упоминали, химиопрепараты атакуют не только опухолевые, но и здоровые клетки. После курса лечения в той или иной степени могут пострадать разные органы. Это неизбежное зло, с которым приходится мириться, чтобы уничтожить раковые клетки.
Для более быстрого и полноценного восстановления после химиотерапии каждый пациент получает индивидуальную программу лечения. В первую очередь усилия направлены на восстановление состава крови, нормализацию работы печени, почек, сердца, борьбу с депрессией и другими психоэмоциональными проблемами.
Выбор препаратов для восстановительного лечения после химиотерапии довольно большой. Важно не забывать и о таких «скучных» мерах, как правильный образ жизни, питание, полноценный сон и отдых, физическая активность. БАДы тоже могут быть полезны, но если вы решили принимать их, сначала нужно проконсультироваться с лечащим врачом.
Цитостатики
Цитостатики с греческого «делающие клетку неподвижной», в онкологии используются с 1947 года. Эти лекарственные препараты нарушают жизнедеятельность клетки, вынуждая идти на самоубийство — апоптоз. Цитостатики используются не только для лечения злокачественных процессов, но также ревматических и аутоиммунных болезней.
Что такое цитостатики?
Химиотерапия — это исключительно использование цитостатиков. Помимо химиотерапии противоопухолевое лечение включает эндокринное воздействие с помощью гормональных препаратов, «выключающую» определённую биохимическую реакцию таргетную терапию и применение биологических — иммуно-онкологических средств, которые сами не действуют на злокачественную клетку, но активируют иммунных защитников.
Цитостатики повреждают все быстро делящиеся клетки — любые злокачественные и нормальные клетки крови, костного мозга и половых желез. Со временем клеточные клоны вырабатывают устойчивость к цитостатикам, снижая результативность химиотерапии.
Классификация цитостатиков
Все цитостатические препараты разделены на 4 больших группы по механизму действия или происхождению:
- алкилирующие цитостатики, которые запутывают нити ДНК образованием внеплановых связок с ними;
- антиметаболиты внешне очень схожи с человеческими белковыми веществами, участвующими в клеточной жизнедеятельности, но в отличии от естественных, вмешательством своим приводят к клеточной гибели;
- противоопухолевые антибиотики по химическому происхождению такие же антибактериальные препараты, что мы используем для борьбы с воспалением и инфекциями, но на бактериальную флору они не влияют, зато убивают раковые клетки;
- цитостатики растительного происхождения имеют схожесть механизмов повреждения клеточных структур, но главное объединяющее начало — первоначальное их получение из растительного сырья, теперь большинство лабораторно синтезируется.
Гормоны никакого отношения к цитостатикам не имеют, поскольку их действие заключается в антагонизме с натуральными половыми гормонами либо в прямой или косвенной блокаде их выработки. Недостаток гормонов или подмена их антигормоном тоже приводит к клеточной гибели.

Как действуют цитостатики?
В конечном итоге все способы цитостатического воздействия приводят к одному — клеточному апоптозу. Апоптоз закономерный этап клеточной жизни, в отличии гибели при воспалении, инфицировании, некрозе. Это запрограммированная гибель, к ней приходит в своё время каждая клетка, а цитостатики приводят к ней вне программы. Каждый день в организме человека апоптозу подвергается 100 миллиардов клеток, можно считать, что каждые два года клеточный состав организма полностью обновляется. В упрощенном виде апоптоз представляется так:
- формирование биохимического сигнала запуска смерти, своеобразное клеточное осознание необходимости умирания;
- выработка внутриклеточных ферментов, сжигающих клеточные «внутренности»;
- поглощение остова умершей клетками-соседями и макрофагами;
- разложение внутриклеточными лизосомами съеденного на микроэлементы для дальнейшего использования.
Процесс протекает по принципу «была и нет», потому-то при химиотерапии на месте опухоли не остается ни воспаления, ни рубцов, а практически нормальная ткань, как будто и не было болезни.
Область применения цитостатиков
Цитостатики применяются при всех злокачественных опухолях, не исключая заболевания крови и лимфатической ткани, опухоли мозга и половых желез. Циклофосфан и антиметаболиты в несоизмеримо меньших дозах, нежели в онкологии, используются в ревматологии.
У каждого цитостатического препарата свой спектр противоопухолевой активности, к примеру, доксорубицин и фторурацил отлично работают при раке молочной железы, но неэффективны при мелкоклеточном раке легкого. Без фторурацила не обходится химиотерапия карцином кишечника, а доксорубицин бесполезен при них.
Показания и противопоказания к применению цитостатиков
Противоопухолевые препараты применяются только при морфологическом подтверждении диагноза. Не признаются злокачественными процессы, если в морфологическом (гистологическом) заключении указано «подозрительно на. », должен быть точный и 100% ответ. При подозрении необходимы дополнительные исследования — повторная биопсия, ИГХ и даже генетическое исследование.
Глобальное противопоказание — прогнозируемая непереносимость химиотерапии при тяжёлых сопутствующих заболеваниях или тяжелом состоянии, обусловленном злокачественным заболеванием. Когда «игра не стоит свеч» и медикаментозное вмешательство угрожает тяжкими осложнениями и смертью.
Нельзя применять препараты при заведомой их неэффективности — вне спектра активности.
Временное противопоказание: воспалительные и инфекционные заболевания, остаточные осложнения после предыдущего курса лечения.
Сегодня выбор противоопухолевых средств настолько широк, что не составляет большого труда подобрать оптимальный препарат и даже комбинацию. Тем не менее, при неэффективности, как минимум, двух линий терапии и прогрессивном ухудшении состояния третий вариант химиотерапии не всегда целесообразен.
Побочные эффекты цитостатиков
Токсические реакции обусловлены повреждением нормальных тканей, как правило, очень чувствительны к цитостатикам:
- клетки крови, что клинически проявляется изменением в анализах, чаще всего лейкопенией и нейтропенией, тромбоцитопенией и много реже — анемией;
- костный мозг постепенно замедляет скорость восстановления ростков кроветворения, активная ткань замещается соединительной и жировой, а в анализах крови снижается уровень всех форменных элементов;
- слизистые оболочки реагируют некрозом с отторжением, что проявляется стоматитом, колитом, энтеритом, пневмонитом и воспалением венозного эндотелия;
- половые железы отвечают нарушением сперматогенеза и прекращением менструаций;
- придатки кожи — волосы выпадают, ногти грубеют и меняют свою структуру.
У препарата могут быть не только общие, но и индивидуальные токсические проявления, при которых избирательно погибают нервные клетки или почечные канальцы, гепатоциты или мышечные волокна сердца. Чувствительность к лекарствам очень индивидуальна, спектр и выраженность побочных реакций тоже разняться.
Механизм действия цитостатиков
Два ведущих механизма:
- изменение строения ДНК, в том числе аномальные скручивания, мешающие расходится нитям во время деления, а также нарушения репарации — восстановления непрерывности нити при повреждении;
- разлад клеточного деления — типичное для растительных препаратов нарушение формирования клеточного веретена, разводящего хромосомы в дочерние клетки.
Не только каждая группа, но и каждый цитостатик имеет собственный механизм противоопухолевого действия, а вернее, несколько механизмов повреждения, большая часть из которых неизвестна.
Какие цитостатики назначают чаще всего?
Назначаются только активно работающие при этой злокачественной нозологии и оптимальные в конкретном клиническом случае. Самый широкий диапазон активности у антибиотика доксорубицина, алкилирующих платиновых производных и циклофосфана, растительных таксанов и антиметаболитов фторурацила и метотрексата.
Клинические рекомендации предлагают использовать самые эффективные комбинации лекарств с оптимальным соотношением эффективности и токсичности. В нашей клинике мы подбираем цитостатическую терапию индивидуально — по чувствительности раковой опухоли. Мы не гарантируем отсутствия токсичности, но умеем минимизировать её проявления и ускорять восстановление нормальных тканей.
Противоопухолевые препараты
Противоопухолевые препараты пугают онкологических пациентов непредсказуемостью позитивного и частого негативного действия. Большинство пациентов предпочло бы остановиться на хирургическом лечении или облучении, но эти строго локальные методы не всегда технически возможны. На все опухолевые очаги системно удается воздействовать только лекарственными препаратами, поскольку они проникают всюду, где есть кровь вне зависимости от способа введения.
Что такое противоопухолевые препараты и как они работают?
Все убивающие злокачественные клетки препараты можно называть противоопухолевыми, не смотря на существенную разнородность лекарственных молекул и механизм повреждающего действия. Большинство противоопухолевых препаратов влияет на деление клеток, нарушая структуру их ДНК или веретена, помогающего развести хромосомы в образующиеся дочерние клетки. Вероятно, цитостатики повреждают не только геном, лучше всего изучено их действие образование сшивок между частями одной нити ДНК и двумя параллельными нитями, заплетенными в спираль. У клетки есть способы для восстановления малого повреждения генетического аппарата, но при существенном нарушении она вынуждена уйти в сторону апоптоза — смерти.
Клеточные популяции в опухолевом узле очень разнородны: какие-то клетки только собираются делиться, другие уже вошли в процесс и активно синтезируют две копии структур для дочерней клеточки, некоторые находятся в покое, а часть после завершения жизненной программы устремилась к гибели. Считается, что находящиеся в состоянии покоя клеточные популяции устойчивы к агрессии противоопухолевых лекарств, зато делящиеся и планирующие войти в эту фазу — самые чувствительные к химиопрепаратам. Делящиеся клетки составляют фракцию опухолевого роста, чем она крупнее, тем агрессивнее рак и одновременно более чувствителен к противоопухолевому воздействию.
Классификация и виды противоопухолевых средств
Противоопухолевые лекарства представлены химиотерапевтическими препаратами, то есть цитостатиками, эндокринными или гормональными средствами, таргетными препаратами. Все они различаются механизмом инициации клеточной смерти.
Цитостатики используются с 1946 года и представлены несколькими группами лекарственных средств:
- алкилирущие получили свое название от химической реакции, реализующей ведущий механизм повреждения — алкилирование, то есть замену атома водорода нуклеиновых кислот нитей ДНК на алкильную группу лекарства с образованием связок и деформацией структуры;
- антиметаболиты прекращают жизнедеятельность клетки, вмешиваясь в её метаболизм и подменяя собой структурные компоненты нуклеиновых оснований ДНК и РНК или блокируя участвующие в синтезе этих оснований ферменты;
- противоопухолевые антибиотики тоже формируют ДНК-сшивки, а традиционное для антибактериальных препаратов противовоспалительное и противомикробное действие у них практически равно нулю;
- препараты растительного происхождения очень разнородны, преимущественный механизм действия — нарушение клеточного деления, общее у них одно — их выделили из растительного сырья, а позже стали синтезировать химическим способом, удешевляя и облегчая процесс производства;
- различные препараты невозможно было отнести к четырём основным группам ни по одному объединяющему критерию.
Алкилирующие средства
Это самые первые противораковые лекарства, начавшие историю химиотерапии. Ярчайшие представители группы — циклофосфамид, нитрозометилмочевина и производные платины.
Алкилирование противоопухолевыми агентами ДНК приводит к разрывам её цепи и сшиванию с закрученной в параллельную спираль второй нитью, образуемые сшивки не хаотичны — в определенном месте и с конкретным нуклеотидом. В конечном итоге предотвращается репликация, то есть сборка второго комплекта структур для разделения клетки. Принципиально алкилирование возможно в любую фазу клеточного цикла, но особенно активно осуществляется во время синтеза.
Препараты этой группы обладают широким противоопухолевым спектром, используются в терапии рака, в том числе сарком и онкогематологических процессов.
Циклофосфамид, более привычное торговое наименование циклофосфан, применяется более 60 лет в качестве компонента полихимиотерапии, в одиночку используется при злокачественных заболеваниях крови и лимфатической ткани. Вводится разными способами: в таблетках, внутривенно и внутримышечно. Для местного применения бесполезен, потому что активируется исключительно в ткани печени, куда попадает с кровью.
Редкая особенность препарата ифосфамида — наличие антидота уромитексана, защищающего слизистую мочевого пузыря от повреждений.
Первое производное платины — цисплатин было синтезировано в середине XIX века, а в клинику пришло в последней четверти прошлого века. Препарат легко проникает в клетки, потому что его молекула не заряжена ни положительно, ни отрицательно, чем и обусловлена его высокая агрессивность в отношении множества злокачественных процессов. Сегодня применяются уже три поколения платиновых производных, при неизменно высокой активности существенно различаются побочные эффекты.
Препараты нитрозометилмочевины преимущественно используются при злокачественных новообразованиях ЦНС и в онкогематологии.
Противоопухолевые препараты растительного происхождения
Вещества растительного происхождения представлены несколькими группами:
- винкаалкалоиды выделены из растения барвинок, у всех четырёх лекарственных средств идентичный механизм противоопухолевого действия — нарушение белка тубулина и вследствие этого остановка клеточного митоза;
- таксаны немногочисленны, первоначально был выделен из коры тихоокеанского тисового кустарника паклитаксел, а через 15 лет уже из игл европейского тиса добыли доцетаксел, сегодня таксаны наполовину синтетические, кроме высокой эффективности они стали первенцами среди слишком дорогих химиопрепаратов;
- камптотецины добывают из южно-китайского ниссового кустарника, препарат нарушает фермент топоизомеразу, не позволяя раскрутиться суперспирали ДНК, сегодняшние полусинтетические аналоги камптотецина топотекан используются при опухолях ЦНС, иринотекан незаменим в схемах химиотерапии карцином толстой кишки, легкого и яичников;
- эпиподофиллотоксины — полусинтетические аналоги смолы из корней американской мадрагоры и самый яркий представитель подгруппы — этопозид оказался эффективнее природного аналога.
Противораковые препараты нового поколения
Противоопухолевое действие цитостатиков обнаруживали почти случайно, таргетные препараты синтезируют на основе научных исследований. Таргетные препараты работают «точечно», блокируя важный внутриклеточный элемент, понуждая к клеточной гибели. Эту группу также называют ингибиторами за подавление ими клеточных процессов. Особенность лекарственных средств в невозможности полного уничтожения опухоли, как правило, они приостанавливают размножение популяции, поэтому используются вместе с цитостатиками.
Иммуноонкологические средства способствуют восстановлению естественной иммунной защиты организма, подавленной злокачественной опухолью. Средства отличаются от стандартных иммунных препаратов, аналогом которых были вырабатываемые организмом цитокины — интерферон и интерлейкин. Лекарства, как и таргетные, создаются целенаправленно на основе фундаментальных достижений науки. Иммунотерапия сдвинула с мертвой точки лечение меланомы, устойчивой к цитостатикам, мало чувствительный рак легкого и желудка, почечноклеточную карциному и рак печени.
Препараты на гормональной основе
Эндокринная терапия призвана снизить выработку половых гормонов или не допустить их внутрь опухолевой клетки, дабы исключить стимуляцию роста чувствительного к уровню гормонов злокачественного процесса.
Классификация эндокринных препаратов по механизму действия:
- центральные, подавляющие выработку гормонов гипофиза, регулирующих синтез эндокринных веществ половыми клетками, и главные представители группы — агонисты ЛГРГ;
- периферические — снижают функцию половых желез или нарушают в жировой ткани работу фермента ароматазы, отвечающего за трансформацию тестостерона в эстроген — группа ингибиторов ароматазы;
- клеточные — связывающиеся на мембране с рецептором и не пропускающие гормоны внутрь клетки и по своей сути антигормоны, как антиэстроген тамоксифен.
Применяются гормональные противоопухолевые лекарства при карциномах молочной и предстательной железы, а также некоторых вариантах рака тела матки, несущие на своей клеточной поверхности специальные рецепторы гормонов. Как правило, лечение рассчитано на несколько лет, поскольку реализация противоопухолевого эффекта очень медленная.
Побочные явления
Точка приложения противоопухолевых препаратов — клетка, причём не только опухолевая, но и нормальная, поэтому при противоопухолевой терапии закономерны осложнения. Спектр побочных эффектов каждого препарата изучен, но токсические проявления у отдельного пациента строго индивидуальны и непредсказуемы по интенсивности.
Даже препараты одной подгруппы при общем механизме действия имеют разные точки приложения, к примеру, очень небольшие отличия в строении алкалоидов барвинка винкристин и винбластин обернулись существенными различиями в спектре активности и токсичности, их применяют при разных болезнях. Скопированный с натурального растительного винбластина синтетический аналог виндезин, по биологическому действию и осложнениям больше походит на винкристин. Структурно схожий с природными винкаалкалоидами и полностью синтетический винорелбин по спектру действия и токсичности совсем не походит на натуральные аналоги.
Противоопухолевые лекарства не гарантируют 100% результата, раковые клетки уникальны в способности самовосстановления и скорости воспроизводства популяции.
Искусство химиотерапии — это не только умелый подбор оптимальной комбинации, обещающей максимально возможный результат, но и минимизация программных осложнений лекарственного лечения. В нашей Клинике не только помогают каждому пациенту легче перенести химиотерапию, но заблаговременно по индивидуальной программе, учитывающей все особенности организма, готовят к курсу лечения.
Современные противоопухолевые средства в терапии раковых заболеваний
В крупнейших лабораториях мира постоянно разрабатываются новые препараты для лечения онкологических патологий. После апробации на добровольцах они успешно используются на практике. В последнее время противоопухолевые препараты стали достойной альтернативой хирургического лечения и лучевой терапии. Современные средства менее токсичны, чем их предшественники, обладают более мощным воздействием на злокачественные опухоли. Если вы не знаете где купить противоопухолевые препараты, зайдите в наш каталог.
Так называются антинеопластические средства с выраженной противоопухолевой и цитостатической активностью. После приема препаратов интермедиаты, являющиеся частицами алканов, присоединяются к ДНК, нарушая ее структуру. Злокачественные клетки утрачивают способность к делению. Запускается процесс их гибели, результатом которого становится распад на отдельные частицы. В онкологии особенно часто проводится лечение такими алкилирующими средствами:
Препараты назначаются при раке, поражающем молочные железы, толстый кишечник, пищеварительный тракт, поджелудочную железу, органы репродуктивной и мочевой систем.
Антиметаболиты

В эту группу цитостатических противоопухолевых химиотерапевтических лекарственных средств входят препараты, многие из которых в течение десятилетий применяются в онкологии. В основе механизма действия лежит ингибирование или конкурентный антагонизм определенных биохимических реакций. Их подавление отрицательно сказывается на размножении мутировавших клеток. Пациентам со злокачественными новообразованиями практикуется назначение следующих средств:
Антиметаболиты включаются в терапевтические схемы пациентов с остро протекающим лимфолейкозом, грибообразным микозом, хориокарциномой, остеогенной саркомой, опухолями лица, раком молочных желез, легких.
Растительные алкалоиды
Несмотря на растительное происхождение активных ингредиентов, такие препараты обладают высокой терапевтической эффективностью. Они достаточно быстро останавливают
митотические циклы злокачественных клеток. В онкологии хорошо зарекомендовала себя терапия следующими группами растительных алкалоидов:
винкалоидами — Винбластином, Винкристином;
таксанами — Паклитакселом, Доцетакселом;
подофиллотоксинами — Этопозидом, Тенипозидом.
У противоопухолевых средств есть определенная нейротоксичность. Из-за выраженных побочных эффектов они используются в лечении онкологических патологий исключительно короткими курсами. Противоопухолевые препараты недорого продаются в нашей аптеке.
Противоопухолевые антибиотики
Это особая группа цитотоксических средств, активные ингредиенты которых прерывают деление переродившихся клеток. Особенно часто лечение пациентов проводится с помощью антрациклинов и блеомицинов, но с успехом применяются и антибиотики — предшественники современных противораковых препаратов. Наибольшая терапевтическая эффективность характерна для таких противоопухолевых средств:
Противоопухолевые антибиотики применяются преимущественно в сочетании с другими препаратами, но в некоторых случаях используются и в качестве монолечения.
Другие группы препаратов с противоопухолевой активностью
Относительно недавно разработаны препараты для лечения определенной формы рака. Они избирательно воздействуют на опухоль, сформировавшуюся в том или ином внутреннем органе. Состав средств представлен компонентами как растительного, так и полусинтетического происхождения. Наиболее результативным считается лечение следующими препаратами:
биотерапевтическими средствами (Альдеслейкином, Целмолейкином, Меланом) злокачественной опухоли, развивающейся из меланоцитов, рака почек;
препаратами с платиной (Цисплатином, Карбоплатином) новообразований яичек, нейробластомы, остеогенной саркомы;
антрацендионом Митоксантроном остропротекающего миелолейкоза, новообразований молочных желез, простаты;
соединением мочевины Гидроксимочевиной миелолейкоза в хронической форме, истинной полицитемии, тромбоцитемии, меланомы;
соединением метилгидразина Прокарбазином лимфогранулематоза;
лекарствами, подавляющими активность коры надпочечников (Митотаном, Аминоглутетимидом) злокачественные патологии надпочечников, груди;
блокатором тирозинкиназы Иматинибом миелолейкоза с хроническим течением.
При выборе противоопухолевого препарата онкологи ориентируются не только на вид патологии, но и на тяжесть ее течения, выраженность симптоматики, размеры злокачественного новообразования.
Гормональные средства в терапии рака
Среди раковых опухолей гормонозависимые новообразования занимают особое место, том числе и потому, что они достаточно хорошо поддаются лечению. Это вариант злокачественного рака, при котором определенная часть атипичных клеток имеют рецепторы к мужским или женским половым гормонам. Если снизить их выработку в организме, то новообразование не будет укрупняться, а в дальнейшем уменьшится в размерах. Какими гормональными препаратами проводится лечение рака:
прогестагенами Гидроксипрогестероном, Медроксипрогестероном, Мегестролом;
эстрогенами Диэтилстильбэстролом, Этинилэстрадиолом;
антиэстрогенами Тамоксифеном, Анастрозолом;
андрогенами Тестостероном, Флуоксиместероном;
аналогом гонадолиберина Лейпрорелином.
Любое гормональное средство токсично по отношению к организму, поэтому его используют в минимально возможных дозировках. Препараты способны провоцировать развитие побочных реакций, но большинство из них носит обратимый характер. Противоопухолевые препараты в Москве продаются в нашей аптеке.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.

Юляша 12.09.2021 Опухоли могут быть и доброкачественные, но мне кажется любое новообразование приводит в панику, меня так точно. У меня фиброма в груди была, типа ничего страшного, но риск перерождения не маленький. Мне, врач эваларовский индол форте порекомендовал принимать в период лечения, не гормональный препарат, на основе экстракта брокколи. Снижает риск разрастания тканей в молочной железе и матке, нормализует гормональный фон. Я его теперь в целя профилактики пью.
Читайте также:
