Лучевая терапия рака яичника и ее эффективность
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Рак яичников является вторым по распространенности и имеет самую высокую смертность среди гинекологических опухолей. Это связано с поздней диагностикой – обнаруживается только на запущенной стадии и растет довольно агрессивно. Рак яичников коварен, т. к. практически не вызывает никаких симптомов на ранних стадиях или проявляется нехарактерными признаками. В момент диагностирования для лечения часто бывает уже слишком поздно. Лучевая терапия при раке яичников (ЛТ) используется преимущественно в качестве дополнительного метода лечения.
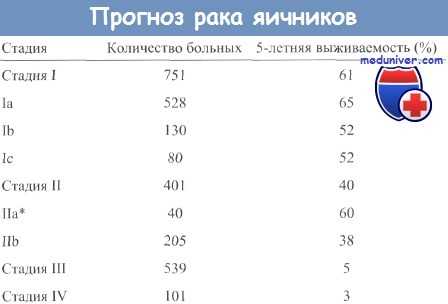
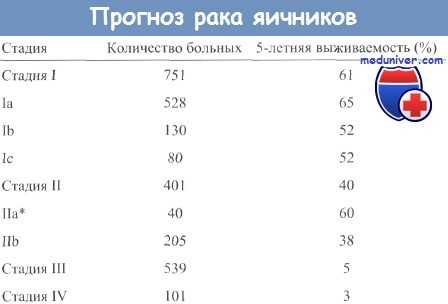
Рак яичников встречается преимущественно у женщин после наступления менопаузы, в возрасте от 50 до 70 лет. Тем не менее, существуют также типы образований, которые поражают молодых женщин и даже детей. Прогноз выживаемости зависит от стадии заболевания. Первая стадия сопровождается 5-летней выживаемостью в 85% до 95% случаев. На IV стадии это не более 20%. У большинства женщин с III или IV стадией имеется вероятность рецидива.
О лучевой терапии при раке яичничков
Когда назначается лучевая терапия при раке яичников
Современная радиотерапия характеризуется разными подходами. Облучение не может быть использовано в качестве самостоятельного метода лечения первичных больных даже с паллиативной целью (для улучшения жизни пациента). Лучевая терапия рекомендована в качестве дополнения к комбинированному лечению.
В основном используется в следующих случаях:
- до операции для уменьшения опухоли (неоадъювантная терапия);
- после операции для уничтожения оставшихся раковых клеток (адъювантная терапия).
Если рак яичников не поддается лечению, применяется паллиативная терапия, которая направлена на то, чтобы остановить распространение опухоли, облегчить дискомфорт и продлить срок жизни.


Виды лучевой терапии
Лучевая терапия используется для уничтожения раковых клеток. Применение современных технологий визуализации (МРТ, КТ и ПЭТ), позволяет наиболее точно определить дозы облучения.
Существует несколько различных методов радиотерапии рака яичников. Точные дозы радиации направляются на раковые клетки, которые более восприимчивы к радиации, чем здоровые. Подобно рентгену, лучевая терапия безболезненна.
Виды облучения при раке яичников:
- Внешняя ЛТ. Наиболее распространенная форма лучевого лечения. Используя аппарат, называемый линейным ускорителем, онкологи направляют высокоэнергетические пучки излучения конкретно в расположение опухоли, сохраняя при этом здоровые ткани.
- Интенсивная модулированная лучевая терапия (IMRT). Процедура включает в себя доставку излучения извне с помощью линейного ускорителя, который подает излучение в трехмерной геометрической прогрессии. Точные и высокие дозы облучения назначаются пациентам, которые не были полностью излечены более низкими дозами. Преимущество этого лечения заключается в том, что из-за прецизионной точности оно уменьшает воздействие радиации на здоровые клетки.
- Комбинированная ЛТ. Сочетание интенсивно-модулированной лучевой терапии (IMRT) и компьютерной томографии (КТ). Такой подход дает возможность направлять излучения к опухолям со сложными формами. Компьютерная томография подтверждает размер и положение опухоли, а томотерапия уменьшает воздействие на здоровые ткани и органы.
- Брахитерапия (внутреннее облучение). При раке яичников применяется в редких случаях. Радиоактивные семена или гранулы, помещается внутри опухолевого образования.
Радиационные онкологи, дозиметристы и физики предоставляют каждому пациенту индивидуальный план лечения, помогая вернуться к нормальной жизни. Доза радиации, которая приходится на неэкранированный участок, не должна быть более 25 Гр. При ежедневном воздействии курс радиотерапии длится на протяжении 5 недель. На область таза доза облучения достигает 40-50 Гр.

Процедура лучевой терапии при раке яичников
Любое лечение начинается с консультации, которая может занять 1-2 часа. Если назначается лучевая терапия, пациент встречается с радиационным онкологом, который подбирает вид радиотерапии и учитывает плюсы-минусы в конкретном случае. Пациенту объясняют все нюансы, как проводится процедура, и предоставляют информацию о том, как заботиться о себе во время и после лечения.
Поскольку лучевая терапия рака требует предельной точности, пациент проходит симуляцию в центре. Используя картографирование изображений в качестве ориентира, медицинская бригада позиционирует каждого клиента, насколько он готов к лечению. Проводятся измерения для построения целевого плана лечения и точного определения направления луча излучения для достижения наилучшего результата.
Основные моменты проведения процедуры:
- Пациент снимает одежду и занимает предназначенное положение на кушетке.
- Фиксация облучаемого участка осуществляется ремнями, гипсовыми пластинами или пластиковыми масками.
- Затем медицинский персонал адаптирует устройство к существующей маркировке, выходит из комнаты и снова проверяет настройки.
- Во время процедуры за пациентом наблюдают через стеклянную панель и/или монитор.
- Связь осуществляется через специальный встроенный микрофон.
Хотя путь каждого пациента индивидуален, большинство женщин с раком яичников получают лучевую терапию 5 дней в неделю, в течение нескольких недель. Все зависит от типа опухоли, ее локализации и технологии, которую будут использовать в каждом отдельном случае. После лечения нужно посещать врача еженедельно, чтобы следить за прогрессом и назначить симптоматическое лечение при возникновении побочных реакций.
Сочетание с другими видами лечения
Лучевая терапия использует высокоэнергетические рентгеновские лучи или частицы для уничтожения раковых клеток. Агрессивная химиотерапия обычно более эффективна при лечении рака яичников. Лучевая терапия редко используется в качестве основного метода воздействия на злокачественное новообразование.
Облучение проводится пациентам в строго контролируемых дозах для контроля роста раковых клеток, в основном используется при лечении метастазированного рака яичников. Его часто назначают до/после операций или в сочетании с химиотерапией. Основное преимущество радиотерапии заключается в том, что оно не только убивает злокачественные клетки, но и помогает уменьшить боль и другие симптомы рака.


Побочные реакции при раке яичников
Побочные эффекты при лучевой терапии возникают из-за повреждения здоровых клеток крови в организме. Когда облучение подается в больших дозах, оно может оказывать неблагоприятное воздействие на организм. Краткосрочные побочные эффекты исчезают через 1-2 недели после лечения, но иногда приходится иметь дело с долгосрочными нежелательными последствиями.
Некоторые распространенные побочные эффекты включают в себя:
- Изменения кожи. В обработанной области эпидермис выглядит раздраженным, могут появиться волдыри и шелушение.
- Усталость. Пациент испытывает недомогание и сонливость.
- Ухудшение и потеря веса. Может появиться тошнота и рвота, из-за которых больной не может полноценно принимать пищу. Также не исключена диарея.
- Ухудшение защитных функций организма. Развивается склонность к инфекциям из-за снижения количества лейкоцитов.
- Анемия. Снижается количество эритроцитов в крови.
- Кровотечение и кровоподтеки. Ухудшаются показатели свертываемости крови, что связано с низким количеством тромбоцитов.
У некоторых пациенток наблюдаются проблемы с мочевым пузырем. Возможно раздражение влагалища, иногда с выделениями.
Основные побочные эффекты после лучевой терапии, возникающие в долгосрочной перспективе:
- высокие дозы радиации убивают здоровые кровеносные сосуды и ухудшают показатели крови;
- лучевая терапия, направленная вблизи почек, может вызвать почечную недостаточность;
- высокие дозы облучения приводят к повышению артериального давления и нарушениям сердечного ритма;
- ЛТ иногда назначается вместе с химиотерапией пациентам, нуждающимся в более высоких дозах, что вызывает снижение тестостерона в организме и нарушает гормональный баланс в организме;
- женщины, перенесшие облучение при раке яичников, склонны к развитию других видов рака в зонах, подвергшихся облучению;
- облучение яичников и матки может привести к бесплодию и снижению либидо.
Противопоказания к проведению лучевой терапии
Список противопоказаний для проведения лучевой терапии при раке яичников не большой. Злокачественное образование – это серьезная угроза для жизни пациента. Поэтому риск от проведения лечения радиацией может быть в некоторой степени противопоставлен опасной опухоли.
Некоторые противопоказания являются относительными:
- возраст;
- беременность и период лактации;
- особенности физиологии у женщин (менструация);
- острая фаза туберкулеза;
- сложные новообразования или опухоли на стадии разложения;
- обострение инфекционных состояний.
К абсолютным противопоказаниям относятся:
- крайне тяжелое физическое состояние пациента;
- наличие отдаленных (особенно множественных) метастазов;
- прорастание опухоли в полые органы;
- заболевания системы кроветворения (тромбоцитопения, выраженная анемия, лейкопения);
- перенесенный инфаркт миокарда (менее года назад);
- декомпенсация функции печени и почек;
- психические нарушения (временная и пространственная дезориентация).

Преимущества лучевой терапии при раке яичников в «Медскан»
В медицинском центре «Медскан» с пониманием относятся к неопределенности, которая приходит с диагнозом рака яичников. Радиационные онкологи центра обладают тем уровнем знаний, который необходим при лечении рака любой стадии. Медицинские бригады обеспечат высокий уровень лечения с помощью лучевой терапии. Каждому пациенту «Медскан» в Москве будет обеспечена забота, комфорт и понимание.
Передовые технологии клиники позволяют создавать лучшие индивидуальные планы лечения для борьбы с раком яичников и минимизировать побочные эффекты. Высококвалифицированные сотрудники имеют многолетний опыт работы и работают в команде.
Лучевая терапия рака яичника и ее эффективность
Исторически лучевая терапия использовалась как самостоятельный метод лечения рака яичника, совместно с хирургическим методом при рецидивах, и иногда в качестве предоперационного мероприятия. В отдельных случаях лучевая терапия назначалась после операции пациенткам, у которых не наблюдалось распространения опухоли за пределы тазовой области. Применялись две основные схемы лучевой терапии.
По первой схеме (для пациенток в I и II стадии заболевания) проводилось облучение области таза в переднезаднем направлении, или с использованием нескольких полей облучения, обычно в дозе 40-50 Гр на протяжении 4-4,5 недель. По второй схеме проводилось тотальное облучение брюшной полости. Технически эта схема более трудновыполнима, поскольку приходится облучать очень большой объем туловища.
При облучении, включающем поддиафрагменную область, объем облучаемого участка простирается от основания таза до купола диафрагмы. Обычно мощность дозы невелика (порядка 1 Гр в день), поскольку у пациенток не должны наблюдаться такие последствия, как тошнота и подавление миелопоэза. Особенно неблагоприятными оказываются последствия после проведения химиотерапии: часто у пациенток развивается нефрит и гепатит. При облучении в дозе 15-20 Гр экранируется область почек и печени.

Доза радиации, приходящаяся на неэкранированный участок, не должна превышать 25 Гр. При ежедневном облучении обычный курс радиотерапии продолжается в течение 5 недель. При этом доза, приходящаяся на область таза, может достигать 40-50 Гр.
Ретроспективные исследования, проведенные на пациентках с опухолью в I стадии, леченных только хирургическим методом и с последующей радиотерапией, имеют один недостаток: подборка групп не дает возможности корректно сравнить полученные результаты. Во многих подобных исследованиях состояние пациенток в группе, получившей после операции сеанс радиотерапии, было гораздо хуже, чем в группе оперированных без последующей лучевой терапии.
Это позволяет заключить, что пациентки первой группы характеризуются повышенной степенью риска, возможно, из-за разрыва кисты или в силу каких-то других причин. Пятилетняя выживаемость для группы пациенток с опухолью на I стадии развития варьировала от 50% до 65% и не зависела от назначения им после операции курса лучевой терапии.
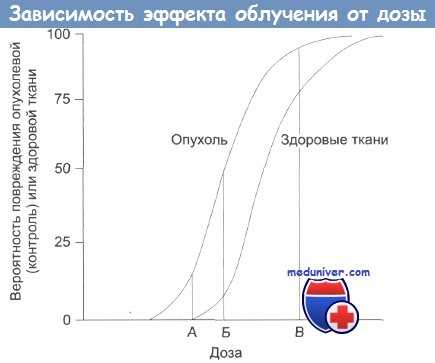
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
Начинают появляться результаты сравнения между группами оперированных пациенток и получавших курс лучевой терапии после операции, однако четких различий выявить пока не удалось.
Постоперативное облучение тазовой области у пациенток с опухолью на II стадии развития оказалось эффективным, хотя в таких случаях сейчас обычно используется химиотерапия. Почти во всех группах отмечалось увеличение 5-летней выживаемости, особенно если операция была проведена адекватным методом. Поскольку эти исследования проводились до того времени, как установление стадии развития опухоли превратилось в обязательный элемент первичного обследования, у многих пациенток фактически могла быть III стадия заболевания.
Лечебный эффект проявлялся даже несмотря на то, что столь большая область была облучена в достаточно низкой дозе. Результаты этих исследований, несомненно, отражают адекватность выбранного хирургического метода, причем больший лечебный эффект отмечался у пациенток, у которых после операции не пальпировались уплотнения в области живота, независимо от дальнейшего назначения хи-мио- или радиотерапии. Не вызывает сомнений, что тактика сокращения размера опухоли при первичной операции и, смотря по показаниям, после курса химиотерапии, снижает значимость облучения таза или брюшной полости как терапевтической процедуры.
Более того, частота случаев развития непроходимости кишечника за счет рецидивов опухоли после облучения брюшной полости увеличивается.
Альтернативной формой радиотерапии является внутриб-рюшинное введение радиоактивного коллоидного золота (Au 198 ) или радиоактивного фосфора (Р 32 ). Первоначально метод применяли в лечении диссеминированного рака, однако сейчас для этой цели используется системная химиотерапия.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Операция при раке яичника и ее эффективность
Основным эффективным методом лечения рака яичников остается хирургический. Операция в большей степени влияет на конечный результат, чем последующая терапия. Именно от тщательности проведения первичной операции во многом зависит эффективность дальнейшего лечения.
Перед операцией необходимо тщательно обследовать всю брюшную полость. Особое внимание уделяют состоянию поверхности диафрагмы и пространству между ободочной кишкой и брюшиной, поскольку в них могут быть метастазы, иногда остающиеся незамеченными. Даже если в поддиафрагменной области не обнаружено видимых узелков, смывы с брюшины могут содержать опухолевые клетки.
При этом у значительной части пациенток с диагнозом локализованной опухоли иногда обнаруживают более обширный процесс, для лечения которого локальные методы не подходят.
Для больных в I стадии заболевания в большинстве случаев оказывается эффективным хирургический метод лечения. Обычно проводят абдоминальную гистерэктомию с двухсторонней сальпингэктомией и овариэктомией. Второй яичник обычно удаляется даже при односторонней начальной локализации опухоли, поскольку в 20% случаев за счет скрытых метастазов в нем в дальнейшем обычно также развивается опухоль.
У молодых пациенток, желающих сохранить яичник, можно попробовать провести более консервативную операцию. С большей уверенностью консервативную операцию можно рекомендовать для случаев опухолей с невыраженной злокачественностью, хотя большинство гинекологов, по понятным причинам, предпочитает при этом радикальный подход, если, конечно, пациентка в дальнейшем не планирует иметь детей.
В отношении случаев с более поздними стадиями заболевания (стадии II—IV) большинство онкологов придерживается мнения о максимально возможном удалении опухоли при первичной операции. Хороший паллиативный эффект достигается, даже если удается сократить размер опухоли хирургическим путем.
Впрочем, лишь немногие результаты свидетельствуют о том, что продолжительность жизни пациенток увеличивается, если не удалена вся или почти вся опухоль. Многие операбельные опухоли характеризуются низкой степенью злокачественности, что уже само по себе является основанием для благоприятного прогноза. Тем не менее максимальный размер участка опухоли, остающегося после резекции, является неплохим ориентиром для последующего назначения курса химиотерапии и дальнейшего прогноза.
При расчете выживаемости пациенток по уравнению линейной регрессии оказывается, что наибольший вклад вносят такие параметры, как гистологическая характеристика опухоли и максимальный размер ее участка, остающегося после операции. Если в результате операции размер опухоли не уменьшился до 1,6 см (или меньше) в диаметре, то такая операция оказывается неэффективной.
Если после операции у пациентки пальпируются остаточные уплотнения, то назначение курса химиотерапии или лучевой терапии вряд ли будет эффективно. Поэтому, по крайней мере для части из них, может потребоваться повторная операция, которая должна проводиться опытным хирургом. Сейчас стали чаще выполняться такие сложные операции, как удаление тазовых органов, удаление сальника, резекция толстой кишки, и полное удаление пристеночной тазовой брюшины.
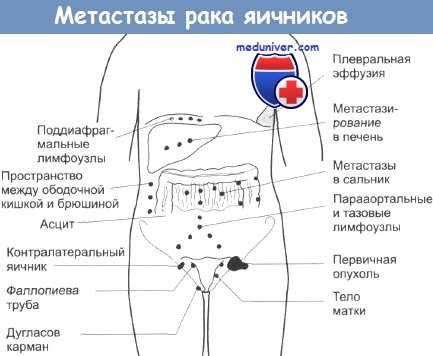
Исследования, проведенные в рамках Межевропейского сотрудничества на рандомизированной группе из 319 первично оперированных пациенток, прошедших курс химиотерапии, подтвердили эффективность повторной операции. У пациенток, которым была сделана лапаротомия «второго взгляда», отмечалось повышение общей выживаемости, а также выживаемости без прогрессирования заболевания.
Несмотря на применение ультразвуковых методов, КТ и МРТ, не существует способов контроля эффективности лечения поздних стадий рака яичников. Снова все сводится к различным методам обследования. Поэтому иногда целесообразно провести хирургическую операцию, даже выходящую за рамки «второго взгляда». Если при лапароскопическом обследовании не обнаруживаются очаги опухоли и результаты анализа внутрибрюшинных смывов отрицательны, то для окончательной уверенности в благоприятном исходе в некоторых случаях можно сделать лапаротомию.
Трудно, конечно, утверждать, что лапаротомия «второго взгляда» способна продлить жизнь пациентки с опухолью яичников, однако в результате ее проведения можно будет использовать более обоснованную тактику дальнейшего лечения. Сейчас все понимают, что лапаротомия «второго взгляда» всего лишь определяет выбор способа последующего лечения.
В последнее время существенно изменилась роль хирурга-гинеколога в лечении рака яичников. Начальное обследование пациенток с локализованными и генерализованными опухолями и выбор техники операции приобрели первостепенную важность. Также не менее важным стало мнение хирурга при выборе метода лечения. Хотя «лапаротомия второго взгляда» и является наиболее надежным методом контроля эффективности лечения, ее истинная терапевтическая польза остается сомнительной.
Лучевая терапия аденокарциномы яичника по стадиям
В послеоперационный период применяют интраперитонеальное введение радиоактивного фосфата хрома и дистанционную лучевую терапию (ЛТ) на область живота и таза. Основанием для такого «широкого» лечебного плана облучения стал анализ рецидивов после лучевой терапии (ЛТ) I и II стадий рака яичника (РЯ), большинство из которых возникают за пределами таза. В тазу нет никакой «заслонки», поэтому злокачественные клетки первичной опухоли яичников, отделяясь от нее, циркулируют по всей брюшной полости. Также возможна и лимфогенная диссеминация.
Для облучения брюшной полости используют две методики. Крупными полями на брюшную полость подводят 25—30 Гр в течение 4—5 нед. Почки и, возможно, правую долю печени экранируют, чтобы ограничить дозу до 20—25 Гр. Лечение часто прекращают из-за тошноты и рвоты. В некоторых центрах долгое время для абдоминальной ЛТ использовали так называемый способ смещающихся полос облучения (moving strip techniques), который завершали бустерной (усиливающей эффект) дозой облучения таза (20—30 Гр).
С развитием химиотерапии (XT) роль облучения при лечении рака яичника (РЯ) значительно снизилась. Характер распространения опухоли и свойства нормальных тканей, попадающих в зону облучения, не позволяют провести эффективную ЛТ. Некоторые специфические проблемы перечислены в таблице ниже.

Если после операции остаточная опухоль большого размера, лучевая терапия (ЛТ) неэффективна. Облучение всей брюшной полости сопровождается осложнениями и имеет множество ограничений. Причины ограничения дозировки ЛТ приведены в таблице ниже.

Эксперты GOG изучили эффективность комбинированной химиолучевой терапии. В проспективном рандомизированном исследовании у четырех групп больных после хирургического вмешательства использовали только ЛТ, ЛТ перед XT (мелфалан), только XT и XT перед ЛТ и не обнаружили существенных различий.
Dembo и соавт. проанализировали результаты проспективного рандомизированного исследования у 231 пациентки с I, II и бессимптомной III стадией рака яичника (РЯ), получивших лучевую терапию (ЛТ) или ее сочетание с хлорамбуцилом. Хлорамбуцил назначали в дозе 6 мг/сут в течение 2 лет. На область таза подводили 22,5 Гр за 10 фракций и сразу же приступали к облучению живота в той же дозе 22,5 Гр за 10 фракций (кобальт) по нисходящей методике (от верхних отделов живота к тазу) смещающихся полос. При I или II стадии рака яичника (РЯ) применяли только тазовое облучение в дозе 45 Гр.
Авторы пришли к выводу, что при Ib, II и бессимптомной III стадиях неполное удаление опухоли влечет за собой плохую выживаемость.
У пациенток после полного удаления опухоли лучевая терапия (ЛТ) на область живота и таза дала лучшие результаты (отдаленная выживаемость и процент возникновения рецидивов в брюшной полости), чем изолированное облучение таза или облучение таза в сочетании с приемом хлорамбуцила. Эффективность абдоминального и тазового облучения не зависела от стадии или гистологических особенностей новообразования. Наилучшие результаты достигнуты у больных без видимой остаточной опухоли. При Ib или II стадии послеоперационное облучение только области таза оказалось неэффективным.
Абдоминальное и тазовое облучение с захватом обоих куполов диафрагмы без защиты печени значительно снизило распространение опухоли за пределы таза и улучшило выживаемость. Однако адъювантная XT хлорамбуцилом после тазового облучения у этих пациенток оказалась неэффективной. Авторы пришли к выводу, что при выборе послеоперационного лечения небольшое поражение верхнего этажа брюшной полости не должно служить поводом к использованию только XT и отказу от ЛТ. По данным Dembo и соавт., 5-летняя выживаемость при II стадии составила 58 %, а при III — 43 %.

Кроме того, Martinez и соавт. сообщили о 42 пациентках со II и III стадиями РЯ, 5-летняя выживаемость у которых достигла 54 %. Для подтверждения этих результатов и возобновления интереса к ЛТ при III и IV стадиях рака яичника (РЯ) необходимы дальнейшие исследования.
Эффективность лучевой терапии (ЛТ) при локальных формах заболевания требует обсуждения. GOG провела проспективное рандомизированное исследование у больных раком яичника (РЯ) I стадии, которых разделили на три группы: без дальнейшего после операции лечения, прием мелфалана (Алкеран) и облучение области таза. Самым эффективным оказался прием мелфалана.
Эффективность тазового облучения при II стадии рака яичника (РЯ) необходимо уточнить. Ранее в некоторых клиниках в качестве стандартного лечения при этой стадии заболевания использовали облучение области таза в сочетании с системной XT. По данным ретроспективных исследований, облучение таза увеличивает выживаемость больных, если его применить после хирургического лечения. Для того чтобы сравнить эффективность тазового облучения и XT при II стадии заболевания, необходимо провести проспективное рандомизированное исследование. Young и соавт. сообщили об исследовании GOG, в котором сравнивалась эффективность XT и и/п введения коллоидного 32Р. По нашему мнению, при II стадии РЯ существует риск распространения злокачественного процесса по всей брюшной полости.
Поэтому, если планируют адъювантную лучевую терапию (ЛТ), целесообразно провести облучение всего живота и таза. III фазу сравнительных исследований эффективности XT препаратами платины и облучения у пациенток с РЯ низкого и промежуточного риска не проводили. Ретроспективные исследования этих методов лечения обладают многими недостатками, не позволяющими провести сравнение эффективности ЛТ и XT. Эти методы лечения настолько разные, что из-за заинтересованности исследователей в конечных результатах невозможно привлечь достаточное число больных и провести проспективный анализ. Во многих случаях исследования ЛТ проводили достаточно давно, а стадирование выполняли не слишком точно. Тщательный отбор пациенток и низкая токсичность ЛТ, обусловленная последними достижениями, — предпосылки к проведению III фазы исследования эффективности этого метода лечения при РЯ.
Лучевая терапия (ЛТ) в качестве терапии второй линии при рецидивирующем и резистентном к цитостатикам РЯ имеет своих сторонников. Как уже говорилось, в связи с прогрессом в области XT ЛТ перестали применять в комплексе первичного лечения. Возрождение интереса к ЛТ как к терапии второй линии связано с безуспешностью XT. Cmelak и Карр сообщили о собственном опыте лечения 41 пациентки, у которых XT оказалась неэффективной. Всем провели полное облучение живота с бустерным воздействием на область таза. 5-летняя актуриальная (предполагаемая) выживаемость, зависящая от заболевания, составила 40 %, а у пациенток с резистентностью к платине — 50 %.
При остаточной опухоли менее 1,5 см безрецидивная 5-летняя выживаемость составила 53 %, при большем размере остаточной опухоли — 0 %. Практически 1/3 пациенток не смогла закончить спланированный курс облучения брюшной полости из-за токсических побочных явлений. В 3 случаях потребовались операции для устранения осложнений со стороны ЖКТ Sedlacek и соавт. провели обследование 27 пациенток, получивших полный курс облучения брюшной полости после XT на основе препаратов платины. 5-летняя выживаемость составила 15 %. Больные с микроскопическими остаточными опухолями прожили в среднем 63 мес, а при размере более 2 см — 9 мес. Хирургическая коррекция проблем, связанных с ЖКТ, потребовалась 4 пациенткам.
Возможно, облучение брюшной полости после химиотерапии (XT) эффективно только при малом размере остаточной опухоли. Sedlacek проанализировал данные литературы и отметил, что при микроскопических остаточных опухолях на момент облучения отдаленная выживаемость составила 36 % (47 из 130 пациенток), а при макроскопических — только 6,8 % (15 из 218).
Лучевая терапия рака матки

Рак матки развивается из клеток слизистой оболочки. Это одно из наиболее распространенных онкологических заболеваний, которым обычно страдают женщины в возрасте от 60 до 70 лет. Рак шейки матки представляет собой вторую по распространенности опухоль после рака молочной железы у женщин. Около 20% всех недавно появившихся злокачественных опухолей – это рак шейки матки.
Факторы риска: избыточный вес, более длительное производство эстрогена и генетическая предрасположенность.
Симптомы: на поздней стадии возникает дискомфорт, в том числе необычное кровотечение, например, между менструациями или после менопаузы. Позже добавляются боли в области влагалища, а также инфекции мочевых путей.
Прогноз: при раннем выявлении шансы на выздоровление высоки. Если метастазы уже сформировались, то прогноз ухудшается.
Лечение: лучший вариант терапии – это операция, при которой матка удаляется. Часто добавляется лучевая и химиотерапия. Единственный способ профилактики – регулярные осмотры у гинеколога.
Лечение лучевой терапией рака матки или шейки матки представляет собой в первую очередь послеоперационную меру. Хотя облучение на ранней стадии может обещать успех, операция обеспечивает лучший прогноз. Вот почему радиотерапия имеет смысл в сочетании с хирургическим вмешательством и незаменима в том случае, если оперативное лечение невозможно.
Радиотерапия направлена на предотвращение роста и распространения опухоли. Но она также используется, если злокачественное новообразование не может быть полностью удалено или свод влагалища уже пострадал. Целенаправленное, локально ограниченное облучение улучшает перспективы выздоровления. Облучение осуществляется с помощью аппликатора, введенного во влагалище, или же снаружи (на линейном ускорителе).
О лучевой терапии при раке матки
Когда назначается лучевая терапия при раке матки
Воздействие ионизирующим излучением является основой медицинской лучевой терапии. Но это звучит как противоречие: излучение оказывает вредное воздействие на живые клетки, то есть на ткани, повреждая наследственный материал, как здоровых, так и раковых клеток. Но здоровые клетки могут восстановить повреждение, а злокачественные клеточные структуры при этом умирают.
Показания к проведению радиотерапии в лечении рака матки:
локализованный рак эндометрия, развивающийся на фоне декомпенсированной и субкомпенсированной соматической патологии, которые являются абсолютным противопоказанием для операции;
местнораспространенные формы злокачественных опухолей: переход опухоли на влагалище, шейку матки и параметральную клетчатку (у 27% больных);
рак эндометрия при наличии неблагоприятных для прогноза факторов (низкодифференцированные опухоли, имеющие большую внутриорганную протяженность);
резектабельные злокачественные образования с распространением на придатки или связочный аппарат матки с глубокой инвазией миометрия, существенно ухудшающей прогноз заболевания.
В основном облучение используется в лечебных целях. При неизлечимых стадиях заболевания речь идет только об улучшении качества жизни или облегчении боли. Облучение проводится самостоятельно или в сочетании с химиотерапией. Тактика проведения лучевой терапии зависит от многих факторов, поэтому дозу облучения рассчитывают совместно врачи разных специальностей.


Как подготовиться к лучевой терапии
Перед началом лечения рака матки лучевая терапия должна быть тщательно спланирована. Для каждого пациента разрабатывается индивидуальный план. Тщательное планирование гарантирует, что облучаемая область охватывает всю опухоль, исключая негативное воздействие на здоровые ткани, чувствительные или жизненно важные органы, такие как сердце и спинной мозг.
Процедура проведения радиотерапии при раке матки:
Врачи и радиотерапевты устанавливают область, а также дозу облучения на компьютере, обычно на основе КТ (компьютерной томографии). Это занимает около недели.
Как только план будет подтвержден, запланированные лучевые поля будут проверены на пациенте с помощью специальной рентгеновской осветительной установки (имитатора терапии).
Затем поля облучения рисуются на коже водостойким карандашом или хной. Обычно это занимает от 30 минут до часа. Важно отметить, что маркер длительное время не смывается. Если разметка повредится, то сложное моделирование должно быть повторено.
Терапия может начаться сразу после планирования или через 1-2 дня. При необходимости поля облучения могут быть скорректированы в ходе проводимого лечения.
Как правило, радиотерапия назначается при раке тела матки после операции и только в исключительных случаях используется в качестве единственной терапевтической меры.
Существует два вида лучевой терапии опухоли матки:
дистанционное (внешнее) с использованием линейного ускорителя;
брахитерапия (внутреннее) с помощью зонда (аппликатора).
При брахитерапии источник излучения помещается во влагалище. Аппликатор вводится в канал шейки матки и максимально точно воздействует на облучаемую область. При достижении желаемой дозы облучения источник излучения извлекается.
Методики лучевой терапии при раке матки часто объединяются в рамках плана лечения, но процедуры проводятся не в один и тот же день. Как правило, назначаются только избирательные сеансы брахитерапии, в то время как облучение извне происходит ежедневно в течение нескольких недель.


Процедура лучевой терапии при раке матки
Радиотерапия обычно проводится с помощью больших устройств, которые генерируют рентгеновские лучи. В некоторых случаях также используется так называемое гамма- или электронное излучение. Вся терапия состоит из серии ежедневных облучений, при которых общая доза делится на небольшие фракции. Количество процедур определяется несколькими факторами, в том числе типом и степенью заболевания.
У большинства пациентов лучевая терапия при онкологии шейки и тела матки проводится ежедневно, как правило, с двухдневным перерывом в выходные дни. В некоторых случаях облучают только один раз или один-два раза в неделю. Вся лучевая терапия может длиться до шести недель. У большинства пациентов облучение проводится амбулаторно, то есть они приходят в больницу на процедуру, а затем могут вернуться домой.
Ход процедуры облучения:
Пациент снимает одежду и занимает запланированную позицию на лечебной кушетке.
Фиксация облучаемой области осуществляется с помощью ремней, гипсовых пластин или пластиковых масок.
Затем медицинский персонал точно настраивает устройство на уже существующую маркировку.
Сотрудники клиники выходят из комнаты и проверяют настройки еще раз.
На протяжении процедуры за пациентом наблюдают через стеклянную панель и/или монитор.
Общение происходит через специальный встроенный микрофон.
При амбулаторной лучевой терапии проводятся регулярные медицинские осмотры. Если возникают вопросы до, во время или после терапии, нужно задавать их лечащему врачу.
Сочетание лучевой терапии с другими видами лечения
Для планирования лечения врачи должны знать, как далеко распространилась опухоль и заражены ли лимфатические узлы, а также другие ткани или органы. Опухоли делятся на разные стадии. Это влияет на тактику лечения:
Опухоль еще мала и лимфатические узлы не поражены: обычно достаточно одной операции. Если имеются высокие риски повторного образования опухоли, назначается лучевая терапия с сопутствующей химиотерапией или без нее.
Опухоль прогрессирует, но лечение все еще возможно: тогда, как правило, не оперируют, а лечат комбинацией лучевой и химиотерапии (радио-химиотерапии).
Эффективность лечения маловероятна: с помощью операции, химиотерапии или лучевой терапии можно попытаться остановить рост опухоли, чтобы выиграть время и уменьшить дискомфорт.
Болезнь неизлечима: на первый план выходит паллиативная помощь, которая включает в себя меры для облегчения боли и улучшения качества жизни.
Операция обычно стоит на первом месте. Цель – полное удаление злокачественной опухоли. При очень небольших раковых новообразованиях конизации может быть достаточно. При конизации вместе с опухолью удаляется конусообразный кусок шейки или тела матки размером примерно с вишню. Оперируется через влагалище, под местной или общей анестезией. Если конизации недостаточно, удаляется большая часть шейки матки и/или вся матка. Также могут быть удалены части смежных органов или соединительной ткани. После частичного удаления шейки матки женщина все еще может иметь детей. Однако процедуры увеличивает риск преждевременных родов во время беременности.
При лучевой терапии опухоль лечится рентгеновскими лучами. Матка может быть облучена снаружи через кожу или изнутри через влагалище. Для лечения рака шейки матки лучевая терапия обычно сочетается с химиотерапией (радио-химиотерапия). Химиотерапия направлена на остановку бесконтрольного деления раковых клеток. Препараты (называемые цитостатиками) обычно вводятся в вену через инфузию или назначаются в виде таблеток. Химиотерапия, как правило, сочетается с лучевой терапией.
Читайте также:
