Лекарства против микроорганизмов. Лекарства и прионы
Добавил пользователь Валентин П. Обновлено: 24.01.2026
Бактерицидные антибиотики ингибиторы синтеза клеточной стенки
У большинства бактерий клеточная стенка окружает клетку в виде плотной оболочки, защищающей от вредных внешних воздействий, и предотвращает разрыв плазматической мембраны под влиянием высокого внутреннего осмотического давления.
Стабильность структуры клеточной стенки обеспечивается в основном муреином (пептидогликаном), имеющим вид решетки. Он состоит из основных «строительных блоков», связанных вместе, которые образуют большую макромолекулу. Каждая основная единица содержит два связанных аминоуглевода N ацетилглюкозамина и N-ацетилмурамовой кислоты; последняя имеет пептидную цепь. «Строительные блоки» синтезируются в бактериях, переносятся наружу через клеточную мембрану и собираются, как показано на схеме.
Транспептидаза сшивает пептидные цепи соседних цепей аминосахаров. Бактерии, которые окрашиваются грамотрицательно, имеют дополнительную мембрану поверх муреинового слоя. Она блокирует доступ многим антибиотикам к грамотрицательным бактериям. Эта мембрана состоит из фосфолипидного бислоя, содержащего белки (в т. ч. транспортные, которые позволяют антибиотикам преодолевать ее) вместе с липополисахаридами.
Ингибиторы синтеза клеточной стенки являются избирательными антибактериальными препаратами, т. к. у животных и у человека клеточная стенка отсутствует. Эти препараты оказывают бактерицидное действие на растущие и размножающиеся бактерии. К представителям данного класса относятся β-лактамные антибиотики, например пенициллины, цефалоспорины и атипичные β-лактамы, а также ванкомицин и бацитрацин.
а) Пенициллины. Исходным веществом данной группы является бензилпенициллин (пенициллин G). Он был впервые получен из культур плесневых грибов Penicillinum notatum. Бензилпенициллин имеет основную структуру, общую для всех пенициллинов, а именно 6-аминопенициллиновую кислоту, содержащую тиазолид и 4-членное β-лактамное кольцо. 6-аминопенициллиновая кислота сама по себе не обладает антибактериальной активностью.
Пенициллины нарушают синтез клеточной стенки за счет ингибирования транспептидазы. Бактерицидное действие пенициллинов проявляется при росте бактерий и в фазе репликации. В результате нарушения целостности клеточной стенки бактерии набухают и разрываются.
Пенициллины, как правило, хорошо переносятся. Суточная доза бензилпенициллина варьирует от 0,6 г в/м (10 6 ME, 1 мегаЕД) до 60 г в виде инфузии. В основе наиболее значимых побочных эффектов лежит гиперчувствительность (частота до 5%) с проявлениями от кожной сыпи до анафилактического шока (< 0,05% случаев). Аллергия к пенициллину в анамнезе служит противопоказанием к данным препаратам. Нейротоксическиеэффекты, в основном судороги вследствие антагонизма с ГАМК, встречаются при чрезвычайно высоких концентрациях в головном мозге, например, после быстрой в/в инъекции большой дозы или при субарахноидальной инъекции.
Бензилпенициллин быстро выводится почками в основном в неизмененном виде (t1/2 из плазмы около 0,5 ч) с помощью системы секреции органических ионов.

Для расширения диапазона дозы с сохранением необходимогоуровня антибактериального препарата пенициллины могут вводиться в высокой дозе в силу широкой терапевтической границы безопасности. Существуют пролонгированные препараты для в/м введения (продолжительность действия прокаин-бензилпенициллина составляет 1 день, а бензатин-бензилпенициллина — 7-28 дней). Одновременное введение пробенецида для ингибирования переносчика анионов в почках задерживает выделение пенициллина.
Несмотря на очень хорошую переносимость, у бензилпенициллина имеются недостатки, которые ограничивают его терапевтическую полезность:
1. Он инактивируется кислотой желудка, которая отщепляет р-лактамное кольцо, что делает необходимым в/в введение.
2. β-лактамное кольцо также разрушается бактериальными ферментами (р-лактамазами), в частности пенициллиназой, которая образуется штаммами стафилококка, обеспечивая их резистентность к бен-зилпенициллину.
3. Узкий антибактериальный спектр, и несмотря на то что он охватывает многие грамположительные бактерии, грамотрицательные кокки и спирохеты, вне поражения остаются многие грамотрицательные возбудители.
Производные пенициллина с различными заместителями 6-аминопенициллиновой кислоты обладают рядом преимуществ.
1. Резистентность в кислой среде позволяет вводить препарат внутрь при условии возможности кишечного всасывания. Многие производные, показанные на рисунке ниже, вводятся внутрь. Пенициллин V (феноксиметил пенициллин) обладает такими же антибактериальными свойствами, что и бензилпенициллин.
2. Благодаря резистентности к пенициллиназе изоксазолилпенициллины (оксациллин, диклоксациллин, флоксациллин) подходят для (перорального) лечения инфекций, вызванных продуцирующими пенициллиназу стафилококками.
3. Расширенный спектр активности: аминопенициллин амоксициллинактивен против многих грамотрицательных организмов, например бактерий группы кишечной палочки или Salmonella typhi.
Амоксициллин устойчив в кислой среде и хорошо всасывается в кишечнике, т. к. транспортируется ди-пептидным переносчиком. Ампициллин обладает аналогичным спектром активности, но из-за плохой всасываемости (< 50%) сильнее повреждает кишечную микробную флору (побочный эффект — диарея), поэтому его следует вводить только в виде инъекции.
Ациламинопенициллины (мезлоциллин, пиперациллин) характеризуются еще более широким спектром против грамотрицательных бактерий (в т. ч. синегнойных бактерий). Эти вещества неустойчивы к кислой среде и к пенициллиназе.
Чувствительные к пенициллиназе пенициллины эффективно действуют против продуцирующих пенициллиназу бактерий при комбинировании их с ингибитором β-лактамазы, который сам по себе не обладает антибактериальным свойством,но необратимо блокирует фермент. Это клавулановая кислота, сульбактам, тазобактам.
б) Цефалоспорины. Эти β-лактамные антибиотики тоже являются продуцентами грибов и обладают бактерицидной активностью из-за ингибирования транспептидазы. В основе их общей структуры лежит 7-аминоцефалоспориновая кислота, что можно видеть на примере цефалексина (серый прямоугольник). Цефалоспорины устойчивы в кислой среде, но многие из них плохо всасываются. Учитывая, что их нужно вводить парентерально, большинство из них, в т. ч. с высокой активностью, используется только в стационарах. Небольшое число препаратов, например цефалексин, подходит для приема внутрь.
Цефалоспорины резистентны к пенициллиназе, однако существуют микроорганизмы, образующие цефалоспориназу. Тем не менее некоторые производные устойчивы и к данной β-лактамазе. Цефалоспорины — антибиотики широкого спектра действия. Последние производные (цефотаксим, цефтриаксон, цефтазидим) тоже эффективны против возбудителей, резистентных к различным другим антибиотикам. Цефалоспорины в большинстве случаев хорошо переносятся. Все они вызывают аллергические реакции, а некоторые также приводят к повреждению почек, непереносимости алкоголя и кровотечению (антагонизм с витамином К).
в) Атипичные β-лактамы являются резервными антибиотиками в случае неэффективности или непереносимости пенициллинов и цефалоспоринов. После клубочковой фильтрации карбапенем имипенем инактивируется в полости проксимального канальца дегидропептидазой, расположенной на щеточной каемке. Их комбинация с ингибитором фермента циластатином защищает против инактивации и сохраняет эффективность в нижних мочевых путях. Меропенем нечувствителен к разрушению и менее токсичен в отношении ЦНС.
У монобактама азтреонама имеется только основная структура β-лактамов в β-лактамном кольце.
г) Другие ингибиторы синтеза клеточной стенки. Бацитрацин и ванкомицин нарушают транспорт пептидогликанов через цитоплазматическую мембрану и активны только против грамположительных бактерий. Ванкомицин — микробный гликопептид, содержащий необычные аминокислоты, поэтому он не расщепляется в ЖКТ. Его можно использовать для (перорального) лечения кишечных инфекций, возникающих как осложнение антибиотикотерапии (псевдомембранозный колит, возбудитель — Clostridium difficile). Он не всасывается.
Инфекции, вызванные грамположительными кокками, резистентные к лучше переносимым препаратам, тоже лечат ванкоми-цином при системном введении. Это приводит к повышенному риску ототоксичности (потеря слуха, шум в ушах) или вестибулярной токсичности (вертиго, атаксия, нистагм). Тейкопланин действует как ванкомицин.
Бацитрацин — смесь полипептидов с выраженной нефротоксичностью, поэтому используется только местно.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лекарства против микроорганизмов. Лекарства и прионы
В этой статье описаны лекарства, которые действуют на патогенные микроорганизмы или злокачественные клетки благодаря своей избирательной токсичности по отношению к ним. Данные препараты сильно отличаются по механизму действия от лекарственных веществ, используемых для воздействия на различные системы организма, которые могут быть рассмотрены одновременно в отношении их образа действия и применения.
У вирусов, бактерий, паразитов и опухолевых клеток существуют определенные молекулярные процессы, которые часто отсутствуют в нормальных тканях млекопитающих и поэтому представляют собой уникальную мишень. В некоторых случаях вирусы, бактерии, паразиты и опухолевые клетки обладают молекулярными механизмами, свойственными также клеткам млекопитающих, однако такие механизмы часто экспрессированы в гораздо большей степени, чем у нормальных клеток млекопитающих.
Существование такого рода различий обусловливает возможность избирательной токсичности. Таким образом, если молекулярная мишень в клетках млекопитающих отсутствует, то лекарство, действующее на эту мишень, например у вирусов, лишь в ограниченной степени влияет на нормальные ткани млекопитающих. Но гораздо важнее добиться идентификации этих мишеней в раковых клетках.
Важно уяснить, что лекарства, предназначенные для уничтожения патогенов или опухолевых клеток, в целом не проявляют полной эффективности в отсутствие иммунного ответа организма. В этих условиях не удается элиминировать все патогены, несмотря на многократные введения лекарственного препарата. Если функции иммунной системы нарушены, возможны рецидивирующие инфекции, вызывающие гибель организма, как это происходит в случае развития оппортунистических инфекций у больных СПИДом.
Следовательно, эффективность многих из этих лекарств невозможно определить в отсутствие клинической информации.

Лекарства и прионы
Термин «прион» относится к определенным белкам, которые в настоящее время считаются инфекционными агентами. Прионы причастны к возникновению трансмиссивных губкообразных энцефалопатии млекопитающих, включая скрепиболезнь овец, губчатую энцефалопатию коров и болезнь Крейтцфельдта-Якоба (БКЯ) у человека.
В 1996 г. был описан новый вариант БКЯ, который поражает только лиц до 40 лет и приводит к быстрому ухудшению здоровья. Предполагают, что эта инфекция возникает у людей в результате потребления мяса крупного рогатого скота, зараженного губчатой энцефалопатией, что указывает на способность некоторых прионов преодолевать тканевые и видовые барьеры. Однако губчатая энцефалопатия — сравнительно редкое заболевание, представляющее минимальную опасность для людей, особенно если учесть возможность профилактики заболевания путем запрета потребления зараженного мяса.
В настоящее время нет лекарств, которые могли бы ингибировать опосредованные прионами нейродегенеративные заболевания, хотя недавно проведенные исследования на животных показывают, что данную инфекцию до некоторой степени может предотвратить полисульфат пентозана.
- Вернуться в оглавление раздела "фармакология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Прионы: исследования таинственных молекул продолжаются

Новость
Путь прионов
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Прионные заболевания — феномен, открытый в двадцатом веке, и в нем же начавший играть большую роль: увеличение продолжительности жизни в развитых странах привело к тому, что все больше людей стало доживать до «своего Альцгеймера» или «своего Паркинсона». Природа нейродегенеративных заболеваний продолжает оставаться туманной, и ученые пока исследуют только отдельные их аспекты — например, причину развития именно в старческом возрасте или способность передаваться от одних видов живых существ другим.
«Био/мол/текст»-2012
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Всё началось с того, что в 20 веке учёные заинтересовались природой необычных заболеваний человека и животных: куру, Крейтцфельда-Якоба, скрэпи. Заметное сходство патологии этих болезней дало основание для гипотезы об их инфекционности, что впоследствии было экспериментально подтверждено. Тогда возник вопрос о возбудителе данных заболеваний. Прежде чем был найден ответ, были выявлены необычайные свойства возбудителей: они не размножаются на искусственных питательных средах, устойчивы к высокой температуре, формальдегиду, различным видам излучений, действию нуклеаз. Очистка инфекционного материала и его изучение позволило провозгласить о том, что «во всём виноват» белок, который 30 лет назад получил название прион (от англ. pr[otenacious infect]ion — белковая инфекция).
Так, известные американские учёные — вирусолог и врач Д.К. Гайдушек, раскрывший инфекционную природу прионных болезней, в 1976 г. и биохимик С.Б. Прузинер, который определил прионы и разработал прионную теорию, в 1997 г., — были удостоены Нобелевских премий. Их работы стали импульсом для последующих исследований, благодаря которым были изучены новые виды прионных инфекций. Но, даже несмотря на неугасающий интерес к «прионной теме», образование прионов до сегодняшнего дня остаётся загадкой.
Биологическая сущность прионов
Рисунок 1. Метафора нейродегенеративного поражения мозга — это губка, в которую превращается нервная ткань в результате массовой гибели нейронов.
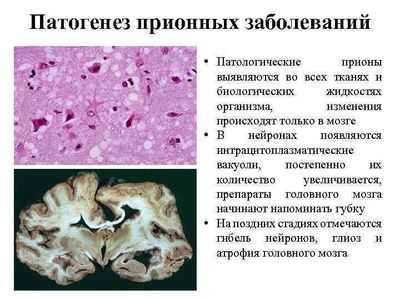
Молекула приона не является чем-то экзотическим: в «нормальной» форме она имеется на поверхности нервных у каждого из нас. При этом мы отлично себя чувствуем, и наши нервные клетки живы и здоровы. Однако это всё до тех пор, пока наш нормальный белок не «переродится» в аномальную форму. А если это случится, то приведёт к ужасающим последствиям: инфекционная форма прионов имеет свойство «склеиваться» с другими молекулами и, мало того, «конвертировать» их в эту же самую форму, вызывая «молекулярную эпидемию». В результате этой полимеризации на нервной клетке появляются токсичные белковые бляшки , и она погибает [1]. На месте погибшей клетки образуется пустота — вакуоль, заполненная жидкостью. С течением времени будет исчезать один нейрон за другим, а в мозге — образовываться всё больше «дыр», пока, наконец, мозг не превратится в губку (рис. 1), за чем неминуемо последует смерть.
Существует упрощенное представление, что полимеризованные прионные фибриллы «протыкают» нейрон, что вызывает его гибель. На самом деле это не совсем так: предшествующие фибриллярной стадии сферические агрегаты прионов также обладают токсичностью (по крайней мере, для болезни Альцгеймера): «Альцгеймеровский нейротоксин: ядовиты не только фибриллы». — Ред.
Но как может нормальный природный белок (обозначается PrP C ) вдруг стать патологическим (PrP Sc ; Sc — от слова «scrapie»)? Что должно произойти? Как и в случае «обычной» инфекции, для такой трансформации необходима встреча с молекулой инфекционного приона. Существуют два пути передачи этой молекулы: наследственный (за счёт мутаций в гене, кодирующего белок) и инфекционный. То есть внедрение приона может произойти неожиданно — например, при употреблении в пищу недостаточно хорошо прожаренного или сваренного мяса (в котором должна присутствовать форма PrP Sc ), при переливании крови, при трансплантации органов и тканей, при введении гормонов гипофиза животного происхождения.
И тогда происходит удивительное событие: нормальные молекулы белка, контактируя с патологическими, сами превращаются в них, изменяя свою пространственную структуру (механизм трансформации остаётся загадкой и по сей день) [1]. Таким образом прион, как самый настоящий инфекционный агент, заражает нормальные молекулы, запуская цепную реакцию, разрушительную для клетки.
Некоторые сведения о прионах
- прионный белок включает 254 аминокислотных остатка и «весит» 33–35 килодальтон [2];
- ген, кодирующий белок PrP, найден у человека, млекопитающих и птиц [1];
- для полного уничтожения прионного белка нужна температура не менее 1000 градусов [1]!
- возможно, прионы принимают участие в межклеточном узнавании и клеточной активации [3];
- не исключено, что функцией прионов является подавление возрастных процессов [3];
- при развитии клинических проявлений прионных заболеваний нет ни признаков воспаления, ни изменений в крови;
- предполагается, что прионы участвуют в развитии шизофрении и миопатии;
- механизм действия прионов и их превращения из нормальной формы в патологическую остаётся неясным.
Условия возникновения заболеваний
Условия возникновения прионовых болезней уникальны. Они могут формироваться по трём сценариям: как инфекционные, спорадические и наследственные поражения. В последнем варианте главную роль играет генетическая предрасположенность [2].
Знаменитый исследователь прионов Стэнли Прузинер (Stanley Prusiner) выделяет две поразительные особенности, присущие таким нейродегенеративным заболеваниям, как болезнь Крейтцфельда-Якоба, болезнь Альцгеймера и болезнь Паркинсона. Первая заключается в том, что более 80% случаев заболевания — спорадические (то есть, случайные, возникающие «сами собой»). Вторая: несмотря на то, что большое количество мутантных белков, специфичных к определённой болезни, экспрессируется в процессе зародышевого развития, формы наследования этих нейродегенеративных заболеваний проявляются позже. Это предполагает, что некоторые процессы происходят во время старения, которое «дает волю» болезнетворным белкам [5]. Более 20 лет назад автор утверждал, что данный процесс включает случайный рефолдинг (пересворачивание) белка в неправильно свёрнутый, что соответствует переходу в инфекционное состояние — прион.
Интересные факты насчет болезни Альцгеймера: ее вероятность может повышаться вследствие хронического недосыпания («Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска»), а сам альцгеймеровский нейропептид (β-амилоид Aβ) может быть частью системы врожденного иммунитета («Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета»). — Ред.
В последнее десятилетие интерес к этой теме возобновился в связи с возможностью развития диагностики и эффективной терапии [5]. Появилось множество различных объяснений для возрастных нейродегенеративных болезней, — например, окислительная модификация ДНК, липидов и/или белков; соматические мутации; измененный врождённый иммунитет; экзогенные токсины; несоответствия ДНК—РНК; нарушение работы шаперонов; отсутствие одного из аллелей гена [5]. Альтернативным комплексным разъяснением служит то, что различные группы белков могут формировать прионы. Несмотря на то, что небольшое количество прионов может быть удалено посредством путей белковой деградации, их чрезмерное накопление с течением времени позволяет прионам самостоятельно распространяться в организме (рис. 2), что приводит к нарушению деятельности центральной нервной системы [5].
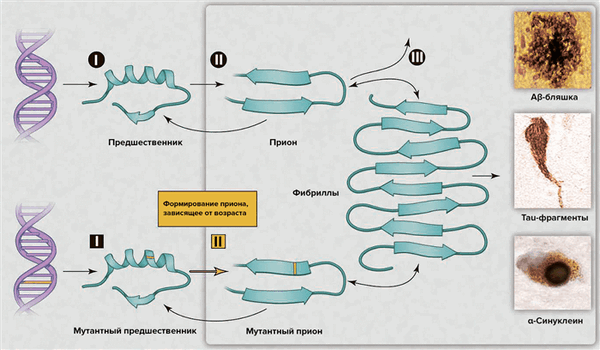
Рисунок 2. Процессы нейродегенерации, вызванной прионами. Сверху: накопление «нормального» прионного белка повышает его вероятность перехода в токсичную конформацию, которая описывается бóльшим содержанием β-структуры. Прионы наиболее патогенны в форме олигомеров; после образования фибрилл токсичность снижается. В зависимости от того, о каком конкретно прионном белке идет речь, в патологическом состоянии он может образовывать бляшки, клубки или тельца включения. Возможные пути лекарственного вмешательства: (I) снижение концентрации «нормального» белка-предшественника; (II) ингибирование образования прионной формы; (III) уничтожение токсичных агрегатов. Снизу: Наследственная старческая нейродегенерация объясняется двумя событиями: наличием мутантной формы предшественника и образованием из него приона, готового к олиго- и полимеризации с образованием токсичных форм.
Группы риска прионных заболеваний
Вот кого прионные заболевания могут настичь с наибольшей вероятностью:
- работники пищевой промышленности;
- ветеринары;
- патологоанатомы;
- хирурги;
- пациенты трансплантолога;
- каннибалы;
- лица, в семье которых были замечены синдромы Герстманна—Штрейслера—Шейнклера или фатальной инсомнии.
Лабораторная диагностика и лечение
Диагностика базируется на внутримозговом заражении мышат или хомяков, у которых медленно (до 150 дней) развивается соответствующее заболевание, если пациент был болен [2]. Часто проводится гистологическое исследование головного мозга погибших животных [2].
К сожалению, до настоящего времени еще не разработаны эффективные методы лечения прионовых болезней, хотя попытки предотвратить конформационный переход нормального белка в аномальный производятся. Поэтому самым надёжным способом предупреждения развития инфекционных форм является профилактика [2].
Особенно актуальным становится решение «прионного вопроса» в связи с нарастающей угрозой возникновения эпидемии через инвазивные медицинские операции и даже при приёме лекарственных средств.
Перспективы
По-видимому, интерес к прионам не угаснет до тех пор, пока предположения на их счёт полностью не подтвердятся и не будут найдены эффективные способы лечения прионных заболеваний. В статье [6] говорится о необходимости современного исследования, которое требует тщательного рассмотрения чужеродных прионов в экстраневрональных тканях.
В качестве модельных объектов авторы использовали мышей: две линии, которые трансгенно экспрессировали овечий прионный белок, и одну линию, которая экспрессировала человеческий прионный белок (рис. 3). Задачей было сравнить эффективность межвидовой передачи инфекции посредством тканей мозга и селезёнки. Внутримозговое заражение чужеродным прионным белком выражалось в отсутствии или небольшом количестве инфекционного агента в мозгах этих мышей. Однако инфекционные чужеродные прионы обнаруживались в селезёнке на более ранних этапах заражения в сравнении с моментом, когда были использованы нейротропные прионы, тем самым определяя, что лимфатическая ткань может быть более пермиссивной к распространению чужеродных прионов по сравнению с мозгом.
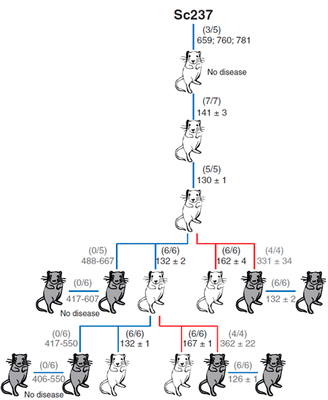
Рисунок 3. Способность приона хомяков Sc237 заражать и передаваться при введении в мозг или селезенку трансгенным мышам, имеющим прионный белок PrP овцы (tg338; белые мыши) или человека (tg7; серые мыши). Число заболевших/инъецированных мышей показано в скобках; ниже приведено среднее время жизни (в днях).
Чем вызвана эта предпочтительная репликация прионов в лимфатических тканях, пока неизвестно. Однако полученные данные показывают, что человек может быть более чувствительным к чужеродным прионам, чем предполагалось ранее на основании присутствия прионов в мозгу, и по этой причине бессимптомный переносчик прионной болезни может быть не распознан. Это ещё раз подтверждает, что такая могущественная биомолекула как прион таит в себе немало загадок, раскрытие которых, возможно, поможет в понимании ряда неразрешимых проблем человечества.
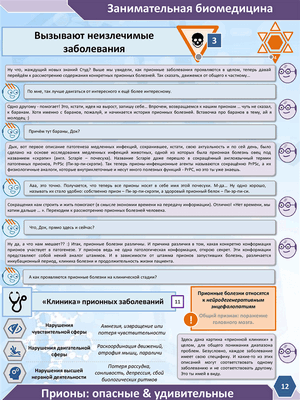
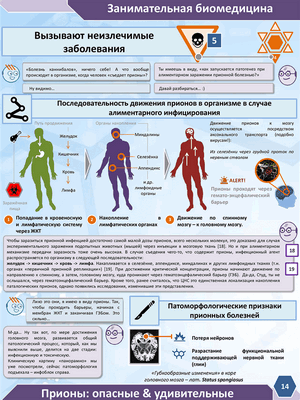
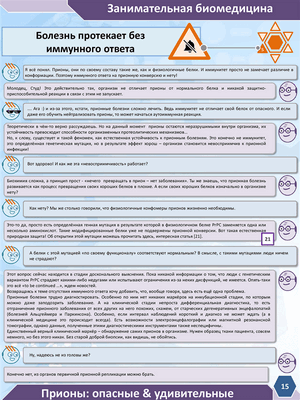
Прионы: опасные и удивительные

Обзор
Статья на конкурс «био/мол/текст»: Тема прионов в научпопе и учебной литературе сегодня, с одной стороны, уже неплохо освещена и проработана, с другой стороны — видится насущная необходимость в разработках, систематизирующих имеющиеся по ней знания и представляющих их широкому кругу читателей в увлекательной форме.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Наглядно о ненаглядном» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
Мы постарались опереться на корпус уже известного знания о прионах, учтя последние результаты экспериментов и аналитической работы в этой области.
Персонажи журнала «Занимательная биомедицина» Студ и Док приглашают Вас вместе с ними окунуться в увлекательный мир науки и поговорить об опасных и удивительных прионах.
Чтобы увидеть рисунок в полном размере, нажмите на него.
Журнал одним файлом доступен по ссылке: «Занимательная биомедицина».

















Литература
Комментарии
Использование материалов сайта разрешено только при наличии активной ссылки на источник. Все права на изображения и тексты принадлежат их авторам.
Прионные болезни нервной системы: как замедлить течение дегенеративного заболевания?
Прионные болезни – трансмиссивные спонгиоформные энцефалопатии (ТСЭ) – это относительно новая группа дегенеративных заболеваний ЦНС. Расстройства характеризуются хроническим необычным взаимодействием иммунной системы и предполагаемого этиологического фактора – белка приона.
Он на периферическом пути болезни размножается в эндоретулярной системе, откуда переходит в ЦНС (головной и спинной мозг), где он вызывают васкуляризацию нейроцитов, глиальных клеток, спонгиоматозную реконструкцию нейропилуса, вымирание и уменьшение количества нейрональных клеток, глиоз без значительного вовлечения воспаления.
Прион — убийца нейрона
Прион, также известный в микробиологии как инфекционный PrP Sc , – это профессиональный термин, описывающий дефектную форму протеина, часто встречающегося в тканях мозга млекопитающих, способствующего долгосрочному функционированию памяти.
Развитие прионной болезни в Википедии (Wikipedia, eng.) описывается так: «…Эти контагиозные молекулы ответственны за возникновение трансмиссивных спонгиоформных энцефалопатий или прионопатий. Их центральные проявления – мозжечковые расстройства и чрезвычайно быстрое слабоумие».
Прионы убивают нейроны очень быстро, что провоцирует стремительное развитие дегенеративных заболеваний.
Согласно теории, речь идет об источнике многих нарушений ЦНС животных (включая человека). Эти белки играют роль в наследственных изменениях и эволюции.
Один из регуляторных факторов прионопреобразования – шапероны, функция которых заключается в чистке клеток от патогенных белков. Как шапероны, так и прионы относятся к группе клеточных протеинов.
Теории и гипотезы

Теория, объясняющая, почему прионы убивают нейроны, была сформулирована профессором С. Б. Прусинером в 1982 г. Он также впервые использовал слово «прион» (первоначально предназначалось использование обозначения «проин», как сочетания слов «proteinaceous» и «infectious», но в измененном состоянии оно звучало лучше).
Теорию прионов, как патогенных белков, Прусинер сформулировал в связи с поиском возбудителя расстройства Крейтцфельда-Якоба. Обнаруженный ним агент являлся чем-то новым. До 1982 г. считалось, что инфекционные заболевания могут вызывать только инфекционные организмы, содержащие нуклеиновую кислоту, несущую генетическую информацию. Но строение белка не содержит нуклеиновой кислоты. Это белок, размножающийся, изменяя аналогичные белки в организме. В 1997 г. С. Б. Прусинер получил Нобелевскую премию в этой области.
Патогенные белки прионы имеют одинаковую первичную структуру (аминокислотную последовательность), но различаются по своей конформационной конфигурации. В то время как дикий PrP с имеет выраженное преобладание α-геликса и около 5% β-листа, патогенный PrP Sc (Sc – scrapie) имеет долю β-листа до 40%. Причины аберрантных свойств прионов PrP Sc все еще рассматриваются. Сегодня есть несколько гипотез.
- Вирусная гипотеза объясняет воздействие прионов вирусологией. Предполагается участие РНК-вирусов в трансмиссивных губчатых энцефалопатиях. Как вироиды, так и прионы – мелкие инфекционные патогены; следовательно, результат воздействия вируса – прион инфекционной природы.
- Мультикомпонентная гипотеза. Предполагается, что для образования инфекционных белков, как новых возбудителей болезней необходима связь с полианионами и липидами.
- Отравление тяжелыми металлами. Интоксикация вызывает развитие инфекции при недостатке или избытке в организме меди (для здорового протеина необходимо оптимальное количество меди).
В чем заключается токсичность белка для нейрона?
После появления инфекционного протеина он может «запечатлеть» свою конформацию в здоровые нейроны. Токсические протеины могут убивать митохондрии в нейронах, распространяя болезнь на ткани.
Патогенные белки чрезвычайно устойчивы к физическим и химическим воздействиям, что приводит к трудностям при стерилизации (были предприняты попытки сжигания головного мозга у пораженных животных при 600°C, пеплом впоследствии были заражены примерно 1/3 животных). В соответствии с тем, какие метаболические процессы нарушают прионы в нейроне, наиболее инфекционные – ткани глаза, головного и спинного мозга.
Факторы риска развития инфекций
Фактор риска заболеваний с генетической точки зрения – наличие определенной последовательности оснований в определенном месте гена, кодирующего белок.
Высокий риск формирования инфекционных прионов и прионных болезней представляют операции с загрязнением тканей и трансплантацией от пациента с присутствующей инфекцией.
Недоказанный риск – потребление тканей больного животного. Здесь важен фактор токсичности приона, его свойства выживать при воздействии температуры, в несколько раз превышающей температуру кипения воды. Животноводство без потребления продуктов не является рисковым.
Наиболее опасные (заразные) из пораженного организма – мозг (ЦНС), мозговые оболочки, роговица (глаз), кровь, лимфатические органы. Мышцы и другие органы представляет намного меньший риск, но не исключают его.
Характеристика инфекций
Заболевания вызываются возбудителями, не содержащими нуклеиновой кислоты. Они могут быть спорадическими, генетически обусловленными, инфекционными (даже ятрогенными). Присутствие дефектных белков вызывает расстройства, обычно называемые спонгиоформными энцефалопатиями. Это дегенеративные нарушения нервной системы, при которых мозг постепенно приобретает губчатый вид из-за миниатюрных отверстий, ввиду того, что прионы убивают нейроны.
Все инфекции неизлечимы и смертельны. Сегодня проводятся исследования и тестирования, направленные на изучение методов замедления течения прионной болезни.
Отдельные нозологические единицы
Прионные болезни человека видоспецифичные. В основном они распространяются только среди особей одного вида. Но учеными была продемонстрирована межвидовая передача (преодоление межвидового барьера): это произошло у скрепи овец с ее передачей коровам (коровье бешенство). Передача заболевания от животного к человеку, несмотря на многие подозрения, не была продемонстрирована.
Ряд заболеваний имеет наследственное происхождение, часть является инфекционной. Иногда болезнь возникает неожиданно, без возможности профилактики.
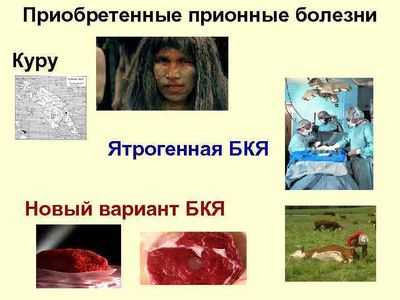
Болезнь существовала только в Папуа-Новой Гвинее в племенах людоедов, потреблявших мозги мертвых. Она проявляется тремором («куру» означает «тремор»), нарушениями речи, равновесия (атаксия). Через несколько месяцев наступает смерть. После остановки каннибализма, заболевание куру исчезло.
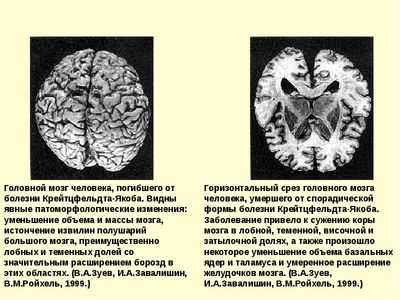
Болезнь Крейцфельдта-Якоба (Creutzfeldt-Jakob disease)
Это редкое расстройство, поражающее пожилых людей (чаще всего 50-70-летних). Его течение относительно быстрое, смерть наступает через несколько месяцев (до года) от проявления первых симптомов. Нейроны быстро гибнут, развивается прогрессивная деменция, не имеющая известного лечения. Существует некоторая наследственная предрасположенность к этому заболеванию:
- Спорадическая форма. Заболеваемость составляет 1-2/1000000. Проблемы начинаются примерно в возрасте 65 лет. Расстройство возникает в виде острого прогрессирования деменции (в течение 2-3 месяцев), атаксии, миоклонуса. Возможностей, как продлить жизнь нейронам при этом прионом заболевании, нет, пациент умирает через 5-12 месяцев после появления первых симптомов.
- Ятрогенная форма. Возникала у пациентов, получавших гормон роста человека из трупных гипофизов (сегодня он готовится рекомбинантно), пересадкой твердых оболочек, перикарда, роговицы. Существует риск нейрохирургической передачи. Заражение возможно также при переливании.
- Семейная форма. Это генетическая форма с мутацией в гене PRNP и психоневрологической симптоматикой.
- Новый вариант. Характеризуется психиатрическими симптомами (тревога, депрессия, изменения в поведении), прогрессирующим мозжечковым синдромом, миоклонусом, другими неврологическими симптомами. В отличие от спорадической формы, новый вариант типичен медленным развитием вирусной инфекции; прионная болезнь затрагивает более молодые возрастные группы. Передача происходит алиментарным путем (при потреблении мяса пораженных животных). Инкубационный период – более 10 лет. В мире на сегодняшний день погибло около 200 человек.
- Детский вариант болезни Крейцфельдта-Якоба – болезнь Альпера. Имеет те же проявления, что и заболевание у взрослых; в дополнение сопровождается стеатозом печени.
Болезнь Герстманна-Штрюсслера-Шейнкера (Gerstmann-Sträussler-Scheinker disease)
Болезнь Герстманна-Штрюсслера-Шейнкера – это очень редкое аутосомно-доминантное наследственное заболевание, начинающееся в 3-4-ой декаде жизни. Проявляется медленным замедлением работы нейронов прионами, прогрессирующей дисфункцией мозжечка и спинного мозга. Признаки:
- атаксия;
- пирамидные симптомы;
- дизартрия;
- дисфагия;
- постепенно развивающаяся деменция.
В начале расстройства могут возникнуть апатия, депрессия. Средняя продолжительность заболевания – около 4-5 лет. Было описано несколько мутаций PRNP, связанных с этим расстройством.
Фатальная фамильярная инсомния (Fatal familiar insomnia)
Это очень редкое заболевание, приводящее к дегенерации ядра таламуса. Основные симптомы:
Дистрофия мозга по воздействием вируса приона
Развиваются когнитивные нарушения, появляются спутанность сознания и галлюцинации. В терминальной стадии развивается полная инсомния. Пациенты умирают в течение 3 лет от проявления первых признаков. Заболевание связано с мутацией PRNP D178N-129M. Существует также спорадическая форма расстройства.
Заболевания животных
Риск заболеваний животных для людей очень спекулятивен (лучше всего проблематику характеризует связь BSE и нового варианта расстройства Крейцфельдта-Якобса). У животных расстройства проявляются агрессивностью, нарушением двигательных способностей:
- cпонгиоформная энцефалопатия крупного рогатого скота (Bovine spongiform encephalopathy – BSE);
- скрепи;
- хроническая болезнь истощения (Chronic wasting disease – CWD);
- войлочная спонгиоформная энцефалопатия;
- трансмиссивная энцефалопатия.
Диагностика
Диагностика прионных болезней основана на обнаружении когнитивных расстройств, их прогрессирующем развитии, и уже на промежуточной стадии развития – не специфических нарушений ЭЭГ, постепенно переходящих на специфические паттерны (burst suppression pattern) с миоклониями в клинической и ЭМГ картине, эпилептическими приступами.
В спинномозговой жидкости присутствует только белок 14-3-3.
При спорадической форме болезни Крейцфельдта-Якобса МРТ на взвешенном изображении Т2 демонстрирует гиперинтенсивность в базальном и хвостовом ядре. При новом варианте заболевания она присутствует в пульвинарном таламусе, имеет форму клюшки.
Тестирование ДНК поможет выявить генетические и семейные формы расстройств, что означает выявление мутации E200K.
Подтверждением клинико-диагностического заключения являются иммуногистохимическое и нейрогистологическое исследование ткани головного мозга.
- типичная нейроцитарная вакуолизация;
- спонгиоматозная дегенерация нейропилы;
- потеря нервных клеток;
- астроглиоз;
- наличия скрепи-ассоциированных фибрилл в пораженном мозге.
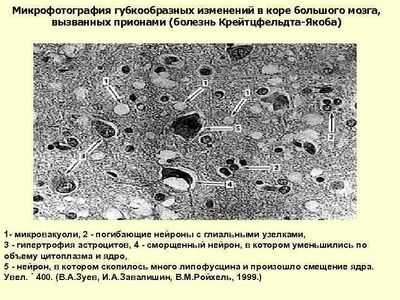
Как замедлить течение прионной болезни
До недавнего времени было сложно замедлить прионную болезнь, не говоря о ее излечении.
Современная нейрохирургия может облегчить дегенеративные осложнения путем пересадки нейронов при прионом заболевании.
Несколько лет журнал «Nature» сообщил о разработке антител против прионов в Англии командой ученых во главе с Симоной Хоук (Imperial College). В тестах на зараженных мышах, грызуны, получившие антитела, были вылечены уже через месяц после заражения.
Врачи намерены использовать эту возможность очистить нейроны от патогенных протеинов для лечения нового варианта болезни Крейтцфельда-Якобса у людей. Дальнейшие исследования должны помочь улучшить лекарства, которые смогут очистить мозг и его микроглии от прионов.
Недавно М. Пфайфер и несколько других немецких ученых обнаружили и подтвердили способ, позволяющий очистить мозг от прионов. Они доказали, что РНК-интерференция может успешно лечить заболевания путем удаления из РНК-клетки части, ответственной за выработку патогенных белков. Это предотвратило их мутацию в опасные протеины.
Подобный метод – воздействие искусственно синтезируемых праймеров (олигонуклеотидов) против прионов. Как и РНК-интерференция, конструирование праймеров находится на стадии исследования.
Теоретически перспективным в лечении болезней может быть пептид PrP13, аналогичный структурному продукту, встречающемуся при этих заболеваниях. Вещество нацелено на ген PRNP, что должно повлиять на превращение PrPC в PrPres. Последняя названная патогенная молекула изменяется в структуру, подобную PrPC. Вещество используется под аббревиатурой PrP13, а его исследования на животных смогли продлить выживаемость на 50-300%.
Профилактика
В вопросе профилактики важно учитывать причины, по которой нейроны погибают при прионном заболевании. Предотвращение спорадических и наследственных форм инфекций не существует. Экспериментально ученые пытаются найти вещество, стабилизирующее белок в физиологической конформации, чтобы предотвратить его переход к конформационной патологии.
Для профилактики переносимых форм заболевания важно избегать всех влияющих факторов риска.
Читайте также:
