Линкозамиды, оксазолидиноны и стрептограмины
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Линкозамиды (син.: линкомицины) — группа антибиотиков, в которую входят природный антибиотик линкомицин и его полусинтетический аналог клиндамицин. Обладают бактериостатическими или бактерицидными свойствами в зависимости от концентрации в организме и чувствительности микроорганизмов.
Содержание
Механизм действия
Действие обусловлено подавлением в бактериальных клетках синтеза белка. Связывает нуклеотидную субъединицу 23S большой субъединицы бактериальной рибосомы 50S и приводит к преждевременной диссоциации комплекса пептидил-тРНК с рибосомы. [1]
Используется при инфекциях, вызванных грамположительными кокками (преимущественно в качестве препаратов второго ряда) и неспорообразующей анаэробной флорой. Их обычно сочетают с антибиотиками, влияющими на грамотрицательную флору (например, аминогликозидами).
Линкозамиды устойчивы к действию соляной кислоты желудочного сока. После приема внутрь быстро всасываются. Побочные эффекты — аллергические реакции, в редких случаях — псевдомембранозный колит.
Фармакокинетика
Линкомицин плохо всасывается из ЖКТ, биодоступность при приёме до еды составляет 30 %, после еды 5 %. Биодоступность клиндамицина значительно выше (90 %) и не зависит от приёма пищи.
Высокие концентрации линкозамидов отмечают в мокроте, жёлчи, плевральной жидкости, костях и суставах. Препараты плохо проникают через ГЭБ, метаболизируются в печени, выводятся преимущественно через ЖКТ. Период полувыведения линкомицина равен 4—6 ч., клиндамицина 2,5—3 ч., увеличивается при тяжёлых нарушениях функции печени.
Напишите отзыв о статье "Линкозамиды"
Примечания
Ссылки
Отрывок, характеризующий Линкозамиды
– День отъездила, хоть мужчине в пору и как ни в чем не бывало!
Скоро после дядюшки отворила дверь, по звуку ног очевидно босая девка, и в дверь с большим уставленным подносом в руках вошла толстая, румяная, красивая женщина лет 40, с двойным подбородком, и полными, румяными губами. Она, с гостеприимной представительностью и привлекательностью в глазах и каждом движеньи, оглянула гостей и с ласковой улыбкой почтительно поклонилась им. Несмотря на толщину больше чем обыкновенную, заставлявшую ее выставлять вперед грудь и живот и назад держать голову, женщина эта (экономка дядюшки) ступала чрезвычайно легко. Она подошла к столу, поставила поднос и ловко своими белыми, пухлыми руками сняла и расставила по столу бутылки, закуски и угощенья. Окончив это она отошла и с улыбкой на лице стала у двери. – «Вот она и я! Теперь понимаешь дядюшку?» сказало Ростову ее появление. Как не понимать: не только Ростов, но и Наташа поняла дядюшку и значение нахмуренных бровей, и счастливой, самодовольной улыбки, которая чуть морщила его губы в то время, как входила Анисья Федоровна. На подносе были травник, наливки, грибки, лепешечки черной муки на юраге, сотовой мед, мед вареный и шипучий, яблоки, орехи сырые и каленые и орехи в меду. Потом принесено было Анисьей Федоровной и варенье на меду и на сахаре, и ветчина, и курица, только что зажаренная.
Всё это было хозяйства, сбора и варенья Анисьи Федоровны. Всё это и пахло и отзывалось и имело вкус Анисьи Федоровны. Всё отзывалось сочностью, чистотой, белизной и приятной улыбкой.
– Покушайте, барышня графинюшка, – приговаривала она, подавая Наташе то то, то другое. Наташа ела все, и ей показалось, что подобных лепешек на юраге, с таким букетом варений, на меду орехов и такой курицы никогда она нигде не видала и не едала. Анисья Федоровна вышла. Ростов с дядюшкой, запивая ужин вишневой наливкой, разговаривали о прошедшей и о будущей охоте, о Ругае и Илагинских собаках. Наташа с блестящими глазами прямо сидела на диване, слушая их. Несколько раз она пыталась разбудить Петю, чтобы дать ему поесть чего нибудь, но он говорил что то непонятное, очевидно не просыпаясь. Наташе так весело было на душе, так хорошо в этой новой для нее обстановке, что она только боялась, что слишком скоро за ней приедут дрожки. После наступившего случайно молчания, как это почти всегда бывает у людей в первый раз принимающих в своем доме своих знакомых, дядюшка сказал, отвечая на мысль, которая была у его гостей:
Макролиды, линкозамиды и стрептограмины Макролиды
Азитромицин, джозамицин, кларитромицин, мидекамицин, олеандомицин, рокситромицин, спирамицин, эритромицин.
Линкозамиды
Стрептограмины
Указанные группы АМП объединяют в группу MLS-антибиотиков. Они имеют одинаковый механизм действия: обратимо связываются с различными доменами каталитического пептидил-трансферазного центра 50S субъединицы рибосом. В результате этого нарушаются процессы транслокации/транспептидации и преждевременно отщепляется растущая т-РНК-полипептидная цепочка, что приводит к нарушению сборки белковой молекулы. Эти антибиотики в отношении большинства микроорганизмов обладают бактериостатическим действием, однако в зависимости от концентрации могут оказывать бактерицидное действие на стафилококки, стрептококки и анаэробы. Обладают умеренно выраженным постантибиотическим эффектом.
Гликопептиды
Проявляют несколько механизмов антимикробного действия, нарушая:
Второй этап синтеза клеточной стенки бактерий, блокируя образование пептидогликана (гликопептиды и ß-лактамы воздействуют на разные этапы синтеза пептидогликана);
Структуру и функцию цитоплазматической мембраны;
Синтез РНК на уровне рибосом.
На большинство микроорганизмов гликопептиды действуют бактерицидно; бактериостатически действуют на энтерококки, коагулазонегативные стафилококки и на некоторые стрептококки группы Viridans. Обладают незначительным ПАЭ.
Клиническое значение ПАЭ заключается во влиянии на режим дозирования АМП.
Оксазолидиноны
Механизм их действия связан с ингибированием синтеза белка в рибосомах бактериальной клетки. В отличие от других антибиотиков, ингибирующих синтез белка, они действуют на ранних этапах трансляции (необратимое связывание с 30S и 50S субъединиц рибосом) в результате чего нарушаются процесс образования 70S-комплекса и формирование пептидной цепи. В результате уникального механизма действия не отмечается перекрестной устойчивости микроорганизмов к линезолиду и другим антибиотикам, действующим на рибосомы (макролиды, линкозамиды, стрептограмины, аминогликозиды, тетрациклины и хлорамфеникол).
Тетрациклины
Доксициклин, окситетрациклин, тетрациклин.
Тетрациклины обладают бактериостатическим действием, подавляют синтез белка в бактериальной клетке на уровне 30S субъединицы рибосомы.
Представители данного семейства характеризуются общим спектром и механизмом антимикробного действия, полной перекрёстной устойчивостью, близкими фармакологическими характеристиками. Различия касаются некоторых физико-химических свойств, степени антибактериального эффекта, особенностей всасывания, распределения, метаболизма в макроорганизме и переносимости.
Хинолы и фторхинолы
Оксолиновая кислота, налидиксиновая кислота, пипемидоновая кислота;
Фторхинолины: гемифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, пефлоксацин, спарфлоксацин, ципрофлоксацин.
Хинолоны являются производными нафтиридина и хинолина. Фторхинолоны синтезированы путем введения в молекулу хинолона нафтиридина одного, двух или трех атомов фтора, что привело к созданию группы ЛС с широким антимикробным спектром действия, с хорошими фармакокинетическими характеристиками, относительно низкой токсичностью.
Хинолоны и фторхинолоны обладают бактерицидным действием, ингибируют ключевой фермент бактерий – ДНК-гиразы (топоизомеразы II), определяющий процесс биосинтеза ДНК и деления клетки, и топоизомеразу IV, нарушая тем самым синтез ДНК микробной клетки. Некоторые фторхинолоны – ломефлоксацин и моксифлоксацин – ингибируют топоизомеразы II и IV.
Каждый из ферментов состоит из четырех субъединиц. ДНК-гираза состоит их двух gyrA и двух gyrB субъединиц (соответствующие гены gyrA и gyrB). Топоизомераза IV – из субъединиц parC и parE (соответствующие гены parC и parE). Гены обоих ферментов локализованы на бактериальной хромосоме.
Поскольку топоизомеразы выполняют несколько различных функций, то для подавления жизнедеятельности микробной клетки достаточно ингибировать активность только одного фермента, активность второго может сохраняться. Эта особенность объясняют объясняет тот факт, что для всех хинолонов можно выделить первичную и вторичную мишень действия. Первичной мишенью является тот фермент, к которому данный хинолон проявляет наибольшее сродство.
У G- бактерий наибольшее сродство хинолоны проявляют к ДНК-гиразе, благодаря чему именно этот фермент является первичной мишенью их действия.
У G+ бактерий для большинства хинолонов основной первичной мишенью действия является топоизомераза IV, а для спарфлоксацина и гатифлоксацина – ДНК-гираза. Монофлоксацин и гемифлоксацин, вероятно, обладают приблизительно одинаковым сродством к обоим ферментам. Хинолонов, которые проявляют абсолютно одинаковое сродство к обоим топоизомерам, не существует.
Линкозамиды, оксазолидиноны и стрептограмины
Летом 2019 г. ВОЗ начала глобальную кампанию, призывающую правительства использовать разработанную в 2017 г. классификацию антибиотиков «Access, Watch, Reserve – AWaRe»* в мероприятиях по снижению устойчивости к противомикробным препаратам. Классификация представляет собой инструмент управления антибиотиками на местном, национальном и глобальном уровнях с целью снижения устойчивости.
Классификационная база данных «AWaRe» включает 180 антибиотиков, разделенных на три группы: доступные (Access), поднадзорные (Watch) и резервные (Reserve), с указанием их фармакологических классов, кодов анатомо-терапевтическо-химической классификации (ATC) и статуса в списке основных лекарственных средств ВОЗ.
В базе данных также перечислены те антибиотики, применение которых не рекомендуется ВОЗ, а именно комбинации фиксированных доз нескольких антибиотиков широкого спектра действия, относительно которых отсутствуют научно обоснованные показания к применению или рекомендации в авторитетных международных руководствах.
Группа Access
В эту группу входят противомикробные средства, обладающие активностью в отношении широкого спектра часто выявляемых восприимчивых патогенов и одновременно демонстрирующие более низкий потенциал резистентности, чем антибиотики других групп. Группа Access включает 48 антибиотиков, 19 из которых включены в примерный перечень основных лекарственных средств ВОЗ в качестве вариантов первого или второго эмпирического выбора для лечения определенных инфекционных синдромов (табл. 1).
Группа Watch
В эту группу входят антибиотики с более высоким потенциалом резистентности, а также большинство наиболее приоритетных препаратов среди критически важных противомикробных лекарственных средств для медицины человека и/или антибиотики, которые подвергаются относительно высокому риску развития бактериальной резистентности. Антибиотики в группе «Watch» должны быть приоритетными в качестве ключевых целей программ управления и мониторинга. Группа Watch включает 110 антибиотиков, 11 из которых включены в Примерный перечень основных лекарственных средств ВОЗ в качестве эмпирических вариантов первого или второго выбора для лечения определенных инфекционных синдромов (табл. 2).
Группа Reserve
В эту группу входят антибиотики и их классы, которые следует зарезервировать для лечения подтвержденных или подозреваемых инфекций, вызванных микроорганизмами со множественной лекарственной устойчивостью. Антибиотики в резервной группе следует рассматривать как варианты «последней инстанции», которые должны быть доступны, но их применение следует адаптировать к очень специфическим пациентам и условиям, когда все альтернативы оказались неудачными или не подходят. Этим лекарственным средствам должен быть отдан приоритет в качестве основных целей национальных и международных программ управления, включающих мониторинг и отчетность об использовании для сохранения их эффективности. К группе «Reserve» отнесены 22 антибиотика, входящие в перечень основных лекарственных средств ВОЗ (табл. 3).
Почему ВОЗ разработала AWaRe
Доступ к качественным, безопасным и доступным лекарственным средствам и медицинским изделиям является ключевым вкладом в обеспечение всеобщего охвата услугами здравоохранения и целью «трех миллиардов», установленной в 13-й Общей программе работы ВОЗ (General Programme of Work – GPW). Для мониторинга доступа к основным лекарственным средствам в рамках 13-й GPW существует показатель, основанный на AWaRe, предписывающий, чтобы в структуре потребления стран не менее 60% антибиотиков приходились на группу «Access».
Этот инструмент также может быть принят клиницистами для мониторинга использования антибиотиков и осуществления надзорных мероприятий на местном уровне, а также для разработки рекомендаций по лечению антибиотиками.
Макролиды, азалиды и кетолиды
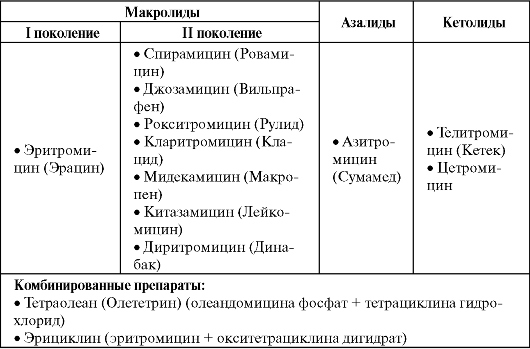
Макролиды, азалиды, кетолиды, линкозамиды и стрептограмины имеют сходный механизм действия, который включает связывание препарата с каталитическим пептидилтрансферазным центром рибосомальной 50S субъединицы, что приводит к нарушению реакции транслокации и транспептидации и, соответственно, прекращению синтеза белка. Кетолиды связываются одновременно с двумя учас-
тками на бактериальной рибосоме, что дает им более высокую, чем у эритромицина, антимикробную активность и способность сохранять ее при резистентности к макролидам, линкозамидам, стрептограминам (MLS-резистентность).
Макролидам присущ бактериостатический тип действия, хотя, в некоторых условиях, определяемых видом микроорганизма и бактериальной нагрузкой, эффект может трансформироваться в бактерицидный. Кроме того, для азитромицина характерно так называемое постантибиотическое действие, проявляющееся подавлением бактериального роста на протяжении 5-7 дней после отмены препарата.
Все антибиотики этой группы обладают заметной противовоспалительной активностью за счет снижения индуцированного микро- организмами высвобождения IL-6 и IL-1, а также NO.
Препараты данной группы (в первую очередь азитромицин и кларитромицин) создают высокие концентрации в макрофагах и нейтрофилах и с ними транспортируются в очаг воспаления.
Спектр действия макролидов изменяется в зависимости от принадлежности к тому или иному поколению (табл. 6.15). Так, для препаратов I поколения он сопоставим с биосинтетическими пенициллинами, но при этом важной особенностью является их активность в отношении внутриклеточных атипичных возбудителей (хламидий, микоплазм, легионелл). Макролиды II поколения и азалиды отличаются более высокой антимикробной активностью (в первую очередь в отношении гемофильной палочки), расширенным спектром действия и улучшенной фармакокинетикой.
Кетолиды при близком к макролидам и азалидам антимикробном спектре действия высокоактивны против эритромицинорези- стентных штаммов кокковых микроорганизмов с MLS-резистентнос- тью, которая достаточно широко распространена. Это отличает кетолиды, например, от рокситромицина и азитромицина, которые в случае MLS-резистентности теряют активность подобно эритромицину. Внутри группы резистентность неперекрестная (т. е. микроорганизмы, резистентные к телитромицину, чувствительны к цетромицину).
Лекарственные взаимодействия макролидов, азалидов и кетолидов представлены в табл. 6.16.
Побочных эффектов, возникающих при применении макролидов, немного. Чаще всего наблюдаются:
- со стороны ЖКТ: тошнота, рвота, диарея, холестатический гепатит, псевдомембранозный колит;
Таблица 6.15. Спектр антибактериальной активности противомикробных средств, используемых при лечении пневмоний
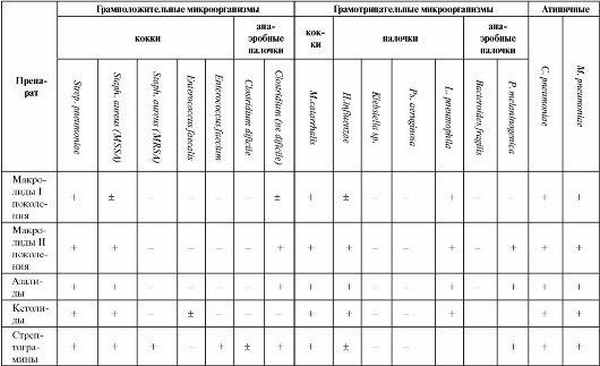
Продолжение табл. 6.15
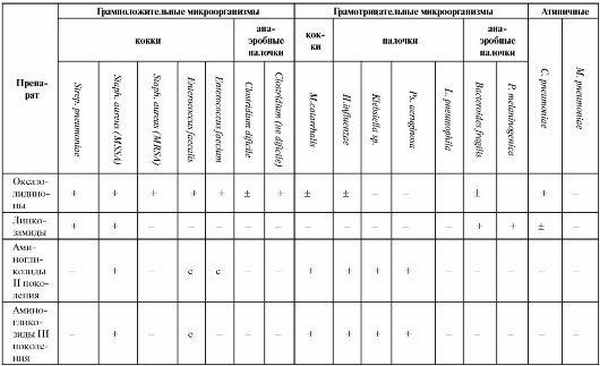
Окончание таблицы 6.15
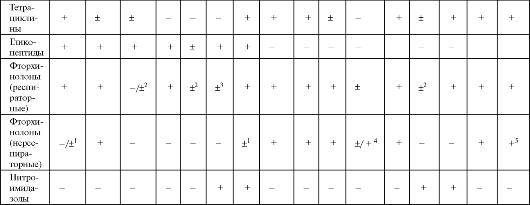
Примечание:С - синергизм с бензилпенициллином, аминопенициллинами, гликопептидами; 1 - офлоксацин, ципрофлоксацин; 2 - моксифлоксацин, гатифлоксацин; 3 - подавляют при смешанных интраабдоминальных инфекциях и инфекциях малого таза; 4 - ципрофлоксацин; 5 - кроме пефлоксацина.
Таблица 6.16. Лекарственные взаимодействия макролидов, азалидов, кетолидов
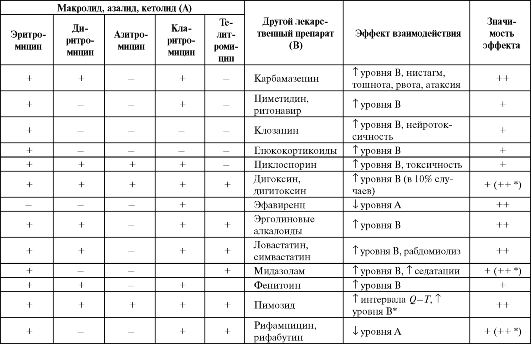
Окончание таблицы 6.16
Примечание:«+» - теоретически возможные; «+» - вероятно значимые; «++» - определенно значимые; * - для телитромицина.
- со стороны сердечно-сосудистой системы: удлинение интервала Q-T, желудочковые тахикардии;
Стрептограмины
Синерцид представляет собой комбинацию двух молекул: стрептограмина А (дальфопристин) и В (квинупристин) в соотношении 30/70. Оба компонента имеют синергичный эффект в подавлении синтеза белка микроорганизмом, связываясь с разными участками 50S субъединицы рибосом. Интересно, что по отдельности эти антибиотики обладают бактериостатическим эффектом, а их комбинация бактерицидна.
Этот препарат активен против большинства грамположительных бактерий и атипичных возбудителей, таких как микоплазмы, хламидии, легионеллы (табл. 6.17). 90% стафилококков чувствительны к си- нерциду, в том числе метициллинрезистентные штаммы. В 100% он активен против пневмококков независимо от их чувствительности к пенициллину. Квинупристин-дальфопристин также активен против Enterococcus faecium, включая ампициллингентамицин- и ванкомицинрезистентные штаммы. Только Enterococcus fecalis обладает устойчивостью к стрептограминам.
Для предупреждения развития резистентности к квинупристиндальфопристину показанием к его применению является только тяже- лая инфекция, вызванная полирезистентными штаммами Enterococcus faecium и Staphylococcus aureus.
Линкозамиды
Спектр действия линкозамидов относительно узкий, с преимущественным влиянием на грамположительную микрофлору (см. табл. 6.15). Особое значение имеет их влияние на стафилококки и анаэробы.
Оба препарата практически не отличаются по антибактериальному спектру, но клиндамицин более активен, лучше проникает в ткани (в том числе в легочную) и имеет меньшее число побочных эффектов. Однако период полувыведения клиндамицина короче, чем у линкомицина, что требует либо его более частого назначения (4 раза в сутки), либо увеличения разовой дозы (до 600 мг), что позволяет использовать его 3 раза в сутки.
Наиболее частыми побочными эффектами препаратов являются диспепсические явления, в редких случаях - развитие псевдомембранозного колита.
Аминогликозиды
I поколение:
II поколение:
III поколение:
Механизм действия аминогликозидов заключается в необратимом связывании со специфическими белками на 30S субъединице рибо- сом, что блокирует инициацию синтеза белка и нарушает считывание информации с иРНК. Это приводит к ошибочному включению некоторых аминокислот в образующийся полипептид и синтезу нефункционального белка. Кроме того, они способны разрушать полисомы и повреждать энергопродуцирующие системы в микроорганизмах и нарушать функцию клеточной мембраны. Тип действия - бактери- цидный с заметным постантибиотическим эффектом.
Аминогликозиды обладают широким спектром действия с преимущественным влиянием на грамотрицательную микрофлору (см. табл. 6.15). Препараты I поколения эффективны в отношении Mycobacterium tuberculosis и поэтому преимущественно используются для лечения ту- беркулеза.
Гентамицин активен при инфекциях, вызванных Pseudomonas aeruginosa, однако уровень резистентности к нему, по некоторым данным, достигает 70%.
Аминогликозиды III поколения имеют спектр действия, сопоставимый с таковым гентамицина, но проявляют несколько боль- шую активность против Pseudomonas aeruginosa и возбудителей рода Enterobacteriacea. К некоторым препаратам (амикацин, тобрамицин) чувствительны Mycobacterium tuberculosis.
В последние годы рекомендуется однократное введение суточной дозы аминогликозидов II-III поколений, что усиливает их бактери-
цидную активность, продолжительность постантибиотического действия, снижает количество побочных эффектов (особенно со стороны почек) и стоимость лечения.
Побочные эффекты включают нефротоксичность, ототоксичность, мышечные блокады и аллергические реакции. По нефро- и ототок- сичности: гентамицин = амикацин >нетилмицин. Препараты противопоказаны при беременности, так как способны приводить к тяжелым нарушениям слуха у плода.
Тетрациклины
Для лечения пневмоний, вызванных атипичными возбудителями, эффективны антибиотики группы тетрациклина, из которых в насто- ящее время по данному показанию применяется только доксициклин. Препарат, связываясь с 30S субъединицей рибосом, нарушает связывание аминоацил-Т-РНК с ацильным центром и препятствует включению аминокислот в строящуюся пептидную цепь. Доксициклин обладает бактериостатическим типом действия и достаточно широким антимикробным спектром (см. табл. 6.15).
Побочные эффекты наблюдаются в первую очередь со стороны пищеварительной системы (тошнота, рвота, боли в животе, диарея, запоры, транзиторное повышение трансаминаз и билирубина). Препараты противопоказаны при беременности, так как оказывают тератогенное действие. У детей может вызывать гипоплазию зубной эмали и изменение ее цвета.
Гликопептиды
• Тейкопланин (Тейкомицин А2).
Гликопептиды являются базовыми препаратами при лечении госпитальных инфекций, вызванных Staphylococcus aureus (в том числе MRSA) и Enterococcus sp. Механизм действия гликопептидов связан с нарушением образования пептидогликана на более ранних этапах, чем у β-лактамов, повреждением мембран микроорганизмов, подавлением синтеза РНК на уровне рибосом. Тип действия бактерицидный. Спектр действия узкий (см. табл. 6.15). Наиболее высокая антибактериальная активность присуща телаванцину, который эффективен в отношении как MRSA Staphylococcus aureus, так и Staphylococcus aureus с промежуточной чувствительностью к гликопептидам (GISA).
Среди побочных эффектов следует отметить нефротоксичность и ототоксичность. Кроме того, препараты являются либераторами гистамина, что может приводить к развитию гипотензии, тахикардии, гиперемии кожного покрова, зуду. Наименьшее число побочных эффектов дает телаванцин.
Оксазолидиноны
Линезолид является первым представителем нового класса антимикробных средств - оксазолидинонов, которые характеризуются уникальным механизмом действия на микробную клетку и отсутстви- ем перекрестной резистентности с другими антибиотиками.
Механизм действия препарата связан с ингибированием синтеза белка в рибосомах бактериальной клетки. В отличие от других антибиотиков, ингибирующих синтез белка, линезолид действует на ран- них этапах трансляции, необратимо связываясь как с 30S, так и с 50S субъединицей рибосом, что нарушает процесс образования 70S комплекса и формирование пептидной цепи. В результате уникального механизма действия не отмечается перекрестной устойчивости микроорганизмов к линезолиду и другим антибиотикам, действующим на рибосомы (макролиды, линкозамиды, стрептограмины, аминогликозиды, тетрациклины и амфениколы).
Линезолид проявляет активность в отношении грамположительных бактерий, в том числе характеризующихся множественной устойчивостью: Staph. aureus (MRSA), Str. pneumoniae (PRP), ванкомицинрезистентных Enterococcus sp. (см. табл. 6.15).
Особенности действия препарата: - выраженная активность против грамположительных бактерий, включая полирезистентные (в том числе ванкомицинрезистентные) штаммы;
- возможность проведения ступенчатой терапии (внутривенно и внутрь) - удобство лечения, лучшая переносимость, реаль- ность ранней выписки и амбулаторного долечивания;
- 100% биодоступность при пероральном приеме;
- лучшее по сравнению с ванкомицином проникновение в ткани;
- лучшая переносимость по сравнению с ванкомицином;
- возможность эффективного применения у тяжелобольных, в том числе с иммунодефицитом.
Большой недостаток - чрезвычайно высокая стоимость лечения препаратом.
Наиболее часто развиваются побочные эффекты со стороны ЖКТ (извращение вкуса, тошнота, рвота, диарея, боли в животе, метеоризм, изменение показателей общего билирубина, трансаминаз, щелочной фосфатазы) и системы кроветворения (анемия, тромбоцитопения, лейкопения, панцитопения).
Фторхинолоны

Фторхинолоны (фторхинолонкарбоновые кислоты) являются одним из наиболее быстро развиваемых классов современных синтети- ческих противомикробных средств. Они являются препаратами широкого спектра действия, активными в отношении грамположительных и грамотрицательных, аэробных и анаэробных микроорганизмов. Грибы, вирусы, трепонемы, большинствопростейшихустойчивы к действию фторхинолонов. Однако при всем сходстве антибактериального спектра существуют различия в чувствительности микроорганизмов как к представителям разных поколений фторхинолонов, так и к тем или иным препаратам внутри поколения.
Линкозамиды - Lincosamides
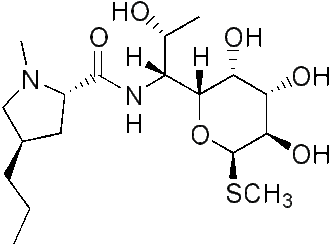
Линкозамиды состоят из пирролидин кольцо связано с пираноза фрагмент (метилтио-линкозамид) через амидную связь. [2] [3] Гидролиз линкозамидов, в частности линкомицина, расщепляет молекулу на строительные блоки, состоящие из сахарных и пролиновых фрагментов. Оба этих производных, наоборот, могут быть рекомбинированы в само лекарство или производное. [4]
Синтез
Биосинтез линкозамидов происходит двухфазным путем, при котором пропилпролин и метилтиолинкозамид независимо синтезируются непосредственно перед конденсацией двух молекул-предшественников. Конденсация карбоксильной группы пропилпролина с аминогруппой метилтиолинкозамида через амидную связь образует N-деметиллинкомицин. N-Деметиллинкомицин впоследствии метилированный через S-аденозилметионин для производства линкомицина А. [5] [6]
Линкомицин естественным образом продуцируется бактериями, а именно Streptomyces lincolnensis, S. roseolus, и S. caelestis. [7] Клиндамицин выводится через (7S)-хлор -замена из (7р)-гидроксил группа линкомицина. [8] Линкомицин в основном выделяют из ферментации Streptomyces lincolnensis, в то время как клиндамицин получают полусинтетическим способом. [9] Хотя было приготовлено несколько сотен синтетических и полусинтетических производных линкозамидов, в клинической практике используются только линкомицин А и клиндамицин из-за проблем с токсичностью и низкой биологической активностью других линкозамидных антибиотиков. [9]
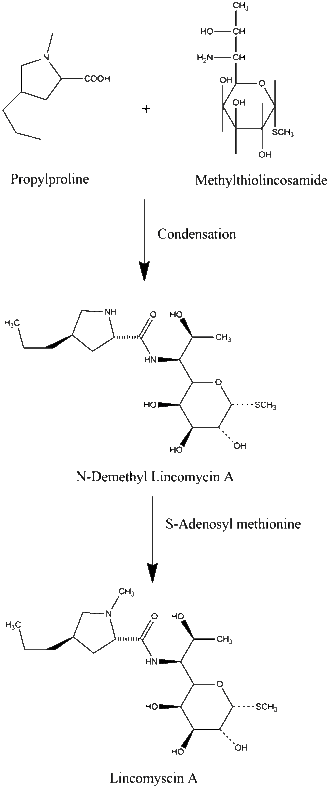
Химический синтез линкомицина A. Пропилпролин и метилтиолинкозамид соединяются посредством реакции конденсации. Эта реакция образует N-деметиллинкомицин А, который метилирован через S-аденозилметионин с образованием линкомицина А.
Механизм действия
Линкозамиды предотвращают размножение бактерий в бактериостатический механизм препятствует синтезу белков.
В механизме, аналогичном макролиды и стрептограмин B, линкозамиды связываются близко к центру пептидилтрансферазы на 23S часть 50S субъединица бактериального рибосомы. Рентгеновские структуры с высоким разрешением клиндамицина и рибосомных субъединиц бактерии ранее показали исключительное связывание с сегментом 23S полости пептидилтрансферазы. [10] Связывание опосредуется сахарной составляющей микарозы, которая имеет частично перекрывающиеся субстраты с пептидилтрансфераза. Распространяясь на центр пептидилтрансферазы, линкозамиды вызывают преждевременную диссоциацию пептидил-тРНК, содержащих два, три или четыре аминокислотных остатка. В этом случае пептиды будут расти до определенного момента, пока стерическое препятствие подавляет активность пептидилтрансферазы. [11] Линкозамиды не влияют на синтез белка в клетках человека (или других эукариот) из-за структурных различий между прокариотическими и эукариотическими рибосомами. Линкозамиды используются против Грамположительные бактерии поскольку они не могут пройти через порины из Грамотрицательные бактерии.
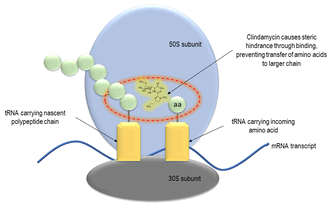
Клиндамицин, обычно используемый линкозамид, связывает 50-ю субъединицу и вызывает стерические затруднения, которые ингибируют перенос аминокислот в более длинную полипептидную цепь. [12]
Сопротивление
Рибосомное метилирование
Вскоре после появления клинического использования линкозамида в 1953 г. штаммы устойчивых стафилококки были изолированы в нескольких странах, в том числе Франция, Япония и Соединенные Штаты. [13] Устойчивые штаммы характеризовались выражением метилтрансферазы диметилатных остатков в 23S субъединице рибосомной РНК, предотвращая связывание макролиды, линкозамиды и стрептограмины B. Семейство генов, ответственных за кодирование этих метилтрансфераз, называется "эээ«семейство, или семейство генов метилазы рибосомы эритромицина. [14] Около 40 эээ на сегодняшний день сообщалось о генах, которые передаются в основном через плазмиды и транспозоны. [15]
Целевая мутация
Было выделено несколько штаммов бактерий, которые обладают высокой устойчивостью к обработке макролидами, и было обнаружено, что они обладают мутациями в кармане связывания трансферазы в 23S субъединице рибосомы. Устойчивый к макролидам Пневмококк изолированные от пациентов больниц в Восточной Европе и Северной Америке, были обнаружены мутации в генах 23S или других рибосомных белков. [16]
Отток антибиотиков
Грамотрицательные бактерии содержат гены, кодирующие молекулярные насосы, которые могут способствовать устойчивости к гидрофобным соединениям, таким как макролиды и линкозамиды. [14] Из многих семейств насосов с множественной лекарственной устойчивостью линкозамиды чаще всего перекачиваются через насосы, принадлежащие надсемейство резистентность-клубенько-деление клеток. [17] Стафилококки экспрессируют насосы оттока со специфичностью для макролидов 14- и 15-членного кольца и стрептограмина B, но не для молекул линкозамида. [18]
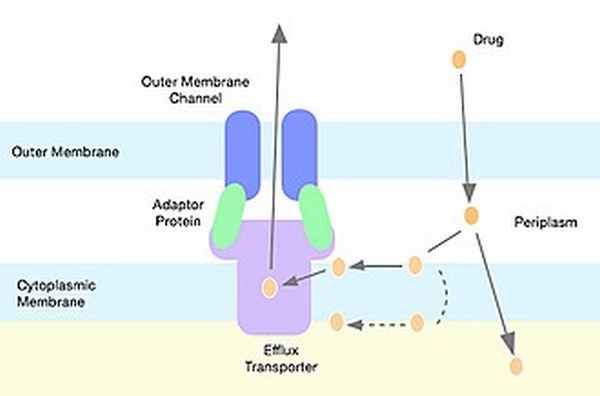
Пример оттока лекарства через насос, принадлежащий к суперсемейству резистентность-клубенько-деление клеток, тип насоса, который в первую очередь отвечает за отток линкозамида.
Модификация препарата
Клинические изоляты S. aureus сообщалось о содержащих генах, которые кодируют нуклеотрансферазы линкозамида. Гены lnuA и lnuB придают устойчивость к линкомицину, но не к клиндамицину. Однако эти гены ограничивают бактерицидную активность клиндамицина. [15] Этот тип сопротивления редко встречается в S. aureus, но, как сообщается, чаще встречается у других штаммов бактерий. [19]
Фармакокинетика
Приблизительно 90% линкозамидов, вводимых перорально, абсорбируются с небольшими колебаниями в зависимости от того, какое лекарство вводится. Концентрации в плазме при использовании этого пути достигают максимума в течение 2–4 часов. Внутримышечное введение линкозамидов приводит к сильному всасыванию, при этом пиковые уровни в плазме достигаются через 1-2 часа. Около 90% клиндамицина связывается с белками плазмы и, как правило, более стабильно и быстро всасывается, чем линкомицин. [20]
Линкозамиды широко распространены в нескольких тканях, за исключением спинномозговая жидкость. Было обнаружено, что при внутримышечном введении крысам линкомицин накапливается в самых высоких концентрациях в почках по сравнению с другими тканями, в то время как клиндамицин обнаруживается в самых высоких концентрациях в легких. [21] Клиндамицин накапливается в макрофагах и других белых кровяных тельцах, что может привести к его концентрациям в 50 раз выше, чем уровень в плазме. [22]
Клиническое использование
Линкозамиды часто используются в клинических условиях в качестве альтернативного антибиотика для пациентов с аллергией на пенициллин. Линкозамидов, клиндамицин чаще всего используется в клинике из-за его более высокой биодоступности, более высокой пероральной абсорбции и эффективности в спектре целевых организмов. [23] Линкозамиды, как правило, представляют собой класс антибиотиков первого выбора в ветеринарной микробиологии, наиболее часто используемые для борьбы с кожными инфекциями. [7]
Линкозамидные антибиотики у человека можно использовать в различных клинических целях. Они эффективны при лечении стоматологических инфекций, инфекций брюшной полости, абсцессов, воспалительных заболеваний органов малого таза и анаэробных инфекций. Было показано, что один клиндамицин эффективен при лечении угревая сыпь, [24] синдром токсического шока [25] и малярия, [26] и снизить риск преждевременных родов у женщин с бактериальный вагиноз. [27] Линкозамидные антибиотики также могут быть полезны при лечении: метициллин-устойчивый S. aureus. [1]
Токсичность и взаимодействия
Другие побочные реакции включают диарею, тошноту, рвоту, боль в животе и сыпь. Местное применение клиндамицина может вызвать контактный дерматит, сухость, жжение, зуд, шелушение и шелушение кожи. [29]
Составы торговой марки линкозамида
- Клиндамицин - Клеоцин, Клеоцин Педиатрический, КлиндаМакс вагинальный, Далацин
- Линкомицин - Линкоцин
- Пирлимицин
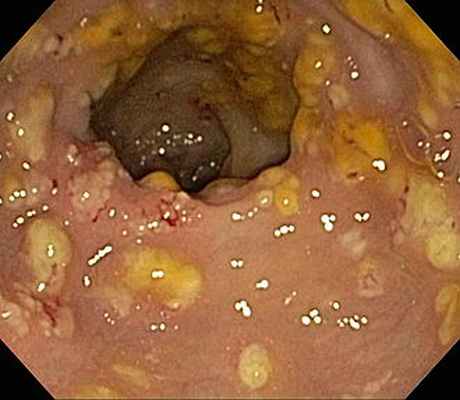
Эндоскопическое изображение псевдомембранозного энтероколлита кишечного тракта. Прием клиндамицина может привести к нарушению микрофлоры желудочно-кишечного тракта и последующей наблюдаемой патологии.
История
Первым обнаруженным соединением линкозамида был линкомицин, выделенный из Streptomyces lincolnensis в образце почвы из Линкольна, Небраска (отсюда и название бактерии). [2]
Читайте также:
