Локализация и функции адаптерных комплексов
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Адапторная гипотеза была доказана в начале 60-х годов в экспериментах Ф. Шапвиля, Г. фон Эренштейна и др. В одном из экспериментов цистеиновую тРНК нагружали цистеином. Затем цистеиновый остаток при помощи никеля Ренея превращали в аланиновый. Таким образом получали комплекс Ала-тРНК-Цис,
В соответствии с адапторной гипотезой каждая тРНК должна обладать участком — антикодоном, комплементарным кодону иРНК, который определяет включение в растущую полипептидную цепь одного аминокислотного остатка. Все тРНК как про-, так и эукариот имеют сходную структуру. Они содержат около 80 оснований, различаются по составу оснований, часть которых модифицирована. Модификация оснований происходит уже после синтеза тРНК в ее определенных положениях. Схематически структуру тРНК принято изображать в форме «клеверного листа» в соответствии с возможностью образования водородных связей между основаниями. Главным участником процесса трансляции, его организующим центром является рибосома. Этот сложный молекулярный агрегат, состоящий из белков и рибонуклеиновых кислот, в ходе всей трансляции выполняет множество функций. Наиболее подробно исследованы структура и функция рибосом у бактерий, особенно у Е. coli.
Транспортная РНК, тРНК — рибонуклеиновая кислота, функцией которой является транспортировка аминокислот к месту синтеза белка. тРНК также принимают непосредственное участие в наращивании полипептидной цепи, присоединяясь — будучи в комплексе с аминокислотой — к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса.
Для каждой аминокислоты существует своя тРНК.
тРНК является одноцепочечной РНК, однако в функциональной форме имеет конформацию «клеверного листа». Аминокислота ковалентно присоединяется к 3'-концу молекулы с помощью специфичного для каждого типа тРНК фермента аминоацил-тРНК-синтетазы. На участке C находится антикодон, соответствующий аминокислоте.
Генетическая роль и механизмы трансляции
Трансляция начинается со стартового кодона АУГ, который при локализации в смысловой части структурного гена кодирует аминокислоту метионин. Каждую аминокислоту доставляет к полисоме транспортная РНК (тРНК), специфичная к данной аминокислоте. тРНК выполняет роль посредника между кодоном мРНК и аминокислотой. Молекулы тРНК узнают в цитоплазме соответствующий триплет (кодон в мРНК) по принципу спаривания комплементарных азотистых оснований. тРНК, которая подходит к малой субчастице, образует связь кодой — аитикодои, при этом одновременно передает свою аминокислоту в аминоацнльный участок (А-участок) большой субъединице. К кодону АУГ «подходит» антикодон только той тРНК, которая переносит метионин. Поэтому прежде всего к рибосоме доставляется метионин. Затем кодон АУГ переходит на пептидильный участок большой субъединицы (Р-участок). В результате этих процессов образуется транслирующая рибосома — инициирующий комплекс. Элонгация — это последовательное включение аминокислотных остатков в состав растущей полипептидной цепи. Каждый акт элонгации состоит из трех этапов: 1. узнавание кодона, которое заключается в связывании антикодона с очередной молекулой тРНК, несущей аминокислоту, с кодоном свободного А-участка на рибосоме; 2. бразование пептидной связи, которое происходит лишь тогда, когда оба участка А и Р заняты молекулами тРНК. Часть большой субъединицы рибосомы — фермент пептидилтрансферазу, катализирующий образование пептидной связи; 3. ранслокация, где тРНК участка Р, не связанная с пептидом, покидает рибосому. Затем молекула тРНК с полипептидом переходят из А на Р-участок и, наконец, рибосома перемещается вдоль РНК на один кодон. Терминация (окончание синтеза) происходит по команде кодонов УАА, УАГ, УГА. В природе не существует таких молекул тРНК, антикодоны которых соответствовали бы этим кодонам. Каждая мРНК транслируется, как правило, несколько раз, после чего разрушается. Среднее время жизни молекулы мРНК около 2 мин. Разрушая старые и образуя новые мРНК, клетка может довольно строго регулировать как тип продуциру' О MUX белков, так и их количество. Это регуляция синтеза белка на уровне транскрипции. У эукариот возможна регуляция и на уровне трансляции. Синтез белка — один из существеннейших показателей жизни. Жизнь каждого индивидуума начинается с оплодотворенной яйцеклетки, которая многократно делится. Вскоре в образовавшейся клеточной массе начинается дифференцировка: между многими ранее однородными клетками возникают различия. Клетки дифференцируются потому, что в них содержатся разные белки, от присутствия которых зависит, какие реакции будут проистекать в клетке, а также свойства и функции данной клетки. Поскольку любой белок является продуктом гена, то дифференцировка обусловлена тем, что разные гены включаются и выключаются на разных этапах онтогенеза. Кроме того, каждый человек на Земле в прошлом, настоящем или будущем имеет свой неповторимый набор только ему свойственных белков, именно поэтому каждый человек уникален. Исключение составляют монозиготные близнецы, у которых генетический материал идентичен. Именно специфичность белковых наборов обеспечивает иммунный статус каждого человека.
Локализация и функции адаптерных комплексов
Механизм созревания эндосом и их превращения в лизосомы
• Транспорт метаболитов от ранних эндосом в поздние эндосомы и лизосомы происходит за счет «созревания»
• Белковые комплексы ESCRT участвуют в сортировке белков в везикулы, которые отпочковываются в люмен эндосом, образуя мультивезикулярные тела, обеспечивающие процесс протеолитической деградации
Превращение ранних эндосом в поздние эндосомы и в лизосомы происходит в ходе процесса созревания, который, по крайней мере, на первый взгляд напоминает созревание цистерн аппарата Гольджи. Вероятно, транспортные везикулы не играют существенной роли в движении белков между эндосомами.
Вместо этого потеря рецепторов за счет их возврата в плазматическую мембрану превращает ранние эндосомы в поздние эндосомы, содержащие диссоциированные лиганды, такие как ЛНП. Транспортные везикулы, содержащие вновь синтезированные ферменты лизосом и мембранные компоненты, происходят из транс-Гольджи сети и сливаются с поздними эндосомами. В ходе этого процесса поздние эндосомы превращаются в лизосомы, и происходит переваривание диссоциированных лигандов.
Образование цилиндрических отростков рециклизации ведет к селективному и постепенному удалению рецепторов из ранних эндосом. Остальные компоненты остаются в везикулярной части ранней эндосомы, которая перемещается в центр клетки вдоль микротрубочек. В конце концов везикулы накапливаются в перинуклеарной части цитоплазмы, примыкающей к центру организации микротрубочек. Одна из причин такого движения везикул заключается в необходимости ограничить их дальнейшее слияние с новыми клатриновыми везикулами, которые отпочковываются от плазматической мембраны.
Однако их слияние с везикулами, которые содержат лизосомальные компоненты и произошли из транс-Гольджи сети, может продолжаться. Таким образом, органеллы, принимающие участие в эндоцитозе, постепенно становятся более «лизосомоподобными» по составу содержащихся в них ферментов, Н+-ионов и мембранных компонентов, таких как v-АТФазы. Это превращение происходит постепенно, с образованием поздних эндосом как промежуточных структур между ранними эндосомами и лизосомами.
Характерная особенность процесса созревания ранних эндосом заключается в образовании мультивезикулярных тел (МВТ). В компартментах, принимающих участие на поздних этапах эндоцитоза (поздние эндосомы и лизосомы), часто присутствуют небольшие везикулярные включения, которые образуются в результате инвагинации мембраны. Таким образом, нередко поздние эндосомы и лизосомы называют МВТ. Функциональная роль этих структур особенно отчетливо проявляется в случае семейства рецепторов тирозинкиназ, например инсулинового рецептора и рецептора эпидермального фактора роста (ЭФР), которые после захвата лиганда деградируют.
Например, десенситизация ЭФР-рецептора происходит потому, что после попадания в ранние эндосомы рецептор селективно включается в участки мембран, которые находятся внутри эндосомы. Мембраны внутренних везикул по своим свойствам отличаются от мембран, ограничивающих эндосомы, и таким образом, рецепторы не попадают в цилиндрические отростки для последующего рециклирования. Вместо этого, совместно с диссоциированными лигандами и другим содержимым ранних эндосом, они поступают в поздние эндосомы и лизосомы, где внутренние везикулы вместе с накопленными рецепторами деградируют под действием липаз (ферментов, разрушающих липиды) и протеаз.
Исследования, проведенные на мутантах дрожжей, дефектных по образованию МВТ, позволили выяснить механизм их образования и отбора белков для мембран внутренних везикул. По-видимому, аналогичный механизм существует и для клеток млекопитающих. Характерной его чертой является метка подлежащих десенситизации рецепторов с помощью ковалентного присоединения к ним убиквитина, небольшого белка, присутствующего в цитоплазме. Молекула убиквитина присоединяется к рецептору с помощью специфических лигаз. Одна из таких лигаз представлена белком Cbl, который кодируется протоонкогеном и содержится в цитозоле. Этот белок катализирует присоединение одного убиквитина к рецептору ЭФР.
Дефект в белке Cbl приводит к нарушению процесса десенситизации ЭФР-рецептора и к неконтролируемому росту клеток. Эти моноубиквитинированные белки узнаются комплексом специальных белков, который обеспечивает их селективный захват во внутренние везикулы, а также участвует в образовании самих везикул. Поскольку эти события начинаются на уровне ранних эндосом, образование МВТ служит этапом на пути созревания ранних эндосом в поздние эндосомы и лизосомы. Исследования образования МВТ у дрожжей и в клетках животных показали, что один из белков цитозоля (Hrs) узнает остатки убиквитина и активирует три дополнительных набора белков, которые называются комплексами ESCRT. Эти комплексы удаляют убиквитин, обеспечивая его последующее использование, и, что более важно, способствуют образованию инвагинирующей внутрь мембранной везикулы с карго, с которого снят убиквинтин.
Важно отметить, что направленность формирования везикул при образовании МВТ имеет противоположный характер, по сравнению с направленностью всех известных на сегодня событий мембранного перемещения. Это объясняется тем, что целью образования МВТ служит выведение отобранных мембранных компонентов из транспортного пути, гарантирующее их последующее переваривание в лизосомах.
По мере созревания ранних эндосом в поздние,
транспортные везикулы доставляют к ним компоненты и рециклируют из них рецепторы. Деградация белков с участием убиквитина происходит в мультивезикулярных тельцах,
представляющих собой поздние эндосомальные компартменты на пути эндоцитоза.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Сортировка белка в поляризованных клетках эпителия
• В поляризованных клетках плазматическая мембрана состоит из отдельных доменов со специфическими наборами белков, и поэтому в этих клетках происходит дополнительная сортировка белков
• В зависимости от типа клеток, сортировка белков поверхности в поляризованных клетках может происходить в транс-Гольджи сети, эндосомах или в одном из доменов плазматической мембраны
• Процесс сортировки белков в поляризованных клетках происходит при участии специальных адаптерных комплексов, а также, вероятно, липидных рафтов (микродоменов) и лектинов
Плазматические мембраны большинства клеток многоклеточных организмов состоят из множества отдельных доменов, расположенных в непрерывном липидном бислое и различающихся между собой по биохимическим, структурным и функциональным характеристикам. Такие клетки считаются «поляризованными». Наиболее типичными примерами таких клеток являются эпителиальные клетки и нейроны.
Эпителиальные клетки выстилают все полости тела (например, кишечник, почки, воздухоносные пути) и, таким образом, обладают двумя поверхностями. Апикальный домен обращен в люмен органа, а базолатеральный граничит с кровью или с примыкающими клетками.
В эпителиальных клетках, специализированных на поглощении питательных веществ (например, клетки эпителия кишечника), на плазматической мембране апикального домена существуют небольшие выросты, которые называются микроворсинки. Они увеличивают общую поверхность клетки, что способствует увеличению поглощения ею питательных веществ.
Апикальная плазматическая мембрана в таких клетках обогащена мембранными белками, которые способствуют захвату клеткой таких питательных компонентов, как аминокислоты, сахара и другие молекулы. Также мембрана богата уникальными гликолипидами.
Напротив, базолатеральный домен содержит большинство мембранных белков (например, ЛНП-рецептор и ЭФР-рецептор) и липидов, находящихся в плазматической мембране неполяризованных клеток. Наряду с этим, переносчики, находящиеся в базолатеральном домене, транспортируют питательные компоненты из клетки в плазму крови.
Межклеточные контактные комплексы, состоящие из плотных контактов, адгезивных контактов и десмосом, разграничивают апикальные и базолатеральные домены. Одна из функций этих комплексов состоит в том, чтобы предотвратить возможность латеральной диффузии компонентов апикальной мембраны в базолатеральный домен, и наоборот.
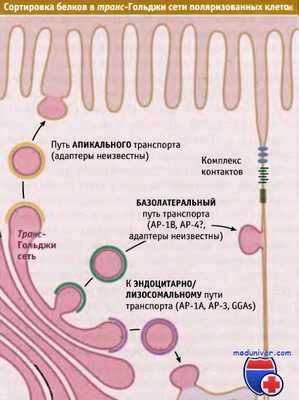
Три типа сортировки, происходящего в транс-Гольджи сети поляризованных клеток эпителия.
Белки сортируются для эндоцитоза и для транспорта через апикальную и базолатеральную мембраны.
Для каждого пути используются свои адаптерные комплексы.
Поэтому липиды и белки должны направляться в соответствующий домен. Транспорт по секреторному механизму и по пути эндоцитоза носит поляризованный характер. Это обеспечивает движение компонентов апикальной и базолатеральной мембран в соответствующих направлениях. Транспорт в базолатеральный домен происходит под действием адресных сигналов, отличающихся от сигналов для апикального транспорта.
В зависимости от того, предназначены вновь образованные мембранные белки для апикальной или базолатеральной поверхности, в транс-Гольджи сети они сортируются по разным типам везикул. Для многих типов поляризованных эпителиальных клеток процесс базолатерального транспорта исследован хорошо. В цитоплазматических доменах большинства базолатеральных белков присутствуют сигналы, содержащие остаток тирозина или два остатка лейцина.
Эти остатки узнаются адаптерными комплексами таким же образом, как это происходит для белков, которые транспортируются по механизму эндоцитоза или направляются в лизосомы. Последовательности, содержащие и иногда не содержащие остатки тирозина, узнаются в транс-Гольджи сети с участием АР-1В, специфичной для эпителиальных клеток изоформы клатринового адаптерного комплекса АР-1. АР-1В связывается с клатрином, образуя транспортную везикулу, ориентированную в базолатеральном направлении. Этот комплекс отличается от широко распространенного комплекса АР-1А только структурой μ-цепи. Субъединицы μ1А и μ1В обладают на 80% одинаковой структурой, однако связывают разные типы сигналов. Причина этих различий не установлена.
Цитоплазматические домены белков, предназначенных для апикальной плазматической мембраны, не содержат специфических сигналов. Вместо этого в домене люмена они содержат критические N- или О-сахарные остатки или имеют особый тип мембранного якорного домена, обеспечивающего их включение в апикально направляющиеся транспортные везикулы. Одним из примеров такого мембранного якоря является GPI, который добавляется к некоторым белкам в эндоплазматическом ретикулуме. Такие везикулы, транспортируемые в апикальном направлении, часто содержат уникальный липидный микродомен, называемый липидный рафт, который накапливает специфические белки, обеспечивая, таким образом, их селективное включение в апикальные везикулы.
Вероятно, этот же механизм в определенной степени позволяет разделять липиды, так что сложные гликолипиды, обнаруженные на апикальной, но не на базолатеральной поверхности эпителиальных клеток, также селективно включаются в эти везикулы.
Для некоторых мембранных белков, в которых отсутствует информация об адресе и которые транспортируются из транс-Гольджи сети и в апикальных, и базолатеральных везикулах, существует третий тип поляризованного адресования. Однако после попадания в плазматическую мембрану эти белки еще могут стать поляризованными. Это происходит в процессе домен-специфического удержания, при котором мембранный белок взаимодействует с предварительно поляризованным цитоскелетом.
Последний содержит белки, которые собираются на мембранных доменах в ответ, например, на такие сигналы, как прикрепление к другой клетке. Часто такой тип цитоскелета собирается в области межклеточных контактов, что обеспечивает асимметричность накопления мембранных белков. Мембранные белки, которые взаимодействуют с таким цитоскелетом, стабилизируются в соответствующем мембранном домене. Однако мембранные белки, попавшие в домен, который не обладает подходящим цитоскелетом, интернализируются путем эндоцитоза, деградируют в лизосомах, или рециклируют.
В последнем случае они получают еще одну возможность попасть в домен с соответствующим цитоскелетом.
Сортировка апикальных и базолатеральных белков также осуществляется в эндосомах. Поскольку эндоцитоз происходит как с апикальной, так и с базолатеральной поверхности эпителиальных клеток, интернализованные белки за счет рециклирования должны вернуться в те домены, из которых они вышли. Очевидно, ранние эндосомы могут вести себя как транс-Гольджи сеть, сортируя апикальные и базолатеральные белки в определенные везикулы рециклирования, которые направляются или к апикальной, или к базолатеральной мембране.
Фактически при сортировке по признаку поляризации в эндосомах используются те же сигналы, что и в транс-Гольджи сети. Чтобы при продолжающемся эндоцитозе эпителиальные клетки могли поддерживать полярность плазматической мембраны, необходимо поляризованное рециклирование содержимого эндосом. Фактически в эндосомах, и в частности, в рециклирующих эндосомах, может происходить биосинтетическая сортировка. Таким образом, в качестве промежуточных звеньев, на пути от транс-Гольджи сети к базолатеральной плазматической мембране, могут использоваться рециклирующие эндосомы. Это, вероятно, объясняет, почему оба пути используют один и тот же набор сигналов.
• Адаптерные комплексы связываются с цитоплазматическим участками трансмембранных белков карго, с клатрином и с фосфолипидами
• Адаптерные белки, относящиеся к семейству АР, представляют собой гетеротетрамерные комплексы, состоящие из двух адаптиновых субъединиц и двух более мелких белков
• АР адаптеры связываются с сигналами сортировки, локализованными в цитоплазматическом участке белков карго. Наиболее изученные сигналы содержат остаток тирозина или два остатка лейцина
• Адаптерные комплексы обеспечивают селективную и быструю интернализацию рецепторов и их лигандов
Адаптерные комплексы связывают цитоплазматические участки белков карго с клатрином. Наиболее полно изучены адаптеры, относящиеся к семейству «АР», состоящему из четырех основных типов. Как показано на рисунке ниже, эти адаптеры распределяются в клетке характерным образом. АР-1 и АР-2 идентифицированы в качестве основных компонентов изолированных клатриновых везикул. АР-1 локализуется в транс-Гольджи сети и в эндосомах, а АР-2 в плазматической мембране.
АР-1 функционирует в транспорте растворимых лизосомальных компонентов и некоторых мембранных белков из транс-Гольджи сети в эндосомы и лизосомы. АР-2 участвует в эндоцитозе.
При поиске по базам данных, содержащим сведения о гомологах известных адапторных последовательностей, был обнаружен белок АР-3. Так же как и белок АР-1 он связан с TGN и может участвовать в биогенезе некоторых специализированных лизосом, таких как меланосомы, в которых хранятся пигменты окраски меланоцитов. У мышей с дефектами цвета шерсти часто наблюдаются мутации в субъединицах АР-3. Функции четвертого комплекса, АР-4, не известны.
Различные адаптерные комплексы, по крайней мере частично, связываются с определенными орга-неллами за счет взаимодействия со специфическими фосфолипидами. АР-2 связывается с фосфатидилино-зитол-4,5-бис-фосфатом (Р14,5Р или PIP2), который представляет собой фосфолипид, образующийся, главным образом, на цитоплазматическом слое плазматической мембраны.
Напротив, АР-1 связывающийся с PI4P, присутствует в основном во внутриклеточных мембранах, например в мембранах комплекса Гольджи и эндосом. Взаимодействие с соответствующим липидом может также индуцировать конформационные изменения, способствующие более эффективному присоединению адаптеров к своим карго, тем самым увеличивая их специфичность.
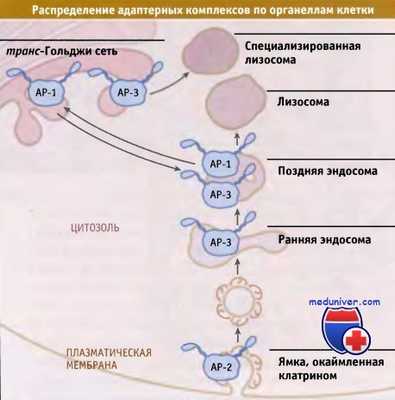
Разные этапы мембранного транспорта происходят с участием различных адаптеров.
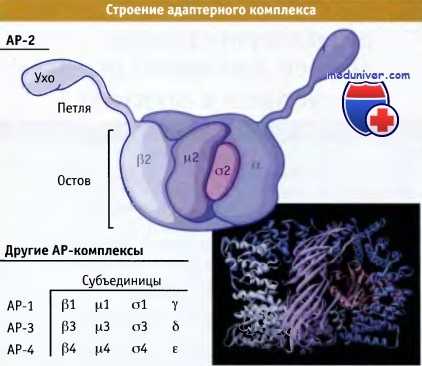
Адаптеры представляют собой комплексы, состоящие из четырех разных субъединиц. Две большие субъединицы в каждом комплексе называются адаптины. Все представители семейства АР обладают одинаковой гетеротетрамерной структурой, представленной на рисунке ниже. Общие представления о форме этих молекул были получены на основании данных электронной микроскопии и кристаллографических исследований очищенных белков.
В основе структуры адаптеров лежит большой центральный домен, представляющий собой как бы основной «остов», от которого отходят две дополнительные структуры («уши»), присоединенные длинными «петлевыми» доменами. Все четыре субъединицы являются частями «остова», однако петлевые и дополнительные домены представляют собой продолжения двух цепей (в АР-1 это b- и γ-цепи; в АР-2 — а- и b-цепи; в АР-3 — b- и δ-цепи).
Различные области адаптерных комплексов обладают различными функциями. Петлевые и дополнительные домены содержат сайты связывания специфической области клатрина, которая называется b-пропеллерный домен. Этот домен дает возможность адаптерному комплексу взаимодействовать с другими белками, регулирующими образование клатриновых везикул.
Центральный домен АР-2 связывается с цитоплазматической частью рецепторов плазматической мембраны и таким образом скрепляет клатриновое покрытие с плазматической мембраной. При фосфорилировании АР-2 открывается его сайт связывания с рецептором. При сборке окаймления специфическая киназа (ААК1) фосфорилирует АР-2. При фосфорилировании также открывается ц-субъединица АР-2, которая является участком адаптера, узнающим сигнал интернализации окаймленной ямки на рецепторе при эндоцитозе. При этом фосфорилировании открывается и сайт связывания для фосфоинозитидов. Эти отрицательно заряженные липиды плазматической мембраны играют роль дополнительных якорей для комплекса АР-2.
Как показано на рисунке ниже, адаптеры специфически связываются с сигналами сортировки, расположенными в цитоплазматическом участке белков карго. Критическая функция, которую играют адаптеры в выборе карго для включения в окаймленные везикулы, лучше исследована для комплекса АР-2. Сигналы сортировки, которые связываются с μ-цепью АР-2, находятся только на белках, которые включаются в клатрин-окаймленные ямки, они называются сигналами сортировки эндоцитоза.
В транспорте посредством окаймленных клатрином везикул участвуют адаптерные комплексы.
Они представляют собой гетеротетрамерные структуры, состоящие из «остова»,
который связывается с сигнальными последовательностями в цитоплазматическом участке мембранных рецепторов,
и подвижных петлевых областей, присоединенных к «ушам», которые связываются с клатрином.
Представлена кристаллическая структура только для «остова».
АР-2, по-видимому, связывается с двумя различными типами сигналов сортировки, содержащими остаток тирозина и два остатка лейцина.
Тирозиновые сигналы были первыми мембранными сигналами сортировки, идентифицированными при анализе мутантных ЛНП-рецепторов, не способных включаться в клатрин-окаймленные ямки. Мутации происходят в короткой последовательности, содержащей остаток тирозина, которая необходима и достаточна для захвата белка. Отсутствие интернализации мутантного рецептора показывает, что эта последовательность необходима для эндоцитоза.
Химерный белок, содержащий последовательности сигналов сортировки и белка плазматической мембраны, который в норме не подвергается эндоцитозу, интернализовался с той же скоростью, что и нормальный ЛНП-рецептор. Этот эксперимент показывает, что тирозиновая последовательность достаточна для эндоцитоза.
В дальнейших экспериментах по получению мутантных ЛНП-рецепторов и исследованию их интернализации была продемонстрирована основополагающая роль тирозинового остатка, а также важность примыкающих к нему остатков других аминокислот. На основании этих экспериментов были предложены две структуры последовательностей, ответственных за интернализацию: Тир-Х-Х-Ф и Асн-Фен-Х-Тир, где X- любая аминокислота, а Ф — аминокислота с объемной гидрофобной боковой цепью. Однако в экспериментах на дрожжевых двойных гибридах было показано, что только первая последовательность непосредственно связывается с μ-цепью АР-2.
Последовательность, содержащая два остатка лейцина, определяет быстрый эндоцитоз ряда рецепторов. Эта последовательность может распознаваться а-цепью. а не b-цепью АР-2, однако их взаимодействие с последовательностью охарактеризовано не столь подробно и может происходить с участием еще одной субъединицы. Наряду с этим, сигналы, содержащие два остатка лейцина, участвуют в сортировке лизосомальных белков в транс-Гольджи сети.

К числу известных сигналов сортировки при эндоцитозе относятся содержащие или тирозин- или два остатка лейцина. X представляет остаток любой аминокислоты.
Адаптерные комплексы, отличающиеся от группы АР, связывают некоторые рецепторы эндоцитоза с клатрином таким же образом, как комплексы АР. Например, b-аррестин связывается с сигнальной последовательностью, расположенной на цитоплазматической части b-адренергического рецептора, и с клатрином, что вызывает интернализацию рецептора в отсутствие АР-2. Аналогичным образом, белки из группы эпсина, такие как Eps15, связываются с тирозинкиназными рецепторами, например с рецептором эпидермального фактора роста, и также могут функционировать как адаптеры.
Существованием адаптеров объясняется одна из ключевых особенностей эндоцитоза — его селективность. В большинстве клеток животных происходит интенсивный конститутивный эндоцитоз, эквивалентный тому, как если бы каждые 1-2 ч с участием клатриновых везикул происходила полная интернализация всей плазматической мембраны. Однако захват специфических рецепторов происходит с полупериодом лишь в несколько минут. Таким образом, должен быть селективный захват этих рецепторов. Мы теперь знаем, что рецепторы избирательно концентрируются на сайтах эндоцитоза, когда их цитоплазматические участки специфически взаимодействуют с адаптерными комплексами, физически связывающими рецепторы с клатриновыми везикулами.
Напротив, белки плазматической мембраны, которые не взаимодействуют с адаптерами, селективно не интернализируются. Эти белки интернализируются гораздо медленнее или вообще могут стерически исключаться из окаймленных ямок селективно включенными туда рецепторами, присутствующими в большей концентрации.
Наряду с этим, растворимые внеклеточные белки характеризуются низким уровнем включения в клатриновые везикулы, поскольку образование пустых везикул невозможно. Так как концентрация большинства лигандов во внеклеточной среде слишком низкая, интернализация их существенного количества возможна только при связывании с рецепторами.
Перспективы изучения транспорта белков в клетке
Охарактеризовано большинство белков, участвующих в процессах перемещения между мембранами, и в ряде случаев выяснены их функции. Однако о функциях многих белков можно только догадываться, и ощущается необходимость использования более углубленных методов исследований в этом направлении.
Например, в настоящее время удержание везикул на мембране рассматривается как событие в категории все или ничего, и упускается тот факт, что этот процесс очень тонко регулируется во времени и пространстве. По-видимому, наиболее адекватным в данном случае является сочетание биохимических и микроскопических методов исследования.
Более того, ощущается необходимость интеграции отдельных процессов для создания целостной картины. Часто можно изучить отдельные этапы, но путь, по которому они объединяются вместе, остается неясным. Примером является процесс выбора карго для транспорта в базолатеральную мембрану поляризованных клеток. Существует очевидная необходимость в специфическом адаптере (АР-1В), но как он связан с процессом сборки окаймления?
Адаптеры, которые связываются с базолатеральным карго и с М-6-Ф рецепторами, оба связываются с клатрином, но для них характерно различное направление. Что препятствует вхождению обоих типов комплексов адаптер-карго в одни и те же транспортные везикулы? Что регулирует и координирует индивидуальные события мембранного транспорта в процессе биологического развития или при метаболических изменениях в клетке или в тканях? Наблюдение и анализ таких событий в реальном времени возможны с помощью биохимических и микроскопических методов.
С другой стороны, существуют сложные структуры, которые исследуются методами рентгеноструктурного анализа и ядерного магнитного резонанса. Например, недавно получена структура адаптерного комплекса АР-2. Выяснение этих структур обеспечивает необходимые предпосылки для дальнейшего изучения механизмов процессов с использованием генетических и биохимических подходов.
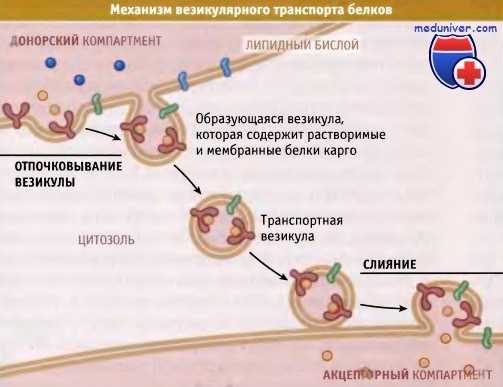
При везикулярном транспорте везикула отпочковывается
от мембраны одного компартмента и сливается с мембраной другого компартмента.
Уникальный набор белков отражает специализированные функции органелл, участвующих в экзо- и эндоцитозе. Состав этого набора поддерживается постоянным, несмотря на большое количество белков, которые проходят через органеллы в ходе их функционирования и в результате биосинтетических процессов. Индивидуальность состава компартментов поддерживается постоянным обменом везикулами между мембранами. Белки селективно включаются в везикулы, которые переносят их к следующему компартменту, и затем везикулы сливаются только с этим компартментом.
Транспортируемые белки сортируются в соответствии с сигналом, который прямо или опосредованно связывается с белком, окаймляющим везикулу. Этот механизм особенно характерен для эндоцитоза и в меньшей степени для эзоцитоза. Последний характеризуется продвижением молекул карго, особенно синтезируемых в больших количествах, или больших структур в виде неизбирательного потока по направлению к транс-Гольджи сети. Прямой селекции белков не происходит, и основную роль играют два других сигнала: удержание и возвращение.
За счет первого белок удерживается на специфической мембране по механизму, в котором участвует домен, пронизывающий мембрану. Второй сигнал обеспечивает захват белка и его возвращение в органеллу, где он должен функционировать. Многие растворимые и присутствующие в больших количествах белки ЭПР обладают С-терминальным сигналом KDEL, который служит для возвращения белков из ранних компартментов Гольджи. Для белков мембран ЭПР характерен сигнал, состоящий из остатков основных аминокислот.
Для направления везикул к определенным компартментам необходимы Rab-ГТФазы, удерживающие белки и белки SNARE. Парные SNARE взаимодействуют между собой, при этом мембраны соприкасаются и сливаются. Слияние мембран контролируется, и таким образом регулируется секреция многих типов карго — от пищеварительных ферментов до нейромедиаторов.
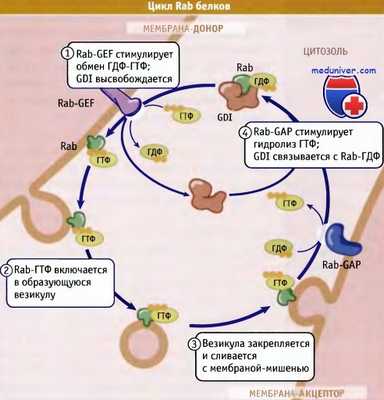
Модель, описывающая цикл Rab-белков между цитозолем и мембранами
(другие белки, участвующие в перемещении, не показаны).
Читайте также:
