Лучевая диагностика радиационного поражения печени
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Одним из прогрессивных методов обследования, позволяющим оценивать не только анатомическое, но и функциональное состояние органов и систем организма, является радиоизотопная или радионуклидная диагностика. С ее помощью удается обнаруживать заболевания (в том числе и онкологические) даже на ранних стадиях их развития, которые характеризуются отсутствием ярко выраженной симптоматики. Таким образом, у врачей появляется возможность оказать пациенту своевременную медицинскую помощь, а у больного – шанс на излечение заболевания.
В чем заключается сущность радионуклидной диагностики
Радиоизотопное исследование – это разновидность лучевой диагностики, основанная на регистрации излучения, исходящего от радиоактивных веществ, введенных в организм пациента или в биологическую жидкость, содержащуюся в пробирке. Данные вещества известны как радиофармацевтические препараты (РФП). Так принято называть химические или биохимические соединения, молекулы которых включают радионуклиды.
Применяемые в диагностических целях радиоактивные изотопы в медицине отличаются коротким периодом полураспада, что обуславливает низкую лучевую нагрузку на организм человека. Выводятся они вместе с мочой. Чаще всего для обследования используют радионуклиды технеция, радиоактивного йода.
После попадания радиофармпрепарата в организм от тела пациента начинает исходить гамма-излучение, которое фиксируется гамма-камерами, проходит компьютерную обработку и преобразовывается в плоское или объемное анатомическо-функциональное изображение исследуемого органа.
Исходя из скорости распределения радиоактивного вещества в организме человека и мест его наибольшей концентрации, медики делают выводы о размерах, форме органа, его расположении, наличии в нем очагов патологии, нарушениях его работы.
Врач имеет возможность получить большой объем информации об исследуемых органах – от данных о клеточном метаболизме (обмене веществ) в них до сведений об их функционировании. Поскольку радиоизотопная диагностика позволяет отслеживать динамику процессов, происходящих на молекулярном и клеточном уровнях, она не дублирует результаты ультразвукового исследования (УЗИ), компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ).
В каких случаях показано и противопоказано радионуклидное обследование
Радионуклидный метод диагностики имеет определенные показания и противопоказания. Так, радиоизотопное исследование может быть назначено с целью:
- обнаружения злокачественных новообразований и их метастазов в организме;
- выявления острых и хронических заболеваний сердца, легких, почек, печени, кишечника и других органов;
- оценки состояний органов после трансплантации;
- диагностики врожденных аномалий органов;
- обнаружения отклонений в работе органов и систем вследствие какого-либо заболевания;
- выявления нарушений кровообращения;
- оценки состояния органов после травм.
Противопоказания к обследованию подразделяются на абсолютные и относительные. В первую группу входит индивидуальная сверхчувствительность к радиофармпрепаратам, но встречается она крайне редко.
Вторая группа объединяет подозреваемую или установленную беременность и период грудного вскармливания у женщин, лихорадку, острые респираторные заболевания и психические расстройства, тяжелую печеночную и почечную недостаточность.
Назначая радиоизотопную диагностику пациентам, имеющим относительные противопоказания к ней, врач должен быть уверен, что ее потенциальная польза превысит возможный вред.
Методы радионуклидной диагностики
Для проведения диагностики используют радиоизотопные методы исследования in vivo и in vitro. В первом случае радиофармпрепарат вводится непосредственно в организм человека, после чего медики наблюдают за тем, как он распределяется в органах и тканях. Во втором же радиоактивное вещество добавляется в пробирку, содержащую исследуемую биологическую жидкость (к примеру, плазму, сыворотку крови, мочу), после чего проводится количественный учет результатов их взаимодействия при помощи методов радиометрии.
Радионуклидная диагностика in vivo позволяет установить, с какой скоростью проходит радиофармпрепарат через определенный орган и как быстро он выводится из организма. Исследование in vitro предоставляет возможность узнать концентрацию гормонов, ферментов, лекарственных препаратов в биологических жидкостях, даже если они там содержатся в ничтожно малых количествах.Радионуклидная диагностика
Как вводят радиофармпрепараты в организм
Существует несколько способов введения радионуклидов в организм пациента в диагностических целях:
- пероральный, который подразумевает всасывание радиоактивного вещества в кровь из желудочно-кишечного тракта и дальнейшее его накопление в исследуемом органе;
- внутривенный и внутриартериальный, при котором радионуклид сразу попадает в кровоток;
- ингаляционный, подразумевающий поступление радиофармпрепарата в организм через дыхательные пути;
- подкожный;
- в лимфатические сосуды;
- непосредственно в ткани исследуемого органа;
- в спинномозговой канал.
Способ введения радиоактивного вещества зависит от того, какой структурный компонент организма пациента необходимо исследовать.
Какими способами регистрируется распределение радиофармпрепарата в организме
Существует несколько разновидностей радионуклидной диагностики: радиометрия, радиография, томография, сцинтиграфия, радиоизотопное сканирование. Ключевое отличие между ними заключается в способе регистрации распределения радиофармпрепарата. Предлагаем вам подробнее ознакомиться с особенностями каждого из перечисленных выше видов исследования.
Что такое сцинтиграфия
Радиоизотопная сцинтиграфия является методом визуализации, позволяющим получать двухмерные изображения. Она бывает статической и динамической. В первом случае делают несколько сцинтиграмм (снимков), по которым изучают анатомо-топографическое состояние скелета, внутренних органов (почек, легких, щитовидной железы и так далее), а также обнаруживают в них очаги патологического скопления радиофармпрепарата.
Во втором случае с определенным интервалом выполняют серию двухмерных изображений. Путем их сложения получают динамические графики, отображающие характер перемещения радиоактивного вещества в исследуемом органе (к примеру, в почках, желчном пузыре, печени). Таким образом, удается оценить, насколько правильно он функционирует.
Исследование предоставляет возможность выявлять заболевания задолго до того, как произойдут изменения в тканях пораженных органов (в среднем, на 1-1,5 года раньше, чем рентгенодиагностика).
Сущность радиоизотопного сканирования «Whole body»
Радиоизотопное сканирование, выполняемое в режиме «Whole body», позволяет получать двухмерные изображения всего тела за счет использования особой гамма-камеры, обладающей большим полем зрения. Преимущество данного вида радиоизотопной диагностики, по сравнению со стандартной сцинтиграфией, заключается в большом объеме предоставляемых данных.
Для исследования не нужно несколько раз вводить радиофармпрепарат. Достаточно однократного его введения.
При помощи радиоизотопного сканирования удается обнаруживать метастазы злокачественных опухолей по всему организму, оценивать уровень эффективности лечения и планировать дальнейшую терапию.
Что являет собой радиометрия
Радиометрией в медицине принято называть метод измерения концентрации радиофармпрепарата в органах и тканях организма за определенный промежуток времени. Различают клиническую и лабораторную радиометрию. Первая используется для обнаружения злокачественных опухолей, расположенных на коже, слизистых оболочках матки, желудка, гортани.
Лабораторная радиометрия применяется для исследования биологических жидкостей в пробирках, в которые введен радиофармпрепарат. Радионуклидный анализ проводится с использованием автоматизированных радиометров, на конвейерах которых устанавливаются пробирки. Фиксируя излучение над емкостью с биологической жидкостью, устройства определяют концентрацию ферментов, гормонов в крови пациента.
Радиография как разновидность радиоизотопной диагностики
Радиографией называется исследование, направленное на регистрацию динамики накопления и процесса перераспределения радиоактивного вещества, введенного в организм пациента. Данная разновидность радионуклидной диагностики используется с целью исследования быстротекущих процессов (в частности, вентиляции легких, кровообращения).
Особенности и виды томографии
Томография – разновидность исследования, позволяющая получать послойную картину распределения радиоактивного вещества в органах и на основании этого создавать объемные (3D) изображения. Выделяют однофотонную эмиссионную компьютерную томографию (ОФЭКТ) и позитронно-эмиссионную томографию (ПЭТ). Отличие между ними заключается в том, что при ОФЭКТ после введения в организм пациента радиофармпрепарата стандартная камера захватывает по одному кванту (наименьшей частице энергии), исходящему от тела, а при ПЭТ – по два.
Томография как вид радионуклидной диагностики позволяет обнаруживать живые патологические ткани. Если, к примеру, после лечения рака на изображениях, полученных в ходе магнитно-резонансной томографии (МРТ) и компьютерной томографии (КТ), видны остатки разрушающейся опухоли, то ОФЭКТ и ПЭТ предоставляют возможность увидеть среди них даже единичные живые клетки.
В каких отраслях медицины чаще всего используется радионуклидная диагностика
Данная разновидность исследования нашла широкое применение в кардиологии, неврологии, урологии, эндокринологии, гастроэнтерологии, онкологии и других отраслях. О том, что помогает обнаружить радиоизотопное обследование различных органов, читайте далее.
Радионуклидная диагностика сердца
Методы радиоизотопного исследования в кардиологии применяются, если необходимо:
- установить точную локализацию повреждения миокарда (мышечного слоя сердца, составляющего основную его массу);
- провести диагностику ишемии (снижение кровоснабжения сердца в результате ослабления притока артериальной крови);
- подтвердить инфаркт (некроз сердечной мышцы в результате закупорки артерий или их спазма) миокарда;
- оценить систолическую (сокращение желудочков и предсердий при сердцебиении) и диастолическую (расслабление желудочков и предсердий при сердцебиении) функции сердца;
- определить степень атеросклеротического (связанного с отложениями холестерина) повреждения коронарных (доставляющих к миокарду насыщенную кислородом кровь) артерий;
- диагностировать стеноз (сужение) коронарных сосудов и так далее.
Радиоизотопное исследование сердца проводится, если нужно подтвердить необходимость хирургического вмешательства, а также оценить эффективность ранее назначенного пациенту лечения: химиотерапии, хирургической реваскуляризации (улучшение кровотока через коронарные сосуды путем их шунтирования) и других методов.
Радионуклидная диагностика печени и органов брюшной полости
Радиоизотопное исследование печени назначается, если есть подозрения на:
- цирроз (патологическое разрастание соединительной ткани в печени);
- гепатит (воспалительное заболевание печени);
- гепатомегалию (патологическое увеличение печени в размерах) и спленомегалию (патологическое увеличение селезенки в размерах);
- абсцессы (гнойные образования) в печени;
- добро- и злокачественные опухоли;
- метастазы рака других органов.
С помощью радионуклидной диагностики проводится оценка состояния органов брюшной полости после травм живота, моторики всего желудочно-кишечного тракта, концентрационной и двигательной способности желчного пузыря, проходимости желчных путей и кишечника.
Применение методов радионуклидного обследования для выявления рака
Радиоизотопная диагностика в онкологии позволяет определять:
- наличие опухоли в исследуемом органе (в том числе и на начальной стадии ее развития, когда отчетливые изменения в структуре органа не визуализируются, но функция его уже нарушена);
- доброкачественное это или злокачественное новообразование (дифференциальная диагностика);
- стадию развития опухоли;
- точное место локализации новообразования;
- наличие метастазов в регионарных (расположенных рядом) лимфоузлах в других органах.
Сцинтиграфия, ОФЭКТ и ПЭТ позволяют проводить анализ эффективности лечения рака на разных стадиях его развития и своевременно обнаруживать рецидивы.
Использование радиоизотопного обследования в других сферах медицины
Радионуклидная диагностика, кроме перечисленных возможных областей, применяется для:
- исследования анатомическо-функциональных особенностей почек (обеих сразу и каждой в отдельности);
- оценки обмена веществ в костной ткани в местах травм, определения наличия метастазов рака в разных участках скелета;
- выявления тромбоэмболии (закупорки) легочной артерии и ее ответвлений, изучения характера кровотока в легких при различных заболеваниях этого парного органа;
- исследования функциональной активности щитовидной железы;
- оценки кровотока в головном мозге при инсульте, черепно – мозговых травмах, психических расстройствах, эпилепсии.
Этот вид исследования используется для определения степени проходимости кровеносных и лимфатических сосудов, а также для изучения их анатомических особенностей.
Как подготовиться к исследованию
Перед процедурой пациенту нужно пройти специальную подготовку, особенности которой зависят от того, какой именно орган будет исследоваться. К примеру, если планируется радиоизотопная диагностика щитовидной железы, запрещено на протяжении как минимум трех месяцев до обследования делать рентгеновское исследование, принимать лекарственные средства, содержащие йод.
Исследование щитовидной железы, желудка, кишечника, печени, желчного пузыря проводится натощак (нельзя ужинать и завтракать пред процедурой). Перед радионуклидной диагностикой головного мозга, легких специальная подготовка не требуется.
За час до исследования всех без исключения органов и их систем пациенту рекомендуется выпить от 1 до 1,5 л негазированной воды.
Жидкость поможет предотвратить задержку радиоактивного вещества в организме и ускорит его выведение с мочой.
Непосредственно перед процедурой следует опорожнить мочевой пузырь.
Порядок проведения радиоизотопной диагностики
Сразу пациенту вводят радиофармпрепарат, а потом помогают ему принять такое положение тела, в котором удастся получить качественное изображение исследуемого органа. В течение первой минуты делают 1 кадр в секунду, а на протяжении следующих 20 минут – 1 кадр в минуту, чтобы посмотреть, как распределяется радиоактивное вещество. Диагностика длится около 20-40 минут, пока основная часть радиофармпрепарата не будет выведена вместе с мочой. В некоторых случаях с этой целью проводят катетеризацию мочевого пузыря.
Преимущества и недостатки радионуклидного исследования
Данная разновидность лучевой диагностики обладает спектром достоинств, среди которых следует назвать:
- неинвазивность;
- высокую информативность;
- универсальность (то есть использование для обследования различных органов и их систем);
- уникальность получаемых данных (сведения об анатомических особенностях органов в сочетании с информацией об их функционировании);
- минимальный риск аллергических реакций и прочих осложнений, отсутствие необходимости в специальной реабилитации пациента после процедуры.
Главными недостатками радиоизотопной диагностики считаются высокая стоимость, а также наличие (хоть и незначительное) лучевой нагрузки на организм пациента. Радиофармпрепараты здоровью взрослого человека вреда не причиняют, но способны негативно сказаться на развитии плода в утробе матери и на неокрепшем детском организме.
Итог
Радиоизотопная диагностика – прогрессивный метод исследования, неоспоримое преимущество которого состоит в предоставлении медикам данных об анатомическом и функциональном состоянии как отдельных органов, так и всего организма в целом. Лучевая нагрузка, которую получает пациент во время процедуры, ниже, чем при рентгенологическом исследовании. Благодаря высокому уровню информативности радионуклидной диагностики у пациентов есть шанс на полное выздоровление при своевременно начатом лечении обнаруженной болезни.
Лучевая диагностика радиационного поражения печени
а) Терминология:
• Лучевое поражение печени: синдром, характеризующийся возникновением асцита при отсутствии желтухи в промежутке от двух недель до четырех месяцев после облучения
б) Визуализация радиационного поражения печени:
• Четкая демаркационная линия, отделяющая патологически измененную паренхиму печени от здоровой ткани и соответствующая границам зоны облучения или распределения микросфер иттрия-90 при внутрисосудистом введении
• На КТ обнаруживаются «географические» очаги, хорошо отграниченные от окружающих тканей:
о Кровеносные сосуды внутри них не выглядят патологически измененными, объемное воздействие отсутствует
о Обычно выглядят гиподенсными как при нативной КТ, так и при КТ с контрастным усилением
о Однако в структуре очагов возможно наличие как гипер-, так и гиповаскулярного компонента
• Плотность поврежденной паренхимы печени, выглядящей гиподенсной в портально-венозной фазе, может увеличиваться и длительно сохраняться таковой в отсроченной фазе:
о Что обусловлено уменьшением сосудистой перфузии, снижением венозного оттока, и, как следствие, стазом контраста
• Для дифференциальной диагностики радиационно-индуцированного поражения печени и стеатоза лучше всего подходит МРТ, в особенности Т1 ВИ и GRE в «фазе» и «противофазе»
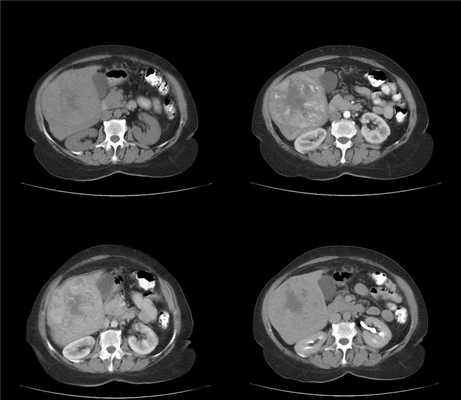
(Слева) На аксиальной КТ с контрастным усилением определяется вертикально ориентированный гиподенсный участок, распространяющийся от краниальных до каудальных отделов печени, отграниченный прямой демаркационной линией, обусловленный лучевой терапией по поводу лимфомы.
(Справа) На аксиальной КТ с контрастным усилением визуализируется ровная демаркационная линия, отделяющая поврежденный участок в левой доле печени, обусловленный лучевой терапией по поводу рака пищевода. Обратите внимание, что левая печеночная вена, проходящая в поврежденном участке печени, не выглядит патологически измененной. (Слева) На аксиальной КТ определяется снижение плотности задних сегментов печени, отделенных от не измененной паренхимы четкой демаркационной линией. Гиподенсные участки паренхимы соотносятся с зоной, подвергнутой эмболизации с использованием микросфер иттрия-90, по поводу гепатоцеллюлярного рака. Обратите внимание, что задняя ветвь правой долевой ветви воротной вены, проходящая внутри измененного участка паренхимы печени, выглядит обычно.
(Справа) На КТ с контрастным усилением у этого же пациента визуализируются жизнеспособные сателлитные очаги ГЦР в передних сегментах печени, которые не подвергались облучению.
в) Дифференциальная диагностика:
• Очаговый стеатоз
• Инфаркт печени
г) Патология:
• Радиационно-индуцированное поражение печени может возникать у пациентов, получивших при дистанционной лучевой терапии лучевую нагрузку 1200 рад единовременно либо 4000-5500 рад фракционно в течение шести недель
• Введение в печеночную артерию стеклянных микросфер с иттрием-90:
о Обеспечивает облучение участка печени, кровоснабжаемого артерией, с периодом полураспада 64 часа
д) Клинические особенности:
• Полное клиническое восстановление обычно наблюдается в течение 60 дней, однако может также обнаруживаться перманентное уменьшение количества гепатоцитов, накопление жира, фиброз, облитерация центральных (дольковых) вен
КТ, МРТ признаки радиационного поражения печени
а) Терминология:
1. Аббревиатура:
• Радиационно-индуцированное повреждение печени (РИПП)
2. Определения:
• Синдром, характеризующийся возникновением асцита при отсутствии желтухи в промежутке от двух недель до четырех месяцев после облучения печени
• Одна из форм венооклюзионной болезни печени, обусловленная фиброзом и облитерацией терминальных печеночных венул, что приводит к постсинусоидальной обструкции
б) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Четкая демаркационная линия, отделяющая нормальную паренхиму печени от патологически измененной, соответствующая границам зоны облучения или внутрисосудистого распределения микросфер иттрия-90
(Слева) На КТ в артериальной фазе контрастного усиления у мужчины 66 лет с известным гепатоцеллюлярным раком (до начала терапии) визуализируется неравномерно гиперваскулярное образование в печени.
(Справа) На КТ в портально-венозной фазе у этого же пациента не определяется каких-либо патологических изменений со стороны паренхимы печени. (Слева) На КТ без контрастного усиления, выполненной повторно во время лечения (внутриартериального введения микросфер иттрия-90), определяется гиподенсный участок клиновидной формы, расположенный в зоне кровоснабжения правой долевой ветви печеночной артерии, и соответствующий распределению радиоактивных микросфер.
(Справа) На КТ в артериальной фазе у этого же пациента сохраняется клиновидный участок лучевого повреждения печени. Обратите внимание на ровную демаркационную линию, ограничивающую повреждение. (Слева) На КТ в венозной фазе контрастного усиления у этого же пациента определяется снижение васкуляризации узла ГЦР по сравнению с КТ-исследованием, выполненным до лечения. Обратите внимание на сохраняющуюся ровную демаркационную линию, отграничивающую сегменты печени, подвергнутые облучению.
(Справа) На заключительной КТ в венозной фазе контрастного усиления у этого же пациента визуализируются интактные кровеносные сосуды, проходящие внутри зоны радиационно-индуцированного поражения печени. Какой-либо клинической симптоматики у пациента не обнаруживается, имеет место лишь легкое повышение уровня печеночных трансаминаз.
2. КТ признаки радиационного поражения печени:
• КТ без контрастного усиления:
о Четко отграниченная «полоска» низкой плотности, соотносящаяся с зоной облучения:
- Скорее всего, обусловленная некрозом гепатоцитов, отеком и стеатозом
о При выраженных застойных явлениях в печени могут обнаруживаться очаговые («пятнистые») зоны конгестии, имитирующие опухолевое поражение
о На фоне стеатоза пораженный участок печени может выглядеть гиперденсным:
- Вследствие отсутствия жира в гепатоцитах, подвергшихся облучению, или регионарного отека
о Со временем края облученного участка становятся все более неровными и нечеткими (вследствие регенеративных изменений паренхимы печени на периферии):
- В конечном итоге участок радиационно-индуцированного поражения печени претерпевает атрофические изменения
• КТ с контрастным усилением:
о Характер контрастного усиления облученного участка печени может различаться в зависимости от патологических изменений печени, имевших место до лучевой терапии
о В острой фазе может обнаруживаться интенсивное контрастное усиление паренхимы печени, поврежденной при лучевом воздействии:
- Вследствие усиления артериального и снижения портального кровотока
о Участок поврежденной паренхимы печени, который в портально-венозной фазе контрастного усиления имеет низкую плотность, в отсроченной фазе может становиться гиперденсным и оставаться таковым длительное время:
- Что обусловлено ↓ перфузии, уменьшением венозного кровотока, и последующим стазом контрастного вещества
о Сосуды печени сужены и имеют неправильную форму вследствие застойных изменений в синусоидах и перисинусоидального отека:
- Кровеносные сосуды, проходящие в поврежденном участке, не выглядят патологически измененными, т. к. объемное воздействие на них отсутствует
3. МРТ признаки радиационного поражения печени:
• Т1 ВИ:
о Гипоинтенсивный сигнал
• Т2 ВИ:
о Гиперинтенсивный сигнал
4. Рекомендации по визуализации:
• Лучший метод диагностики:
о Нативная КТ или КТ с контрастным усилением, или МРТ (Т1 ВИ GRE в «фазе» и «противофазе»)
• Выбор протокола:
о МРТ, особенно Т1 ВИ в «фазе» и «противофазе» лучше всего позволяет дифференцировать радиационно-индуцированное поражение печени и стеатоз
(Слева) На КТ в артериальной фазе контрастного усиления у мужчины 66 лет с известным гепатоцеллюлярным раком (до начала терапии) визуализируется неравномерно гиперваскулярное образование в печени.
(Справа) На КТ в портально-венозной фазе у этого же пациента не определяется каких-либо патологических изменений со стороны паренхимы печени. (Слева) На КТ без контрастного усиления, выполненной повторно во время лечения (внутриартериального введения микросфер иттрия-90), определяется гиподенсный участок клиновидной формы, расположенный в зоне кровоснабжения правой долевой ветви печеночной артерии, и соответствующий распределению радиоактивных микросфер.
(Справа) На КТ в артериальной фазе у этого же пациента сохраняется клиновидный участок лучевого повреждения печени. Обратите внимание на ровную демаркационную линию, ограничивающую повреждение. (Слева) На КТ в венозной фазе контрастного усиления у этого же пациента определяется снижение васкуляризации узла ГЦР по сравнению с КТ -исследованием, выполненным до лечения. Обра -тите внимание на сохраняющуюся ровную демаркационную линию, отграничивающую сегменты печени, подвергнутые облучению.
(Справа) На заключительной КТ в венозной фазе контрастного усиления у этого же пациента визуализируются интактные кровеносные сосуды, проходящие внутри зоны радиационно-индуцированного поражения печени. Какой-либо клинической симптоматики у пациента не обнаруживается, имеет место лишь легкое повышение уровня печеночных трансаминаз.
в) Дифференциальная диагностика:
1. Очаговый стеатоз:
• Может представлять собой «географический» очаг, выглядеть в виде «полоски» («тяжа»), или иметь клиновидную форму
• В очаге обнаруживаются сохранные кровеносные сосуды, заполняющиеся контрастом
• На МРТ (GRE в «противофазе) наблюдается подавление сигнала
2. Инфаркт печени:
• «Географический» (сегментарный) участок низкой плотности с ровными краями, не накапливающий (или неравномерно накапливающий) контраст
г) Патология:
1. Общая характеристика:
• Этиология:
о Радиационно-индуцированное поражение печени может возникать у пациентов, получивших при дистанционной лучевой терапии лучевую нагрузку 1200 рад единовременно либо 4000-5500 рад в течение нескольких сеансов на протяжении 6 недель
о Инъекция в печеночную артерию стеклянных микросфер иттрия-90
- Обеспечивает облучение участка печени, кровоснабжаемого артерией, с периодом полураспада 64 часа
2. Микроскопия:
• Веноокклюзионная болезнь
• Выраженные панлобарные застойные изменения, гиперемия, кровоизлияния, легкие пролиферативные изменения сублобарных центральных вен:
о Стаз, обусловленный повреждением этих вен
(Слева) На аксиальной КТ с контрастным усилением у мужчины 65 лет, которому проводилась лучевая терапия по поводу рака пищевода с метастазами в левую долю печени, визуализируются гипо- и гиперденсные очаги в левой и хвостатой долях печени, отграниченные от неизмененной паренхимы печени четкой демаркационной линией, определяющей границы области облучения.
(Справа) На КТ в венозной фазе контрастного усиления у этого же пациента визуализируются очаги различной плотности в зоне облучения, не соответствующей анатомическому сегментарному делению печени, обусловленные радиационным гепатитом. (Слева) На аксиальной КТ с контрастным усилением у женщины 26 лет с известным раком носоглотки и метастазами в печень визуализируется гиподенсная «полоска» в центральных отделах печени. Обратите внимание на отсутствие объемного воздействия на крупные ветви воротной и печеночной вен, расположенных внутри измененного участка печени.
(Справа) На этом же КТ срезе в «костном» электронном окне определяется один из нескольких метастазов в позвоночник, по поводу которых также осуществлялась дистанционная лучевая терапия. (Слева) На корональной КТ у этой же пациентки визуализируется гиподенсная «полоска» в печени, соотносящаяся с радиационно-индуцированным поражением ее паренхимы. Обратите внимание на отсутствие объемного воздействия на кровеносные сосуды в пораженном участке, а также на метастазы в печени.
(Справа) На аксиальной КТ с контрастным усилением, выполненной спустя четыре месяца этой же пациентке, определяется регресс изменений, обусловленных облучением, наряду с уменьшением размеров одного из метастазов в печени, что, скорее всего, является эффектом химиотерапии, а не лучевого воздействия.
д) Клинические особенности:
1. Проявления:
• Гепатомегалия, асцит, слабость, утомляемость
2. Демография:
• Эпидемиология:
о Радиационно-индуцированное поражение печени в настоящее время обнаруживается чаще, что связано с использованием объемного планирования лечения и проведением трансплантации костного мозга с облучением всего тела
3. Течение и прогноз:
• Полное клиническое разрешение обычно происходит в течение 60 дней:
о Наблюдается или полное исчезновение изменений или атрофия пораженных сегментов печени, реже цирроз
е) Диагностическая памятка. Следует учесть:
• Факторы, от которых зависит выраженность поражения печени:
о Объем облученной ткани печени, размер фракции облучения, использование цитостатиков, нутриционный статус
ж) Список использованной литературы:
1. Jung J et al: Radiation-induced liver disease after stereotactic body radiotherapy for small hepatocellular carcinoma: clinical and dose-volumetric parameters. Radiat Oncol. 8:249, 2013
2. Ng SC et al: Patient dosimetry for 90Y selective internal radiation treatment based on 90Y PET imaging. J Appl Clin Med Phys. 14(5):212-21, 2013
3. Tao C et al: Improved radiotherapy for primary and secondary liver cancer: stereotactic body radiation therapy. Anticancer Res. 32(2):649-55, 2012
Лучевая диагностика гепатоцеллюлярного рака

Гепатоцеллюлярный рак является наиболее распространённой первично злокачественной опухолью печени. Он чаще всего возникает на фоне цирроза как алкогольной, так и вирусной этиологии. ГЦР является пятым по распространённости злокачественным новообразованием в мире и третьей по частоте причиной смерти от рака (после рака лёгких и желудка). Заболеваемость ГЦР растет, что в значительной степени объясняется повышением уровня инфицированности гепатитом С.
К факторам риска относятся:
- инфицированность гепатитом B (HBV): 10% 5-летний кумулятивный риск;
- инфицированность гепатитом С (HCV): 30% 5-летний совокупный риск;
- алкоголизм: 8% 5-летний кумулятивный риск;
- билиарный цирроз: 5% 5-летний кумулятивный риск;
- врождённая атрезия желчных путей;
- контакт с некоторыми токсическими веществами (афлотоксины), а также потребление лекарственных средств (метилдофа, изониазид, цитостатики и т. д.);
- врождённые нарушения обмена веществ:
- гемохроматоз: 20% 5-летний кумулятивный риск,
- дефицит альфа-1-антитрипсина,
- дефицит галактозо-1-фосфат-уридилтрансферазы,
- болезни накопления гликогена типа 1,
- болезнь Вильсона,
- тирозинемия типа I;
ГЦР обычно диагностируется в среднем возрасте или у пожилых (в среднем 65 лет) и чаще встречается у мужчин (в 75% случаев). Однако опухоль также может встречаться в педиатрической практике; это вторая по распространённости у детей первично-злокачественная опухоль печени после гепатобластомы. Так как ГЦР чаще всего проявляется на фоне цирроза, не лишним будет описать типичную КТ/МРТ картину этого заболевания.
Общими для всех методов признаками являются:
- гетерогенность структуры по типу мелко-/крупноочаговой нодуллярности (за счёт присутствия регенераторных узлов) или септальной перестройки;
- сегментарная гипертрофия/атрофия:
- гипертрофия хвостатой доли и боковых сегментов левой доли (сегменты II и III),
- атрофия задних сегментов (VI и VII) правой доли;
При КТ:
- регенераторные узлы (большинство) изоденсны остальной ткани печени;
- сидерические узлы (меньшинство) гиперденсы вследствие накопления в них железа;
- может определяться неровность края печени;
- признаки портальной гипертензии:
- расширение портальной вены;
- портальный венозный тромбоз.
При МРТ:
- на T1 обычно изоинтенсивны, иногда слегка гиперинтенсивны, не наблюдается артериального накопления и «вымывания»;
- на T2 : обычно изоинтенсивны, гипоинтенсивные сидерические узлы;
- узлы низкой степени дисплазии будут напоминать регенераторные узлы;
- узлы высокой степени дисплазии очень схожи с высокодифференцированым ГЦР небольших размеров — отличить их бывает невозможно даже при гистологическом исследовании.
На фоне нерезко выраженых цирротических изменений в виде гетерогенности структуры и неровности контуров печени визуализуется крупное (более 2 см) образование, изоденсное в нативную фазу. В артериальную фазу оно демонстрирует гетерогенное накопление контраста (выше чем паренхима печени). Структура мозаичная, в центре образования участок пониженной плотности - вероятно, центральный некроз. Вокруг образования гиперденсный ободок, выраженый в портовенозную фазу. В отсроченной фазу образование гиподенсно по отношению к окружающей паренхиме печени.
Морфологически ГЦР может быть представлен очаговой, многоочаговой и диффузной формами. В большинстве случаев он не проявляется какими-либо симптомами на фоне уже имеющихся симптомов цирроза. Поэтому важно скрининговое наблюдение для пациентов с циррозом и гепатитами С и В — оно позволяет выявлять ГЦР на ранней стадии.
Радиологами часто используется система LI-RADS (Liver Imaging Reporting and Data System), которая содержит стандартную терминологию и специально разработана для определения рисков ГЦР и дифференциальной диагностики ГЦР с другими злокачественными образованиями (в частности, с внутрипечёночной холангиокарциномой) у пациентов с циррозом печени. В LI-RADS выделяют основные и дополнительные критерии. Основные критерии:
гиперинтенсивность (накопление) в артериальную фазу, или изо- или гипоинтенсивность в артериальную фазу;
надпороговое увеличение диаметра.
Как их правильно определять?
Накопление контрастного вещества в артериальную фазу подразумевает, что образование в артериальную фазу контрастирования становится гиперденсным (КТ) или гиперинтенсивным (МРТ) по отношению к остальной паренхиме печени в эту же фазу. Если образование в артериальную фазу становится гиперинтенсивным по сравнению с тем же образованием в нативную фазу, это не считается накоплением. Накопление контрастного вещества отслеживают в позднюю артериальную фазу, т.е. когда контрастирована брюшная аорта, ветви печёночной артерии и ветви портальной вены; ветви печёночной вены не контрастированы. Трудности с измерением диаметра могут возникнуть, если образование мозаичной структуры, структуры «узел-в-узле» или «узлы-в-узле», и при наличии «капсулы».
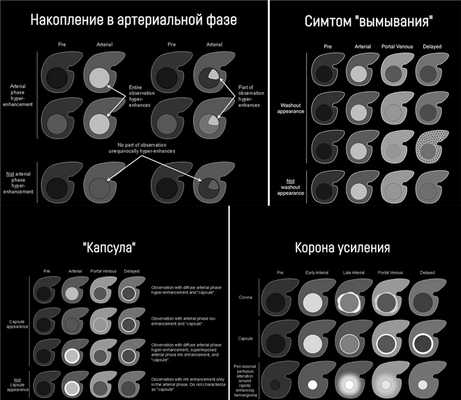
Симптом «вымывания» означает, что в портовенозную (во время наиболее выраженного контрастирования портальной вены; пикового контрастного накопления паренхимой печени и начального контрастирования ветвей печёночной вены) или отсроченную (в которой умеренно контрастированы вены печени и её паренхима) фазы образование становится гипоинтенсивным на фоне окружающей паренхимы печени. Здесь действует то же правило: если образование стало менее интенсивно по сравнению с собой в артериальную фазу, но не по отношению к паренхиме — это не симптом «вымывания».
Если образование накопило контраст в артериальную фазу, а в более поздние фазы выглядит изоинтенсивно паренхиме печени, это называют симтомом «выцветания» (fade). Термин «капсула» при визуализации соотносится с наличием как капсулы, так и псевдокапсулы у опухоли. «Капсула» визуализируется как ровный гладкий ободок по периферии образования, который усиливается в портовенозной или отсроченной фазе и является более толстым или более заметным, чем у ободки фоновых цирротических узелков.
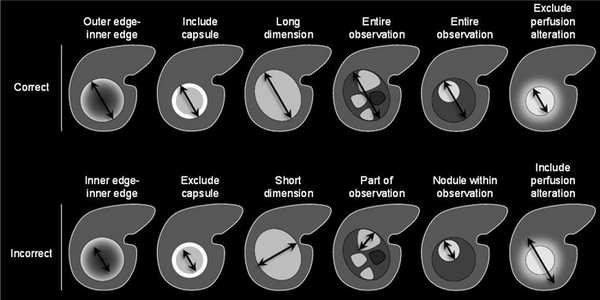
Надпороговое увеличение диаметра означает:
увеличение диаметра ≥50% менее чем за 6 месяцев,
увеличение ≥100% более чем за 6 месяцев,
появление нового образования размером 10 мм и более,
критерий увеличения выше пороговых значений не применим к диффузному поражению,
при сравнении измерения должны проводиться в одинаковых последовательностях/фазах, например, сравнивать Т2 только с другим Т2.
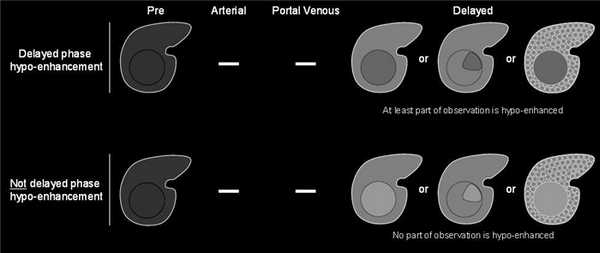
указывающие на ГЦР:
- умеренная гиперинтенсивность на Т2,
- на диффузно-взвешенных изображениях гипоинтенсивность при низких и высоких значениях b-value, гипоинтенсивность на картах ИКД (истинного коэффициента диффузии),
- корона усиления,
- мозаичная структура,
- структура «узла-в-узле»,
- признаки жирового отложения в образовании,
- признаки отложения железа менее выражены в образовании,
- признаки жирового гепатоза менее выражены в образовании,
- признаки кровотечения,
- увеличение диаметра образования, но меньше пороговых значений;
указывающие на доброкачественное образование:
- выраженная гомогенная гиперинтенсивность в Т2,
- выраженная гомогенная гипоинтенсивность в T2 или T2,
- неизменённые сосуды печени,
- образование накапливает контраст параллельно остальной паренхиме печени,
- уменьшение диаметра образования,
- стабильность диаметра на протяжении двух лет и более.
Корона усиления (corona enhancement) обозначает чаще усиление неровных, нечётких контуров вокруг образования, которое проявляется в позднюю артериальную фазу и становится изоденсным в портовенозную или отсроченную фазу. Этот симптом считается отображением раннего вымывания контрастного вещества из образования. Его редко наблюдают во время обычного четырёхфазного сканирования, чаще — при серии сканов в артериальную фазу. Если ободок усиления остается гиперинтенсивным в поздние фазы, его считают капсулой. Корону усиления при ГЦР следует дифференцировать с нарушением перфузии, асоциированном с быстро накапливающей контраст гемангиомой. Если КТ/МРТ картина более типична для гемангиомы, этот симптом не учитывается.
Система классификации
Основные критерии часто приводят непосредственно к присвоению балльной оценки LI-RADS. Если остаются сомнения,картину могут прояснить дополнительные критерии.

Дополнительные критерии, указывающие на ГЦР, могут быть использованы для повышения степени на одну или несколько LR-категорий, но не для присвоения LR5 категории. Это правило введено для того, чтобы сохранить соответствие между классификациями LI-RADS и OPTN (Organ Procurement and Transplantation Network). С помощью дополнительных критериев, указывающих на доброкачественный процесс, можно понизить степень на одну и больше категорий от LR5 до LR1. Эти критерии радиолог использует на свое усмотрение, исходя из общей лучевой и клинической картин.
Категории LI-RADS включают в себя: LR1-LR5, LR5V («опухоль-в-вене»), LR5 TREATED (после лечения) и LR OM (другое злокачественное образование). LR1 (100% вероятность доброкачественного образования) ставится, когда радиолог видит картину, типичную для (например):
сливного фиброза печени;
или другого доброкачественного образования.
Категория LR1 не включает в себя такие доброкачественные образования как фокальная нодуллярная гиперплазия (из-за сложностей её дифференциальной диагностики с ГЦР) и гепатоцелюлярная аденома (так как она крайне редко встречается при циррозе). Образование, которое редуцировалось само по себе в отсутствии лечения, тоже определяется как LR1.
К категории LR2 (вероятно доброкачественное) относятся образования, имеющие несколько нетипичный для доброкачественных вид, но все же не выглядящие злокачественными, например киста с перегородкой. Также категория LR2 присваивается цирроз-ассоциированным узлам печени, которые отвечают всем следующим критериям:
Изоинтенсивный другим фоновым узелкам во всех фазах.
Отличается от фоновых узелов по одному или нескольким из признаков:
отчетливо больше, чем другие фоновые узелки;
умеренно гиперденсны на КТ;
умеренно гиперинтенсивны на Т1;
умеренно гипоинтенсивны на Т2 или Т2* или умеренно или выраженно гиперинтенсивны на T2 или T2.
Узелки, которые не соответствуют всем этим критериям, классифицируются как LR3 или выше.
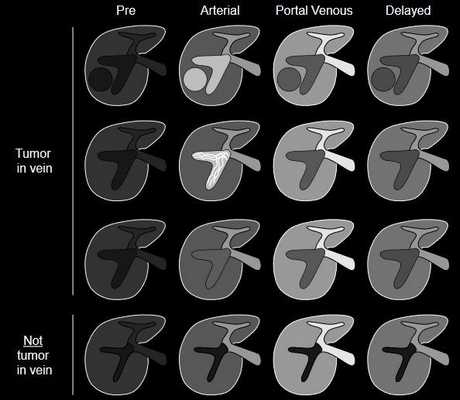
Категория LR5V используется для образования, проросшего в просвет вены. Радиологически оно проявляется как (см. схему):
Оклюзия и расширение вены, гипер- изо- или гиподенсное в артериальную фазу;
Гипо- или изоденсное в портовенозную и отсроченную;
Может присутствовать мягкотканное образование, ассоциированное с окклюзией, но его присутствие необязательно;
Могут определяться гиперденсные полосы в артериальную фазу (симптом “thread-and-streak”).
Опухолевую инвазию следует отличать от не-опухолевого тромбоза, при котором вена не будет выглядеть расширенной и не будет демонстрировать контрастного накопления ни в одну из фаз.
Категория LR5TREATED присваивают в случае:
Подтвержденного ГЦР после эмболизации или абляции, вне зависимости от успешности лечения;
Категория LR5TRAETED не присваивается:
Образованиям категории LR4 и ниже после эмболизации или абляции;
Подтвержденному ГЦР после системной терапии или
Категория OM и дифференциальная диагностика
ГЦР – наиболее распространенное злокачественное образование, возникающее на фоне цирроза. Однако, выявленные изменения следует дифференцировать со следующими злокачественными образованиями:
Посттранплантационная лимфопролиферативная болезнь.
Факторы риска развития холангиокарциномы мало отличаются от таковых для ГЦР. Биохимические маркеры ХГЦ: СА 19-9 (углеводный антиген 19-9) и CEA (карциноидоэмбриональный антиген). При визуализации для ХГЦ характерны:
Только кольцевидное усиление в артериальную фазу;
Усиление в портовенозную и отсроченную фазы;
Нерезко выраженные рестриктивные изменения в DWI;
«Втяжение» ткани печени к образованию;
Билиарная обструкция, при чем степень обструкции не соответствует размерам образования.
Первичные лимфомы печени крайне редки. Чаще встречаются вторичные поражения при системном процессе. Следует помнить, что лимфомы чаще возникают на фоне иммуносупрессии. Увеличение абдоминальных лимфоузлов может навести на правильный диагноз.
Посттранплантационная лимфопролиферативная болезнь – одно из наиболее частых злокачественных новообразований у пациентов с трансплантацией в анамнезе. Ее развитие ассоциировано с иммуносупрессией и инфицированием вирусом Эпштейн-Барра. Печень – наиболее частая локализация экстранодального поражения. Метастазы редко встречаются на фоне цирротического изменения. Необходимо указать первичную опухоль. При визуализации более вероятны следующие признаки:
Усиление в портовенозную/отсроченную фазы;
Частичное или кольцевидное усиление в артериальную фазу;
Центральный некроз или ишемия;
Нерезко выраженные рестриктивные изменения в DWI.
В зависимости от присвоенной категории, ACR рекомендовано:
LR1: продолжать скрининг в обычном режиме;
LR2: продолжать скрининг в обычном режиме;
LR3: тщательное наблюдение: отслеживать изменения размера, стабильности и клинических проявлений;
LR4: тщательное наблюдение, дополнительная визуализация, биопсия или лечение;
LR5: лечение без биопсии, радиологическое ТNM-стадирование.
Применяя LI-RADS в МРТ, следует помнить, что эта классификация разработана для использования внутриклеточных гадолиний-содержащих контрастных веществ (например, Гадавист). Использование гепатобилиарного контраста (Эовист, Примовист) изменит интерпретацию МРТ-картины.
Ведение пациентов выявленными объемными поражениями на фоне цирроза
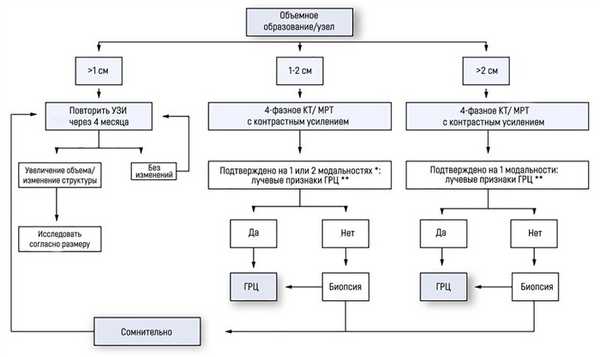
Гайдлайны EASL–EORTC (European Association for the Study of the Liver – European Organisation for Research and Treatment of Cancer) рекомендуют следующую тактику в случае, если УЗИ выявило очаговое поражение у пациента с циррозом:
если найденный узел менее 1 см диаметром, наблюдение каждые 4 месяца на протяжении первого года; затем – каждые 6 месяцев;
при узле 1-2 см диаметром диагноз базируется на неинвазивных методах визуализации или данных биопсии. Если последние оказались неубедительны или паттерн контрастного накопления при КТ/МРТ изменился за время исследования, рекомендована вторая биопсия;
при узле более 2 см диаметром диагностика должна базироваться на неинвазивных методах. Биопсия проводится в случае неубедительных или нетипичных данных КТ/МРТ.
EASL–EORTC называет типичные паттерны, наличия которых при визуализации достаточно для постановки диагноза: образование гиперваскулярно в артериальную фазу и демонстрирует симптом «вымывания» в портовенозную и/или отсроченную фазы. УЗИ с контрастным усилением не рекомендовано для диагностики ГЦР из-за иных характеристик контрастных веществ – они не покидают сосудистое русло. Определение уровня альфа-фетопротеина было исключено из протокола диагностики, так как он редко возрастает на ранней стадии ГЦР.
Источники
Радиационно-индуцированное поражение печени
Последнее время в общей структуре заболеваний значительную долю занимают патологии гепатобилиарной системы. Помимо токсических поражений отрицательное влияние на печень могут оказывать также другие неблагоприятные факторы, в частности, влияние ионизирующей радиации. Печень, которая в покое обладает небольшой пролиферативной активностью, традиционно относили к радиорезистентным органам, однако многочисленные исследования с использованием различных видов ионизирующих излучений в широком диапазоне доз показали не только чувствительность печени к лучевому воздействию, но и значительные нарушения регенерационных процессов.
Представление о радиационно-индуцированном поражении печени в основном основано на клинических наблюдениях и результатах гистопатологических исследований. На основе клинических наблюдений, многими авторами были разработаны экспериментальные модели для исследования механизма развития радиационно-индуцированного поражения печени. Создание экспериментальных моделей на животных имеет важное значение для лучшего понимания патогенеза и молекулярных механизмов развития патологии.
Печень – самая крупная железа позвоночных. У человека она составляет около 2,5% от массы тела и занимает центральное место в процессах углеводного, белкового, липидного, пигментного метаболизма, а также в процессах детоксикации многочисленных веществ, попадающих в организм, как извне, так и из кишечника и, в частности, путем их окисления, конъюгирования, декарбоксилирования.
В последнее время в общей структуре заболеваний значительную долю занимают патологии гепатобилиарной системы, заболевания печени стоят на восьмом месте среди причин смертности населения репродуктивного возраста в разных странах. Одной из наиболее распространенных причин данных заболеваний являются воздействия гепатотоксических агентов. К ксенобиотикам, поступающим в организм человека и животных и способным вызвать поражения печени, относятся производственные токсикаты, медикаментозные средства, алкоголь, вещества, загрязняющие окружающую среду [1, 2]. Помимо токсических поражений отрицательное влияние на печень могут оказывать также другие неблагоприятные факторы, в частности, влияние ионизирующей радиации.
Печень традиционно относили к радиорезистентным органам, однако многочисленные исследования с использованием различных видов ионизирующих излучений в широком диапазоне доз показали не только чувствительность печени к лучевому воздействию, но и значительные нарушения регенерационных процессов.
Острому радиационному воздействию ткань печени подвергается не только при лучевой терапии злокачественных новообразований гепатобилиарной системы, но и при лучевой терапии раковых заболеваний желудочно-кишечного тракта из-за ее близкого расположения и больших размеров [3, 4]. Печень также может подвергаться воздействию излучения во время подготовки к аллогенной трансплантации костного мозга или гемопоэтических стволовых клеток [5]. Радиационно-индуцированное поражение тканей печени связывают с многими осложнениями, встречающимися после лучевой терапии, при этом отмечается ухудшение способности к гепатоцеллюлярной регенерации и необратимая печеночная недостаточность [6]. Хотя патофизиологические характеристики радиационно-индуцированного поражения печени у людей относительно хорошо охарактеризованы, точные механизмы развития этой патологии остаются в значительной степени мало изученными. В результате отсутствуют эффективные терапевтические меры для предотвращения и терапии прогрессирования данной патологии.
Патогенез радиационно-индуцированного поражения печени включает комплексные и многоклеточные реакции, связанные с сосудистыми изменениями, усиление синтеза коллагена и последовательную активацию ключевых факторов роста и цитокинов, таких как фактор некроза опухолей альфа (TNF-α), трансформирующий фактор роста бета (TGF-β) и морфогенетический фактор – фактор hedgehog (Hh ), которые являются важными регуляторами в реакции восстановления на повреждение печени [7]. Радиационное воздействие вызывает острое или хроническое поражение печени. Ранние эффекты облучения включают повреждение ДНК, окислительный стресс и образование реактивных форм кислорода, приводящее к гепатоцеллюлярному апоптозу и острым воспалительным реакциям в облученных тканях [8]. Хотя гепатоциты считаются более радиорезистентными, чем непаренхимные клетки, индуцированное радиацией высвобождение TNF-α клетками Купфера увеличивает восприимчивость гепатоцитов к радиационно-индуцированному апоптозу и в конечном итоге индуцирует гепатоцеллюлярную смерть [9].
Массовая гибель гепатоцитов, вызванная повторными или однократным острым воздействием, также связана с компенсаторной пролиферацией миофибробластических звездчатых клеток печени, активация которых, является ключевым клеточным явлением, лежащим в основе фиброза печени [7]. При повреждении печени звездчатые клетки печени трансдифференцируются от покоящихся в активированные миофибробластические звездчатые клетки, основные коллагенообразующие клетки в печени. Активация миофибробластических звездчатых клеток также считается важным процессом в развитии радиационно-индуцированного поражения печени, поскольку эти клетки обладают высокой радиочувствительностью и накапливаются в печени пациентов после лучевой терапии. Так же в гистологических образцах печени человека после облучения, наблюдали повреждение и апоптоз синусоидных эндотелиальных клеток, что ведет к нарушениям микроциркуляторного кровотока, и как следствие – к повреждению гепатоцитов. Повреждение эндотелия печеночных сосудов активирует коагуляционный каскад и приводит к осаждению фибрина и образованию сгустков в центральных венах и печеночных синусоидах. Последующая гипоксия приводит к гибели гепатоцитов и атрофии внутренней печеночной пластинки, способствуя дисфункции печени [10]. На более поздних стадиях фиброзная реакция в синусоидах может привести к облитерации центральных вен, что приводит к веноокклюзионной болезни печени. Таким образом, при радиационно-индуцированном поражении печени происходит сложное и динамическое взаимодействие между различными типами клеток печени.
Представление о радиационно-индуцированном поражении печени в основном основано на клинических наблюдениях и результатах гистопатологических исследований. На основе клинических наблюдений, были разработаны экспериментальные модели для исследования механизма развития радиационно-индуцированного поражения печени. Создание экспериментальных моделей на животных имеет важное значение для лучшего понимания патогенеза и молекулярных механизмов развития патологии. Наиболее широко используются в подобных исследованиях лабораторные мыши и крысы, несколько в меньшей степени используются обезьяны, собаки и кролики. Однако экспериментальные модели на лабораторных животных в большинстве исследований не показали сходных патологических характеристик для радиационно-индуцированного поражения печени у человека. Кроме того, существует ряд трудностей при сравнении и обобщении данных полученных в экспериментах на животных: это не только значительные межвидовые различия, но и различная чувствительность линий лабораторных животных, исследователями используются разные способы и дозы облучения, разные комбинированные радиационно-химические воздействия, время наблюдения и так далее. Эти различия в проведении экспериментов приводят к различиям в результатах исследований, что препятствует пониманию механизма развития радиационно-индуцированного поражения печени [11].
Грызуны имеют много преимуществ в качестве экспериментальных моделей, таких как их анатомическое, физиологическое и генетическое сходство с людьми. Лабораторные крысы наиболее часто используются в экспериментальных исследованиях радиационно-индуцированного поражения печени. Наиболее распространенными линиями крыс являются Sprague-Dawley (SD) и крысы Wistar. При облучении крыс Wistar однократно в дозе 6 Гр общего облучения, было отмечено значительное увеличение в печени уровня ПОЛ и окислительного стресса, о чем свидетельствовало повышенное содержание малонового диальдегида, основного продукта перекисного окисления липидов и цитотоксического оксида азота в печени [12]. Но другими авторами было высказано замечание, что хотя облучение всего тела вызывает окислительный стресс в печени, неуместно исследовать радиационно-индуцированные печеночные реакции, потому что облучение всего тела может вызывать иммуносупрессию, эндокринную дисфункцию и множественную органную недостаточность, которые, в свою очередь, являются факторами риска поражения печени [13]. Поэтому в ряде исследований было применено локальное облучение печени, которое, по-видимому, более подходит для исследования радиационно-индуцированных эффектов в печени. При однократном облучении области брюшной полости SD-крыс в дозе 8 Гр, через 36 ч после воздействия отмечены кровоизлияния, расширение центральной вены, деструкция гепатоцитов с перинуклеарной вакуолизацией [13]. Однако, когда крыс Wistar подвергали однократному локальному облучению печени в дозе 25 Гр, через 24 и 48 ч. наблюдалось только умеренное гепатоцеллюлярное повреждение и стеатоз [14], что может свидетельствовать о разной радиочувствительности этих линий крыс.
Кроме того, доза облучения влияет на реакцию печени. Когда крысы линии SD были подвержены облучению печени в дозе 30 Гр, через 6 месяцев наблюдался радиационный фиброз печени [15]. Однако, когда крысы этой же линии подвергались облучению печени в дозе 60 Гр, фиброз печени был обнаружен уже через 8 недель после облучения. Эти наблюдения свидетельствуют о том, что фиброз печени увеличивается по мере увеличения дозы облучения.
Однако увеличение дозы облучения увеличивает вероятность летальности. Rave-Frank с соавторами [16] использовали фракционированное облучение, которое обычно используется в клинике при лучевой терапии, чтобы минимизировать поражение тканей. Когда крысы Wistar подвергались локальному облучению печени, в фракционированной дозе 2 Гр пять раз в неделю в течение 6 недель (общая доза составила 60 Гр), в облученной печени через 3 месяца отмечено повышенные уровни ALP без некроза, воспаления и фиброза. Тогда как другие авторы показали [17], что та же доза облучения SD-крыс путем однократного облучения вызывала дисфункцию печени, апоптоз гепатоцитов и фиброз через 8 недель после облучения. Эти данные свидетельствуют о том, что фракционированное облучение проявляет гораздо меньшую тканевую токсичность, чем однократное облучение. Однако для выяснения влияния однократного и фракционированного облучения на печень требуются повторные эксперименты в идентичных условиях по одному протоколу [11].
Мыши все чаще используются для создания экспериментальных моделей радиационно-индуцированного поражения печени, но в относительно меньшей степени по сравнению с крысами. При общем однократном облучении самок мышей линии C57BL/6 в дозе 20 Гр, через 1 неделю в печени животных наблюдали жировую инфильтрацию гепатоцитов, увеличение количества апоптотических клеток, а также был отмечен повышенный фиброз [18]. Другие авторы также отмечали жировую дистрофию, апоптоз клеток печени и фиброз у облученных самок в большей степени, чем у самцов мышей после общего однократного облучения в дозе 6 Гр [19]. Эта гендерная разница в радиочувствительности, влияет на результаты экспериментального радиационно-индуцированного поражения печени в моделях на животных.
У мышей, которые были подвергнуты облучению верхней области брюшной полости однократно в дозе 6 Гр, наблюдали повышенные уровни триглицеридов в печени, АЛТ, АСТ и апоптоз, жировую инфильтрацию и усиленный фиброз через 6 и 10 недель после облучения; однако у данных животных не было выявлено ни одной из гистопатологических особенностей радиационно-индуцированного поражения печени [20]. Другими авторами, при использовании локального фракционированного облучения в 6 Гр в неделю в течение 5 недель (общая доза 30 Гр) через 10 недель после курса облучения был отмечен поздний ответ, который проявлялся разрушением клеток паренхимы и значительным фиброзом, чего не было отмечено на ранних сроках [21]. Таким образом, при фракционированном локальном облучении у крыс наблюдались умеренные повреждения, тогда как в экспериментах на мышах отмечались серьезные повреждения с поздним ответом. Однако эти результаты тяжело сравнивать, поскольку виды, доза облучения, частота фракционированного излучения и последующие наблюдения, используемые интервалы времени были различны.
Хотя гепатоцеллюлярные повреждения и сопутствующий фиброз установлены и воспроизводимы при облучении крыс и мышей, но отмечено развития веноокклюзионной болезни печени и морфологических признаков радиационно-индуцированного поражения печени, которые свойственны радиационному повреждению печени у человека. Кроме того, большинство исследователей используют животных, не имеющих ни опухолей, ни хронических заболеваний или других патологий, что резко разнится с ситуацией в клинике для пациентов, получающих лучевую терапию.
Таким образом, для получения адекватных моделей радиационно-индуцированного поражения печени у грызунов должны быть установлены и оптимизированы условия эксперимента, такие как доза облучения, время экспозиции, однократное или фракционированное облучение и последующее время наблюдения. Для лучшего выяснения патогенеза радиационно-индуцированного поражения печени необходимы дальнейшие исследования в экспериментальных моделях на животных, которые бы сочетали не только радиационное воздействие, но и другие патологии.
Литература
- Ильченко, Л.Ю. Поражения печени у токсикоманов. / Л.Ю. Ильченко и др. // Гепатология — 2003. — № 2. — С. 22 — 26.
- Chow, J.H. The encyclopedia of hepatitis and other liver disesases. / J.H. Chow, C. Chow. – Facts On File, Inc., N.-York, U.S.A., — 2006. – 372 p.
- Benson R, Madan R, Kilambi R, Chander S. Radiation induced liverdisease: a clinical update. // J. Egypt Natl Canc Inst. – 2016; 28: 7–11.
- Li G, Wang J, Hu W, Zhang Z. Radiation-induced liver injury inthree-dimensional conformal radiation therapy (3D-CRT) for postoperativeor locoregional recurrent gastric cancer: risk factors and dose limitations. // PLoS ONE. – 2015; 10.
- Qiao J, Fu J, Fang T, Huang Y, Mi H, Yang N et al. Evaluation of the effectsof preconditioning regimens on hepatic veno-occlusive disease in mice afterhematopoietic stem cell transplantation. // Exp. Mol. Pathol. – 2015; 98: 73–78.
- Guha C, Sharma A, Gupta S, Alfieri A, Gorla GR, Gagandeep S et al.Amelioration of radiation-induced liver damage in partially hepatectomizedrats by hepatocyte transplantation. // Cancer Res. – 1999; 59: 5871–5874.
- Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis. // Best. Pract. Res.Clin.Gastroenterol. –2011; 25: 195–206.
- Robbins ME, Zhao W. Chronic oxidative stress and radiation-induced latenormal tissue injury: a review. // Int. J. Radiat. Biol. – 2004; 80: 251–259.
- Christiansen H, Saile B, Neubauer-Saile K, Tippelt S, Rave-Frank M, Hermann RM et al. Irradiation leads to susceptibility of hepatocytes to TNF-alpha mediated apoptosis. // Radiother Oncol. – 2004; 72: 291–296.
- DeLeve LD, Shulman HM, McDonald GB. Toxic injury to hepatic sinusoids: sinusoidal obstruction syndrome (veno-occlusive disease). // Semin. Liver. Dis. – 2002; 22: 27–42.
- Kim J., Jung Y. Radiation-induced liver disease: current understanding and future perspectives // Experimental & Molecular Medicine. – 2017. № 49. e359; doi:10.1038/emm.2017.85.
- Taysi S., Koc M., Buyukokuroglu M.E., Altinkaynak K., Sahin Y.N. Melatonin reduces lipid peroxidation and nitric oxide during irradiation-induced oxidative injury in the rat liver. // J. Pineal Res 2003; 34: 173–177.
- Ozyurt H, Ozden AS, Cevik O, Ozgen Z, Cadirci S, Elmas MA et al. Investigation into the role of the cholinergic system in radiation-induced damage in the rat liver and ileum. // J Radiat Res 2014; 55: 866–875.
- Christiansen H, Batusic D, Saile B, Hermann RM, Dudas J, Rave-Frank M et al. Identification of genes responsive to gamma radiation in rat hepatocytes and rat liver by cDNA array gene expression analysis. // Radiat Res 2006; 165: 318–325.
- Du SS, Qiang M, Zeng ZC, Zhou J, Tan YS, Zhang ZY et al. Radiation-induced liver fibrosis is mitigated by gene therapy inhibiting transforming growth factor-beta signaling in the rat. // Int J Radiat Oncol Biol Phys. – 2010; 78: 1513–1523.
- Rave-Frank M, Malik IA, Christiansen H, Naz N, Sultan S, Amanzada A et al. Rat model of fractionated (2 Gy/day) 60 Gy irradiation of the liver: long-term effects. // Radiat Environ Biophys 2013; 52: 321–338.
- Zhang J, Zhou S, Zhou Y, Feng F, Wang Q, Zhu X et al. Hepatocyte growth factor gene-modified adipose-derived mesenchymal stem cells ameliorate radiation induced liver damage in a rat model. // PLoS ONE 2014; 9: e114670.
- Wang S, Hyun J, Youn B, Jung Y. Hedgehog signaling regulates the repair response in mouse liver damaged by irradiation. // Radiat Res 2013; 179: 69–75.
- Wang S, Lee K, Hyun J, Lee Y, Kim Y, Jung Y. Hedgehog signaling influences gender-specific response of liver to radiation in mice. Hepatol Int 2013; 7: 1065–1074.
- Wang S, Lee Y, Kim J, Hyun J, Lee K, Kim Y et al. Potential role of Hedgehog pathway in liver response to radiation. PLoS ONE 2013; 8:
- Kim J, Wang S, Hyun J, Guy CD, Jung Y. Hedgehog signaling is associated with liver response to fractionated irradiation in mice. Cell Physiol Biochem 2016; 40: 263–276.

Веялкина Наталия Николаевна
© Наталия Веялкина, кандидат биологических наук, заведующая лабораторией экспериментальных биологических моделей
Читайте также:
- Мегалобластическая анемия за счет нарушения поглощения фолиевой кислоты
- Диагностика пантотенаткиназа-ассоциированной нейродегенерации по КТ, МРТ
- Отсутствие фронтальных зубов. Артикуляционное равновесие.
- Симптомы синдрома шиловидного отростка (Игла) и его лечение
- Многоплодная беременность. Частота многоплодной беременности.
