Лучевые методы обследования печени
Добавил пользователь Евгений Кузнецов Обновлено: 24.01.2026
Распознавание заболеваний печени и желчевыводяших путей в настоящее время является результатом коллективных усилий терапевтов, хирургов, лучевых диагностов, врачей-лаборантов и других специалистов. Лучевые методы занимают важное место в комплексе диагностических мероприятий.
Диффузные поражения печени. Точная диагностика диффузных поражений основывается на анамнестических и клинических данных, результатах биохимических исследований и в ряде случаев пункционной биопсии печени. Лучевые методы обычно играют лишь вспомогательную роль. Исключением является жировой гепатоз. Жир поглощает рентгеновское излучение хуже, чем остальные мягкие ткани, поэтому тень печени при жировом гепатозе на компьютерных томограммах характеризуется низкой плотностью (рис. Ш.136).
При гепатитах на рентгено-, соно- и сцинтиграммах определяется равномерное увеличение печени. Как на сонограммах, так и на сцинтиграммах
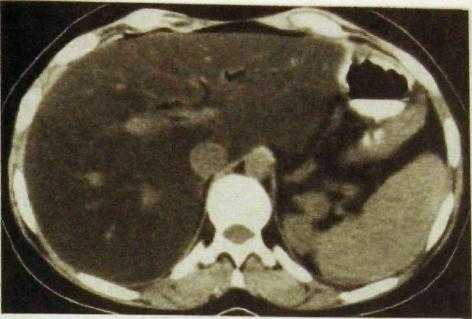
Рве. III. 136. Компьютерная томограмма печени. Жировой гепатоз: низкая плотность печеночной ткани.
может отмечаться небольшая неоднородность изображения. Умеренно увеличена селезенка.
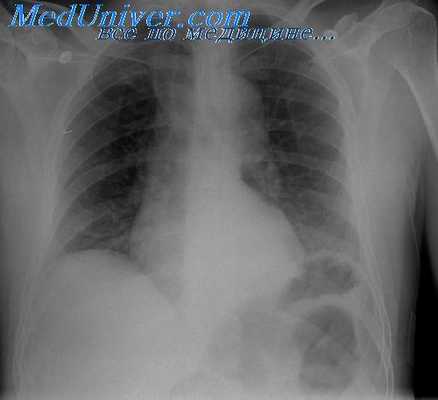
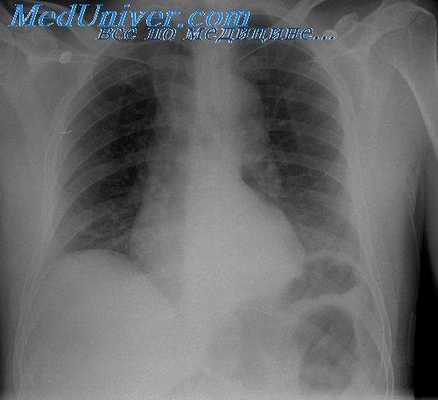
Значительно более выражены лучевые симптомы цирроза печени. Печень увеличена, край ее неровный. В дальнейшем могут наблюдаться уменьшение и деформация правой доли печени. Всегда заметно увеличение селезенки. При сцинтиграфии с коллоидными растворами отмечается значительное повышение радиоактивности селезенки, в то время как в печени концентрация РФП снижается (рис. IIL137). Выявляются очаги пониженного накопления РФП в участках разрастания соединительной ткани и, наоборот, повышенного накопления в узлах регенерации. Особенно наглядно пестрота изображения органа определяется при послойном радионуклидном исследовании — эмиссионной однофотонной томографии. При гепатобилисцинтиграфии обнаруживают признаки нарушения функции гепатоцитов: кривая радиоактивности печени достигает максимума поздно, через 20—25 мин после начала исследования, плато кривой удлиняется (признак внутри печеночного холестаза), желчные пути контрастируются поздно.
Сонограммы подтверждают неоднородность структуры печени: в ее изображении выявляют множественные очаги различной эхогенности — пониженной и повышенной. МРТ и КТ позволяют обнаружить участки регенерации среди цирротических полей. Ветви воротной вены в печени сужены, а сама воротная вена и селезеночная вена расширены, так как цирроз ведет к портальной гипертензии. При сонографии и КТ устанавливают наличие выпота в брюшной полости. На компьютерных томограммах и ангиограм-мах можно обнаружить варикозн о-р асширенные вены — следствие портальной гипертензии.
Достаточно четко выявляются варикозно-расширенные вены пищевода и желудка при рентгенологическом исследовании верхних отделов пищеварительного тракта с сульфатом бария. На фоне складок слизис-
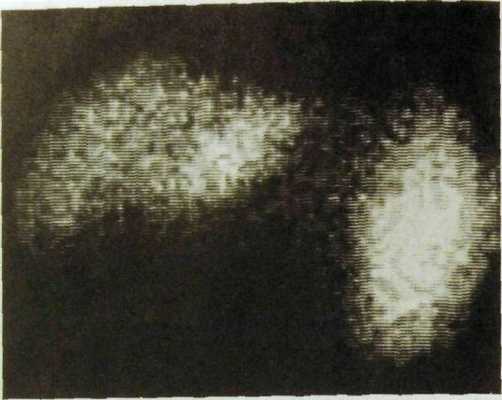
рис. Ш.137. Сцинтиграмма печени. Цирроз: печень уменьшена, распределение в ней РФП неравномерное, селезенка увеличена и активно накапливает РФП.
той оболочки пищевода и в меньшей степени желудка варикозные узлы образуют округлые, овальные и змеевидные полоски просветления — дефекты наполнения.
Больным циррозом печени всегда показано рентгенологическое исследование пишевода и желудка с сульфатом бария.
При циррозе в процесс вовлекаются все сосудистые системы печени. Печеночная артерия и особенно ее разветвления резко сужены, тогда как желудочные и селезеночная артерии расширены. Это отчетливо демонстрирует ангиография. В паренхиматозной фазе ангиографии печень контрасти-руется неравномерно. На большинстве участков тканевой рисунок обеднен, тогда как в узлах регенерации отмечаются зоны гиперваскуляризации. Во время возвратной (венозной) фазы удается документировать коллатеральные пути кровотока, варикозно-расширенные вены, в том числе в пищеводе и желудке, расширение спленопортального ствола и вместе с тем деформацию и сужение внутрипеченочных портальных сосудов.
Очаговые поражения печени. К очаговым (объемным) образованиям печени относят кисты, абсцессы и опухоли 1 . Увереннее всего распознаются кисты, заполненные жидкостью. На сонограммах такая киста выглядит как эхонегативное образование округлой формы с четкими ровными контурами и тонкой стенкой. Встречаются как одиночные, так и множественные кисты различной величины. Кисты диаметром меньше 0,5— 1,0 см не определяются, если в их капсуле нет отложений извести. Краевые
1 Подробнее см.: Зубарев Л.В. Методы медицинской визуализации — УЗИ, КТ и МРТ в диагностике опухолей и кист печени.— М.: ВИДАР, 1996.
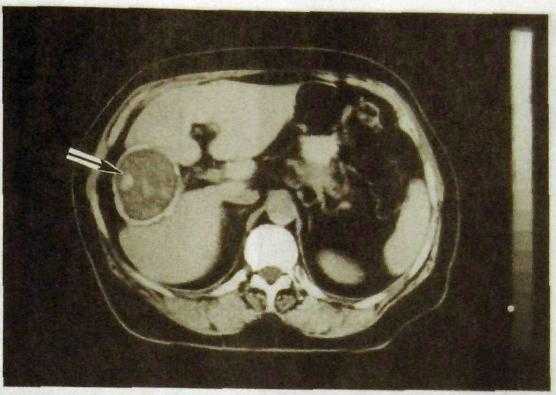
Рис. III. 138. Компьютерная томограмма печени. Эхинококковая киста с отложением извести в фиброзной капсуле кисты (указана стрелкой).
кольцевидные обызвествления наиболее характерны для эхонококковых кист. Одной из разновидностей кистозного поражения печени является поликистоз, при котором большая часть паренхимы органа замещена содержащими жидкость полостями. При этом заболевании кисты могут быть также в почках и поджелудочной железе.
На компьютерных и магнитно-резонансных томограммах киста отражается как округлое образование с ровными контурами, содержащее жидкость (рис. III. 138). Особенно хорошо видны кисты на усиленных компьютерных томограммах, т.е. полученных после введения контрастных веществ. Пространственное разрешение КТ и МРТ намного выше, чем со-нографии. При этих исследованиях удается выявить кистозные образования диаметром всего 2—3 мм. Сцинтиграфию печени редко применяют для выявления кист в связи с ее низким пространственным разрешением.
Асбцесс печени, подобно кисте, на сонограммах, с цинти граммах, компьютерных и магнитно-резонансных томограммах обусловливает ограниченный дефект изображения. Помимо клинических данных, различить эти два поражения помогают дополнительные признаки. Во-первых, вокруг абсцесса обычно расположена зона измененной ткани. Во-вторых, очертания абсцесса менее ровные, чем кисты, а по ден сито метрической плотности на компьютерных томограммах он превосходит кисту. Мелкие пиогенные абсцессы обычно расположены группами, в них часто видны уплотнения — по краю или в центре полости.
Большинство доброкачественных опухолей печени — гемангиомы, реже встречаются аденома и узловая гиперплазия. На сонограммах они видны как гиперэхогенные образования округлой или овальной формы с четкими контурами и однородной структурой (рис. Ш.139). На компьютерных томограммах гемангиома обусловливает ограниченный участок пониженной плотности неоднородной структуры с неровными очертаниями (рис. III. 140). При усиленной КТ отмечается увеличе-
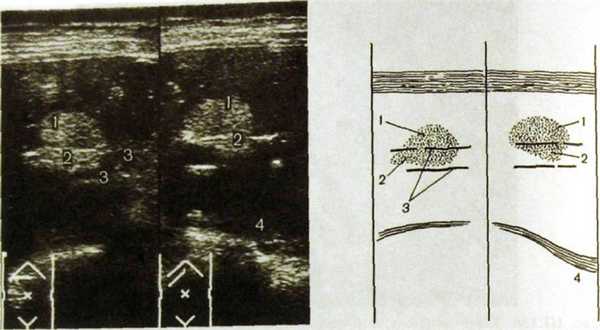
Рис. HI. 139. Сонограммы печени (две проекции и схемы к ним). Гемангиома.
1 — гемангиома; 2 — тромб в ветви воротной вены; 3 — стенки правой ветви воротной вены; 4 — диафрагма.
ние денситометрической плотности зоны поражения. Схожую картину на компьютерных томограммах дает а д е н о м а, но при усилении контрастным веществом тень ее оказывается менее интенсивной, чем окружающая ткань печени. При узловой гиперплазии на компьютерных томограммах обнаруживают множественные мелкие гиподенсные очаги. Гемангиома достаточно четко вырисовывается при МРТ, особенно при сочетании этого исследования с контрастированием парамагнетиками. Что же касается радионуклидной визуализации, то по пространственному разрешению она уступает всем перечисленным способам визуализации печени и в настоящее время ее с этой целью применяют редко.
Гепатоцеллюлярный рак (гепатома) обусловливает на сонограммах участок неравномерной плотности с неровными контурами (рис. Ш.141). Распад опухоли выглядит как эхонегативная зона неправильной формы, а отек вокруг опухоли — как расплывчатый ободок, тоже эхонегативный. На компьютерных, магнитно-резонансных томограммах и сцинтиграммах (эмиссионных томограммах) гепатома обусловливает дефект неправильной формы с неровными очертаниями (рис. III. 142).
Лучевая картина метастазов злокачественных опухолей в печени (а это, к сожалению, частое поражение) зависит от числа и размеров опухолевых узлов.
Среди всех средств визуализации метастазов наилучшим пространственным разрешением обладает КТ, особенно при ее выполнении по усиленной методике, далее следует МРТ и замыкают названную выше группу сонография и сцинтиграфия (рис. III. 143).
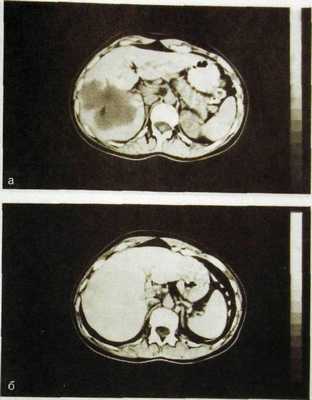
Рис. Ш.140. Компьютерные томограммы печени с усилением. Кавернозная ге-мангиома печени.
а — до внутривенного введения контрастного вещества; б — после его введения: изображение гемангиомы почти исчезло (контрастное вещество заполнило сосудистые пространства опухоли).
Обследование таких больных обычно начинают с сонографии как наиболее доступного и дешевого метода. В нашей стране в онкологических диспансерах по устоявшейся традиции у большинства больных со злокачественными новообразованиями с целью выявления метастазов, помимо сонографии, выполняют сцинтиграфию печени. Однако постепенно, по мере развития и укрепления материальной базы этих лечебных учреждений все большее значение в выявлении метастазов в печени приобретает КТ. Заметим также, что при наличии метастазов, как и при других объемных процессах в печени (первичная злокачественная или доброкачественная опухоль, абсцесс), КТ и сонография позволяют выполнить прицельную пункцию патологического образования, взять ткань для гистологического (или цито-
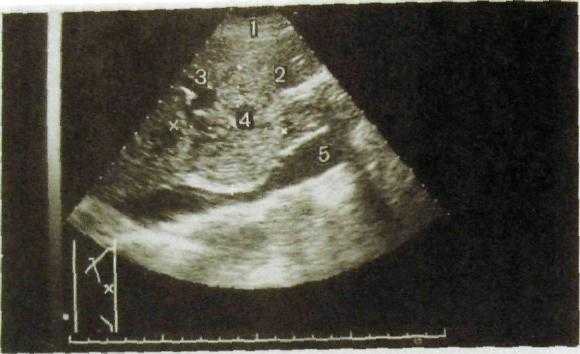
Рис. Ш.141. Сонограмма печени. Гепатоцеллюлярный рак. Опухоль сдавливает нижнюю полую вену и прорастает в воротную вену.
1 — передняя брюшная стенка; 2 — печень; 3 — ветвь воротной вены; 4 — гепато-ма; 5 — нижняя полая вена.
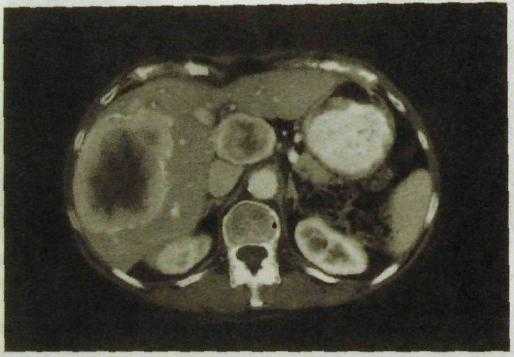
Рас. III.142, Компьютерная томограмма печени. Большая раковая опухоль в правой доле.
логического) исследования и при необходимости ввести в зону поражения необходимое лекарственное средство.
Под контролем лучевых исследований проводят лечение больных с небольшими печеночно-клеточными злокачественными опухолями и одиночными метастазами (в частности, колоректальным раком). Применяют либо чрескожные инъекции этанола в опухолевый узел, либо лазерное облучение по оптическим волокнам, также чрескожно введенным в опухоль. Соно-граммы и томограммы позволяют оценить результаты лечения. Ценным подспорьем при оперативных вмешательствах на печени служит интраопе-
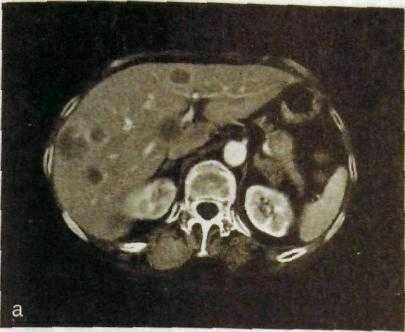
Рис. III. 143. Метастазы рака в печени.
а — компьютерная томограмма: множественные метастазы опухоли в печени; б — ультразвуковая ангиограмма: одиночный аваску-лярный метастаз в печени.
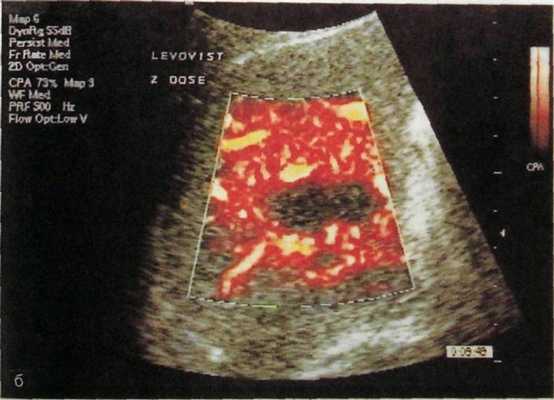
рационная сонография. Стерильный ультразвуковой датчик, подведенный к печени, дает возможность уточнить анатомические варианты ветвления сосудов и протоков печени и обнаружить незамеченные ранее добавочные опухолевые узелки.
Заболевания желчных путей. В последние годы заметно возросла частота развития желчнокаменной болезни. По составу различают холестериновые, пигментные, извест ко выей смешанные (холестерин о-п и г м е н т н о-и звестковые) камни.
В диагностике камней желчного пузыря решающую роль играет сонографии. Ее чувствительность достигает 95—99 %, а предел выявляемо-сти камней — 1,5—2 мм. Камень на сонограмме обусловливает ги-перэхогенное образование в полости желчного пузыря (рис. III. 144). Позади камня определяется акустическая тень — «звуковая дорожка».
На обычных рентгенограммах желчные камни можно распознать только в том случае, если они содержат отложения извести (рис. III. 145). Остальные камни выявляют при холецистографии, если пузырный проток проходим и контрастированная желчь проникает в пузырь. Камни дают дефекты в тени желчного пузыря. Число, величина и форма дефектов зависят от числа, величины и формы камней. Четко обнаруживаются камни при КТ. С развитием сонографии холецистография, бывшая основным методом выявления камней в пузыре, утратила свое значение.
Камни в желчных протоках с помощью сонографии выявляют редко, поскольку обычно они небольшой величины; к тому же некоторая часть общего желчного протока прикрыта двенадцатиперстной кишкой, что ухудшает ультразвуковую визуализацию этой части желчевыдели-тельной системы. В связи с этим основным методом визуализации камней в желчных протоках является КТ, и лишь в отсутствие возможности ее проведения может быть назначена холеграфия. Показательна картина камней в желчных протоках на МРТ. При механической желтухе важные диагностические данные могут быть получены с помощью ЭРХПГ.
В последние годы все более широкое распространение получают интервенционные методы лечения желчнокаменной болезни. Под контролем ультразвука или КТ производят чрескожную пункцию желчного пузыря, его катетеризацию и последующее введение лекарственных препаратов (алифатических спиртов), растворяющих камни. В практику вошли также методы экстракорпоральной ударно-волновой литотрипсии. Быстро развиваются рентгенохирургические вмешательства, применяемые при окклюзион-
ных поражениях желчных путей. Чрескожным доступом в печень вводят специальные катетеры, а через них необходимые инструменты для удаления оставленных при операции желчных камней, ликвидации стриктур, размещения в протоках дренажной трубки с целью билиарной декомпрессии и наружного или внутреннего дренирования желчных путей.
Ценным подспорьем клини цисту служат лучевые методы при диагностике холециститов. Во-первых, они позволяют сразу же разграничить калькулез- Рис. III. 144. Сонограмма желчного пу-'|Иые и бескаменные холе- зыря. В полости пузыря — множествен- циститы. Во-вторых, с их помо- ные камни, видна широкая акустическая шью выделяют группу больных с «дорожка». воспалительным стенозом терми-
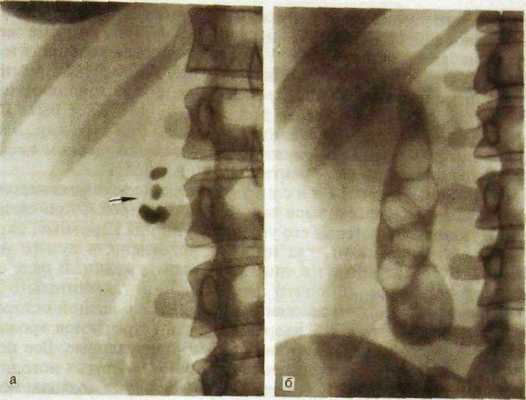
Ряс. III. 145. Желчные камни.
а — рентгенограмма: выявляются камни, содержащие известь (указано стрелкой); б — холецисто-грамма: видны множественные камни в полости желчного пузыря.
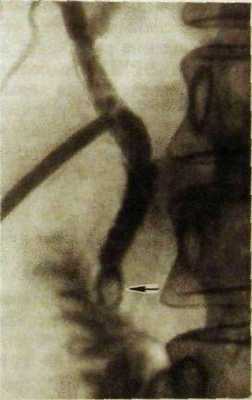
Ряс. III. 146. Холангиография через дренажную трубку после холе-цистэктомии. В дистальной части общего желчного протока одиночный камень (указан стрелкой).
нального отдела общего желчного протока. В-третьих» они дают возможность установить проходимость пузырного протока и степень нарушения концентрационной и двигательной функций желчного пузыря, а это очень важно при планировании лечения, особенно при решении вопроса об оперативном вмешательстве.
При остром холецистите первичным методом исследования является сонография. При ней обнаруживается увеличение размеров пузы-
ря, утолщение его стенки. Вокруг пузыря вырисовывается зона отека. Весьма частой находкой при оонографии являются внутрипузырные желчные камни; они наблюдаются у 90—95 % больных острым холециститом. Все эти симптомы достаточно четко выявляются при КТ, однако при положительных сонографических и клинических данных ее выполняют нечасто. Косвенным признаком холецистита при сонографии может быть ограниченная подвижность правой половины диафрагмы при дыхании. Заметим, что данный симптом выявляют также при рентгенологическом исследовании органов грудной полости — рентгеноскопии.
Хронический холецистит при сонографии проявляется сходными признаками: размеры пузыря чаще увеличены, реже, при сморщивании пузыря, уменьшены, стенки его утолщены, иногда неровные, окружающая пузырь печеночная ткань, как правило, уплотнена, в пузыре нередко видны камни или осажденные плотные компоненты желчи. В ряде случаев пузырь вследствие склерозирующего перихолецистита значительно деформирован. Последний симптом должен быть оценен с большой осторожностью. Следует помнить, что у 8 % здоровых людей встречаются врожденные деформации желчного пузыря, иногда довольно причудливые. Все перечисленные симптомы могут быть выявлены и при помощи других методов лучевой визуализации — КТ и МРТ. Гепатобияисцинтпиграфия позволяет обнаружить дискинезию пузыря различной степени выраженности, вплоть до полной утраты его концентрационной функции и сократительной способности.
Неразрывно связаны лучевые методы и хирургия желчных путей. Ультразвуковое наблюдение расширяет возможности лапароскопической хирургии. Под контролем ЭРХПГ выполняют папиллотомию и сфинктеротомию. Чрескожная чреспеченочная холангиография является обязательной предварительной процедурой перед чрескожным дренированием желчных путей и введением в них различных инструментов, в частности для дилатации суженных участков протоков. Для обнаружения оставленных при выполнении операции желчных камней используют холангиографию через дренажную трубку (рис. III. 146). С помощью венопортографии оценивают функцию пе-ченочно-портального анастомоза, наложенного больному циррозом печени. Вполне понятно, что основные лучевые методы — сонография, КТн МРТ— необходимы при трансплантации печени.
Синдром портальной гипертензии. Термином «портальная гипертензия» обозначают повышение давления в системе воротной вены. Различают надпеченочную блокаду, когда гипертензия обусловлена нарушением оттока крови из печени в результате сдавления или тромбоза нижней полой вены, тромбофлебита печеночных вен, констрик-тивного перикардита, внутрипеченочную блокаду, главным образом при циррозе печени, и подпеченочную блока-д у, вызванную аномалией развития, тромбозом или сдавлением ствола самой воротной вены.
Тактика обследования такого рода больных приведена на схеме.
При портальной гипертензии наблюдается варикозное расширение вен пищевода и желудка, которое может осложниться кровотечением. Для оценки локализации и степени выраженности варикозного расширения вен применяют рентгенологическое исследование пищевода и желудка с суль-
Лучевые методы обследования печени
Рентгенологическое исследование печени. Лучевые методы исследования печени
Желчный пузырь, даже наполненный камнями, в виду небольшого содержания кальциевых солей и малой абсорбирующей способности холестерина и пигментов, удается видеть и фотографировать только при особо благоприятных условиях. Контуры нижнего края печени и особенно желчного пузыря при нормальных условиях бывают неясны; чтобы их различить, нужно искусственно надуть желудок и colon газом.
В этих условиях нижние контуры печени вырисовываются отчетливо, что позволяет каждый раз составить точное представление о ее форме, величине, положении. Конфигурацию же верхней поверхности, прилегающей к диафрагме, мы различаем совершенно ясно в виду того, что она плотно прилежит к диафрагме, которая, будучи органом относительно податливым и растяжимым, повторяет контуры верхней поверхности печени, приспособляясь к ним.
Простое рентгеноскопическое исследование совершенно точно позволяет констатировать захождение петель кишек между печенью и диафрагмой или боковыми отделами брюшной стенки, накопление воздуха под диафрагмой при перфорации какого-нибудь полостного органа брюшной полости, скопление гноя и газов между печенью и диафрагмой при поддиафрагмальном газовом нарыве, сращение печени по верхней поверхности с диафрагмой, резкие неровности на верхней поверхности.
Это значит, что при рентгеноскопическом исследовании можно точно диагностировать эхинококк, нарыв, иногда раковую опухоль, поддиафрагмальный абсцесс, но констатировать камни в пузыре, различать более мелкие деформации печени или изменения консистенции ткани обычной рентгеноскопией не удается. Чтобы облегчить распознавание и этих морфологических изменений, стремились, по почину Вебера, экспериметировавшего на животных, облегчить исследование вдуванием воздуха или кислорода в брюшную полость. (Goetze и Rautenberg).
Техника этого способа очень проста. По Rautenberg'y она состоит в вдувании посредством двойного балона через канюлю, проникающую в брюшную полость между лобком и пупком воздуха, пропущенного через вату, в количестве от 1 - 2 литров. Но можно также пользоваться аппаратом Forlanini для наложения искусственного пневмоторакса). Этот способ позволяет лучше рассмотреть контуры печени и в некоторых случаях видеть камни в желчном пузыре и протоках.
Но по отношению к камням это обычно удается только в тех случаях, когда они содержат достаточное количество кальциевых солей. Словом, успехи рентгенодиагностики печени и желчных путей очень велики, но нельзя сказать, что рентгеновский снимок или рентгеноскопия во всех сомнительных случаях может разрешить наши недоумения. По отношению к печени, как и к другим органам, надо признать, что клинический диагноз ставится на основании совокупности результатов всех методов исследования, клинического наблюдения, анамнеза и анализа всего накопленного материала.
Надо сказать, что в настоящее время, благодаря усовершенствованию методики физического исследования, диагностика заболеваний печени стоит на достаточной высоте. Одна коже это еще не значит, что мы уже умеем в клинике распознавать решительно все заболевания печени. Многие патологические процессы нами пока еще не распознаются. Это те именно заболевания, где нет резких нарушений морфологических, но имеются на лицо нарушения функции органа и где все наши методы физического исследования a priori не могут дать каких-либо результатов, так как они, как мы видели, имеют своей задачей констатирование лишь грубых морфологических изменений свойств печени и ее положения.
Распознавание нарушений функций органа не входит в задачу физической диагностики; оно является целью функциональной диагностики. Этим в отношении печени и занята в настоящее время клиника. К сожалению, результаты пока не особенно велики. Объясняется это тем, что физиология и патологическая физиология печени далеко еще не закончены; слишком сложны функции печени в организме и обширны функциональные связи с другими органами и железами, а это делает крайне трудным анализ полученных результатов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
4.Лучевые методы исследования печени, желчных путей и поджелудочной железы.
Обзорный снимок печени и поджелудочной железы.обычно сводится к производству и изучению обзорных снимков, что дает очень скудные сведения. Можно увидеть инородные тела, обладающие более высокой рентгеновской контрастностью (металлические), воздух в полости абсцесса и др. При газе в брюшной полости зачастую видна поддиафрагмальная поверхность органа. С появлением контрастных веществ, поглощаемых печенью и выводимых с желчью, появилась возможность изучения состояния желчных путей. Применяется при поиске минеральных камней жёлчного пузыря и поджелудочной железы. Если для жёлчного пузыря он почти потерял свое значение, так как камни жёлчного пузыря легко выявляются при УЗИ-сканировании, то для камней поджелудочной железы он сохранил свою значимость, так как обызвествления в поджелудочной железы при УЗИ-сканировании выявляются не всегда.
Холецистография. Контрастное вещество (билитраст, йопогност и т.п.) принимают внутрь за 13–14 часов до исследования. Дозировка обычно 1 таблетка на 10 кг веса больного. Всасываясь из кишечника, контрастное вещество концентрируется с желчью в желчном пузыре, который становится видимым на снимке. Лучше выполнять прицельные снимки за экраном, т.к. при этом можно выбрать оптимальную проекцию. На фоне контрастного вещества становятся видными дефекты наполнения (камни, полипы, опухоли пузыря), деформации пузыря. При непроходимости пузырного протока пузырь не контрастируется. При наличии препятствий нормальному оттоку желчи (желчно-каменная болезнь, рак желчного пузыря, рак головки поджелудочной железы и фатерова соска, метастазы в лимфатические узлы ворот печени, атрезин желчевыводящих путей) нарушается эвакуаторная функция желчного пузыря. После выполнения снимков больному дают желчегонный завтрак (обычно 2 яичных желтка или раствор сульфата натрия), через 45 минут повторяют снимки. Пузырь за это время должен сократиться до половины или даже до трети первоначальной величины. При атониях, вызванных хроническим холециститом или другими причинами, пузырь не сокращается. При хронических холециститах с выраженным фиброзом стенки и образованием спаек, стенка пузыря деформируется, утолщается, нередко спаяна с нижней поверхностью печени. Слизистая оболочка при этом атрофируется.
Холеграфия. Контрастное вещество (билигност и т.п.) вводится внутривенно. Уже через 5–7 минут в норме отмечается контрастиро-вание печеночных протоков, через 30–45 минут – желчного пузыря. Исходя из этого, рекомендуется производить снимки через 7, 15, 40, 90 минут после введения. Это дает возможность определить состояние как пузыря, так и желчевыводящих протоков. Во многих хирургических клиниках принято проводить холеграфию во время операции по поводу желчнокаменной болезни. Контрастное вещество вводят пункционно непосредственно в пузырь или общий желчный проток. Снимки, выполненные при этом, дают возможность установить местонахождение препятствия оттоку желчи (камень, маленькая опухоль).
Чрескожно-чреспеченочнаяхолангиография (ЧЧХ). Проводится в тех случаях, когда при УЗИ-и КТ-исследованиях не удается установить причину механической желтухи. С помощью длинной тонкой иглы пунктируется печень по срединно-подмышечной линии в 7-8 межреберье, и вводится 20 мл любого водного контрастного препарата. Затем выполняются обзорные снимки печени в прямой и косой проекциях.
РХПГ (ретроградная холангиопанкреатикография). Показание те же, что и для ЧЧХ, плюс необходимость визуализации вирсунгиева протока. Выполняется с помощью дуоденофиброскопа, через который в фатеров сосок вводится зонд и водный контрастный препарат. В настоящее время обычно используется как первый этап интервенционных вмешательств в терминальном отделе холедоха.
Интраоперационнаяхолангиография. Выполняется во-время или после холелецистэктомии, если в ходе операции у хирурга возникает сомнение в проходимости желчных путей. Жидкий контраст вводится в холедох через устье пузырного протока, после чего выполняется снимок с помощью передвижного рентгеновского аппарата. При сохранении проходимости общего желчного протока контраст свободно проникает в двенадцатиперстную кишку.
Фистульная холангиография. Выполняется, обычно, после операций на желчных протоках, при появлении у больного признаков обструкции желчных ходов. Через дренажную трубку вводится какой-либо жидкий контрастный препарат и выполняются два снимка в прямой и косой проекциях.
1.2. Компьютерная томография.Нативная КТ в настоящее время является одним из ведущих методов лучевой визуализации печени и поджелудочной железы вместе с УЗИ. КТ, прежде всего, информативны при объёмных образованиях – первичные опухоли печени, метастазы, простые и паразитарные кисты, абсцессы, панкреатиты. Эффективна КТ и при жировой и гепатоцеребральной дистрофии, циррозах, гемохроматозе. КТ-ангиография с болюсным введением контраста даёт возможность выделить артериальную, портальную и венозные фазы кровотока, что чрезвычайно важно при дифференциации опухолевых поражений печени и поджелудочной железы, травмах, сосудистых мальформациях. Кроме того, эта методика позволяет оценить величину перфузии паренхимы печени.
1.3. Магнитно-резонансная томография.
МР-холангиография, выполняемая с помощью ананасового сока, эффективно визуализирует жёлчные пути, позволяя выявлять принину обструкции (камни, органические стенозы) при отрицательных данных УЗИ и невозможности проведения ЧЧХ и РПХГ.
Синдром портальной гипертензии характеризуется наличием асцита и спленомегалией, дилатацией воротной вены и её ветвей, наличием венозных коллатералей по ходу печеночно-дуоденальной связки и в стенке желчного пузыря в виде грозди винограда. В ряде случаев происходит реканализация пупочной вены, визуализирующейся в виде протяженной сосудистой структуры, диаметром до 1,5 см. Портальная гипертензия может и признаком диффузно-очагового или очагового поражения печени (см. ниже). Характерным признаком, указывающим на портальную гипертензию является резкое равномерное утолщение и отчетливая слоистость стенки желчного пузыря при одновременном сужении его просвета (отчего он может слегка напоминать матку (!).
Синдром наличия свободного газа в брюшной полости проявляется в появлении резко гиперэхогенной полосы, ограниченной внутренним контуром передней брюшной стенки, с выраженными реверберациями, глубже которой визуализация каких-либо структур невозможна.
Синдром диффузного поражения печени («большая белая печень»). Эхографически характеризуется увеличением всех размеров печени с ровным закруглением. Увеличивается зернистость структуры, вплоть до диффузно-неоднородной, эхогенность органа равномерно возрастает, а звукопроведение ухудшается. В большинстве случаев несколько обедняется сосудистый рисунок за счет сдавления печеночных вен, однако в целом венозный и лимфатический отток не страдает, признаков отека стенки желчного пузыря нет. Признаки портальной гипертензии отсутствуют. Характерен для жировой дистрофии печени, однако встречается при всех состояниях, связанных с развитием воспалительных и дистрофических изменений печени.
Синдром диффузно-очагового поражения печени. Эхографически характеризуется изменением размеров и, в ряде случаев, деформацией органа. Контур чаще ровный, однако возможна некоторая его «волнистость». В целом эхогенность повышена, но структура неоднородная за счет наличия зон различнойэхогенности и увеличения эхогенностиперипортальныхзоню. Сосудистый рисунок перестроен, при появлении портальной гипертензии удается проследить мелкие ветви портальных вен. Звукопроведение ухудшается. Характерен для хронических гепатитов и циррозов (в последнем случае сочетается с синдромами портальной гипертензии и холестаза).
Техника этого способа очень проста. По Раутенбергу она состоит в вдувании посредством двойного балона через канюлю, проникающую в брюшную полость между лобком и пупком воздуха, пропущенного через вату, в количестве от 1 - 2 литров. Но можно также пользоваться аппаратом Форвалини для наложения искусственного пневмоторакса). Этот способ позволяет лучше рассмотреть контуры печени и в некоторых случаях видеть камни в желчном пузыре и протоках.
1. Кармазановский Г.Г., Вилявин М.Ю., Никитаев М.С. Компьютерная томография печени и желчных путей. – М.: Паганель-Бук, 1997. – 358 с.
2. Ничитайло М.Е., Фарзоллах М.Д. Современный диагностический и лечебный алгоритм при абсцессах печени различной этиологии // Клiн. хiрургiя. – 2004. – № 11 – 12. – С. 75.
3. Хацко В.В., Шаталов А.Д., Дудин А.М. и др. Новые возможности диагностики и миниинвазивного лечения сосудистых опухолей печени // Клiн. хiрургiя. – 2007. – № 2 – 3. – С. 62.
4. Alegre – Vivas S., Jorquera-Plaza F, Munoz-Nunez F et al. Multiple hepatic focal nodular hyperplasia: its presentation in childhood and atypical evolution. Gastroenterol. HepatoL, 2000 Jan; 23(1): 9-11.
5. Arbab A.S., Ichikawa Т., Araki Т. et al. Detection of hepatocellular carcinoma and its metastases with various pulse sequences using superparamagnetic iron oxide (SHU-555-A). Abdom. Imaging, 2000 Mar-Apr; 25(2): 151-8.
6. Barnes P.F, de Cock K ., Reynolds Т.N. et al. A comparison of amebic and pyogenic abscesses of the liver. Medicine, 1987, 66: 472-483.
Проблема своевременного распознавания и точной диагностики кистозно-очаговых образований печени (КООП) не только в раннем периоде организации патологического процесса, но и в последующих стадиях его развития – одна из наиболее актуальных в хирургической гепатологии. Наиболее частыми причинами диагностических ошибок, особенно при первичном осмотре, являются отсутствие патогномоничных признаков заболевания, недоучет некоторых анамнестических данных, характерных жалоб больных и клинических проявлений заболевания (Панфилов С.А. 2003, Tochi A. 2002).
Роль неинвазивных методов диагностики в настоящее время постоянно возрастает. Появляются новые приборы, обладающие прекрасными возможностями дифференциации патологических процессов, в том числе и при заболеваниях печени [3,4,5]. В ряде случаев, особенно при планировании хирургического вмешательства, более рациональным представляется проведение магнитно-резонансной томографии (МРТ), а не рентгеновской компьютерной томографии (КТ) [1,2,6]. МРТ позволяет использовать разные программы, что делает возможным иногда в одном исследовании провести последовательное уточнение характера поражения.
В то же время многие виды патологии диагностируются уже при адекватно проведенном ультразвуковом исследовании (УЗИ). Часто пациенты приходят на КТ или МРТ, не имея результатов УЗИ, в то время как первоначальное его выполнение во многом облегчило бы тактику дальнейшего обследования и оптимизацию предлагаемых методик.
Цель исследования – уточнение возможностей и роли лучевых методов (УЗИ, КТ и МРТ) в диагностике ДООП.
Материалы и методы. Проведен анализ результатов обследования и лечения 120 пациентов, из них 29 больных с абсцессами печени, 83 пациента с кистозным поражением и 8 больных с гемангиомами печени.
Открытые оперативные вмешательства под контролем УЗИ при абсцессах печени выполнены 14 (48,3 %) больным в возрасте от 1 до 15 лет; резекция II-III сегмента с абсцессом печени, со стимуляцией регенераторных процессов печеночной ткани; вскрытие абсцесса, санация, дренирование, отграничение абсцесса; атипичная резекция печени с удалением абсцесса, со стимуляцией регенераторных процессов печеночной ткани. При непаразитарных кистах печени вмешательства под частичное иссечение стенок кисты с ликвидацией остаточной полости 5,1 %; частичное иссечение стенок кисты с ликвидацией остаточной полости со стимуляцией регенераторных процессов печеночной ткани 7,7 %; лапаротомия, атипичная резекция печени (перикистозной части с кистой) с ликвидацией остаточной полости 23,1 %; лапаротомия, атипичная резекция печени (перикистозной части с кистой) с ликвидацией остаточной полости со стимуляцией регенераторных процессов печеночной ткани 20,5 %; лапаротомия, цистоэктомия с ликвидацией остаточной полости 12,8 %; лапаротомия, цистоэктомия с ликвидацией остаточной полости и стимуляцией регенераторных процессов печеночной ткани 20,5 %; операция не проводилась (диспансерное наблюдение) 10,3 %. При паразитарных кистах: эхинококкэктомия с частичным иссечением фиброзной капсулы и ушиванием остаточной полости изнутри, со стимуляцией регенераторных процессов печеночной ткани 56,8 %; эхинококкэктомия с частичным иссечением фиброзной капсулы и ушиванием остаточной полости изнутри 27,3 %; эхинококкэктомия с полным иссечением фиброзной капсулы, со стимуляцией регенераторных процессов печеночной ткани 6,8 %; резекция II-III сегмента с кистой печени, со стимуляцией регенераторных процессов печеночной ткани 9,1 %.
Всем больным выполнялось комплексное обследование, включающее сбор анамнеза, общеклинические, специальные лабораторные и инструментальные методы исследований. Общеклиническая диагностика основывалась на изучении жалоб, анамнеза и данных объективного обследования больных.
Ультразвуковое исследование, а также малоинвазивные чрескожные вмешательства производились с применением ультразвукового сканера ETKS-DM-04 (производства НТФ «Ратекс» СПб, Россия), оснащенного электронной матрицей для контроля положения иглы в тканях и аппаратом Д – 250 фирмы «Алока» (Япония). ФГДС выполняли с использованием фиброгастродуоденоскопа фирмы «Olympus» (Япония). Сцинтиграфия печени выполнялась на гамма-камере «САОРИ-01» с применением радиофармпрепарата Тс 99м + технофит (100 МБК). Использовался компьютерный томограф фирмы «Siemens» (Швеция) Somaton-2. Технические параметры сканирования: напряжение 125 кВ, экспозиция 230 мАс, толщина слоя 10 мм. Артериография производилась на ангиографическом аппарате фирмы «General Electric» США с рентгенотелевизионной системой «Fluoricon-300».
Лапароскопическая диагностика выполнялась на аппаратуре и инструментами фирмы «Джонсон и Джонсон» (США), для этого использовали иглу Вереша, троакар (10 мм), инсуфлятор, лапароскоп, видеокамеру и монитор. При выполнении операции из мини-доступа использовался специализированный билиарный набор инструментов «Миниассистент» фирмы Лига-7.
Статистическая обработка результатов исследования осуществлена общепринятыми методами вариационной статистики по Фишеру-Стьюденту, при помощи программы «Statistica 6.0» на персональном компьютере. Данные считались достоверными, если уровень значимости соответствовал условию (р<0,05). Оценку отдаленных результатов лечения доброкачественных очаговых поражений печени проводили по трехбальной системе: хорошие, удовлетворительные и неудовлетворительные. Сведения о состоянии больных получали при их обследовании в клинике, при амбулаторном осмотре.
Результаты и обсуждение: Как показало наше исследование, все современные диагностические методы, как инвазивные, так и неинвазивные, имеют достаточно высокие показатели эффективности для диагностики очаговых образований печени.
Чувствительность различных методов исследования при обнаружении очаговых образований, установлении их размеров и локализации. Так чувствительность ультразвуковой диагностики составила 80,6 %, а чувствительность компьютерной томографии – 87,5 % (p > 0,05). Наименьшей чувствительностью среди неинвазивных методов диагностики обладает статическая сцинтиграфия печени с Тс99ш, которая составляет только 70,8 % (p < 0,05).
Вторая диагностическая задача заключалась в необходимости проведения точного дифференциального диагноза между доброкачественными очаговыми образованиями и злокачественными новообразованиями печени. Для её решения была оценена специфичность каждого из представленных методов исследования. При этом была установлена зависимость данного показателя для неинвазивных методов исследования от размеров и объема поражения печени, что показано на рисунке.
Рис. 1. Зависимость специфичности диагностических методов от размера и объема поражения
При сравнении дифференциально-диагностической ценности неинвазивных методов исследования было установлено, что компьютерная томография имеет явные преимущества перед УЗИ, специфичность которого для дифференциального диагноза очаговых образований печени четко зависела от размера и объема поражения печени, составляя 54,7 % для образований менее 5 см, 66,6 % – при множественном поражении печени, и только 22,2 % при образованиях более 5 см в диаметре, что связано с их неоднородной эхоструктурой. Специфичность компьютерной томографии зависела от выявляемого размера образования и объема поражения печени.
В отдельных случаях при проведении МРТ бывает затруднен дифференциальный диагноз кист и гемангиом, несмотря на различие их гистологического строения, особенно при их малых размерах (менее 1.5 см). Представляется интересной методика использования импульсных последовательностей МРТ, предложенная (М. Fisher) при которой анализируются изображения, полученные при увеличении времени ТЕ от 60 до 180 мс и постоянном TR 2000 мс. Киста выглядит гипоинтенсивной на Т1- и гиперинтенсивной на Т2-взвешенных изображениях.
Более низкая специфичность лапароскопии (69,6 %) объясняется тем, что визуальному осмотру доступны только подкапсульно расположенные образования, а внешний вид, например, скиррозных гемангиом трудно дифференцировать от злокачественных опухолей, что нередко приводит к диагностическим ошибкам (p < 0,05). Выполнение же пункции или биопсии образования даже под контролем лапароскопии крайне опасно, так как сопровождается высоким риском развития кровотечения (в наших наблюдениях 3 случая из 5 – 60 %).
Выводы. Таким образом, для первичного выявления доброкачественных очаговых поражений печени целесообразно обследование начинать с УЗ исследования с последующим выполнением КТ и инвазивных методов диагностики. УЗИ, КТ и МРТ являются высокоинформативными методами диагностики при заболеваниях печени, которые в комбинации или комплексно позволяют установить характер патологии, топографическую сегментарную локализацию очагового образования, определить объем поражения и степень вовлечения в патологический процесс глиссоновых элементов портальных ворот печени, выявить проксимальную и дистальную границу поражения желчной системы при опухолевых или паразитарных заболеваниях.
Читайте также:
- Миотоническая дистрофия. Причины и признаки миотонической дистрофии.
- Механизмы (патогенез) появления ушных шумов при отосклерозе
- Рефлекторно-токсические осложнения ангиографии. Токсическое действие контраста
- Дентин зуба. Строение дентина зуба.
- Стент Кроуфорда при травме слезных канальцев. Применение
