Рефлекторно-токсические осложнения ангиографии. Токсическое действие контраста
Добавил пользователь Cypher Обновлено: 24.01.2026
Осложнения прескаленной биопсии. Медиастиноскопия
Прескаленную биопсию нельзя считать совершенно безопасным исследованием. А. Н. Матыцин (1963) на 120 прескаленных биопсий отметил следующие осложнения: повреждение грудного лимфатического протока у одного больного, пристеночное повреждение внутренней яремной вены — у 3, ранение подключичной вены — у одного и плеврит — у одного. Berger, Boyd, Strieder (1963) на 320 прескаленных биопсий наблюдали одно повреждение подключичной артерии, две воздушных эмболии, повреждение грудного лимфатического протока и переходящий симптом Горнера.
Слабым местом прескаленной биопсии является то, что впередилестничные лимфоузлы не являются прямым коллектором лимфатических путей легких. Maloney с соавт. (1964), основываясь на анатомических и клинических данных, доказывают, что «скаленные лимфоузлы» представляют коллектор лимфы от головы, ротоглотки и плеча, тогда как коллектором лимфы от правого легкого и нижней доли левого являются лимфоузлы правого грудного протока, а от верхней доли левого легкого — лимфоузлы левого грудного протока. Ими предложен доступ к этим группам лимфоузлов с пересечением стернальной ножки кивательной мышцы.
Таким образом, прескаленную биопсию при неувеличенных впередилестничных лимфоузлах в значительной степени можно рассматривать как поиск вслепую. В определении операбельности рака легкого и опухолей средостения эта методика заметно уступает медиастиноскопии, позволяющей получить информацию о состоянии паратрахеальных и бифуркационных лимфоузлов, которые являются прямым лимфатическим коллектором для легких и средостения. Поэтому показанием к прескаленной биопсии мы считаем наличие пальпирующихся увеличенных прескаленных лимфоузлов.
Медиастиноскопия
Существуют различные оперативно-диагностические методики осмотра, пальпации и биопсии переднего средостения. Harken с соавт. (1954) предложили через боковой разрез на шее вводить ларингоскоп для осмотра паратрахеальных тканей. Операция выполнялась под местной анестезией, позволяла произвести ревизию только с одной стороны, вследствие чего иногда возникали показания к проведению операции с другой стороны. Авторами описаны такие осложнения, как пневмоторакс, разрыв шейных вен и др.
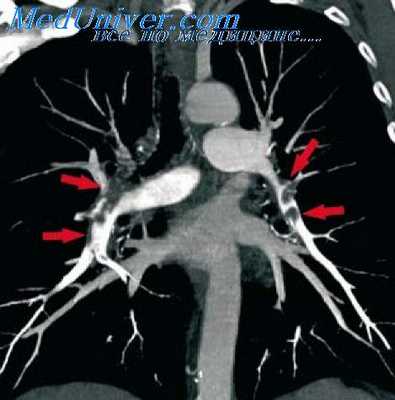
Steel, Marble (1959) используют для ревизии переднего средостения технику шейной медиастинотомии: под местной анестезией производят разрез по переднему краю кивательной мышцы, после отодвигания которой кнаружи осуществляют осмотр прескаленного пространства и взятие лимфоузлов для гистологического исследования. Далее пальцем проделывают канал кзади от дуги аорты до верхушки легкого, которую можно пропунктировать под визуальным контролем.
Stemmer с соавт. (1965) предложили диагностическую медиастинотомию, выполняемую путем разреза на передней поверхности грудной клетки с резекцией 2 и 3-го реберных хрящей. Авторами выполнена 21 такая операция (18 под местной анестезией и 3 под наркозом), из осложнений отмечено нагноение раны у 2 больных, получавших рентгенотерапию.
Указанные методики обладают рядом недостатков: невозможность билатеральной ревизии, опасность ранения крупных вен шеи и воздушной эмболии при методике Harken, травматичность методики Stemmer.
В 1959 году Carlens сообщил о разработанной им диагностической операции медиастиноскопии, выполненной у более 100 больных без осложнений. Принцип методики Carlens состоит в срединном доступе к переднему средостению, чем обеспечивается возможность билатерального осмотра паратрахеального пространства и подход к бифуркационной группе лимфоузлов, а также избегается контакт с тонкостенными венами шеи.
Медиастиноскопия по Carlens быстро получила широкое распространение при определении операбельности рака легкого, дифференциальной диагностике некоторых заболеваний легких и средостения. Так, медиастиноскопия стала основным методом диагностики медиастиальной формы саркоидоза: по данным Bergh с соавт. (1964), из всех случаев клинической диагностики легочного саркоидоза 87% выявлено путем медиастиноскопии. Эти авторы сообщают о произведенных ими медиастиноскопиях 300 больным. Revnders (1964) сообщил о 250 хмедиастиноскопиях, выполненных у больных бронхогенным раком. 230 больным произвели медиастиноскопию Aeberhard, Akovbiantz (1965).
В нашей стране медиастиноскопия при опухолях легкого и средостения начала применяться В. Л. Маневичем в клинике, руководимой Б. К. Осиповым с 1961 года (Б. К. Осипов, В. Л. Маневич, А. Г. Кочеткова и В. Т. Апоян, 1963). Г. И. Лукомский (1966) сообщил об опыте 100 медиастиноскопии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Рефлекторно-токсические осложнения ангиографии. Токсическое действие контраста
Определенная искусственность этого наименования вызвана сложностью реакции, возникающей при введении контрастного вещества при ангиографии легких. Однако крайняя антифизиологичность методики ангиопульмонографии вполне очевидна: азбучным правилом обучения студентов и медицинских сестер считается медленное введение любых лекарственных веществ в вену, в том числе и такого «безобидного», как 40% раствор глюкозы. Залогом успеха общей ангиопульмонографии является максимально быстрое введение 50—60 мл 70% контрастного вещества. К тому же применяется эта методика в большинстве случаев у больных с выраженными изменениями сердечно-сосудистой системы.
По данным комитета Американской ассоциации кардиологов Cournand и соавт. (1953) на 6824 контрастных исследования правого сердца и легочной артерии, проведенных в 200 лечебных учреждениях, отмечено 26 летальных исходов.
В отечественной литературе о летальных исходах при ангиокардиографии сообщили Е. Н. Мешалкин (1954), М. И. Бурмистров, В. И. Мишура, Ю. Ф. Писарев и Г. С. Рухимович (1959). Следует отметить, что четыре летальных исхода, приводимых ими, имели место у детей с тяжелыми врожденными пороками сердца.
Причиной летальных исходов и тяжелых осложнений (остановка дыхания и сердечной деятельности, требующие проведения реанимации) является прежде всего усугубление гипоксии вследствие блокады легочного кровотока в момент поступления контрастного вещества в малый круг кровообращения, сочетающееся с сильным рефлекторным действием концентрированных растворов на сосудистые рецепторы. Подтверждением тому служат результаты патологоанатомических исследований при летальных исходах, указывающие на гипоксическую причину смерти (Е. Н. Мешалкин; М. И. Бурмистров с соавт.).
Осложнения, обусловленные токсическим действием контрастных веществ, могут проявляться в виде развития печеночной, особенно почечной недостаточности, что чаще имеет место у больных хроническими заболеваниями почек. Существует мнение, что двухйодистые контрастные вещества более токсичны и чаще вызывают осложнения, чем трехйодистые (Skop, 1959, и др.).
Тяжесть побочных реакций и частота осложнений при ангио-пульмонографии пропорциональна количеству, концентрации и скорости введения контрастного вещества, а также наличию и степени исходной гипоксии у больного (Е. Н. Мешалкин, 1954; А. Н. Новиков, А. X. Трахтеиберг и С. Я. Марморштейн, 1964, и др.).
Рефлекторно-токсические осложнения при селективной ангиопульмонографии встречаются реже, чем при общей (внутривенной) . Это легко объяснить меньшим количеством вводимого контрастного вещества. Тщательный учет противопоказаний и отработка методики позволяют свести к минимуму число осложнений ангиопульмонографии при заболеваниях легких. Так, на 327 ангиопульмонографии П. Н. Мазаев, М. М. Воропаев и И. П. Копейко (1965) не наблюдали серьезных осложнений.
В. В. Васильева, К. М. Лактин и П. В. Сергеев (1962) на основании экспериментальных данных рекомендуют использовать для профилактики осложнений ангиографии антикоагулянты типа дикумарина, которые не только предупреждают тромбообразование, но и оказывают регулирующее влияние на сниженный уровень венечного кровотока и сосудистый тонус.
Прокол ребра при ангиографии. Тромбоэмболические осложнения ангиографии
Специфическим осложнением азигографии является сквозной прокол ребра с введением контрастного вещества в плевральную полость или мягкие ткани. Клинически это проявляется резкой болезненностью, в последующие дни появляется болезненная припухлость, повышается температура. Рентгенологически отмечается депо контрастного вещества. При введении контрастного вещества в мягкие ткани следует произвести обкалывание раствором новокаина с антибиотиками. Мерой профилактики должно быть педантичное соблюдение методики.
Флебит плечевых вен может возникнуть как после введения зонда, так и после общей ангиопульмонографии. Для предупреждения его необходимо бережное обращение с веной, обязательное «промывание» вены раствором новокаина после инъекции контрастного вещества. Лечение флебитов проводится по обычным правилам.
Развитие тромбоза и инфаркта легкого возможно при излишне длительном измерении легочно-капиллярного давления, которое не должно превышать 10 минут (В. С. Савельев, 1961). При прекращении непрерывного тока раствора гепарина через зонд в просвете его может образоваться сгусток, что случается при повторном взятии проб крови. Закупорка зонда требует извлечения его. Попытка промывания зонда или введения контрастного вещества под давлением могут вести к эмболии.
При зондировании сердца и ангиопульмонографии воздушная эмболия, по мнению В. С. Савельева (1961), встречается чаще, чем это принято считать. Для профилактики воздушное эмболии следует внимательно проверять заполнение систем, ис пользуемых при исследовании.
При чрезкостной азигографии потенциально возможна жировая эмболия, но клинические проявления ее обычно не обнаруживаются и проходят бесследно (В. Т. Апоян, 1964).
Контроль коагулограммы и коррекция нарушений свертывающей системы крови перед ангиопульмонологическим исследованием и после него помогает свести до минимума число тромбозов.
Подготовляя ангиологическое исследование легких, врач должен быть готов к оказанию экстренной помощи при развитии осложнений, включая все меры реанимации. В. В. Зверев (1966) приводит наблюдение, когда при зондировании сердца и селективной ангиопульмонографии у больного с хронической пневмонией возникла остановка сердца. Проведение реанимации потребовало интубации трахеи, открытого массажа сердца и электрической дефибрилляции.
В приведенных выше наблюдениях О. С. Шкроба и В. С. Помелова спасти больных с развившейся в результате перфорации стенки правого желудочка зондом тампонадой сердца удалось только путем экстренной торакотомии.
Возможность развития угрожающих осложнений диктует необходимость соответствующего оборудования рентгеновского кабинета, в котором производятся ангиопульмонологические исследования и подготовки бригады к быстрому и четкому выполнению необходимых мероприятий.
Зондирование сердца и ангиопульмонография неизбежно сопровождаются рентгеновским облучением больного и персонала. Наибольшая доза облучения имеет место при проведении зонда под контролем рентгеноскопии. По данным М. И. Бурмистрова с соавт. (1959), проводивших дозиметрию при зондировании, за весь период исследования, включая проведение зонда и контрастную рентгенографию, больной получает дозу в 55—60 p. Semisch, Gessner, Kolling (1958) указывают, что разовая доза облучения не должна превышать 100 р.
Значительную дозу облучения получает врач, проводящий зондирование, тогда как остальные члены бригады во время производства снимков находятся за ширмой. Для уменьшения дозы облучения рекомендуется производить рентгеноскопию при максимальном диафрагмировании, а персонал, выполняющий исследование, одевает защитные фартуки, перчатки и т. п. При технических трудностях проведения зонда в ветви легочной артерии не следует забывать о рентгеновском излучении и вовремя прекратить попытки, ограничившись контрастированием из основной ветви или общего ствола легочной артерии. Значительные перспективы в данной области открывает применение электронно-оптических преобразователей, которые в 7—10 раз уменьшают вредное действие ионизирующего излучения (П. Н. Мазаев, М. М. Воропаев и И. П. Копейко, 1965; Н. И. Хурамович, 1965, и др.).
Применение рентгеноконтрастных веществ в интервенционной кардиологии и ангиологии: история, осложнения и их профилактика

Введение. В последние годы в мире происходит значительный рост количества рентгенохирургических вмешательств, большую часть из которых составляют операции на сердце и сосудах. Для адекватной визуализации состояния сосудистого русла и проведения эндоваскулярных операций необходимо выполнение ангиографических исследований с введением контрастных веществ (КВ). В современных условиях рентгенохирургические вмешательства часто выполняются у пожилых пациентов с различными сопутствующими заболеваниями (сахарный диабет, артериальная гипертензия, сердечная недостаточность, заболевания почек и др. ). Эндоваскулярные операции становятся более сложными, часто многоэтапными и выполняются с применением значительного объема КВ. Все вышеизложенное свидетельствует о необходимости более широкого освещения вопросов по использованию КВ в интервенционной кардиологии и ангиологии; особенного внимания заслуживают различные осложнения и способы их профилактики (1, 2, 3).
История использования контрастных веществ в интервенционной ангиологии.
В 1895 году В. К. Рентген открыл неизвестные ранее лучи, названные им “X-лучами”. Интересно, что уже в 1896 году В. М. Бехтерев предсказал открытие ангиографии. Выдающийся русский невролог заметил: “Раз стало известно, что некоторые растворы не пропускают лучи Рентгена, то сосуды мозга могут быть заполнены ими и сфотографированы “in situ”.
Реальное использование рентгеноконтрастных веществ началось гораздо позже. В 1923 году Berberich и Hirsch сделали первую в истории прижизненную ангиограмму артерий и вен руки с помощью бромида стронция. В 1924 году Brooks, используя йодистый натрий, впервые выполнил ангиограмму артерий нижней конечности, а в 1929 г. Renaldo dos Santos и коллеги провели первую прижизненную брюшную аортографию с помощью йодистого натрия. Вышеперечисленные исследования выполнялись с помощью солей тяжелых металлов и неорганических солей йода. Крайне высокая токсичность этих веществ ограничивала дальнейшее развитие ангиографии, ввиду большого числа осложнений.
Присоединение атомов йода к молекулам органических веществ позволило создать новые, менее токсичные рентгеноконтрастные вещества. В 1925 – 1929 гг. компанией Эрнеста Шеринга велась активная разработка органических йодсодержащих КВ; уже в 1929 году Swick впервые выполнил в/в урографию с помощью йодсодержащего препарата уроселектан (Schering AG). В 1950-х годах в клиническую практику были внедрены йодсодержащие КВ из группы диатризоатов (урографин, ренографин, гипак), которые были менее токсичны, чем прежние препараты. Следующей значимой вехой в интервенционной кардиологии стало выполнение первой селективной коронарографии F. Sones в 1958 году (с помощью гипака).
В 1964 году шведский радиолог Torsten Аlmen разработал новую концепцию строения КВ, и в 1969 году по его заказу было синтезировано первое неионное контрастное вещество Амипак. Необходимо отметить, что после внедрения неионных КВ частота осложнений после выполнения ангиографии значительно уменьшилась. Как известно, первую баллонную ангиопластику коронарных артерий у человека выполнил в 1977 году А. Gruentzig, а первое стентирование коронарных артерий – в 1986 году U. Sigwart (Швейцария) и J. Puel (Франция), в разных клиниках, независимо друг от друга. Пионеры интервенционной кардиологии выполняли свои первые вмешательства уже с помощью более безопасных неионных КВ.
В настоящее время в интервенционной кардиологии и ангиологии используют только неионные низкоосмолярные (омнипак, ксенетикс) и изоосмолярные (визипак) контрастные препараты (1, 2). Основные виды контрастных веществ (КВ) представлены в таблице 1.
Свойства контрастных веществ.
Выделяют несколько основных факторов, которые определяют безопасность контрастного препарата. Это осмолярность, вязкость, гидрофильность, растворимость и электрическая активность (ионность).
Виды контрастных веществ
Международное
название
Торговое
Таблица 1. Виды контрастных веществ, используемых в интервенционной ангиологии.
Осмолярность определяется числом частиц вещества в растворе. Чем больше данных частиц, тем выше осмолярность. Относительно крови человека, осмолярность которой составляет 280 мОсм/кг Н2О, контрастные препараты могут быть низкоосмолярными, если осмолярность не превышает 1200 мОсм/кг Н2О, высокоосмолярными - выше 1200 мОсм/кг Н2О и изоосмолярными. Высокая осмолярность раствора является неблагоприятным фактором, поскольку при введении высокогипертоничных растворов в кровь наблюдается расширение сосудов и наступает “сладж-эффект”, вызванный повышением осмотического давления крови. При этом оказывается отрицательное воздействие на эндотелий, кровяные клетки, клеточные мембраны и протеины.
Вязкость – свойство жидкостей, характеризующее сопротивление действию внешних сил, вызывающих их течение. С одной стороны, более высокая вязкость контрастного вещества является положительным фактором, поскольку определяет лучшую контрастность изображения, с другой – отрицательной, т. к. может ухудшать микроциркуляцию в почках. Высокая гидрофильность и низкая липофильность молекулы также являются важными свойствами, поскольку они уменьшают вероятность взаимодействия контрастного вещества с клеткой и, главное, уменьшают вероятность осложнений. Большое влияние на безопасность того или иного КВ оказывает его ионность. В водной среде ионные контрастные вещества распадаются на ионы, в результате количество частичек вещества увеличивается в два раза (из одной молекулы твердого вещества образуется два связанных с водой иона). В отличие от этого, неионные растворы в водной среде не диссоциируют. Поэтому все ионные растворы в силу двукратного увеличения содержания в них отдельных частиц (ионов) имеют осмолярность вдвое большую, чем неионные растворы, что делает их более опасными препаратами для применения.
В современных условиях пока не удалось синтезировать молекулу контрастного вещества, которая бы сочетала в себе только положительные качества, т. е. содержала бы большое количество атомов йода (для высокого качества изображения), обладала высокой гидрофильностью и растворимостью, небольшой вязкостью и низкой осмолярностью. Это происходит вследствие того, что усиление одних полезных качеств всегда ведет к ослаблению других. Поэтому на сегодняшний день в интервенционной ангиологии применяют контрастные препараты с оптимальным соотношением между полезными и нежелательными их свойствами. Так, по данным некоторых исследований, у пациентов с исходно высоким риском развития нефропатии изоосмолярный димер Визипак является более безопасным препаратом, чем низкоосмолярные мономеры Омнипак и Ультравист (4, 5). Тем не менее, изоосмолярные КВ являются более вязкими, чем низкоосмолярные, что, в свою очередь, может являться одним из факторов риска развития нефропатии.
Осложнения при введении контрастных веществ.
Выделяют рефлекторные реакции на введение КВ в сосудистое русло, которые лишь условно можно причислить к осложнениям. Так, при инъекции контрастных препаратов в коронарные артерии может наблюдаться падение артериального давления и частоты сердечных сокращений. При введении КВ в полость сердца иногда отмечается снижение артериального давления, повышение частоты сердечных сокращений и возникновение различных аритмий. Данные реакции обычно непродолжительны и редко приводят к ухудшению состояния пациента.
К наиболее значимым осложнениям относятся тошнота, рвота, кожный зуд, крапивница, анафилактический шок и отек легких. Следует отметить, что в современных условиях данные проблемы встречаются редко; это связано с появлением неионных низко- и изоосмолярных КВ. Тем не менее, до сих пор сохраняется проблема контраст-индуцированной нефропатии (1, 2, 4, 5).
Контраст-индуцированная нефропатия (КИН) - это нарушение почечной функции после внутрисосудистого введения контрастных веществ, обычно определяемое как увеличение концентрации сывороточного креатинина более чем на 25%, или ≥ 0, 5 мг/дл (44 мкмоль/л). В интервенционной кардиологии и ангиологии данное осложнение является одним из наиболее серьезных. Общеизвестно, что КИН является третьей по частоте причиной развития острой почечной недостаточности в стационаре и развивается примерно у 1-5% пациентов, подвергаемых эндоваскулярным вмешательствам. В группах высокого риска частота развития КИН после проведения рентгенохирургических операций достигает 50%, а необходимость использования гемодиализа – 15%.
Главным патогенетическим механизмом, вызывающим развитие КИН, считается вазоконстрикция, приводящая к снижению почечного кровотока и скорости клубочковой фильтрации (СКФ). Также играют роль такие факторы, как стимуляция ренин-ангиотензиновой системы (РАС) и повышение гидростатического давления в канальцах, вызывающее ухудшение интраренальной микроциркуляции. Длительная вазоконстрикция афферентных артериол со снижением фильтрационного давления в клубочках неизбежно сопровождается последующей ишемией мозгового вещества. Как показали эксперименты на животных, введение КВ сопровождалось увеличением продукции свободных кислородных радикалов, снижением активности антиоксидантных ферментов и прямыми токсическими эффектами медиаторов свободных радикалов кислорода.
Наиболее важными факторами риска развития КИН, связанными с пациентом, являются: исходная почечная недостаточность, сахарный диабет, возраст, гиповолемия, гипотензия, низкий сердечный выброс, сердечная недостаточность, пересадка почки в анамнезе, гипоальбуминемия (< 35 г/л) и прием нефротоксичных лекарств. Из факторов, связанных с вмешательством, особенно нужно выделить высокую осмолярность контрастного вещества, большой объем введенного КВ, интраартериальное введение КВ и повторные рентгенохирургические операции в течение 72 часов.
В 2004 году известный американский ученый R. Mehran предложила схему стратификации риска развития КИН, которая в настоящее время является наиболее используемой в мире (6). Согласно этой схеме, каждому фактору риска у данного пациента соответствует определенное число баллов которые потом суммируются.
В зависимости от суммы полученных баллов больному присваивается та или иная степень риска развития КИН (от низкого до очень высокого) и рассчитывается количественный риск выполнения диализа после проведения интервенционного вмешательства (см. таблицу 2).
При анализе отдаленных результатов эндоваскулярных операций у пациентов с разными степенями риска развития КИН были получены интересные результаты. Оказалось, что у пациентов с исходно очень высокой степенью риска по Mehran летальность в течение года после вмешательства составила более 30% (см. рис. 1).
Меры профилактики КИН.
Для снижения риска развития КИН было исследовано множество препаратов – антагонисты аденозина, статины, аскорбиновая кислота, простагландин Е1, допамин, теофиллин, блокаторы кальциевых каналов, L-аргинин, фуросемид, маннитол и другие (7, 8). Особенные надежды возлагались на N-ацетилцистеин, прием которого перед введением контрастных веществ, по данным ряда исследований, снижал вероятность развития КИН и даже был рекомендован для использования у пациентов высокого риска в ряде международных руководств. Однако, данные последних рандомизированных исследований, выполненных на большом количестве больных, свидетельствуют о неубедительном эффекте данного препарата. Так, в рекомендациях 2011 года по лечению пациентов с нестабильной стенокардией Американского Кардиологического Общества ацетилцистеин вообще был вычеркнут из списка мероприятий, рекомендуемых для профилактики КИН (9). По остальным препаратам достоверно положительных результатов также не было получено. Не снижало риск развития КИН в группах пациентов высокого риска использование превентивного гемодиализа или гемофильтрации после выполнения эндоваскулярных вмешательств. В большинстве исследований достоверно подверждается, что единственным реальным методом борьбы с КИН остается гидратация пациента.
Важным элементом профилактики КИН является уменьшение объема вводимого контрастного препарата. Особенное значение это имеет для пациентов с исходно повышенным уровнем креатинина и другими признаками нарушения функции почек (10).
Рекомендуемое максимальное количество КВ для введения при нормальной почечной функции рассчитывается по формуле:
Макс. объем КВ в мл = вес (в кг) х 5
при почечной дисфункции:
Макс. объем КВ в мл = клиренс креатинина (мл/мин) х 5
Использование КВ у пациентов с электролитными нарушениями, в состоянии шока или застойной сердечной недостаточности допускается только по жизненным показаниям (например, при остром инфаркте миокарда). Не следует выполнять рентгенохирургические операции у плановых пациентов до тех пор, пока не будет скорректирован гемодинамический статус и уровень электролитов в сыворотке крови. Кроме того, как минимум за 2 дня перед эндоваскулярным вмешательством должны быть отменены потенциально нефротоксичные препараты, нестероидные противовоспалительные средства, антибиотики и метформин у пациентов с сахарным диабетом. В нашей стране наиболее часто используют схему профилактики КИН, предложенную Российским научным обществом интервенционных кардиоангиологов (РНОИК), которая представлена ниже.
Рекомендации по профилактике КИН Российского научного общества интервенционных кардиоангиологов:
- В/в гидратация 0, 9% раствором NaCl за 2 часа до и спустя 24 часа после введения КВ со скоростью 0, 5 мл/кг/час, при сердечной недостаточности – 1 мл/кг/час; дополнительно рекомендовано обильное питье до и после введения контрастного вещества;
- Стимуляция диуреза лазиксом в/в 0, 5 мг/кг при отрицательном балансе диуреза;
- Контроль диуреза и уровня креатинина в течение 3 суток после введения КВ;
- Отмена метформина, нестероидных противовоспалительных средств и цитотоксических антибиотиков за 48 часов до вмешательства;
- У больных со сниженной функцией почек рекомендовано использование низко- или изоосмолярных КВ (кроме йоксаглата и йогексола) ;
- Использование катетеров малого калибра и автоматических инжекторов;
- Ограничение объема вводимого КВ.
В заключение следует сказать, что использование современных рентгеноконтрастных веществ является относительно безопасным при выполнении эндоваскулярных вмешательств в общей популяции пациентов с сердечно-сосудистыми заболеваниями. Тем не менее, у определенных групп больных необходимо выполнение профилактических мер для предотвращения осложнений (прежде всего, контраст-индуцированной нефропатии).
Список литературы.
1. Gleeson T. , Bulugahapitiya S. Contrast-Induced Nephropathy // Am J Roentgenol 2004; 183 (6): 1673-1689.
2. Thomsen H. S. , Morcos S. K. Contrast media and the kidney: European Society of Urogenital Radiology (ESUR) Guidelines // British Journal of Radiology 2003; 76: 513-518.
3. Goldenberg I. , Matetzky S. Nephropathy induced by contrast media: pathogenesis, risk factors and preventive strategies // CMAJ 2005; 24: 172 (11).
4. Morcos S. K. Prevention of contrast media nephrotoxicity – the story so far // Clin Radiol 2004; 59: 381-389.
5. Safirstein R. , Andrade L. , Vieira J. M. Acetylcysteine and nephrotoxic effects of radiographic contrast agents: a new use for an old drug // N Engl J Med 2000; 343: 210-212.
6. Mehran R. , Aymong E. D. , Nikolsky E. et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention: development and initial validation // J Am Coll Cardiol. 2004; 44: 1393-1399.
7. Vaitkus P. T. Current status of prevention, diagnosis, and management of coronary artery disease in patients with kidney failure // Am Heart J 2000; 139: 1000-1008.
8. Barrett B. J. , Parfrey P. S. Preventing nephropathy induced by contrast medium // N. Engl. J. Med. 2006;354 (4): 379-386.
9. 2011 ACCF/AHA Focused Update of the Guidelines for the Management of Patients With Unstable Angina/ Non–ST-Elevation Myocardial Infarction // Circulation. 2011; 123: 2039-2040.
10. Aspelin P. , Aubry P. , Fransson S. G. ct al. Nephrotoxic effects in high-risk patients undergoing angiography // N. Engl. J. Med. 2003; 348 (6): 491-499.
Контрастная нефропатия

Контрастная нефропатия (КН) характеризуется острым снижением функции почек с повышением уровня креатинина более чем на 25% (более 44 мкмоль/л) от исходного значения в течение от 24 до 48 часов после введения контрастного вещества. Пик уровня креатинина наблюдается на 5-е сутки, затем происходит его постепенное снижение.
В настоящее время в мире наблюдается рост числа рентгеноконтрастных процедур. В последнее время рентгеноконтрастные процедуры становятся сложнее, что влечёт увеличение объёма вводимого контрастного препарата.
КН занимает третье место среди причин развития острого повреждения почек (ОПП) и достигает 12% среди госпитализированных больных [11]. КН возникает примерно у 3% больных, но может возрастать при наличии факторов риска и достигать 50% в сочетании с сахарным диабетом и почечной недостаточностью. Около 12% больных с контрастной нефропатией нуждаются в проведении гемодиализа (ГД) в связи с ОПП [1,3,8]. Смертность в результате ОПП при применении контрастного средства может достигать 34% [1].
Возникновение КН связано с токсичным действием йода, который содержится в контрастном веществе, применяемым во время коронарной ангиографии (КАГ). В настоящее время считается, что развитие КН обусловлено следующими основными механизмами.
В первых непосредственное токсическое действие контрастного вещества на эпителий клеток канальцев, что приводит к увеличению осмолярности в канальцах почек [5].
Во вторых происходит изменение гемодинамики. Мозговой слой почки очень чувствителен к ишемическим повреждениям, а контрастные вещества могут вызывать гипоксию мозгового слоя за счет шунтирования кровотока в кортикальном слое. Установлено, что развитие нефропатии, вызванной контрастными веществами, вызывает изменения в почечной гемодинамике, влияющие на активность многих субстанций, включая повышение активности почечных вазоконстрикторов (вазопрессин, ангиотензин 2, эндотелин) и снижение активности почечных вазодилятаторов (оксид азота (NO), простагландины). Другие факторы также могут уменьшать почечный кровоток, включая повышенную вязкость контрастного вещества и повышенную агрегацию эритроцитов, которая проявляется в уменьшении поступления кислорода [17].
В третьих исследования показали, что эндогенные биологические нарушения, такие как увеличение количества свободных радикалов кислорода и/или снижение активности антиоксидантных ферментов могут усугублять повреждение канальцев почек и вносить свой вклад в развитие КН [17].
Факторы риска, способствующие развитию КН зависят от состояние пациента и свойства используемого контрастного вещества.
Наиболее важным фактором является имеющаяся хроническая почечная недостаточность в сочетании с сахарным диабетом. Риск КН, обусловленной введением контрастного вещества, прямо пропорционален исходному уровню сывороточного креатинина, который увеличивается при наличии диабетической нефропатии.
Застойная сердечная недостаточность в анамнезе является отдельным фактором риска, особенно у пациентов с диабетом или болезнями почек, что возможно, связано с действием низкого сердечного выброса на почечный кровоток, наличием гипертензии, гемодинамической нестабильностью.
Дегидратация также является фактором риска, поскольку связана со сниженной перфузией почек, которая способствует развитию ишемического инсульта, обусловленного действием контрастного вещества.
Физико-химические свойства контрастного вещества, объём вводимого препарата, кратность применения тоже являются определёнными факторами риска КН.
Клиническая картина КН не имеет определённых, специфических черт. Достаточно часто на первое место в клинической картине выходят признаки основного заболевания. В тяжёлых случаях клиническая картина характерна для ОПП.
Для того чтобы свести к минимуму риск развития КН были созданы и предложены шкалы оценки риска. Одной из таких шкал является шкала риска развития КН, предложенная Mehran R. et al. (2004) (табл. 1) [9].
Расчёт риска развития контрастной нефропатии (Mehran R. et al. (2004))
Факторы риска КН
Сниженная ренальная перфузия
Интрааортальная баллонная помпа в течение 24 ч. от процедуры
Рестриктивная сердечная недостаточность функционального класса III-IV или отёк лёгких
Объём контрастного вещества
1 на каждые 100 мл контрастного вещества
Исходное нарушение функции почек
Концентрация креатинина >1,5 мг/дл
Скорость клубочковой фильтрации
В соответствии с приведёнными данными таблицы 1, риск КН имеет следующую интерпретацию:
Риск 1-й категории (≤ 5 баллов) – 7,5% риск КН и 0,04% риск ГД;
Риск 2-й категории (6-10 баллов) – 14% риск КН и 0,12% риск ГД;
Риск 3-й категории (11-16 баллов) – 26,1% риск КН и 1,09% риск ГД;
Риск 4-й категории (≥ 16 баллов) – 57,3% риск КН и 12,6% риск ГД.
Повышение уровня сывороточного креатинина с его пиком на 3-4 день после введения контрастного вещества и снижение клиренса креатинина, отражающего уменьшение скорости клубочковой фильтрации – основные проявления нефротоксического действия контрастного вещества. У 80% пациентов с тяжёлой почечной недостаточностью, нуждающихся в госпитализации или ГД, уровень сывороточного креатинина почти всегда повышается в течение первых 24 часов, с пиком на 2-3 день после введения контрастного вещества, и возвращается к исходному уровню в течение 2 недель. У пациентов с нефропатией может возникнуть необходимость в кратковременном ГД, что удлиняет время пребывания в стационаре и увеличивает риск длительного нарушения функции почек. Следовательно, диагностика КН и как её следствие развитие ОПП строится на динамике концентрации сывороточного креатинина. Однако, повышение уровня креатинина отмечается только через 24-48 часов, что является недостаточно чувствительным показателем формирования КН.
В настоящее время в клиническую практику введены биомаркеры, позволяющие на ранних этапах определить степень повреждения и выявить развитие КН. На данный момент самыми эффективными биомаркерами КН признаны плазменный п-ацетил-β-глюкозамин (pNGAL) и плазменный цистеин (pCysC) [2].
Большое значение отводится профилактике возникновения КН. В настоящее время самым простым методом, позволяющим предотвратить возникновение КН и как её следствие ОПП является гипергидротация [1,4]. Доказано, что внутривенное введение физиологического раствора до и после введения контрастного вещества позволяет увеличить объём циркулирующей крови и уменьшить повреждения, вызванные свободными радикалами [10].
Ряд исследований продемонстрировал преимущество натрия гидрокарбоната в качестве инфузионного раствора перед другими растворами. Это связано с тем, что натрий гидрокарбонат повышает рН среды, что приводит к уменьшению свободных радикалов [1,3].
В настоящее время нет чётких данных, доказывающих эффективность N-ацетилцистеина. Однако, считается, что N-ацетилцистеинпрепятствует почечной вазоконстрикции, устраняет свободные кислородные радикалы и снижает окислительный стресс [12].
Контрастные вещества вызывают артериальную вазоконстрикцию, которая приводит к снижению почечного кровотока. В настоящее время для профилактики КН предлагается использовать препараты, обладающие вазоактивным действием. К данной группе препаратов относится простагландин Е1. Простагландин Е1 является вазодилататором, который улучшает почечный кровоток. По данным Koch J.A. et al. (2000) введение 20 нг/кг/мин благоприятно влияет на концентрацию креатинина после выполненной КАГ [6].
В контексте профилактики КН рассматривается применение таких препаратов как аскорбиновая кислота, теофиллин, антогонисты кальция и ингибиторы АПФ [13,14,15].
Lehner T. et al. (1998) показал, что при ГД выводятся контрастные вещества, но сам он не оказывает воздействия на проявления нефротоксичности контрастного вещества. В-первых, время между введениями контрастного вещества и началом ГД слишком продолжительное и нефротоксичность проявляется уже перед ГД. Во-вторых, контрастное вещество не выводится при ГД настолько, чтобы оказать существенное воздействие на предотвращение развития нефропатии, вызванной контрастным веществом [7]. Считается, что ГД может вызывать нарушение почечной функции через активацию воспалительной реакции и выброс вазоактивных субстанций, которые могут способствовать острой артериальной гипотензии. Стратегия выполнения ГД непосредственно после введения контрастных веществ у пациентов со сниженной почечной функцией не способствует уменьшению частоты осложнений, включая нефротоксическое действие контрастных веществ [16].
Прогноз КН определяется сочетанием факторов риска. При тяжёлом течении КН, особенно приведшей к развитию ОПП, которая потребовала проведения ГД, летальность превышает 50% и двухлетняя выживаемость не превышает 19%.
Читайте также:
- Признаки разрыва или тендинопатии сухожилия задней большеберцовой мышцы
- Признаки растяжения капсулы и адгезивного капсулита плечевого сустава на артрограмме
- Распределение припадков при височной эпилепсии. Височная эпилепсия сна
- Показания, методика введения лекарств, контраста в коленный сустав
- Диагностика чумы. Микробиологическая диагностика чумы. Выделение возбудителя чумы. Чумной бактериофаг. Биологическая проба при чуме. Аллергическая проба при чуме.
