Стент Кроуфорда при травме слезных канальцев. Применение
Добавил пользователь Алексей Ф. Обновлено: 29.01.2026
ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Министерства обороны Российской Федерации, Санкт-Петербург, Россия
Кафедра хирургических болезней, эндоскопической и детской хирургии Института повышения квалификации специалистов здравоохранения, Хабаровск
Комплексное лечение хронического дакриоцистита и сопутствующей патологии полости носа и околоносовых пазух
Журнал: Российская ринология. 2016;24(1): 34‑37
Анатомо-топографические взаимоотношения определяют тесную взаимосвязь между полостью носа, околоносовыми пазухами и слезоотводящей системой. Патологические процессы, протекающие в полости носа, в виду ее непосредственной близости с областью слезоотводящих путей могут распространяться и на них. Цель — совершенствование хирургического лечения дакриоцистита у пациентов с заболеваниями носа и околоносовых пазух. Пациенты и методы. В исследование вошли 56 пациентов, которые были разделены на 2 группы. В 1-ю группу были включены 22 пациента с хроническим дакриоциститом, проходившие лечение в клинике офтальмологии без привлечения врача-оториноларинголога, им была выполнена трансканаликулярная лазерная дакриоцисториностомия, во 2-ю группу — 34 пациента с хроническим дакриоциститом и сопутствующей патологией полости носа и околоносовых пазух, которым была выполнена эндоназальная эндоскопическая дакриоцисториностомия. Результаты. В раннем послеоперационном периоде, начиная со 2-х суток, пациенты 1-й группы отмечали исчезновение отделяемого из слезных точек и уменьшение слезотечения. На 2—3-и сутки пациенты отмечали улучшение носового дыхания, отсутствие слезотечения, улучшение общего состояния. Восстановление нормальных показателей мукоцилиарного клиренса у пациентов обеих групп происходило на протяжении 2—6 мес. Заключение. Комплексный подход к лечению патологии носослезного канала, предусматривающий одновременную коррекцию внутриносовых структур с устранением назальной обструкции и патологических изменений в околоносовых пазухах, позволяет повысить эффективность хирургического лечения хронического дакриоцистита у пациентов с сопутствующей ринологической патологией.
Дакриоциститы у взрослых нередко являются одной из причин длительной нетрудоспособности, составляя 2—7,65% всей офтальмопатологии; у женщин данное заболевание встречается в 6—10 раз чаще, чем у мужчин [1].
Нарушение слезоотведения сопровождается слезотечением, слезостоянием и, как следствие, изменением структуры, снижением качества слезной пленки, ее локальным или полным разрушением. Упорное слезотечение, возникающее при дакриоцистите и стенозе носослезного канала, вызывает ряд неприятных ощущений в виде «затуманивания» зрения, необходимости постоянно осушать глаза, что ухудшает качество жизни пациентов. Выделение экссудата в конъюнктивальный мешок может привезти к тяжелому поражению глаза — хроническому бактериальному конъюнктивиту, язве роговицы, тяжелым осложнениям в виде абсцесса слезного мешка, а также флегмоны орбиты с последующей потерей зрения, менингита [2].
Основные причины дакриоцистита:
1) хронические заболевания слизистой оболочки полости носа;
2) травмы средней зоны лица, носа;
3) ятрогенные нарушения анатомии полости носа.
Тесная взаимосвязь слезного аппарата глаза и ЛОР-органов расширяет спектр возможных пусковых механизмов рассматриваемой в данной работе патологии и диктует необходимость взаимодействия врачей разных специальностей при ее диагностике и лечении. Известна исключительно высокая частота ринологической патологии у больных дакриоциститом, показатели которой достигают, по данным разных авторов, 80—97% [3].
Наружная дакриоцисториностомия, предложенная итальянским ринологом А. Toti (1904), в модификации Dupuy—Dutemps и Bourquet (1921), А.А. Тауми (1948), В.В. Волкова и М.Ю. Султанова (1975), Б.Ф. Черкулова (1991) и других авторов, достаточно трудоемка для хирурга, травматична для пациента (необходимость формирования костного окна, значительная травматизация окружающих тканей и высокая вероятность обильного кровотечения) [4]. Операции с наружным доступом нередко сопровождаются образованием кожных рубцов, эпикантуса, фистулы, которые являются результатом диссекции тканей, хирургической травмы и воспаления. Отсутствие ринологического контроля за состоянием стомы повышает риск ее повторного закрытия. Во время наружной операции возможно позиционирование стомы мешка не на латеральную стенку полости носа, а в решетчатые клетки. Имеется риск травмирования структуры слезных канальцев [5].
Трансканаликулярные лазерные дакриоцисториностомии отличаются простотой образования соустья под контролем оптики и быстрым выполнением операции. Однако высокая температура при карбонизации и абляции тканей повышает степень операционной травмы и способствует возникновению рецидивов.
Применение микродебридера с использованием эндоскопической техники при эндоназальной дакриоцисториностомии, по данным различных авторов, весьма эффективно и сводит к минимуму риск рецидива [6].
Цель исследования — совершенствование хирургического лечения дакриоцистита у пациентов с заболеваниями носа и околоносовых пазух.
1) определить показания к выбору ринохирургического доступа для лечения дакриоцистита;
2) усовершенствовать методику предоперационного лечения ринологической патологии у пациентов с хроническим дакриоциститом, позволяющую создать благоприятные условия для восстановления функций носа в ближайшем послеоперационном периоде.
Пациенты и методы
Под нашим наблюдением находились 56 пациентов, которые были разделены на 2 группы. В 1-ю (контрольную) группу вошли пациенты с хроническим дакриоциститом (n=22), проходившие лечение в клинике офтальмологии без привлечения врача-оториноларинголога, которым была выполнена трансканаликулярная лазерная дакриоцисториностомия. Во 2-ю (основную) группу вошли пациенты с хроническим дакриоциститом и сопутствующей патологией полости носа и околоносовых пазух (n=34), которым была выполнена эндоназальная эндоскопическая дакриоцисториностомия. Эти больные находились на лечении в клинике оториноларинологии. В диагностике заболевания и в выполнении хирургического вмешательств участвовал офтальмолог.
Клиническое обследование больных 1-й группы включало в себя стандартный набор офтальмологических исследований (проверка остроты зрения, рефракции, оценка прозрачности оптических сред и состояние глазного дна, периметрия и тонометрия, биомикроскопия, дакриоцистография с одновременной визуализацией околоносовых пазух), позволяющих оценить состояние органа зрения. Для оценки активной функции слезоотведения применяли цветную канальцевую и цветную слезно-носовую пробы.
Клиническое обследование больных 2-й группы кроме перечисленных выше методов включало также переднюю риноскопию и оптическую эндоскопию полости носа, переднюю активную риноманометрию, компьютерную томографию околоносовых пазух с контрастированием слезоотводящих путей. Для оценки функции активного слезоотведения также применяли цветную канальцевую и цветную слезно-носовую пробы.
Результаты
Эндоскопический осмотр средних и верхних носовых ходов, области обонятельной щели позволил выявить полипозно-измененную слизистую оболочку у 3 (8,8%) больных, добавочные отверстия в проекции задней фонтанеллы у 6 (17,6%) пациентов.
При оценке носовых раковин у 34 (100%) пациентов 2-й группы была выявлена гипертрофия задних концов нижних и средних носовых раковин различной степени выраженности. Смещение перегородки носа выявлено у 28 (82,3%) пациентов. В процессе эндоскопии носоглотки у 4 (11,7%) пациентов определялись аденоидные вегетации.
У всех пациентов с искривлением перегородки носа было выявлено нарушение дыхательной функции, по данным передней активной риноманометрии величина суммарного носового сопротивления составила 0,9±0,12 Па/с/см 3 , асимметрия носового сопротивления составила 59±11,3%. После выполнения анемизации слизистой оболочки произошло уменьшение величины носового сопротивления на 10—20%, при этом изменения степени асимметрии отсутствовали, а суммарный объемный поток до оперативного вмешательства составил 396,9±83,4 см 3 /с, что явилось одним из показаний для выполнения септопластики.
Кроме этого, в ходе предоперационного обследования у 2 (5,9%) пациентов было выявлено кистоподобное образование верхнечелюстной пазухи, у 1 (2,9%) больного — полипозный риносинусит, у 3 (8,8%) исследуемых — киста, гранулема и локальный периодонтит в проекции верхушек корней верхнего зубного ряда.
Как уже говорилось выше, пациентам 1-й и 2-й групп проводили цветную канальцевую и цветную слезно-носовую пробы. Результаты цветной канальцевой пробы у пациентов обеих групп были положительными. Цветная слезно-носовая проба была отрицательной. При промывании слезных путей жидкость выходила через противоположную слезную точку со слизью и гноем.
По результатам дакриоцистографии в 100% случаев была выявлена патология слезного аппарата.
При проведении предоперационной подготовки пациентам основной группы выполнялось консервативное лечение (не менее 2 нед перед операцией), включающее орошение полости носа солевыми растворами, применение интраназальных топических глюкокортикостероидов или системных кортикостероидов (по показаниям) и поливитаминов.
На фоне консервативного лечения у 4 (11,7%) пациентов наблюдалось улучшение функции носового дыхания и общего самочувствия.
Пациентам без сопутствующей ринологической патологии выполнялась трансканаликулярная лазерная дакриоцисториностомия. После обработки операционного поля и анестезии (эпибульбарной — 0,4% раствором инокаина, инфильтрационной — 2% раствором лидокаина, аппликационной — 10% раствором лидокаина эндоназально, а также промывание полости слезного мешка 2% раствором лидокаина) производили расширение верхней слезной точки коническим зондом [7]. Цилиндрическими зондами № 2 и № 3 проверяли проходимость верхнего слезного канальца до упора в слезную кость. Затем в каналец вводили рабочий наконечник световода диодного лазера и продвигали до упора в слезную кость. Не смещая рабочий конец световода с момента упора, его переводили в вертикальное положение приблизительно на 10 мм книзу от места первоначального упора. Излучением лазера (длина волны 1,56 мкм, мощность 5 Вт в непрерывном режиме с экспозицией 5—10 с) формировали риностомическое отверстие диаметром 3—4 мм. Через оба слезных канальца и риностому в полость носа с помощью канюли-проводника проводили упругую полипропиленовую нить с шариком на конце.
После этого через оба слезных канальца и риностому в полость носа проводили двойную силиконовую нить [8]. Место формирования риностомы и положение нити в носу контролировали с помощью эндоскопа. Концы нити после перевязывания лигатурой и завязывания страхующих узелков вводили в полость носа [9].
Пациентам 2-й группы выполнялась эндоскопическая эндоназальная дакриоцисториностомия с оперативной коррекцией сопутствующей ринологической патологии. У 31 (91,2%) пациента была выполнена септопластика, подслизистая вазотомия нижних носовых раковин, частичная ультразвуковая задняя конхотомия, у 4 (11,7%) — септопластика, подслизистая вазотомия нижних носовых раковин, частичная ультразвуковая задняя конхотомия, частичная инфундибулотомия, эндоназальная эндоскопическая гайморотомия.
Эндоназальную дакриоцисториностомию выполняли под эндотрахеальным наркозом. После введения больного в наркоз производили инфильтрационную анестезию — вводили 1% раствор лидокаина с адреналином (1:200 000) в слизистую оболочку валика носа (agger nasi). Под контролем эндоскопа серповидным ножом производили разрез слизистой оболочки в области проекции слезного мешка в форме прямоугольника размером 1×1 см. Лоскут отсепаровывали вместе с надкостницей и укладывали в средний носовой ход. Таким образом формировали доступ к костной стенке, отделяющей слезный мешок от полости носа. На втором этапе выполнялось формирование костного окна. Наиболее полезным и безопасным инструментом для данного этапа является хирургическая бормашина. Режущим бором производили удаление большей части костного массива в зоне проекции слезного мешка. Сформированное костное отверстие располагалось в нижней части слезной ямки. Нижний край отверстия соответствовал месту перехода слезного мешка в слезно-носовой проток, а наружный край — середине слезной ямки. Важно и то, что именно в нижней части слезной ямки кость наиболее тонкая. После того как в костном окне появлялась стенка слезного мешка, работу режущим бором прекращали, а оставшийся тонкий слой кости удаляли с помощью алмазного бора. Применение алмазных боров позволяет избежать травмы стенки слезного мешка и сгладить острые костные края. Идентификация слезного мешка производилась при помощи зонда, введенного через нижнюю слезную точку по направлению к сформированному костному окну. Со стороны слезных канальцев через риностому в полость носа проводили полипропиленовую нить с шариком на конце, затем — шелковые лигатурные нити и с их помощью — двойную силиконовую нить. Концы нити после перевязывания лигатурой и завязывания страхующих узелков помещали в полости носа.
При проведении трансканаликулярной лазерной дакриоцисториностомии и эндоназальной эндоскопической дакриоцисториностомии стентирование (проведение двойной силиконовой нити) выполнялось в 100% случаев.
Сроки госпитализации пациентов 2-й группы составили 2—3 сут.
В послеоперационном периоде пациентам обеих групп назначали капли тобрадекс 4—6 раз день. В раннем послеоперационном периоде, начиная со 2-х суток, пациенты 1-й группы отмечали исчезновение отделяемого из слезных точек и уменьшение слезотечения. Область слезного мешка при пальпации была безболезненна.
Ежедневно пациентам основной группы, находившимся на стационарном лечении, проводили инструментальную санацию полости носа, контролируя реактивные изменения слизистой в области хирургического вмешательства.
На 2—3-и сутки пациенты отмечали улучшение носового дыхания, отсутствие слезотечения и улучшение общего состояния.
Восстановление нормальных показателей мукоцилиарного клиренса у пациентов обеих групп происходило на протяжении 2—6 мес.
В течение 3—6 мес после операции у 90% пациентов отмечались улучшение общего самочувствия и отсутствие гнойного отделяемого. Стенты в обеих группах удалялись через 3—4 мес после оперативного лечения.
В 1-й группе рецидивы наблюдались в 6 (27,2%) случаях: в сроки до 4 мес — у 3 (13,6%) пациентов, в течение 5—6 мес — у 2 (9%) исследуемых, более чем через 6 мес — у 1 (4,5%) больного.
Рецидивы после проведения эндоназальной эндоскопической дакриоцисториностомии в комплексе с оперативным лечением патологии полости носа и околоносовых пазух были отмечены у 2 (5,8%) пациентов. При этом в сроки до 4 мес они не наблюдались, через 5—6 мес рецидив был выявлен у 1 (2,9%) пациента, более чем через 6 мес — также у 1 (2,9%) больного.
Выводы
1. Эндоназальная эндоскопическая дакриоцисториностомия и трансканаликулярная лазерная дакриоцисториностомия с проведением двойной силиконовой нити (стентированием) малотравматичны и эффективны, не сопровождаются косметическими нарушениями.
2. Комплексный подход к лечению патологии носослезного канала, предусматривающий одновременную коррекцию внутриносовых структур с устранением назальной обструкции и патологических изменений в околоносовых пазухах, позволяет повысить эффективность хирургического лечения хронического дакриоцистита у пациентов с сопутствующей ринологической патологией.
Стент Кроуфорда при травме слезных канальцев. Применение
Моноканаликулярный стент, кольцевой стент при травме слезных канальцев. Применение
Моноканаликулярный стент (Mini Monoka) используют при повреждениях наружных 2/3 одного канальца.
• Находят просветы поврежденного канальца, как было описано выше.
• Моноканаликулярный стент подрезают до нужного размера таким образом, чтобы конец капилляра находился в слезном мешке (приблизительно 12 мм).
• Слезную точку расширяют и продвигают стент через оба поврежденных конца.
• Глубокие мягкие ткани сшивают узловыми швами 7—0 полигликолиевой кислоты. Швы накладывают близко к поврежденным концам канальца для лучшего сближения. При слишком большом напряжении используют 5—0 полигликолиевую кислоту.
• Кожу сшивают прерывными (узловыми) швами 7—0 полигликолиевой кислоты или нейлоном.
• Два прерывных 8—0 викриловых шва накладывают через медиальный и латеральный концы основания стента для того, чтобы фиксировать его к краю века.
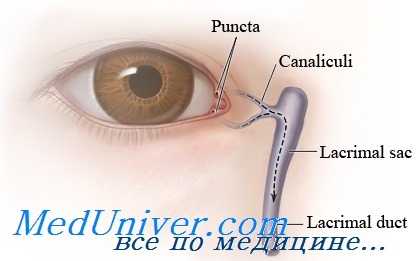
Кольцевой стент при травме слезных канальцев
Данный метод заключается в установке силиконового биканаликулярного стента в канальцевую систему, используя зонд типа «поросячий хвост». Его применение было описано ранее, и он используется не только при канальцевых повреждениях, но и при реконструкции внутреннего угла глаза с захватом слезоотводящих путей по Moh.
• Зонд типа «поросячий хвост» проводят через неповрежденный каналец и выводят через поврежденный проксимальный конец.
• Участок зонда прошивают 6—0 проленовым швом (иглу удаляют).
Затем зонд удаляют, натягивая шов через каналец.
• Противоположный конец зонда проводят через противоположную слезную точку и выводят через дистальный разорванный конец. Другим концом 6—0 проленовой нити прошивают участок зонда и удаляют его, протягивая шов через слезную точку. 6—0 проленовая нить служит проводником, по которому проводят силиконовый стент.
• Используя часть силиконового стента Кроуфорда (внутренний шов удаляют), стент проводят вокруг 6—0 проленового шва и через канальцевую систему. Покрытие стента мазью с антибиотиком облегчит его установку. Нужно постараться не перекручивать шов, так как перекруты значительно усложняют процесс. Стент вставляют в одну слезную точку и продвигают через поврежденный край, затем выводят через другую слезную точку.
• Оба конца силиконового стента захватывают в иглодержатель для предотвращения прошивания, а также для того, чтобы стент не сорвался. Когда канальцевая система полностью канюлирована, следует заняться восстановлением целостности окружающих мягких тканей, как было описано выше. Если предпринять такие действия до завязывания стента, то удастся избежать оставления слишком длинного стента, который может травмировать роговицу.
• После восстановления целостности мягких тканей подбирают нужный размер стента и концы его захватывают иглодержателем. Затем стент подрезают до нужного размера силиконовым стриппером. Силиконовый стриппер позволяет отделить силиконовую трубку от лежащего под ним проленового шва. Стриппер захватывают указательным пальцем и большим пальцем берут за самые нижние отверстия инструмента для лучшего контроля. Трубку обхватывают и инструмент аккуратно оттягивают кверху.
• Когда стент подрезан до нужного размера, его подвязывают к проленовому шву тремя узелками.
• Узелок аккуратно поворачивают к слезному мешку, используя зажимы и иглодержатели.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Восстановление слезных канальцев при травме. Принципы
При любом повреждении в области медиального края глазной щели должен был произведен тщательный осмотр на предмет выявления повреждения слезных канальцев. При отсутствии полной уверенности в том, повреждены ли канальцы, следует расширить слезные точки и прозондировать их зондом Боумена 0 или 00, стараясь избежать ложного хода. Если зонд проходит правильно, то, скорее всего, слезоотводящие пути интактны.
Хирургическое восстановление слезных канальцев
Для восстановления поврежденных канальцев существует множество методов. Среди них моноканаликулярный стент, биканаликулярный кольцевой стент и биканаликулярный стент Кроуфорда. Стент обеспечивает адекватное восстановление поврежденных краев канальцев, обычно его устанавливают на 3—6 месяцев. При установке внеоперационной обычно не используют стент Кроуфорда, так как его установка часто требует применения седативных средств.
Установка моноканаликулярного стента требует наличия только одного канальца. Это особенно важно для небольшого процента людей, не имеющих общего канальца, когда затруднен биканаликулярно-кольцевой способ интубации. Биканаликулярные стенты, такие как стент Кроуфорда и кольцевой стент, более устойчивы, и их смещение менее вероятно.
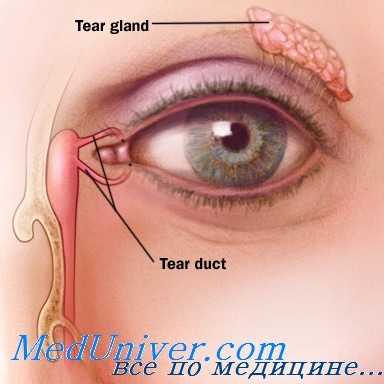
При выборе любого из этих методов операционное поле моют, анестезируют и обкладывают стерильными салфетками. Особое внимание уделяют выделению концов травмированных канальцев, для этого ткани осматривают при помощи хирургической лупы или в операционный микроскоп. Чаще всего их довольно легко обнаружить, ориентируясь на то, что края поврежденного канальца беловатые, «сверкают эпителиальной белизной».
Если не удалось таким образом обнаружить место разрыва, то существует несколько приемов для его идентификации:
1. Окраска травмированной области при помощи стерильной флуоресцеиновой полоски поможет обнаружить место разрыва канальцев.
2. Введение окрашенного физиологического раствора или вискоэластика через интактные пути покажет пассаж жидкости через травмированный конец канальца.
3. Можно ввести воздух через слезную точку и наблюдать выделение пузырьков из разорванного конца.
4. Если проксимальный конец травмированного канальца все же не выделен, надо после погружения в мазь с содержанием стероидов и антибиотиков ввести зонд типа «поросячий хвост» через интактную слезную точку и аккуратно закрутить его по направлению поврежденного канальца, следуя нормальному анатомическому строению последнего. Конец зонда будет выведен в месте разрыва канальца. Пробу следует проводить осторожно, чтобы избежать ложного хода.
Когда просвет поврежденного канальца найден, следует приступать к его восстановлению. Каждую методику мы опишем отдельно.
Лечение взрывных переломов глазницы. Рекомендации
В начальном посттравматическом периоде пациенты получают системную антибиотикотерапию (обычно цефалоспорины первого поколения), назальные деконгестанты и пакеты со льдом. Некоторые предпочитают отложить хирургическое лечение «взрывных» переломов на 7—10 дней для уменьшения отека и рассасывания кровоизлияний. Для разработки хирургического подхода необходима консультация хирурга-окулопластика.
Диплопия часто является следствием кровоизлияний и отеков в тканях нижней прямой мышцы и, в таком случае, разрешается спонтанно. Время проведения и показания для хирургического вмешательства являются предметом обсуждения. Выделяют следующие показания для проведения хирургического вмешательства:
1. Признаки ущемления нижней прямой мышцы глаза или околомышечных тканей с явлениями диплопии
2. Заметный энофтальм через 7—10 дней после травмы
3. Травмы с высоким риском последующего энофтальма:
а. обширные переломы дна и/или медиальной стенки
б. комбинированные переломы дна и медиальной стенки глазницы
Если диплопия сохраняется по прошествии 7—10 дней, для подтверждения ущемления мышцы выполняют форсированный тест. Лидокаином или тетракаином проводят местную анестезию глазного яблока книзу от лимба. Глазное яблоко захватывают пинцетом за конъюнктиву и поворачивают кверху. При положительном тесте глазное яблоко повернуть невозможно, что указывает на ущемление нижней прямой мышцы, нижней косой мышцы или фиброзной околомышечной ткани. Форсированный тест также проводится для определения, является ли мышечная дисфункция следствием отека или гематомы.
Глазное яблоко захватывают зажимом за конъюнктиву и пациента просят смотреть в направлении исследуемой мышцы (обычно вниз — при поражении нижней прямой мышцы). Таким образом, врач сможет определить, действует ли мышца.
Намного легче и эффективнее проводить коррекцию энофтальма в ранние сроки, так как по прошествии определенного времени энофтальм осложняется атрофией орбитальной жировой клетчатки и укорочением наружных мышц глаза. Операция выполняется под общей анестезией. Доступ к дну глазницы можно получить через трансконъюнктивальный или субцилиарный разрез. Обнажают надкостницу нижнего орбитального края, и надкостницу глазницы осторожно приподнимают от дна и медиальной стенки. Ущемленные ткани аккуратно высвобождают при помощи тупых инструментов, например, периостального элеватора Freer.
Хирург ищет задний край перелома дна для установки орбитального имплантата. В качестве имплантата используют множество материалов, включая нейлон (супрамид), пористый полиэтилен, тефлон, кость и др. Целью является реконструкция нормального контура стенок глазницы и репозиция орбитальных тканей в глазницу. Следует соблюдать осторожность, чтобы не повредить подглазничный нерв, который хорошо заметен на дне глазницы. Доступ к медиальной стенке глазницы осуществляется через дно или транскарункулярный разрез. При обширных переломах медиальной стенки часто требуется установка имплантата.
Небольшие переломы медиальной стенки обычно не требуют восстановления, они редко вызывают ущемление мышц. Надкостницу сшивают, так же как конъюнктиву или кожу. Могут быть оставлены шелковые швы на реберном крае нижнего века (обеспечивающие натяжение), которые фиксируются к коже лба в течение первой послеоперационной недели. Это поможет предотвратить ретракцию нижнего века и обеспечит защиту глаза в течение раннего послеоперационного периода. Пациенты получают подробные инструкции не выдувать воздух с силой через нос и избегать чрезмерной физической нагрузки.
Некоторые переломы глазницы требуют немедленного хирургического вмешательства, в таких случаях отсрочка на 7—10 дней невозможна. Они носят название «переломы-ловушки», некоторые авторы описывают их как «взрывные» переломы типа «white-eyed».13 Переломы такого типа обычно наблюдаются у детей и молодых людей при неполном переломе нижней стенки глазницы. В таких клинических случаях может потребоваться консультация специалиста по окулопластике. Неоскольчатый (в виде петли) перелом дна глазницы сопровождается плотным ущемлением нижней прямой мышцы или околомышечных тканей.
Такой перелом напоминает перелом по типу «зеленой ветки», при котором кость не ломается полностью, а может деформироваться и быстро возвращаться в исходную конфигурацию вследствие высокой эластичности костей в молодом возрасте. Временная деформация дна глазницы вызывает прочное ущемление тканей. У таких пациентов отмечается значительное ограничение подвижности глазного яблока при взгляде вверх. Кроме того, у данных пациентов может наблюдаться окулокардиальный рефлекс с тошнотой, рвотой, брадикардией и блокадой сердца.
Такое состояние может быть опасно для жизни, при симптомах сердечной блокады рекомендуется провести ЭКГ-исследование. Корональная КТ может выявить «отсутствие» нижней прямой мышцы при практически нормальном дне глазницы с локализацией мышцы в верхнечелюстной пазухе. Томограммы могут быть интерпретированы как нормальные, в таком случае необходимо получить мнение нескольких специалистов. При таком переломе может быстро развиться ишемия нижней прямой мышцы с ишемическим некрозом, следствиями которого будут фиброз и потеря функции мышцы. Следовательно, операцию рекомендуется провести в пределах 24—72 часов для предотвращения некроза мышцы и уменьшения риска тяжелой брадикардии вследствие развития окулокардиального рефлекса.
Медиальная стенка глазницы образована преимущественно тонкой бумажной пластинкой решетчатой кости и также легко подвержена переломам; переломы медиальной стенки часто сочетаются с переломами дна глазницы. Изолированные переломы медиальной стенки встречаются намного реже и требуют особого наблюдения, так как могут быстро вызвать нарушения подвижности глаза. Они также являются частой причиной позднего развития энофтальма. Осложнения переломов медиальной стенки глазницы включают ущемление внутренней прямой мышцы, эмфизему глазницы, псевдосиндром Дуэйна, при котором наблюдается втягивание глазного яблока в глазницу, верхнее веко опускается при повороте глаза к носу (абдукции), а также может возникнуть поздний энофтальм.17 Хирургическое вмешательство требуется при обширных переломах медиальной стенки глазницы и при ущемлении мышцы костными отломками.
Переломы крыши глазницы обычно наблюдаются в результате серьезных травм, например, после дорожно-транспортных происшествий или падений с высоты. Такие переломы могут сочетаться с повреждением лобной пазухи и внутричерепных структур. В числе осложнений могут быть истечение цереброспинальной жидкости, внутричерепное кровоизлияние, дисбаланс наружных мышц глаза с болезненным ограничением подвижности при взгляде вверх, птоз, травматическое энцефалоцеле, менингит и абсцесс мозга. Верхняя поднадкостничная гематома может вызвать смещение глаза книзу. При простом переломе крыши глазницы без перелома внутренней пластинки черепной кости доступ к нему может быть осуществлен через разрез со стороны надбровной дуги. Более сложные переломы требуют консультации нейрохирурга и/или оториноларинголога.
Назоэтмоидальные переломы являются результатом контузионной травмы, направленной в среднюю часть лица. Переломы костей носа и решетчатой кости обычно сопровождаются расширением внутреннего угла глазной щели (травматический телекантус) и уплощением переносицы. Переломы, захватывающие слезоотводящие пути, сопровождаются обструкцией носослезного протока и слезотечением. Переломы медиальной стенки глазницы могут распространяться в переднюю черепную ямку. Такие переломы часто захватывают решетчатую пластинку с проникновением костных отломков в переднюю черепную ямку и сопровождаются ринореей цереброспинальной жидкости.
При продолжающейся ринорее СМЖ требуется консультация нейрохирурга. Хирургическое вмешательство при травматическом телекантусе или обструкции носослезного протока выполняет специалист по окулопластике.
Переломы латеральной стенки глазницы также наблюдаются при серьезных травмах, обычно после дорожно-транспортных происшествий, падений или ударов тупыми предметами. Такие переломы редко сопровождаются нарушениями подвижности глаза, но могут также требовать хирургического восстановления при значительных косметических дефектах или при соприкосновении костных отломков с содержимым глазницы.
Наблюдаются также тройные переломы, так называемые переломы «треножника», с захватом скуловой кости. Обычно такие переломы происходят в трех местах: по линии лобно-скулового шва, по скуловой дуге и по нижнему краю глазницы около скуловерхнечелюстного шва. При этом скуловая дуга смещается с уплощением скулового бугра, расширением и смещением книзу латерального края глазницы, увеличением орбиты с энофтальмом; кроме того наблюдается гипестезия щеки и верхних зубов на соответствующей стороне. Уплощение щеки может быть скрыто отеком тканей лица. Перелом может распространяться на дно глазницы с ущемлением ее содержимого и развитием диплопии.
Пациенты часто жалуются на затруднение жевания (тризм), которое является следствием повреждения височно-нижнечелюстного сустава. Большинство хирургов рекомендуют выполнять хирургическое вмешательство в ранние сроки, так как позднее восстановление усложняется развитием фиброза и может потребовать проведения остеотомии.
Переломы в средней части лица называются переломами Ле Форт. При переломе Ле Форт I вовлекается нижний отдел верхней челюсти, глазница не повреждается. Переломы Ле Форт II, также называемые пирамидальными переломами, включают перелом верхней челюсти, костей носа, нижнего края глазницы, медиальной стенки и дна глазницы, а также могут захватывать слезоотводящие пути. Перелом Ле Форт III, называемый также черепно-лицевым разобщением, захватывает кости носа, медиальную и латеральную стенки глазницы и скуловую дугу. При таком переломе лицевой скелет соединен с черепом только мягкими тканями. Вовлечение глазницы при II и III типах может осложняться ущемлением глазодвигательных мышц и развитием диплопии.
Ранние послеоперационные осложнения после восстановления переломов дна и медиальной стенки глазницы включают присоединение инфекции, кровотечение, потерю зрения и развитие диплопии. При слишком большом размере имплантата может развиться компрессия зрительного нерва. Пациенты с ущемлением глазодвигательных мышц часто имеют преходящую послеоперационную диплопию вследствие геморрагии и отека тканей. При старом переломе могут развиваться рубцевание и фиброз нижней прямой мышцы, и в таком случае, даже при полном высвобождении мышцы, может сохраняться диплопия. Таким пациентам может потребоваться операция по коррекции косоглазия для восстановления бинокулярного зрения. Перед проведением таких операций обычно требуется выждать достаточное время (обычно 6 месяцев) для послеоперационного восстановления функции мышцы.
Поздние осложнения обычно связаны с орбитальным имплантатом. Среди них присоединение инфекции, смещение и экструзия. Кроме того, может образоваться интраорбитальная киста, особенно при наличии в орбите остатков слизистой оболочки пазухи. В редких случаях в окружающей имплантат капсуле может развиться позднее кровотечение, при этом пациенты жалуются на боль, ощущение давления, воспаление и проптоз.
Восстановление старых переломов затруднено, т.к. они обычно осложняются развитием фиброза ущемленных тканей и атрофией жировой клетчатки. Тем не менее, часто имеют место хорошие результаты. Другие возможности хирургического лечения включают коррекцию косоглазия для восстановления бинокулярного зрения и блефаропластику верхнего века с целью маскировки энофтальма на травмированной стороне.
Интубационные методы лечения дакриостенозов на современном этапе
Актуальность. Стеноз слезных протоков - наиболее частая проблема в дакриологии и одна из основных причин дакриоцистита. Патогенетически обоснованным методом лечения дакриостенозов является рассечение спаек и стентирование слезных путей. Начало применения эндоскопии в ринологии дало импульс к использованию эндоназального доступа офтальмологами. В последние годы оптические волокна, предназначенные для эндоскопии, благодаря инновационным технологиям их изготовления, стали значительно тоньше, что сделало возможным их антеградное введение в просвет слезного канальца. Широко известны два типа стентов: полиуретановый (ЗАО «Медсил», РФ) и силконовый (FCI, Франция), отличающиеся не только материалом, из которого изготовлена трубка-стент, но и способом его проведения в лакримальный тракт [2, 4]. Ряд авторов предлагает использовать интубационные методы так же и при дакриоциститах путем реканализации естественного пути слезооттока [1]. Главным недостатком стентов является то, что они обтурируют собой просвет слезных протоков. Это приводит к жалобам пациентов на слезотечение в период нахождения стента в слезных путях. По этой же причине может возникать вторичная альтерация, в том числе и в слезном мешке. В этом смысле более выигрышно выглядит моноканаликулярное стентирование или использование дренажей типа «нунчаки». Однако, в первом случае возникают косметические неудобства, связанные с необходимостью крепления концов стента на лице, во втором — возможна дислокация дренажа в сторону конъюнктивального мешка, ввиду того, что его свободные концы не фиксируются в полости носа, а силиконовая трубка, смоченная слезной жидкостью, легко скользит и мигрирует [6]. Таким образом, основным различием между дренированием и стентированием слезных путей является то, что стент, поддерживая просвет слезных протоков, препятствует пассажу слезы, а дренаж позволяет ей из конъюнктивального мешка через трубку оттекать в полость носа. Также через дренаж можно проводить лечебные промывания.
Сравнительный анализ материалов, из которых изготавливается трубка, показывает, что полиуретан обладает низкими фрикционными свойствами, обеспечивает сохранение просвета слезоотводящих путей, поддерживая их форму. Однако такие стенты быстро колонизируются штаммами различных бактерий и инкрустируются кристаллами солей, а при длительном использовании выделяют токсичные продукты. Все эти обстоятельства ограничивают применение полиуретановых стентов лишь краткосрочным периодом.
Силикон же относится к наиболее биоинертным материалам, обеспечивая максимальную биосовместимость, и по своим физико-химическим свойствам (эластичность, прочность и т.д.) близок к мягким тканям организма и при импланатации вызывет меньше раздражения, чем многие другие синтетические материалы. При этом описаны случаи разрастания грануляций и прорезывания канальцев силиконовыми трубками [2,7], что не встречается при использовании полиуретана [5].
Цель Провести сравнительную оценку стентирования и дренирования слезоотводящих путей, а также определить место трансканаликулярной эндоскопии при дакриостенозах различного уровня.
Материал и методы Проанализированы результаты 500 операций по поводу непроходимости слезных путей разного уровня. Эндоскопическое исследование слезных путей с использованием систем «Flexiscope» (Италия) и «Machida» (Япония) было проведено 56 пациентам с эпифорой, вызванной блокадой слезоотведения на различных уровнях. Процедура выполнялась под местной анестезией в условиях стерильной операционной. Эндоскоп вводился со стороны слезной точки и направлялся антеградно к устью носослезного канала. Для облегчения скольжения эндоскопа использовался вискоэластик. Меняя угол наклона рукоятки эндоскопа, а также посредством манипуляций с веком, достигалась соосность эндоскопа и просвета слезного канальца. Одномоментно с исследованием выполнялись вмешательства, направленные на разрушение препятствий слезооттоку.
В зависимости от конкретной клинической ситуации использовались: полиуретановые стенты и дренажи (ЗАО «Медсил»), силиконовые стенты (FCI), установленные на сроки от 2 недель до 4 месяцев, в том числе последовательно (1-м этапом полиуретановый дренаж, 2-м - силиконовый стент). Возраст пациентов - от 4 месяцев до 85 лет. Мужчин - 23,57%, женщин - 76,43%. По уровню непроходимости пациенты разделились следующим образом: пресаккальный, т.е непроходимость на протяжении и в устье слезных канальцев – 13,76%, постсаккальный, в том числе у новорожденных – 71,38%, непроходимость носила многоуровневый характер в 14,86% случаев. Основным отличием дренажа от стента являлось наличие в стенке дренажной трубки овального отверстия [3]. При использовании данной конструкции отверстие располагается в медиальном углу глаза и обращено латерально для создания условий оттока слезной жидкости по дренажу. Это же отверстие может быть использовано для лечебных промываний слезных путей антибактериальными препаратами, глюкокортикостероидами и ферментами. При необходимости интраоперационно в стенке трубки может производиться дополнительная перфорация, что способно повысить эффективность лечебных промываний. В ходе работы пациенты были также разделены на следующие группы: 1 - после устранения непроходимости слезных путей или формирования анастомоза биканаликулярно установливались полиуретановый или силиконовый стенты, 2 – то же с проведением полиуретанового дренажа, у 3-й группы больных лечение носило этапный характер: вслед за непродолжительным (2-4 недели) дренированием слезных путей проводился силиконовый стент, но уже на более продолжительное время (2-4 месяца).
Трансканаликулярно через дилятированную коническими зондами нижнюю слезную точку в слезно-носовой канал или дакриоцисториностому проводился зонд Ритленга, снабженный внутренним каналом. Через зонд проводилась окрашенная леска-проводник, конец которой под контролем риноскопа извлекался из полости носа при помощи крючка Ритленга. Удалялся зонд Ритленга. Со стороны преддверия носа на леску одевалась дренажная трубка. Удерживая ее на проводнике, тянули за противоположный конец лески до выведения верхнего конца дренажной трубки из нижней слезной точки. Через дилятированную коническими зондами верхнюю слезную точку в слезно-носовой канал или дакриоцисториностому проводился зонд Ритленга. Через зонд проводилась окрашенная леска-проводник, конец которой под контролем риноскопа извлекался из полости носа при помощи крючка Ритленга. Удалялся зонд Ритленга. Верхний конец лески вводился в трубку. Удерживая трубку на леске, тянули за противоположный конец лески, при этом верхний конец трубки вместе с леской внедрялся через верхнюю слезную точку в одноименный слезный каналец, а затем в слезно-носовой канал или дакриоцисториностому, полость носа и выводился наружу через преддверие носа. Леска извлекалась из полости дренажной трубки. Концы трубки подрезались на уровне преддверия носа или погружались в полость носа и там клепировались.
Замена дренажа (группа № 3) производилась через 2-4 недели интубации. Для этого полиуретановый дренаж рассекался в зоне свободного доступа между слезными канальцами. В оба «рукава» трубки вводились лески-проводники, на которых зажимами типа «москит» фиксировались две половины силиконового стента, после проведения которого фрагментированный полиуретановый стент удалялся.
Результаты Трансканаликулярная эндоскопия позволила визуально определить уровень непроходимости слезоотводящих путей. По характеру содержимого слезного мешка, состоянию его слизистой можно было судить о клинической форме дакриоцистита. Эндоскопическая система «Flexiscope» имеет в своем составе режущий наконечник с ротационной подачей, который заключен в общий со световодом кожух. Это позволило одновременно с исследованием производить дозированное рассечение синехий стенок канальцев. Система имеет в качестве дополнительной опции канал и совместимый с ним лазерный световод. Эта технологическая инновация предназначена как для рассечения мягкотканых препятствий слезооттоку, так и для выполнения трепанации кости в случае необходимости формирования дакриоцисториностомы при обструкции вертикального колена слезоотводящего тракта. Преимуществами лакримального эндоскопа фирмы «Machida» являются лучшее качество изображения исследуемых структур и, как следствие, более точная интерпретация полученных в ходе исследования данных, а также меньший вес устройства и удобная геометрия эндоскопа, сконструированного с учетом анатомических особенностей в зоне проводимых манипуляций.
Наилучшие результаты были достигнуты в случаях постсаккальных стенозов новорожденных (98% эффективности). При этом как в 1-ой, так и во 2-ой группе результаты были схожими и отличались лишь сохранением эпифоры в период нахождения трубки в слезных путях у новорожденных из 1-ой группы. Ни в одном из этих случаев не потребовалось пролонгирования интубации более 2 недель.
Использование интубационных методов при дакриоциститах у взрослых оказалось целесообразным при неосложненном течении воспаления и на его начальном этапе (катаральный дакриоцистит). Мы убедились в том, что в этих случаях краткосрочное дренирование полиуретановой трубкой предпочтительно, при этом на стенку дренажа наносились дополнительные отверстия так, чтобы пассивному и активному орошению подвергались полость слезного мешка и устье слезно-носового протока. Сопоставление результатов операций у этих пациентов показало рост эффективности на 20% в группе №2 по сравнению с группой №1.
В ходе дакриоцисториностомии стентирование и дренирование применялось в следующих случаях: многоуровневые дакриостенозы, наличие спаек по ходу и в устье слезных канальцев, флегмона слезного мешка, лакримальные свищи, дакриоцистоцеле, сопутствующая ринопатология, выраженное интраоперационное кровотечение, травмы, рецидивы. Усредненное распределение положительных исходов хирургического лечения в трех группах исследования у таких пациентов было – 89%, 93,4%, 94,2% соответственно и зависело от тяжести исходного состояния.
После операций по поводу канальцевой обструкции основной жалобой пациентов 1-ой группы было слезотечение и слезостояние, которое сохранялось до тех пор, пока стент заполнял слезоотводящий тракт. Позже стент удалялся и проводились лечебные промывания 2-3 раза в неделю в течение 1 месяца. В 72% случаев восстановление нормального слезооттока после завершения лечения было достигнуто. Пациентам 2-ой группы на протяжении всего периода дренирования проводилось промывание слезных путей через окно в трубке, которое было доступно у внутреннего угла глаза. Также эту процедуру было возможно проводить и ретроградно через концы трубки, выведенные из полости носа. Эффективность лечения в группе №2 превысила 80%. Кроме того, значительно меньшее число пациентов 2-ой группы жаловалось на слезотечение в период нахождения дренажа в слезных путях.
Травматические повреждения канальцев и врожденные атрезии очень вариативны и отличаются главным образом протяженностью облитерированного участка слезных протоков. Часто таким пациентам приходится производить протезирование канальцев или накладывать лакориностому. Интубационные методы в таких случаях не отличаются высокой эффективностью, однако статистически достоверным оказалось их преимущество при условии длительной интубации дренажами и стентами, отличающимися по своим физико-химическим свойствам (группа №3). Способность полиуретановых дренажей (в отличие от силиконовых) создавать хороший каркас для поврежденных канальцев, сохранение перфораций, нанесенных на стенку трубки, и проходимости особенно важны в ранний послеоперационный период, когда эпителизируются раневые поверхности. Биоинертность, фрикционность, смачиваемость силиконовой трубки позволяли удерживать ее в слезных путях пациентов этой группы длительное время. Данный метод позволил восстановить слезоотведение, примерно, в половине трудноизлечимых случаев рецидивирующих пресаккальных дакриостенозов
Выводы Эндоскопия слезных протоков обладает высокой информативностью и с успехом может заменить такие травматичные методы исследования уровня окклюзии слезных путей как диагностическое зондирование и бужирование, а также контрастную рентгенографию. Использование эндоскопии в ходе реканализирующих операций открывает дополнительные перспективы в хирургии лакримальных структур с точки зрения ее малоинвазивности.
Стентирование и дренирование сопоставимо по эффективности, однако дренирование открывает дополнительные возможности для более полноценного лечения дакриостенозов. Лакримальные стенты и дренажи, отличаясь по своим физико-химическим свойствам, не являются взаимоисключающими при лечении дакриостенозов. Они, имея каждый свои преимущества, могут с успехом использоваться в режиме "one by one".
Читайте также:
