Лучевые признаки ассоциации VACTERL у плода
Добавил пользователь Владимир З. Обновлено: 24.01.2026
По данным ВОЗ, ежегодно 4–5 % новорожденных появляются на свет с врожденной или наследственной патологией. Из них около 2 % имеют тяжелые аномалии, несовместимые с жизнью, и, прежде всего, это врожденные пороки сердца (ВПС). Почти 40 % ранней детской смертности частично или полностью обусловлено наследственными заболеваниями, половину из которых составляет патология сердечно-сосудистой системы.
Источник:
Автор:
Правообладатель:
По данным ВОЗ, ежегодно 4–5 % новорожденных появляются на свет с врожденной или наследственной патологией. Из них около 2 % имеют тяжелые аномалии, несовместимые с жизнью, и, прежде всего, это врожденные пороки сердца (ВПС). Почти 40 % ранней детской смертности частично или полностью обусловлено наследственными заболеваниями, половину из которых составляет патология сердечно-сосудистой системы [1, 2, 4].
ВПС являются одним из клинических симптомов многочисленных синдромов, связанных с известными хромосомными нарушениями. Ярким примером является синдром Дауна (СД) – частая форма слабоумия, комбинирующаяся с характерными соматическими признаками. Этот синдром описан в 1866 г. J. Down, его частота в популяции составляет – 1:700 новорожденных.
Необходимо отметить, что 50 % больных с СД имеют ВПС, при этом более чем у 40 % пациентов диагностируют атриовентрикулярную коммуникацию (АВК). В то же время в общей популяции частота этого порока составляет 4,7–6,5 % [2–4]. Как объяснение такой неслучайной ассоциации исследователи предполагают, что участок 21-й хромосомы может быть задействован в развитии сердца вообще и эндокардиальных подушечек в частности, дефект которых и лежит в основе АВК. Кроме того, у больных с СД выявляют дефект межжелудочковой перегородки (ДМЖП), дефект межпредсердной перегородки (ДМПП), открытый артериальный проток, тетраду Фалло и др.
В зависимости от степени недоразвития эндокардиальных валиков выделяют две формы порока: неполную и полную.
Полная АВК – это ВПС, включающий сливающиеся между собой низкий (первичный большой) ДМПП, высокий (мембранозный) ДМЖП, аномальное единое центрально расположенное большое атриовентрикулярное отверстие, расщепление створок – чаще митрального (переднемедиальная) или трикуспидального (септальная) клапанов. Общее центральное атриовентрикулярное отверстие при этом прикрывается клапаном, состоящим из передней и задней створок, связанных с остатками перегородок, и двух латеральных створок, прикрепляющихся к боковым стенкам каждого из желудочков.
Порок относится к группе ВПС с гиперволемией малого круга кровообращения, обусловленной артериовенозным сбросом крови через общий атриовентрикулярный септальный дефект в правые отделы сердца и в систему легочной артерии (ЛА). Сброс происходит на уровне предсердий и желудочков. При этом кровь из левого желудочка (ЛЖ) может поступать одновременно через ДМЖП в правый желудочек (ПЖ), через ДМПП в правое предсердие (ПП) и через дефектный атриовентрикулярный клапан в левое предсердие (ЛП), то есть имеет место гемодинамическая ситуация, обусловленная сочетанием трех дефектов: ДМЖП, ДМПП и недостаточности атриовентрикулярного клапана. В результате циркуляции балластного объема крови практически через все отделы сердца возникают объемная перегрузка и дилатация ЛП, ПП и ПЖ, а также гиперволемия и нарастающая спастическая гипертензия малого круга кровообращения. Из-за того что ДМЖП и ДМПП большие, давление между правыми и левыми камерами сердца быстро выравнивается и объем сброса слева направо на уровне предсердий определяется большей растяжимостью ПП, а на уровне желудочков (в основном) – мощностью сокращений ЛЖ и величиной градиента давления между аортой и ЛА. В результате выраженной объемной перегрузки правых камер сердца быстро формируется кардиомегалия и расширяется ЛА. Особенно выражена перегрузка ПП, поскольку в него кровь сбрасывается не только из ЛП, но и из ЛЖ. Легочная гипертензия (ЛГ) развивается быстро, что добавляет к диастолической перегрузке и систолическую перегрузку правых отделов сердца и вызывает их гипертрофию. С нарастанием ЛГ появляются признаки синдрома Эйзенменгера и перекрестного, а затем и стойкого венозно-артериального шунта с хронической артериальной гипоксемией, обусловленной сбросом венозной крови в аорту [4, 6, 7].
Представляем два клинических случая сочетания СД и полной АВК у детей, находившихся под наблюдением в городском специализированном доме ребенка г. Донецка.
Первое клиническое наблюдение.
Ребенок Д., 5 лет 8 мес. Девочка поступила в дом ребенка в возрасте 7 мес 28 дней. Родилась от 15-й беременности, протекавшей с анемией, фетоплацентарной недостаточностью, хронической внутриутробной гипоксией плода, маловодием. Роды вторые, срочные. Масса при рождении 3050 г, длина тела 54 см, оценка по шкале Апгар 6–7 баллов. В родах имела место кефалогематома. После рождения отмечали следующий характерный внешний вид ребенка: косой разрез глаз, уплощенный нос, большой язык, маленький рот, уплощенный затылок, кожная складка на короткой и широкой шее, диспластичные ушные раковины, мышечная гипотония, "бедный" рефлекс Моро, короткие пальцы рук, обезьянья (поперечная) складка на коротких и широких ладонях и стопах. Заподозрен СД. Ребенок обследован в Донецком межобластном медико-генетическом центре, в котором диагноз был подтвержден. У ребенка с рождения над всей сердечной областью выслушивался грубый систолический шум с максимумом в IV межреберье у левого края грудины и на верхушке. Шум иррадиировал в правую и левую аксиллярную области, на спину. Диагностирован ВПС (полная АВК). Ребенка консультировал кардиохирург.
У девочки неоднократно, особенно на первом году жизни, отмечали пневмонии, пиелонефрит. Девочка развивалась с резким отставанием в физическом и нервно-психическом развитии. В возрасте 5 лет 8 мес масса тела составила 15 800 г, рост – 103 см, что по таблице сигмальных отклонений соответствует физическому развитию ниже среднего. Обращают внимание проявления атопического дерматита. У ребенка рано развились признаки хронической сердечной недостаточности (ХСН) IIА стадии, проявившейся тахикардией, одышкой в покое, периоральным цианозом, акроцианозом, увеличением печени, пастозностью стоп. Вследствие хронической гипоксемии у ребенка сформировались признаки хронической гипоксии тканей: пальцы в виде "барабанных палочек", ногти по типу "часовых стекол". Девочка самостоятельно ходит, говорит несколько элементарных слов, ест из ложки, пьет из чашки.
Приводим результаты обследования ребенка в 5 лет 8 мес.
Клинический анализ крови: эритроциты – 5,0·1012/л, гемоглобин – 160 г/л, цветной показатель – 0,95, гематокрит – 46 %, лейкоциты – 8,2·109/л, базофилы – 1 %, эозинофилы – 2 %, нейтрофилы палочкоядерные – 4 %, нейтрофилы сегментоядерные – 48 %, лимфоциты – 39 %, моноциты – 6 %, ретикулоциты – 8 ‰, тромбоциты – 182 Г/л, СОЭ – 6 мм/ч.
Биохимические исследования крови: общий белок – 83 г/л, кальций – 2,3 ммоль/л. IgG к токсоплазме, цитомегаловирусу, вирусу простого герпеса, вирусам гепатита В, С, ВИЧ не обнаружены.
ЭКГ: отклонение электрической оси сердца влево. Гемодинамическая перегрузка всех отделов сердца.
Эхокардиография: полная АВК. Тотальная гипертрофия миокарда. Признаки ЛГ (давление в ЛА 86–91 мм рт. ст.). Сократительная способность сердца не снижена. Фракция выброса – 78 %. Полости не расширены.
Ребенку установлен диагноз: СД, трисомия 21, мейотическое нерасхождение. ВПС (полная АВК), ЛГ, ХСН ІІА стадии. Задержка физического развития. Умеренная умственная отсталость. Атопический дерматит, период неполной ремиссии.
Получает с 7-месячного возраста дигоксин, каптоприл, верошпирон по показаниям. Периодически получает курсы лечения ноотропами, кардиотрофическими, антигистаминными препаратами, ферментами.
Анализируя возможные пути оказания медицинской помощи ребенку, необходимо отметить следующее. Известно, что основное лечение АВК оперативное. Хирургическая коррекция данного вида ВПС является одной из сложнейших кардиохирургических операций и сопровождается высокой летальностью. Если же не проводить оперативного вмешательства, то порок будет иметь злокачественное прогредиентное течение с развитием тяжелой, рефрактерной к терапии ХСН, присоединением пневмонии, прогрессированием ЛГ и необратимостью поражения сосудов легких. Так, в течение первых 4–6 мес жизни без оперативной коррекции погибает до 50 % детей, в 1–2-ой годы жизни – до 87 % больных, к 5 годам – до 96 % пациентов [2, 4, 8]. ЛГ достигает высокой степени уже к концу первого года жизни, причем это касается, прежде всего, детей с СД, а к концу второго года у этого контингента пациентов часто возникают необратимые морфологические изменения в легочных сосудах. Операцию проводят с применением искусственного кровообращения и регулируемой гипотермии тела до 20–22 °С. Радикальная коррекция порока включает закрытие ДМЖП и ДМПП заплатой с одновременным разделением атриовентрикулярного кольца на правое и левое, устранение недостаточности предсердно-желудочковых клапанов.
Изучение литературы по оперативной коррекции полной АВК у детей с СД [2, 4, 8, 9] свидетельствует, что такие пациенты могут быть успешно прооперированы на первом году жизни, что позволяет устранить проблемы, связанные с прогрессирующей ХСН и ЛГ. Ранняя хирургическая коррекция у пациентов с СД до увеличения легочного сосудистого сопротивления и деформации атриовентрикулярного клапана имеет благоприятную перспективу. Данный подход позволяет снизить раннюю смертность, обеспечивает хорошие показатели выживаемости в отдаленный период и более надежную защиту от последующей дегенерации клапана.
Оперативная коррекция полной АВК у детей с СД в возрасте старше одного года, как правило, связана с более высоким риском операционной смертности и меньшей надеждой на улучшение гемодинамики по сравнению с детьми без СД. Кроме того, дети с СД имеют предрасположенность к развитию тяжелых послеоперационных инфекционных осложнений, прежде всего со стороны респираторного тракта, что требует более продолжительной искусственной вентиляции легких, длительного пребывания в отделении интенсивной терапии, удлиняющих сроки госпитализации [2, 8, 10].
Особенностью представленного случая явилось то, что, несмотря на высокую летальность при данном пороке без операции, девочка жива к 5 годам 8 мес. Состояние больной в настоящее время стабильное, однако ХСН и ЛГ прогрессируют. Высокие показатели ЛГ уже на первом году жизни не позволили провести оперативную коррекцию ребенку.
Второе клиническое наблюдение.
Ребенок У., 27.07.2008 г. рождения. Умерла 11.11. 2008 г. в возрасте 3 мес 15 дней.
Девочка рождена от 3-й беременности (1-я беременность в 1997 г. – искусственные роды в 30 нед по социальным показаниям, 2-я беременность в 2000 г. – медицинский аборт). Настоящая беременность наступила в результате стимуляции яичников матери по поводу вторичного бесплодия. Беременность протекала на фоне миомы матки, хронического сальпингоофорита, эрозии шейки матки, интенсивного табакокурения. В сроке гестации 21–22 нед обследована в Донецком межобластном медико-генетическом центре, где был установлен высокий риск рождения ребенка с СД. Вместе с тем, женщина продолжала донашивать настоящую беременность. Роды первые, преждевременные, в сроке 31– 32 нед. Масса при рождении 1700 г. Состояние девочки после рождения тяжелое, обусловленное недоношенностью, внутриутробной пневмонией. В родильном доме выявлены стигмы даунизма. Диагноз СД подтвержден в Донецком межобластном медико-генетическом центре. Кроме того, у ребенка с рождения над всей сердечной областью выслушивался грубый систолический шум с максимумом в IV межреберье у левого края грудины и на верхушке. Установлен ВПС (полная АВК). Ребенка консультировал кардиохирург. После выписки из родильного дома ребенок находился на лечении в ЦГКБ № 3, реанимационном отделении ГДКБ № 1 г. Донецка.
Приводим результаты обследования девочки в возрасте 3 мес 12 дней.
Клинический анализ крови: эритроциты – 2,9·1012/л, гемоглобин – 79 г/л, цветной показатель – 0,82, гематокрит – 28 %, лейкоциты – 20,0·109/л, плазменные клетки – 1 %, метамиелоциты – 3 %, базофилы – 1 %, эозинофилы – 1 %, нейтрофилы палочкоядерные – 15 %, нейтрофилы сегментоядерные – 57 %, лимфоциты – 17 %, моноциты – 5 %, тромбоциты – 115 Г/л, СОЭ – 5 мм/ч.
Биохимические исследования крови: общий белок – 48 г/л, кальций – 1,98 ммоль/л, сахар – 10,0 ммоль/л, протромбиновый индекс – 83 %, фибриноген – 4,83 г/л.
ЭКГ: отклонение электрической оси сердца влево. Гемодинамическая перегрузка левых отделов сердца.
Рентгенограмма органов грудной клетки: двусторонняя пневмония. Смещение левой границы сердца влево.
Эхокардиография: полная АВК. Дилатация левых отделов сердца. Признаки ЛГ (давление в ЛА 40 мм рт. ст.). Сократительная способность сердца не снижена. Фракция выброса – 72 %.
У ребенка рано развились признаки ХСН, по поводу которой были назначены дигоксин, каптоприл, фуросемид, калия и магния аспарагинат. В связи с присоединением пневмонии девочка получала комбинированную антибактериальную терапию, инфузионно-трансфузионную терапию. Кроме того, проводились курсы лечения нейрометаболическими препаратами.
Несмотря на проводимое лечение, состояние девочки прогрессивно ухудшалось, нарастали явления сердечно-легочной недостаточности. Отмечали одышечно-цианотические приступы, по поводу которых проводили оксигенотерапию. Однако продолжали нарастать проявления сердечной недостаточности (одышка, цианоз кожных покровов). Ребенку 11.11.2008 г. в 7.00 в реанимационном отделении ГДКБ № 1 начата искусственная вентиляция легких с помощью аппарата "Малятко". Состояние продолжало ухудшаться. 11.11.2008 г. в 8.15 зафиксирована остановка кровообращения. Реанимационные мероприятия в течение 30 мин не имели эффекта и в 8.45 – констатирована смерть.
Основной клинический диагноз: врожденный порок сердца (полная АВК), ЛГ. СД.
Осложнения: двусторонняя пневмония. Гипотрофия. Отек-набухание головного мозга. Отек легких. Острая сердечно-сосудистая недостаточность.
Сопутствующий диагноз: перинатальное поражение ЦНС.
Основной патологоанатомический диагноз: болезнь Дауна (кариотип 47 ХХ+21 от 01.08.2008 г.) со сложным пороком сердца (открытый общий предсердно-желудочковый канал, коарктация перешейка аорты). Состояние после катетеризации правой подключичной вены, искусственной вентиляции легких, реанимации.
Осложнения основного заболевания: ЛГ. Двусторонняя крупноочаговая пневмония. Гипотрофия (масса тела 2175 г). Дистрофические изменения паренхиматозных органов. Отек оболочек и вещества головного мозга.
Непосредственная причина смерти: сердечно-легочная недостаточность, двусторонняя очаговая пневмония, СД со сложным пороком сердца, гипотрофия.
Особенностями данного случая являются сочетание СД со сложным ВПС – полной АВК и коарктацией перешейка аорты, резистентная к медикаментозной терапии ХСН, прогрессирующая кахексия, приведшие к смерти ребенка в раннем возрасте.
Литература
- Белоконь Н.А., Кубергер М.Б. Болезни сердца и сосудов у детей. – М.: Медицина, 1987. – Т. 1. – С. 230-235.
- Задко Т.И., Туманян М.Р., Левченко Е.Г. Синдром Дауна в сочетании с полной формой атриовентрикулярной коммуникации: актуальность, диагностика, сопутствующая патология, анатомия, особенности естественного течения, результаты хирургического лечения // Детские болезни сердца и сосудов. – 2005. – № 6. – С. 10-18.
- Лимаренко М.П. Наследственные заболевания и врожденные пороки сердца у детей // Врачеб. практика. – 2005. – № 5. – С. 4-7.
- Мутафьян О.А. Врожденные пороки сердца у детей. – СПб.: Невский Диалект, 2002. – С. 116-129.
- Ciach K., Grzybowski W., Wydra D. et al. Prenatal diagnosis of an atrioventricular canal in a foetus with deletion of chromosome 8 (pter і p 21) // Ginekol. Pol. – 2008. – Vol. 79. – № 3. – P. 209-211.
- Gorbachevskii S.V., Khamida A.V. Embryologic and pathogenetic aspects of the common atrioventricular canal development // Arkh. Patol. – 1999. – Vol. 61. – № 3. – P. 53-57.
- Hung J.H., Lu J.H., Hung C.Y. Prenatal diagnosis of complete atrioventricular canal associated with tetralogy of Fallot // J. Clin. Ultrasound. – 2008. – Vol. 36, № 3. – P. 180-185.
- Michell M.E., Litwin S.B., Tweddell J.S. Complex atrioventri-cular canal // Semin. Thorac. Cardivasc. Surg. Pediatr. Card. Surg. Annu. – 2007. – P. 32-41.
- Vazquez-Antona C.A., Lomeli C., Buendia A., Vargas-Barron J. Pulmonary hypertension in children with Down's syndrome and congenital heart disease. Is it really more severe? // Arch. Cardiol. Mex. – 2006. – Vol. 76, № 1. – P. 16-27.
Vida V.L., Barnoya J., Larrazabal L. A. et al. Congenital cardiac disease in children with Down's syndrome in Guatemala // Cardiol. Young. – 2005. – Vol. 15. – № 3. – P. 286-290.
Лучевые признаки ассоциации VACTERL у плода
Сочетание аномалий VACTERL. Секвенция VATER
Аббревиатура VACTERL образована начальными буквами названий неслучайного сочетания мальформаций, представленных аномалиями позвонков (vertebral), атрезией ануса (anal), пороками сердца (cardiac), трахеопищеводным свищом (tracheoesophageal) или атрезией пищевода (esophageal), аномалиями развития почек и мочевыводящих путей (renal), а также дефектами конечностей (limb). Три из перечисленных аномалии должны обязательно присутствовать для установления диагноза данного синдрома, однако нередко встречается наличие 7 или 8 из них.
Синонимы. Секвенция VATER, ассоциация VATER и синдром VACTERL.
Риск рецидива. Варьирует от 1 до 50%.
Патогенез. Дефект развития мезенхимы неизвестной этиологии. Возможно, имеют место митохондриальные нарушения.
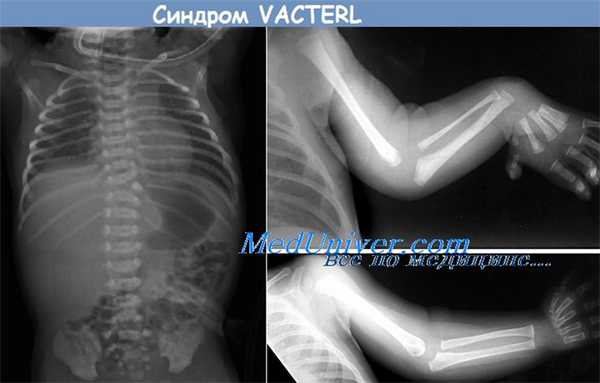
Диагностика. Сочетание аномалий развития позвонков, особенно пояснично-крестцового отдела, почек, сердца и дефекты лучевой кости является классическими проявлениями ассоциации VACTERL. Однако хорошо известно, что у некоторых пораженных плодов проявляются не все типичные признаки. Заболевание может быть также заподозрено при наличии многоводия в сочетании уменьшения размеров или отсутствем возможности визуализировать желудок плода (при трахеопищеводном свище), при обнаружении полупозвонка или сколиоза, аномалий конечностей (особенно нарушений развития лучевой кости, косорукости, редукционных форм дефектов и полидактилии), а также пороков сердца и почек. При ультразвуковом исследовании может быть установлено превышение количества ребер (13 или 14 пар в грудном отделе и 6 или 7 - в поясничном) особенно при использовании трехмерной реконструкции изображения. Эхографическая диагностика ассоциации VACTERL возможна начиная с первой половины второго триместра беременности в том случае, если у плода имеется тяжелая форма заболевания.
Генетические нарушения. Неизвестны.
Дифференциальный диагноз. Примерно у половины пациентов с трахеопищеводными свищами имеются другие проявления ассоциации VACTERL. Похожие признаки наблюдаютсяя у плодов с синдромом Дауна (Downe). В связи с тем, что при ассоциации VACTERL формируются множественные поражения, такие хромосомные нарушения, кактрисомии 18 и 13, должны быть исключены путем кариотипирования. Необходимо рассматривать возможность заболеваний, которые характеризуются аномалиями позвонков, почек или лучевой кости, такие как синдром тромбоцитопении - аплазии лучевой кости, анемия Фанкони (Fanconi), синдромы Робертса (Roberts), Холта-Орама (Holt-Oram), Нагера (Nager), синдром каудальной регрессии, сиреномелия, ассоциация MURCS, синдром эктродактилии-эктодермальной дисплазии и синдром Яхо-Левина (Jarcho-Levin).
Сочетанные аномалии. Многочисленны. Наиболее часто заболевание сочетается с гидроцефалией. Прогноз. В целом неблагоприятный, но зависит от особенностей имеющегося сочетания аномалий.
Акушерская тактика. Рекомендуется ежемесячный эхографический контроль за развитием плода и формированием структурных аномалий. Родоразрешение рекомендуется проводить в специализированных перинатальных медицинских центрах для выполнения хирургической коррекции пороков сразу после рождения и последующей реабилитации.
- Вернуться в оглавление раздела "Акушерство."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
УЗИ при ассоциации VACTERL у плода
а) Терминология:
1. Синонимы:
• Ассоциация VATER/VACTERL
2. Определения:
• Закономерно объединенное сочетание шести основных аномалий развития:
о Аномалии развития позвонков (vertebral anomalies)
о Атрезия ануса (anal atresia)
о Пороки сердца (cardiac anomalies)
о Трахеопищеводный свищ с АП (tracheoesophageal fistula with esophageal atresia)
о Аномалии почек (renal anomalies)
о Дефекты конечностей (чаще всего - радиального луча) (limb defects)
• Ассоциация VATER включает аномалии позвонков, атрезию анального отверстия, трахеопищеводный свищ с АП, дефекты почек и радиального луча
• Для подтверждения диагноза должны присутствовать как минимум три находки
б) Лучевая диагностика:
1. Общие сведения:
• Критерии диагностики:
о Множественные аномалии, определяемые при УЗИ во II триместре
о Чаще всего обнаруживают аномалии почек, конечностей и позвонков

(Слева) На врезке - нормальная анальная ямка с гипоэхогенной мышечной стенкой, окружающей гиперэхогенную слизистую оболочку. Сравните со случаем отсутствия ямки у плода с атрезией ануса.
(Справа) Промежность новорожденного мужского пола с ассоциацией VATER/VACTERL. Видны атрезия анального отверстия, расщепление мошонки и микропенис. Аномалии мочеполовой системы часто сопутствуют аноректальным аномалиям.
2. УЗИ при ассоциации VACTERL у плода:
• Патология сегментации позвоночника:
о Полупозвонки:
- Лучше всего визуализируются во фронтальной плоскости
- Сколиоз в области полупозвонков (полупозвонка), часто сложный
о Слияние тел позвонков или их задних частей (блокирование позвонков)
• Атрезия анального отверстия:
о В норме анальное отверстие визуализируется как гипоэхогенное кольцо с гиперэхогенным центром («анальная ямка»):
- Отсутствует при атрезии
о Иногда толстая кишка может быть расширена
о Часто не обнаруживают пренатально
о Атрезия ануса сочетается с повышением частоты аномалий половых органов, мочеполовой системы и пояснично-крестцового отдела позвоночника
• Аномалии развития сердца:
о ВПС - наиболее распространенные аномалии, определяемые примерно в 80% случаев
о По данным некоторых исследований, ДМЖП наиболее распространен
• АП ± трахеопищеводный свищ:
о Обнаруживают в 50-60% случаев VACTERL
о Диагностируется с трудом о Желудок уменьшен или не определяется
о В III триместре находят признак пищеводного кармана:
- Преходящее наполнение проксимального отдела пищевода при проглатывании
о Многоводие, как правило, оказывается поздней находкой (в III триместре)
о Устойчивое отсутствие дна желудка на фоне увеличивающегося объема околоплодных вод - наиболее очевидный признак
• Патология почек:
о Пузырно-мочеточниковый рефлюкс с дополнительными структурными аномалиями (27%)
о Односторонняя агенезия почки (24%)
о Мультикистоз/дисплазия почек (18%)
о Удвоение ЧЛС (18%)
о Гидронефроз
о Эктопическая почка
о У большинства новорожденных со структурными аномалиями почек также находят аномалии ануса и прямой кишки
• Аномалии конечностей:
о Обычно ограничены верхними
о Как правило, двусторонние, могут быть асимметричными
о Распространены дефекты радиального луча:
- Гипо-/аплазия больших пальцев
- Гипо-/аплазия лучевой кости с лучевым отклонением кисти
• Другие сопутствующие аномалии и нарушения:
о Многоводие:
- Чаще всего при АП
о Аномалии ребер (укороченные, сросшиеся, отсутствующие):
- Обычно сопровождают нарушения сегментации позвоночника
о ЕАП в сочетании с аномалиями почек
о Аномалии развития половых органов:
- Гипоспадия, расщепление мошонки, гипоплазия половых губ
- Чаще всего сочетаются с аноректальными дефектами о ЗРП
о Расщелина губы/нёба, высокое готическое нёбо
о Маловодие при тяжелой двусторонней аномалии почек
3. Рекомендации по лучевой диагностике:
• Предпочтительный метод исследования:
о УЗИ во II триместре
о 3D/4D УЗИ позволяет обнаружить аномалии конечностей и позвонков
• Советы по проведению исследования:
о При обнаружении одной аномалии необходимо систематично исследовать плод на наличие остальных
о ЭхоКГ плода
о Кариотипирование для исключения хромосомных аномалий
о Повторное УЗИ в III триместре для оценки объема околоплодных вод и роста плода
(Слева) Новорожденный мужского пола с атрезией анального отверстия. В данном случае половые органы сформированы нормально, но по данным УЗИ есть подозрение на аномалии позвоночника.
(Справа) Рентгенография, выполненная у этого же новорожденного в прямой проекции, позволяет увидеть многочисленные дефекты позвонков пояснично-крестцового отдела. Аномалии дистальных отделов позвонков часто видны в сочетании с аномалиями анального отверстия и прямой кишки и служат важной частью ассоциации VATER/VACTERL.
в) Дифференциальная диагностика ассоциации VACTERL у плода:
1. Т18:
• Симптомы существенно пересекаются с ассоциацией VACTERL с другими аномалиями
• Аномалии ЦНС
• ЗРП, часто тяжелая форма
2. Атрезия анального отверстия:
• Изолированная или синдромальная патология
• Часто сопутствует аномалиям мочеполовой системы, аномалиям поясничных позвонков
3. Дефекты радиального луча:
• Изолированная или синдромальная патология
• Широкий спектр аномалий конечностей:
о Отсутствие I пальца → гипоплазия → трехфалангизм
4. Синдромы с совпадающей симптоматикой:
• Синдром Холт-Орама:
о Дефекты радиального луча, фокомелия верхней конечности
о Аномалии сердца (ДМПП и ДМЖП)
о Аномалии развития позвоночника
о Сколиоз грудного отдела позвоночника
• Диабетическая эмбриопатия:
о Аномалии сердца (транспозиция, дефекты перегородки)
о Аномалии почек (агенезия, гидронефроз)
о Аномалии ЦНС (дефекты заращения нервной трубки, ГПЭ)
о Дефекты конечностей (полидактилия, гипоплазия бедренной кости, радиального луча)
• Тромбоцитопения с отсутствием лучевой кости (TAR-синдром):
о Двусторонние дефекты радиального луча с нормальными большими пальцами
о Другие аномалии сердца, почек, скелета
о Высокая смертность новорожденных из-за кровоизлияний, пороков сердца
• Артрогрипоз:
о Контрактуры конечностей могут напоминать дефекты ра-диального/ульнарного луча
о Конечности фиксированы на всем протяжении исследования
о Сколиоз
• Ассоциация MURCS:
о Аномалии мюллеровых протоков, почек, дисплазия позвонков шейного и грудного отделов
• Синдром CHARGE:
о Колобомы, порок сердца, атрезия хоан, задержка роста/ развития, аномалии гениталий и органа слуха
о Трахеопищеводный свищ ± АП, атрезия анального отверстия
• Синдром Таунса-Брокса:
о Дисплазия ушных раковин, трехфалангизм пальцев, аномалии ануса и почек
• Синдром Робертса/БС-синдром Робертса/псевдоталидо-мидовый синдром:
о Тетрафокомелия (90%), орофациальные расщелины, ЗРП
о Широкий спектр фенотипических проявлений, совпадающих с TAR
• VACTERL с гидроцефалией (VACTERL-H)/VACTERL ± гидроцефалия (VACTERLX):
о Х-сцепленное или аутосомно-рецессивное наследование
о Прогноз часто неблагоприятный, с тяжелой задержкой умственного развития
о Фенотипически совпадает с анемией Фанкони, в случае подозрения на VACTERL-H необходимо провести исследование на синдромы хромосомных разрывов, чтобы исключить анемию Фанкони
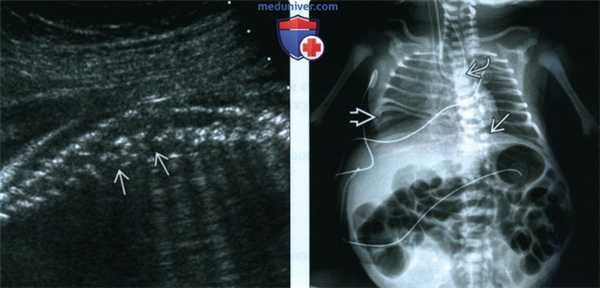
(Слева) Тот же плод. УЗИ позвоночника, сагиттальная плоскость. «Перемешанные» позвонки выглядят так из-за множественных дефектов сегментации позвонков. Полупозвонки - наиболее распространенные аномалии позвоночника при ассоциации VATER/VACTERL.
(Справа) Рентгенограмма новорожденного с ассоциацией VACTERL с орога-стральной трубкой, изогнутой в месте АП. Дистальный отдел трахеопищеводного свища отвечает за наличие газа в кишечнике. Аномалии позвонков и расширенные петли кишечника из-за атрезии анального отверстия. Также видны аномалии ребер.
г) Патологоанатомические особенности:
1. Общие сведения:
• Этиология:
о Нарушение дифференцировки мезодермы до 35-го дня развития
о Возможно, связано с мутацией генов, кодирующих элементы сигнального пути Sonic hedgehog
о Дефект сигнального пути Sonic hedgehog (Shh) у мышей приводит к появлению аномалий, сходных с наблюдаемыми при ассоциации VACTERL у людей
о К настоящему времени установлено участие нескольких генов, включая FGF8, FOXF1, HOXD13, LPP, TRAP1, ZIC3
о Факторы риска: СД у матери плода
• Генетические факторы:
о Возникает случайно:
- Изредка описывают случаи наследования от родителя к ребенку
- Отдельные черты VACTERL у сиблингов или родителей обнаруживают в 9% случаев при тщательном обследовании
о Риск повторного возникновения о Сопутствующих хромосомных аномалий не выявлено, хотя имеются пересекающиеся с ними симптомы
2. Стадирование, градация и классификация ассоциации VACTERL у плода:
• Диагноз ставят методом исключения
• Специальных исследований для подтверждения диагноза не существует
• Характерных черт лица, облегчающих распознание фенотипа, нет
• Все характерные особенности VACTERL часто обнаруживают при других синдромах или по отдельности
• Абсолютно все признаки определяются у меньшинства пациентов:
о В среднем у пациента находят 3-4 признака
о Для подтверждения диагноза нужна как минимум одна аномалия конечностей, грудной клетки, брюшной полости/таза
д) Клинические особенности:
1. Клиническая картина:
• Самые частые субъективные и объективные симптомы:
о Множественные аномалии при УЗИ во II триместре
2. Демографические особенности:
• Эпидемиология:
о Заболеваемость - 1,6:10 000
3. Естественное течение и прогноз:
• Варьируют в зависимости от количества и типа аномалий:
о Смертность новорожденных 28%
• Потенциально жизнеугрожающие аномалии включают трахеопищеводный свищ, атрезию анального отверстия и пороки сердца
• У выживших прогноз благоприятный, интеллект сохранен
• Тяжелый сколиоз может прогрессировать, сложно поддается лечению
• Лицам с серьезными поражениями требуется долгосрочное лечение
4. Лечение ассоциации VACTERL у плода:
• Кариотипирование для исключения хромосомных аномалий
• При множественных или тяжелых аномалиях развития рекомендуют прерывание беременности:
о Аутопсия для подтверждения диагноза
• При сохранении беременности — роды в условиях узкоспециализированного центра
• Полное обследование, включающее ЭхоКГ плода, УЗИ почек и рентгенографию конечностей
• Все ключевые симптомы требуют хирургического вмешательства
е) Особенности диагностики. Признаки, учитываемые при интерпретации изображений:
• Наличие одного или более признаков указывает на необходимость исследования других сопутствующих аномалий:
о Часто другие аномалии не столь очевидны (например, АП и пороки сердца), но могут давать куда более существенные осложнения
ж) Список использованной литературы:
1. Reutter Н et al: Underlying genetic factors of the VATER/VACTERL association with special emphasis on the «Renal» phenotype. Pediatr Nephrol. ePub, 2016
2. Cunningham BK et al: Analysis of renal anomalies in VACTERL association. Birth Defects Res A Clin MolTeratol. 100( 10):801—5, 2014
3. Brosens E et al: VACTERL Association Etiology: The Impact of de novo and Rare Copy Number Variations. Mol Syndromol. 4(l-2):20-6, 2013
4. Cunningham BK et al: Analysis of cardiac anomalies in VACTERL association. Birth Defects Res A Clin Mol Teratol. 97(12):792-7, 2013
5. Solomon BD et al: Clinical geneticists views of VACTERL/VATER association. Am J Med Genet A. 158A( 12):3087—100, 2012
Редактор: Искандер Милевски. Дата обновления публикации: 22.11.2021
Атрезия пищевода
Атрезия пищевода – наиболее распространенная желудочно-кишечная атрезия. Частота составляет приблизительно 1 случай на 3500 живорожденных. Другие врожденные аномалии составляют до 50% случаев. Два синдрома специфически связаны с атрезией пищевода:
VACTERL (от англ Vertebral anomalies, Anal аtresia, Cardiovascular malformations, Tracheoesophageal fistula, Esophageal atresia, Renal anomalies, Radial aplasia, Limb anomalies – аномалии позвоночника, атрезия ануса, пороки сердца, трахеопищеводный свищ с атрезией пищевода, аномалии почек, гипоплазия лучевой кости, дефекты конечностей)
Симптомокомплекс CHARGE (от англ Coloboma – колобома, Heart defects – пороки сердца, Atresia of the choanae – атрезия хоан, Retardation of mental and/or physical development – задержка роста и развития, Genital hypoplasia – гипоплазия наружных половых органов, Ear abnormalities – аномалии ушей)
Приблизительно у 19% детей с атрезией пищевода наблюдаются симптомы VACTERL.
© Springer Science+Business Media
Этот рентгеновский снимок показывает аномалии, относящиеся к ассоциации VACTERL (вертебральные аномалии, атрезия заднего прохода, пороки сердца, трахеопищеводный свищ, атрезия пищевода, почечные аномалии, аплазия лучевой кости и аномалии конечностей). Обратите внимание на аномалию сегментации позвоночника (указатель белого цвета), кишечную трубку, свернутую в атретическом проксимальном участке пищевода (указатель черного цвета), содержащийся в кишечнике газ, связанный с атрезией пищевода и с трахеопищеводным свищом, и деформацию левой верхней конечности.
У большинства младенцев симптомы проявляются в неонатальном периоде, однако у детей с трахеопищеводной фистулой Н-типа симптомы могут проявляться значительно позже.
Характерными признаками избыточной секреции являются кашель и цианоз после попыток кормления, аспирационная пневмония. Эзофагальная атрезия с дистальным свищом приводит к вздутию живота, поскольку во время плача ребенка, воздух из трахеи нагнетается через фистулу в нижние отделы пищевода и желудка.
Типы и относительные частоты атрезии пищевода и трахеопищеводного свища
Относительные частоты основаны на компиляции из различных источников.
Атрезия пищевода: причины, симптомы и лечение — Образ жизни для хорошего здоровья
Атрезия пищевода – это тяжелый порок развития, характеризующийся слепым окончанием верхнего отрезка данной части пищеварительного канала. Часто эта патология сочетается с другими пороками развития. В 5% случаев она встречается при хромосомных болезнях.
Как ее выявляют? Что служит предпосылками для появления патологии? Какие симптомы указывают на ее наличие? И, самое главное, как ее лечить? На эти и многие другие вопросы сейчас стоит дать ответы.
Причины развития патологии
Их немного. Одна, если быть точнее. Развитие порока начинается из-за возникающего еще на стадии эмбриогенеза нарушения. То есть в момент, когда плод лишь развивается в организме женщины.
Как известно, пищевод и трахея возникают из головного конца передней кишки. Это один зачаток. На ранних стадиях две эти части широко сообщаются между собой. Они разделяются на 4-5-й неделе. И если скорость роста не будет совпадать с направлением и процессами вакуолизации (изменение клеток организма), то появится риск развития атрезии пищевода плода.
Также причиной зачастую становится неправильный процесс реканализации, через который проходят все образования кишечной трубки.
К сожалению, медицинской практике известно немало случаев, когда это завершалось многоводием и выкидышем еще на первом триместре.
Провоцирующие факторы
Важно оговориться, что здесь все неоднозначно. Бывает, что дети с этим пороком рождаются и у абсолютно здоровых родителей. Но все же существует целый ряд провоцирующих факторов, которые могут поспособствовать развитию патологии, а именно:
- Курение беременной женщины.
- Употребление наркотиков.
- Воздействие излучения на раннем сроке.
- Злоупотребление алкоголем.
- Воздействие на женский организм химических средств.
- Употребление медикаментов, запрещенных при беременности.
- Возраст старше 35 лет.
Перечисленные факторы также могут привести и к развитию других патологий. Именно поэтому от всех вредных привычек нужно отказаться еще за несколько месяцев до планируемого зачатия, начать принимать фолиевую кислоту, придерживаться правильного питания и здорового образа жизни.
Классификация
По МКБ атрезия пищевода имеет код Q42. К основным формам патологии относят такие пороки:
- Атрезия со свищом, находящимся между трахеей и дистальным отделом пищевода. Встречается в 85-90% случаев.
- Атрезия со свищом, находящимся между трахеей и проксимальным отделом. Встречается в 0,8% случаев.
- Атрезия со свищом, образованная между обоими концами этих органов. Встречается в 0,6% случаев.
- Атрезия изолированной формы. Встречается в 8% случаев.
В редких случаях формируется трахеопищеводный свищ, но атрезии при этом нет. Однако бывают еще более патологичные ситуации. Они характеризуются полным отсутствием пищевода.
Сочетание с другими пороками
Рассматриваемая патология, согласно статистике, встречается у 0,1-0,4% младенцев. В большинстве случаев она сочетается с пороками других систем и органов. Чаще всего встречаются такие заболевания:
- Дисплазия лучевых костей.
- Порок развития конечностей.
- Пилоростеноз.
- Трахеопищеводный свищ.
- Атрезия хоан.
- Порок развития позвоночника.
- Агенезия желчного пузыря.
- Аномалии в развитии почек.
Также надо отметить, что в 5% всех случаев атрезии диагностируется хромосомная патология – синдром Дауна, Эдвардса или Патау. Еще 40% младенцев рождаются недоношенными либо с внутриутробной задержкой развития.
Диагноз при беременности реален?
Да, для этого проводят пренатальную комплексную диагностику. Во время УЗИ выявляются такие косвенные признаки:
- Многоводие. Женщина сильно прибавляет в весе, и причиной этому является сниженный оборот околоплодных вод. Почему чего он появляется? Из-за того, что плод не может проглатывать амниотическую жидкость.
- Аномально маленькие размеры контуров желудка или и вовсе их отсутствие.
Вероятность подтверждения порока по данным признакам достигает 50%. Если женщина не прервет беременность, то во втором и третьем триместрах доктор увидит периоды опустошения и наполнения слепого пищеводного конца.
При появлении подозрения на патологию, проводится определение содержания в амниотической жидкости фермента ацетилхолинэстеразы.
Симптомы
Атрезия пищевода у новорожденных дает о себе знать в течение первых часов после появления ребенка на свет. Проявляется это в следующих симптомах:
- Выделение изо рта и носа обильной пенистой слюны, которое не прекращается. Это называется ложной гиперсаливацией.
- Аспирация младенцем части слизи в трахею.
- Нарушения дыхания: приступы кашля, хрипы, одышка, асфиксия, тахипноэ.
- Регургитация пищи. Младенец не может проглотить молоко – как только оно попадает к нему в рот, он его немедленно срыгивает. Возможна рвота.
- Аспирационная пневмония (из-за вдыхания младенцем пищи и слизи).
- Лихорадка.
- Часто атрезия пищевода сочетается с нижним трахеопищеводным свищом. В таком случае наблюдаются еще и следующие симптомы:
- Заброс в дыхательные пути содержимого желудка.
- Тяжелый приступообразный кашель, возникающий при каждом приеме пищи.
- Цианоз и удушье.
- Вздутие живота, возникающее из-за попадания в желудок и пищевод воздуха через свищ.
- Истощение и обезвоживание.
Если свищ отсутствует, то атрезия пищевода у новорожденного сопровождается запавшим животом.
Диагностика
Игнорирование вышеперечисленных симптомов приводит к дыхательной недостаточности, а впоследствии к летальному исходу. Поэтому диагностика атрезии пищевода должна быть проведена оперативно – в первые 12-24 часа после появления младенца на свет. Иначе потом начнется развитие аспирационной пневмонии.
Если есть хоть малейшее подозрение на атрезию пищевода, то младенцу проводят интраназальное зондирование, выполняемое с помощью резинового катетера. Если у ребенка действительно есть эта патология, то инструмент просто не получится ввести в желудок. Зонд либо упрется в слепой конец пищевода, либо завернется и выйдет обратно.
Если случай сомнительный, врачи проводят так называемую пробу Элефанта. Заключается данная процедура во введении в пищевод порции воздуха посредством катетера. При атрезии он с шумом выходит из носоглотки.
Иногда могут назначить бронхоскопию и эзофагоскопию. Вот что удается сделать при помощи данных процедур:
- Выявить слепой конец пищевода.
- Установить вид патологии.
- Определить, какова протяженность максимального сегмента слепого конца пищевода.
- Выяснить, имеется ли свищевой ход с бронхами и трахеей.
Кстати, последний момент можно определить посредством проведения интраоперационной эзофагоскопии, контролируемой рентгеном.
Есть ли способ, позволяющий установить стопроцентный диагноз? Да, и это рентгенография, в ходе которой в пищевод младенца вводят рентгеноконтрастный катетер.
В редких, особо тяжелых случаях могут использовать бариевую взвесь. Но это крайне нежелательно, так как велик риск респираторных осложнений, которые завершаются летальным исходом.
Операция
Она должна быть выполнена в течение 36 часов после рождения. Потому что самое страшное последствие атрезии пищевода у новорожденных – это смерть.
Операция осуществляется под защитным переливанием крови, количество которой обычно составляет от 150 до 200 мл. Потому младенцу на вену голени накладывают специальный аппарат. С его помощью и осуществляется капельное вливание крови.
Цель вмешательства – провести прямой анастомоз. Так называется процедура сшивания двух пустотелых органов, позволяющая сделать их функциональными. Данная операция максимально приближает уровень жизни младенца к полноценному.
Но анастомоз возможен лишь в том случае, если имеющийся между сегментами пищевода диастаз не более 1,5 см. Если диагностируется большее натяжение тканей, то проведение данной операции становится неоправданным, потому что в период восстановления могут натянуться и прорезаться швы.
Что происходит в случае превышения диастаза 1,5 см? Сначала хирурги удаляют свищ, после чего становится возможным вывести верхний конец пищевода на шею. Так удается предотвратить развитие аспирационной пневмонии. Затем младенцу из кишки делают искусственный пищевод.
Операция проводится, как правило, при эндотрахеальном наркозе с обязательной вентиляцией легких.
Реабилитация
После операции атрезии пищевода малышу предстоит длительный период восстановления. Тактику лечения врач подбирает, принимая во внимание следующие критерии:
- Степень недоношенности.
- Тип сочетанных патологий.
- Уровень дыхательной дисфункции.
Если состояние ребенка нормальное, то могут провести экстубацию – вывод дыхательной трубки из трахеи. Но при нестабильности младенца подключат к аппарату, посредством которого осуществляется принудительная вентиляция легких. И его отключат только тогда, когда способность к самостоятельному дыханию у ребенка восстановится.
Важно отметить, что во многих случаях при атрезии пищевода у детей диагностируется слабость трахейных стенок. В такой ситуации без трахеостомии и трахеопексии не обойтись.
Также после проведения хирургического вмешательства шею младенца надежно фиксируют на период от трех до семи суток. Это необходимо, чтобы свести к минимуму риск расхождения швов и натяжения наложенного анастомоза.
Разумеется, безболезненно данный период не проходит. Потому малышам вводят через капельницу опиоидные анальгетики, которые, попав в организм, купируют неприятные ощущения. На 3-5-й день обычно переходят на уколы. Также обязательно проводят антибактериальную терапию, которая подразумевает прием младенцем метронидазола (противопротозойное средство) в небольших количествах – 15 мг/кг*сут.
Дальнейшее восстановление
Последствия атрезии пищевода врачи будут устранять в течение долгого времени. Спустя 1,5-2 месяца у малышей появляется грубый кашель. Причиной являются рубцы и спайки, образовавшиеся в областях трахеи и анастомоза.
Чтобы от этого избавиться, проводят специальную рассасывающую физиотерапию. Но к возрасту 5-6 месяцев у младенцев возникает другое осложнение. Происходит изолированное сужение пищевода. К сожалению, встречается это в 36-50% случаев.
Лечение затруднений не вызывает. Достаточно несколько сеансов бужирования, проводимых обязательно под контролем эзофагоскопии.
Однако важно отметить, что консервативные процедуры помогают не всегда. И потому некоторым детям проводят торакотомию и пластику суженного отдела повторно.
Что касательно питания? Кормление дробное, порции увеличиваются постепенно. В первый день, например, через желудочный свищ вводится 10 раз по 3 мл. Во второй – по 7 мл. На третий – по 15 мл. И так далее.
Через неделю желудок увеличивается, что позволяет вводить уже по 40-45 мл жидкости, причем через эзофагостомическое отверстие. Примерно 1/3 питания составляет грудное молоко и слабый глюкозный раствор.
Прогноз
К сожалению, если диагностика проводится запоздало, ребенок погибает от аспирационной пневмонии. Если оперативно провести хирургическую коррекцию, то прогноз будет благоприятным.
Лучшие шансы у младенцев с атрезией изолированной формы. В таких случаях выживаемость составляет порядка 90-100%. Если же ребенок недоношенный или у него диагностированы тяжело сочетанные пороки, то данный показатель сокращается до 30-50%.
Даже в условиях успешно проведенной операции и удовлетворительного трансэзофагеального пассажа у дистального участка пищевода не будет нормальной моторики. Ее просто невозможно восстановить полностью.
В течение целого года малыш будет находиться в диспансере, под постоянным наблюдением гастроэнтеролога и хирурга, потому что после атрезии пищевода появляется риск появления таких осложнений:
- Дисфункция глотательной способности.
- Несостоятельность или непроходимость области анастомоза.
- Развитие инфекции в месте соединения.
- Сужение прохода, приводящее к трудностям с проглатыванием пищи.
- Слабость в мышцах.
- Обратный рефлюкс, из-за которого еда выбрасывается в пищевой тракт из желудка.
В случае появления хотя бы одного последствия атрезии пищевода у детей экстренно назначается эзофагоскопия. Она необходима, чтобы осмотреть внутреннюю поверхность органа специальным оборудованием.
Что будет через несколько лет?
Всех родителей, дети которых родились с такой патологией, волнует данный вопрос. Лечение атрезии пищевода – это испытание для всех. Сначала для родителей, а потом для подросших, уже начинающих все понимать детей.
На самом деле здесь все индивидуально. Но если почитать то, что пишут люди, столкнувшиеся с данной проблемой, можно себя успокоить.
Говорят, какое-то время детям действительно тяжело по понятным причинам. Но с течением времени они начинают набирать вес, а когда становятся на ноги, то большинство симптомов прекращаются, срыгивания проходят. Некоторым приходится делать повторную пластику.
Также ребенка не рекомендуется отдавать в ясли и садик. Ведь ему необходимо соблюдать строгую диету, а в таких учреждениях далеко не всегда могут предложить отдельное меню.
Дальнейший образ жизни
Если операция будет проведена вовремя, а реабилитационный период пройден успешно, то ребенок будет жить полноценной жизнью.
Но в дальнейшем ему придется ограничить себя в употреблении вредной пищи, которая является нежелательным раздражителем для всей пищеварительной системы. Это все острое, копченое, соленое, жирное, сильно зажаренное, а также фастфуд, консервы и т. д.
Лучше придерживаться здорового образа жизни и сбалансированного питания, потребляя достаточное количество витаминов и макро-/микроэлементов. И, конечно, хотя бы раз в год проходить обследование.
Атрезия пищевода - симптомы и лечение
Что такое атрезия пищевода? Причины возникновения, диагностику и методы лечения разберем в статье доктора Вавилова Артема Сергеевича, детского хирурга со стажем в 7 лет.
Над статьей доктора Вавилова Артема Сергеевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
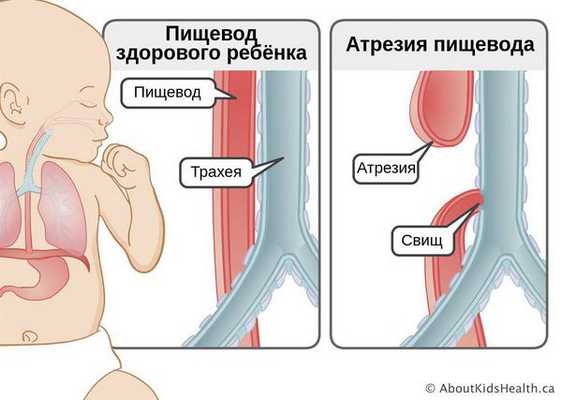
Определение болезни. Причины заболевания
Атрезия пищевода — это врождённый порок развития пищевода, при котором верхняя и нижняя часть пищевода не соединяются. В некоторых случаях при атрезии сегменты пищевода сообщаются с трахеей. Из-за этого дефекта пища не может попасть в желудок и задерживается в верхнем "слепом" конце пищевода. При наличии свища с трахеей, пища (или слюна, если кормление младенца ещё не начато) попадает в лёгкие, что вызывает тяжёлую пневмонию. Без хирургического вмешательства на ранних сроках атрезия пищевода приводит к смерти младенца.
Достоверных причин появления атрезии пищевода не установлено. У развития пороков плода, в том числе атрезии пищевода, могут быть различные причины:
- генетические факторы;
- инфекции у матери;
- плохое питание матери во время беременности (дефицит необходимых микроэлементов, таких как йод, фолиевая кислота и др.);
- тяжёлые хронические заболевания (например, сахарный диабет);
- экологические факторы;
- употребление алкоголя и некоторых лекарственных средств, табачная зависимость.
Атрезия пищевода встречается как в изолированной форме, так и в вместе с другими аномалиями, которые собраны в специальную ассоциацию VACTERL. В неё входят аномалии позвоночника, атрезия ануса, пороки сердца, аномалии почек, дефекты лучевой кости.
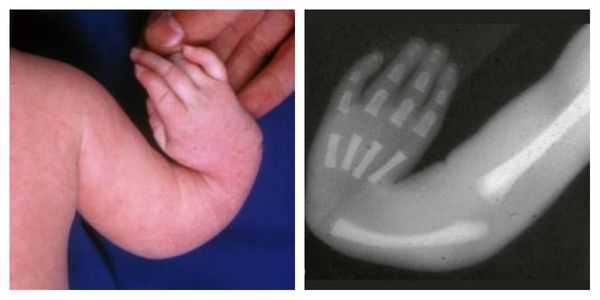
Атрезия пищевода может сопутствовать синдрому Чарга — Стросса (аутоиммунной аномалии), синдрому Гольденхара (дефекту в развитии зубов, ушной раковины, глаз и лица), трисомии (наличию трёх хромосом вместо двух в клетках) и другим врождённым порокам развития.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы атрезии пищевода
Заподозрить наличие атрезии пищевода можно уже в первые минуты жизни новорождённого. Ребёнок не может проглотить слюну, поэтому акушеры наблюдают повышенное слюнотечение (гиперсаливацию). Один из самых характерных признаков — через нос или рот младенца начинает идти пена.
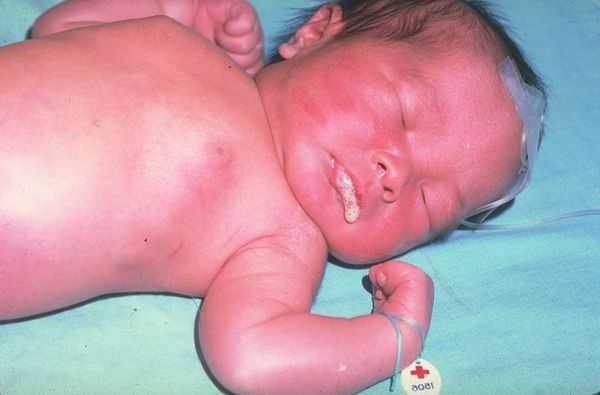
Проблемы выясняются сразу при первом кормлении: ребёнок будет давиться пищей. При атрезии пищевода полностью или частично нарушается прохождение пищи по пищеводу. В некоторых случаях может возникнуть синюшность кожи (цианоз) из-за недостатка кислорода в крови — в дыхательные пути попадает проглоченная пища и мешает дышать. Также отмечается рвота неизменённым молоком или смесью.
О наличии трахеопищеводного свища говорят приступы кашля во время кормления. Сильнее они проявляются при горизонтальном положении ребёнка, наблюдаются одышка и хрипы.
Младенцу с такими симптомами установливают назогастральный зонд. Если он упирается в препятствие, заворачивается и выходит через рот, то с большой вероятностью можно предполагать наличие атрезии пищевода.
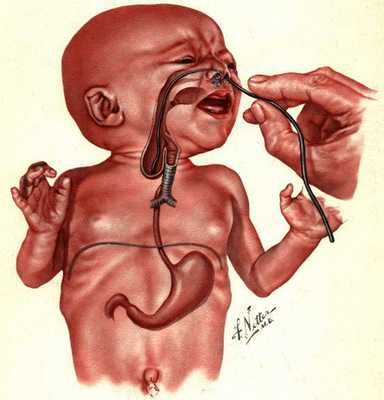
В пренатальном периоде атрезию пищевода можно заподозрить на УЗИ при наличии многоводия, отсутствия визуализации желудка и расширенного верхнего сегмента пищевода. Последний признак наиболее достоверный [1] [4] [9] .
Патогенез атрезии пищевода
Возникновение атрезии пищевода связано с нарушением формирования у эмбриона головного отдела первичной кишки во время беременности. Так как трахея и пищевод формируются из одного зачатка, на ранних стадиях они сообщаются. На 4-5 неделе развития эмбриона пищевод и трахея разделяются на два разных канала. При нарушении направления и скорости роста тканей складываются условия для формирования атрезии пищевода.
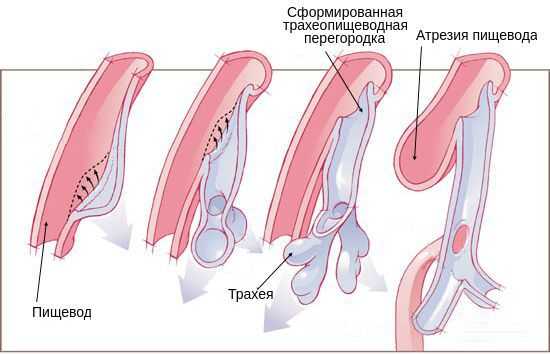
Когда эмбрион заглатывает околоплодные воды, при разобщении сегментов пищевода происходит перерастяжение верхней части. Из-за отсутствия проходимости по пищеводу перистальтические движения не происходят должным образом, нарушается глотательный рефлекс. Перерастянутый верхний сегмент пищевода сдавливает трахею, из-за чего хрящевые кольца трахеи формируются неправильно. При наличии трахеопищеводного свища околоподные воды из лёгких попадают в желудочно-кишечный тракт, что приводит к снижению давления внутри бронх. Из-за этого бронхи и альвеолы формируются неправильно [1] [4] [11] .
Классификация и стадии развития атрезии пищевода
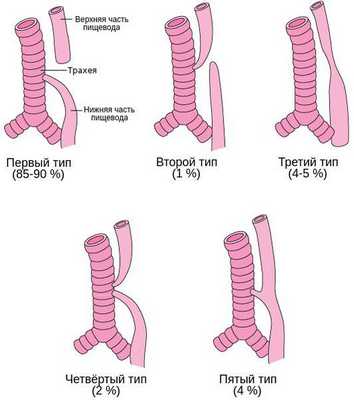
Встречается несколько основных анатомических вариантов атрезии пищевода:
- Атрезия пищевода с нижним трахеопищеводным свищём — верхний сегмент пищевода оканчивается слепо, а нижний формирует трахеопищеводный свищ. Встречается в 85-90 % случаев.
- Атрезия пищевода с верхним трахеопищеводным свищём — верхний сегмент пищевода формирует трахеопищеводный свищ, а нижний заканчивается слепо. Встречается в 1 % случаев.
- Изолированная атрезия пищевода — имеется большой промежуток между пищеводной трубкой и желудком, при этом трахеопищеводный свищ отсутсвует. Встречается в 4-5 % случаев.
- Атрезия пищевода с верхним и нижним трахеопищеводным свищём — встречается в 2 % случаев.
- Трахеопищеводный свищ без атрезии пищевода (Н-тип) — характеризуется наличием аномального соединения пищевода и трахеи, при этом нарушения проходимости пищевода нет. Встречается в 4 % [4] .
Трахеопищеводный свищ и атрезия пищевода чаще всего наблюдаются как комбинированная аномалия, но могут встречаться и как изолированные пороки развития.
Таким образом, можно выделить три основные формы данного заболевания:
- атрезия пищевода без свища;
- атрезия пищевода с трахеально-пищеводным свищём;
- врождённый трахеально-пищеводный свищ без атрезии.
При этом симптомы во всех формах атрезии пищевода будут одинаковы [1] [4] [8] .
Осложнения атрезии пищевода
При отсутствии своевременного лечения высок риск смертельного исхода. Этот риск увеличивается при наличии сопутствующих патологий [4] .
Когда желудок напрямую сообщается с трахеобронхиальным деревом через свищ, во время крика младенца из-за поступающего воздуха он перерастягивается. При этом подвижность диафрагмы ограничивается, и развивается ателектаз — спадение участка лёгкого в связи с частичным или полным отсутствием воздуха в альвеолах [4] . Если такой трахеопищеводный свищ поздно диагностировать, то это может привести к развитию аспирационной пневмонии (воспалению лёгких, спровоцированному попаданием внутрь инородных тел) и нарастанию дыхательной недостаточности.
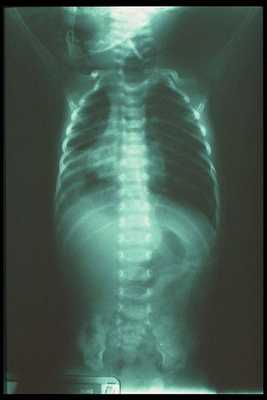
Иногда через трахеопищеводный свищ в бронхи и альвеолы попадает содержимое желудка. Это может спровоцировать "химическую" пневмонию, которая способна перерасти в бактериальную [4] .
Диагностика атрезии пищевода
Опыт диагностики атрезии пищевода на УЗИ во время беременности не распространён широко, поэтому атрезия зачастую диагностируется уже в постнатальном периоде.
После рождения ребёнка при подозрении на атрезию пищевода диагностика проводится незамедлительно. В родильном зале в пищевод вводится желудочный зонд. При наличии атрезии зонд пройдёт на глубину 7-10 см, упрётся в слепой конец верхнего сегмента и, при дальнейшем продвижении, появится в полости рта. Во время зондового исследования также проводится проба Элефанта: через зонд шприцем вводится воздух, и при атрезии со слепым верхним сегментном воздух с шумом выходит наружу.
Если пробы с желудочным зондом подтвердили наличие атрезии, ребёнка переводят в хирургический стационар и делают рентгенологическое обследование.
На обследовании выполняются рентгеновские снимки грудной клетки и брюшной полости, предварительно в пищевод устанавливают рентген-контрастный зонд. Исследование проводится в прямой проекции в вертикальном положении ребёнка. Оценивают уровень стояния зонда (свёрнутый зонд в слепом верхнем сегменте); газонаполнение желудка и кишечника (при наличии трахео-пищеводного свища между нижним сегментом и трахеей будет определяться воздух в брюшной полости, при отсутствии воздуха в желудке и кишечнике исключается наличие нижнего трахеопищеводного свища).
Также проводится рентген-контрастное исследование. Через зонд в верхний сегмент пищевода вводится не более 1 мл контраста. При наличии верхнего трахеопищеводного свища, кроме пищевода окрашивается ещё и трахеобронхиальное дерево.
Во время проведения рентгенологического обследования можно выявить сопутствующие патологии — непроходимость кишечника, пороки развития позвоночника и пневмонию.
В виду высокой вероятности сочетанных аномалий проводятся дополнительные обследования — УЗИ сердца, УЗИ мочевыделительной системы, нейросонография — ультразвуковое исследование головного мозга.
Параллельно с рентгенологическим обследованием проводится и общеклиническое: общий анализ крови, биохимический анализ крови, коагулограмма, определение газового состава крови, группы крови с фенотипом [1] [4] [5] [7] [9] [10] [13]
Лечение атрезии пищевода
Каждый ребёнок с подозрением на атрезию пищевода должен быть переведён в специализированный стационар, где при подтверждения диагноза начнётся лечение.
Консервативного лечения атрезии пищевода не существует. Коррекция порока — только хирургическое лечение. Операция проводится после стабилизации состояния ребёнка и коррекции нарушений метаболизма. Готовность ребёнка к операции определяют по результатам лабораторных показателей и всех проведённых обследований. Предоперационная подготовка занимает от 12 до 24 часов.
В некоторых случаях проводится экстренное лечение. Показанием для экстренной операции могут быть сопутствующие патологии (например, дуоденальная непроходимость, или атрезия кишечника), а также осложнения, связанные с наличием широкого трахеопищеводного свища и невозможностью проводить адекватную искусственную вентиляцию лёгких. Экстренное лечение проводится в первые часы после выявления патологии.
Цель операции — восстановление проходимости пищевода, соединение его разобщённых отделов и устранение трахеопищеводного свища.
В зависимости от технической оснащённости клиники и квалификации хирурга оперативное лечение проводят традиционным способом (открытая операция — торакотомия), или с помощью эндоскопического оборудования (торакоскопия) [2] [4] [7] [8] [14]
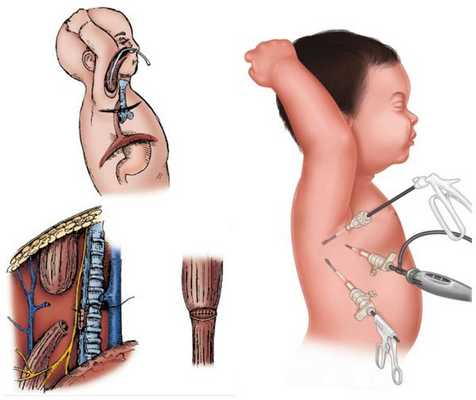
Этапная коррекция
Предпочтение к этапному лечению отдаётся у детей с нестабильной работой сердца и лёгких и детей с экстремально низкой массой тела. Этапное лечение также проводится при большом расстоянии между сегментами пищевода. Расстояние между сегментами пищевода, превышающее 2-3 см, считается противопоказанием к наложению первичного анастомоза (сшиванию концов пищевода в единый канал).
Первым этап коррекции: устранение трахеопищеводного свища и наложение гастростомы — специальной трубки, ведущей в желудок, с помощью которой можно искусственно подавать пищу.
Дальнейшая коррекция: наложение анастомоза (сшивание пищевода) или пластика пищевода с использованием тканей других органов. Предпочтительный орган для выполнения пластики пищевода — ободочная толстая кишка.
При невозможности сшивания пищевода или при повреждении его сегментов при попытке наложить анастомоз проводится двойная эзофагостомия по Баирову [5] . Дальнейшая пластика пищевода проводится через несколько месяцев после первого этапа операции.
Трудности в определении объёмов оперативного вмешательства возникают у детей с сочетанными пороками желудочно-кишечного тракта. Действия врачей в таких случаях для каждого ребёнка определяются индивидуально в зависимости от особенностей патологии. Но принцип ведения таких больных сводится к единому постулату: провести как можно меньше вмешательств с наиболее оптимальным эффектом.
Наиболее часто атрезия пищевода сочетается с высокой и низкой кишечной непроходимостью. Например, с атрезией мембраны двенадцатиперстной кишки или атрезией анального отверстия и прямой кишки.
При сочетании атрезии пищевода с высокой кишечной непроходимостью на первом этапе целесообразно наложить анастомоз пищевода и устранить трахеопищеводный свищ. Затем проводится радикальная операция для устранения кишечной непроходимости. Чтобы избежать в послеоперационном периоде застойные явления в желудке, нужно установить гастростому. В случае, если пришлось сшивать кишечник, также необходима установка трубки для внешнего питания.
При сочетании с низкой кишечной непроходимостью (атрезия анального отверстия или прямой кишки) выбор метода лечения определяется особенностями пороков. После разобщения трахеопищеводного свища и наложении анастомоза пищевода проводится коррекция низкой кишечной непроходимости. При высокой атрезии прямой кишки накладывается колостома — искусственный задний проход [1] [4] [5] .
Прогноз. Профилактика
При изолированных формах атрезии пищевода выживаемость достигает 90-100 %. При тяжёлых сочетанных аномалиях — значительно ниже, до 30-50 %.
Для прогноза по выживаемости в случае с артезией используются классификации по Waterston, Spitz, Poenaru. Данные классификации являются «оценочными» и используются больше для статистических измерений. На практике они не используются. Для примера приведём классификацию по Waterson:
- Класс А — масса тела при рождении больше 2500 граммов, нет пневмонии, нет сочетанных аномалий, выживаемость 99 %;
- Класс В — масса тела при рождении от 1800 до 2500 граммов, нет пневмонии, нет сочетанных аномалий; либо же масса тела при рождении более 2500 граммов, есть умеренная пневмония, имеются сочетанные аномалии, — выживаемость 95 %;
- Класс С — масса тела при рождении менее 1800 граммов, нет пневмонии, нет сочетанных аномалий; либо же масса тела при рождении больше 1800 граммов, есть тяжёлая пневмония, есть сочетанные аномалии, выживаемость 71 % [4] .
Осложнения после операции
В раннем послеоперационном периоде могут встречаться такие осложнения, как несостоятельность швов анастомоза пищевода и восстановление трахеопищеводного свища.
Если после начала кормления ребёнка в интубационной трубке появляется смесь, можно заподозрить, что трахеопищеводный свищ образовался снова. О нарушении герметичности анастомоза говорит появление слюны в страховочном дренаже в зоне анастомоза. В таких случаях для дополнительной диагностики проводится рентгенологическое исследование с использованием водорастворимых контрастных веществ. При обнаружении «утечки» проводится повторное оперативное вмешательство с целью устранения несостоятельности швов на пищеводе или трахее.
К поздним послеоперационным осложнениям можно отнести стеноз пищевода — канал становится более узким из-за рубцов. Возникает он обычно не ранее четырёх недель после проведённого оперативного вмешательства. Ребёнок начинает отказываться от еды, появляются явления дисфагии — затрудняется глотание, комок пищи не может пройти дальше по пищеводу.
Для диагностики стеноза пищевода проводится фиброэзофагоскопия и рентгеноскопия пищевода. Рентгенологическими признаками стеноза являются сужения в области зоны анастомоза и расширение пищевода выше анастомоза, отмечается замедление прохождения контрастного вещества за зону анастомоза. Если сужение пищевода всё-таки обнаружится, что в пищевод будет вставлена специальная трубка — буж, которая будет поддерживать канал в расширенном состоянии [1] [4] [11] .
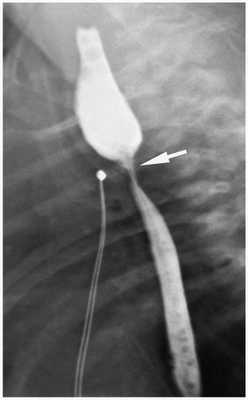
В ближайшие годы после оперативного лечения также могут отмечаться явления дисфагии — расстройства акта глотания и прохождения пищевого комка, связанные с желудочно-пищеводным рефлюксом или стенозом пищевода. Поэтому все дети, прооперированные из-за атрезии пищевода, подлежат постоянному наблюдению [1] [7]
Профилактика
Так как достоверных причин возникновения атрезии пищевода не установлено, специфических мер профилактики возникновения данного порока развития не существует.
Чтобы избежать появление аномалий развития, до или во время наступления беременности женщинам стоит придерживаться общих рекомендаций ВОЗ:
Читайте также:
