Лютеинизирующий гормон - ЛГ. Рецепторы к ФСГ и ЛГ, эндогенные опиоиды
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Этиология и патогенез овариальной гиперандрогении неопухолевого генеза синдрома поликистозных яичников (СПЯ), несмотря на многочисленные исследования, остаются неясными. Повышенное содержание ЛГ наблюдается далеко не у всех больных, что привело к разделению синдрома на «классический» и «неклассический». До сих пор нет доказательств основополагающей роли нарушений гонадотропной регуляции в патогенезе синдрома и, по мнению некоторых исследователей, изменения в гонадотропной регуляции, такие как повышенный уровень ЛГ, повышенное соотношение ЛГ/ФСГ, являются следствием, а не причиной заболевания.
Многочисленные данные относительно секреции гонадотропных гормонов в условиях пробы с люлиберином (ГнРГ) при данном заболевании свидетельствуют о повышенной секреции ЛГ с большими индивидуальными вариациями. Как показали исследования, на реакцию гонадотрофов могут оказывать влияние эндогенные опиоидные пептиды (ЭОП), дофамин, половые стероиды или неизвестные вещества, синтезируемые в яичнике и оказывающие влияние непосредственно на гонадотрофы. Какова причина вариабельности ответа у больных с СПЯ, остается неизвестной.
Особый интерес при данной патологии представляют секреция биологически активного ЛГ (6ЛГ) и соотношение 6ЛГ и иммунологически реактивного ЛГ (иЛГ). Такое различие в содержании ЛГ отражает структурную гетерогенность молекулы гормона, которая обусловлена вариациями в количестве и природе карбогидратного комплекса и особенно сиаловой кислоты. Гетерогенность определяется в меньшей степени также аминокислотной последовательностью. Исследования гипофизарных экстрактов, сыворотки крови показали, что наличие и распространение различных молекулярных форм ЛГ и ФСГ зависят от пола и эндокринного статуса. Например, молекулярные формы гонадотропинов у женщин после гонадэктомии и в период менопаузы. характеризуются повышением содержания сиаловых кислот, что увеличивает период полужизни гормона, но снижает его биологическую активность. И наоборот, у женщин репродуктивного возраста период полужизни гормона снижается, а его биологическая активность увеличивается. Кроме того, спектр синтезируемых и секретируемых форм гормона изменяется под влиянием половых стероидов, ЭОП, ГнРГ. И таким образом, индекс 6ЛГ/иЛГ является показателем синтеза и секреции разных форм гормона.
В задачу нашего исследования входило изучение секреции 6ЛГ и иЛГ у женщин с СПЯ в базальных условиях, на фоне введения ГнРГ, а также выяснение корреляционных связей со стероидными гормонами и клиническими проявлениями заболевания.
Ключевые слова
Для цитирования:
For citation:
Этиология и патогенез овариальной гиперандро- гении неопухолевого генеза синдрома поликистозных яичников (СПЯ), несмотря на многочисленные исследования, остаются неясными. Повышенное содержание ЛГ наблюдается далеко не у всех больных, что привело к разделению синдрома на «классический» и «неклассический» [2, 3]. До сих пор нет доказательств основополагающей роли нарушений гонадотропной регуляции в патогенезе синдрома и, по мнению некоторых исследователей, изменения в гонадотропной регуляции, такие как повышенный уровень ЛГ, повышенное соотношение ЛГ/ФСГ, являются следствием, а не причиной заболевания [7].
Многочисленные данные относительно секреции гонадотропных гормонов в условиях пробы с лю- либерином (ГнРГ) при данном заболевании свидетельствуют о повышенной секреции ЛГ с большими индивидуальными вариациями [5, 10]. Как показали исследования, на реакцию гонадотро- фов могут оказывать влияние эндогенные опиоидные пептиды (ЭОП), дофамин, половые стероиды или неизвестные вещества, синтезируемые в яичнике и оказывающие влияние непосредственно ■на гонадотрофы [9—12, 14]. Какова причина вариабельности ответа у больных с СПЯ, остается неизвестной.
Особый интерес при данной патологии представляют секреция биологически активного ЛГ '(6ЛГ) и соотношение 6ЛГ и иммунологически реактивного ЛГ (иЛГ). Такое различие в содержании ЛГ отражает структурную гетерогенность молекулы гормона, которая обусловлена вариациями в количестве и природе карбогидратного ■комплекса и особенно сиаловой кислоты. Гетерогенность определяется в меньшей степени также ■амииокислотной последовательностью. Исследования гипофизарных экстрактов, сыворотки крови показали, что наличие и распространение различных молекулярных форм ЛГ и ФСГ зависят от пола и эндокринного статуса [13, 14]. Например, молекулярные формы гонадотропинов у женщин после гонадэктомии и в период менопаузы .характеризуются повышением содержания сиало- ■аых кислот, что увеличивает период полужизни гормона, но снижает его биологическую активность. И наоборот, у женщин репродуктивного возраста период полужизни гормона снижается, а его биологическая активность увеличивается [13]. Кроме того, спектр синтезируемых и секретируемых форм гормона изменяется под влиянием половых стероидов, ЭОП, ГнРГ [5, 14]. И таким образом, индекс бЛГ/иЛГ является показателем синтеза и секреции разных форм гормона.
В задачу нашего исследования входило изучение секреции 6ЛГ и иЛГ у женщин с СПЯ в базальных условиях, на фоне введения ГнРГ, а также выяснение корреляционных связей со стероидными гормонами и клиническими проявлениями заболевания.
Материалы и методы
Обследовано 24 больных с СПЯ в возрасте от 12 до 36 лет с длительностью заболевания от 1 года до 16 лет. Контрольную группу составили 26 здоровых женщин в возрасте от 17 до 35 лет с нормальным овариальным циклом. Диагноз СПЯ устанавливался на основании клинических и лабораторных . исследований. В группу включались больные с нормальным или повышенным уровнем Л Г, тестостерона (Т), нормальным или сниженным уровнем ФСГ и нормальным уровнем пролактина (ПРЛ). Обследовали больных с нарушениями менструального цикла (олигоменореей, аменореей), которые по данным ультразвукового исследования имели нормального размера или увеличенные яичники с многочисленными кистами.
В крови больных в базальных условиях определяли уровень 6ЛГ, иЛГ, ФСГ, ПРЛ, Т методами радиоиммунологи- ческого анализа системы ВОЗ. Содержание эстрадиола (Нг) определяли с помощью наборов фирмы «Serono» (Италия), содержание 6ЛГ — по секреции Т-клетками Лейдига мышей ln vitro методом Е. Wilkings и соавт. [15]. Биометод обладает очень высокой ччувтЕ^г^т^е^льностью, что позволяет выявлять низкие концентрации гормона в любых тканях и биологических жидкостях.
У 18 больных исследовали секрецию 6ЛГ, иЛГ и ФСГ в условиях пробы с ГнРГ (фирмы «Ferring»), который в количестве 100 мкг вводили внутривенно. При этом взятие крови проводили по схеме 0, 15, 30, 60, 90, 120 мин. Статистическую обработку результатов проводили по методу Стьюдента.
Результаты и их обсуждение
На основании данных клинических, биохимических и морфологических исследований больные были разделены на 3 группы. В 1-ю группу вошли больные со средним возрастом 25,3+2,1 года длительностью заболевания 9,2+2,5 года. После предварительного клинического и гормонального обследования всем больным была проведена клиновидная резекция яичников и после гистологического исследования всем больным был поставлен диагноз текоматоза яичников.
Во 2-ю группу вошли больные с СПЯ в возрасте старше 20 лет (25,6+1,2 года) длительностью заболевания 9,8+2,7 года. У всех больных наблюдалось незначительное увеличение массы тела. Больные лечились консервативно с хорошим клиническим эффектом — восстановление регулярных овариальных циклов, фертильности, уменьшение гирсутизма.
- я группа неоднородна по своему составу. В среднем возраст больных составлял 15,7+0,6 года, длительность заболевания 3,2+0,6 года. В группу вошли девушки и молодые женщины (12—19 лет), которые были оперированы после предварительного обследования. Гистологически
Исходное содержание гонадотропных гормонов, Т и Ег у больных с СПЯ
подтвержден диагноз СПЯ. После оперативного вмешательства у всех больных восстановился нормальный овариальный цикл. Кроме того, в эту группу входили девушки от 15 до 18 лет, у которых отмечен положительный эффект от консервативного лечения и которые в настоящее время' не нуждаются в оперативном вмешательстве.
Результаты сравнительного исследования содержания гормонов у женщин здоровых и с СПЯ представлены в таблице. Содержание иЛГ было повышено у 12 (50 %) из 24 больных. Однако в среднем по группе больных его содержание достоверно не отличалось от нормы. Увеличение содержания 6ЛГ выявлено у 15 (62,5 %) больных. Следует отметить, что у остальных 9 больных содержание 6ЛГ было на верхней границе нормы. В среднем в данной группе содержание 6ЛГ достоверно превышало норму. Одновременное повышение содержания обеих форм гормона выявлено у 12 женщин, повышенный уровень 6ЛГ при нормальном уровне иЛГ отмечен у 3 женщин. Соотношение бЛГ/иЛГ достоверно не отличалось от нормы, соотношение 6ЛГ/ФСГ и иЛГ/ФСГ достоверно выше по сравнению с нормой. При этом необходимо подчеркнуть, что содержание ФСГ, ПРЛ, Е2 в группе больных достоверно не отличалось от физиологических значений. Однако содержание Т в среднем достоверно превышало его нормальный уровень. Достоверной корреляционной связи между содержанием гонадотропных и половых гормонов не выявлено.
Несмотря на предположение, что в основе патогенеза СПЯ лежит повышенная секреция ЛГ, многие исследователи не находят повышенного 'уровня гормона у больных с данным заболеванием [2, 3]. Не подтверждается такое предположение 1и результатами лечения больных. Недавние исследования R. Fleming и соавт. [7] показали, что исход лечения больных человеческим меноп аузаль- ным гонадотропином и хорионическим гонадотро- 'пином не зависит от исходного уровня ЛГ. Скорость роста и отбор пула фолликулов у больных с нормальным и высоким уровнем ЛГ одинаковы и, как считают авторы, повышенный уровень Л Г является следствием, а не причиной заболевания.
В целом по группе больных СПЯ выявлено повышенное соотношение 6ЛГ/ФСГ и иЛГ/ФСГ. Изменение соотношения ЛГ/ФСГ в сторону увеличения у больных СПЯ отмечается многими исследователями, и этот показатель широко используется для диагностики данного заболевания [3]. Это изменение обусловлено, по-видимому, не только повышением секреции ЛГ, но и снижением секреции ФСГ. В среднем содержание ФСГ у больных СПЯ не отличается от нормы, но, как правило, оно находится на ее нижней границе.
Исследование секреции гонадотропных гормонов у обследованных нами больных в условиях пробы с ГнРГ показало резкие индивидуальные различия в ответной реакции аденогипофиза. Прирост уровня иЛГ колебался от 10 до 209,4 ЕД/л, прирост уровня 6ЛГ — от 10 до 225,5 ЕД/л. Нами не выявлено связи между величиной ответа и исходным уровнем ЛГ, а также между содержанием половых стероидов и степенью прироста уровня ЛГ. При анализе секреции 6ЛГ и иЛГ в условиях пробы с ГнРГ обнаружены характерные особенности как величины выброса, так и его динамики. По двум этим параметрам больные были разделены на 3 группы: 1-я — больные с гиперергиче- ским выбросом иЛГ, не снижающимся к 120-й минуте, и незначительным выбросом 6ЛГ, снижающимся на 120-й минуте до исходного (рис. 1, кривая /); 2-я—больные, которые имели одинаковую направленность прироста и динамики секреции 6ЛГ и иЛГ; прирост уровня обеих форм гормона был незначительным. На 120-й минуте уровень их снижался до исходного (рис. 1, кривая 2) \ 3-я — больные с гиперергическим приростом уровня как и Л Г, так и 6ЛГ (рис. 1, кривая 3).
При анализе величины прироста уровня 6ЛГ и иЛГ выявлены следующие особенности (рис. 2): прирост уровня 6ЛГ у больных 3-й группы в среднем в 5—6 раз выше по сравнению с больными 1-й и 2-й группы. Прирост уровня иЛГ также был максимальным в этой группе. Соотношение секретируемых форм в ответ на пробу с ГнРГ у больных 3-й группы не изменялось в течение 120 мин. Однако следует отметить, что динамика секреции ЛГ у больных этой группы была разная. У 3 больных ' на 120-й минуте содержание иЛГ и 6ЛГ снижалось до исходного уровня. У остальных 3 больных содержание 6ЛГ и иЛГ на 120-й минуте в 2 раза превышало исходный уровень. Во 2-й группе больных величина прироста уровня 6ЛГ и иЛГ была незначительной и их соотношение не изменялось при проведении пробы. В 1-й группе больных наблюдался значительный прирост уровня иЛГ, достоверно превышающий прирост у больных 2-й группы. Секреция иЛГ не возвращалась к исходному уровню на 120-й ми-
Рис. 1. Секреция иЛГ и 6ЛГ у больных с СПЯ (1,2 и 3-й групп) в условиях пробы с люлиберином.
Рис. 2. Выброс гонадотропных гормонов (суммарный прирост от исходного) на введение люлиберина у больных с СПЯ и здоровых женщин.
По оси ординат — прирост гонадотропных гормонов, ЕД/л; по оси абсцисс — номера групп больных и группа здоровых женщин (Н).
нуте. Прирост содержания 6ЛГ незначительный. Соотношение секретируемых форм гормона в ответ на введение ГнРГ у больных данной группы достоверно снижалось уже на 15-й минуте от начала пробы.
Примечательно, что прирост уровня ФСГ в ответ на введение ГнРГ у больных 3-й группы достоверно выше по сравнению с больными 1-й и 2-й групп.
Величина выброса гонадотропных гормонов в ответ на введение ГнРГ зависит от уровня половых стероидов [1]. Кроме того, на характер ответа могут оказывать влияние ЭОП, дофаминергическая система [4, 10]. В своих исследованиях мы не установили связи между содержанием половых стероидов (Е2 и Т) и величиной прироста уровня ЛГ. Нами выявлено изменение соотношения бЛГ/иЛГ у больных 1-й группы. По сравнению с другими группами у этих больных достоверно повышен уровень Т. Можно предположить, что снижение соотношения у них обусловлено повышенным уровнем Т. Альтернативно Т может влиять прямо на гонадотрофы, изменяя процесс гликозилирования ЛГ. Недавно показано, что Т подавляет гликозилирование а-субъединицы ЛГ в культуре гипофизарных клеток [9]. Показано снижение уровня 6ЛГ под влиянием Т у мужчин. Мы исключили из исследования больных с высоким уровнем ПРЛ, поскольку они имеют гиперер- гический ответ на введение ГнРГ [11].
Изменение дофаминергической регуляции гонадотропной секреции у больных СПЯ подчеркивается рядом авторов. Так, в исследованиях [4, 11] показано, что у данных больных снижен ответ ПРЛ на введение сульпирида. Инфузия дофамина снижает секрецию ПРЛ у таких больных в большей степени, чем в норме [8]. Кроме того, показано, что лечение бромкриптином больных СПЯ снижает секрецию гонадотропных гормонов в ответ на ГнРГ. Мы не выявили связи между содержанием ПРЛ и выбросом ЛГ в ответ на введение ГнРГ. Однако исключить зависимость секреции ЛГ в условиях пробы от состояния дофаминергической регуляции на основании содержания ПРЛ не представляется возможным.
При исследовании исходного содержания гормонов у больных данных групп выявлено (рис. 3), что по содержанию Ег, ПРЛ, соотношению бЛГ/иЛГ они не различаются между собой и со здоровыми женщинами. В среднем содержание обеих форм ЛГ у больных этих групп также достоверно не различается. Однако обращает на себя внимание более высокий средний уровень 6ЛГ и иЛГ у больных 1-й группы. Отличительной чертой данной группы был достаточно однонаправленный высокий уровень ЛГ, особенно его биологической формы. Только у 1 из 7 женщин содержание 6ЛГ было в пределах нормы, у остальных 6 больных содержание гормона колебалось от 23,2 до 36,6 ЕД/л. У больных 2-й и 3-й групп содержание ЛГ не носило такого однородного характера и колебалось в более широком диапазоне. Во 2-й группе высокий уровень 6ЛГ выявлен у 2 (40 %) из 5 больных, в 3-й группе — у 3 (50 %) из 6. Отсутствие достоверной разницы в содержании 6ЛГ и иЛГ между группами, возможно, обусловлено малым числом больных в группах, а также большими вариациями в содержании гормона.
Рис. 3. Содержание половых и гонадотропных гормонов, соотношение ЛГ/ФСГ в 3 группах у больных с СПЯ и здоровых женщин.
По оси ординат — содержание гормонов в соответствующих единицах и соотношение ЛГ/ФСГЕ; по оси абсцисс номера групп больных и группа здоровых женщин (//).
Соотношение иЛГ/ФСГ у больных отдельных групп не отличалось от нормы. Однако величина эта была максимальной в 1-й группе. Аналогичная закономерность наблюдается в соотношении 6ЛГ/ФСГ, и эта разница у больных 1-й группы достоверна по сравнению с нормой.
Таким образом, в результате исследований установлено, что у больных с СПЯ и текоматозом в условиях пробы с ГнРГ наблюдаются резкие различия по величине прироста, динамике секреции и соотношению секретируемых 6ЛГ и иЛГ. Характер секреции ЛГ в условиях пробы с люли- берином имеет связь с клиническим течением заболевания, обусловленным нарушением функции яичников и состоянием гипоталамо-гипофизарной системы.
- У больных с СПЯ в условиях пробы с люли- берином секреция ЛГ неоднородна как по величине прироста, динамике,, так и по соотношению бЛГ/иЛГ.
- У больных с СПЯ и текоматозом в условиях пробы с люлиберином изменяется соотношение секретируемых 6ЛГ и иЛГ в сторону уменьшения уровня 6ЛГ, что может служить диагностическим критерием в диагностике текоматоза.
У больных с СПЯ без текоматоза соотношение 6ЛГ и иЛГ при пробе с люлиберином не изменяется.
Лютеинизирующий гормон - ЛГ. Рецепторы к ФСГ и ЛГ, эндогенные опиоиды
Лютеинизирующий гормон - ЛГ. Рецепторы к ФСГ и ЛГ, эндогенные опиоиды
Лютеинизирующий гормон (ЛГ) — гликопротеин с молекулярной массой 29 000 Да. Как и ФСГ, ТТГ или ХГЧ, он состоит из а- и b-субъединиц (b-ХГЧ). а-Субъединица идентична таковым ФСГ, ТТГ и ХГЧ. b-ХГЧ содержит 121 аминокислоту и 1-2 остатка сиаловых кислот.
Лютеинизирующий гормон (ЛГ) синтезируется в передней доле гипофиза. Из-за незначительного содержания сиаловых кислот он быстро выводится из кровотока почками и печенью, поэтому ЛГ синтезируется быстро, а пики его происходят с большей амплитудой по сравнению с ФСГ. Предполагают, что запасы ЛГ в гипофизе полностью обновляются 1-2 раза вдень.
Сывороточная концентрация лютеинизирующего гормона (ЛГ) начинает повышаться за несколько дней до начала менструации. В фолликулиновую фазу она очень плавно возрастает. В отличие от ФСГ, содержание ЛГ сыворотки крови резко повышается в позднюю фолликулиновую фазу, превосходя концентрацию ФСГ на 9-10-й дни цикла. Пик ЛГ в середине цикла сменяется стабильным снижением его концентрации до минимума в середине лютеиновой фазы.
Рецепторы к ФСГ и ЛГ
Эффекты лютеинизирующего гормона (ЛГ) и ФСГ опосредуются G-протеиновыми рецепторами клеточной мембраны. Рецепторы к ЛГ в организме обнаружены только на тека-лютеиновых клетках яичника. Стимуляция этих рецепторов повышением активности фермента цитохрома Р450с17 (17-гидроксилазы и 17,20-лиазы) на тека-лютеиновых клетках, приводящая к активации аденилатциклазы и цАМФ-зависимых протеинкиназ, увеличивает синтез андростендиона и тестостерона.
Рецепторы к ФСГ находятся исключительно на гранулезных клетках яичника. ФСГ связывается с рецепторами на поверхности гранулезных клеток антральных фолликулов. Как и в случае с ЛГ, эффекты ФСГ реализуются через цАМФ-зависимые протеинкиназы. Под действием ФСГ андрогены, синтезируемые в ответ на стимуляцию ЛГ, превращаются в гранулезных клетках в эстрогены путем ароматизации.
Эндогенные опиоиды
Эндогенные опиоиды — седативные наркотические вещества естественного происхождения, синтезируемые в головном мозге, строение и эффект которых сходны с опиумом. К эндогенным опиоидам относятся энкефалины, эндорфины и динорфины. Они влияют на синтез каждого из гипофизарных гормонов, воздействуя на гипоталамические структуры. Важнейший эффект опиоидов — ингибирование секреции гонадотропинов посредством подавления высвобождения ГнРГ.
Концентрация опиоидов — важный фактор регуляции менструального цикла. Минимальное содержание эндорфинов отмечают в ранней фолликулиновой фазе (во время менструации), затем оно постепенно возрастет до пиковой концентрации в лютеиновую фазу в ответ на подъем концентрации эстрогена и прогестерона. Считают, что опиоиды опосредуют отрицательную обратную связь между содержанием яичниковых стероидов и высвобождением гонадотропинов, особенно в лютеиновую фазу цикла.
Эндогенные опиоиды, по-видимому, играют ключевую роль в развитии гипоталамической аменореи. Назначение женщинам с такой патологией антагонистов опиоидных рецепторов (например, налтрексона) приводит к восстановлению овуляторного менструального цикла и даже (в некоторых случаях) способности к зачатию. У женщин со стрессовой аменореей обнаруживают повышенные концентрации гипоталамического кортиколиберина и гипофизарного кортикотропного гормона, что проявляется в виде гиперкортицизма. Пептид-предшественник кортикотропина проопиомеланокортин также является и предшественником эндорфина. Предполагают, что стрессовая аменорея наступает в результате ингибирования ГнРГ, вызванного повышением образования эндогенных опиоидов.
Количество опиоидов также повышается при физических нагрузках (так называемая эйфория бегуна), что может вносить определенный вклад в развитие гипоталамической аменореи у спортсменок.
Лютеинизирующий гормон (ЛГ)
Лютеинизирующий гормон синтезируется аденогипофизом. ЛГ является биоактивным веществом, регулирующим продукцию половых гормонов, участвующим в функционировании репродуктивной системы. От его уровня зависит фертильность женского и мужского пола. Анализ на содержание ЛГ важен при оценке репродуктивного здоровья, планировании зачатия, исследовании патологий полового развития, эффективности гормонзаместительной терапии.
Характеристика и роль гормона
ЛГ – гликопротеид, состоящий из α и β-субъединиц. α-субъединица по строению и функциям одинакова у многих гормонов. Отличие функций обусловлено различным строением β-субъединицы. Именно эта часть молекулы гормона ЛГ и образует комплексы с рецепторами в тканях-мишенях. Активность β-субъединицы ограничивается гонадотропными клетками гипофиза.
По своему строению вещество схоже с фолликулостимулирующим гормоном и хорионическим гонадотропином. Но из-за более низкого содержания в ЛГ сиаловой кислоты, его время циркуляции в системном кровотоке в 4-6 раз меньше, чем у перечисленных гормонов. Лютеинизирующий гормон оказывает потенцирующее воздействие на синтез эстрогена и прогестерона у женщин и тестостерона у мужчин.
Повышение уровня ЛГ запускает процесс овуляции. Гормон необходим не только для роста яйцеклетки, стероидогенеза, но и для поддержания существования «желтого тела». У женщин ЛГ влияет на клетки тканей яичников, стимулируя синтез предшественников эстрадиола и андрогенов.
У мужчин гормон влияет на работу клеток Лейдинга, локализованных в семенниках, вырабатывающих мужской половой гормон, ответственный за сперматогенез. Уровень гормона ЛГ контролируется гонадорелином, который продуцирует гипоталамус.
Уровень гормона зависит от многих факторов. Отмечается корреляция его с:
- полом;
- возрастом;
- состоянием репродуктивных органов и нервной системы;
- питанием и образом жизни;
- климатическими условиями;
- условиями труда;
- экологией.
У мужчин в репродуктивном возрасте активность ЛГ не изменяется. У женщин колебания количества ЛГ отмечаются на протяжении всей жизни. Своего пика активность гормона ЛГ достигает в середине менструального цикла. Его количество увеличивается в 10 раз за сутки до выхода созревшей яйцеклетки.
Если женщина планирует зачатие, то рекомендуется ежедневно измерять содержание ЛГ в моче, начиная с 12 и заканчивая 28 днями менструального цикла. Также цикличность роста активности гормона отмечается с:
- момента рождения;
- 6-8 лет до пубертата;
- менопаузы.
Повышение уровня ЛГ является диагностическим признаком:
- образования множественных кист в яичниках;
- процесса овуляции;
- гипофизарных новообразований;
- эндометриоза;
- патологии почек;
- интенсивных физических нагрузок;
- воздействия стрессовых факторов;
- недостаточного питания;
- гиперплазии надпочечников;
- влияния лекарств;
- атрофии семенников.
Понижен уровень лютеотропина может быть в результате:
- вторичной аменореи;
- хирургического вмешательства;
- нарушения обмена веществ;
- никотиновой зависимости;
- терапевтического воздействия;
- стресса.
У мужчин ЛГ повышен после 60-65 лет. Для диагностического исследования оценивают соотношение ЛГ/ФСГ.
Когда назначают анализ на ЛГ
Показанием к проведению анализа на лютеотропин служат:
- половые дисфункции: снижение полового влечения, нарушение потенции;
- аномалии полового созревания;
- задержка роста;
- бесплодие;
- подготовка к экстракорпоральному оплодотворению;
- определение благоприятного периода зачатия;
- невынашивание плода;
- патологии репродуктивной системы, в том числе: эндометриоз, поликистоз яичников, аменорея;
- повышенное оволосение;
- дисфункциональные маточные кровотечения;
- контроль эффективности гормонзаместительной терапии и др.
На руки пациенту выдается бланк, в котором указана норма и полученный результат. Таблица, в которой указана норма ЛГ для разного возраста и пола пациентов имеет следующий вид.
Для получения объективных данных необходимо придерживаться правил сдачи крови для проведения анализа.
Правила подготовки
Так как влияние эндогенных и экзогенных факторов на уровень ЛГ может исказить результаты исследований, необходимо придерживаться правил, минимизирующих ошибку:
- сдавать материал на голодный желудок;
- исключить влияние вредных веществ – алкоголя, табака, лекарств;
- исключить воздействие стрессирующих факторов и экстремальных физических нагрузок.
У женщин с регулярным месячным циклом рекомендуется сдавать кровь на 6-7 день месячных. При нарушении цикла анализ проводят ежедневно в интервале с 8 по 18 день месячных. Интерпретацию полученных результатов тестирования проводит только врач.
Отзывы
10 років не виходило у нас із чоловіком народити дітей. Пройшли всіх найкращих лікарів в своєму місті, а потім зрозуміли, що вже треба їхати в Харків або Київ, бо тут вже допомогти не могли. З початку ми звернулися до найрозкрученішої харківської клініки, де спочатку мені сказали, що своїх рідних дітей я мати не зможу ніколи, а коли прийшли аналізи чоловіка, передзвонили та відмовилися з нами працювати взагалі. Скільки я проревіла – не хочу й згадувати. І я почала шукати, хто б взявся за наш майже безнадійний випадок – бо проблеми були з обох стрін і у кожного з нас - одразу декілька, і цією вирішальною людиною у моєму житті та житті нашої родини виявилася Багатько Ольга Володимирівна. Сподобалася нам з першого прийому – компетентний, розумний та приємний у спілкуванні лікар. А далі – море підтримки і лише вперед! І ось результат - 22.04.2022 на світ з'явився наш довгоочікуваний син!! Дякуємо безмежно за наше щастя!! )))))
Обзор эндокринной системы (Overview of the Endocrine System)
Эндокринная система координирует функции различных органов посредством гормонов, являющихся химическими веществами, которые выделяются в кровоток из специализированных клеток, находящихся внутри эндокринных желез (внутренней секреции). Находясь в крови, гормоны влияют на функцию тканей-мишеней, которые могут быть либо другой эндокринной железой, либо рецептором. Некоторые гормоны действуют на клетки того же органа, который является их источником (паракринный эффект), а иногда даже на сами продуцирующие их клетки (аутокринный эффект).
Гормоны могут быть:
Пептиды (одна или несколько аминокислот, соединенных химическими связями) различных размеров
Стероидами (образуются из холестерина)
Гормоны избирательно связываются с рецепторами, располагающимися внутри или на поверхности клеток-мишеней. Рецепторы, находящиеся внутри клетки, взаимодействуют с гормонами, регулирующими функции гена (например, кортикостероидами, витамином D, гормоном щитовидной железы). Рецепторы на поверхности клеток связываются с гормонами, которые регулируют функцию энзимов или влияют на ионные каналы (например, гормон роста, тиреотропин-рилизинг гормон).
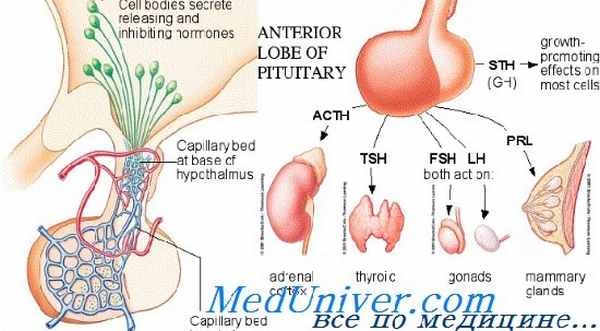
Гипофиз и его органы-мишени
Гипоталамо-гипофизарная система
Функции периферических эндокринных органов в той или иной степени контролируются гормонами гипофиза. Некоторые функции (например, секреция инсулина поджелудочной железой, в первую очередь контролируется уровнем глюкозы в крови) контролируются в минимальной степени или являются независимыми от контроля гипофиза (например, секреция паратиреоидного гормона Обзор паратиреоидной функции Обычно имеется четыре околощитовидные железы. Как следует из названия, они располагаются рядом со щитовидной железой, хотя их число и особенно локализация весьма разнообразны. Эти железы размером. Прочитайте дополнительные сведения околощитовидными железами, прежде всего происходит в ответ на уровень кальция в крови), в то время как многие (например, секреция гормонов щитовидной железы или гонад) контролируются в значительной степени. Секреция самих гипофизарных гормонов контролируется гипоталамусом.
Взаимоотношения между гипоталамусом и гипофизом (называемые гипоталамо-гипофизарной системой) представляют собой систему с обратной связью. Гипоталамус получает сигналы практически из всех областей центральной нервной системы и использует их для формирования сигналов, направляемых в гипофиз. Гипофиз в ответ выделяет различные гормоны, которые стимулируют многие эндокринные железы организма. Изменения в крови уровней гормонов, продуцируемых этими эндокринными железами, воспринимаются гипоталамусом, который соответственно усиливает или ослабляет стимуляцию гипофиза, поддерживая таким образом гомеостаз.
Гипоталамус модулирует активность передней и задней долей гипофиза разными способами. Синтезируемые в гипоталамусе нейрогормоны достигают передней доли гипофиза (аденогипофиза) через особую портальную систему сосудов и регулируют синтез и секрецию 6 основных пептидных гормонов передней доли (см. рисунок Гипофиз и его органы-мишени Гипофиз и его органы-мишени ). Последние регулируют функции периферических эндокринных желез (щитовидной железы, надпочечников и гонад), а также рост и лактацию. Прямые нервные контакты между гипоталамусом и передней долей гипофиза отсутствуют.
В отличие от этого задняя доля гипофиза (нейрогипофиз) состоит из аксонов, нейронные тела которых расположены в гипоталамусе. Эти аксоны служат в качестве депо для 2 пептидных гормонов: вазопрессина (антидиуретического гормона) и окситоцина , синтезируемых в гипоталамусе; на периферии эти гормоны регулируют водный баланс, выработку молока и маточное сокращение.
Практически все гормоны, продуцируемые гипоталамусом и гипофизом, выделяются в кровь импульсами; периоды секреции сменяются периодами покоя. Секреция некоторых гормонов [например, адренокортикотропного гормона (АКТГ), гормона роста, пролактина] обладает четким циркадным ритмом; секреция других (например, лютеинизирующего и фолликулостимулирующего гормонов в ходе менструального цикла) подчиняется месячному ритму, на который накладывается циркадный.
Лютеинизирующий гормон (ЛГ, LH)
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, и приводимая ниже информация носит исключительно справочный характер.
Лютеинизирующий гормон: показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания для назначения исследования
Уровень лютеинизирующего гормона в сыворотке крови определяют при гонадальной причине бесплодия, когда отмечают увеличение его концентрации, сочетающееся с низкой концентрацией половых гормонов.
Низкие концентрации лютеинизирующего гормона наблюдаются в случае гипофункции гипофиза.
Подготовка к процедуре
- Утром натощак, после ночного периода голодания продолжительностью от 8 до 14 часов.
- Накануне следует избегать пищевых перегрузок.
- Исключить прием алкоголя накануне исследования и не курить минимально в течение 1 часа до исследования.
- За три дня до исследования исключить физические нагрузки (спортивные тренировки).
- Избегать эмоциональных перегрузок накануне исследования.
Синонимы: Гликопротеидный гонадотропный гормон; Лютеотропин; Лютропин. Luteinizing hormone; LH; Lutropin; Interstitial cell stimulating hormone; ICSH. Краткая характеристика определяемо�.
Срок исполнения
1 рабочий день (указанный срок не включает день взятия биоматериала).
Что может повлиять на результаты
Женщинам определение уровня лютеинизирующего гормона в крови при условии регулярных менструаций обычно назначают на 2-4-й день цикла, если лечащим врачом не указаны иные рекомендации. При сдаче крови необходимо указывать день цикла.
На концентрацию лютеинизирующего гормона в крови может заметно повлиять сильный стресс, интенсивные спортивные тренировки накануне сдачи крови, прием пероральных контрацептивов и гормональных препаратов.
Лютеинизирующий гормон
Сдать Лютеинизирующий гормон можно в ближайшем медицинском офисе ИНВИТРО. Список офисов, где принимается биоматериал для лабораторного исследования, представлен в разделе «Адреса».
Референсные значения
В таблице представлены нормальные значения лютеинизирующего гормона в зависимости от пола, возраста и фазы менструального цикла (для женщин).
| Возраст (период) | Уровень лютеинизирующего гормона, мМЕд/мл | ||
| Женщины | Мужчины | ||
| 0 - 1 год | < 3,29 | < 6,34 | |
| 1 - 5 лет | < 0,27 | < 0,92 | |
| 5 - 10 лет | < 0,46 | < 1,03 | |
| 10 - 14 лет | < 15,26 | < 5,36 | |
| 14 – 20 лет | < 15,97 | 0,78 – 4,93 | |
| старше 20 года | - | 1,14 – 8,75 | |
| Репродуктивный период | Фолликулярная фаза | 1,68 – 15,0 | - |
| Овуляторная фаза | 21,9 – 56,6 | - | |
| Лютеиновая фаза | 0,61 – 16,30 | - | |
| Постменопауза | 14,2 -52,3 | - | |
Лютеинизирующий гормон
Лютеинизирующий гормон – это вещество, образующееся в гипофизе (небольшой эндокринной железе, располагающейся в основании черепа и связанной короткой ножкой со специальным отделом головного мозга - гипоталамусом).
В эмбриональном (внутриутробном) периоде и после рождения вплоть до полового созревания образование лютеинизирующего гормона как в женском, так и в мужском организме постоянно и равномерно - его концентрация сохраняется на низком уровне. Рост уровня этого гормона у женщин начинается с наступлением фертильного возраста.
Образуясь в клетках гипофиза, лютеинизирующий гормон попадает в кровь и достигает половых желез, где располагаются его клетки-мишени.
Лютеинизирующий гормон является важным участником образования яйцеклеток в яичниках женщин и сперматозоидов в семенниках у мужчин.
Кроме того, с помощью лютеинизирующего гормона происходит регуляция образования половых гормонов.
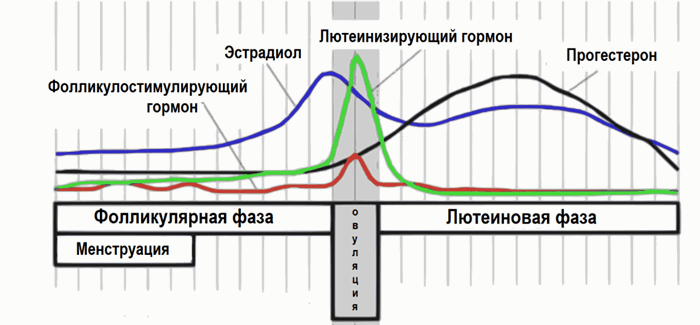
По достижении фертильного возраста у женщин в яичниках начинают образовываться яйцеклетки, проходя через несколько стадий созревания, - этот процесс цикличен (повторяется примерно каждые 28 дней) и называется менструальным циклом. Внутри яичника яйцеклетка находится в фолликуле, окруженном специальными (соматическими) клетками. В течение каждого цикла яйцеклетка приобретает свойства, необходимые для оплодотворения и формирования жизнеспособного эмбриона. К середине менструального цикла происходит выброс лютеинизирующего гормона, что обеспечивает овуляцию – своевременное высвобождение созревшей яйцеклетки. К моменту овуляции концентрация лютеинизирующего гормона резко возрастает. Лютеинизирующий гормон запускает и регулирует заключительные стадии созревания яйцеклетки и разрыв фолликула для выхода полноценной яйцеклетки в маточную трубу, где возможно оплодотворение.
После овуляции уровень лютеинизирующего гормона снижается по отношению к «овуляторному пику», начинается лютеиновая фаза менструального цикла. В эту фазу под действием лютеинизирующего гормона разорвавшийся фолликул превращается в так называемое желтое тело, где секретируется гормон прогестерон.
У мужчин рецепторы к лютеинизирующему гормону располагаются на клетках Лейдига, которые синтезируют мужской половой гормон тестостерон.
Снижение или прекращение образования лютеинизирующего гормона (гипофизарная недостаточность) может приводить к развитию бесплодия, отсутствию менструаций, импотенции, снижению либидо.
Секреция лютеинизирующего гормона повышается при физических нагрузках и тренировках, а снижается при психологическом стрессе.
Причины повышения уровня лютеинизирующего гормона в крови
- Базофильная аденома гипофиза.
- Гипергонадотропный гипогонадизм (у женщин): синдром истощения яичников.
- Синдром поликистозных яичников.
- Эндометриоз.
- Синдром Шершевского-Тернера.
- Тестикулярная феминизация.
- Длительное голодание.
- Интенсивные спортивные тренировки.
- Почечная недостаточность.
Причины снижения лютеинизирующего гормона в крови
- Вторичная аменорея.
- Гиперпролактинемия.
- Гипофизарный нанизм.
- Синдром Шихана.
- Болезнь Симмондса.
- Синдром Денни-Морфана.
- Синдром поликистозных яичников: атипичная форма.
- Недостаточность лютеиновой фазы.
- Ожирение.
- Курение.
- Хирургические вмешательства.
- Стресс.
- Diane M Duffy, CheMyong Ko, Misung Jo, Mats Brannstrom and Thomas E Curry. Ovulation: Parallels With Inflammatory Processes. Endocrine Reviews, Volume 40, Issue 2, April 2019, P. 369–416 .
- Rebecca L Robker, Jon D Hennebold, Darryl L Russell. Coordination of Ovulation and Oocyte Maturation: A Good Egg at the Right Time. Endocrinology, Volume 159, Issue 9, September 2018, P. 3209–3218 .
- Верин В.К., Иванов В.В. Гормоны и их эффекты: справочник. СПб: ООО «Издательство ФОЛИАНТ», 2012, 23-27.
- Физиология человека с основами патофизиологии: в 2 т. Т.1/ под ред. Р.Ф. Шмидта, Ф. Ланга, М. Хекманна; перевод с нем. под ред. М.А. Каменской и др. – 2 изд., М: - Лаборатория знаний, 2021. – 537 с.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Читайте также:
