Макролиды - эритромицин. Кларитромицин и азитромицин
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Начало клинического применения макролидов датируется 1952 годом, когда из культуры Streptomyces erythreus, полученной из образцов почвы филиппинского острова Paray, был выделен эритромицин [1, 2]. Однако со временем «увлеченность» эритромицином, прежде всего — при инфекциях кожи и мягких тканей, дыхательных путей и др., уступила место более сдержанному к нему отношению, что объяснялось невысокой биодоступностью при приеме препарата внутрь (из-за его низкой стабильности в кислой среде желудка и как следствие этого — малопредсказуемой гастроинтестинальной абсорбции), быстрой элиминацией, требующей частого повторного приема, а также большим числом нежелательных явлений [3, 4].
Последовавшее за этим в 80–90-х годах прошлого века возрождение интереса к макролидным антибиотикам, помимо уточнения «слабых мест» эритромицина, было обусловлено осознанием клинического значения в развитии патологии человека таких возбудителей, как Legionella spp., Mycoplasma spp., Chlamydia/Chlamydophila spp., Campylobacter spp. и ряда других внутриклеточных патогенов, в отношении которых макролиды демонстрируют беспрецедентную активность. Итогом этого явилось создание новых препаратов с более высокой кислотоустойчивостью, биодоступностью, привлекательным профилем безопасности, а также расширенным спектром антимикробного действия.
Основу химической структуры макролидов составляет макроциклическое лактонное кольцо, связанное с одним или несколькими углеводными остатками. В зависимости от числа атомов углевода в гетероциклической структуре макролидные антибиотики подразделяются на 14-членные (природные — эритромицин, олеандомицин; полусинтетические — кларитромицин, рокситромицин, диритромицин), 15-членные (азалиды) — азитромицин (полусинтетический препарат) и 16-членные (природные — спирамицин, джозамицин, мидекамицин) (табл. 1) [5].
В настоящее время современные макролиды (прежде всего — кларитромицин и азитромицин) относятся к числу наиболее часто применяемых антибиотиков в амбулаторной практике. В частности, в США в период с 1992 по 2000 гг. было отмечено 4-кратное возрастание частоты назначения кларитромицина на фоне сокращения использования аминопенициллинов и эритромицина [6].
Обратной стороной столь высокой популярности данной группы антибиотиков является рост устойчивости основного возбудителя внебольничных инфекций дыхательных путей — Streptococcus pneumoniae к макролидам, что в очередной раз вызвало необходимость обсуждения перспектив их дальнейшего использования в клинической практике. Все сказанное выше и побудило к написанию данной статьи, посвященной оценке роли и места кларитромицина в лечении обострения хронической обструктивной болезни легких (ХОБЛ).
Кларитромицин (6-О-метилэритромицин) был разработан в результате химического модифицирования эритромицина путем замещения гидроксильной группы эритромицина в положении С6 на метокси-группу (рис. 1) [7, 8].
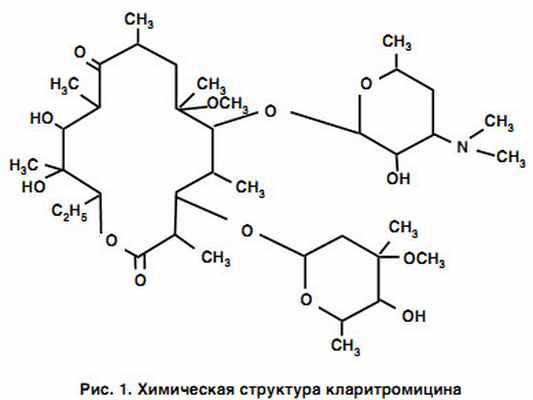 |
Данная структурная модификация обеспечила большую активность кларитромицина по сравнению с эритромицином в отношении S. pneumoniae, Streptococcus pyogenes, Staphylococcus aureus и Moraxella catarrhalis (табл. 2). Кларитромицин уступает in vitro азитромицину по активности в отношении Haemophilus influenzae, однако его действие in vivo усиливается за счет активного метаболита 14-гидроксикларитромицина (14-ГКМ), обладающего более высокой активностью в отношении данного микроорганизма [9]. Препарат демонстрирует также наилучший эффект при инфекции, вызванной метициллиночувствительными штаммами S. aureus. И, наконец, большая устойчивость кларитромицина в кислой среде эндосом повышает активность препарата в отношении таких внутриклеточных патогенов, как Legionella pneumophila и Chlamydophila pneumoniae. Препарат демонстрирует высокую и сравнимую с другими макролидами активность в отношении Mycoplasma pneumoniae. Необходимо отметить, что грамотрицательные бактерии семейства Enterobacteriaceae, Pseudomonas и Acinetobacter обладают природной устойчивостью ко всем макролидным антибиотикам.
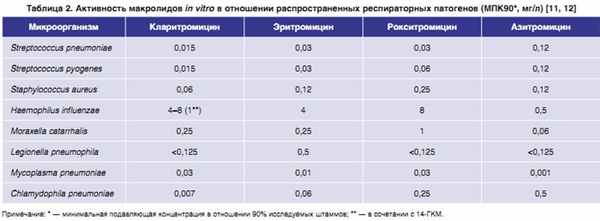 |
Механизм действия макролидов
Все макролиды демонстрируют сходный механизм действия, основанный на ингибировании у чувствительных микроорганизмов РНК-зависимого синтеза удлинения белковой молекулы. Антибиотики обратимо связываются с 50S субъединицей бактериальной рибосомы, результатом чего становится блокада транспептидации и/или транслокации, преждевременно отщепляется растущая тРНК-полипептидная цепочка, обусловливая прекращение сборки белковой молекулы. Характер антимикробного действия кларитромицина в большинстве случаев бактериостатический, но при определенных условиях (в зависимости от вида микроорганизма, концентрации антибиотика и размера инокулюма) в отношении таких микроорганизмов, как S. pneumoniae и S. pyogenes, возможен бактерицидный эффект.
Антимикробный эффект в отношении H. influenzae и S. pneumoniae азитромицина и в некоторой степени кларитромицина зависит от создаваемой в очаге инфекции концентрации, а для остальных макролидов — от поддержания концентрации выше минимальной подавляющей концентрации (МПК) на протяжении как минимум 40–50% временного интервала между приемами доз.
Неантимикробная активность кларитромицина
Кларитромицин, как и ряд других макролидов, обладает противовоспалительными, иммуномодулирующими и мукорегулирующим свойствами, которые проявляются независимо от его антибактериальной активности [17, 18]. Кроме всего прочего, макролиды, в том числе кларитромицин, способствуют уменьшению гиперреактивности бронхиального дерева, оказывают благоприятное влияние на клиренс бронхиального и назального секрета. Как показывают исследования, их применение приводит к уменьшению продукции мокроты у пациентов с избыточной секрецией, что характерно для таких заболеваний, как ХОБЛ, диффузный панбронхиолит, хронический синусит [5].
Механизмы развития резистентности к макролидам
Широкое применение макролидов обусловливает рост устойчивости среди штаммов S. pneumoniae и S. pyogenes — основных возбудителей внебольничной пневмонии и острого тонзиллита/фарингита соответственно. Известно, что устойчивость микроорганизмов к макролидам в основном (более чем в 90%) определяется двумя основными механизмами: модификацией мишени их действия (это происходит вследствие выработки микроорганизмами фермента метилазы эритромицинрезистентности) и активным выведением препарата (эффлюксом) из микробной клетки [14].
Под действием метилазы 14-, 15- и 16-членные макролиды, линкозамиды и стрептограмин В теряют способность связывания с рибосомами (MLSB-фенотип), а микроорганизм приобретает высокий уровень устойчивости (МПК >32–64 мг/л). Данный механизм резистентности характерен для S. pneumoniae, S. aureus, S. pyogenes и ряда других микроорганизмов.
Другой распространенный механизм устойчивости к макролидам обусловлен выведением препарата из микробной клетки (М-фенотип). В результате формируется устойчивость к 14- и 15-членным макролидам, но менее выраженная (МПК=1–32 мг/л), чем в случаях MLSB-фенотипа резистентности. Штаммы, обладающие М-фенотипом резистентности, сохраняют чувствительность к 16-членным макролидам, кетолидам, линкозамидам, стрептограминам группы В. Эффлюкс характерен для S. pneumoniae, S. pyogenes, S. epidermalis, S. aureus, Enterococcus spp.
Интересно отметить тот факт, что риск селекции лекарственноустойчивых микроорганизмов (например, S. pneumoniae) зависит от длительности периода полувыведения того или иного макролида, оказываясь меньшим у кларитромицина (период полувыведения — 5–6 ч) по сравнению с азитромицином (период полувыведения — 35–76 ч) [21]. Это обусловлено длительным сохранением азитромицина в организме в низких (субингибирующих) концентрациях, которые не способны подавлять рост микроорганизмов, но, тем не менее, могут вызвать мутации, способствующие развитию резистентности (рис. 2).
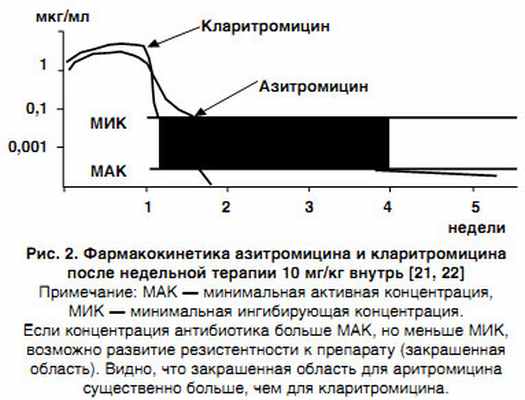 |
Фармакокинетика
Метилирование гидроксигруппы эритромицина в положении С6 улучшает кислотную устойчивость, что позволяет кларитромицину лучше всасываться из желудочно-кишечного тракта (ЖКТ) [10]. Кроме того, при низких значениях рН кларитромицин не распадается на элементы, ответственные за возникновение значительной части побочных эффектов, что наблюдается, в частности, при применении эритромицина [9]. При приеме внутрь кларитромицин быстро всасывается в ЖКТ, его максимальные концентрации в крови достигаются через 1–2 ч. Биодоступность составляет 52–55%, незначительно возрастает при одновременном приеме с пищей, у пожилых пациентов [13]. Сывороточная концентрация антибиотика при приеме внутрь варьирует от 1 мг/л (прием 250 мг 2 раза в сутки) до 2–3 мг/л (при применении 500 мг 2 раза в сутки); 42–70% препарата связывается с белками плазмы (табл. 3) [14].
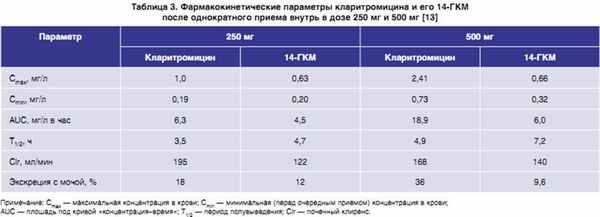 |
Важной особенностью кларитромицина является способность накапливаться в полиморфноядерных нейтрофилах, макрофагах, моноцитах — концентрации препарата в альвеолярных макрофагах превышают внеклеточные в 94 раза, а в мононуклеарах — в 20 раз [15]. Максимальное накопление препарата наблюдается в легочной ткани, жидкости, выстилающей слизистую оболочку бронхов и альвеолы, бронхиальном секрете, слюне, миндалинах, среднем ухе, синусах, слизистой оболочке ЖКТ, предстательной железе, конъюнктиве и тканях глаза, коже, желчи, уретре, матке, придатках и плаценте [16]. В частности, концентрация препарата в жидкости, выстилающей альвеолы, — в сотни раз, а в альвеолярных макрофагах — в тысячи раз превышает таковую в сыворотке крови.
Кларитромицин интенсивно (на 78%) метаболизируется в печени путем окислительного N-деметилирования и гидроксилирования при участии системы цитохрома Р450; главным метаболитом (20%) является микробиологически активный 14-ГКМ. Около 20–30% от введенной дозы экскретируется через почки в неизмененном виде, 10–15% — в виде метаболитов. Период полувыведения (Т1/2) при приеме в дозе 250 мг 2 раза в сутки составляет 3–4 ч и возрастает до 7–8 ч при увеличении дозы до 500 мг 2 раза в сутки [13]. При почечной недостаточности (клубочковая фильтрация
Нежелательные лекарственные реакции
Наиболее типичными при применении кларитромицина являются нежелательные лекарственные реакции (НЛР) со стороны ЖКТ — диарея, тошнота, изменение вкуса, встречающиеся с частотой около 3% у взрослых [5, 12]. Иногда на фоне приема препарата отмечается повышение активности печеночных трансаминаз. Большинство НЛР при приеме кларитромицина мало выражены и носят транзиторный характер. По сравнению с эритромицином он характеризуется достоверно меньшей частотой НЛР со стороны ЖКТ у взрослых и реже вызывает НЛР, приводящие к прекращению приема препарата (13% в сравнении с 32% соответственно; р<0,01). Препараты группы макролидов не обладают перекрестными аллергическими реакциями с антибиотиками, содержащими b-лактамное кольцо (пенициллины, цефалоспорины), что позволяет использовать их у лиц с аллергическими реакциями на b-лактамные антибиотики. Случаи развития аллергических реакций на макролиды — чрезвычайно редки.
Резистентность к макролидам ключевых возбудителей инфекционного обострения ХОБЛ
Согласно результатам международного многоцентрового исследования PROTEKT (2002) распространенность штаммов S. pneumoniae, резистентных к эритромицину, составила 31,5%. В Европе резистентность пневмококков к макролидам в 2000–2001 гг. варьировала в широких пределах – от 12,2% (Великобритания) до 36,6% и 58,1% (Испания и Франция соответственно). Однако в РФ данные о резистентности клинических штаммов S. pneumoniae, полученные в ходе многоцентрового исследования ПеГАС (1999–2005), показали, что резистентность пневмококка к макролидам остается невысокой: частота выявления штаммов, не чувствительных к 14- и 15-членным макролидам (эритромицин, кларитромицин, азитромицин), составляет 6–9%, к 16-членным макролидам (спирамицин, мидекамицин) и линкозамидам — 4,5% [23].
От 61 до 95% штаммов Н. influenzae, как продуцирующих, так и не продуцирующих b-лактамазы, чувствительны к кларитромицину. При этом средние значения МИК50 и МИК90 кларитромицина примерно в 2 раза выше, чем у азитромицина, однако здесь следует учитывать возможную недооценку активности препарата, поскольку активность метаболита 14-ГКМ аналогична таковой у азитромицина [24]. В отношении ряда штаммов Н. influenzae комбинированная ингибирующая активность кларитромицина и 14-ГКМ оказывается содружественной, а в ряде случаев — синергичной.
В отношении М. catarrhalis существенных отличий между значениями МПК для разных макролидов не выявлено, при этом и кларитромицин, и эритромицин демонстрируют высокую активность в отношении данного микроорганизма [25, 26].
Обострение ХОБЛ
Установлено, что пациенты с ХОБЛ переносят от 1 до 4 и более обострений заболевания в течение года, и именно частота обострений является одним из наиболее важных факторов, определяющих качество жизни больных ХОБЛ, темпы прогрессирования заболевания и экономические потери [30, 31].
По современным представлениям до 75–80% обострений ХОБЛ имеют инфекционную природу, а наиболее вероятными возбудителями являются нетипируемые штаммы H. influenzae, а также S. pneumoniae и M. catarrhalis, удельный вес которых, по данным различных исследователей, составляет 13–46%, 7–26% и 9–20% соответственно [31]. Кларитромицин, как уже было отмечено выше, обладает высокой активностью в отношении пневмококка и M. сatarrhalis, а за счет активного метаболита 14-ГКМ демонстрирует и клинически значимую активность в отношении H. influenzae. Клиническая и микробиологическая эффективность антибиотика при лечении инфекционного обострения ХОБЛ подтверждена результатами многочисленных исследований (табл. 4).
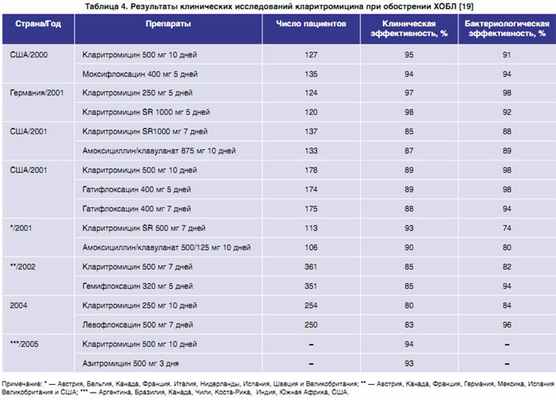 |
В этом плане показательны и результаты мета-анализа, выполненного I.I. Siempos и соавторами (2007) [32], в ходе которого проводилась сравнительная оценка эффективности и безопасности использования макролидов, респираторных фторхинолонов и амоксициллина/клавуланата в терапии пациентов с обострением хронического бронхита бактериальной природы. Авторами проанализировано 19 рандомизированных контролируемых исследований, в которых макролиды продемонстрировали сравнимую эффективность с b-лактамными антибиотиками и фторхинолонами при лечении пациентов с инфекционным обострением ХОБЛ (рис. 3, 4). Однако отмечено, что использование фторхинолонов характеризовалось более высокой микробиологической эффективностью и меньшей частотой рецидивов хронического бронхита по сравнению с макролидами, тогда как использование амоксициллина/клавуланата сопровождалось наиболее высокой частотой развития нежелательных лекарственных реакций по сравнению с другими препаратами.
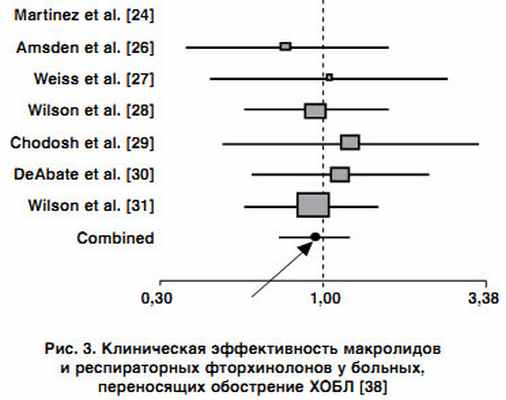 |
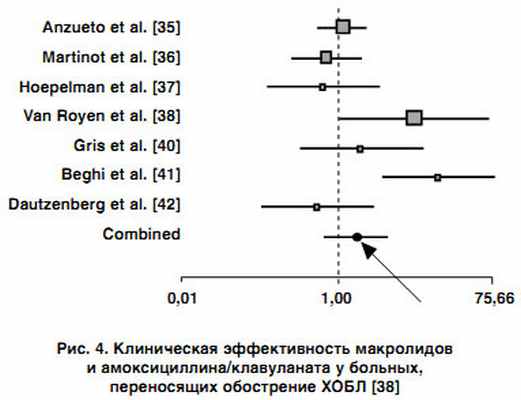 |
В этой связи логичным представляется положение кларитромицина (наряду с азитромицином и амоксициллином) в качестве препарата выбора для лечения пациентов, переносящих простое (неосложненное) обострение ХОБЛ (табл. 5).
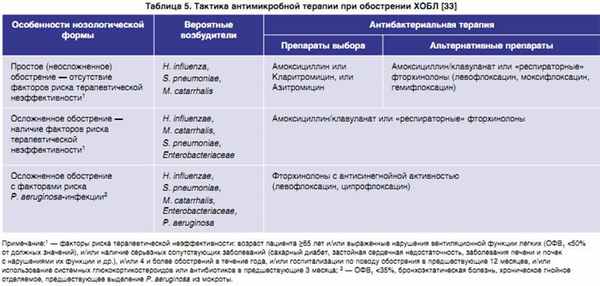 |
Заключение
Неблагоприятные события у людей, принимающих антибиотики-макролиды
Мы хотели выяснить, испытывают ли люди, принимающие антибиотики-макролиды, больше неблагоприятных событий чем те, кто принимают плацебо.
Актуальность
Антибиотики-макролиды являются группой антибиотиков, которые обычно используются для лечения острых и хронических инфекций. Четырьмя наиболее часто используемыми макролидами являются: азитромицин, кларитромицин, эритромицин и рокситромицин. Люди, принимающие антибиотики-макролиды имеют риск проявления неблагоприятных событий, таких как тошнота, диарея и сыпь.
Дата Поиска
Мы провели поиск литературы по май 2018 года.
Характеристика исследований
Мы включили 183 исследования с 252,886 участниками. Большинство исследований были проведены в больничных условиях. Азитромицин и эритромицин были изучены в большей степени, чем кларитромицин и рокситромицин. В большей части исследований (89%) сообщили о некоторых неблагоприятных событиях, или по меньшей мере утверждали, что неблагоприятных событий не наблюдалось.
Источники финансирования исследований
Фармацевтические компании поставляли исследуемые лекарства или финансировали исследование, или и то, и другое в 91 исследовании. Источники финансирования были неясны в 59 исследованиях.
Основные результаты
Люди, лечившиеся антибиотиками-макролидами, испытывали желудочно-кишечные неблагоприятные события такие как тошнота, рвота, боли в животе и диарею, чаще, чем те, кто лечился плацебо.
Нарушение вкуса отмечалось чаще людьми, получавшими макролиды, чем принимавшими плацебо. Однако, поскольку лишь некоторые исследования отмечали наличие этих неблагоприятных событий, эти результаты следует интерпретировать с осторожностью.
О потере слуха сообщалось чаще людьми, принимавшими антибиотики-макролиды, однако лишь четыре исследования сообщали об этом исходе.
Макролиды вызывали меньше кашля и реже инфекции дыхательных путей, чем плацебо.
Мы не нашли доказательств того, что макролиды вызывают больше сердечных нарушений, печеночных проблем, инфекций крови, инфекций кожи и мягких тканей, изменений печеночных ферментов, потерю аппетита, головокружений, головной боли, дыхательных симптомом, зуда или сыпи, чем плацебо.
Мы не обнаружили большее число смертей у людей, леченных макролидами, чем леченных плацебо.
Очень ограниченна была информация о том, имеют ли люди, леченные макролидами, больший риск развития устойчивых бактерий, чем те, которые лечились плацебо. Однако, бактерии, устойчивые к антибиотикам-макролидам чаще выявлялись сразу после начала лечения у людей, принимавших макролиды, чем у тех, кто принимал плацебо, но разница в устойчивости после лечения была противоречивой.
Качество доказательств
Качество доказательств было от очень низкого (сердечные расстройства, изменение печеночных ферментов, печеночные проблемы) до низкого (боли в животе, смерть, диарея, головокружение, потеря слуха, инфекции кожи и мягких тканей, расстройства вкуса, хрипы), до среднего (потеря аппетита, инфекции крови, кашель, лихорадка, головная боль, зуд, тошнота, сыпь, дыхательные симптомы, инфекции дыхательной системы, рвота).
Макролиды
Макролиды (см. таблицу Макролиды [Macrolides] Макролиды ) являются прежде всего бактериостатическими антибиотиками Обзор антибактериальных препаратов (Overview of Antibacterial Drugs) Антибактериальные препараты получают из бактерий или плесневых грибов или синтезируют de novo. Технически слово «антибиотик» относится только к антибактериальным препаратам, полученным из бактерий. Прочитайте дополнительные сведения ; они подавляют бактериальный синтез белка, связываясь с субъединицей рибосомы 50S.
Фармакокинетика
Макролиды относительно слабо усваиваются в пероральной форме. Фидаксомицин всасывается минимально и активен только локально в желудочно-кишечном тракте. Пища оказывает следующее воздействие на всасываемость макролидов:
На кларитромицин замедленного высвобождения - увеличивает всасывание
На кларитромицин быстрого высвобождения в форме таблеток или суспензии – никакого эффекта
На азитромицин в форме капсул и эритромицин (основание и стеарат) – уменьшает всасывание
Для фидаксомицина - эффекты минимальны
После всасывания, макролиды хорошо проникают в жидкости тела, кроме спинномозговой жидкости, и концентрируются в фагоцитах. Выведение происходит главным образом с желчью.
Показания к применению макролидов
Макролиды активны против следующего:
Аэробные и анаэробные грамположительные кокки, за исключением большинства энтерококков, многие штаммы Staphylococcus aureus Стафилококковые инфекции Стафилококки – грамположительные аэробные микроорганизмы. Staphylococcus aureus наиболее патогенный; как правило, он вызывает инфекции кожи, может вызывать пневмонию, эндокардит и остеомиелит. Прочитайте дополнительные сведения и S. pyogenes
Chlamydophila pneumoniae
Propionibacterium acnes
Макролиды считаются препаратами выбора при стрептококковых Стрептококковые инфекции Стрептококки – грамположительные аэробные организмы, вызывающие множество заболеваний, включая фарингит, пневмонию, инфекции ран и кожи, сепсис и эндокардит. Симптомы изменяются в зависимости. Прочитайте дополнительные сведения Streptococcus pneumoniae (пневмококки) представляют собой грамположительные альфа-гемолитические аэробные диплококки, формирующие капсулу. В США пневмококковая инфекция является основной. Прочитайте дополнительные сведения группы А, когда пенициллин использовать нельзя. Однако пневмококки со сниженной чувствительностью к пенициллину часто резистентны к макролидам, а в некоторых сообществах до 20% S. pyogenes являются макролид-резистентными. Поскольку они активны против нетипичных респираторных болезнетворных микроорганизмов, они часто используются эмпирически при респираторных инфекциях нижнего отдела дыхательного тракта, но часто требуется другой препарат, чтобы охватить пневмококки, резистентные к макролидам. У макролидов имеется другое клиническое применение (см. таблицу Некоторые аспекты клинического применения макролидов [Some Clinical Uses of Macrolides] Некоторые аспекты клинического применения макролидов ). Макролиды не используются для лечения менингита.
Противопоказания к назначению макролидов
Maкролиды противопоказаны пациентам с наличием в анамнезе аллергической реакции на эти препараты.
Одновременное применение макролидов с астемизолом, цизапридом, пимозидом или терфенадином противопоказано, поскольку могут возникнуть потенциально смертельные сердечные аритмии (например, пролонгация интервала QT, желудочковая тахикардия, фибрилляция желудочков, двунаправленная тахикардия) при одновременном приеме кларитромицина или эритромицина с этими препаратами. Этот эффект происходит, скорее всего, из-за ингибирования эритромицином и кларитромицином метаболизма этих препаратов.
Назначение во время беременности и кормления грудью
Исследования влияния эритромицина или азитромицина на репродуктивную функцию животных не показали риска для плода. После приема эритромицина на ранних сроках беременности наблюдается более высокая вероятность появления сердечно-сосудистых аномалий, чем после приема пенициллина, однако в рамках других исследований этот риск не был выявлен. Эритромицин считают более безопасным, чем азитромицин, потому что его клиническое использование намного более обширное.
Исследования кларитромицина на животных в репродуктивном периоде показывают некоторые риски. Кларитромицин не следует принимать беременным женщинам, за исключением случаев, когда нет альтернативной терапии.
Считают, что эритромицин совместим с кормлением грудью. Безопасность других макролидов во время кормления грудью неизвестна.
Побочные эффекты макролидов
Главные проблемы, связанные с применением макролидов, включают:
Нарушения со стороны желудочно-кишечного тракта (ЖКТ) (главным образом при назначении эритромицина)
Продление интервала QT при назначении эритромицина
Подавление печеночного метаболизма, что приводит к многочисленным лекарственным взаимодействиям
Эритромицин обычно вызывает зависимые от дозировки нарушения желудочно-кишечного тракта, включая тошноту, рвоту, брюшные колики и диарею; нарушения проявляются реже при приеме кларитромицина и азитромицина. Прием препарата во время еды может помочь уменьшить нарушения желудочно-кишечного тракта. Эритромицин может вызывать зависящий от дозировки звон в ушах, головокружение и обратимую потерю слуха. Холестатическая желтуха обычно встречается при назначении эритромицина эстолат. Желтуха обычно появляется после 10 дней использования, прежде всего у взрослых, но может проявиться раньше, если препарат назначали ранее. Эритромицин не назначается внутримышечно, потому что это причиняет сильную боль; при внутривенном назначении могут быть флебит или боль. Аллергические реакции встречаются редко.
Эритромицин вызывает продление интервала QT и предрасполагает к желудочковой тахиаритмии, особенно у женщин, у тех пациентов, у которых есть продление интервала QT или отклонения электролита, и у тех пациентов, которые принимают другой препарат, который может продлить QT-интервал.
Рекомендации по дозировке макролидов
Для азитромицина не требуется никакой коррекции дозирования при почечной недостаточности.
Эритромицин и до некоторой степени кларитромицин взаимодействуют с многочисленными препаратами, потому что они подавляют печеночный метаболизм через систему цитохрома P-450 (CYP450). Маловероятно, что азитромицин взаимодействует с другими препаратами.
Взаимодействия могут встречаться, когда эритромицин или кларитромицин назначают со следующими препаратами:
Варфарин: дальнейшее повышение протромбинового времени/международного нормализованного соотношения (ПВ/МНО)
Ловастатин и симвастатин: острый некроз скелетных мышц
Mидазолам и триазолам: сонливость
Теофиллин: тошнота, рвота и приступы судорог
Taкролимус, циклоспорин и алкалоиды спорыньи: повышенные уровни этих препаратов в сыворотке
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Какая опасность кроется за использованием макролидов во время беременности?
Английские ученые оценили связь между использованием антибиотиков макролидов во время беременности и частотой крупных врожденных пороков, церебральным параличом, эпилепсией, синдромом дефицита внимания и гиперактивности и расстройствами аутистического спектра.
Методы
Популяционное когортное исследование, основанное на данных национальной базы данных Великобритании, включило 104 605 детей, рожденных с 1990 по 2016 год. Матери этих детей во время беременности получали монотерапию макролидом (эритромицин, кларитромицин или азитромицин) или монотерапию антибиотиком пенициллинового ряда. Терапия назначалась с 4 гестационной недели до родов.
Контрольную группу составили 2 когорты детей, матери которых такую терапию получали до беременности (82 314 детей), вторая когорта – братья или сестры детей, включенных в основную когорту (53 735 детей).
Результаты
- Крупные врожденные пороки были выявлены у 186 из 8632 детей (21,55 на 1000 человек), которые имели воздействия макролидов во время внутриутробного развития и 1666 из 95 973 детей (17,36 на 1000 человек), матери которых получали пенициллин во время беременности.
- Использование макролидов в первом триместре было ассоциировано с повышением риска любых крупных мальформаций, по сравнению с использованием пенициллина (27,65 по сравнению с 17,65 на 1000 человек, относительный риск (ОР), 1,55, 95% доверительный интервал (ДИ) 1,19-2,03) и, в частности, сердечных врожденных пороков (10,60 по сравнению с 6,61 на 1000 человек, ОР, 1,62, 95% ДИ 1,05-2,51).
- Отмечено, что использование макролидов в любом триместре повышало риск генитальных пороков развития (4,75 по сравнению с 3,07 на 1000 человек, ОР, 1,58, 95% ДИ 1,14-2,19, по большей части речь шла о гипоспадии).
- Эритромицин в первом триместре был ассоциирован с повышением риска любых крупных пороков развития (27,39 по сравнению с 17,65 на 1000 человек, ОР, 1,50, 95% ДИ 1,13-1,99).
- Не выявлено достоверной связи между мальформациями других систем или нейродегенеративными заболеваниями.
Источник: Heng Fan, Ruth Gilbert, Finbar O’Callaghan, et al. BMJ 2020; 368:m331.
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Макролиды и азалиды
Макролиды оказывают бактериостатическое действие и преимущественно активны в отношении внутриклеточных возбудителей (хламидии, микоплазмы, легионеллы) и грамположительных кокков (кроме MRSA и энтерококков). В последние годы резко снизилась активность в отношении пневмококков и стрептококков, что необходимо учитывать при выборе ЛС для респираторных инфекций. Грамотрицательные микроорганизмы семейства Enterobacteriaceae, Р. aeruginosa и грамотрицательные анаэробы к макролидам природно резистентны. Из других грамотрицательных бактерий определенную чувствительность к макролидам проявляют моракселлы, бордетеллы, нейссерии, кампилобактеры и хеликобактеры. Практически важное значение имеет активность некоторых макролидов в отношении атипичных микобактерий и простейших (токсоплазм). Среди макролидов умеренной активностью против Н. influenzae in vitro обладают только азитромицин и кларитромицин.
Макролиды удовлетворительно всасываются при пероральном приеме (пища снижает биодоступность) и распределяются во многих тканях и секретах (плохо проникают через ГЭБ). Создают высокие тканевые и внутриклеточные концентрации. Метаболизируются в печени, выводятся в основном через ЖКТ. При почечной недостаточности коррекцию доз не проводят (исключение — кларитромицин).
Наиболее частые нежелательные реакции — диспептические явления. Аллергические реакции наблюдаются редко. При в/в введении может развиваться флебит. Эритромицин у новорожденных может способствовать развитию пилоростеноза.
Большинство ЛС (особенно эритромицин и кларитромицин) является сильными ингибиторами изоферментов цитохрома Р450, поэтому на фоне их применения ослабляется в/м биотрансформация и повышается концентрация в плазме (сыворотке) крови ЛС, метаболизирующихся в печени (в т.ч. теофиллин, варфарин, циклоспорин). Также возможно удлинение интервала QT. Макролиды применяют при инфекциях верхних и нижних дыхательных путей (преимущественно вызванных «атипичными» возбудителями), урогенитальных инфекциях, вызванных хламидиями и микоплазмами, при инфекциях кожи и мягких тканей. Эритромицин — препарат выбора при легионеллезе, для профилактики острой ревматической лихорадки (при аллергии к пенициллину) и для деконтаминации кишечника перед колоректальными операциями. Кларитромицин используют для лечения и профилактики оппортунистических инфекций при СПИДе, вызванных некоторыми атипичными микобактериями, а также для эрадикации Н. pylori при язвенной болезни желудка и двенадцатиперстной кишки. Спирамицин применяют для лечения токсоплазмоза, в т.ч. у беременных.
Преимущества спирамицина, кларитромицина, азитромицина, рокситромицина, мидекамицина и джозамицина перед эритромицином: улучшенная фармакокинетика, переносимость и меньшая кратность применения. 16-членные макролиды (спирамицин, джозамицин и мидекамицин) в меньшей степени ингибируют изоферменты цитохрома Р450, не обладают прокинетическими свойствами и активны в отношении некоторых штаммов стрептококков и пневмококков, устойчивых к 14- и 15-членным макролидам.
Читайте также:
