Макролиды
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
«Возрождение» макролидов произошло в середине 1970 — начале 1980 гг. в связи с синтезированием новых препаратов этой группы. Расширение спектра антибактериального действия и хорошая переносимость макролидов нового поколения определили их место в современной терапии бактериальных инфекций.
Макролиды проявляют активность в отношении грамположительных и грамотрицательных кокков, Parvobacteriaceae (Bordetella pertussis), видов Legionella, Chlamydia, Mycoplasma, Ureaplasma urealyticum, Listeria monocytogenes.
Кроме перечисленных выше микроорганизмов макролид нового поколения АЗИНОМ (азитромицин) действует также против таких бактерий, как Mycobacterium avium, Helicobacter pуlori, Borrelia burgdorferi, Toxoplasma gondii [5].
В последние годы значительно возросла роль так называемых атипичных возбудителей. В частности, этиологическим фактором пневмонии могут быть микоплазмы (в 29,3% случаев), хламидии (11,0%), легионеллы (3,7%) [1–3].
Атипичные микроорганизмы развиваются внутри клеток, что существенно ограничивает действие ряда антибактериальных препаратов в отношении данных возбудителей. Макролиды способны накапливаться в высоких концентрациях в макрофагах, нейтрофильных гранулоцитах и других клетках и воздействовать на внутриклеточные микроорганизмы [2, 3].
Противомикробный эффект макролидов обусловлен нарушением синтеза белка рибосомами микробной клетки. Как правило, макролиды проявляют бактериостатический эффект, но в высоких концентрациях способны действовать бактерицидно на b -гемолитический стрептококк группы А, пневмококк, возбудителей коклюша и дифтерии. Макролиды проявляют постантибиотический эффект в отношении грамположительных кокков. Кроме антибактериального действия, макролиды обладают умеренной иммуномодулирующей и противовоспалительной активностью.
Класс макролидов насчитывает более 10 различных антибиотиков. Эти противомикробные средства содержат в своей молекуле полиоксилактонное кольцо (агликон), ассоциированное с различными сахарами (гликон). В зависимости от числа атомов углерода в лактонном кольце макролиды подразделяются на 3 группы: 14,15 и 16-членные соединения [1, 2, 4].
1) 14-членные антибиотики подразделяют на природные (эритромицин и олеандомицин), полусинтетические (рокситромицин, кларитромицин и т.д.).
2) 16-членные — включают природные (спирамицин, джозамицин, китазамицин, лейкомицин) и полусинтетические (ракитомицин и миокамицин).
3) 15-членные антибиотики выделены в подгруппу азалидов, поскольку в их лактонное кольцо включен атом азота. Первым и пока единственным представителем данной группы является азитромицин.
Азитромицин был получен путем включения атома азота в 14-членное лактонное кольцо между 9-м и 10-м атомами углерода, в результате чего было сформировано 15-атомное нелактонное кольцо. Благодаря подобной структурной перестройке азитромицин по сравнению с эритромицином обладает большей кислотоустойчивостью, следовательно, и большей стабильностью в кислой среде желудка, что повышает его абсорбцию и биодоступность. По биологическому происхождению азитромицин относится к группе антибиотиков, получаемых из актиномицетов, и является антибиотиком широкого спектра действия.
К преимуществам АЗИНОМА относят его способность создавать высокие концентрации в тканях, значительно превышающие минимальную ингибирующую концентрацию (МИК). Высокие концентрации АЗИНОМА в тканях сохраняются в течение 5–7 дней после приема последней дозы, этим объясняется его длительное противомикробное действие при малой продолжительности курса лечения.
АЗИНОМ при назначении в терапевтических дозах оказывает бактерицидное действие.
По спектру антибактериального действия АЗИНОМ сходен с эритромицином, однако он более активен в отношении следующих грамположительных и грамотрицательных штаммов микроорганизмов: Haemophilus influenzae (включая ампициллинорезистентные штаммы), H. parainfluenzae, Moraxella catarrhalis, Neisseria gonorrhoeae, Borrelia burgdorferi, Chlamydia trachomatis [7, 8], Toxoplasma gondii, Pneumocytis catarrhalis, Listeria spp., Streptococcus pyogenes, Streptococcus agalactiae, эритромицин- и пенициллинорезистентных штаммов Streptococcus pneumoniae и метициллинорезистентных штаммов S. aureus.
По влиянию на некоторые грамотрицательные бактерии АЗИНОМ превосходит другие макролидные антибиотики. Энтеробактерии менее чувствительны к АЗИНОМУ. Активность АЗИНОМА в отношении токсоплазмы несколько выше, чем эритромицина.
Антибиотик не подвергается разрушающему действию соляной кислоты в желудке. При приеме внутрь натощак биодоступность составляет 37%. Прием пищи уменьшает объем и скорость всасывания приблизительно в 2 раза. Максимальная концентрация в сыворотке крови составляет 0,4 мг/л и достигается через 2–3 ч. Степень связывания с белками плазмы крови — от 7 до 50%. Период полувыведения — около 68 ч. Не создавая высоких концентраций в крови, АЗИНОМ благодаря высокой липофильности хорошо распределяется в организме, проникая во многие органы, ткани и биологические жидкости организма.
Наиболее высокие концентрации АЗИНОМА достигаются в тканях миндалин, легочной ткани, половых органах. После однократного приема антибиотика в дозе 500 мг в этих органах и тканях создаются концентрации, значительно превышающие МИК для чувствительных микроорганизмов, которые сохраняются на протяжении нескольких дней.
После однократного приема в дозе 500 мг АЗИНОМ в очень высоких концентрациях накапливается в мокроте, слизистой оболочке бронхов и особенно в альвеолярных макрофагах. Высокие концентрации сохраняются даже через 96 ч.
АЗИНОМ плохо проникает через гематоэнцефалический барьер.
В тканях АЗИНОМ накапливается преимущественно внутриклеточно, в особенно больших количествах — в лизосомах альвеолярных макрофагов, нейтрофильных гранулоцитов, моноцитов и фибробластов, которые являются наиболее объемным и стабильным депо препарата.
Антибиотик активно захватывается фагоцитами из крови, интерстициальной жидкости и фибробластов, а затем транспортируется в очаг инфекционного воспаления, где в присутствии бактерий медленно высвобождается из фагоцитов. Внутри клеток АЗИНОМ накапливается в фосфолипидном слое лизосом.
В ткани печени антибиотик накапливается в концентрациях, в 20 раз превышающих таковые в сыворотке крови. Еще более высокие концентрации препарата, почти в 100 раз превышающие концентрацию в сыворотке крови, отмечаются в желчи.
С желчью АЗИНОМ экскретируется в кишечник и затем выводится с калом. Только около 6% принятого внутрь антибиотика экскретируется с мочой в течение 1 нед.
Побочные эффекты при применении АЗИНОМА развиваются редко. Они проявляются умеренно выраженными реакциями со стороны пищеварительного тракта. Среди возможных побочных эффектов следует отметить диарею, которая возникает у взрослых в 4,8 % случаев, а у детей — в 2,6% случаев, тошноту и рвоту, которые наблюдают соответственно в 4,2 и 1,3% случаев.
Исключительно редко могут отмечаться головная боль, аллергические реакции, изменение активности печеночных ферментов. При этом суммарная частота всех побочных эффектов иногда достигает у взрослых 15,3%, у детей — около 8%.
Широкий спектр антимикробного действия АЗИНОМА позволяет использовать его в терапии различных инфекций, в том числе мочевых путей и половых органов.
АЗИНОМ при однократном приеме в дозе 1 г эффективен при острой хламидийной инфекции.
Вследствие частого сочетания гонококковой инфекции с хламидийной (острый уретрит и цервицит) АЗИНОМ в этой ситуации является препаратом выбора.
Высокая эффективность препарата установлена при лечении больных с хроническим простатитом, эпидидимоорхитом, циститом и уретритом микробной этиологии. В терапии неосложненных острых урогенитальных инфекций, в том числе гонококковой этиологии, обычно достаточно однократного применения АЗИНОМА в дозе 500 мг. При инфекциях верхних и нижних дыхательных путей препарат обычно назначают по 0,25 г 1 раз в сутки в течение 5 дней.
АЗИНОМ применяют при лечении больных с отитом, тонзиллитом, фарингитом, бронхитом и пневмонией, особенно атипичной.
АЗИНОМ является препаратом выбора для лечения инфекций нижних дыхательных путей, особенно внебольничной пневмонии, поскольку соответствует всем требованиям, предъявляемым к средствам для начальной эмпирической антибиотикотерапии:
• высокая активность в отношении основных возбудителей заболевания (пневмококк — 42% случаев, гемофильная палочка — 4% случаев, микоплазмы — 22%, легионеллы — 6%, хламидии — 1%, золотистый стафилококк — 1% и грамотрицательные бактерии — 1% случаев);
• создание высоких концентраций в тканях респираторной системы и бронхиальном секрете;
• низкая частота развития побочных эффектов;
• удобство применения (1 раз в сутки).
АЗИНОМ назначают также при инфекции кожи и мягких тканей (инфицированные раны, рожа, флегмона, абсцесс, инфицированные дерматозы, импетиго, мигрирующая эритема (болезнь Лайма)), острых кишечных инфекциях (шигеллез, эшерихиоз, сальмонеллез, псевдотуберкулез, иерсиниоз), а также заболеваниях желудка и двенадцатиперстной кишки, ассоциированных с Helicobacter pylori.
АЗИНОМ принимают внутрь 1 раз в сутки за 1 ч до еды или через 2 ч после еды. Взрослым обычно назначают 0,5 г/сут в течение 3 дней или в 1-й день 0,5 г, во 2–5-й дни — по 0,25 г в 1 прием. При тяжелых инфекциях назначают в начальной дозе 1 г, в последующие 3–5 дней — по 0,5 г/сут, максимальная продолжительность курса лечения — 7 дней.
Детям в возрасте старше 1 года обычно назначают из расчета 10 мг на 1 кг массы тела в сутки в течение 3 дней, или в 1-й день лечения 10 мг на 1 кг массы тела, а в последующие 4 дня — 5 мг на 1 кг массы тела [6].
АЗИНОМ противопоказан при повышенной чувствительности к макролидам. С особой осторожностью следует назначать препарат больным с выраженными нарушениями функции печени и почек. При необходимости назначения АЗИНОМА в период беременности и кормления грудью следует сопоставить степень потенциального риска для плода или ребенка и пользу от применения препарата для матери.
И.Н. Танасова, канд. мед. наук
1. Белоусов Ю.Б., Омельяновский В.В. Клиническая фармакология болезней органов дыхания. — М.: Универсум Паблишинг, 1996. — C. 59–65.
2. Белоусoв Ю.Б., Смирнова Е.Ю. // Клин. фармакол. и терапия. — 1996. — № 2 (5). — C. 21–24.
4. Страчунский Л.С., Козлов С.Н. Антибиотики: клиническая фармакология. — Смоленск: Амипресс, 1994.
5. Страчунский Л.С., Козлов С.Н. // Рус. мед. журнал. — 1997. — Т. 5, № 21. — C. 1392–1404.
6. Klein J.O. // Pediatr. Infect. Dis. J. — 1997, Apr. — V. 16, № 4. — P. 427–434.
Неблагоприятные события у людей, принимающих антибиотики-макролиды
Мы хотели выяснить, испытывают ли люди, принимающие антибиотики-макролиды, больше неблагоприятных событий чем те, кто принимают плацебо.
Актуальность
Антибиотики-макролиды являются группой антибиотиков, которые обычно используются для лечения острых и хронических инфекций. Четырьмя наиболее часто используемыми макролидами являются: азитромицин, кларитромицин, эритромицин и рокситромицин. Люди, принимающие антибиотики-макролиды имеют риск проявления неблагоприятных событий, таких как тошнота, диарея и сыпь.
Дата Поиска
Мы провели поиск литературы по май 2018 года.
Характеристика исследований
Мы включили 183 исследования с 252,886 участниками. Большинство исследований были проведены в больничных условиях. Азитромицин и эритромицин были изучены в большей степени, чем кларитромицин и рокситромицин. В большей части исследований (89%) сообщили о некоторых неблагоприятных событиях, или по меньшей мере утверждали, что неблагоприятных событий не наблюдалось.
Источники финансирования исследований
Фармацевтические компании поставляли исследуемые лекарства или финансировали исследование, или и то, и другое в 91 исследовании. Источники финансирования были неясны в 59 исследованиях.
Основные результаты
Люди, лечившиеся антибиотиками-макролидами, испытывали желудочно-кишечные неблагоприятные события такие как тошнота, рвота, боли в животе и диарею, чаще, чем те, кто лечился плацебо.
Нарушение вкуса отмечалось чаще людьми, получавшими макролиды, чем принимавшими плацебо. Однако, поскольку лишь некоторые исследования отмечали наличие этих неблагоприятных событий, эти результаты следует интерпретировать с осторожностью.
О потере слуха сообщалось чаще людьми, принимавшими антибиотики-макролиды, однако лишь четыре исследования сообщали об этом исходе.
Макролиды вызывали меньше кашля и реже инфекции дыхательных путей, чем плацебо.
Мы не нашли доказательств того, что макролиды вызывают больше сердечных нарушений, печеночных проблем, инфекций крови, инфекций кожи и мягких тканей, изменений печеночных ферментов, потерю аппетита, головокружений, головной боли, дыхательных симптомом, зуда или сыпи, чем плацебо.
Мы не обнаружили большее число смертей у людей, леченных макролидами, чем леченных плацебо.
Очень ограниченна была информация о том, имеют ли люди, леченные макролидами, больший риск развития устойчивых бактерий, чем те, которые лечились плацебо. Однако, бактерии, устойчивые к антибиотикам-макролидам чаще выявлялись сразу после начала лечения у людей, принимавших макролиды, чем у тех, кто принимал плацебо, но разница в устойчивости после лечения была противоречивой.
Качество доказательств
Качество доказательств было от очень низкого (сердечные расстройства, изменение печеночных ферментов, печеночные проблемы) до низкого (боли в животе, смерть, диарея, головокружение, потеря слуха, инфекции кожи и мягких тканей, расстройства вкуса, хрипы), до среднего (потеря аппетита, инфекции крови, кашель, лихорадка, головная боль, зуд, тошнота, сыпь, дыхательные симптомы, инфекции дыхательной системы, рвота).
Макролиды и азалиды
Макролиды оказывают бактериостатическое действие и преимущественно активны в отношении внутриклеточных возбудителей (хламидии, микоплазмы, легионеллы) и грамположительных кокков (кроме MRSA и энтерококков). В последние годы резко снизилась активность в отношении пневмококков и стрептококков, что необходимо учитывать при выборе ЛС для респираторных инфекций. Грамотрицательные микроорганизмы семейства Enterobacteriaceae, Р. aeruginosa и грамотрицательные анаэробы к макролидам природно резистентны. Из других грамотрицательных бактерий определенную чувствительность к макролидам проявляют моракселлы, бордетеллы, нейссерии, кампилобактеры и хеликобактеры. Практически важное значение имеет активность некоторых макролидов в отношении атипичных микобактерий и простейших (токсоплазм). Среди макролидов умеренной активностью против Н. influenzae in vitro обладают только азитромицин и кларитромицин.
Макролиды удовлетворительно всасываются при пероральном приеме (пища снижает биодоступность) и распределяются во многих тканях и секретах (плохо проникают через ГЭБ). Создают высокие тканевые и внутриклеточные концентрации. Метаболизируются в печени, выводятся в основном через ЖКТ. При почечной недостаточности коррекцию доз не проводят (исключение — кларитромицин).
Наиболее частые нежелательные реакции — диспептические явления. Аллергические реакции наблюдаются редко. При в/в введении может развиваться флебит. Эритромицин у новорожденных может способствовать развитию пилоростеноза.
Большинство ЛС (особенно эритромицин и кларитромицин) является сильными ингибиторами изоферментов цитохрома Р450, поэтому на фоне их применения ослабляется в/м биотрансформация и повышается концентрация в плазме (сыворотке) крови ЛС, метаболизирующихся в печени (в т.ч. теофиллин, варфарин, циклоспорин). Также возможно удлинение интервала QT. Макролиды применяют при инфекциях верхних и нижних дыхательных путей (преимущественно вызванных «атипичными» возбудителями), урогенитальных инфекциях, вызванных хламидиями и микоплазмами, при инфекциях кожи и мягких тканей. Эритромицин — препарат выбора при легионеллезе, для профилактики острой ревматической лихорадки (при аллергии к пенициллину) и для деконтаминации кишечника перед колоректальными операциями. Кларитромицин используют для лечения и профилактики оппортунистических инфекций при СПИДе, вызванных некоторыми атипичными микобактериями, а также для эрадикации Н. pylori при язвенной болезни желудка и двенадцатиперстной кишки. Спирамицин применяют для лечения токсоплазмоза, в т.ч. у беременных.
Преимущества спирамицина, кларитромицина, азитромицина, рокситромицина, мидекамицина и джозамицина перед эритромицином: улучшенная фармакокинетика, переносимость и меньшая кратность применения. 16-членные макролиды (спирамицин, джозамицин и мидекамицин) в меньшей степени ингибируют изоферменты цитохрома Р450, не обладают прокинетическими свойствами и активны в отношении некоторых штаммов стрептококков и пневмококков, устойчивых к 14- и 15-членным макролидам.
Макролиды
Макролиды (см. таблицу Макролиды [Macrolides] Макролиды ) являются прежде всего бактериостатическими антибиотиками Обзор антибактериальных препаратов (Overview of Antibacterial Drugs) Антибактериальные препараты получают из бактерий или плесневых грибов или синтезируют de novo. Технически слово «антибиотик» относится только к антибактериальным препаратам, полученным из бактерий. Прочитайте дополнительные сведения ; они подавляют бактериальный синтез белка, связываясь с субъединицей рибосомы 50S.
Фармакокинетика
Макролиды относительно слабо усваиваются в пероральной форме. Фидаксомицин всасывается минимально и активен только локально в желудочно-кишечном тракте. Пища оказывает следующее воздействие на всасываемость макролидов:
На кларитромицин замедленного высвобождения - увеличивает всасывание
На кларитромицин быстрого высвобождения в форме таблеток или суспензии – никакого эффекта
На азитромицин в форме капсул и эритромицин (основание и стеарат) – уменьшает всасывание
Для фидаксомицина - эффекты минимальны
После всасывания, макролиды хорошо проникают в жидкости тела, кроме спинномозговой жидкости, и концентрируются в фагоцитах. Выведение происходит главным образом с желчью.
Показания к применению макролидов
Макролиды активны против следующего:
Аэробные и анаэробные грамположительные кокки, за исключением большинства энтерококков, многие штаммы Staphylococcus aureus Стафилококковые инфекции Стафилококки – грамположительные аэробные микроорганизмы. Staphylococcus aureus наиболее патогенный; как правило, он вызывает инфекции кожи, может вызывать пневмонию, эндокардит и остеомиелит. Прочитайте дополнительные сведения и S. pyogenes
Chlamydophila pneumoniae
Propionibacterium acnes
Макролиды считаются препаратами выбора при стрептококковых Стрептококковые инфекции Стрептококки – грамположительные аэробные организмы, вызывающие множество заболеваний, включая фарингит, пневмонию, инфекции ран и кожи, сепсис и эндокардит. Симптомы изменяются в зависимости. Прочитайте дополнительные сведения Streptococcus pneumoniae (пневмококки) представляют собой грамположительные альфа-гемолитические аэробные диплококки, формирующие капсулу. В США пневмококковая инфекция является основной. Прочитайте дополнительные сведения группы А, когда пенициллин использовать нельзя. Однако пневмококки со сниженной чувствительностью к пенициллину часто резистентны к макролидам, а в некоторых сообществах до 20% S. pyogenes являются макролид-резистентными. Поскольку они активны против нетипичных респираторных болезнетворных микроорганизмов, они часто используются эмпирически при респираторных инфекциях нижнего отдела дыхательного тракта, но часто требуется другой препарат, чтобы охватить пневмококки, резистентные к макролидам. У макролидов имеется другое клиническое применение (см. таблицу Некоторые аспекты клинического применения макролидов [Some Clinical Uses of Macrolides] Некоторые аспекты клинического применения макролидов ). Макролиды не используются для лечения менингита.
Противопоказания к назначению макролидов
Maкролиды противопоказаны пациентам с наличием в анамнезе аллергической реакции на эти препараты.
Одновременное применение макролидов с астемизолом, цизапридом, пимозидом или терфенадином противопоказано, поскольку могут возникнуть потенциально смертельные сердечные аритмии (например, пролонгация интервала QT, желудочковая тахикардия, фибрилляция желудочков, двунаправленная тахикардия) при одновременном приеме кларитромицина или эритромицина с этими препаратами. Этот эффект происходит, скорее всего, из-за ингибирования эритромицином и кларитромицином метаболизма этих препаратов.
Назначение во время беременности и кормления грудью
Исследования влияния эритромицина или азитромицина на репродуктивную функцию животных не показали риска для плода. После приема эритромицина на ранних сроках беременности наблюдается более высокая вероятность появления сердечно-сосудистых аномалий, чем после приема пенициллина, однако в рамках других исследований этот риск не был выявлен. Эритромицин считают более безопасным, чем азитромицин, потому что его клиническое использование намного более обширное.
Исследования кларитромицина на животных в репродуктивном периоде показывают некоторые риски. Кларитромицин не следует принимать беременным женщинам, за исключением случаев, когда нет альтернативной терапии.
Считают, что эритромицин совместим с кормлением грудью. Безопасность других макролидов во время кормления грудью неизвестна.
Побочные эффекты макролидов
Главные проблемы, связанные с применением макролидов, включают:
Нарушения со стороны желудочно-кишечного тракта (ЖКТ) (главным образом при назначении эритромицина)
Продление интервала QT при назначении эритромицина
Подавление печеночного метаболизма, что приводит к многочисленным лекарственным взаимодействиям
Эритромицин обычно вызывает зависимые от дозировки нарушения желудочно-кишечного тракта, включая тошноту, рвоту, брюшные колики и диарею; нарушения проявляются реже при приеме кларитромицина и азитромицина. Прием препарата во время еды может помочь уменьшить нарушения желудочно-кишечного тракта. Эритромицин может вызывать зависящий от дозировки звон в ушах, головокружение и обратимую потерю слуха. Холестатическая желтуха обычно встречается при назначении эритромицина эстолат. Желтуха обычно появляется после 10 дней использования, прежде всего у взрослых, но может проявиться раньше, если препарат назначали ранее. Эритромицин не назначается внутримышечно, потому что это причиняет сильную боль; при внутривенном назначении могут быть флебит или боль. Аллергические реакции встречаются редко.
Эритромицин вызывает продление интервала QT и предрасполагает к желудочковой тахиаритмии, особенно у женщин, у тех пациентов, у которых есть продление интервала QT или отклонения электролита, и у тех пациентов, которые принимают другой препарат, который может продлить QT-интервал.
Рекомендации по дозировке макролидов
Для азитромицина не требуется никакой коррекции дозирования при почечной недостаточности.
Эритромицин и до некоторой степени кларитромицин взаимодействуют с многочисленными препаратами, потому что они подавляют печеночный метаболизм через систему цитохрома P-450 (CYP450). Маловероятно, что азитромицин взаимодействует с другими препаратами.
Взаимодействия могут встречаться, когда эритромицин или кларитромицин назначают со следующими препаратами:
Варфарин: дальнейшее повышение протромбинового времени/международного нормализованного соотношения (ПВ/МНО)
Ловастатин и симвастатин: острый некроз скелетных мышц
Mидазолам и триазолам: сонливость
Теофиллин: тошнота, рвота и приступы судорог
Taкролимус, циклоспорин и алкалоиды спорыньи: повышенные уровни этих препаратов в сыворотке
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Макролиды и их значение в лечении внебольничных пневмоний различной этиологии
Успех антибиотикотерапии зависит от правильно выбранного антибиотика, своевременности его назначения, состояния макроорганизма (пациент) и микроорганизма (резистентность бактериального патогена к лекарственному препарату), биодоступности и биоэквивалентности. Последнее относится к генерическим препаратам, столь широко представленным на отечественном фармакологическом рынке.
Макролидные антибиотки занимают одно из ведущих мест в антибактериальной терапии внебольничных пневмоний (ВП) различной этиологии. По фармакокинетическим характеристикам макролиды относятся к тканевым антибиотикам. К особенностям фармакокинетики наиболее часто назначаемых при лечении ВП антибиотиков (бета-лактамов и макролидов) относится способность макролидов к большей концентрации в очаге инфекции, чем в плазме крови (табл. 1) [1].
| Таблица 1. Фармакокинетика бета-лактамов и макролидов | |
| Бета-лактамы | Макролиды |
| Сывороточная концентрация = концентрации в очаге инфекции | Концентрация в очаге инфекции больше, чем концентрация в плазме крови |
| Возможность экстраполировать in vivo результаты минимальной подавляющей концентрации, полученные in vitro | Трудно экстраполировать in vivo результаты минимальной подавляющей концентрации, полученные in vitro |
Одним из широко представленных на фармакологическом рынке макролидных антибиотиков является азитромицин.
Доказано, что азитромицин может действовать не только бактериостатически, как и другие макролиды, но и, в отличие от антибиотиков этого класса, бактерицидно. Бактерицидный эффект достигается благодаря способности азитромицина создавать очень большие внутриклеточные концентрации на многие патогены, находящиеся внутри клеток [2]. Уже в первые сутки приема азитромицин создает концентрации в очаге инфекции, преимущественно в альвеолярных макрофагах, многократно превышающие минимальную подавляющую концентрацию (МПК) (рис. 1, 2) [3].
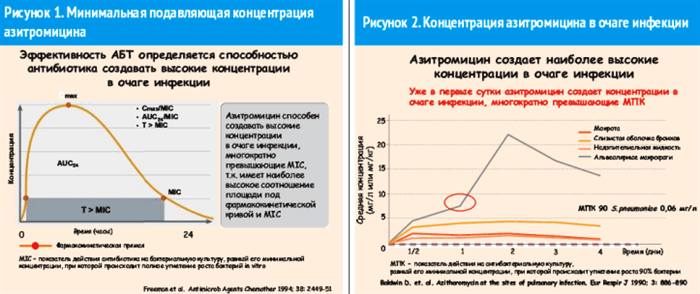
Особенностью азитромицина является способность создавать не только высокие концентрации в очаге инфекции, но и обеспечивать концентрацию препарата, в несколько раз превышающую МПК после 3-дневного приема в течение 7 дней, что практически соответствует 10-дневной антибактериальной терапии [4].
Азитромицин проявляет постантибиотический эффект и постантибиотический суб-МПК, т. е. влияние на микроорганизмы после воздействия субингибирующих концентраций антибиотика не только против Streptococcus pneumoniae, но и в отношении Streptococcus pyogenes, Haemophilus influenzae, Legionella pneumophila. Азитромицин является единственным макролидом с природной активностью в отношении Haemophilus Influenzae, а по продолжительности постантибиотического эффекта у Haemophilus Influenzae и Legionella pneumophila он превосходит кларитромицин [5].
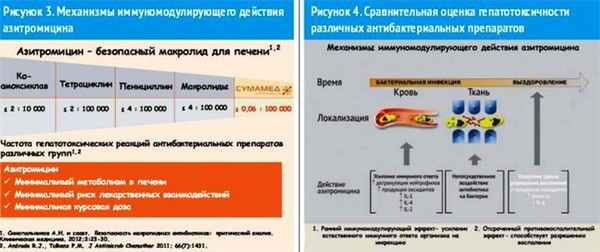
Известно, что азитромицин и другие макролиды обладают иммуномодулирующим и противовоспалительным действием [6]. Уникальность азитромицина не только как антибиотика, обладающего антибактериальным, но и иммуномодулирующим свойством, может быть связана с особым строением молекулы. По химическому строению азитромицин является 15-членным макролидом и его коренное отличие от «классических» 14-членных макролидов состоит в том, что в состав его молекулы входит атом азота. В эксперименте на здоровых добровольцах, которые принимали азитромицин в дозе 500 мг в сутки в течение 3 дней, было продемонстрировано двухфазное иммуномодулирующее действие препарата [7]. Ранний иммуномодулирующий эффект азитромицина проявляется в усилении естественного иммунного ответа организма на инфекцию, поздний (отсроченный) противовоспалительный эффект антибиотика способствует разрешению воспаления. Макролиды, и в частности азитромицин, повышают активность Т-киллеров. Они накапливаются в нейтрофилах, моноцитах и макрофагах, усиливают их миграцию в очаг воспаления, повышают фагоцитарную активность, стимулируют секрецию интерлейкинов IL-1, IL-2, IL-4. Кроме того, азитромицин ускоряет апоптоз нейтрофилов после ликвидации патогена. С противовоспалительным действием макролидов связано уменьшение гиперреактивности дыхательных путей, как правило, сопровождающей бронхолегочные инфекции [6, 8]. Механизмы иммуномодулирующего действия азитромицина отражены на рисунке 3.
наблюдается при назначении антибиотиков в высоких дозах. Однако даже при внутривенном введении 4,0 г раствора азитромицина частота болей в животе и тошноты не превышает 0,5%.
Одной из важных сторон безопасности антибиотиков является определение их кардиотоксичности, связанной с влиянием на проводящую систему сердца. Результаты проведенных исследований убедительно свидетельствуют о сердечно-сосудистой безопасности макролидов. Частота развития жизнеугрожающих аритмий при их применении чрезвычайно низка и не превышает 1 случай на 100 тыс. назначений [11]. В эксперименте (Poluzzi E. et al.) и в исследовании H. Svanstrom et al. выявлено, что среди макролидов азитромицин оказывает наименьший аритмогенный потенциал [12, 13].
Что касается гепатотоксичности, то по сравнению с многими антибиотиками азитромицин отличает наименьшая частота гепатотоксических реакций, в т. ч. и по сравнению с другими макролидами (рис. 4) [14, 15].
В этой связи распространяемые мифы о гепато- и кардиотоксичности макролидов (азитромицин) недопустимы, т. к. это может привести к избыточному потреблению оставшихся классов антибиотиков и росту устойчивости микроорганизмов [16].
Согласно национальным и международным рекомендациям по ВП азитромицин применяется для лечения нетяжелой ВП как в качестве монотерапии (1-я группа больных ВП), так и в качестве комбинированной антибактериальной терапии (АБТ) (2-я группа) [17, 18].
Показаниями для назначения макролидов при нетяжелом течении ВП являются:
• подозрение на «атипичную» этиологию заболевания (Mycoplasma pneumoniae, Chlamydia pneumoniaе, Legionella spp.);
• аллергия на ?-лактамы;
• отсутствие эффекта при лечении ?-лактамами.
На основании национальных рекомендаций по внебольничной пневмонии у взрослых нами разработан алгоритм ведения больных с ВП в амбулаторных условиях, представленный в таблицах 2 и 3 [19].
Комбинированная антибактериальная терапия ВП, включающая макролиды, применяется при нетяжелом течении ВП у больных с сопутствующей патологией или при указании больными на прием за последние 3 мес. антибактериальных препаратов ? 2 дней. Наиболее частое применение макролиды находят у больных с ВП, требующих госпитализации, в т. ч. в отделение реанимации и интенсивной терапии [17, 18]. В этом аспекте макролиды следует рассматривать не только в качестве средства «прикрытия» от внутриклеточных возбудителей, но и как антибиотик с потенцированием эффекта в отношении пневмококка [20]. В таблице 4 представлены схемы антибактериальной терапии ВП у госпитализированных пациентов различной тяжести [17, 18].
| Таблица 4. Антибактериальная терапия внебольничной пневмонии у госпитализированных пациентов | ||
| Группа | Наиболее частые возбудители | Рекомендованные режимы терапии |
| Пневмония нетяжелого течения 1 | S. pneumoniae H. influenzae C. pneumoniae S. aureus Enterobacteriaceae | Ампициллин в/в, в/м ± макролид внутрь 2 Амоксициллин/клавуланат в/в ± макролид внутрь 2 Амоксициллин/сульбактам в/в, в/м ± макролид внутрь 2 Цефотаксим в/в, в/м ± макролид внутрь 2 Цефтриаксон в/в, в/м ± макролид внутрь 2 Эртапенем в/в, в/м ± макролид внутрь 2 или Респираторный фторхинолон (левофлоксацин, моксифлоксацин) в/в или внутрь |
| Пневмония тяжелого течения 3 | S. pneumoniae Legionella spp. S. aureus Enterobacteriaceae | Амоксициллин/клавуланат в/в + макролид в/в Цефотаксим в/в + макролид в/в Цефтриаксон в/в + макролид в/в Эртапенем в/в + макролид в/в или Респираторный фторхинолон (левофлоксацин, моксифлоксацин) в/в + цефотаксим, цефтриаксон в/в |
| Примечание. 1 Предпочтительна ступенчатая терапия. При стабильном состоянии пациента допускается сразу назначение препаратов внутрь. 2 Следует отдавать предпочтение наиболее изученным при ВП макролидам с улучшенными фармакокинетическими свойствами (азитромицин, кларитромицин). 3 При наличии факторов риска Р. aeruginosa–инфекции (бронхоэктазы, прием системных глюкокортикоидов, терапия антибиотиками широкого спектра действия более 7 дней в течение последнего месяца, истощение организма) препаратами выбора являются цефтазидим, цефепим, цефоперазон/сульбактам, тикарциллин/клавуланат, пиперациллин/тазобактам, карбапенемы (меропенем, имипенем) + ципрофлоксацин или + аминогликозиды II-III поколения (гентамицин, тобрамицин, амикацин). При подозрении на аспирацию целесообразно использовать в качестве монотерапии амоксициллин/клавуланат или цефоперазон/сульбактам, или тикарциллин/клавуланат, или пиперациллин/тазобактам, или моксифлоксацин или в качестве комбинированной терапии цефалоспорины III поколения (цефтриаксон, цефотаксим) + метронидазол. | ||
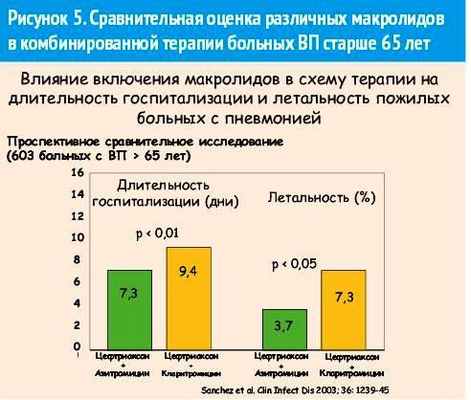
На практике наиболее частой комбинированной антибактериальной терапией тяжелой пневмонии является сочетание цефалоспоринов III поколения и макролидов, причем назначение комбинации этих 2 классов антибиотиков должно быть в качестве стартовой терапии, только в этом случае достоверно сокращается длительность госпитализации [21]. Отвечая на вопрос: «Какому макролиду отдать предпочтение при сочетании с цефалоспоринами III поколения?», мы приводим результаты перспективного сравнительного исследования, в котором показано преимущество сочетанной терапии цефтриаксона и азитромицина по сравнению с лечением цефтриаксоном и кларитромицином (рис. 5) [22].
О значении макролидов в лечении больных тяжелой пневмонией свидетельствуют результаты систематического обзора 28 наблюдательных исследований около 10 тыс. больных с тяжелой ВП, в котором было показано, что использование макролидов в комбинированной терапии с бета-лактамными антибиотиками в сравнении с монотерапией привело к снижению смертности (р = 0,02) [23]. Заслуживает внимания сравнительная оценка показателей смертности у больных тяжелой ВП, получавших бета-лактамы в сочетании с макролидами и бета-лактамы в сочетании с респираторными фторхинолонами (РФХ). Оказалось, что значительной разницы между данными схемами антибактериальных препаратов не было обнаружено (20%-ный бета-лактам + макролид и 23%-ный бета-лактам + РФХ; отношение шансов (ОШ) 0,83, 95% доверительный интервал (ДИ) 0,67--1,03, р = 0,09).
Одним из препаратов выбора при болезни легионеров являлся азитромицин. Антибиотик назначался в качестве монотерапии в течение 10 дней по 500 мг однократно при нетяжелом проявлении легионеллезной инфекции внутрь в 10 случаях из 15 (66,7%) и 17 больным из 46 (37,0%) с тяжелым течением легионеллезной пневмонии по принципу ступенчатой терапии.
В результате лечения азитромицином достигнута положительная клинико-лабораторная и рентгенологическая динамика у больных легионеллезной пневмонией тяжелого течения. Умерших больных среди пролеченных азитромицином не было.
Обращало внимание достоверное увеличение уровня аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в периферической крови после антибиотикотерапии нестандартно длительного курса азитромицином у больных с тяжелым течением легионеллезной ВП без сопутствующих заболеваний печени [26]. Полученные результаты корреспондируют с данными литературы, свидетельствующими о преходящем повышении трансаминаз как побочном действии антибиотиков [27--29]. Синдром цитолиза гепатоцитов носил преходящий характер без признаков печеночной недостаточности, что подтвердилось нормализацией уровня трансаминаз через 12 мес. после выписки больных из стационара. Сравнительная оценка показателей АСТ и АЛТ в динамике у больных легионеллезной пневмонией тяжелого течения, пролеченных азитромицином, представлена в таблице 5.
| Таблица 5. Сравнительная оценка показателей АСТ и АЛТ в динамике у больных легионеллезной пневмонией тяжелого течения, пролеченных азитромицином, М (95%ДИ) 1 | |||||
| Показатель | При госпитализации (1); n = 28 | После окончания лечения (2) n = 22 | Через 12 мес. (3) n = 17 | Р 1-2 | Р 2-3 |
| АСТ 2 , МЕ/л | 26,5 (17,3-35,6) | 79,0 (53,2-104,7) | 22,8 (18,93--26,71) | 0,0007 | 0,0000 |
| АЛТ 3 , МЕ/л | 36,6 (22,0-51,2) | 75,8 (48,2-103,5) | 26,4 (20,0?32,9) | 0,01 | 0,0001 |
| Примечание: 1 М(95% ДИ) -- М -- среднее значение (95% доверительный интервал); 2 АСТ -- аспартатаминотрансфераза; 3 АЛТ -- аланинаминотрансфераза. | |||||
Еще одним подтверждением необходимости применения азитромицина являются полученные нами результаты при лечении больных тяжелой пневмонией в период эпидемической вспышки гриппа A (H1N1) pdm09. Из 250 больных, находившихся под наблюдением, 104 (41,6%) лечились одновременно назначаемой комбинацией цефалоспоринов III поколения и азитромицином [30]. У большинства из них (64 пациента) диагностирована тяжелая пневмония на фоне гриппа A (H1N1) pdm09. Парентеральное применение цефалоспоринов III поколения и азитромицина в дозе 500 мг в течение 3--5 дней с последующим назначением ингибиторозащищенных пенициллинов обеспечило регресс клинических симптомов и рентгенологических изменений со стороны органов дыхания через 16,3 дня 95% ДИ [15,2--17,3].
Таким образом, в настоящее время макролидам принадлежит одно из ведущих мест в антибактериальной терапии внебольничной пневмонии независимо от их этиологической принадлежности и тяжести заболевания, а азитромицин является одним из основных представителей этого класса антибиотиков.
Читайте также:
