Маркеры поражения яичников. Влияние лучевой терапии
Добавил пользователь Владимир З. Обновлено: 27.01.2026
1 ФГБУ «Ростовский научно-исследовательский онкологический институт» Министерства Здравоохранения Российской Федерации
Проведено изучение функции сохраненных яичников, у больных раком шейки матки спустя 5 лет после выполнения расширенной гистерэктомии с трубами с формированием ложа для яичников из круглой маточной связки, что позволило временно выводить гонады из зоны облучения при проведении радиотерапии на втором этапе лечения. После окончания лучевой терапии, яичники возвращались в малый таз в положение, имитирующее их связочный аппарат, что предотвращало развитие постовариоэктомического синдрома и лучевой кастрации. В результате проведенных гормональных и ультразвуковых исследований у 176 больных, выявлено, что яичники продолжали полноценно функционировать спустя 5 лет после лечения согласно возрастному критерию, благодаря их физиологическому расположению в малом тазу, что препятствовало перегибу сосудистой ножки и способствовало адекватному кровоснабжению.
1. Доброхотова Ю.Э. Гистерэктомия в репродуктивном возрасте (системные изменения в организме женщины и методы их коррекции): Автореф. дис. д-ра мед. наук. – М., 2000. – 36 с.
2. Каприн А.Д. Злокачественные новообразования в России в 2013 году (заболеваемость и смертность) / В.В. Старинский, Г.В. Петрова. – М.: МНИОИ им. П.А. Герцена – филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России, 2015. – C. 41.
3. Кулаков В.И., Адамян Л.В., Аскольская С.И. Гистерэктомия и здоровье женщины. – М: Медицина, 1999. – 311 с.
4. Новикова Е.Г., Каприн А.Д., Трушина О.И. Взгляд онкогинеколога на скрининг рака шейки матки // Российский вестник акушера-гинеколога. – 2014. – № 5. – С. 39–43.
5. Новикова Е.Г. Использование оперативной лапароскопии в комбинированном лечении местно-распространенного рака шейки матки у пациенток молодого возраста // Онкология. – 2012. – № 1. – С. 10–14.
6. Пылова И.В. Репродуктивная функция у пациенток с лимфомой Ходжкина и возможности ее сохранения // Онкогематология. – 2006. – № 1. – С. 113–121.
7. Рубченко Т.И. Клинико-метаболические последствия гистерэктомий и их гормональная коррекция: Автореф. дис. д-ра мед. наук. – М., 2000. – 45 с.
8. Сидоренко Ю.С. Сохранение функции яичников в процессе комбинированного лечения рака шейки матки // Опухоли женской репродуктивной системы. – 2012. – № 1. – С. 113–117.
9. Сидоренко Ю.С., Неродо Г.А., Крузе П.А. Способ предупреждения посткастрационного синдрома при лечении рака шейки матки // Патент России № 2254064. 2005. Бюл. №17.
10. Katki, H.A. How might HPV testing be integrated into cervical screening? / H.A. Katki, N. Wentzensen // Lancet Oncol. – 2012. – Vol. 13, № 1. – P. 8–10.
Рак шейки матки (РШМ) является наиболее частой злокачественной опухолью у женщин 15–39 лет. Согласно статистике, как минимум треть женщин больных раком шейки матки находится в фертильном периоде, то есть до 45 лет [2, 4]. Рост заболеваемости в этом возрасте связан с увеличением распространенности вируса папилломы человека, который обнаружен почти у 100 % женщин больных РШМ [4, 10]. Общепризнанный стандарт лечения инвазивных форм рака шейки матки включает в себя проведение расширенной экстирпации матки с придатками с последующей лучевой терапией. К сожалению, это приводит к развитию постовариоэктомического синдрома у молодых женщин в результате удаления яичников [5]. Учитывая вирусную этиологию заболевания, статистически доказанное редкое метастазирование в гонады, оправдано выполнение операции с сохранением яичников больным репродуктивного возраста. Известно, что для повреждения фолликулярного аппарата достаточно подведения дозы в 20 Гр. Однако исследованиями установлено, что данная доза приводит к «гибели» яичника у 25-ти летних женщин. В позднем репродуктивном возрасте, после 35 лет, в связи с тем, что фолликулярный резерв яичников уже снижен, доза в 6–8 Гр является пагубной для овариальной функции [6].
К сожалению, существующие методики, позволяющие однократно вывести яичники из зоны облучения могут привести к необратимым изменениям в них, в результате возможного перегиба питающей ножки.
Нами была предложена хирургическая методика временного выведения яичников из зоны облучения на втором этапе лечения, позволяющая после окончания лучевой терапии вернуть сохраненные интраоперационно яичники в предварительно созданное ложе, способствующее достаточному кровоснабжению и, как следствие, адекватному функционированию гонад [9].
Остается дискутабельным вопрос о сроках полноценной овариальной функции после удаления матки. По данным одних авторов яичники прекращают свою работу в ближайшее время после гистерэктомии [1], другие исследования говорят в пользу многолетнего функционирования яичников соответственно возрасту [3, 7].
Таким образом, принимая во внимание тенденцию роста заболеваемости раком шейки матки молодых женщин, актуально провести дополнительное изучение состояния сохраненных яичников спустя более длительный срок.
Цель исследования: изучить функцию половых желез в сроки более 5 лет после проведения комбинированного лечения.
Материалы и методы исследования
Предложенный нами способ мобилизации сохраненных яичников применялся у 176 женщин репродуктивного возраста (от 20 до 45 лет) больных раком шейки матки Ib стадии (гистотип соответствовал плоскоклеточному раку) с 2003 по 2014 годы. На момент оценки результата возрастной промежуток варьировал от 25 до 56 лет. Сроки наблюдения составили от 1-го года до 11 лет. Большинство женщин (130 человек, 74 %) находились в периоде, соответствующему репродуктивному (до 45 лет), из них 104 пациентки (59 %) наблюдались после окончания лечения более 5 лет. Старше 45-ти лет (46–56 лет) было 46 пациенток (26 %), клинически у них было отмечено состояние перименопаузы.
После проведения планового обследования, оценки типа кровоснабжения яичников до операции (преимущественно из яичниковой артерии), пациенткам проводилось комбинированное лечение, включающее расширенную гистерэктомию с фиксацией сохраненных яичников к круглым маточным связкам и последующим выведением половых желез из зоны облучения при проведении дистанционной гамма-терапии на область удаленной опухоли и зону регионарного метастазирования. В работу включались женщины с достаточно длинной круглой маточной связкой, чтобы обеспечить максимально возможное удаление яичников от ромбовидного поля облучения. С целью контроля расположения гонад в брюшной полости при проведении лучевой терапии и для подтверждения их локализации в малом тазу после лечения, все яичники интраоперационно помечались рентгенконтрастными танталовыми скрепками. С помощью обзорной рентгенографии на аппарате PHILIPS BV PULSERA выполнялась визуализация яичников. Облучение осуществлялось в статическом режиме на аппарате АГАТ-С, с двух диаметральных ромбовидных полей – надлобкового и ягодично-крестцового, размерами 13х13 см. Ежедневное фракционирование разовой дозы составило 2 Гр., суммарная очаговая доза варьировала в пределах 40–46 Гр.
Пациенткам, после завершения лечения, и на этапах наблюдения проводилась оценка состояния яичников с помощью анкетного опроса, ультразвукового сканирования с допплерометрией (с использованием аппаратов «IU 22PHILIPS», HITACHI «HIVISION 900»), выполнялось определение уровня стероидных и гонадотропных гормонов в плазме крови радиоиммунологическим методом в соответствующее фолликулиновой фазе время. Полученные показатели сравнивались с результатами обследования здоровых женщин аналогичного возраста.
Результаты исследования и их обсуждение
Операция заключалась в осуществлении расширенной гистерэктомии с трубами; выкраивания тканевого стебля из воронко – тазовой связки, содержащего сосуды, питающие яичник, и выделении максимальной длины круглой маточной связки, из которой формировалось ложе для оставленных яичников. С этой целью круглая маточная связка натягивалась, ее брюшина Т-образно надсекалась и разворачивалась. Следующим этапом сохраненный яичник укладывался в подготовленное ложе. Для этого культя собственной связки яичника подшивалась к брюшине круглой маточной связки в дистальной части разреза и помечалась танталовыми скрепками. Далее, несколькими швами, яичник фиксировался к развернутым краям брюшины круглой маточной связки. Аналогичные манипуляции выполнялись на втором яичнике. На конце круглых маточных связок фиксировались две мерсиленовые нити, проведенные через тонкие силиконовые катетеры, выведенные на кожу (дистально через круглую маточную связку, проксимально в области подреберья). Перед проведением лучевой терапии подтягиванием верхней лигатуры яичники выводились из зоны облучения. Их расположение контролировалось рентгенологически.
Окончив лучевую терапию, после соответствующей обработки кожи верхние нити натягивались до упора, извлекались катетеры, содержащие нити, последние отсекались на уровне кожи. Далее, натягиванием нижних лигатур, яичники возвращались в малый таз, в положение, имитирующее их связочный аппарат. Затем, проводилось аналогичное удаление нижних нитей с катетерами. После чего, расположение яичников в малом тазу контролировалось с помощью ультрасонографии.
Нашими предыдущими исследованиями [8] было показано, что после проведенного лечения гормональная функция оставленных яичников практически полностью восстанавливается к 12 месяцам наблюдения, сохраняя свою активность, как минимум до 5 лет, таким образом, избавляя женщин от развития климактерического синдрома и связанных с ним вегетоневротических, сердечно-сосудистых и обменно-эндокринных нарушений. Основными гормонами, ответственными за отсутствие посткастрационного синдрома, развивающегося в результате выключения функции яичников, являются эстрогены, выработка которых контролируется фолликулостимулирующим гормоном (ФСГ). Поэтому, для наглядности мы остановились на рассмотрении взаимосвязи этих двух гормонов.
Учитывая фертильный период пациенток на момент операции, нас больше всего интересовало состояние яичников спустя 5 лет после лечения, так как большинство женщин не достигало перименопаузального возраста даже через 10 лет после лечения.
Так, при обследовании наших больных, находящихся в периоде соответствующему среднему репродуктивному, т.е. до 40 лет (111 человек – 63 %) гормональные показатели были стабильны и характерны для этого возраста, в среднем уровень фолликулостимулирующего гормона и эстрадиола (Э2), составил 3,8 МЕ/л и 261 пмоль/л соответственно (таблица). Несмотря на начинающуюся перестройку женского организма и периодические всплески гормонов в поздний репродуктивный период (от 41 до 45 лет – 19 женщин), концентрация гонадотропных и половых гормонов была также в пределах нормы (таблица). При ультрасонографии яичники визуализировались в виде образований овальной формы, средней эхоплотности, однородной структуры без патологических изменений с эхонегативными включениями линейной формы (изображение танталовых скрепок). В этой группе больных специфические менопаузальные симптомы (приливы, потливость, сухость влагалища) никто не предъявлял, хотя треть пациенток были пролечены 7 лет назад.
Маркеры поражения яичников. Влияние лучевой терапии
Влияние химиотерапии на яичники. Факторы риска бесплодия
Степень токсического поражения половых желез, вызванная химиотерапией, варьирует.
Гистологические исследования ткани яичников после лечения цитотоксичными препаратами показывают большое разнообразие повреждений: от уменьшения количества фолликулов до их отсутствия и фиброза. Частоту нарушения функций яичников под воздействием проведенной химиотерапии трудно установить с достаточной точностью, поскольку токсическое действие на яичники оказывают и многие другие факторы.
Цитотоксические препараты могут повреждать созревающие фолликулы, примордиальные фолликулы, нарушать созревание фолликулов или оказывать комбинированное воздействие. Поражение созревающих фолликулов приводит к временной аменорее, тогда как поражение примордиальных фолликулов — к постоянной аменорее вследствие нарушения функций яичников.
Считают, что первичной мишенью отдельных цитотоксических препаратов бывают или гранулезные клетки яичника, или ооциты. Трудно точно сказать, что именно страдает в первую очередь, поскольку структурное и функциональное взаимодействие зернистых клеток яичника с ооцитами настолько тесное, что разрушение одного типа клеток приводит к поражению другого.

Нарушение менструального цикла, происходящее после химиотерапии, не всегда бывает прямым результатом токсического воздействия лекарственных препаратов на яичники. Тяжелое заболевание, недостаточность питания, психический и физический стресс могут стать причиной нарушения функций гипоталамо-гипофизарно-яичниковой системы. Кратковременные нарушения менструального цикла также чаще бывают результатом поражения растущих, а не примордиальных фолликулов.
Поражение всех развивающихся фолликулов задерживает менструацию, по меньшей мере, на 3 мес, поскольку примордиальный фолликул достигает стадии овуляции приблизительно за 85 дней.
Наиболее значимые факторы риска поражения половых желез — возраст больной, класс медикаментозного препарата и кумулятивная доза препарата. Риск поражения половых желез увеличивается с возрастом женщины. Скорее всего, это обусловлено малочисленностью сохранившихся ооцитов у женщин старшего возраста по сравнению с более молодыми.
По данным одного исследования, у пациенток, страдающих болезнью Ходжкина и получавших новэмбихин (мехлоретамин), винкристин, прокарбазин и преднизон (так называемый метод МОПП), последующая аменорея возникала у 20% женщин моложе 25 лет в сравнении с 45% женщин в возрасте 25 лет и старше. По данным другого исследования, частота ПЯН после химиотерапии по методу МОПП составила 61%.
Различные цитотоксические химиотерапевтические препараты имеют разную степень гонадотоксичности. Неспецифические цитостатики, применяемые при химиотерапии, считают более гонадотоксичными, чем специфические. У женщин, получающих высокие дозы алкилирующих неспецифических цитостатиков (в высокой степени гонадотоксичных), применяемых при химиотерапии, возникает наибольший риск возникновения ПЯН. В этой группе цитостатиков наиболее гонадотоксичным препаратом считают циклофосфамид.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Эффективность транспозиции яичников. Частота беременности после лучевой терапии
В большинстве случаев яичники сохраняют функции, если они были сдвинуты не менее чем на 3 см от верхнего края поля облучения. Дозу облучения, которую получают яичники после транспозиции, рассчитывают. Известно, что при лечении рака шейки матки облучением в дозе 4000 сГр, яичники, сдвинутые на 3 см от края поля облучения, получают дозу 280 сГр, а те, что за краем поля на 4 см, получают 200 сГр рассеянного облучения.
В одном из исследований было продемонстрировано, что яичники сохраняют функции, когда сдвинуты выше гребня подвздошной кости.
Было подсчитано, что приблизительно 80% женщин, перенесших лапароскопическую транспозицию яичников, сохранили функции яичников после различных вариантов лучевой терапии. Большинство женщин с I и II стадиями болезни Ходжкина, получавшие после лапароскопической транспозиции яичников только лучевую терапию или совместно с минимальной химиотерапией, сохранили функции яичников и фертильность.
Клинические случаи неудачной транспозиции яичников. Преждевременное истощение яичников после транспозиции может быть обусловлено разными причинами. Это может произойти, если яичники не были сдвинуты достаточно далеко за пределы радиационного поля. Другая причина неудачной терапии может состоять в миграции яичников назад, на свое обычное место. Такое может происходить, при использовании рассасывающегося шовного материала.
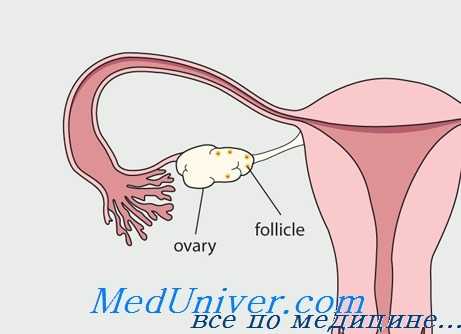
Яичниковая недостаточность после транспозиции может также быть обусловлена нарушением кровоснабжения яичников после хирургического вмешательства или лучевой травмы сосудистой ножки. В других случаях происходит формирование функциональных кист. Механизм образования кист неизвестен, но их образование можно подавить назначением пероральных контрацептивов.
Фертильность после лучевой терапии. Беременность может наступить после лучевой терапии независимо от проведенной транспозиции яичников перед лечением. По данным исследования 37 женщин, беременность наступила у 15% со светлоклеточным раком влагалища или шейки матки после близкофокусной лучевой терапии с дополнительным наружным облучением или без него и у 80% пациенток — после наружного облучения при дисгерминоме и саркоме органов малого таза. Интересно, что 75% беременностей наступили без репозиции яичников.
Частота наступления беременности после лучевой терапии. В ряде исследований была рассмотрена частота наступления беременности после проведенной лучевой терапии на область малого таза. При обследовании 31 150 человек, переживших взрыв атомной бомбы, не было отмечено повышения мертворождаемости, значительных врожденных уродств, хромосомных аномалий или мутаций.
Аналогичным образом у женщин, получавших химиотерапию с лучевой терапией при болезни Ходжкина, также не было отмечено повышения частоты мертворождаемости, рождения детей с малой массой тела, врожденных уродств, аномального кариотипа или онкозаболевания. Однако в одном из исследований было выявлено увеличение частоты рождения детей с малой массой тела и самопроизвольных выкидышей, если зачатие происходило в срок менее 1 года после воздействия облучения. На этом основании можно рекомендовать отложить беременность на 1 год после окончания лучевой терапии.
Преждевременная яичниковая недостаточность (ПЯН) не всегда возникает у пациенток, получавших комбинированное лечение химиотерапевтическими препаратами, независимо от их возраста и типа химиотера-певтических агентов. Большинство молодых женщин с болезнью Ходжкина, лечившихся несколькими химиотерапевтическими препаратами и получавших лучевую терапию на области, исключающие яичники, сохраняли способность к деторождению, хотя их репродуктивные функции и начинали снижаться раньше, чем в контрольной группе.
Сывороточные маркеры поражения яичников. Концентрации ингибина В, АМГ и ФСГ используют как маркеры для определения нарушения функций яичников после проведения химиотерапии, хотя ни один из них нельзя считать идеальным показателем. Ингибин В и АМГ синтезируются зернистыми клетками яичников, ФСГ секретируется в гипофизе, ингибируется эстрадиолом и ингибином В. Повышение содержания ФСГ в сыворотке крови и снижение концентрации ингибина В и АМГ отражают угнетение функций яичников у выживших онкологических больных даже при наличии регулярных менструаций.
Химиотерапия при онкологических заболеваниях связана с транзиторным подавлением ингибина В у девочек в препубертатном возрасте. Следовательно, чувствительные к изменениям показатели концентраций ингибина В и ФСГ — потенциальные маркеры гонадо-токсичного эффекта химиотерапевтических препаратов у девочек в препубертатном периоде.
УЗИ-маркеры поражения яичников. Другим методом определения состояния яичников у таких пациенток служит УЗИ, при котором определяют объем яичников и количество антральных фолликулов. У пациенток, перенесших онкологические заболевания, с нормальными функциями яичников нередко обнаруживают нормальное количество антральных фолликулов, хотя яичники у них часто имеют меньший размер, чем в контрольной группе.
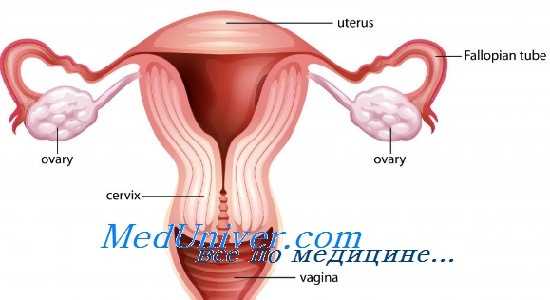
Влияние лучевой терапии на яичники
Лучевая терапия области малого таза повреждает как яичники, так и матку. Поражение яичников при лучевой терапии приводит к снижению репродуктивной функции и ПЯН. Поражения матки, вызванные лучевой терапией, проявляются нарушением роста эндометрия и олигоменореей. Это может существенно повлиять на последующие беременности.
При воздействии ионизирующей радиации наиболее уязвимыми оказываются фолликулы яичников ввиду воздействия на ДНК. Лучевая терапия приводит к атрофии яичников и уменьшению запаса фолликулов. В результате воздействия радиации происходит прогрессивное повышение содержания ФСГ и ЛГ и снижение концентрации эстрадиола в течение 4-8 нед после лучевой нагрузки.
На клеточном уровне облучение ооцитов сказывается на состоянии клеток и приводит к стремительно развивающемуся пикнозу, уплотнению хромосом, разрушению ядерной оболочки и вакуолизации цитоплазмы. Необратимость этих повреждений принято объяснять недостаточным количеством зарождающихся стволовых клеток в яичнике.
Однако недавние исследования показали присутствие зарождающихся стволовых клеток в яичниках у взрослых женщин, что доказывает способность ооцитов к восстановлению после окончания химио- или лучевой терапии.
Онкологические больные после лучевой терапии тазовой области или всего туловища относятся к группе повышенного риска по ПЯН. Степень поражения яичников связана с возрастом пациенток и общей дозой облучения яичников. Доза облучения 12 грэй (Гр; 1 рад = 1 сГр) приводила к стойкой яичниковой недостаточности у девочек в препубертатном периоде, в то время как доза всего 2 Гр давала такой же результат у женщин старше 45 лет. Обычно полагают, что однократной дозы от 6,5 до 8,0 Гр достаточно для развития стойкой яичниковой недостаточности у большинства женщин в постпубертатном периоде.
Процент уменьшения запаса примордиальных фолликулов в яичниках при лучевой терапии, направленной на область яичников, зависит от полученной дозы. Считают, что уже сравнительно малая доза облучения (3 Гр) достаточна для поражения 50% всех ооцитов у молодых женщин детородного возраста.
Проведен ряд исследований для определения зависимости поражения яичников от полученной дозы излучения у 90% пациенток в возрасте 15-17 лет. Когда средняя доза радиации, воздействовавшей на яичники, составляла 1,2 Гр, сохранялись функции яичников, тогда как при средней дозе 5,2 Гр функции яичников сохранялись только у 60% пациенток. Истощение яичников развивается практически у всех пациенток при воздействии на область таза облучения в дозах, необходимых для лечения рака шейки матки (85 Гр), рака прямой кишки (45 Гр) или общего облучения всего тела с пересадкой костного мозга (от 8 до 12 Гр на яичники). Если проводят также химиотерапию, доза облучения, вызывающая ПЯН, снижается.
Угнетение функций яичников происходит даже в тех случаях, когда облучение не направлено непосредственно на область яичников. Кратковременная лучевая терапия, направленная на периаортальные лимфатические узлы при лечении болезни Ходжкина, дает рассеянное облучение яичников дозой 1,5 Гр, в ближайшее время функции яичников при этом не нарушаются. Влияние этой дозы на развитие отдаленных по времени нарушений функций яичников остается менее ясным. Важно обсудить с онкологом, будет терапевтическая доза облучения направлена непосредственно на яичники или она будет рассеянной.
Лучевая терапия рака матки

Рак матки развивается из клеток слизистой оболочки. Это одно из наиболее распространенных онкологических заболеваний, которым обычно страдают женщины в возрасте от 60 до 70 лет. Рак шейки матки представляет собой вторую по распространенности опухоль после рака молочной железы у женщин. Около 20% всех недавно появившихся злокачественных опухолей – это рак шейки матки.
Факторы риска: избыточный вес, более длительное производство эстрогена и генетическая предрасположенность.
Симптомы: на поздней стадии возникает дискомфорт, в том числе необычное кровотечение, например, между менструациями или после менопаузы. Позже добавляются боли в области влагалища, а также инфекции мочевых путей.
Прогноз: при раннем выявлении шансы на выздоровление высоки. Если метастазы уже сформировались, то прогноз ухудшается.
Лечение: лучший вариант терапии – это операция, при которой матка удаляется. Часто добавляется лучевая и химиотерапия. Единственный способ профилактики – регулярные осмотры у гинеколога.
Лечение лучевой терапией рака матки или шейки матки представляет собой в первую очередь послеоперационную меру. Хотя облучение на ранней стадии может обещать успех, операция обеспечивает лучший прогноз. Вот почему радиотерапия имеет смысл в сочетании с хирургическим вмешательством и незаменима в том случае, если оперативное лечение невозможно.
Радиотерапия направлена на предотвращение роста и распространения опухоли. Но она также используется, если злокачественное новообразование не может быть полностью удалено или свод влагалища уже пострадал. Целенаправленное, локально ограниченное облучение улучшает перспективы выздоровления. Облучение осуществляется с помощью аппликатора, введенного во влагалище, или же снаружи (на линейном ускорителе).
О лучевой терапии при раке матки
Когда назначается лучевая терапия при раке матки
Воздействие ионизирующим излучением является основой медицинской лучевой терапии. Но это звучит как противоречие: излучение оказывает вредное воздействие на живые клетки, то есть на ткани, повреждая наследственный материал, как здоровых, так и раковых клеток. Но здоровые клетки могут восстановить повреждение, а злокачественные клеточные структуры при этом умирают.
Показания к проведению радиотерапии в лечении рака матки:
локализованный рак эндометрия, развивающийся на фоне декомпенсированной и субкомпенсированной соматической патологии, которые являются абсолютным противопоказанием для операции;
местнораспространенные формы злокачественных опухолей: переход опухоли на влагалище, шейку матки и параметральную клетчатку (у 27% больных);
рак эндометрия при наличии неблагоприятных для прогноза факторов (низкодифференцированные опухоли, имеющие большую внутриорганную протяженность);
резектабельные злокачественные образования с распространением на придатки или связочный аппарат матки с глубокой инвазией миометрия, существенно ухудшающей прогноз заболевания.
В основном облучение используется в лечебных целях. При неизлечимых стадиях заболевания речь идет только об улучшении качества жизни или облегчении боли. Облучение проводится самостоятельно или в сочетании с химиотерапией. Тактика проведения лучевой терапии зависит от многих факторов, поэтому дозу облучения рассчитывают совместно врачи разных специальностей.


Как подготовиться к лучевой терапии
Перед началом лечения рака матки лучевая терапия должна быть тщательно спланирована. Для каждого пациента разрабатывается индивидуальный план. Тщательное планирование гарантирует, что облучаемая область охватывает всю опухоль, исключая негативное воздействие на здоровые ткани, чувствительные или жизненно важные органы, такие как сердце и спинной мозг.
Процедура проведения радиотерапии при раке матки:
Врачи и радиотерапевты устанавливают область, а также дозу облучения на компьютере, обычно на основе КТ (компьютерной томографии). Это занимает около недели.
Как только план будет подтвержден, запланированные лучевые поля будут проверены на пациенте с помощью специальной рентгеновской осветительной установки (имитатора терапии).
Затем поля облучения рисуются на коже водостойким карандашом или хной. Обычно это занимает от 30 минут до часа. Важно отметить, что маркер длительное время не смывается. Если разметка повредится, то сложное моделирование должно быть повторено.
Терапия может начаться сразу после планирования или через 1-2 дня. При необходимости поля облучения могут быть скорректированы в ходе проводимого лечения.
Виды лучевой терапии
Как правило, радиотерапия назначается при раке тела матки после операции и только в исключительных случаях используется в качестве единственной терапевтической меры.
Существует два вида лучевой терапии опухоли матки:
дистанционное (внешнее) с использованием линейного ускорителя;
брахитерапия (внутреннее) с помощью зонда (аппликатора).
При брахитерапии источник излучения помещается во влагалище. Аппликатор вводится в канал шейки матки и максимально точно воздействует на облучаемую область. При достижении желаемой дозы облучения источник излучения извлекается.
Методики лучевой терапии при раке матки часто объединяются в рамках плана лечения, но процедуры проводятся не в один и тот же день. Как правило, назначаются только избирательные сеансы брахитерапии, в то время как облучение извне происходит ежедневно в течение нескольких недель.


Процедура лучевой терапии при раке матки
Радиотерапия обычно проводится с помощью больших устройств, которые генерируют рентгеновские лучи. В некоторых случаях также используется так называемое гамма- или электронное излучение. Вся терапия состоит из серии ежедневных облучений, при которых общая доза делится на небольшие фракции. Количество процедур определяется несколькими факторами, в том числе типом и степенью заболевания.
У большинства пациентов лучевая терапия при онкологии шейки и тела матки проводится ежедневно, как правило, с двухдневным перерывом в выходные дни. В некоторых случаях облучают только один раз или один-два раза в неделю. Вся лучевая терапия может длиться до шести недель. У большинства пациентов облучение проводится амбулаторно, то есть они приходят в больницу на процедуру, а затем могут вернуться домой.
Ход процедуры облучения:
Пациент снимает одежду и занимает запланированную позицию на лечебной кушетке.
Фиксация облучаемой области осуществляется с помощью ремней, гипсовых пластин или пластиковых масок.
Затем медицинский персонал точно настраивает устройство на уже существующую маркировку.
Сотрудники клиники выходят из комнаты и проверяют настройки еще раз.
На протяжении процедуры за пациентом наблюдают через стеклянную панель и/или монитор.
Общение происходит через специальный встроенный микрофон.
При амбулаторной лучевой терапии проводятся регулярные медицинские осмотры. Если возникают вопросы до, во время или после терапии, нужно задавать их лечащему врачу.
Сочетание лучевой терапии с другими видами лечения
Для планирования лечения врачи должны знать, как далеко распространилась опухоль и заражены ли лимфатические узлы, а также другие ткани или органы. Опухоли делятся на разные стадии. Это влияет на тактику лечения:
Опухоль еще мала и лимфатические узлы не поражены: обычно достаточно одной операции. Если имеются высокие риски повторного образования опухоли, назначается лучевая терапия с сопутствующей химиотерапией или без нее.
Опухоль прогрессирует, но лечение все еще возможно: тогда, как правило, не оперируют, а лечат комбинацией лучевой и химиотерапии (радио-химиотерапии).
Эффективность лечения маловероятна: с помощью операции, химиотерапии или лучевой терапии можно попытаться остановить рост опухоли, чтобы выиграть время и уменьшить дискомфорт.
Болезнь неизлечима: на первый план выходит паллиативная помощь, которая включает в себя меры для облегчения боли и улучшения качества жизни.
Операция обычно стоит на первом месте. Цель – полное удаление злокачественной опухоли. При очень небольших раковых новообразованиях конизации может быть достаточно. При конизации вместе с опухолью удаляется конусообразный кусок шейки или тела матки размером примерно с вишню. Оперируется через влагалище, под местной или общей анестезией. Если конизации недостаточно, удаляется большая часть шейки матки и/или вся матка. Также могут быть удалены части смежных органов или соединительной ткани. После частичного удаления шейки матки женщина все еще может иметь детей. Однако процедуры увеличивает риск преждевременных родов во время беременности.
При лучевой терапии опухоль лечится рентгеновскими лучами. Матка может быть облучена снаружи через кожу или изнутри через влагалище. Для лечения рака шейки матки лучевая терапия обычно сочетается с химиотерапией (радио-химиотерапия). Химиотерапия направлена на остановку бесконтрольного деления раковых клеток. Препараты (называемые цитостатиками) обычно вводятся в вену через инфузию или назначаются в виде таблеток. Химиотерапия, как правило, сочетается с лучевой терапией.
Читайте также:
- Синдром сдавления локтевого, лучевого нерва. Диагностика и лечение
- Дифференциальная диагностика алкогольных нарушений мозгового кровообращения
- Врожденный острый лейкоз плода - частота, диагностика
- Операция при остеомиелите челюсти. Консервативное лечение остеомиелита челюсти
- Обезболивание слизистых новокаином. Препараты для местной анестезии
