Механизм удаления гистонов с нуклеосом при транскрипции
Добавил пользователь Алексей Ф. Обновлено: 10.01.2026
Изучение взаимодействия С-концевого домена РНК-полимеразы II и хроматина в элонгации транскриптов через нуклеосому НИР
Understanding CTD-chromatin crosstalk during transcription through nucleosome
- Руководитель НИР: Студитский В.М.
- Ответственные исполнители: Герасимова Н.С., Коровина А.Н.
- Участники НИР: Андреева Т.В., Афонин Д.А., Бондаренко Е.А., Голяева В.Е., Дралкина М.Г., Коровина А.Н., Косарим Н.А., Кошкина Д.О., Любителев А.В., Малинина Д.К., Малюченко Н.В., Мариловцева Е.В., Сивкина А.Л.
- Подразделение: Кафедра биоинженерии
- Срок исполнения: 1 марта 2019 г. - 31 декабря 2021 г.
- Номер договора (контракта, соглашения): 19-44-02013
- Номер ЦИТИС: АААА-А19-119051390027-6
- Тип: Фундаментальная
- Приоритетное направление научных исследований: Физико-химические основы биологии и биотехнологии
- ПН России: Науки о жизни
- Направление технологического прорыва России: Медицинские технологии и лекарственные средства
- Критическая технология России: Геномные, протеомные и постгеномные технологии
- Рубрики ГРНТИ:
- 34.15.17 Макромолекулярные ассоциации и проблемы узнавания в молекулярной биологии
Экспрессия генов у эукариот контролируется сложной, многокомпонентной системой регуляции транскрипции РНК-полимеразой II (РНКП II). Гены, транскрибируемые РНКП II, имеют нуклеосомную организацию. Нуклеосомы состоят из белкового ядра, образованного молекулами основных белков-гистонов, вокруг которого накручена ДНК в 1,65 витка. Белковое ядро представлено октамером гистонов и содержит по две копии каждого из канонических гистонов: H3, H4, H2A и H2B. При сборке нуклеосомы гистоны взаимодействуют в определенном порядке, поэтому строение нуклеосомы имеет модульный характер. Упорядоченная разборка нуклеосом при транскрипции облегчает доступ РНКП II к ДНК, в то время как нуклеосомная сборка затрудняет доступ фермента к матрице, тем самым затрудняя транскрипцию. Модификации хроматина, хроматин-ремоделирующие комплексы, шапероны гистонов и вариантные формы гистонов регулируют динамику нуклеосом во время транскрипции. Скорость транскрипции генов, содержащих нуклеосомы in vivo близка к скорости процесса, наблюдаемого in vitro на свободной от гистонов ДНК, однако даже одна нуклеосома in vitro может представлять высокий барьер для РНКП II. Эти наблюдения поднимают вопросы о природе нуклеосомного барьера при транскрипции и о механизмах его преодоления in vivo. Сравнение транскрипции через одиночные позиционированные мононуклеосомы при инициации с одноцепочечного участка ДНК, инициации на промоторе и прямой сборке элонгационного комплекса (ЭК) РНКП II показывает, что распределения пауз фермента при прохождении нуклеосомы различаются во всех этих случаях. Только инициация на промоторе и после сборки элонгационного комплекса РНКП II позволяют сформировать правильный транскрипционный комплекс, тогда как с одноцепочечного участка ДНК приводит к появлению характерной 10 п.н. периодичности паузирования фермента. Дальнейший анализ транскрипции с использованием ЭК, содержащих различные формы РНКП II существенно улучшит понимание механизма транскрипции через нуклеосомы. При синтезе мРНК осуществляется регулируемое взаимодействие РНКП II, комплексов ремоделирования хроматина и факторов транскрипции и процессинга РНК. РНКП II имеет уникальный дополнительный С-концевой домен (CTD) на самой крупной субъединице, Rpb1, содержащий повторяющиеся аминокислотные последовательности Tyr1Ser2Pro3Thr4Ser5Pro6Ser7, обогащенные сайтами для ковалентных посттрансляционных модификаций (особенно фосфорилирования). Для этого домена были предложены различные роли, включая функционирование в качестве платформы для связывания других белков, участвующих в транскрипции мРНК, модификации гистонов, взаимодействии с нуклеиновыми кислотами и перемещении нуклеосом. На каждом этапе транскрипции преобладают различные сочетания фосфорилирования, и с каждым преимущественно связывается определенный набор факторов. Различные комбинации фосфорилированных остатков либо индуцируют, либо предотвращают связывание факторов, которые необходимы для работы РНКП II в биогенезе мРНК. Таким образом, CTD и связанные с ним изменения имеют решающее значение для обеспечения эффективной инициации и элонгации транскрипции в хроматине. Полученные данные свидетельствуют о взаимодействия CTD и хроматина при транскрипции. По аналогии с гистоновым кодом было предположено существование кода CTD, представляющего собой стабильные или временные посттрансляционные модификации в повторяющихся аминокислотных последовательностях, регулирующие действие различных эффекторов. Наблюдается взаимная корреляция между паттернами фосфорилирования CTD РНКП II и модификациями гистонов. Кроме того, CTD и хроматин тесно взаимодействуют в пространстве на всех этапах транскрипции. Поэтому изучение взаимодействия этих структур и того, является ли модификация хроматина первичной или, наоборот, запускается модификацией CTD, является важной задачей. Белок BRD4 с двумя бромодоменами связывается с ацетилированными «хвостами» гистонов H3 и H4. BRD4 привлекает CDK9-содержащий фактор PTEFb и тем самым вызывает фосфорилирование Ser2 в CTD. Нарушение взаимодействия между бромодоменами и ацетилированными гистонами низкомолекулярным ингибитором JQ1 приводит к снижению связывания BRD4, снижению фосфорилирования Ser2, а также снижению экспрессии генов. С другой стороны, гистон-модифицирующие ферменты (Set1 и Set2) привлекаются с помощью ковалентных модификаций, присутствующих в CTD, к транскрипционному комплексу. Ser5-Р связывает и привлекает к CTD H3K4-метилтрансферазу Set1 вместе с комплексом PAF. Set1 триметилирует H3K4 в близлежащих к промотору гистонах, что является отличительной чертой активных генов. Set1 диметилирует H3K4, а модификация H3K4me2 участвует в привлечении деацетилаз гистонов (HDACs) к хроматину. Малая форма гистондеацетилазы Rpd3, Rpd3S, привлекается с помощью Ser5-Р к активно транскрибируемым генам. Во время активной элонгации дважды фосфорилированный CTD (Ser2-P/Ser5-P) привлекает комплекс Set2 для ко-транскрипционного метилирования хроматина по положению H3K36. Он также привлекает различные шапероны гистонов (например, Spt6 и комплекс FACT) для облегчения восстановления нуклеосом после транскрипции. Эти факторы имеют решающее значение для транскрипции хроматина. Модификации Ser2-Р и Ser5-P участвуют в привлечении комплекса PAF-Bre1-RAD1 для убиквитинирования гистонов H2B. FACT также облегчает диссоциацию H2A/H2B димера из нуклеосом при транскрипции хроматина. Поскольку нуклеосомная структура хроматина является барьером для транскрибирующей РНКП II, ремоделирование хроматина и модификации гистонов и CTD, по-видимому, облегчают транскрипцию РНКП II через хроматин. Кроме того, CTD играет важную роль в интеграции нескольких сигнальных путей, глобально влияющих на регуляцию генов. Определение возможного совместного действия CTD и хроматина в ходе транскрипции, такого как взаимодействие метил-трансфераз гистонов с CTD и взаимодействие CTD-специфических киназ с гистонами, влияющее на процессы ремоделирования хроматина и позиционирования нуклеосом, требует понимания роли CTD в транскрипции хроматина. Эти исследования предоставят ценную информацию о механизмах транскрипции хроматина и биогенезе мРНК.
Control of gene expression in eukaryotes relies on complex regulatory machinery dedicated to proper transcription by RNA Polymerase II (RNAPII). RNAPII-transcribed genes are covered by nucleosomes. A nucleosome consists of a protein core of basic histone proteins, around which the DNA is wound 1.65 times. The core is an octamer that comprises two copies of each of the core histones: H3, H4, H2A and H2B. The four proteins interact in an ordered manner during nucleosome assembly, giving rise to the modular nature of the nucleosome. The ordered disassembly of nucleosomes permits RNAPII to access the DNA, whereas nucleosomal reassembly impedes access, thus preventing transcription and mRNA synthesis. Chromatin modifications, chromatin remodellers, histone chaperones and histone variants regulate nucleosomal dynamics during transcription. The rate of transcription of nucleosome-covered genes in vivo is close to the rate observed on histone free DNA in vitro, however, even a single nucleosome can present a strong barrier for RNAPII in vitro. These observations raise questions about the nature of a nucleosomal barrier to transcription and about the mechanism by which it is overcome in vivo. Comparison of the transcription through a uniquely positioned mononucleosome by end-initiation, promoter initiation and assembled authentic RNAPII elongation complex suggests that the nucleosome-specific pausing is not similar in all these cases. Only promoter-initiated and assembled RNAPII ECs form the proper transcription “bubble” whereas the end-initiated RNAPII showed a characteristic 10 bp periodicity of pausing. A further analysis of transcription using authentic ECs comprising various forms of RNAPII would put insight into the mechanism of transcription through nucleosome. The mRNA transcription is accomplished by a fine-tuned interplay of RNAPII, chromatin remodeling complexes, RNA transcription factors and RNA processing factors. RNAPII uniquely possesses an extra C-terminal domain (CTD) on its largest subunit, Rpb1 comprising a repetitive Tyr1Ser2Pro3Thr4Ser5Pro6Ser7 with potential epigenetic (especially phosphorylations) modifications sites. Various roles have been proposed for this domain including functioning as a binding platform for other proteins involved in mRNA transcription, histone modifications, interactions with nucleic acids and displacement of nucleosomes. Different phosphorylation states predominate at each stage of transcription, and each preferentially binds a distinct set of factors. Different combinations of phosphorylated residues either recruit or repel factors that are essential for the activity of RNAPII in mRNA biogenesis. Thus, the CTD tail and its associated modifications are crucial to ensure effective initiation and elongation of RNAPII over a chromatin template. Various observations suggest the existence of a CTD-chromatin crosstalk during the transcription. Similar to the histone code, the existence of a CTD code has also been postulated, which describes mainly the formation of (either stable or transient) structures in histone tails or heptads of the CTD by posttranslational modifications to regulate the action of downstream effectors. In fact, specific examples show evidence for a linkage of the phosphorylation state of the RNAPII CTD (CTD-P) with the modification state of histone tails. The CTD and chromatin have an intimate spatial relationship during all stages of transcription. It will be, therefore, a challenging task to get a deeper insight into the relationship of these two structures and to uncover if chromatin-modifying processes can be instructed by the CTD and vice versa. The dual bromodomain-containing protein, BRD4, binds to acetylated tails of histones H3 and H4. BRD4 recruits P-TEFb (containing CDK9) and, thereby, induces CTD Ser2 phosphorylation. Disruption of the bromodomain-histone acetylation interaction by JQ1, a small-molecule bromodomain inhibitor, results in decreased BRD4 binding, reduced Ser2-P, and reduced gene expression. Inversely, histone-modifying enzymes (Set1 and Set2), are recruited by CTD-P marks to the transcription machinery. Ser5-P binds and recruits the H3K4 methyltransferase, Set1, to the CTD together with the PAF complex. Set1 trimethylates H3K4 of promoter-proximal histones and is a hallmark of activated genes. Downstream of promoters, Set1 dimethylates H3K4, and the H3K4me2 mark is involved in the recruitment of HDACs to chromatin. The small form of the histone deacetylase Rpd3, Rpd3S, is specifically recruited by the Ser5-P to actively transcribed genes. During active elongation, the doubly modified Ser2-P/ Ser5-P of CTD recruits Set2 complex to co-transcriptionally methylate chromatin at H3K36. It also recruits various histone chaperones (for example, Spt6 and the FACT complex) to facilitate the reassembly of nucleosomes. These factors are critical to the role that chromatin plays in transcription. Ser2-P and Ser5-P residues allow the recruitment of the PAF-Bre1-Rad1 complex to facilitate histone H2B ubiquitination. FACT facilitates the dissociation of a H2A/H2B dimer from the nucleosome. The nucleosomal structure of chromatin provides a natural barrier for RNAPII activity. Chromatin remodeling machines and modification of histone tails as well as CTD appears to fulfill critical tasks to allow RNAPII transcription through chromatin. The CTD serves to integrate multiple signaling pathways that globally affect gene regulation. The possible CTD-chromatin crosstalk during the transcription such as the interaction of histone methyl transferases with CTD and the interaction of CTD specific kinases to histone in affecting the chromatin remodeling and nucleosomal positioning demands an extensive characterization of the CTD role in the transcription and chromatin remodeling. These studies would provide valuable insight regarding the transcription through nucleosome and mRNA biogenesis.
Результатом проекта будет определение ролей различных участников реализации кода С-концевого домена РНКП II (CTD) в транскрипции хроматина. Взаимодействие гистонов и CTD, модифицированного в различной степени, будет описано в терминах скорости элонгации, структур ключевых интермедиатов и судьбы нуклеосом. В ходе проекта мы планируем исследовать состав транскрипционных комплексов, связанных с CTD, и выявить белки и белковые комплексы, функции которых в транскрипции в настоящий момент неизвестны или не связаны с взаимодействием CTD и гистонов. В результате успешной реализации проекта будут получены ответы на многие фундаментальные вопросы, а именно: 1) Как CTD РНКП II влияет на ремоделирование хроматина в ходе транскрипции и участвует в объединении нескольких сигнальных путей? 2) Какие изменения происходят в нуклеосомной структуре при транскрипции через хроматин РНКП II при том или ином уровне фосфорилирования CTD? 3) Каково время жизни ключевых структурных интермедиатов, образующихся во время транскрипции РНКП II при том или ином уровне фосфорилирования CTD? 4) Как модификации гистонов и присутствие гистоновых шаперонов и других идентифицированных белковых факторов влияют на транскрипцию через хроматин РНКП II при том или ином уровне фосфорилирования CTD? Основной целью проекта является более глубокое понимание механизмов ремоделирования хроматина при транскрипции. Точная регуляция транскрипции имеет решающее значение для клеточного развития, в то время как ошибочная регуляция часто связана с развитием рака и других заболеваний. Таким образом, дальнейший анализ способов регуляции и механизма транскрипции хроматина важен для лучшего понимания как фундаментальных, так и прикладных аспектов процесса. Понимание такой регуляции генов поможет определить и контролировать аномальное клеточное поведение при раке и других заболеваниях, и в конечном итоге способствовать разработке более целенаправленных стратегий их лечения.
Ранее сотрудниками российской лаборатории была разработана высокоочищенная система транскрипции in vitro с использованием позиционированных мононуклеосомных матриц и предложен ряд молекулярно-биологических методов для изучения механизмов транскрипции хроматина. С использованием предложенных подходов были получены уникальные данные, позволившие сформулировать концепцию «нуклеосомного цикла», и его роли в сохранении и изменении эпигенетического статуса клетки. Каким образом непосредственно РНКП II воздействует на нуклеосомы, чтобы осуществлялась эффективная транскрипция, в настоящий момент всё ещё остается не до конца изученным. Известно, что CTD принимает различные конформации в зависимости от состояния фосфорилирования, приводящего к связыванию и диссоциации факторов, необходимых для биогенеза мРНК. Хотя транскрипция in vitro возможна без CTD, однако биохимические исследования показали, что фосфорилированный CTD усиливает сплайсинг экзогенного субстрата, воздействуя на раннюю стадию сборки сплайсомы. Эти данные указывают на значимую роль фосфорилированного CTD даже в транскрипции in vitro, и вместе со структурным анализом CTD и его динамической подвижности, позволяют предположить, что CTD в его удлиненной конформации (из-за фосфорилирования) будет более стабильным и благоприятным для активной транскрипции. Мы проверили роль фосфорилированного (РНКП II O) и нефосфорилированного (РНКП II A) CTD в транскрипции in vitro. Была собрана мононуклеосома, и транскрипция была инициирована обеими формами РНКП II. Мы обнаружили значительное различие в транскрипции и эффективности удаления нуклеосом в случае РНКП II O по сравнению с РНКП II A. Кроме того, были проанализированы несколько белков, имеющих CTD-взаимодействующие домены, для определения специфичности их взаимодействия с CTD и функции в транскрипции.
Источник финансирования НИР
Этапы НИР
Прикрепленные к НИР результаты
Для прикрепления результата сначала выберете тип результата (статьи, книги, . ). После чего введите несколько символов в поле поиска прикрепляемого результата, затем выберете один из предложенных и нажмите кнопку "Добавить".
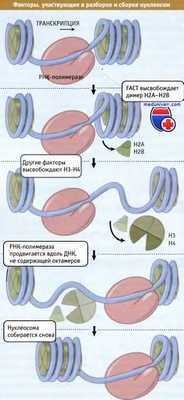
Механизм удаления гистонов с нуклеосом при транскрипции
• При транскрипции в модельных системах РНК-полимераза удаляет октамеры гистонов, однако после прохождения полимеразы они вновь связываются с ДНК
• При транскрипции гена происходит реорганизация нуклеосом
Эксперименты, предпринятые с целью выяснить, может ли РНК-полимераза осуществлять транскрипцию ДНК в составе нуклеосомы, показали, что в результате транскрипции происходит удаление октамера гистонов. На рисунке ниже представлены события, происходящие, когда РНК-полимераза фага Т7 in vitro транскрибирует короткий участок ДНК, содержащий октамер гистонов Коровая частица остается связанной с ДНК, но перемещается на другой участок. Наиболее вероятно, что коровая частица повторно связывается с той же молекулой ДНК, с которой она была связана раньше.
На рисунке ниже представлена модель, описывающая движение полимеразы. По мере того как фермент входит в пределы нуклеосомы, ДНК отходит от коровой частицы, но полимераза достигает точки, при которой нить ДНК направляется в обратную сторону и повторно присоединяется к ней, замыкая область. По мере дальнейшего продвижения полимеразы ДНК раскручивается, и в петле образуются положительные супервитки. Это может иметь серьезные последствия, поскольку замкнутая петля содержит только 80 пн, так что каждая пара оснований, которую проходит полимераза, является существенным добавлением к суперспирализации. Фактически полимераза легко проходит первые 30 пн в составе нуклеосомы.
Затем она начинает продвигаться медленнее и как будто испытывает возрастающие препятствия. Через каждые 10 пн наступает пауза, позволяющая предполагать, что структура петли накладывает определенные ограничения на вращение вокруг каждого витка ДНК. Когда полимераза достигает середины нуклеосомы (следующие основания, которые должны добавиться, находятся на оси диадной симметрии), пауз не возникает, и фермент начинает продвигаться быстрее. Это говорит о том, что середина нуклеосомы является точкой, к которой смещается октамер (вероятно, потому, что положительная суперспирализация достигла некоторого критического уровня, при котором октамер вытесняется с ДНК).
Это ослабляет напряжения в ДНК, существующие на пути полимеразы, и снимает препятствия к движению фермента. Октамер гистонов изменяет свое положение на ДНК, не теряя с ней контакта.
Высвобождается ли октамер гистонов в виде интактной частицы? В результате сшивок белков октамера не возникает препятствий для транскрипции. Транскрипция может происходить даже в том случае, когда между коровыми гистонами присутствуют сшивки. Это говорит о том, что транскрипция не требует диссоциации октамера на составляющие гистоны и вообще каких-либо существенных изменений его структуры. Однако при добавлении в систему гистона Н1 скорость транскрипции быстро снижается. Это позволяет прийти к двум заключениям: октамер гистонов (оставаясь на своем месте или смещаясь) функционирует как интактная единица; и может оказаться необходимым удалить Н1 из активного хроматина или каким-то образом изменить его взаимодействие с другими компонентами.
Таким образом, небольшая по размеру молекула РНК-полимеразы вызывает перемещение нуклеосомы, которая после прохождения фермента формируется снова. Конечно, в ядре эукариотической клетки ситуация более сложная. РНК-полимераза по размеру гораздо больше, и цепочка нуклеосом создает помехи на пути продвижения фермента. Для преодоления этих трудностей необходимо участие дополнительных факторов.
При транскрипции меняется организация нуклеосом. На рисунке ниже показано, что происходит при транскрипции дрожжевого гена URA3, находящегося под контролем индуцибельного промотора. Позиционирование нуклеосом определяли, используя микрококковую нуклеазу, расщепляющую ДНК по сайтам рестрикции на 5'-конце гена. Исходно в гене, на значительном расстоянии от промотора, присутствует нуклеосомная структура; в 3'-области их позиционирование теряется. Когда ген экспрессируется, то при электрофорезе наблюдается мазок ДНК. Таким образом, хотя нуклеосомы присутствуют, они не организованы. Это позволяет предположить, что транскрипция нарушает их позиционирование.
При репрессии гена, в пределах 10 мин начинает проявляться позиционирование нуклеосом (хотя и не полное). Этот результат позволяет сделать интересный вывод о том, что позиционирование нуклеосом не зависит от репликации.
Согласно общепринятой модели, РНК-полимераза по мере продвижения вдоль ДНК смещает октамеры гистонов. Если ДНК позади молекулы полимеразы оказывается доступной, то октамер с ней связывается. (По-видимому, октамер никогда не теряет контакт с ДНК. Остается только догадываться, каким образом он сохраняет его, не раскручиваясь и не теряя своих компонентов по мере продвижения по ДНК. Вероятно, создание контакта с РНК-полимеразой обеспечивает «двойной проход» октамера.) Если ДНК недоступна, например потому, что непосредственно за одной полимеразой следует другая, то октамер постоянно смещается, и ДНК постоянно находится в растянутой конфигурации.
Схема эксперимента по исследованию влияния транскрипции на нуклеосомы,
показывающая, что октамер гистонов покидает ДНК и связывается с другим ее участком. По мере своего продвижения РНК-полимераза вытесняет октамер гистонов.
ДНК снова начинает сворачиваться и связывается (с полимеразой или с октамером), образуя замкнутую петлю.
По мере продвижения полимеразы, она генерирует впереди положительные супервитки.
Супервитки вытесняют октамер гистонов, который сохраняет контакт с ДНК и/или полимеразой,
и занимает свое место за РНК-полимеразой. В гене URA3, до его транскрипции, нуклеосомы определенным образом позиционированы.
При индукции транскрипции позиции нуклеосом становятся случайными.
Когда происходит репрессия транскрипции, нуклеосомы снова позиционируются.Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Факторы удаления и сборки гистонов нуклеосом
• Для удаления октамеров при транскрипции с участием РНК-полимеразы и повторной сборки гистонов в нуклеосомы необходимо участие дополнительных факторов
Удаление нуклеосом с ДНК является ключевым моментом всех стадий транскрипции. Лучше всего этот процесс исследован на стадии инициации. Активные промоторы обладают сайтами с высокой чувствительностью к ДНКазе, поскольку октамеры гистонов были удалены с ДНК.
Удаление октамеров требует реконструкции комплексов, которые набираются, комплектуются с помощью транскрипционных факторов и которые используют энергию, поставляемую при гидролизе АТФ для того, чтобы изменить структуру хроматина. Это означает, что РНК-полимераза начинает синтез на коротком отрезке ДНК, свободном от нуклеосом.
Для того чтобы синтез РНК продолжался дальше, октамеры гистонов должны быть удалены. Затем, чтобы не допустить появления не закрытой белком ДНК, октамеры должны собраться вновь в ходе транскрипции.
Транскрипция РНК-полимеразой II in vitro требует участия белка, который называется FACT и который по свойствам напоминает фактор элонгации транскрипции. (FACT представляет собой аббревиатуру от "facilitates chromatin transcription» и не является частью РНК-полимеразы, хотя специфическим образом связывается с ней в фазе элонгации.) Этот фактор состоит из двух субъединиц, имеющих общую структуру у всех эукариот, Он связан с хроматином активных генов.
При добавлении FACT к изолированным нуклеосомам они теряют димеры Н2А-Н2В. При транскрипции in vitro фактор превращает нуклеосомы в «гексасомы», у которых отсутствуют димеры Н2А-Н2В. Это позволяет считать FACT частью механизма, ответственного за удаление октамеров при транскрипции. Белок также может участвовать в сборке нуклеосом после транскрипции, поскольку он способствует их образованию из коровых гистонов.
На рисунке ниже представлена модель, описывающая удаление Н2А-Н2В из нуклеосомы под действием FACT, происходящее впереди РНК-полимеразы, и затем добавление их к нуклеосоме, формирующейся позади фермента. Для завершения процесса могут понадобиться и другие факторы. Также FACT необходим для осуществления других процессов, при которых происходит удаление нуклеосом, например таких, как репликация и репарация ДНК.
Для поддержания структуры хроматина в других транскрибируемых регионах требуются другие факторы. Вероятно, они также принимают участие в процессах разборки-сборки нуклеосом, но мы не располагаем более подробной информацией об их функциях.
![Факторы разборки-сборки нуклеосом]()
Разборка октамеров гистонов, необходимая для удаления нуклеосом, происходит до начала транскрипции.
После окончания транскрипции октамеры собираются снова. Процесс разборки, по-видимому, начинается с высвобождения димера Н2А-Н2В гистонов.• При репликации не сохраняются октамеры гистонов, однако димеры Н2А-Н2В и тетрамеры Н32-Н42 сохраняются
• Существуют различные и независимые от репликации пути сборки нуклеосом при репликации
• Для облегчения процесса сборки нуклеосом требуются дополнительные белки
• CAF-1 представляет собой белок сборки, связанный с PCNA субъединицей реплисомы. Этот белок необходим для поддержания тетрамеров Н32-Н42 после репликации
• Для сборки, независимой от репликации, может использоваться другой белок сборки и вариантная форма гистона Н3
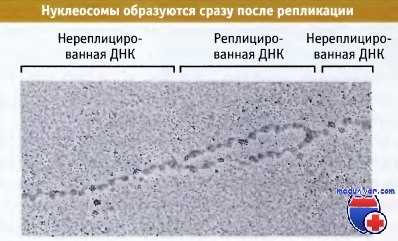
При репликации происходит разделение цепей ДНК, и при этом структура нуклеосомы неизбежно должна нарушаться. Репликативная вилка обладает характерной структурой. Она более устойчива к микрококковой нук-леазе и при ферментативной обработке дает полосы, по размеру отличающиеся от ДНК нуклеосом. Область с такой измененной структурой находится в непосредственной близости от репликативной вилки. Это позволяет считать, что в репликации ДНК участвует крупный белковый комплекс, причем по мере его продвижения за ним довольно быстро реформируются нуклеосомы. Это иллюстрируется на микрофотографии, на которой показан участок недавно реплицированной ДНК, уже упакованный в нуклеосомы на обоих дочерних дуплексных сегментах.
Поэтому биохимический анализ и непосредственные наблюдения над репликативной вилкой позволяют считать, что нарушение структуры нуклеосом ограничено коротким участком, находящимся рядом с вилкой. При росте вилки нуклеосомы разрушаются, однако по мере продвижения вилки они очень быстро образуются на дочерних дуплексах. Фактически сборка нуклеосом прямо связана с реплисомой, где происходит репликация ДНК.
Каким образом гистоны связываются с ДНК, образуя нуклеосомы? Образуют ли гистоны вначале октамер белков, вокруг которого впоследствии оборачивается ДНК? Или же октамер собирается на ДНК из свободных гистонов? На рисунке ниже показано, что, в зависимости от конкретных условий, in vitro могут использоваться две схемы сборки нуклеосом. Согласно первой схеме, с ДНК связывается уже сформированный октамер. Вторая схема предполагает, что вначале образуется тетрамер Н32-Н42, к которому затем добавляются два димера Н2А-Н2В. Обе схемы имеют отношение к процессам, происходящим in vivo. Первая отражает способность хроматина к перестройке, которая обеспечивается движением октамера гистонов по ДНК. Вторая схема соответствует событиям, происходящим при репликации.
![Нуклеосомы]()
Реплицирующаяся ДНК сразу же включается в состав нуклеосом.
Связыванию гистонов с ДНК способствуют дополнительные белки. Эти белки можно идентифицировать в экстрактах, участвующих в сборке гистонов и экзогенной ДНК в нуклеосомы. Дополнительные белки могут выполнять роль «молекулярных шаперонов», которые связываются с гистонами, чтобы контролировать связывание индивидуальных гистонов или их комплексов (Н32-Н42 или Н2А-Н2В) с ДНК. Это может оказаться необходимым, поскольку гистоны, являясь основными белками, вообще проявляют высокое сродство к ДНК. При таком взаимодействии гистоны образуют нуклеосомы, минуя промежуточные продукты (т. е. не участвуя в образовании других компактных комплексов, которые могут возникать при их связывании с ДНК).
Предложена система, позволяющая воспроизвести процесс сборки нуклеосом при репликации. Эта система использует экстракты клеток человека, которые реплицируют ДНК SV40 и осуществляют сборку хроматина. Сборка преимущественно происходит на реплицирующейся ДНК. Неообходимо присутствие дополнительного фактора, CAF-1, состоящего из > 5 субъединиц, с общей массой 238 кДа. Этот фактор попадает в область репликативной вилки под действием PCNA, который является процессивным фактором ДНК полимеразы. Таким образом обеспечивается связь между репликацией ДНК и сборкой нуклеосом, причем сборка происходит сразу же после завершения репликации.
CAF-1 стехиометрически связывается с вновь синтезированными Н3 и Н4. Это позволяет предполагать, что при сборке новых нуклеосом вначале образуется Н32-Н42 тетрамер, к которому затем добавляются Н2А-Н2В димеры. Образующиеся in vitro нуклеосомы характеризуются длиной повтора 200 пн, хотя и не имеют Н1 гистона. Это позволяет предполагать, что надлежащее расположение нуклеосом может обеспечиваться и без участия гистона Н1.
При репродукции хроматина происходит репликация релаксированной ДНК, уже связанной с нуклео-сомами. При этом образуются два дочерних дуплекса. Что происходит в этот момент с предсуществующими нуклеосомами? Диссоциирует ли октамер гистонов на свободные белки, которые потом утилизируются, или же гистоны остаются связанными? Ответить на этот вопрос можно, выращивая клетки в среде, содержащей тяжелые (меченные дейтерием) аминокислоты, и переводя их на среду с легкими аминокислотами непосредственно перед репликацией. При последующем использовании сшивающих агентов можно выяснить, входят ли в белки октамера только один или оба типа аминокислот. Полученные результаты позволяют предполагать, что перед репликацией происходит смешивание гистонов, синтезированных до репликации, с синтезированными при репликации гистонами. Это говорит в пользу по крайней мере частичной диссоциации и реассоциации компонентов октамера.
Процесс сборки и разборки нуклеосом трудно охарактеризовать детально, однако на рисунке ниже представлена наша рабочая модель. Репликативная вилка смещает октамер гистонов, который диссоциирует на Н32-Н42 тетрамер и Н2А-Н2В димер. Эти «старые» тетрамеры и димеры поступают в общий пул, который также содержит «новые» тетрамеры и димеры, собранные из ново-синтезированных гистонов. Нуклеосомы собираются на расстоянии примерно 600 пн за репликативной вилкой. Сборка начинается, когда Н32-Н42 тетрамеры связываются с каждым из дочерних дуплексов, при участии дополнительного белка CAF-1. Затем два димера Н2А-Н2В связываются с каждым Н32-Н42 тетрамером и образуют полный октамер гистонов. Сборка тетрамеров и димеров носит случайный характер по отношению к утилизации «старых» и «новых» субъединиц. Это объясняет, почему в октамере смешаны «старые» и «новые» гистоны. Возможно, что нуклеосомы разрушаются и собираются аналогичным образом и при транскрипции.
В клетках эукариот, находящихся в S-фазе (т. е. в периоде репликации ДНК), дупликация хроматина требует синтеза большого количества гистонов для упаковки всего генома — фактически должно быть синтезировано такое же количество гистонов, которое уже содержится в нуклеосомах. Синтез гистоновой иРНК находится под контролем клеточного цикла и сильно увеличивается в S-фазе. Схема сборки хроматина в S-фазе из равной смеси старых и новых гистонов носит название пути, связанного с репликацией (RC).
Другой путь называется независимым от репликации (RI) и используется при сборке нуклеосом в остальные фазы клеточного цикла, вне синтеза ДНК. Использование этого пути становится необходимым при возникновении повреждений в ДНК или при смещении нуклеосом в результате транскрипции. Очевидно, в этом случае процесс сборки должен отличаться от пути RC, поскольку он не связан с репликативным аппаратом. Одна из наиболее интересных особенностей пути, независимого от репликации, заключается в том, что в нем участвуют различные варианты некоторых гистонов из числа тех, которые используются при репликации.
Н3.3 вариант отличается от консервативного гистона Н3 положением четырех аминокислот. В дифференцирующихся клетках, в которых не происходит репликации ДНК, этот вариант гистона постепенно замещает гистон Н3. Это происходит в результате сборки новых октамеров гистонов взамен тех, которые в силу разных причин были удалены из структуры хроматина. Механизм использования Н3.3 в независимом от репликации пути в двух исследованных случаях оказался различным.
Использование гистонов организмом простейшего Tetrahymena определяется исключительно их доступностью. Гистон Н3 синтезируется только в клеточном цикле, вариант этого гистона — только в неделящихся клетках. Однако у Drosophila существует механизм, обеспечивающий использование Н3.3 по схеме RI. Новые нуклеосомы, содержащие Н3.3, собираются на месте транскрипции, предположительно замещая нуклеосомы, смещенные РНК полимеразой. В процессе сборки гистоны Н3 и Н3.3 распознаются по структуре, и Н3 в сборке не участвует. Наоборот, при сборке по пути RC используются оба варианта гистона Н3 (хотя Н3.3 доступен в гораздо меньших количествах, чем Н3, и поэтому входит только в небольшое количество нуклеосом).
По-видимому, белок CAF-1 не участвует в сборке по схеме RI. (Также в таких организмах, как дрожжи и Arabidopsis, ген, кодирующий этот белок, не играет существеной роли, что позволяет предполагать существование альтернативных процессов сборки по схеме RC.) Белок, возможно участвующий в сборке по пути RI, называется HIRA. Исключение этого белка из бесклеточной системы сборки нуклеосом приводит к ингибированию их образования на нереплицирующейся, но не на реплицирующейся ДНК. Это является свидетельством того, что оба пути действительно используют различные механизмы сборки хроматина.
Сборка нуклеосом, содержащих альтернативный вариант гистона Н3, происходит также на центромерах. В ходе репликативной фазы клеточного цикла ДНК центромеры реплицируется рано (в противоположность окружающим гетерохроматиновым последовательностям, которые реплицируются позже. Включение Н3 в центромерную область подавляется, и вместо него у высших эукариот включается белок, называемый CENP-A (у Drosophila он называется Cid, а у дрожжей Cse4p). Это происходит с участием RI-пути сборки, что связано с блокировкой пути RC в течение короткого промежутка времени, пока реплицируется ДНК центромеры.
In vitro ДНК может или непосредственно взаимодействовать с интактным (сшитым) октамером гистонов,
или связываться с Н32-Н42 тетрамером, после чего к комплексу добавляются Н2А-Н2В димеры гистонов. При движении репликативной вилки октамеры гистонов удаляются с ДНК.
Они диссоциируют на тетрамеры Н3-Н4 и димеры Н2А-Н2В. Вновь синтезированные гистоны собираются в Н33-Н4 тетрамеры и Н2А-Н2В димеры.
Предсуществующие и вновь образованные тетрамеры и димеры собираются с помощью белка CAF-1 случайным образом;
при этом новые нуклеосомы образуются непосредственно за репликативной вилкой.Структура ДНК нуклеосом
• Вокруг октамера гистонов обернуто 1,65 витка ДНК
• Структура ДНК изменяется таким образом, что на среднюю ее часть приходится максимальное количество оснований на виток, а на концах это значение оказывается ниже
• При изменении с 10,5 пн/виток в ДНК в растворе до 10,2 на поверхности нуклеосом, теряется около 0,6 отрицательных супервитка, что объясняет парадокс коэффициента зацепления
Расположение ДНК на поверхности нуклеосомы объясняет, почему она подвержена действию некоторых нуклеаз. Особенно информативна обработка нуклеазами, действующую на одну цепь ДНК. Эти нуклеазы (например, ДНКаза I) образуют разрывы в одной из цепей ДНК; при этом вторая цепь остается интактной, и поэтому в двухцепочечной структуре дефекты не проявляются. Однако при денатурации вместо протяженных высвобождаются короткие фрагменты ДНК. Если ДНК на концах была помечена, то концевые фрагменты можно идентифицировать методом радиоавтографии.
Когда ДНК присутствует в растворе в свободном виде, то она атакуется нуклеазами в случайных местах. ДНК, которая находится на нуклеосомах, также подвергается действию ферментов, но разрывы возникают на определенных расстояниях друг от друга. Если ДНК пометить, обработать нуклеазой, а затем денатурировать и подвергнуть электрофорезу, то получается лесенка подобно изображенной на °ис.
Расстояние между ступеньками этой лесенки составляет 10-11 оснований. Лесенка распространяется на все расстояние, которое занимает коровая ДНК. Разрывы нумеруются, начиная с S1 по S13 (где S1 отстоит примерно на 10 оснований от меченного 5'-конца, S2 на 20 оснований, и т. д.).
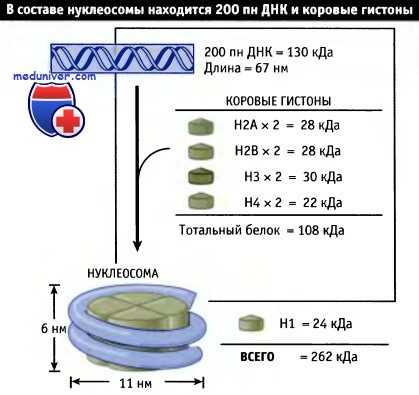
![Нуклеосома]()
Нуклеосомы состоят из примерно одинаковых количеств ДНК и гистонов (включая гистон Н1).
Рассчетная маса нуклеосомы составляет 262 кДаНе все сайты с одинаковой эффективностью атакуются ферментом: некоторые расщепляются довольно быстро, а в других разрывы образуются с трудом. ДНКаза I и ДНКаза II дают одинаковую лесенку, хотя интенсивность полос несколько различается. Это свидетельствует о том, что характер деградации ДНК определяется расположением соответствующих сайтов, которое зависит от организации ДНК и лишь в незначительной степени от сродства фермента к сайту. Такой же характер деградации ДНК обнаруживается при атаке гидроксил-радикалом.
Это позволяет предполагать, что он определяется структурой самой ДНК, а не нуклеотидным составом. Отсутствие расщепления по некоторым сайтам является следствием существования определенной структуры нуклеосомы, из-за которой некоторые участки ДНК оказываются недоступными для фермента.
Поскольку в состав коровой частицы входят две цепочки ДНК, метятся оба 5'- (или 3'-) конца, по одному в каждой цепи. Таким образом, при обработке нуклеазами образуются фрагменты обеих цепей. Это иллюстрируется рис. 6.36, где каждый меченный фрагмент происходит из различной цепи. В результате, в таком эксперименте каждая меченная полоса фактически представлена двумя фрагментами, отрезанными на одном и том же расстоянии от любого из меченных концов.
Каким же образом можно тогда объяснить дискретное предпочтение определенных сайтов? Считается, что путь ДНК вдоль частицы симметричен (по отношению к горизонтальной оси, проходящей через нуклеосому). Таким образом, если, например, после обработки ДНКазой I не образуется фрагмент в 80 пн, это должно означать, что положение, соответствующее 80-му основанию с 5'-конца любой из цепей, не чувствительно к ферменту.
Когда ДНК иммобилизована на плоской поверхности, сайты нарезаются в соответствии с определенным расстоянием между точками расщепления. Рисунок ниже позволяет предполагать, что периодичность разрезания соответствует структурной периодичности, присущей В-форме ДНК (классической двуспиральной структуре В-типа, предложенной Уотсоном и Криком). Периодичность разрезания (расстояние между точками расщепления) действительно соответствует структурной периодичности (числу пар на виток двойной спирали).
Таким образом, расстояние между точками расщепления соответствует числу нуклеотидных пар, приходящемуся на виток. Соответствующие измерения показывают, что среднее значение для двухспиральной В-формы ДНК составляет 10,5 пн на виток.
Какова природа участков-мишеней на нуклеосоме? Рисунок ниже иллюстрирует данные, согласно которым в каждом сайте разрезания существуют 3-4 положения, в которых может произойти разрез, т. е. сайт разрезания определяется с точностью ±2 пн. Иными словами, сайт разрезания представляет собой короткий отрезок в обеих цепях, на 3-4 пары оснований открытый для действия нуклеазы. Относительная интенсивность разрезания указывает на то, что некоторые положения оказываются предпочтительнее других.
На основании полученной картины можно рассчитать «среднюю» точку разрезания. Пары сайтов S1-S4 и S10-S13, лежащие на концах ДНК, находятся на расстоянии 10,0 оснований друг от друга. Сайты от S4 до S10, расположенные в ДНК в центре частицы, разделены 10,7 оснований. (Поскольку мы анализируем среднее положение, сайты оказываются разделены не целым числом оснований.)
Вариабельность в периодичности разрезания коровой ДНК (10,0 на концах и 10,7 в середине молекулы) означает, что существует вариабельность в ее структурной периодичности. ДНК, находящаяся в середине частицы содержит больше, а находящаяся на концах меньше пн на виток, чем ДНК в растворе. Средняя периодичность на нуклеосому составляет только 10,17 пн на виток, что существенно меньше, чем 10,5 пн приходящихся на виток ДНК в растворе.
На основании кристаллической структуры коровой частицы можно предполагать, что ДНК организована в плоскую суперспираль, которая образует 1,65 витка вокруг октамера гистонов. Шаг суперспирали варьирует, и в середине имеется перерыв. Области перегибов расположены симметрично и находятся в положениях ±1 и ±4. Это соответствует сайтам S6 и S8 и S3 и S11, которые наименее чувствительны к ДНКазе I.
Структура нуклеосомной коровой частицы показывает, каким образом искажается структура ДНК. Большая часть суперспиральной структуры приходится на центральный район в 129 пн, в котором находится 1,59 левых суперспиральных витка диаметром 80 А (лишь в 4 раза превышающим диаметр самого дуплекса ДНК). Концевые терминальные последовательности вносят лишь небольшой вклад в общую кривизну.
Центральные 129 пн находятся в В-форме, но существенно деформированы, что необходимо для образования суперспирали. Большая канавка согнута плавно, однако маленькая изогнута с резкими изгибами. Эти конформационные изменения объясняют, почему центральная часть нуклеосомной ДНК не связывается с регуляторными белками. Последние обычно связываются с терминальными участками коровой ДНК или с линкер-ной последовательностью.
ДНК располагается на поверхности нуклеосомы таким образом, что при удалении белков, вызывающих конформационные ограничения, образуется 1 отрицательный супервиток. Однако длина ДНК на нуклеосоме соответствует 1,67 супервитку. Это расхождение иногда называют парадоксом коэффициента зацепления.
Расхождение объясняется существованием различия между, в среднем, 10,17 пн на виток в нуклеосомной ДНК и 10,5 пн на виток в свободной ДНК. В нуклеосоме на 200 пн приходится 200/10,17 = 19,67 витков. Когда ДНК высвобождается из нуклеосомы, получается 200/10,5 = 19,0 витков. Менее плотно скрученная ДНК на нуклеосоме занимает -0,67 витка, что объясняет разницу между фактическим (-1,67) и измеренным (-1,0) числом супервитков. Фактически, некоторая часть деформации кручения в нуклеосомной ДНК расходуется на увеличение количества пн/виток; лишь оставшаяся часть воспринимается как суперспираль.
Разрывы в цепях ДНК можно обнаружить по появлению фрагментов после денатурации ДНК, приводящей к образованию одноцепочечных форм.
Если ДНК содержала метку, например, на 5'-конце, то при авторадиографии будут видны только 5'-фрагменты.
Размер фрагмента определяется расстоянием от разрыва до положения метки. Исследование фрагментов переваривания ядер с помощью ДНКазы I показывает,
что разрывы коровой ДНК образуются через регулярные интервалы. Наиболее чувствительные к нуклеазе сайты ДНК располагаются с периодичностью,
отражающей структуру двойной спирали (для ясности показаны сайты только одной цепи). Методом электрофореза с высоким разрешением показано,
что каждый сайт атаки ДНКазы I состоит из нескольких чувствительных фосфодиэфирных связей.
Это следует из рисунка, на котором представлены фрагменты ДНК после ДНКазной обработки коровых частиц с концевым мечением ДНК.
Атака фермента происходила по сайтам S4 и S5. Два витка ДНК на нуклеосоме расположены близко друг к другу. Нуклеосома может представлять собой цилиндр,
снаружи которого располагаются два витка ДНК. Последовательности ДНК, локализованные на разных витках,
на нуклеосоме могут располагаться близко друг к другу.Читайте также:
- Профилактика и лечение нейрокардиогенного обморока (вазовагального синдрома)
- Симптомы хронического паротита и его лечение
- Локтевой сустав, articulatio cubiti. Внешние ориентиры локтевого сустава. Проекция суставной щели локтевого сустава. Строение локтевого сустава. Капсула локтевого сустава.
- Параганглиома глазницы (хемодектома глазницы): признаки, гистология, лечение, прогноз
- Контроль перехода метафазы в анафазу кинетохорами