Метахроматическая лейкодистрофия на МРТ головного мозга
Добавил пользователь Skiper Обновлено: 30.01.2026
Метахроматическая лейкодистрофия у детей, подростков и взрослых
Метахроматическая лейкодистрофия - это нарушение метаболизма миелина наследуется по аутосомно-рецессивному типу и характеризуется снижением активности арилсульфатазы А. Идентифицировано несколько мутаций в гене, кодирующем арилсульфатазу А Ген локализован на хромосоме 22ql3-13qter. Разработана ДНК-диагностика заболевания. Отсутствие или дефицит арилсульфатазы А приводит к накоплению сульфатида цереброзида в миелиновых оболочках в пределах центральной и периферической нервной системы, что вызвано невозможностью отщепления сульфата от галактозил-3-сульфат церамида.
Считается, что избыточное накопление сульфатида цереброзида вызывает распад миелина и деструкцию олигодендроглии. Разработана пренатальная диагностика метахроматической лейкодистрофии, основанная на определении арилсульфатазы А в ворсинах хориона или в культуре клеток амниотической жидкости. Окраска срезов тканей крезилом фиолетовым вызывает метахроматическое окрашивание сульфатидных гранул, этот феномен лежит в основе названия заболевания.
Группа метахроматических лейкодистрофии включает шесть заболеваний, которые классифицируется в соответствии с возрастом пациентов в дебюте болезни и ферментным дефицитом. Ниже представлены короткие описания трех из этих заболеваний: классическая, или поздняя, младенческая, ювенильная и взрослая лейкодистрофия.
Поздняя младенческая метахроматическая лейкодистрофия характеризуется постепенным малозаметным началом с нарушения походки в возрасте 1-2 лет. В начале ребенок выглядит неловким и часто падает, однако способность к передвижению постепенно значительно нарушается и пациент нуждается в поддержке при ходьбе. Выявляется гипотония мышц конечностей, глубокие сухожильные рефлексы отсутствуют или снижены. В последующие несколько месяцев ребенок теряет способность стоять, снижение интеллекта становится выраженным.
Характерна нечеткая речь, дизартрия, ребенок выглядит вялым и апатичным. Зрительная фиксация нарушена, выявляется нистагм, на глазном дне — атрофия диска зрительного нерва. В течение 1 года после дебюта заболевания ребенок теряет способность сидеть самостоятельно, отмечается прогрессирующая декортикационная ригидность. Прием пищи и глотание нарушены вследствие псевдобульбарного паралича, необходимо наложение гастростомы для кормления ребенка. На конечной стадии заболевания развивается ступор, пациенты умирают от аспирации или бронхопневмонии в возрасте 5-6 лет. Нейрофизиологические методы исследования выявляют прогрессирующее изменение ВП (ЗВП, слуховых ВП ствола, ССВП) и значительное снижение скорости проведения возбуждения по периферическим нервам.
На КТ и МРТ головного мозга диффузное симметричное снижение плотности белого вещества в мозжечке и полушариях мозга, в СМЖ повышен уровень белка. Трансплантация костного мозга — перспективный метод лечения поздней младенческой метахроматической лейкодистрофии. Эффективность трансплантации отмечена только при ее проведении на ранней стадии заболевания. В настоящее время небольшое число пациентов и слишком короткий период катамнестического наблюдения не позволяют сделать заключение об эффективности трансплантации костного мозга в лечении этого заболевания.
Ювенильная метахроматическая лейкодистрофия по многим признакам напоминает позднюю младенческую форму, однако заболевание начинается позже — в возрасте 5-10 лет. Первыми его признаками могут служить снижение школьной успеваемости и личностные нарушения. Затем появляются нарушение координации при ходьбе, недержание мочи и дизартрия. Отмечается повышение мышечного тонуса, возможны атаксия, дистония или тремор. В терминальной стадии развиваются генерализованные тонико-клонические приступы, трудно контролируемые на фоне .антиэпилептической терапии. Пациенты редко переживают средний подростковый возраст.
Взрослая форма метахроматической лейкодистрофии дебютирует на 2-6-м десятилетии жизни. Основные клинические проявления — нарушение памяти, психические нарушения и личностные изменения. Медленно прогрессируют такие неврологические нарушения, как спастичность, дистония, атрофия зрительных нервов и генерализованные судороги; в терминальной стадии пациенты прикованы к постели, характерны декортикационная поза и отсутствие реакции на окружающую среду.
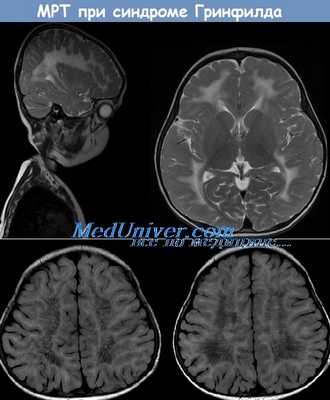
МРТ при метахроматической лейкодистрофии детей - синдроме Гринфилда
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лейкодистрофия
Лейкодистрофия — нейродегенеративное заболевание, обусловленное наследственным нарушением обмена веществ с накоплением в головном и спинном мозге метаболитов, провоцирующих разрушение миелина. Манифестирует в основном в детском возрасте задержкой психомоторного развития, двигательными расстройствами, поражением зрительных и слуховых нервов, гидроцефалией, эпилептическими приступами. Диагностируется лейкодистрофия по данным неврологического статуса, анамнеза, генетических исследований, МРТ или КТ картины головного мозга, биохимических анализов. Лечение симптоматическое. При раннем выявлении и медленном прогрессировании возможна трансплантация пуповинной крови или костного мозга.
МКБ-10
Общие сведения
Лейкодистрофия получила свое название в связи с поражением белого вещества мозга (с греческого leukos — белый). Различают около 60 разновидностей лейкодистрофии, определяющихся видом генной аномалии и возрастом манифестации клинических проявлений. Наряду с отдельными воспалительными поражениями ЦНС (например, лейкоэнцефалитом Шильдера) лейкодистрофия относится к синдрому диффузного склероза мозга. При этом доминирующее поражение миелина сближает ее с демиелинизирующими заболеваниями (рассеянным склерозом, РЭМ и пр.), а отдельные формы можно отнести к липидозам.
К основным формам лейкодистрофии относятся метахроматическая, суданофильная, глобоидно-клеточная, дегенерация Ван-Богарта-Бертрана, болезнь Александера, вариант Галлервордена-Шпатца. Наиболее распространены первые 3 вида лейкодистрофии. Их встречаемость колеблется от 0,4 до 1 случая на 100 тыс. новорожденных. Ряд форм лейкодистрофии являются настолько редкими, что в мировой литературе по неврологии описано всего несколько сотен их клинических наблюдений. В зависимости от возрастного периода, в котором дебютирует лейкодистрофия, каждая ее форма может подразделяться на инфантильный, поздний инфантильный, ювенильный и взрослый вариант.
Причины возникновения лейкодистрофии
В своей основе каждая лейкодистрофия имеет генетическую аномалию определенного фермента. Вид аномалии и локализация генной мутации пока установлены лишь для наиболее встречающихся форм патологии. В большинстве случаев лейкодистрофия имеет аутосомно-рецессивный путь наследственной передачи, однако отдельные ее формы могут наследоваться сцеплено с полом. Кроме того, не одиноки случаи спонтанных мутаций. Генетически детерминированный энзимный дефект ведет к обменным нарушениям (чаще в метаболизме липидов) с отложением определенного метаболита в нервных структурах и отдельных соматических органах, в первую очередь в печени и почках.
Следствием метаболической аномалии является разрушение миелина оболочек нервных стволов и проводящих путей, гибель нейронов с замещением их разрастающейся глиальной тканью. Морфологически лейкодистрофия характеризуется диффузными и симметрично расположенными в полушариях головного мозга зонами гибели миелина, скоплением продуктов миелинового распада, усиленной пролиферацией глии. В отдельных нозологических вариантах лейкодистрофия имеет специфическую морфологическую картину — метахроматическое или суданофильное окрашивание продуктов миелинового распада, скопление в зонах демиелинизации глобоидных клеток и т. п.
Симптомы лейкодистрофии
В большинстве случаев лейкодистрофия дебютирует в раннем детском возрасте. Новорожденные, как правило, выглядят здоровыми. Определенный период они нормально развиваются, а затем постепенно возникают различные неврологические симптомы, отличающиеся неуклонным прогрессированием. Скорость нарастания симптомов тем выше, чем раньше манифестировала лейкодистрофия. Ведущими проявлениями выступают прогрессирующая олигофрения, ухудшение зрения, тугоухость, эписиндром, спастические парезы. Первыми симптомами лейкодистрофии могут быть атаксия, мышечно-тонические расстройства (гипо- или гипертонус, мышечные подергивания), экстрапирамидные проявления, изменения поведения. Затем возникают эпиприступы, бульбарные проявления, снижается слух и зрение, отмечается интеллектуальное снижение с постепенной утратой ранее приобретенных навыков. Сенсорные расстройства не характерны. На поздних этапах развития болезни наблюдаются параличи, выраженная олигофрения, грубое расстройство глотания, амавроз, глухота. В терминальной фазе обычно отмечается децеребрационная ригидность.
Виды лейкодистрофии
Метахроматическая лейкодистрофия в зависимости от манифестации имеет 4 варианта. Врожденный вариант дебютирует в первые 1-3 мес. жизни задержкой развития и судорожным синдромом; дети не достигают возраста 1 года. Позднедетский вариант метахроматической лейкодистрофии начинается в период от 1 до 3 лет с мышечной гипотонии и слабости, атаксии, задержки психического развития (ЗПР). Затем формируется спастическая тетраплегия, афазия, псевдобульбарный синдром. В редких случаях пациенты доживают до 10-летнего возраста. Ювенильный вариант манифестирует в 4-6 лет и длится в среднем 7 лет. Взрослый вариант дебютирует в третьей декаде жизни, иногда позднее, продолжительность жизни пациентов от начала клиники варьирует в пределах 10-20 лет.
Суданофильная лейкодистрофия наследуется сцеплено с Х-хромосомой и имеет несколько разновидностей. Лейкодистрофия Пелицеуса-Мерцбахера может стартовать на 1-ом году жизни или в 3-4 года. Первым признаком является крупноразмашистый нистагм, позже возникает ЗПР, мозжечковая атаксия, гиперкинезы, парезы. Наибольшее прогрессирование происходит в возрасте до 10 лет, затем заболевание принимает замедленное течение с длительными ремиссиями. Пациенты могут жить до зрелого возраста. Адренолейкодистрофия — вариант, при котором лейкодистрофия сочетается с надпочечниковой недостаточностью. Характеризуется прогрессирующим течением с летальным исходом спустя 6-8 лет от начала клиники.
Глобоидно-клеточная лейкодистрофия (болезнь Краббе) — липоидоз с накоплением в очагах демиелинизации галактоцереброзида и образованием больших округлых глобоидных клеток. Раннедетский вариант развивается в первом полугодии жизни с гипервозбудимости и периодической гипертермии, задерживается психомоторное развитие, нарастает тонус мышц, затем развивается спастический тетрапарез, олигофрения, эписиндром, возможен опистотонус. В годовалом возрасте наступает летальный исход. Позднедетский вариант более редкий, манифестирует ухудшением зрения.
Спонгиозная дегенерация Ван-Богарта-Бертрана характеризуется эписиндромом, гиперсомнией, выраженной гидроцефалией с увеличением размеров головы, вызывающей амавроз атрофией зрительных нервов. Резкая внутричерепная гипертензия приводит к расхождению черепных швов, регистрируемому при рентгенографии черепа. Пациенты с этой формой лейкодистрофии погибают до 3-летнего возраста.
Болезнь Александера (лейкодистрофия с волокнистой формацией) обусловлена мутацией гена, ответственного за синтез GFAP белка. В результате происходит накопление в клетках глии аномального GFAP белка, содержащего волокна Розенталя. Неонатальный вариант имеет тяжелое течение с летальным исходом к концу 1-го года. Инфантильный вариант встречается примерно в половине случаев, проявляется в первые 1-2 года жизни ЗПР, затем присоединяются спастические парезы, атаксия, гидроцефалия. Дети погибают спустя несколько лет. Ювенильная лейкодистрофия Александера дебютирует в период от 4-х до 10-летнего возраста, протекает с преимущественно стволовой симптоматикой. Продолжительность жизни колеблется в пределах 10-30 лет. Взрослый вариант отличается поздней манифестацией и относительно медленным течением в пределах 10 и более лет.
Лейкодистрофия Галлервордена-Шпатца чаще всего стартует в 10-летнем возрасте. Проявляется дисфункцией стриопаллидарной системы, затем на фоне гиперкинезов прогрессирует тетрапарез, развивается гемералопия и пигментный ретинит, наблюдается снижение интеллекта, возникают эпиприступы.
Диагностика лейкодистрофии
Диагностический поиск требует привлечения ряда специалистов: невролога, педиатра, медицинского генетика, для диагностики расстройств зрения и слуха — отоларинголога и офтальмолога. Важное значение имеет изучение анамнеза болезни (возраст и симптомы дебюта, последовательность развития клиники) и семейного анамнеза (наличие лейкодистрофии у родственников). Нейросонография через родничок и эхо-энцефалография у пациентов более старшего возраста, как правило, выявляет повышение интракраниального давления. Лейкодистрофия сопровождается существенным увеличением концентрации белка, обусловленным разрушением церебральных клеток, что определяется при исследовании цереброспинальной жидкости.
С целью диагностики вида метаболической аномалии проводится целый ряд биохимических тестов с определением уровня ферментов и накапливающихся метаболитов. Очаги демиелинизации хорошо визуализируются при помощи МРТ, могут быть обнаружены и на КТ головного мозга. Обычно демиелинизация видна на МРТ головного мозга еще до клинической манифестации лейкодистрофии. Благодаря развитию генетики, лейкодистрофия имеет разработанную ДНК-диагностику, а отдельные ее формы (метахроматическая, адренолейкодистрофия, глобоидно-клеточная) — возможность пренатального диагностирования.
Лечение лейкодистрофии
На сегодняшний день лейкодистрофия не имеет эффективных способов терапии, позволяющих купировать прогрессирование симптомов. Проводится симптоматическое лечение — в основном дегидратационная и антиконвульсантная терапия. Единственным методом, способным увеличить продолжительность жизни пациентов с лейкодистрофией и улучшить качество их жизни, является трансплантация пуповинной крови или пересадка костного мозга. Трансплантация приводит к нормализации метаболизма. Однако этот процесс занимает длительное время (от 12 до 24 мес.), в течение которого продолжается прогрессирование лейкодистрофии. Поэтому зачастую тяжелая инвалидизация или гибель пациента наступает даже после успешной трансплантации.
Следует подчеркнуть, что трансплантация никак не влияет на уже развившийся неврологический дефицит, она лишь позволяет приостановить его дальнейшее прогрессирование. В связи с тем, что эффект такого лечения наступает спустя 1-2 года, оно целесообразно в случае ранней доклинической диагностики лейкодистрофии (при соответствующей настороженности родителей рожденного ребенка в связи с наличием подобной патологии в семье) или при медленно прогрессирующем варианте течения. Кроме того, необходимо учитывать, что трансплантация связана с риском ряда серьезных осложнений, таких как отторжение, реакция «трансплантат против хозяина», развитие инфекций.
Метахроматическая лейкодистрофия
Метахроматическая лейкодистрофия — аутосомно-рецессивно наследуемая демиелинизирующая патология ЦНС, отличительной особенностью которой является метахроматическое окрашивание зон демиелинизации. В клинике преобладает задержка развития, парезы, судорожные приступы, экстрапирамидные и мозжечковые расстройства, нарушение зрения. В ходе диагностики проводится исследование цереброспинальной жидкости, уровня сульфатидов, активности арилсульфатазы А, КТ/МРТ головного мозга, генетические обследования. Возможна пренатальная диагностика. Лечение симптоматическое, в отдельных случаях проводится трансплантация пуповинной крови или стволовых клеток.
Метахроматическая лейкодистрофия — один из основных видов лейкодистрофии, характеризующийся, как и другие ее типы, задержкой психомоторного развития, расстройством психики, спастическими парезами, мозжечковым синдромом, экстрапирамидными нарушениями, судорожным синдромом и атрофией зрительных нервов. Встречается в популяции с частотой 1 случай на 40 тыс. Наследуется аутосомно-рецессивно. Впервые выделена как нозологическая форма в 1910 г. Альцгеймером, подробно описана в 1925 г. Шольцем. Время манифестации заболевания существенно варьирует и обуславливает его клиническое течение. В соответствии с этими особенностями выделяют несколько вариантов патологии: врожденную (раннедетскую) форму, позднедетскую форму Гринфилда, ювенильную форму Шольца и взрослую форму. Наиболее часто наблюдается познедетская форма. В виду отсутствия эффективных способов лечения метахроматическая лейкодистрофия является проблемной патологией для современной педиатрии, неврологии и генетики.
Причины
Основным субстратом заболевания выступает дефект расположенного на 22-й хромосоме гена, ответственного за синтез арилсульфатазы А. Результатом дефицита указанного энзима является блокировка метаболизма сульфатида в галактоцереброзид. Сульфатиды откладываются в белом веществе головного и спинного мозга, коже, соматических органах (печени, легких, сердце, почках) и в костях. Однако при этом функция внутренних органов не страдает (исключением является желчный пузырь), а в мозговом веществе происходят прогрессирующие дегенеративные изменения, ведущие к гибели заболевшего.
Отложение сульфатидов в нервной ткани приводит к разрушению миелина и накоплению продуктов его распада. В процесс демиелинизации вовлекаются не только структуры ЦНС, но и периферические нервные стволы. В головном мозге формируются диффузные очаги демиелинизации, дающие при их гистохимическом исследовании метахроматическое окрашивание.
Симптомы метахроматической лейкодистрофии
Врожденная метахроматическая лейкодистрофия дебютирует до 3-месячного возраста задержкой развития и эписиндромом. Быстро присоединяется спастический парез, расстройства глотания. Дети погибают на 1-ом году жизни.
Позднедетская метахроматическая лейкодистрофия (поздняя инфантильная форма) обычно манифестирует на 2-ом году жизни ухудшением моторики и задержкой психического развития. Отмечается неустойчивая походка, понижение мышечного тонуса. В течении позднедетской формы различают 4 периода. Первый характеризуется мышечной гипотонией и слабостью, угасанием сухожильных рефлексов, затруднением ходьбы. Длится от 1-3 мес. до 1 года, иногда и дольше. Второй период знаменуется выраженным отставанием в интеллектуальной сфере, сменой гипотонии на гипертонию мышц. Ребенок утрачивает способность стоять. Наблюдается дизартрия, атрофия зрительных нервов. Период занимает несколько месяцев. В третьем периоде отмечается тетраплегия, тяжелая олигофрения, бульбарный и псевдобульбарный паралич. Четвертый период сопровождается утратой реакций на окружающие события. Ребенок не говорит, не может принимать пищу, развивается полная слепота. При хорошем уходе и кормлении через гастростому или желудочный зонд данный период может продолжаться 1-2 года.
Ювенильная метахроматическая лейкодистрофия начинается после 3-летнего возраста в периоде до 10 лет (чаще в возрасте около 6 лет). Дебютирует эмоциональной лабильностью, изменениями в поведении, снижением когнитивных функций (у школьников происходит резкое ухудшение успеваемости), атаксией, затруднениями при ходьбе. Зачастую отмечаются эпиприступы. Заболевание неуклонно прогрессирует и, в зависимости от начала симптоматики, к 10-15 годам жизни приводит к летальному исходу.
Взрослая метахроматическая лейкодистрофия манифестирует после пубертата, может возникать до 60-летнего возраста. Как правило, имеет начало с психических расстройств шизофреноподобного или психопатического характера, отчего заболевшие первоначально становятся пациентами психиатра. В отдельных случаях дебют происходит с симптомов полиневропатии. Развитие патологических изменений происходит медленнее, чем при других возрастных вариантах заболевания. В позднем периоде развиваются тетрапарез, бульбарные нарушения, деменция. Летальный исход наблюдается спустя 10-20 лет от начала симптоматики.
Диагностика метахроматической лейкодистрофии
Диагностические мероприятия имеют комплексный характер и позволяют отдифференцировать метахроматическую лейкодистрофию от других нейродегенеративных заболеваний и других форм лейкодистрофии. Проводится люмбальная пункция, при исследовании цереброспинальной жидкости определяется повышенная концентрация белка, дефицит арилсульфатазы, белково-клеточная диссоциация. Электромиография выявляет увеличение длительности проведения нервных импульсов. КТ головного мозга визуализирует расширенные желудочки и определяет пониженную плотность белого церебрального вещества. МРТ головного мозга выявляет очаги демиелинизации.
Важное диагностическое значение имеют биохимические исследования: определение сульфатидов в крови и моче, оценка активности арилсульфатазы А в лейкоцитах взятой на анализ крови. Пациентам показана консультация генетика с проведением генеалогического исследования; возможна ДНК-диагностика. Разработан также метод пренатальной диагностики патологии — определение активности арилсульфатазы А в клетках полученной при амниоцентезе амниотической жидкости. Исследования показали, что у носителей патогенного гена также отмечается сниженный уровень арилсульфатазы А. В связи с этим вместо пренатальной диагностики плода предлагается обследовать родителей будущего ребенка, чтобы избежать медаборта плода, являющегося лишь носителем дефектного гена.
Лечение метахроматической лейкодистрофии
Терапия, способная предотвратить летальный исход заболевания, пока не найдена. Осуществляется лечение, направленное на купирование его отдельных симптомов: противосудорожная терапия, борьба с контрактурами суставов; на поздних стадиях — профилактика пролежней, парентеральное питание. Проводится поиск более эффективных способов лечения, особенно в области генной терапии.
Предпринимаются попытки лечения путем трансплантации костного мозга и пуповинной крови. У ряда пациентов пересадка стволовых клеток позволяет добиться временной стабилизации состояния и замедления прогрессирования патологических изменений. Донором стволовых клеток обычно выступает родственник больного, не имеющий лейкодистрофии и тщательно обследованный. Однако следует помнить, что сама трансплантация может повлечь за собой целый ряд осложнений: отторжение, интеркурентные инфекции, реакцию «трансплантат против хозяина». Кроме того, при быстром прогрессировании симптомов летальный исход опережает наступление эффекта трансплантации.
Прогноз
Пока не найдена эффективная терапия лейкодистрофий, она имеет крайне неблагоприятный прогноз. При врожденной форме дети не доживают до 1 года. При позднедетском варианте продолжительность болезни, как правило, не превышает 4 года, при ювенильном — 6 лет. Среди пациентов со взрослой формой известны отдельные случаи, когда продолжительность жизни составила около 50 лет. Пока единственным способом предупреждения лейкодистрофии является недопущение рождения ребенка, имеющего соответствующую генную мутацию. В этом плане основное значение имеет генетическое консультирование пар, планирующих деторождение, а также обследование будущих родителей из группы риска на степень активности арилсульфатазы А.
Прогрессирующая мультифокальная лейкоэнцефалопатия
Прогрессирующая мультифокальная лейкоэнцефалопатия — редкое демиелинизирующее заболевание, обусловленное реактивацией находящегося в организме большинства людей вируса JC. Патология возникает на фоне угнетения иммунитета у больных СПИДом, гемобластозами, наследственными иммунодефицитами, у пациентов, получающих иммуносупрессивную терапию. Диагностика базируется на клинических данных, результатах томографии головного мозга, ПЦР-исследования ликвора на вирусную ДНК, гистологии церебральных биоптатов. Специфическая терапия не разработана.
Прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ) ассоциирована с JC-вирусом (JCV), возникает у иммунокомпрометированных пациентов, 85% из которых составляют ВИЧ-инфицированные. Заболевание относится к оппортунистическим инфекциям, носителями вируса являются 90% человечества. До 90-х годов ХХ века заболеваемость ПМЛ не превышала 1 случая на 100 тыс. населения. С ростом числа больных СПИДом этот показатель увеличился до 1 на 20 тыс. человек. Сегодня прогрессирующая лейкоэнцефалопатия наблюдается у 5% больных СПИДом. Некоторые авторы сообщают о снижении заболеваемости за последнее десятилетие в связи с успешным применением антиретровирусной терапии. Одновременно отмечается увеличение распространённости ПМЛ среди лиц с аутоиммунными заболеваниями, что обусловлено использованием в их лечении агрессивной иммунотерапии.
Причины ПМЛ
Прогрессирующая мультифокальная лейкоэнцефалопатия развивается в результате реактивации полиомавируса JC. Вирус распространён повсеместно. Источником инфекции является человек, заражение происходит воздушно-капельным, алиментарным путём. Подавляющее большинство людей заражаются в детстве, являются здоровыми носителями. В течение жизни вирус находится в латентном состоянии, персистирует в почках, селезёнке, костном мозге. Реактивация возбудителя происходит на фоне резко сниженного иммунитета. В группу риска развития заболевания входят следующие состояния:
- ВИЧ-инфецирование. Протекающая в виде СПИДа ВИЧ-инфекция сопровождается угнетением клеточного иммунитета. Выступает самой частой причиной ПМЛ.
- Гемобластозы. Миелопролиферативные (лейкемия) и лимфопролиферативные (лимфомы) процессы приводят к развитию иммунодефицита.
- Аутоиммунная патология: системная красная волчанка, склеродермия, ревматоидный артрит. Иммунодефицит формируется на фоне активного иммуносупрессивного лечения, особенно препаратами моноклональных антител.
- Наследственные заболевания с иммунодефицитом: синдром Ди Джорджи, Вискотта-Олдрича, атаксия-телеангиэктазия.
- Иммуносупрессия на фоне трансплантации органов.
- Вторичный иммунодефицит в результате цитостатической терапии при онкологических заболеваниях.
Патогенез
Расстройство клеточного иммунитета провоцирует перестройку последовательности ДНК JC-вируса, приводит к его активации. Вирус обладает тропностью к клеточным элементам нейроглии (олигодендроцитам, астроцитам), поражение которых сопровождается разрушением миелина. В результате в веществе головного мозга происходит мультифокальная прогрессирующая демиелинизация с ростом и слиянием очагов поражения. Микроскопически обнаруживается увеличение астроцитов, деформация их ядер, окрашивание олигодендроцитов выявляет ядерные включения — скопления частиц JCV. Первостепенную роль в иммунной антивирусной реакции играют цитотоксические Т-лимфоциты, убивающие инфицированные активным вирусом клетки. Снижение выработки специфических Т-лимфоцитов вследствие иммунодефицита обуславливает развитие ПМЛ.
Симптомы ПМЛ
Дебют заболевания носит подострый (2-3 дня) или постепенный (1-3 недели) характер. На первый план выходит патопсихологическая симптоматика и очаговый неврологический дефицит. В типичном варианте прогрессирующая мультифокальная лейкоэнцефалопатия протекает без свойственных нейроинфекциям общемозговых симптомов, менингеального синдрома. Отмечается изменение поведения, агрессивность, эмоциональная лабильность, подозрительность, прогрессирующее ослабление когнитивной сферы (памяти, мышления, внимания). Очаговый дефицит представлен мышечной слабостью конечностей одной половины тела (гемипарезом), афазией, гемианопсией, атаксией, парестезиями в паретичных конечностях. Вначале гемипарез может отсутствовать, в дальнейшем наблюдается у 75% больных. 20% случаев протекают с пароксизмами эпилепсии. Психические расстройства отмечаются у 38% пациентов. Прогрессирование когнитивного дефицита приводит к деменции.
В редких случаях мультифокальная лейкоэнцефалопатия протекает в атипичной форме. К атипичным вариантам относятся JC-менингоэнцефалит, JC-энцефалопатия, гранулярно-клеточная невропатия. Менингоэнцефалитическая форма характеризуется наличием менингеальных симптомов. При JC-энцефалопатии отсутствует очаговый неврологический дефицит. Клиника гранулярно-клеточного варианта представлена изолированным мозжечковым синдромом.
Диагностика
Прогрессирующая лейкоэнцефалопатия диагностируется специалистами в области неврологии на основании клинических данных, результатов нейровизуализирующего исследования, обнаружения специфической ДНК. Диагностический алгоритм включает:
- Осмотр невролога. В классическом варианте в неврологическом статусе определяется гемипарез, гемигипестезия, шаткость, неустойчивость в позе Ромберга, дискоординация, сенсомоторная афазия, когнитивные нарушения. Наблюдается лабильность психики, психопатологические симптомы, возможно неадекватное поведение.
- Осмотр офтальмолога. У большинства пациентов диагностируют снижение зрения, периметрия выявляет гомонимную гемианопсию.
- МРТ головного мозга. Обнаруживается диффузная мультифокальная демиелинизация, очаги имеют различный размер, асимметрично располагаются в белом веществе, таламусе, базальных ядрах.
- ПЦР-исследование. Направлено на выявление ДНК вируса JC в цереброспинальной жидкости, полученной путём люмбальной пункции. Специфичность анализа 90-100%, чувствительность — 70-90%. Проведение антиретровирусной терапии больным СПИДом понижает чувствительность исследования до 58%, отрицательный результат не исключает наличие заболевания.
- Биопсию мозговых тканей. Инвазивная методика, проводится в диагностически затруднительных случаях. Гистологическое исследование образцов церебральных тканей позволяет подтвердить специфические для лейкоэнцефалопатии морфологические изменения.
Точный диагноз «прогрессирующая мультифокальная лейкоэнцефалопатия» правомочен, когда классические клинические проявления, изменения МРТ сочетаются с положительным результатом ПЦР или имеют подтверждение по данным гистологии. Наличие только клинических и МРТ признаков позволяет трактовать диагноз как вероятный. Дифференциальная диагностика проводится с первичным нейроСПИДом, нейроревматизмом, вирусными энцефалитами.
Лечение ПМЛ
В настоящее время не существует препаратов для лечения прогрессирующей лейкоэнцефалопатии с доказанной эффективностью. Специфическая терапия находится в стадии разработки. Попытки лечения интерфероном, иммуностимуляторами, цитарабином, их комбинациями оказались безрезультатными. Окончились неудачей клинические испытания препарата цидофовир, показывающего анти-JC эффективность на опытах с мышами. Недавно был предложен кардинально новый метод лечения антидепрессантом миртазапином, блокирующим распространение JCV благодаря связыванию рецепторов, через которые вирус инфицирует клетки нейроглии. Способ требует клинических испытаний.
Прогноз и профилактика
Прогрессирующая мультифокальная лейкоэнцефалопатия отличается неуклонно усугубляющимся течением с исходом в кому. Продолжительность жизни варьирует от 1 мес. (острая форма) до 10-12 мес. с момента заболевания. Профилактика подразумевает меры предупреждения инфицирования ВИЧ, осторожное проведение терапии аутоиммунных заболеваний, мониторинг неврологической симптоматики у больных, получающих лечение моноклональными препаратами.
Метахроматическая лейкодистрофия на МРТ головного мозга
Диагностика метахроматической лейкодистрофии по КТ, МРТ головного мозга
а) Терминология:
1. Сокращения:
• Метахроматическая лейкодистрофия (МХЛ)
2. Синонимы:
• Сульфатидный липоидоз
3. Определение:
• Лизосомная болезнь накопления:
о Обусловлена ↓ арилсульфатазы A (ARSA)
о Приводит к демиелинизации ЦНС, ПНС
• Три клинические формы: поздняя инфантильная (наиболее частая), ювенильная, взрослая
б) Визуализация:
1. Общие характеристики метахроматической лейкодистрофии (МХЛ):
• Лучший диагностический критерий: Т интенсивности сигнала на Т2-ВИ сливного характера в форме бабочки от глубокого белого вещества (БВ) больших полушарий
• Локализация: глубокое БВ больших полушарий:
о Ранняя стадия: сохранность субкортикальных U-волокон:
- Изначально вовлекаются валик мозолистого тела, БВ теменно-затылочных областей
- Быстрое «центробежное» распространение изменений на БВ лобных, височных областей
о Поздние стадии: вовлечение субкортикальных U-волокон
• Морфология: симметричное повышение интенсивности сигнала на Т2-ВИ сливного характера от перивентрикулярного (ПВ) и глубокого БВ
2. КТ признаки метахроматической лейкодистрофии (МХЛ):
• Бесконтрастная КТ: симметричное ↓ плотности центрального БВ больших полушарий; атрофия на поздней стадии заболевания
• КТ с контрастированием: отсутствие накопления контрастного вещества (воспалительная реакция отсутствует)
• КТ-перфузия: ↓ перфузии БВ больших полушарий
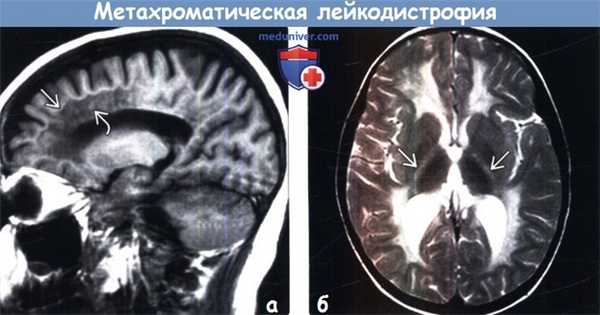
(а) МРТ, Т1-ВИ, сагиттальный срез: определяется снижение интенсивности сигнала от перивентрикулярного и глубокого БВ сливного характера с сохранностью субкортикальных U-волокон. Наблюдаются точечные очаги сохранного перивентрикулярного миелина, хотя они и менее хорошо дифференцируются на сагиттальных срезах.
(б) МРТ, Т2-ВИ, аксиальный срез: визуализируется бабочковидная конфигурация изменений, что характерно для более поздней стадии метахроматической лейкодистрофии (МХЛ). Несмотря на сохранность субкортикальных U-волокон отмечается вовлечение задних бедер внутренних капсул.
4. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о МРТ и МР-спектроскопия при пресимптоматической ферментной недостаточности у родных братьев и сестер
• Советы по протоколу исследования:
о МРТ: включите в протокол исследования последовательность FLAIR
о МР-спектроскопия: выполните оценку центрального БВ полушарий
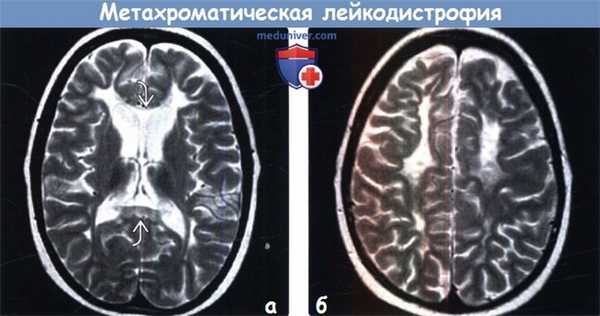
(а) МРТ, Т2-ВИ, аксиальный срез: у этого же пациента с поздней стадией МХЛ несмотря на выраженную потерю Объема БВ определяется характерная бабочковидная картина изменений. Наблюдается расширение боковых желудочков (заместительного генеза) и атрофия базальных ганглиев. Кроме того, отмечается повышение интенсивности сигнала от мозолистого тела.
(б) МРТ, Т2-ВИ, аксиальный срез: у этого же пациента определяются повышение интенсивности сигнала сливного характера и выраженная потеря объема БВ. Субкортикальные U-волокна у данного пациента сохранны, однако они часто вовлекаются в процесс на поздней стадии заболевания.
в) Дифференциальная диагностика метахроматической лейкодистрофии (МХЛ):
1. Болезнь Пелицеуса-Мерцбахера:
• Обычно манифестирует у новорожденных и младенцев
• Отсутствие миелинизации без разрушения миелина
• Возможно наличие выраженной атрофии мозжечка
2. TORCH:
• Вариабельное повышение интенсивности сигнала от БВ (демиелинизация и глиоз)
• Отсутствие прогрессирования
• Вариабельные паттерны кальцификации в зависимости от этиологии
3. Псевдо-TORCH:
• Прогрессирующая демиелинизация большого мозга и мозжечка
• Кальцификация ствола мозга, базальных ганглиев и ПВ БВ
• Повышение активности нейромедиаторов в СМЖ
4. Периентрикулярная лейкомаляция:
• Обычно симметричное повышение интенсивности сигнала на Т2-ВИ от БВ ПВ
• Потеря объема ПВ (непрогрессирующая)
• Статическая спастическая диплегия или квадриплегия
5. Синдром Снеддона (псевдодифицит арилсульфатазы А):
• Демиелинизация:
о Может быть обусловлена гипоксическим событием
• Гиперинтенсивный сигнал от ПВ БВ на Т2-ВИ
• Подтверждение диагноза при биопсии кожи
6. Болезнь Краббе:
• Раннее вовлечение БВ мозжечка
• ↑ плотности таламусов по данным КТ
7. Мегаленцефалия с лейкоэнцефалопатией и кистами:
• Медленное прогрессирование, отсутствие изменений со стороны сознания, макроцефалия
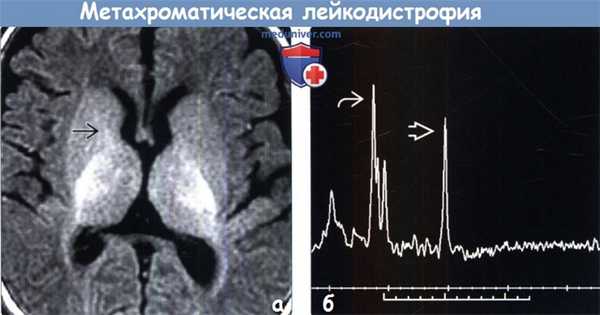
(а) МРТ, Т1-ВИ, аксиальный срез: изображение головного мозга четырехмесячного ребенка после трансплантации костного мозга (ТКМ), чьи более старшие родные братья и сестры страдали МХЛ. За исключением легкой задержки миелинизации в области переднего бедра внутренней капсулы на традиционных изображениях изменений выявлено не было.
(б) Одновоксельная МР-спектроскопия (ТЕ = 288 мс), область интереса в перивентрикулярном БВ: у того же пациента определяется подъем пика холина. В данном возрасте пик NAA должен иметь наибольшую амплитуду.
г) Патология:
1. Общие характеристики метахроматической лейкодистрофии (МХЛ):
• Основные патофизиологические аспекты:
о ↓ ARSA приводит к системному накоплению сульфатида:
- Симптоматическое течение: накопление в ЦНС, ПНС, желчном пузыре
- Бессимптомное течение: накопление в почках, надпочечниках, поджелудочной железе, печени
о Подтверждают диагноз:
- Избыток сульфатида в моче
- Отсутствие или недостаточная активность ARSA в фибробластах и/или лейкоцитах
• Генетика: аутосомно-рецессивный тип наследования:
о Ген ARSA расположенный в 22q13.31-qter
о > 110 различных мутаций
о Вызванная мутациями поздняя инфантильная форма приводит к чрезвычайно низкому уровню ARSA
о Ювенильная/взрослая формы характеризуются остаточной активностью ARSA
• Этиология:
о Отсутствие или ↓ ARSA → увеличение накопления сульфатида вследствие лизосомных нарушений → летальная демиелинизация
• Ассоциированные аномалии: заболевание желчного пузыря
2. Макроскопические и хирургические особенности:
• Ранняя стадия:
о Увеличение размеров головного мозга и демиелинизация
о Отсутствие воспалительного компонента в БВ
• Поздняя стадия:
о Прогрессирующая демиелинизация БВ больших полушарий о Атрофия головного мозга
3. Микроскопия:
• Центральная нервная система:
о Накопление PAS(+) метахроматического материала в глиальных клетках, нейронах, клетках Шванна, макрофагах
о Отложение сульфата в плазматических мембранах
о Сульфатидные мембранные включения во внутреннем слое ми-елиновой оболочки
о Демиелинизация может иметь распространенный характер, однако при этом воспалительный компонент отсутствует
о В поздней инфантильной форме содержание сульфатида в БВ значительно выше
д) Клиническая картина:
1. Проявления метахроматической лейкодистрофии:
• Наиболее частые признаки/симптомы:
о Поздняя инфантильная форма:
- Бессимптомный дебют в начале второго года жизни
- Косоглазие, нарушение походки, атаксия, слабость, гипотония
- ± вишнево-красное пятно в области желтого пятна
- Бульбарные симптомы → прогрессирующая гипотония → децеребрационная ригидность → атрофия зрительного нерва
- Летальный исход часто в течение четрех лет после постановки диагноза
о Ювенильная форма:
- Появляется в возрасте от 5-10-ти лет
- Школьная неуспеваемость (неспособность к невербальному обучению)
- Спастическая походка, атаксия, когнитивные нарушения
- Оживленные глубокие сухожильные рефлексы
- Прогрессирующая спастичность → прогрессирующая деменция → децеребрационная ригидность → судороги
- Больные редко живут больше 20-ти лет
о Взрослая форма:
- Может проявиться только на 6-м десятилетии жизни
- Проявления:
Может проявляться как PC
Деменция, шизофрения
Криптогенная спастичность ног
Прогрессирующие кортикобульбарные, кортикоспинальные и мозжечковые изменения
• Клинический профиль: ребенок ясельного возраста с визуально-моторными нарушениями и болью в животе
2. Демография:
• Возраст: зависит от клинической формы
• Половая принадлежность: отсутствует
• Распространенность всех форм в США: 1:100000:
о ↑ у популяции евреев-хаббанитов (1:75 живорождений)
о ↑ в популяци индейцев Навахо (1:2500 рождений)
3. Течение и прогноз:
• Вариабельны, зависят от клинической формы
е) Диагностическая памятка:
1. Обратите внимание:
• При изменениях со стороны БВ по типу «наихудшего варианта МХЛ» с вовлечением внутренней капсулы и ствола мозга → МХЛ нехарактерна, предполагайте
о Псевдо-TORCH
о Мегаленцефалия слейкоэнцефалопатией и кистами
• Взрослым пациентам с криптогенной спастичностью ног следует провести скрининг на Х-сцепленную адренолейкодистрофию/ адреномиелонейропатию.лизосомныеболезни (например, МХЛ)
2. Советы по интерпретации изображений:
• Конфигурация по типу бабочки изменений БВ больших полушарий головного мозга
• Картина по типу тигрового или леопардового окраса на Т2-ВИ
• Сохранность субкортикальных U-волокон на ранней стадии
• Отсутствие контрастирования БВ
Читайте также:
