Примеры хемотермотерапии ретинобластомы
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Ретинобластома (РБ) – наиболее распространенная внутриглазная злокачественная опухоль оптической части сетчатки нейроэктодермального происхождения. Опухоль развивается внутриутробно или в раннем возрасте и характеризуется высокой степенью злокачественности, инвазивностью, способностью быстро метастазировать в соседние органы и ткани. В последние годы наблюдается рост частоты РБ в популяции: в настоящее время она составляет 1:10000-20000 живых новорожденных [2,7,16], хотя еще 20 лет назад частота опухоли оценивалась как 1:30000 [1,3]. Участие генетических факторов в процессе канцерогенеза в настоящее время не подвергается сомнению. Многочисленными исследованиями подтверждено, что злокачественная опухоль развивается в результате как структурных, так и функциональных (эпигенетичеких) мутаций генов.
Ретинобластома – наследственное заболевание, и предрасположенность к ней обусловлена герминальной мутацией в одном из аллелей гена RB1, который относится к классу генов-супрессоров опухолевого роста и расположен в проксимальном районе длинного плеча хромосомы 13 (q14.1). Передается потомству по аутосомно-доминантному типу с варьированием экспрессивности и достаточно высокой пенетрантностью (90%) [5,6]. РБ – первое онкологическое заболевание, на примере которого была сформулирована двухударная теория канцерогенеза, предполагающая, что для перехода нормальной клетки в опухолевую необходимы два последовательных мутационных события [5,10]. При наследственной форме РБ вторая мутация может появиться в любой соматической клетке организма, поэтому у больных с герминальной мутацией в гене RB1 существует большой риск развития различных злокачественных опухолей, таких как остеосаркома, рак молочной железы и другие. Существует спорадическая и наследственная форма заболевания. Спорадическая форма встречается в 60% случаев и проявляется как монолатеральная, монофокальная опухоль у детей после года. Наследственная форма встречается в 40% случаев, выявляется преимущественно на первом году жизни и сопровождается двусторонним поражением с мультицентричным характером роста.
РБ развивается в возрасте от 0 до 9 лет. У подавляющего большинства детей РБ развивается в возрасте до 3 лет. Однако в последние 10 лет наблюдается увеличение заболеваемости у детей старше 5 лет. Выявление опухоли в юношеском возрасте считается раритетом [6,10]. Оба глаза поражаются одинаково часто. Различий по половому признаку, расовой принадлежности не установлено. В начале 20 века дети, страдающие от ретинобластомы, имели мало шансов на выживание. Прогресс в лечении этого заболевания позволил повысить выживаемость с 30% в 1930 году, до 80% в 1960 г. В настоящее время, благодаря внедрению в практику различных комбинированных методов лечения, эта цифра достигает 95% в развитых странах [10,16]. Ключевую роль в революционном снижении смертности сыграли усовершенствование лучевых технологий и внедрение новых лекарственных препаратов, которые были включены в протоколы лечения детей [3].
Целью настоящего исследования является анализ эффективности проводимого комбинированного лечения больных с различными формами ретинобластомы.
Материал и методы
Проведен ретроспективный анализ эффективности лечения детей с различными формами РБ, поступившими в стационар отдела офтальмоонкологии и радиологии МНИИ ГБ им. Гельмгольца с января 2002 г. по декабрь 2006 г. Под наблюдением находились 164 ребенка (79 девочек и 85 мальчиков) с первичной ретинобластомой. Монокулярная форма выявлена у 110 больных (67.0%), бинокулярная – у 54 детей (32.9%), у 1 ребенка выявлена трилатеральная ретинобластома. Наследственная РБ отмечена в 9 случаях (5.5%). Средний возраст больных с монокулярной формой заболевания при обращении составил 28±2.4 мес., при бинокулярном поражении – 14.5±1.5 мес. До госпитализации дети проходили полноценное общеклиническое обследование на предмет исключения регионарных и отдаленных метастазов. Всем детям после года проводили КТ орбит и головного мозга, дети до года подвергались этому обследованию в случае подозрения на экстрабульбарный рост или наличие метастазов в головной мозг. В стационаре все больные были обследованы в условиях медикаментозного сна с максимальным мидриазом, во время которого проводилось полное офтальмологическое обследование, включающее в себя, помимо рутинных методов, осмотр глазного дна ретинальной педиатрической камерой (RetCam), УЗИ, УЗДГ и ОСТ. Согласно классификации ВОЗ, III стадия заболевания была выявлена у 80% детей, IV стадия – в 11% случаев, а I-II стадия присутствовала только у 9% больных. Согласно принятой в западных странах классификации Reese-Ellsworth, построенной по прогностическому принципу, 75% больных отнесены к 4-5 группе (плохой прогноз), а 25% – к 1-3 группе.
В клинической картине монокулярных РБ преобладали больные со смешанным (рис.1) и эндофитным характером роста (74%), а при бинокулярном поражении – в лучших глазах наблюдался экзофитный (рис.2) или эндофитный (рис.3) характер роста (93%). У 36 из 54 больных (66.7%) с бинокулярной РБ имело место мультифокальное поражение сетчатки (рис.4). Количество опухолевых очагов колебалось от 2 до 5. У большинства больных с монокулярным поражением (82%) параметры опухоли определить было невозможно, так как опухоль выполняла практически весь глаз, помимо этого, отслойка сетчатки, кровоизлияния препятствовали детальному осмотру опухоли. Кальцификаты выявлялись в 76% случаев. При бинокулярном поражении толщина опухоли в «лучших» глазах варьировала от 1.2 до 8.5 мм (в среднем 5.3±0.7мм), а диаметр основания – от 3.5 до 14.5 мм (в среднем 7.5±1.2 мм).
Всем больным проведено комбинированное лечение с обязательной полихимиотерапией. Ликвидационные операции при монокулярном поражении сопровождались адъювантной полихимиотерапией по дробно-протяженной схеме, которая проводилась 1 раз в 3 недели в течение года под контролем гематологов и педиатров. Протокол включал внутривенное введение винкристина в дозе 0.05 мг/кг веса и циклофосфана из расчета 30 мг/кг веса. При проведении органосохраняющих операций лечение начинали с неадъювантной полихимиотерапии, предложенной нами, включающей цитостатик платинового ряда – карбоплатин (доза 18.7 мг/кг веса) и винкристин (0.05 мг/кг веса) в/в 1 раз в 3 недели с соблюдением всех норм введения. Количество курсов колебалось от 3 до 11 (стандартный блок – 6 курсов), зависело от параметров опухоли и ее чувствительности. После уменьшения параметров опухоли переходили к одному из видов локального разрушения опухоли (лазеркоагуляция, криодеструкция, брахитерапия Ru 106 +Rh 106 или Sr 90 +Y 90 ). Сроки наблюдения за больными составили от 12 до 60 мес., в среднем 42.5 мес. При оценке эффективности проведенной терапии из исследования были исключены 8 детей с бинокулярной РБ, наблюдение за которыми по не зависящим от нас причинам было прервано на разных этапах лечения.
Результаты и обсуждение
Анализ полученных результатов показал, что единственным методом лечения, который можно было предложить 91% больных (100 детей) с монокулярной ретинобластомой, являлась энуклеация. Во всех случаях опухоль или выполняла практически всю полость глаза, или имелись вторичные осложнения в виде тотально отслоенной сетчатки, вторичной глаукомы, гемофтальма, диссеминации опухолевых клеток в стекловидное тело или инвазия в ДЗН (рис.5), распространение опухоли в переднюю камеру (рис.6). Объясняется это, во-первых, поздним обращением больных к врачу, а во-вторых, отсутствием системы активного выявления врожденной патологии у детей младшего возраста. Известно, что самой распространенной жалобой является свечение зрачка (симптом «кошачьего глаза», лейкокория – 68%) однако этот признак свидетельствует о поздней стадии заболевания, при которой сохранение глаза практически невозможно. Анализ предъявляемых родителями жалоб свидетельствует о том, что второй основной жалобой у детей младшего возраста является косоглазие (32%). Но, к сожалению, врачи, как правило, не обращают на него внимания, в то время как косоглазие может возникать на ранней стадии развития центрально расположенной опухоли. Об отсутствии настороженности у офтальмопедиатров в плане выявления РБ говорит тот факт, что даже в семьях с высоким риском появления больного ребенка к врачу с просьбой об обследовании обращались родители [6].
В некоторых работах дискутируется вопрос о необходимости проведения адъювантной ПХТ после ликвидационных операций [7]. Основанием для исключения ПХТ из протокола лечения является отсутствие прорастания опухоли в хориоидею. Однако согласно полученным в нашем исследовании патоморфологическим результатам у 89% больных с рТ3с стадией развития опухоли наблюдались признаки инвазии опухоли в подлежащую хориоидею, что, как известно, резко повышает риск метастазирования опухоли и считается плохим прогностическим признаком [9]. Следовательно, включение в протокол лечения адъювантной полихимиотерапи, направленной на эрадикацию микрометастазов и профилактику рецидивов заболевания, является вполне обоснованным и необходимым принципом. В 10 случаях (9.09%), несмотря на большие размеры опухоли (более 8 мм), была предпринята попытка органосохраняющего лечения, которое начинали с неоадъювантной ПХТ. Глаза удалось сохранить у 8 больных, что составило 7.2% от общего числа больных с монокулярной формой опухоли.
Основной группой больных, среди которых развернулась борьба за сохранение глаза и зрения, были дети с бинокулярным поражением. После исключения 8 детей анализ эффективности лечения был проведен среди 46 детей с двухсторонней ретинобластомой. Необходимо отметить, что после тщательного обследования у 3 детей было выявлено полное поражение обоих глаз с развитием вторичной глаукомы, в связи с чем произведена одномоментная бинокулярная энуклеация. Еще у четырех детей была предпринята попытка сохранения второго глаза, однако, несмотря на временный эффект после неоадъювантной ПХТ, брахитерапии и лазеркоагуляции, возникли рецидивы опухоли и новые очаги, которые вынудили нас провести энуклеацию и второго глаза. Таким образом, на фоне лечения было удалены оба глаза в 8.7% случаев. У двух детей, благодаря предпринятым мерам, удалось сохранить оба глаза (4.3%). У 39 больных после обследования худшие глаза были удалены (Т3сm). Парный «лучший» глаз был подвергнут комбинированному лечению, на первом этапе которого применялась НХТ, разрушающая первичную опухоль до размеров, позволяющих проводить один из методов локального разрушения. Во всех случаях вторым этапом проводилась брахитерапия. При этом у 8 детей (20.5%) на фоне лечения возникли рецидивы или новые очаги, по поводу которых производилась повторная брахитерапия или разрушающая лазеркоагуляция. Помимо локального облучения, в случаях с мультицентричным поражением, при небольших размерах (толщиной до 1.5 мм), очаги, расположенные постэкваториально, разрушались с помощью диодного лазера (18 детей – 46.2%), а преэкваториальные – с помощью криодеструкции (3 больных). Таким образом, благодаря многофакторному воздействию на мультицентричные опухолевые очаги удалось сохранить 39 из 46 глаз (84.8%), а предметное зрение – у 35 детей (рис.7).
Анализ результатов комбинированного лечения больных с РБ еще раз доказал, что разрушение опухоли с помощью локального облучения офтальмоаппликаторами является наиболее эффективным методом. Известно, что брахитерапия для лечения ретинобластомы впервые была использована Stallard and Moore в 1920 г. в виде капсул с радоном. Затем радиоактивные источники неоднократно пересматривались. Сейчас в мире используются в основном офтальмоаппликаторы с радиоактивным йодом ( 125 I) и рутением 106 Ru. Локальное облучение рутениевыми аппликаторами впервые было применено в 1960 г. немецкими офтальмологами Lommatzsch and Vollmar. У нас в стране брахитерапия при РБ впервые использована Г.Д. Зарубеем в 1978 г. в отделении патологии глаз у детей МНИИ ГБ им. Гельмгольца (руководитель – проф. А.В. Хватова). Несмотря на то, что радиоактивный йод обладает большей проникающей способностью, чем рутений, применение его ограничено быстрым распадом частиц (одноразовое применение), большим количеством осложнений и дороговизной. Рутениевые офтальмоаппликаторы зарекомендовали себя как надежные, хорошо переносимые при правильном расчете дозы источники. В нашем исследовании не было ни одного случая склеромаляции, несмотря на то, что в 8 случаях аппликатор был использован повторно.
Хорошие результаты, полученные при лечении детей с тяжелой формой поражения, объясняются включением в комплекс лечения обязательной полихимиотерапии. Протокол адъювантной полихимиотерапии, применяемой в отделе офтальмоонкологии и радиологии МНИИ ГБ им. Гельмгольца, разработан в 1989 г. Международным комитетом по изучению ретинобластомы во главе с J. Shields. Почти 20-летний опыт использования подтвердил его высокую эффективность и хорошую переносимость. Внедрение в практику в 1995 г. неоадъювантной терапии произвело революцию в лечении больших и мультицентричных опухолей, так как основной компонент ПХТ – карбоплатин – обладает способностью разрушать первичную опухоль внутри глаза. Необходимо отметить, что приведенный нами протокол можно и нужно использовать только при локальных формах опухоли. При наличии признаков экстрабульбарного роста или генерализации процесса дети направляются в общеонкологические клиники для проведения высокодозной химиотерапии [3,7,13].
Благодаря карбоплатину стало возможным сохранять глаза, которые ранее однозначно подлежали удалению или подвергались наружному облучению в виде дистанционной гамматерапии. Безусловно, рентгенотерапия позволила в середине прошлого века резко повысить непосредственные результаты лечения детей с ретинобластомой и уменьшить смертность от заболевания. Однако уже в 1969 г. Sagerman [14] показал высокую зависимость развития вторичных опухолей от облучения. В последующие годы многие авторы подтверждали эту взаимосвязь. Так, Abramson [8] описал многочисленные случаи развития вторых, третьих и четвертых опухолей у выживших после РБ больных, причем количество вторых опухолей увеличивалось с каждым прожитым десятилетием, а смертность возрастала. Основываясь на этих данных, мы резко сократили показания к облучению детей. К сожалению, полностью исключить дистанционную гамма-терапию из протокола лечения невозможно, так как вероятность рецидива опухоли в орбиту или продолженного роста в полость мозга при экстрабульбарном росте очень велика. В связи с этим при наличии клеток в ретробульбарном пространстве или на срезе зрительного нерва больные направлялись на наружное облучение. В нашей серии мы не наблюдали развития вторых или вторичных опухолей, но косметические дефекты развились у всех 7 детей, направленных на облучение.
За исследуемый период (январь 2002 – декабрь 2006 гг., 5 лет) в общей группе погибло 4 ребенка, что составило 2.6%. Во всех случаях дети погибли от прорастания опухоли в головной мозг. Смертность в группе с монокулярным поражением составила 1.8%, а смертность в группе с бинокулярным поражением – 4.3%.
Таким образом, благодаря проведению адекватного индивидуального комбинированного и многофакторного лечения различных форм ретинобластомы выживаемость детей с бинокулярной ретинобластомой составила 95.7%, а вторые глаза и зрение сохранены в 84.7% случаев.
Все выжившие дети, несмотря на то, что являются инвалидами с детства, благодаря даже частично сохраненному зрению полностью адаптированы в окружающую общественно-социальную среду. Они посещают детские и средние образовательные учреждения, что свидетельствует о большой медико-социальной значимости разработанного комплекса комбинированного лечения больных с разными формами РБ и повышения качества жизни не только самих детей, но и их родителей.
Выявляемость ретинобластомы на ранних стадиях развития остается чрезвычайно низкой (4%). Своевременная диагностика ретинобластомы позволяет сохранить не только глаз, но и зрение. С целью выявления опухоли на ранних стадиях следует проводить офтальмоскопию с широким зрачком всем детям при рождении, в 3, 6 и 12 мес. Далее не реже, чем раз в год. Дети из группы риска должны находиться под постоянным динамическим наблюдением и обследоваться каждые 3 мес. Внедрение в клинику протокола неоадъювантной полихимиотерапии и многофакторного воздействия на опухоль позволило расширить показания к органосохранному лечению больших и мультицентричных ретинобластом, повысило выживаемость и качество жизни детей и их семей.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Примеры хемотермотерапии ретинобластомы
Примеры интраартериальной химиотерапии ретинобластомы
Интраартериальная терапия представляет собой метод доставки химиопрепарата непосредственно в глазную артерию по катетеру, проведенному через бедренную артерию в аорту, а оттуда во внутреннюю сонную артерию. Глазная артерия является ветвью внутренней сонной артерии, катетер подводится к ее устью, и химиопрепарат вводится непосредственно в артерию. Этот эффективный метод используется для лечения как небольших, так и крупных опухолей, односторонних и двусторонних поражений, в качестве как первичной, так и вторичной терапии.
Небольшая ретинобластома макулярной области. После интраартериального введения двух доз химиопрепарата наблюдается полный регресс опухоли. Крупная ретинобластома с тотальной отслойкой сетчатки. После интраартериального введения трех доз химиопрепарата наблюдается полный регресс опухоли. Массивная ретинобластома с тотальной отслойкой сетчатки и диссеминацией в стекловидное тело. После интраартериального введения четырех доз химиопрепарата достигнут полный регресс опухоли.
РЕТИНОБЛАСТОМА: ИНТРААРТЕРИАЛЬНАЯ ХИМИОТЕРАПИЯ В КАЧЕСТВЕ ВТОРИЧНОГО ЛЕЧЕНИЯ
Интраартериальная химиотерапия может проводиться в качестве как первичной, так и вторичной терапии. В последнем случае ее обычно проводят после безуспешной внутривенной химиотерапии.
Небольшая опухоль макулярной области, рецидивировавшая после внутривенной химиотерапии. После интраартериального введения трех доз химиопрепарата был достигнут регресс опухоли. Крупная периферическая опухоль, рецидивировавшая после внутривенной химиотерапии. После интраартериального введения четырех доз химиопрепарата был достигнут полный регресс опухоли. Массивная субретинальная диссеминация, рецидивировавшая после внутривенной химиотерапии. После интраартериального введения пяти доз химиопрепарата был достигнут регресс опухоли.
РЕТИНОБЛАСТОМА: ВНУТРИВЕННАЯ ПЛЮС ИНТРААРТЕРИАЛЬНАЯ ХИМИОТЕРАПИЯ РАСПРОСТРАНЕННОЙ ДВУСТОРОННЕЙ РЕТИНОБЛАСТОМЫ
Лечение более распространенных двусторонних ретинобластом, в том числе двусторонних опухолей групп D и Е, часто начинают с внутривенной химиотерапии с целью сохранения глаза и профилактики метастазирования. Однако в некоторых случаях также назначают и интраартериальную химиотерапию с целью профилактики развития местного рецидива.
Массивные ретинобластомы обоих глаз, отнесенные к группе Е Международной классификации. После внутривенной и интраартериальной химиотерапии были достигнуты полный регресс опухоли и восстановление зрительных функций. Массивные ретинобластомы обоих глаз у ребенка, отнесенные к группе Е Международной классификации. После внутривенной и интраартериальной химиотерапии был достигнут полный регресс опухоли. Диагностированы складки сетчатки, окружающие центральную ямку. Массивная ретинобластома левого глаза того же ребенка, что и на рисунке выше. Опухоль отнесена к группе Е Международной классификации. После внутривенной и интраартериальной химиотерапии был достигнут полный регресс опухоли. Сетчатка в фовеолярной области осталась плоской, сохраняются перспективы восстановления зрительных функций.
Роль интравитреальной химиотерапии с мелфаланом в комбинированном лечении ретинобластомы с эндофитным характером роста
Для цитирования: Саакян С.В., Харлампиди М.П., Иванова О.А. и др. Роль интравитреальной химиотерапии с мелфаланом в комбинированном лечении ретинобластомы с эндофитным характером роста // Эффективная фармакотерапия. 2019. Т. 15. № 33. С. 8–12.
- Аннотация
- Статья
- Ссылки
- Английский вариант
Цель – оценить эффективность интравитреальной химиотерапии (ИВХТ) в комбинированном лечении ретинобластомы с эндофитным характером роста.
Материал и методы. За период 2013–2018 гг. на базе отдела офтальмоонкологии и радиологии ФГБУ «Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца» Министерства здравоохранения Российской Федерации проведено комбинированное лечение с включением ИВХТ с мелфаланом 19 детям (28 глаз). Средний возраст пациентов составил 27 ± 12 месяцев. Количество инъекций (от одной до пяти) ИВХТ зависело от реакции на лечение. Процедуру проводили на фоне системной химиотерапии, в двух случаях одновременно с брахитерапией, в одном – в сочетании с транспупиллярной термотерапией, в четырех – после брахитерапии.
Результаты. У всех пациентов отмечалась положительная динамика в виде частичной или полной регрессии опухолевых отсевов в стекловидное тело, уменьшения объема диссеминации опухолевых очагов по сетчатке. На фоне системной полихимиотерапии наблюдался стойкий эффект. При невозможности проведения системной химиотерапии положительный эффект носил временный характер, что потребовало назначения повторной ИВХТ или применения локальных методов лечения. По завершении процедуры у двух пациентов зафиксировано кратковременное снижение зрения, обусловленное отеком сетчатки и диска зрительного нерва и тромбозом центральной вены сетчатки, которые были купированы после инстилляций противовоспалительных препаратов и дегидратационной терапии. В двух случаях увеличилось преретинальное кровоизлияние. У всех пациентов на глазном дне выявлены хориоретинальные дистрофические изменения.
Выводы. Несмотря на побочные явления, ИВХТ в схеме комбинированного лечения ретинобластомы групп C, D и E считается эффективным методом при запущенных формах ретинобластомы с эндофитным характером роста и массивной диссеминацией опухолевых клеток по сетчатке.
- КЛЮЧЕВЫЕ СЛОВА: ретинобластома, интравитреальная химиотерапия, диссеминация, мелфалан
Рис. 3. Ретинобластома с эндофитным характером роста и опухолевыми клонами в стекловидном теле (А – до лечения, Б – после одного курса ИВХТ)
Рис. 4. Ретинобластома с эндофитным характером роста и множественными опухолями в сетчатке (А – до лечения, Б – после двух курсов ИВХТ)
Рис. 5. Отек диска зрительного нерва и папиллярное кровоизлияние после комбинированного лечения ретинобластомы с включением ИВХТ
Ретинобластома (РБ) – нейроэктодермальная злокачественная опухоль сетчатки, относящаяся к одним из наиболее тяжелых заболеваний глаз у пациентов младшего возраста. По последним данным, частота РБ составляет 1 : 15 000 живых новорожденных [1].
Алгоритм комбинированного лечения РБ включает в себя лекарственные, лазерные, лучевые и хирургические методы. При РБ применяются хирургическое ликвидационное (энуклеация) и локальное (разрушающая лазеркоагуляция, транспупиллярная термотерапия, криодеструкция, брахитерапия) органосохраняющее лечение. Одним из компонентов лечения РБ является системная (адъювантная и неоадъювантная) и локальная (суперселективная интраартериальная (СИАХТ), интравитреальная (ИВХТ), периокулярная) химиотерапия [2–16].
Впервые ИВХТ применили L. Ericson и B. Rosengren. В 1961 г. они ввели тиотеп в стекловидное тело при РБ с опухолевыми клонами [8]. Преимущество данного метода заключается в обеспечении максимальной концентрации химиопрепарата (мелфалана) внутри глаза без системного воздействия на организм [13]. В начале 2000-х гг. метод стал широко применяться при эндофитных формах РБ c преретинальными и диффузными отсевами в стекловидное тело [9–16].
Цель данной работы – оценить эффективность ИВХТ с мелфаланом в комбинированном лечении ретинобластомы с эндофитным характером роста.
Материал и методы
За период 2013–2019 гг. на базе отдела офтальмоонкологии и радиологии ФГБУ «Национальный медицинский исследовательский центр глазных болезней им. Гельмгольца» Минздрава России проведено комбинированное лечение с включением ИВХТ с мелфаланом 19 детям (28 глаз). Средний возраст пациентов составил 27 ± 12 месяцев. У всех больных имела место эндофитная форма РБ с преретинальными и диффузными отсевами в стекловидное тело групп C, D и E (рис. 1).
Для проведения ИВХТ использовали тонкие иглы (30 или 32 G). Мелфалан вводили через плоскую часть цилиарного тела (рис. 2) [17]. Доза препарата составила от 16 до 25 мкг на один курс. В зависимости от реакции на лечение проводили от одной до пяти инъекций мелфалана один раз в три-четыре недели (всего 33 процедуры). Процедуры ИВХТ выполняли на фоне системной химиотерапии, в двух случаях одномоментно с брахитерапией, в одном – одновременно с транспупиллярной термотерапией, в четырех – после брахитерапии. Срок наблюдения составил 36 ± 1,2 месяца.
Результаты и обсуждение
Во всех случаях отмечалась положительная динамика в виде частичной или полной регрессии опухолевых отсевов в стекловидное тело, уменьшения объема диссеминации опухолевых очагов по сетчатке (рис. 3).
На фоне системной полихимиотерапии регистрировался стойкий эффект. При невозможности проведения системной химиотерапии положительный эффект носил временный характер, что потребовало назначения повторной ИВХТ или использования локальных методов лечения (рис. 4).
В двух случаях увеличилось преретинальное кровоизлияние. У всех пациентов на глазном дне выявлены хориоретинальные дистрофические изменения (рис. 6). Экстраокулярного роста опухоли по раневым каналам не зафиксировано.
В последние годы часто используется системная полихимиотерапия на основе препарата платины – карбоплатина в комбинации с цитостатиком винкристином и полусинтетическим производным подофилотоксина – этопозидом. Комбинированное воздействие этих препаратов направлено на разрушение ДНК опухолевой клетки, нарушение процесса ее репликации, снижение биологической и ферментативной активности ядер опухолевых клеток, торможение пролиферации клеток и подавление нуклеотидного транспорта, уменьшение параметров первичной опухоли, увеличение резектабельности, повышение абластики, предотвращение развития метастазов [1–4, 13].
Широкое применение системной химиотерапии обусловлено ее эффективностью в разрушении опухоли и предотвращении метастатической болезни. Тем не менее на фоне такой терапии неизбежно возникают побочные эффекты. Как следствие – ухудшается соматический статус пациентов, нарушается режим проведения терапии, снижается ее эффективность [19]. Кроме того, со временем возрастает частота запущенных форм и развиваются рефрактерные формы РБ.
В целях усовершенствования видов химиотерапии, облегчения переносимости системной химиотерапии, уменьшения количества и тяжести ее осложнений были разработаны методы доставки химиопрепаратов непосредственно к опухолевому очагу. В связи с этим особую значимость приобрели методы локальной химиотерапии (СИАХТ, ИВХТ) [5, 9–16].
В начале 2000-х гг. был возрожден и усовершенствован метод селективного интраартериального введения препарата, предложенный в 1987 г. японскими врачами [20]. Однако он не нашел широкого распространения в мире [21]. Развитие высоких технологий в XXI в. позволило усовершенствовать методику и снизить риск возможных осложнений. Первые публикации с анализом результатов применения суперселективной химиотерапии у детей с запущенными формами РБ появились в 2006 г. [22].
Опубликованные результаты лечения методом СИАХТ подтверждают его эффективность при бинокулярных формах РБ со смешанным характером роста [22].
Данные исследований, проведенных в отделе офтальмоонкологии и радиологии Национального медицинского исследовательского центра глазных болезней им. Гельмгольца, также подтвердили эффективность ИАХТ с мелфаланом при резистентных опухолях с экзофитным характером роста, локализующихся в постэкваториальной зоне [5]. Эффект цитостатика алкилирующего типа действия из группы производных бис-бета-хлорэтиламина – мелфалана обусловлено образованием иона этиленимония, алкилирующего связи многих внутриклеточных молекул, в том числе нуклеиновых кислот (посредством связывания с гуанином в 7-й позиции), с блокированием их полимеризации и редупликации, формированием дефектных форм ДНК и блокадой митоза быстро делящихся опухолевых клеток. Препарат активен в отношении находящихся в покое и активно делящихся опухолевых клеток. Его действие фазонеспецифично, но наиболее чувствительны клетки, находящиеся в конце фазы G2 и переходе G2-1, при применении в более высоких дозах – в переходе S-G2 и фазе синтеза ДНК [23].
M. Ueda и cоавт. изучали влияние мелфалана на эритроциты кролика и человека in vitro для определения его токсичной концентрации при РБ путем проведения электроретинографии (ЭРГ). Мелфалан не оказывал существенного влияния на альфа- и бета-волну или колебательный потенциал, что позволило говорить о применении препарата in vivo [24].
Попытки интравитреального введения цитостатиков предпринимались давно, однако показания к этому методу были сформулированы в 2010–2012 гг. В Российской Федерации ИВХТ применяют в соответствии с Федеральными клиническими рекомендациями по диагностике, мониторингу и лечению детей с ретинобластомой, утвержденными Ассоциацией врачей-офтальмологов [25]. Появление новых цитостатиков сделало возможным разрушение опухолевых клонов в стекловидном теле при эндофитной РБ путем интравитреального введения химиопрепаратов [9–16, 26], что резко расширило показания для органосохраняющего лечения.
Интравитреальная химиотерапия с мелфаланом в составе комбинированной терапии считается методом выбора при далеко зашедших формах РБ групп C и D с эндофитным характером роста и массивной диссеминацией опухолевых клеток по сетчатке и в стекловидное тело. Несмотря на побочные эффекты, подобная терапия обеспечивает частичную или полную резорбцию либо кальцификацию узлов РБ в сетчатке и опухолевых клонов в стекловидном теле. Метод исключает развитие системных осложнений и позволяет сохранить зрение.
Отдаленные итоги лечения детей с интраокулярной ретинобластомой
Для цитирования: Саакян С.В., Иванова О.А., Горовцова О.В. и др. Отдаленные итоги лечения детей с интраокулярной ретинобластомой // Эффективная фармакотерапия. 2019. Т. 15. № 33. С. 14–17.
Цель – проанализировать отдаленные результаты комбинированного лечения пациентов с интраокулярной ретинобластомой групп C и D.
Материал и методы. Всего в исследование включено 70 пациентов (77 глаз) с интраокулярной ретинобластомой (группы C – 22 глаза и D – 55 глаз), получавших лечение в 2012–2017 гг. по трехстороннему протоколу органосохраняющего лечения ретинобластомы RB2012. У 28 пациентов имела место бинокулярная ретинобластома, у 42 – монокулярная. Средний возраст пациентов с монокулярной ретинобластомой составил 17,1 ± 1,2 месяца, с билатеральной – 9,5 ± 0,9 месяца. Средний срок наблюдения – 46,0 ± 13,7 (28–77) месяца.
Результаты. В 37,6% случаев (n = 29) отсутствовала необходимость в локальной терапии после проведения суперселективной интраартериальной и интравитреальной химиотерапии в связи с полной регрессией опухоли клинически и по данным ультразвукового исследования. Фокальные методы применяли при стабилизации заболевания (n = 23), прогрессировании (n = 8, из них новые очаги опухоли на сетчатке в группе C (n = 1) и D (n = 7)) и рецидиве (n = 14, из них новые очаги на сетчатке в группе C (n = 5) и D (n = 6) и новые очаги на сетчатке и отсевы в стекловидное тело в группе D (n = 3)). В ряде случаев в качестве «долечивания» использовали агрессивные методы органосохраняющего лечения: вторую линию системной химиотерапии (n = 5), дистанционную лучевую терапию (n = 2), стереотаксическую хирургию с применением аппарата «Гамма-нож» (n = 4), а также ликвидационное лечение – энуклеацию (n = 14). Общая пятилетняя выживаемость составила 97,7%, общая пятилетняя органная выживаемость – 81,8% в группе C и 80,0% в группе D.
Выводы. Показана высокая эффективность комбинированного органосохраняющего лечения интраокулярной ретинобластомы. Общая пятилетняя выживаемость достигла 97,7%, при этом удалось сохранить 80,9% глаз, из них в подавляющем большинстве случаев – без проведения дистанционной лучевой терапии. Как следствие – снижение вероятности развития вторых злокачественных опухолей и повышение качества жизни пациентов.
- КЛЮЧЕВЫЕ СЛОВА: ретинобластома, локальная химиотерапия, выживаемость, критерий Фишера, органосохраняющее лечение
Ретинобластома (РБ) – наиболее частая первичная злокачественная внутриглазная опухоль в педиатрической популяции [1]. Ежегодно в мире выявляется около 7000–8000 новых случаев РБ [2]. В 2/3 всех случаев отмечается несемейный (спорадический) характер РБ, ассоциированный с нормальной продолжительностью жизни после лечения [3]. В 1/3 случаев определяют семейный характер заболевания, связанный с герминальной мутацией в гене RB1 [3].
В настоящее время в развитых странах выживаемость пациентов с РБ достигает 99% [4]. Благодаря появлению новых технологий диагностики и лечения РБ смертность от этого заболевания в развитых странах снизилась до 5%, в то время как в странах Африки она остается высокой – до 70% [2].
В запущенных случаях для сохранения жизни ребенка прибегают к энуклеации пораженного глаза. Органосохраняющие методы при небольших и средних опухолях включают локальное лечение (крио- и фотокоагуляцию и брахитерапию) [5, 6]. В последние годы стал доступен метод суперселективной интраартериальной химиотерапии (СИАХТ), позволяющий расширить показания для органосохраняющего лечения РБ, а также интравитреальная химиотерапия (ИВХТ) [5, 7–9].
Цель данной работы – проанализировать отдаленные результаты комбинированного лечения пациентов с интраокулярной ретинобластомой групп C и D.
Всего в исследование было включено 70 пациентов (77 глаз) с интраокулярной РБ групп C и D, получавших лечение в 2012–2017 гг. по трехстороннему протоколу органосохраняющего лечения ретинобластомы RB2012 (ФГБУ «Национальный медицинский исследовательский центр (НМИЦ) глазных болезней им. Гельмгольца», НМИЦ онкологии им. Н.Н. Блохина, НМИЦ «МНТК „Микрохирургия глаза“» им. акад. С.Н. Федорова). У 28 пациентов имела место бинокулярная РБ, у 42 – монокулярная. Средний возраст пациентов с монокулярной РБ составил 17,1 ± 1,2 месяца, с билатеральной – 9,5 ± 0,9 месяца. Средний срок наблюдения – 46,0 ± 13,7 (28–77) месяца. Все пациенты были разделены на группы в соответствии со стадией заболевания по классификации ABC – группу C (22 глаза с отдельными локализованными опухолями с минимальным обсеменением субретинального пространства или стекловидного тела), группу D (55 глаз с диффузно распространенной опухолью со значительным обсеменением субретинального пространства).
Лечение проводили в соответствии с режимом 2 трехстороннего протокола по схеме: винкристин – 1,5 мг/м 2 внутривенно в первый день, этопозид – 150 мг/м 2 внутривенно в первый и второй дни, карбоплатин – 560 мг/м 2 внутривенно в первый день. Детям в возрасте до 36 месяцев дозу рассчитывали на 1 кг массы тела: винкристин – 0,05 мг/кг, карбоплатин – 18,6 мг/кг, этопозид – 5 мг/кг. Селективная внутриартериальная химиотерапия мелфаланом проводилась не ранее чем после одного курса системной химиотерапии в дозе 5–7,5 мг/м 2 каждого пораженного глаза со степенью распространения опухоли, соответствующей группам C или D. При одновременном лечении обоих глаз доза мелфалана составила 5 мг/м 2 , при односторонней РБ – 7,5 мг/м 2 . Интравитреально вводили 16 мкг мелфалана (0,05 мл).
Статистический анализ проводили с применением точного критерия Фишера. Выживаемость пациентов после лечения рассчитывали статистическим методом множительных оценок Каплана – Мейера. Для оценки различия между двумя выборками использовали двухвыборочный критерий Вилкоксона (Манна – Уитни) и регрессионную модель Кокса. Для анализа полученной информации все наблюдения были разделены на два типа:
- цензурированные (незавершенные): исход на момент окончания исследования (пациенты живы) не наступил либо пациенты выбыли из него (в том числе смерть от других причин);
- нецензурированные (завершенные): зафиксирована смерть пациента от прогрессирования ретинобластомы.
Расчеты проводили с помощью пакета программ для Windows (Microsoft Excel, Statistica 10.1).
Результаты и их обсуждение
Отдаленные результаты наблюдения доступны для всех включенных в исследование пациентов. В 37,6% случаев (n = 29) отсутствовала необходимость в локальной терапии после проведения СИАХТ и ИВХТ в связи с полной регрессией опухоли клинически и по данным ультразвукового исследования. На рисунках 1 и 2 представлены примеры РБ группы D до ИВХТ и на фоне курса терапии. Основными методами «долечивания» пациентов при недостаточной эффективности селективной интраартериальной и интравитреальной химиотерапии, прогрессировании заболевания или его рецидиве (появлении новых очагов на сетчатке и/или в стекловидном теле) служили фокальная терапия и локальная химиотерапия. Фокальная терапия включала транспупиллярную термотерапию, криодеструкцию, брахитерапию офтальмоаппликаторами и комбинацию указанных подходов. Данные методы применяли при стабилизации заболевания (n = 23), прогрессировании (n = 8, из них новые очаги опухоли на сетчатке в группе C (n = 1) и D (n = 7)) и рецидиве (n = 14, из них новые очаги на сетчатке в группе C (n = 5) и D (n = 6) и новые очаги на сетчатке и отсевы в стекловидное тело в группе D (n = 3)). В ряде случаев в качестве «долечивания» применяли агрессивные методы органосохраняющего лечения: вторую линию системной химиотерапии (n = 5), дистанционную лучевую терапию (n = 2), стереотаксическую хирургию с применением аппарата «Гамма-нож» (n = 4), а также ликвидационное лечение – энуклеацию (n = 14).
На рисунке 3 представлена общая выживаемость пациентов через пять лет наблюдений. Спустя один и три года наблюдений все 70 пациентов были живы (выживаемость – 100%). Через 45 месяцев наблюдений один пациент умер вследствие развития второй злокачественной опухоли (острый миелолейкоз). Таким образом, общая пятилетняя выживаемость составила 97,7%.
Общую органную выживаемость (долю сохраненных глаз в максимальном периоде наблюдения) оценивали отдельно по группам C и D (рис. 4). Так, в группе C (n = 22) одногодичная выживаемость составила 90,9 ± 6,1%, трехлетняя – 81,8 ± 8,2% (оставалась неизменной в течение пяти лет наблюдения). 18 глаз (82%) из 22 удалось сохранить, при этом дистанционная лучевая терапия была проведена только в одном случае. В группе D (n = 55) одногодичная выживаемость составила 94,5 ± 3,1%, трехлетняя – 83,6 ± 5,0%, пятилетняя – 80,0 ± 6,0%, что соответствовало 44 сохраненным глазам из 55 (во всех случаях без проведения дистанционной лучевой терапии). При анализе показателя в общей когорте пациентов одногодичная выживаемость составила 93,5 ± 2,8%, трехлетняя – 83,1 ± 4,3%, пятилетняя – 80,9 ± 4,7%. Таким образом, удалось сохранить 62 глаза из 77.
Локальная химиотерапия остается одним из наиболее перспективных методов лечения РБ, в том числе далеко зашедших ее стадий.
C.L. Shields и соавт. анализировали результаты применения СИАХТ у 60 пациентов (70 глаз). Эффективность достигнута в 100% в группах B и C, в 94% – в группе D, в 36% – в группе E [10].
Y.P. Gobin и соавт. опубликовали результаты наблюдения за 78 пациентами (95 глаз) с РБ групп D и E. Ремиссия в течение двух лет составила 70% для всех глаз, 81,7% – для пациентов, получивших СИАХТ в качестве основного лечения, и 58,4% – для неэффективно перенесших предшествующую внутривенную химиотерапию и/или наружную лучевую терапию [11].
В работе С.В. Саакян и соавт. представлены результаты лечения 28 детей (35 глаз) с РБ групп С (n = 6), D (n = 10) и E (n = 22).
Авторы установили первичную далеко зашедшую форму РБ – восемь глаз, формы РБ, резистентные к проведенной системной химиотерапии и локальному лечению, – 30 глаз. Во всех случаях проведена СИАХТ. Из 30 сохраненных глаз – 25 с резистентными к проведенному ранее системному и локальному лечению и пять глаз с далеко зашедшей формой РБ. 28 пациентам из 30 удалось сохранить предметное зрение. Вместе с тем срок наблюдения (8 ± 2,5 (1–17) месяца) требовал более длительного анализа полученных данных [12]. Представленные в настоящей работе результаты соответствуют литературным данным и свидетельствуют об эффективности комбинированного лечения при РБ групп C и D.
Показана высокая эффективность комплексного органосохраняющего лечения интраокулярной ретинобластомы. Общая пятилетняя выживаемость достигла 97,7%. Удалось сохранить 80,9% глаз, причем в подавляющем большинстве случаев – без проведения дистанционной лучевой терапии. Это позволило снизить вероятность развития вторых злокачественных опухолей и повысить качество жизни пациентов.
4 метода лечения и симптомы ретинобластомы глаза
Злокачественные опухоли могут проявляться в самых разных формах и поражать разные органы, в том числе глаза. Рак сетчатки – ретинобластома – при ранней диагностике не так опасен, как другие виды онкологии. Если правильно скомбинировать методы, можно добиться полного выздоровления и отсутствия рецидивов в 95% случаев.
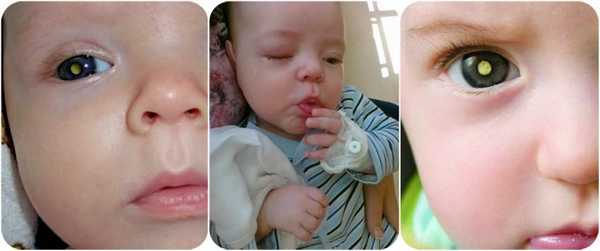
Главное о ретинобластоме
Ретинобластома – злокачественное образование, состоящее из клеток нейроэктодермы сетчатки. Болезнь поражает сетчатку, сосудистую оболочку и орбиту. Опухоли сетчатки растут очень быстро, метастазы через зрительный нерв проникают в головной мозг, откуда через кровь попадают в костный мозг и трубчатые кости.
- Опухоль занимает 25% глазного дна (Т1).
- Новообразование занимает 25-50% поверхности сетчатки (Т2).
- Охватывает больше половины сетчатки и распространяется за ее пределы, но внутриглазное расположение сохраняется (Т3).
- Опухоль выходит за границы орбиты (Т4).
- Метастазы в региональных лимфоузлах (N1).
- Метастазы в мозге, костях и внутренних органах (MI).
Ретинобластомы составляют 2-4% от всех случаев злокачественных образований у пациентов до 15 лет. Опухоль развивается преимущественно у детей до 5 лет, большая часть больных – дети в возрасте 2-3 года. Риск возникновения не зависит от пола.
Эта опухоль представляет собой типичный наследственный рак. У многих людей, которые имели ретинобластому, рождаются дети с аналогичным диагнозом. Вероятность развития опухоли у второго ребенка, когда ретинобластома была диагностирована у первого, составляет 6%. Если в одной семье есть несколько больных детей, опасность возрастает до 50%. Несмотря на злокачественную природу, болезнь излечима. Своевременное лечение обеспечивает выживаемость подавляющего большинства пациентов.
Структура ретинобластомы
Глаза человека начинают формироваться на раннем этапе внутриутробного развития. В этот период появляются клетки ретинобласты, которые способны быстро делиться. Из них образуются клетки сетчатки, но мутации в генах мешают ретинобластам формировать зрелые клетки. Вместо этого незрелые ретинобласты продолжают множиться, образуя опухоль.
Название опухоли обусловлено тем, что она формируется из ретинобластов, а точнее из зачатков нервной ткани сетчатки (нейроэктодерма). Ретинобластома может образоваться из клеток любого ядерного слоя сетчатки. В такой опухоли нет стромы, имеются очаги некроза и кальцификаты.
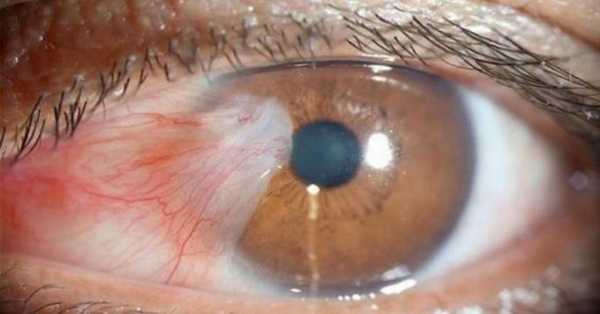
Причины ретинобластомы
Основная причина развития односторонних ретинобластом – соматические мутации. Двусторонние появляются вследствие мутаций хромосом в половых клетках.
В 40% случаев диагностируют врожденную ретинобластому, и болезнь проявляется в первые 30 месяцев жизни ребенка. Нередко врожденная опухоль сочетается с другими аномалиями развития (порок сердца, кортикальный детский гиперостоз, расщелина неба). Повышается риск возникновения злокачественных очагов в других органах.
Причины приобретенной ретинобластомы не выяснены. К факторам риска врачи относят поздний возраст деторождения, работу на металлургических фабриках, загрязнение экологии. У взрослых приобретенную форму диагностируют очень редко, чаще у детей дошкольного возраста.
Классификация опухолей сетчатки
Ретинобластомы делят на наследственные и спорадические (случайные). Наследственные опухоли поражают оба глаза, а случайные обычно имеют форму единичного узла в одном глазу.
- дифференцированная (ретиноцитома);
- недифференцированная (ретинобластома);
- смешанная.
Ретинобластома – более злокачественная форма – встречается гораздо чаще. Ее клетки группируются преимущественно вокруг сосудов, образуя псевдорозетки. А вот клетки ретиноцитомы образуют истинные розетки (опухоль формируется вокруг светлого пространства), эта форма имеет более благоприятное течение.
Как растет ретинобластома
Существует несколько типов роста рака сетчатки. Рост опухоли может быть направлен внутрь сетчатки или наружу. В редких случаях ретинобластома прорастает в окружающие ткани так хаотично, что определить ее границы не удается.
- Эндофитный. Опухоль распространяется на внутренний слой сетчатки и стекловидное тело, прорастая в направлении глазного яблока. Узлы бугристые, большое количество новообразованных сосудов. Быстрый рост ретинобластомы вызывает помутнение стекловидного тела.
- Экзофитный. Опухоль формируется в подсетчаточном пространстве (между сенсорной частью и пигментным эпителием). Рост ретинобластомы вызывает субтотальную отслойку сетчатки и накоплении транссудата.
- Смешанный. Состояние, при котором сочетаются признаки двух предыдущих типов. Клоны клеток опухоли распространяются и в стекловидное тело, и в подсетчаточное пространство. Для этого типа характерны кровоизлияния в переднюю камеру и стекловидное тело.
- Диффузный. Этот тип диагностируют редко. При диффузной форме инфильтрируются все слои сетчатки, опухоль прорастает в переднюю камеру глаза и симулирует воспаление. В этом случае границы ретинобластомы определить сложно, развивается диффузное истончение сетчатки, а в передней камере глаза скапливается экссудат. Возникают передние спайки и псевдогипопионы (кристаллы холестерина). Наблюдается ишемия сетчатки и неоваскуляризация радужки, степень которых зависит от стадии заболевания. Новообразованные сосуды могут блокировать отток внутриглазной жидкости и вызывать повышение внутриглазного давления (вторичная глаукома).
При распространении за пределы глазного яблока происходит смещение глаза и развивается экзофтальм. Ретинобластома может проникнуть в орбиту, околоносовые пазухи и нос, в полость черепа. Обширное метастазирование опухоли приводит к гибели пациента.

Симптомы ретинобластомы
Проявления ретинобластомы напрямую зависят от размеров опухоли, ее локализации и типа роста. Небольшие очаги, которые не дают выраженных симптомов, можно обнаружить во время профилактического осмотра. У 20-40% больных заболевание захватывает оба глаза. Опухоль во втором глазу может проявиться не сразу, иногда разница по времени составляет несколько лет.
Лейкокория является первым симптомом, который замечают даже родители. Это беловато-желтый отсвет, возникающий при отражении света от опухолевой массы. Если ретинобластома расположена в центре глаза, одним из ранних симптомов может быть косоглазие.
- Покой. Для этой стадии характерно отсутствие субъективных симптомов. Во время осмотра может быть выявлен синдром «кошачьего глаза» (зрачковый рефлекс, просвечивание опухоли через зрачок). Ранним признаком ретинобластомы выступает потеря центрального и бинокулярного зрения, что нередко становится причиной косоглазия у ребенка.
- Глаукома. На этой стадии отмечается воспаление в глазу, сопровождаемое светобоязнью, слезотечением, покраснением слизистой. Часто развиваются увеиты и иридоциклиты. Поскольку начинается распространение опухолевых клеток, возникает болевой синдром. Когда опухоль поражает трабекулярный аппарат, развивается вторичная глаукома. Пациенты начинают жаловаться на боль.
- Прорастание. Эта стадия начинается с экзофтальма (выпячивание глаз). Опухоль врастает в мягкие ткани орбиты и разрушает ее стенки, позже проникает в придаточные пазухи и между оболочками мозга.
- Метастазирование. Очаги опухоли формируются в костном мозге, печени, костях, головном мозге и даже костях черепа. Распространение начинается с мягкой мозговой оболочки по зрительному нерву, а дальше лимфогенными и гематогенными путями (через лимфу и кровь). На четвертой стадии развития ретинобластомы ухудшается общее самочувствие пациента (слабость, интоксикация, тошнота, головные боли).
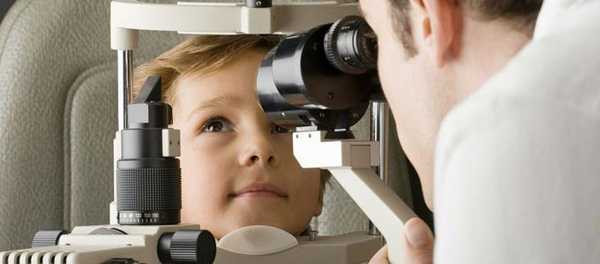
Полная диагностика рака сетчатки
Если в семейном анамнезе есть случаи ретинобластомы, детей нужно регулярно показывать офтальмологу. У ретинобластомы есть своя триада симптомов: лейкокория (белый цвет зрачка), косоглазие и расширение зрачка при слабой реакции на свет. Пациентов с опухолью консультирует офтальмолог, возможно подключение невролога и отоларинголога.
- биомикроскопия (изучение переднего отдела глаза при помощи щелевой лампы);
- офтальмоскопия (осмотр глазного дна);
- визометрия (определение остроты зрения);
- тонометрия (измерение внутриглазного давления);
- гониоскопия (визуальное исследование переднего отрезка глазного яблока);
- экзофтальмометрия (определение выстояния глазного яблока из орбиты);
- проверка бинокулярного зрения;
- определение угла косоглазия;
- УЗИ глазного яблока (помогает при помутнении оптических сред).
Интраокулярная биопсия нежелательна, поскольку она может спровоцировать распространение клеток по лимфатическому и кровеносному руслу. К этому методу прибегают только в крайнем случае, когда опухоль не просматривается другими способами.
- рентгенография орбиты и пазух носа;
- КТ и МРТ головного мозга;
- остеосцинтиграфия (визуализация костно-суставного аппарата);
- сцинтиграфия печени (лучевой метод визуализации органов и тканей).
Чтобы выявить отдаленное метастазирование, проводят люмбальную пункцию и дальнейшее исследование цереброспинальной жидкости и костного мозга. Дополнительно делают миелограмму (мазок пунктата костного мозга, который отражает состав клеток миелоидной ткани).
- рубцовая ретинопатия;
- ретинит Коутса;
- гамартома (доброкачественная аномалия тканевого развития);
- эндофтальмит;
- дисплазия сетчатки;
- отслойка сетчатки;
- мягкотканная саркома;
- ретролентальная фиброплазия;
- фиброз стекловидного тела;
- метастазы нейробластомы;
- метастатическая офтальмия;
- поражение орбиты при лейкемии и лимфоме;
- болезнь Гиппеля-Линдау;
- паразитарные заболевания (личиночный гранулематоз, токсоплазмоз).
Принципы лечения ретинобластомы
План лечения разрабатывается врачом в зависимости от стадии ретинобластомы. Если имеется двустороннее поражение, тактику лечения разрабатывают для каждого глаза отдельно.
Что нужно учитывать при выборе лечения:
- поражен один глаза или оба;
- степень ухудшения зрительной функции;
- выход опухоли за пределы глазного яблока;
- распространение на зрительный нерв;
- влияние на центральную нервную систему;
- наличие метастазов.
В ходе лечения может быть использовано несколько разных методов, их правильное сочетание во многом определяет шансы на сохранение зрения и глаза. Современные методы диагностики позволяют выявить ретинобластому на ранней стадии, когда для успешного лечения еще достаточно криотерапии, фотокоагуляции и лучевого воздействия.
- хирургическое вмешательство;
- лучевая химиотерапия;
- лекарственная химиотерапия;
- криотерапия;
- лазерная коагуляция;
- термотерапия.
Современная медицина предпочитает консервативное лечение ретинобластомы. Такая тактика эффективна только при наличии небольших единичных образований, которые остаются в пределах глаза, но за границами макулярной и перипапиллярной зон.
Для лечения рака глаза активно применяют криотерапию и фотокоагуляцию, позволяющие сохранить зрение и редко дающие осложнения. Криотерапия воздействует на поражения в передней камере глазного яблока, а фотокоагуляция – в задней. Контроль за ходом лечения осуществляют при помощи офтальмоскопии и ультразвукового исследования.
- Брахитерапия. Техника локального облучения опухолей, которая заключается в подшивании к глазу офтальмоаппликатора (радиоактивная пластинка). Преимущество метода заключается в том, что можно подводить максимальные дозы излучения непосредственно к очагу без воздействия на здоровые ткани глаза и организм.
- Криодеструкция. Метод воздействия низкими температурами. При замораживании клетки опухоли перестают расти и разрушаются. Лечение осуществляют при помощи аппарата с наконечником в несколько миллиметров. Криодеструкция применима к опухолям в переднем отделе сетчатки, которые не превышают 7 мм в диаметре.
- Фотокоагуляция. Лечение с применением лазерного луча. Эффективно при размерах ретинобластомы до 4 мм и расположении в заднем отделе сетчатки.
- Транспупиллярная диод-лазерная термотерапия (ТТТ). Бесконтактное лечение внутриглазных опухолей, основанное на инфракрасном излучении. Метод заключается в длительном прогревании ретинобластомы до 45-55°С.
Лучевая терапия для лечения рака сетчатки
К лучевой терапии обращаются с целью сохранить зрительные функции. Ретинобластома очень чувствительна к лучевой терапии: 75% пациентов справляются с болезнью исключительно при помощи этого метода, но для закрепления эффекта рекомендована криотерапия.
Возможно применение разных лучевых методик при лечении ретинобластомы, но обычно прибегают к наружному облучению с двумя латеральными полями, включающими сетчатую оболочку. Это обусловлено тем, что у большинства пациентов имеются множественные опухоли мультифокального происхождения.
Поле облучения захватывает также стекловидное тело и 10 мм доступной части зрительного нерва. Дозы лучевой терапии варьируются в высоких пределах (3500 Гр при I-III группе, 4500 Гр при IV-V группе). Детей до трех лет облучают под наркозом на специальном столе для фиксации.
Для лечения ретинобластомы можно применять радиоактивные пластинки. Их применение ограничено, но они хорошо воздействуют на маленькие опухоли вне оптического диска. Методика не рекомендована при врожденных ретинобластомах, поскольку высок риск сосудистых повреждений и кровотечений ввиду мультифокального поражения.
Чтобы предотвратить развитие постлучевой катаракты, используют специальные блоки. Поскольку есть риск рецидива опухоли в передней части сетчатки, после лучевой терапии рекомендованы дополнительные криопроцедуры.
Локальная и системная химиотерапия при ретинобластоме
Хирургическое лечение и лучевая терапия эффекты в 80-90% случаев ретинобластомы. Химиотерапия показана при массивном поражении, затрагивании зрительного нерва и орбиты, а также при наличии региональных метастазов.
В случае ретинобластомы самым эффективным комплексом химиотерапевтических препаратов признаны Винкристин, Вепезид и Карбоплатин. Возможно применение Винкристина, Доксорубицина и Циклофосфана, но практика показывает, что последний цитостатик повышает риск рецидива и приводит к стерилизации.
Химиотерапия может быть системной и локальной. К локальным методам относят интраартериальный и интравитреальный. Первый подразумевает введение препаратов в артерию, которая снабжает кровью зону расположения ретинобластомы. Второй – введение препаратов в стекловидное тело, когда оно поражено опухолью или соприкасается с ее очагами на сетчатке.
Энуклеация при ретинобластоме
Самым эффективным методом лечения рака глаза является энуклеация – удаление глазного яблока. В ходе операции зрительный нерв отсекают максимально далеко, поэтому этот метод показывает наилучшие результаты при лечении ретинобластомы. Через 6 недель после операции можно осуществить протезирование для устранения визуального дефекта. Поскольку пациенты с ретинобластомой чаще всего дети, энуклеация сопряжена с некоторыми сложностями. После удаления глазного яблока кости орбиты начинают расти активнее, вызывая сильный дефект.
- обширное поражение и отсутствие возможности восстановить зрение;
- массивное обсеменение стекловидного тела;
- опухоль поражает заднюю камеру глаза и достигает задней капсулы хрусталика;
- локализуется вблизи цилиарного тела или занимает большую часть переднего отдела глаза;
- глаукома на фоне разрастания сосудов;
- запущенные вторичные осложнения (увеит, катаракта, гемофтальм, гифема);
- наступление слепоты с невозможностью восстановить зрение.
После энуклеации глаз отправляют на гистологический анализ. Если опухоль поразила зрительный нерв и сосудистую оболочку или вышла за пределы склеры, это указывает на плохой прогноз для пациента. Когда ретинобластома выходит за границы орбиты, рекомендована экзентерация орбиты (удаление содержимого орбиты).
- прорастание ретинобластомы в зрительный нерв;
- поражение склеры;
- экстрабульбарное распространение опухоли;
- расположение в перипапиллярной зоне;
- наличие больших и множественных опухолевых узлов;
- проникновение очагов в стекловидное тело, радужку, передний отрезок глаза;
- вовлечение хориоидеи.
Прогноз и профилактика рака сетчатки
Правильная диагностика ретинобластомы на ранней стадии – залог успешного лечения. Пока опухоль не распространилась, возможно органосохраняющее лечение (фотокоагуляция, криотерапия, лучевое воздействие). Обеспечить выживаемость пациента может энуклеация, но результатом будет потеря зрения и образование визуального дефекта.
- проникновение опухоли в зрительный нерв;
- поражение хориоидальной оболочки;
- распространение ретинобластомы за пределы глазного яблока;
- опухоли в обоих глазах.
Поскольку в подавляющем большинстве случаев заболевание имеет врожденную природу, профилактикой будет генетическое консультирование семей, в которых были случаи рака сетчатки. Очень важно регулярно обследовать детей из групп риска и соответствующих по возрасту.
Читайте также:
- Принципы лечения отравления кокаином
- Местная температура при гипотермии. Феномен отдачи при краниоцеребральной гипотермии
- Оснащение лаборатории для анализа коагулограммы - гемостаза
- Синоназальный плоскоклеточный рак - лучевая диагностика
- Инсулин длительного действия (ультраленте). Инсулины лизпро и аспарт
