Методы лечения инфантильного нистагма и их эффективность
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Для цитирования: Байбакова Е.В. Доброкачественное пароксизмальное позиционное головокружение: диагностика и лечение. РМЖ. 2012;27:1370.
Головокружение может возникать при различных заболеваниях, отличающихся друг от друга по этиологии и патогенезу. Оно может быть системным и несистемным, длиться от нескольких секунд до суток и более, может возникать спонтанно или под воздействием определенных условий: например, может быть спровоцировано изменением положения тела и/или головы. Пациенты с головокружением попадают к врачам разных специальностей, и от правильной интерпретации данной симптоматики во многих случаях зависят направление диагностического поиска, а также адекватность и эффективность назначаемого лечения.
В настоящее время наиболее частой причиной головокружения, связанного с патологией внутреннего уха, считается доброкачественное пароксизмальное позиционное головокружение (ДППГ), которое составляет, по данным различных авторов, от 17 до 35% всех периферических вестибулярных расстройств [3–6,24,25]. Основным проявлением заболевания являются кратковременные приступы системного головокружения, возникающие при перемене положения головы. ДППГ достаточно легко диагностируется и в большинстве случаев излечивается с помощью методик, выполняемых в амбулаторных условиях.
Впервые такое состояние описал Barany в 1921 г. Он привел выписку из истории болезни пациентки, у которой приступы системного головокружения возникали только при укладывании на правый бок, носили кратковременный характер (длились до 30 с), сопровождались тошнотой, при этом визуализировался правосторонний ротаторный нистагм. Если сразу же после прекращения приступа больная поворачивала голову направо, то приступа не возникало, а для его повторного возникновения пациентке необходимо было полежать некоторое время на спине или другом боку.
С того времени был достигнут значительный прогресс в понимании этой патологии. Как было доказано в клинических исследованиях, во время хирургических вмешательств на полукружных каналах и в эксперименте на животных [10,30,31], причиной возникновения головокружения при ДППГ являются фрагменты отолитовой мембраны эллиптического мешочка, которые при свободном перемещении проникают в эндолимфатическое пространство полукружных каналов. В зависимости от расположения частиц по отношению к купуле и полукружному каналу различают купулолитиаз и каналолитиаз. Некоторые вестибулологи для упрощения объединяют эти два термина в один – «отолитиаз».
Каналолитиаз предполагает наличие свободно плавающих отолитов в просвете полукружного канала. Это состояние было впервые описано S.F. Hall и J.A. McClure в 1979 г. [16]. Свободно плавающие в эндолимфе частицы были обнаружены S.K. Agrawal и L.S. Parnes [4] в 30% случаев при операциях по поводу ДППГ. В эксперименте этот феномен был продемонстрирован L.S. Parnes и J.A. McClure [30]. Термин «купулолитиаз», означающий наличие частиц, прилипших к купуле полукружного канала, был введен в научный оборот H.F. Schuknecht [31].
Для лучшего понимания патофизиологии данного состояния следует коротко напомнить особенности строения полукружных каналов. Три полукружных канала во внутреннем ухе воспринимают угловые ускорения и расположены почти под прямым углом друг к другу. Каждый канал заполнен эндолимфой и имеет расширение, именуемое ампулой. Ампула содержит в себе купулу, покрытую желатинозной массой, которая прикреплена к волосковым клеткам рецептора. Движения купулы могут вызывать стимулирующий и угнетающий ответ, зависящий как от направления движения эндолимфы, так и от того, в каком канале это движение происходит. Необходимо отметить, что купула практически полностью перекрывает просвет ампулы, поэтому частицы отолитовой мембраны, попадая в полукружный канал, могут выйти оттуда только через его гладкое колено. Подавляющее большинство случаев ДППГ обусловлено локализацией отолитов в заднем (вертикальном, сагиттальном) полукружном канале (ЗПК). Это происходит, по–видимому, в связи с тем, что большинство свободно плавающих в эндолимфе обломков отолитов под влиянием силы гравитации попадают в ЗПК, который наиболее низко располагается как при вертикальном, так и при горизонтальном положении тела человека. Однажды попав в ЗПК, осколки отолитов не могут выйти через «купулярный барьер», блокирующий выход из канала. Поэтому частицы отоконий оказываются «в ловушке» и могут покинуть канал только через его гладкое колено [10].
Возникает вопрос: почему отоконии покидают отолитовую мембрану и, что называется, отправляются в свободное плавание? По мнению большинства исследователей, в 50–70% случаев причину развития такого состояния установить не удается [27]. Однако возникновение этого заболевания может быть связано с черепно–мозговой травмой (7–17%), вирусным лабиринтитом (15%), болезнью Меньера (5%), ототоксическим действием антибиотиков (гентамицин), хирургическими вмешательствами на внутреннем ухе, мигренями, обусловленными нейроциркуляторной дистонией (спазм лабиринтной артерии) и т.д. [2,14,15,18–20,22,25]. Также нельзя исключить тот факт, что в связи с большой распространенностью ДППГ может быть случайной находкой при других заболеваниях, являясь при этом сопутствующей патологией.
Со времен публикаций D.J. Lim в 1984 г. [25] стало известно, что сферический и эллиптический мешочки отличаются высокой метаболической активностью и имеют сложную ультраструктуру. Размер отоконий составляет приблизительно 10 микрон, они обладают большим удельным весом, чем эндолимфа. Отоконии воспроизводятся в течение всей жизни человека и подвергаются дегенерации при естественном старении организма. Резорбция отоконий осуществляется с помощью темных клеток, расположенных в утрикулюсе и саккулюсе. Нарушения в различных звеньях метаболизма отоконий могут привести к изменению их формы, гиперпродукции и неспособности полноценной деминерализации темными клетками. В результате таких нарушений массы отолитов накапливаются в саккулюсе и утрикулюсе и затем попадают в различные отделы перепончатого лабиринта под влиянием силы гравитации [10,12]. При посттравматических ДППГ частицы отоконий попадают в полукружные каналы вследствие травматического разрушения отолитовой мембраны.
Клиника этого заболевания очень характерна. Пациенты описывают внезапные сильные приступы системного головокружения с горизонтальным или вертикальным движением предметов или их комбинацией, возникающие при определенном положении головы или движениях, чаще всего это переворачивание в кровати, повороты головы в сторону, разгибание и сгибание шеи. Пациенты часто идентифицируют больное ухо, точно указывая, на каком боку у них возникает головокружение, а на каком – нет. Приступы головокружения продолжаются не более 30 с, однако многие люди преувеличивают их продолжительность, говоря о нескольких минутах. Приступы головокружения могут быть единичными, а могут повторяться через разные промежутки времени: от нескольких приступов в неделю до нескольких приступов в течение дня. В дополнение к системным головокружениям многие больные жалуются на тошноту и ощущение покачивания.
Симптомы отсутствуют, если больной избегает провоцирующих движений. При ДППГ не наблюдаются тугоухость, шум в ушах, головная боль и другие симптомы. Название этого заболевания говорит о благоприятном его течении, однако в ряде случаев оно может быть опасным, особенно если приступ системного головокружения возникает при нахождении человека на большой высоте, глубине или при управлении транспортом [5,6,9,21,24,36].
Для подтверждения диагноза ДППГ необходимо провести пробу Дикса–Холлпайка, которая была впервые предложена в 1952 г. (рис. 1) [9].
Больной сидит на кушетке, при этом голова повернута на 45° в предполагаемую больную сторону, а взгляд фиксирован на лице врача (нос, переносица). Больного резко укладывают на спину, при этом голову запрокидывают назад на 30° назад, сохраняя разворот на 45° в больную сторону. При положительной пробе после небольшого латентного периода (1–5 с) возникают головокружение и ротаторный нистагм, направленный в плоскости ЗПК исследуемого уха (при левостороннем ДППГ – по часовой стрелке, при правостороннем – против часовой стрелки), которые длятся не более 30 с. После исчезновения нистагма больного быстро усаживают в исходное положение, при этом в большинстве случаев возникает реверсивный нистагм – ротаторный, направленный в обратную сторону, менее сильный и продолжительный, в сочетании с легким головокружением.
Проба Дикса–Холлпайка обязательно проводится с двух сторон. Если во время проведения пробы нистагм и головокружение не выявлены, проба считается отрицательной. Проба может быть положительной с двух сторон, особенно это характерно для посттравматического ДППГ. Следует отметить, что нистагм, получаемый при данной пробе, безусловно периферический, т.е. он подавляется фиксацией взора, поэтому без специального оборудования (очков Френзеля или инфракрасной регистрации движения глаз) он может быть не зафиксирован.
Почему в пробе Дикса–Холлпайка возникает раздражение или угнетение заднего полукружного канала? В положении со свешенной головой «критическая масса» частиц отоконий отходит от купулы, индуцируя ампулофугальное отклонение купулы, что приводит к раздражению нейроэпителиальных клеток ампулярного рецептора ЗПК и, следовательно, к возникновению нистагма и головокружения, непродолжительных по времени, т.к. после достижения частицами самой низкой точки канала купула возвращается в нейтральное положение. Когда больного усаживают, масса отоконий движется в противоположном направлении, вызывая ампулопетальное движение купулы, т.е. тормозя нейроэпителиальные клетки, это приводит к возникновению менее сильного нистагма в противоположном направлении.
Следует напомнить, что стимуляция полукружного канала вызывает более сильный ответ, чем его угнетение. При последовательном неоднократном выполнении пробы Дикса–Холлпайка нистагм истощается, и симптоматика головокружения исчезает, т.к. частицы рассеиваются по каналу и не создают критическую массу [11,12,16,33].
У определенной части больных при проведении пробы Дикса–Холлпайка можно не выявить типичного нистагма, но при этом возникает типичное позиционное головокружение – так называемое «субъективное ДППГ» [17,21,33]. Это может происходить по нескольким причинам: во–первых, нистагм может не визуализироваться врачом, во–вторых, может истощаться в результате повторяющихся тестов, в–третьих, из–за наличия легкой формы ДППГ, при которой стимуляция вестибуло–глазодвигательного пути недостаточна.
Дифференциальная диагностика данного заболевания проводится с несколькими патологическими состояниями. При ортостатической гипотензии в отличие от ДППГ головокружение сопровождается ощущением мушек перед глазами, нистагм возникает только при резком вставании и запрокидывании головы. Ключ к диагнозу – сравнение АД в положении больного лежа и стоя.
Вертеброгенное головокружение наряду с ДППГ является одним из наиболее частых вестибулярных нарушений и характеризуется головокружением, появляющимся при поворотах головы и шеи. Возникновение его обусловлено патологическими изменениями дегенеративного, воспалительного, обменного и травматического характера в межпозвонковых суставах и связочном аппарате шейного отдела позвоночника, приводящими к нарушению кровообращения в позвоночной артерии, ирритации симпатического позвоночного сплетения, а также к изменению состояния проприорецепторов в спазмированных шейных мышцах.
Но помимо головокружения при остеохондрозе шейного отдела позвоночника имеется ряд симптомов, таких как тупая, ноющая боль в шее, ограничение движений головы, усиление боли при резком сгибании или разгибании шеи, а также при длительной постоянной нагрузке на шейный отдел позвоночника, иррадиация боли в затылочную область головы, верхние конечности. При обследовании больных может определяться ограничение объема движений в шейном отделе позвоночника (особенно поворотов и наклонов головы). Часто больные предъявляют жалобы на снижение слуха и шум в ушах, усиливающийся при поворотах головы. Кохлеовестибулярные нарушения определяют клиническую картину синдрома позвоночной артерии или заднего шейного симпатического синдрома Барре–Льеу, который характеризуется интенсивными головными болями, шумом в ушах и снижением слуха, приступами головокружения и нарушением зрения.
Опухоли задней черепной ямки помимо позиционного головокружения проявляются выраженными расстройствами равновесия, центральным диагональным или вертикальным нистагмом, направленным вниз и усиливающимся в положении лежа, симптомами поражения лицевого, тройничного и других черепно–мозговых нервов.
Позиционное головокружение встречается также при рассеянном склерозе, однако при этом заболевании характерно возникновение нистагма при запрокидывании головы, когда один глаз находится выше, а другой – ниже горизонтальной плоскости (поражение вестибулярных ядер дна IV желудочка) [34,35].
За последние 20 лет методы лечения ДППГ серьезно изменились в связи с прогрессом в понимании патогенеза данного заболевания [7,8,13,23,24,29]. Раньше больным советовали избегать триггерных положений, а лекарственная терапия носила симптоматический характер. Позже появились методики и маневры, позволяющие осколкам отолитов вернуться обратно в эллиптический мешочек.
В 1988 г. A. Semont и соавт. описали методику, которая базируется на теории купулолитиаза (рис. 2) [17,32]. Авторы полагают, что путем выполнения серий быстрых смен положения головы происходит освобождение частиц, прилипших к купуле. При выполнении этой методики пациент сначала находится в положении сидя, с головой, повернутой в сторону, противоположную больной стороне. Затем больного быстро укладывают на бок – в сторону больного уха, при этом положение головы сохраняется, то есть в данном случае пациент находится лицом вверх. Спустя 5 мин. больного перекладывают через исходную позицию на другой бок, при этом голова по–прежнему повернута в «здоровую» сторону (лицом вниз). В этом положении пациент остается на 10–15 мин., а затем медленно садится в исходное положение.
Согласно методике J.M. Epley (рис. 3), предложенной в 1992 г. [1,13], пациента укладывают в положение Дикса–Холлпайка по указанному выше способу и оставляют его в этом положении на 1–2 мин. Затем резко переворачивают на бок, при этом голову поворачивают на 180°, чтобы она оказалась в положении, диагонально противоположном позиции Дикса–Холлпайка. Если при этом возникают головокружение и нистагм (продолжение движения отоконий в ампулофугальном направлении к утрикулюсу), то маневр удался. Больной удерживается в этом положении в течение 1–2 мин. Затем его усаживают, и в том случае, если манипуляция была успешной, ни головокружения, ни нистагма не возникает. В оригинальном описании для повышения эффективности вышеуказанной методики автор применял вибрацию черепа, однако в последующих работах было доказано, что метод Epley очень эффективен независимо от использования вибрации [15].
Большинство врачей после проведения позиционных терапевтических методик рекомендуют больному находиться в вертикальном положении в течение 24–48 ч [26], хотя многочисленными исследованиями доказано, что это необязательно [28]. Эффективность предложенных методов неоспорима и подтверждена многочисленными исследованиями [7,9,12–13].
В заключение следует отметить, что, по мнению большинства зарубежных исследователей, ДППГ является отдельной нозологической формой, в основе которой – выход осколков отолитов из отолитовой мембраны утрикулюса и попадание их в эндолимфатическое пространство полукружных каналов, чаще заднего, что клинически проявляется кратковременным (в течение 20–30 с) системным головокружением, связанным с определенным положением головы и тела, иногда сопровождающимся тошнотой, при этом отсутствуют какие–либо признаки поражения слухового анализатора. Все это возникает в большинстве случаев идиопатически или в результате травмы головы. Наличие ДППГ при других заболеваниях внутреннего уха или ЦНС, скорее всего, является случайной находкой, т.е. в данных случаях ДППГ является сопутствующим заболеванием. ДППГ хорошо диагностируется и часто проходит самостоятельно или излечивается с помощью простых методик, без каких–либо хирургических и медикаментозных вмешательств.
Литература
1. Asawavichianginda S., Isipradit P., Snidvongs К., Supiyaphun P. // Ear Nose Throat J. 2000. Vol. 79. Р. 732–734.
2. Atacan E., Sennaroglu L., Gene A., Kaya S. // Laryngoscope. 2001. Vol. 11. Р. 1257–1259.
3. Atlas J.T., Parnes L.S. // Curr. Opin. Otolaryngol. Head Neck Surg. 2001. Vol. 9. Р. 284–289.
4. Agrawal S.K., Parnes L.S. // Ann. N. Y. Acad. Sci. 2001. Vol. 942. Р. 300–305.
5. Baloh R.W., Honrubia V., Jacobson K. // Neurology. 1987. Vol. 37. Р. 371–378.
6. Bourgeois P.M., Dehaene I. // Acta neurol. (Belg.) 1988. Vol. 88. Р. 65–74.
7. Cohen H.S., Jerabek J. // Laryngoscope. 1999. Vol. 109. Р. 584– 590.
8. Collison P.J., Kolberg A. // S.D.J. Med. 1998. Vol. 51 (3). Р. 85–87.
9. Dix M.R., Hallpike C.S. // Proc. roy. Soc. Med. 1952. Vol. 45. Р. 341.
10. Dohlman G. // Acta Otolaryngol. Suppl. (Stockh). 1944. Vol. 51. Р. 211.
11. Epley J.M. // N.Y. Ann. Acad. Sci. 2001. Vol. 942. Р. 179–191.
12. Epley J.M. // Otolaryngol. Head Neck. Surg. 1980. Vol. 88. Р. 599–605.
13. Epley J.M. // Otolaryngol. Head Neck. Surg. 1992. Vol. 107. Р. 399–404.
14. Gross E.M., Ress B.D., Viirre E.S., Nelson J.R., Harris J.P. // Laryngoscope. 2000. Vol. 10. Р. 655–659.
15. Hain T.C., Helminski J.O., Reis I.L., Uddin Arch. M.K. // Otolaryngol. Head Neck Surg. 2000. Vol. 126. Р. 617–622.
16. Hall S.F., Ruby R.R., McClure J.A. J. // Otolaryngol. 1979. Vol. 8 (2). Р. 151.
17. Hawthorne M., el–Naggar M. // J. Laryngol. Otol. 1994. Vol. 108. Р. 935–939.
18. Ishiyama A., Jacobson K.M., Baloh R.W. // Ann. Otol. Rhinol. Laryngol. 2000. Vol. 109. Р. 377–380.
19. Karlberg M., Hall K., Quickert N., Hinson J., Halmagyi G.M. // Acta Otolaryngol. 2000. Vol. 120. Р. 380–385.
20. Katsarkas A. // Acta Otolaryngol. 1999. Vol. 119 (7). Р. 745–749.
21. Kentala E., Pyykko I. // Acta Otolaryngol. 2000. Vol. 543. Р. 20–22.
22. Lempert T., Leopold M., von Brevern M., Neuhauser H. // Ann. Otol. Rhinol. Laryngol. 2000. Vol. 109. Р. 1176.
23. Lempert T., Tiel–Wilck K. // Laryngoscope. 1996. Vol. 106. Р. 476–478.
24. Lynn S., Pool A., Rose D., Brey R., Suman V. // Otolaryngol. Head Neck Surg. 1995. Vol. 113. Р. 712–720.
25. Lim D.J. // Otol. Rhinol. Laryngol. 1984. Suppl. 112. Р. 17–24.
26. Massoud E.A., Ireland D.J. // J. Otolaryngol. 1996. Vol. 25. Р. 121–125.
27. Mizukoshi K., Watanabe Y., Shojaku H., Okubo J., Watanabe I. // Acta Otolaryngol. 1988. Vol. 447. Р. 67–72.
28. Nuti D., Nati C., Passali D. // Otolaryngol. Head. Neck. Surg. 2000. Vol. 122. Р. 440–444.
29. Oas J.G. Ann. N.Y. // Acad. Sci. 2001. Vol. 942. Р. 201–209.
30. Parnes L.S., McClure J.A. // Laryngoscope. 1992. Vol. 102 (9). Р. 988–992.
31. Schuknecht H.F., Ruby R.R. // Adv. Otorhinolaryngol. 1973. Vol. 20. Р. 434.
32. Semont A., Freyss G., Vitte E. // Adv. Otorhinolaryngol. 1988. Vol. 42. Р. 290–293.
33. Tirelli G., D'Orlando E., Giacomarra V., Russolo M. // Laryngoscope. 2001. Vol. 11. Р. 1053–1056.
34. Благовещенская Н.С. Отоневрологические симптомы и синдромы. М., 1990. С. 73–78.
35. Григорьев Г.М. // Вестник оториноларингологии. 1997. № 3. С. 4–7.
36. Солдатов Н.Б., Сущева Г.П., Храппо Н.С. Вестибулярная дисфункция. М., 1980.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Методы лечения инфантильного нистагма и их эффективность
Клинические варианты инфантильного нистагма
а) Идиопатический инфантильный нистагм. Идиопатический инфантильный нистагм диагностируется методом исключения другой глазной и неврологической патологии. Передний отрезок, глазное дно, ЗВП и ЭРГ нормальны. При семейном идиопатическом инфантильном нистагме наиболее часто встречающийся механизм наследования — Х-сцепленный, клиническая картина развивается приблизительно у 50% женщин-носителей.
Также описано аутосомно-доминантное наследование. Первый обнаруженный ген, мутации которого вызывают Х-сцепленный идиопатический инфантильный нистагм — FRMD7. Нокдаун FRMD7 во время нейрональной дифференцировки вызывает нарушение функции нейритов.
У пациентов с идиопатическим инфантильным нистагмом острота зрения составляет в среднем 0,18 logMAR (6/9,20/30,0,63), косоглазие наблюдается нечасто (менее, чем в 10% случаев), зачастую отмечается высокая острота стереоскопического зрения. У пациентов с мутациями гена FRMD7 аномальные положения головы наблюдаются реже по сравнению с пациентами с идиопатическим инфантильным нистагмом при отсутствии мутаций этого гена. Нистагм ассоциированный, обычно горизонтальный, особенно при мутациях гена FRMD7.
При идиопатическом инфантильном нистагме обычно наблюдается ускорение движения в медленную фазу. Однако нистагм может быть и более сложным и состоять из фоновых маятникообразных колебаний, регулярно прерываемых быстрофазовыми колебаниями. Ускорение движения в медленную фазу лучше заметно в стороне от нулевой зоны.
Колебания при нистагме в первые несколько месяцев жизни зачастую характеризуются очень большой амплитудой, но с возрастом она становится меньше. Также изменяются характеристики колебаний: с возрастом они становятся заметно более толчкообразными. Возможно, эти изменения обусловлены действием адаптивных механизмов: во время периодов относительно медленного движения глаз возникает фовеолярная фиксация, обеспечивающая более высокую остроту зрения. Обычно имеется нулевая зона нистагма, в ней интенсивность нистагма ниже; когда нулевая зона не совпадает с первичной позицией взора, возникает аномальное положение головы.
Более чем у 20% пациентов с идиопатическим нистагмом вследствие мутаций FRMD7 наблюдается периодический альтернирующий нистагм, который обычно не выявляется клинически, а диагностируется только по данным окулографии. Хотя и редко, инфантильный идиопатический нистагм может быть вертикальным.
б) Аномалии путей хиазмы. Нистагм при альбинизме имеет характеристики, очень сходные с идиопатическим инфантильным нистагмом. Альбинизм легко может остаться недиагностированным, поэтому пациенты с такими признаками, как просвечивающая радужка, гипопигментация сетчатки, гипоплазия зрительного нерва и аномальный перекрест по результатам исследования ЗВП требуют тщательного обследования. ОКТ очень информативно при диагностике гипоплазии центральной ямки.
У пациентов с ахиазмией наблюдается врожденный вертикальный диссоциированный нистагм. Диагноз подтверждается с помощью МРТ и ЗВП.
в) Нистагм при заболеваниях глаз. Нистагм может развиваться при большинстве типов дистрофии сетчатки. У пациента с повышенной чувствительностью к свету, низкой остротой зрения, плохим цветовосприятием и низкоамплитудным высокочастотным нистагмом вероятен диагноз ахроматопсии или монохроматизма синих колбочек. Ахроматопсия наследуется по аутосомно-рецессивному механизму, описаны мутации четырех генов, возможно проведение молекулярной генетической диагностики. Пациенты с мутацией в одном и том же гене могут иметь очень различные фенотипы, от глубокого нарушения зрения и полного отсутствия цветовосприятия, до неполной ахроматопсии с сохранением некоторого цветовосприятия и, реже, до «трихромазии малого количества колбочек» («oligocone trichromacy») с почти нормальным цветовосприятием и остротой зрения не ниже 0,1 logMAR (6/7,5, 20/25, 0,8).
У пациентов с ахроматопсией часто наблюдается быстрый маятникообразный нистагм, накладывающийся на толчкообразный нистагм, а также вертикальный нистагм. При ахроматопсии описаны характерные изменения на ОКТ. Диагноз подтверждается затухающей или значительно ослабленной фотопической электроретинограммой. При монохромазии синих колбочек острота зрения обычно выше, наследование Х-сцепленное.
Врожденная стационарная ночная слепота часто сопровождается нистагмом с траекторией колебаний, соответствующей инфантильному или манифестному латентному нистагму. У пациентов отмечается вариабельная острота зрения, ослабленное ночное зрение, часто — высокая близорукость, негативная ЭРГ. Описан маятникообразный, косой и чаще всего диссоциированный высокочастотный низкоамплитудный нистагм, часто в сочетании с двойными толчкообразными колебаниями. Обычно отмечается Х-сцепленное наследование, идентифицированы мутации двух патогенных генов.
При дистрофиях сетчатки нистагм развивается при цилиопатиях, представляющих собой дисфункцию первичных ворсинок — органелл, участвующих во внутриклеточных и межклеточных процессах чувствительности и сигнализации (например синдром Alstrom, синдром Bardet-Biedl, синдром Joubert, синдром Senior-Loken и врожденный амавроз Leber). Иногда при дистрофиях сетчатки нистагм манифестирует в более старшем возрасте одновременно с ухудшением зрения.
Нистагм может возникать при ретинопатии недоношенных, врожденных катарактах, помутнениях роговицы и гипоплазии зрительного нерва. У таких пациентов нистагм может иметь те же характеристики, что и при ахроматопсии или врожденной стационарной ночной слепоте, или быть похожим на манифестный латентный нистагм. Раннее лечение катаракты или других помутнений оптических сред может предотвратить развитие нистагма. Мутации гена РАХ6, наследуемые по аутосомно-доминантному механизму, сопровождаются нистагмом, который может быть горизонтальным, вертикальным или ротаторным.
При ОКТ выявляется гипоплазия центральной ямки, но при исследовании ЗВП признаки аномалий зрительного пути, характерные для альбинизма, отсутствуют. Часто наблюдается аниридия.
г) Нистагм при неврологических заболеваниях или синдромах. Нистагм у детей — обычное проявление различных синдромов, аномалий развития и неврологических заболеваний, например синдрома Down, синдрома Noonan, структурных мальформаций, объемных процессов, перивентрикулярной лейкомаляции, церебрального паралича, лейкодистрофии, мальформации Chiari, метаболических нарушений или митохондриальных болезней. При неврологической патологии часто наблюдаются вертикальные, ротаторные, диссоциированные или вертикальные диссоциированные колебания (см. рисунке ниже, показан вертикальный нистагм при мальформации Chiari). При наличии другой неврологической симптоматики, задержки развития, атрофии зрительного нерва или подозрения на атипичный нистагм, большое значения для диагностики имеет МРТ.
д) Spasmus nutans. Spasmus nutans представляет собой триаду нистагма, кивательных движений и аномального положения головы. Заболевание дебютирует позже, чем инфантильный нистагм, обычно в возрасте старше шести месяцев. Нистагм маятникообразный, высокочастотный, может быть периодическим и диссоциированным. Иногда нистагм клинически заметен только на одном глазу. Обычно нистагм проходит самостоятельно через год-два после дебюта, хотя сохраняется субклинический нистагм, выявляемый при окулографии. Вестибулярный рефлекс стабилизирует глаза, поэтому кивательные движения головы подавляют нистагм, что позволяет развиться бинокулярному зрению. Этиология spasmus nutans остается неясной. Состояние связано с низким социально-экономическим статусом пациента.
Нистагм с такими же характеристиками — кивательными движениями головы и тортиколлисом — может развиваться при супраселлярных опухолях, например при хиазмальной глиоме. Дефект афферентной реакции зрачка или бледность диска зрительного нерва должны вызывать сильные подозрения о наличии опухоли. Некоторые заболевания сетчатки, ахроматопсия и врожденная стационарная ночная слепота могут имитировать spasmus nutans. Мы рекомендуем выполнять электроретинографию и/или МРТ всем детям с дебютом spasmus nutans.
е) Манифестный латентный нистагм. Манифестный латентный нистагм, или «синдром нарушения развития фузии и нистагма», является частью синдрома врожденного косоглазия. Нистагм обычно усиливается при прикрывании одного глаза, быстрая фаза направлена в сторону фиксирующего глаза, в медленную фазу отмечается замедление движения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Классификация инфантильного нистагма у новорожденных детей
Существуют значительные разногласия относительно классификации и терминологии, используемой при описании нистагма. Некоторых исследователей интересует главным образом траектория колебаний, а других — клиническая этиология.
Преимущества классификации инфантильного нистагма, основанной на связанной с нистагмом патологии, заключаются в том, что в ней подчеркиваются такие клинически важные проблемы, как прогноз, возможности генетического консультирования или методы лечения.
На рисунке ниже в соответствии с такой классификацией перечислены расстройства, сопровождающиеся нистагмом. Идиопатический нистагм является диагнозом исключения, когда в результате проведенного обследования не было выявлено другой патологии. У большинства пациентов острота зрения составляет 0,3 logMAR (6/12,20/40,0,5) или выше.
Было установлено, что причиной большинства случаев Х-сцепленного идиопатического нистагма являются мутации гена FRMD7. Известны несколько мутаций, вызывающих другие расстройства, в том числе альбинизм и ахроматопсию. Вероятно, в будущем основой классификации станет генотип нистагма.
В классификации Рабочей группы Комитета по классификации глазодвигательных нарушений и косоглазия (The Committee for the Classification of Eye Movement Abnormalities and Strabismus Workshop — CEMAS) идиопатический нистагм, нистагм, связанный с заболеваниями глаз и аномалиями путей хиазмы сгруппированы в одну категорию, «синдром инфантильного нистагма». В этой классификации принимается неподтвержденное предположение об общем механизме развития нистагма при любой фоновой патологии.
Терминология, используемая при описании нистагма. Нистагм можно охарактеризовать на основании результатов клинического исследования пациента. С помощью окулографии удается более точно зафиксировать и описать траекторию колебаний при нистагме, что может способствовать диагностике. Для описания нистагма используются следующие параметры:
а) Плоскость. Колебания могут происходить в горизонтальной, вертикальной, торзионной (ротаторной) плоскостях, либо комбинированно в двух и более плоскостях.
б) Интенсивность. Интенсивность нистагма определяется скоростью движения глаз и рассчитывается как произведение амплитуды нистагма (в градусах) и его частоты (колебаний в секунду, в герцах).
в) Траектория движений. Нистагм можно классифицировать как толчкообразный (подергивающий) и маятникообразный. При толчкообразном нистагме колебания глаз включают в себя быструю и медленную фазы. Направление нистагма определяется по его быстрой фазе. В медленную фазу может регистрироваться ускоряющийся профиль, когда глаз сначала движется медленно, а затем все быстрее (например рисунке ниже при взгляде вправо).
Или же, наоборот, в медленную фазу может отмечаться профиль, указывающий на снижение скорости (например, рисунке ниже) или движение с постоянной скоростью. В отличие от толчкообразного, маятникообразный нистагм представляет собой синусоидальные колебания, при этом быстрая фаза короткая или отсутствует (например рис рисунке ниже в нулевой зоне). Двойной толчкообразный нистагм представляет собой комбинацию широких подергивающих колебаний, на которые накладываются маленькие маятникообразные колебания в той же плоскости.
г) Содружественность. Если оба глаза двигаются вместе, т.е. с одинаковыми амплитудой, частотой и в одной плоскости, нистагм называется ассоциированным. При несодружественном (диссоциированном) нистагме глаза двигаются с различными амплитудой (например ротаторные движения глаз на рисунке ниже), частотой и фазой (например вертикальные движения глаз на рисунке ниже) или вдоль разных плоскостей.
д) Фовеальная фиксация. При большинстве типов инфантильного нистагма наблюдаются периоды, когда движения глаз замедляются. В эти периоды замедления достигается фовеальная фиксация и повышается острота зрения, поэтому эти периоды называют периодами фовеальной фиксации.
е) Нулевая зона. Многие пациенты с инфантильным нистагмом предпочитают определенное направление взора, при котором интенсивность нистагма снижается и острота зрения становится оптимальной. Это направление взора называется нулевой зоной.
Если нулевая зона не совпадает с первичной позицией взора, у пациента может развиваться аномальное положение головы, позволяющее переместить нулевую зону прямо перед собой и повысить остроту зрения. Подобный пример приведен на рисунке ниже, нулевая зона достигается при взгляде вправо.
Инфантильный нистагм может изменяться в зависимости от нескольких факторов:
1. Изменения в зависимости от направления взора. У пациентов с альбинизмом и идиопатическим нистагмом обычно имеется нулевая зона. В стороне от нулевой зоны нистагм становится более толчкообразным и интенсивным.
2. Изменения со временем. У большинства пациентов при фиксации взгляда характер колебаний остается неизменным. Однако определенные формы нистагма изменяются с течением времени. При периодическом альтернирующем нистагме направление движений быстрой фазы периодически изменяются влево или вправо, при перемене направления отмечаются периоды отсутствия нистагма.
3. Изменения при прикрывании одного глаза. При манифестном латентном нистагме направление колебаний изменяется в сторону фиксирующего глаза.
Разработка способа лечения врожденного оптического нистагма и оценка его эффективности
Development of method of treatment of congenital
optic nystagmus and evaluation of it’s efficacy
V.I. Dolzhich, S.V. Yakovenko, I.S. Malyutina
Rostov State Medical University “Eximer” clinic, Rostov-on-Don
Purpose: to find the pathogenic basis of treatment method of congenital nystagmus and to evaluate it’s efficacy.
Materials and methods: 54 patients (108 eyes) with optic nystagmus at the age of 6-14 years old were examined. To evaluate ophthalmologic and neurophysiologic indices we took group of healthy children (n = 10) of the same age. Ophthalmologic examination included: visometry, refractometry with cycloplegia and usual accommodation tonus, ophthalmometry, echo biometry, ophthalmoscopy and electrophysiological examination.
Foe treatment of those patients we used instenon and glicin and also training in “Ambliocor”.
Results: Refractometry showed the prevalence of hypermetropic refraction with astigmatic component. Electrophysiological data showed that decrease of vision mainly depends on the decrease of functional activity of central part of visual analyzer and pathways. It was found out that there is a decrease of vision in all children with congenital nystagmus (n = 108). After the treatment electrophysiological indices and visual acuity increased.
Conclusion: Thus, method of combined treatment of nystagmus not only allows to improve visual functions but also to reach improvement of cortical and subcortical relations, mental faculties and adaptation abilities of the child.
Врожденный оптический нистагм имеет сложный патогенез и, как правило, сопровождается значительным снижением зрения. В школах для слабовидящих дети с врожденным оптическим нистагмом составляют от 20 до 40% в разных регионах России [3,5].
Непосредственным механизмом снижения зрения при оптическом нистагме некоторые авторы считают амблиопию и рекомендуют соответствующее лечение [2,3,5]. Другие авторы указывают на роль изменений корково–подкорковых отношений в механизме снижения зрения у детей с нистагмом [4,7].
Учитывая медико–социальное значение врожденного оптического нистагма, обусловленное снижением профессиональной адаптации, качеством жизни пациентов молодого возраста, разработка новых способов лечения и повышение зрения у такой категории больных является актуальной задачей в нейроофтальмологии.
Целью настоящей работы явилось патогенетическое обоснование способа лечения врожденного оптического нистагма и оценка его эффективности.
Материал и методы. Обследовано 54 пациента (108 глаз) в возрасте от 6 до 14 лет с оптическим нистагмом. Для оценки офтальмологических и нейрофизиологических показателей обследована группа детей (n = 10) аналогичного возраста офтальмологически и соматически здоровых. Офтальмологическое обследование включало: визометрию по общепринятым методикам с коррекцией и без нее, рефрактометрию в условиях циклоплегии и привычного тонуса аккомодации, офтальмометрию, эхобиометрию, офтальмоскопию.
Электрофизиологические исследования: определение порога электрической чувствительности сетчатки (ПЭЧ), электрической лабильности зрительного нерва (ЭЛ); исследование частотно–контрастной чувствительности с помощью компьютерной программы «Зебра» с использованием пространственных решеток различной частоты, ахроматических и цветовых решеток, предъявляющихся на мониторе компьютера; исследование зрительных вызванных корковых потенциалов (ЗВКП). Углубленное исследование биоэлектрической активности коры головного мозга осуществляли методом электроэнцефалографии (ЭЭГ) с определением амплитуды, индекса и частоты основных групп волн с локализацией максимальной электрической активности альфа–ритма.
Результаты и обсуждение. Офтальмологические методы обследования показали, что у всех детей основной группы с врожденным нистагмом (n = 108) острота зрения снижена. Рефрактометрия выявила преобладание частоты гиперметропической рефракции с астигматическим компонентом (табл. 1).
Данные таблицы 1 показывают, что у детей старшего возраста острота зрения ниже 0,1 встречается на 9,6% реже, чем в младшей возрастной группе. Это объясняется проводимым ранее лечением, включающим нейропротекторы и витамины. Однако у всех пациентов основной группы острота зрения не выше 0,3 с коррекцией.
Биомикроскопически установлено наличие признаков дисгенеза в виде membrane persistens, эмбриотоксона в 30 глазах (27,8%). Оптические среды прозрачны. Офтальмоскопически в 64,8% случаев определялось побледнение диска зрительного нерва без признаков проминенции, с нечеткими границами. В 35,2% случаев глазное дно – без патологии. У пациентов основной группы нистагм был маятникообразный, среднеамплитудный в 74% (80 глаз). В остальных случаях – ротационный.
Исследование электрофизиологических показателей позволило установить ряд различий у пациентов с нистагмом по сравнению с данными контрольной группы (табл. 2).
Данные таблицы 2 показывают, что порог ЭЧ у детей с нистагмом достоверно выше на 5% у пациентов в возрасте 6 – 9 лет. В старшей возрастной группе показатель порога ЭЧ сетчатки достоверно не изменился (р > 0,05). Достоверно снижен порог ЭЛ зрительного нерва на 28% у детей с нистагмом младшего возраста и на 27,1% у детей старшего возраста. Эти данные позволяют заключить, что при врожденном нистагме электрогенез сетчатки снижен незначительно и преобладает угнетение проводимости по зрительным путям к корковому центру.
Исследование вспышечных и паттерн ЗВКП показали, что у пациентов с оптическим нистагмом происходит обеднение компонентного состава ЗВКП, значительное и достоверное (р < 0,05) снижение амплитуды компонента Р100 до 6,3 ± 0,24 мкВ и достоверное (р < 0,05) увеличение латентности до 127,0 ± 2,7 мс. В контрольной группе амплитуда Р100 составила 9,8 ± 0,18 мкВ, латентный период 101,3 ± 0,58 мс. Компонент Р200 выражен слабо или вообще отсутствует. Анализ данных свидетельствует о низкой степени зрелости высших зрительных центров у детей с оптическим нистагмом.
При исследовании частотно–контрастной чувствительности отмечалось умеренное снижение общего уровня контрастной чувствительности, снижение или полное выпадение области высоких частот. У всех пациентов форма кривой отличалась от нормы. Снижение чувствительности в области высоких пространственных частот указывает на поражение зрительного анализатора на уровне среднего мозга и коры [4,6,7].
Данные ЭЭГ имеют существенное значение в изучении нейрофизиологических механизмов в патогенезе оптического нистагма у детей. Нами установлено, что у детей с нистагмом с низкой остротой зрения регистрируется 2 вида электроэнцефалограммы (ЭЭГ), в отличие от контрольной группы аналогичного возраста: 1) гиперсинхронная ЭЭГ с высоким нерегулярным альфа–ритмом с амплитудой до 100 мкВ и выше в сочетании с высокой амплитудой медленных волн и 2) дезорганизованная ЭЭГ с низким нерегулярным альфа–ритмом с амплитудой до 30 мкВ и преобладанием медленных волн – дельта и тета. Оба вида ЭЭГ подтверждают наличие незрелой коры, низкой ее биоэлектрической активности с преобладанием активности диэнцефальной области при гиперсинхронной ЭЭГ, что подтверждает патологию центрального отдела зрительного анализатора у детей и подростков с оптическим нистагмом.
Для детей контрольной группы в возрасте от 6 до 9 лет была характерна регистрация организованного альфа–ритма с амплитудой 50 – 58 мкВ (в среднем 53,3 ± 0,62 мкВ) в сочетании с медленными волнами – дельта и тета, фокус максимальной электрической активности регистрировался в затылочной области. У детей от 10 до 14 лет медленные волны на ЭЭГ не определялись, амплитуда альфа–ритма была достоверно (р < 0,05) выше, чем у детей младшего возраста, и составляет в среднем 58,1 ± 0,54 мкВ. Полученные результаты были характерны для организованной ЭЭГ. Сравнительная оценка данных ЭФИ показала, что в механизме снижения зрения ведущая роль принадлежит снижению функциональной активности центрального отдела зрительного анализатора и проводящих путей. В связи с этим нами разработана схема комплексного лечения, направленная на коррекцию выявленных изменений. В качестве медикаментозного компонента нами были выбраны препараты инстенон и глицин.
Выбор лекарственных препаратов обусловлен их фармакологическим действием [8]. Препарат инстенон содержит 50 мг этамивана, 20 мг гексобендина дигидрохлорида, 60 мг этофиллина. Совокупность компонентов обеспечивает активирующее воздействие на лимбическую и ретикулярную формацию ствола мозга, что приводит к адекватному функционированию нейронных компонентов коры и подкорково–стволовых структур, в основном за счет этамивана.
Гексобендин, входящий в состав препарата, улучшает церебральный кровоток, стимулирует нейрональный метаболизм, восстанавливает синаптические связи. При этом очень важен факт отсутствия так называемого «синдрома обкрадывания», наблюдаемого при назначении других вазотропных препаратов.
Этофиллин – стимулирует подкорковые образования, центры вегетативной регуляции. У детей с оптическим нистагмом в сочетании с дезорганизованной низкоамплитудной ЭЭГ инстенон вызывает состояние активации коры.
Препарат глицин – заменимая аминокислота, центральный медиатор тормозного типа действия; улучшает метаболические процессы в тканях мозга, повышает умственную работоспособность. У детей с оптическим нистагмом в сочетании с гиперсинхронной ЭЭГ глицин вызывает состояние релаксации коры.
Лечение проводилось на фоне тщательно подобранной очковой или контактной коррекции. Кроме этого, в технологию способа лечения нистагма дополнительно подключен аппаратный комплекс «Амблиокор – 01», позволяющий воздействовать на корковый отдел зрительного анализатора в виде тренинга параметров биоэлектрической активности корково–подкорковых отделов зрительного анализатора в заданном направлении [1]. Мы предлагаем у пациентов с врожденным оптическим нистагмом выставлять режим на аппаратном комплексе «Амблиокор – 01» с учетом исходной ЭЭГ. Лечение осуществлялось следующим образом: первоначально на электроэнцефалографе записывают ЭЭГ и с учетом амплитуды альфа–ритма ЭЭГ назначают медикаментозное лечение: при наличии дезорганизованной низкоамплитудной ЭЭГ, когда амплитуда альфа–ритма ниже 30 мкВ или вообще не определяется, назначают инстенон per os по 1 таблетке 2 раза в день ежедневно 2 недели, а при регистрации высокоамплитудной гиперсинхронной ЭЭГ с амплитудой альфа–ритма 100 мкВ и выше назначают глицин по 1 таблетке 100 мг под язык 2 раза в день ежедневно 2 недели, после чего проводят видеотренинг с помощью прибора «Амблиокор – 01» 2 недели, одновременно продолжая прием ранее назначенных препаратов. Режим воздействия зависит от данных ЭЭГ: при дезорганизованной низкоамплитудной ЭЭГ режим – «релаксация», при высокоамплитудной гиперсинхронной ЭЭГ – режим «активация». Ежедневный мониторинг в течение 2–х недель способствует выработке условного рефлекса, направленного на коррекцию биоэнергетики коры головного мозга в заданном направлении, которая нормализуется продолжающейся дифференцированной медикаментозной терапией, направленной на усиление при дезорганизованной низкоамплитудной ЭЭГ и на расслабление при высокоамплитудной гиперсинхронной ЭЭГ.
В результате проведенного лечения отмечается повышение остроты зрения и улучшение показателей ЭФИ (табл. 3).
Данные таблицы 3 показывают, что после комплексного лечения повысилась острота зрения до 0,4 – 0,5 в 20 – 22,9% случаев, а низкая острота зрения (ниже 0,1) повысилась до 0,1 – 0,2 в 21,7% в младшей возрастной группе и в 18,7% в старшей возрастной группе.
Патогенетическая направленность предложенного способа подтверждается улучшением показателей порога ЭЛ зрительного нерва на 16,2% в младшей возрастной группе, на 17% в старшей возрастной группе и данных ЭЭГ. У 38 детей (70,4%) при регистрации ЭЭГ отмечается организованная альфа–активность с повышением амплитуды альфа–ритма в пределах 54 – 56 мкВ, с локализацией фокуса максимальной электрической активности в затылочной доле коры головного мозга.
Таким образом, предложенный способ повышения зрительных функций у детей с оптическим нистагмом (заявка № 2005132147/14), с учетом особенностей исходной ЭЭГ и ее медикаментозной коррекции позволяет с помощью тренинга на аппаратном комплексе «Амблиокор – 01» не просто повысить зрительные функции, но и добиться улучшения корково–подкорковых отношений, повысить умственные способности и поведенческую адаптацию ребенка с оптическим нистагмом, что в целом можно обозначить, как улучшение качества жизни этой категории пациентов.
Статья принята в печать 12 сентября 2006 г.
Литература
1. Авдеева А.А., Михайленок Е.Л., Мошетова Л.К. Видеокомпьютерная коррекция зрения в лечении глазных заболеваний // Методические рекомендации. РМАПО. – М., 2000. – С. 1 – 5.
2. Аветисов Э.С., Смольянинова И.Л., Шаповалов. С.Л. и др. Новые возможности улучшения зрительных функций при нистагме // Вестн. офтальмол. – 1979. – № 3. – С. 26 – 32.
3. Аветисов Э.С. Система мер по улучшению зрительных функций при нистагме // Методические рекомендации МНИИ глазных болезней им. Гельмгольца. – М., 1980. – С. 13.
4. Должич Г.И., Щербакова Е.М. Роль нейрофизиологических механизмов в патогенезе оптического нистагма // Вестн. офтальмол. – 2002. – Т. 118, № 6. – С. 19 – 21.
5. Проскурина О. В. Аккомодационная способность глаз у больных
оптическим нистагмом и возможности ее восстановления: Дис. Е канд. мед. наук. – М., 1994. – 178с.
6. Шелепин Ю.Б., Колесникова Л.Н., Левкович Ю.И. Визоконтрастометрия. Измерение пространственных передаточных функций зрительной системы. – Л.: Наука, 1985.
7. Щербакова Е.М. Состояние зрительных функций у детей с оптическим нистагмом с учетом нейрофизиологических особенностей: Дис. Е канд. мед. наук. – Р., 2000. – 111с.
8. Регистр лекарственных средств России. – Доктор. М., – 1999. – С.342, 448.
Вертикальный нистагм: диагностическое значение и требования к проведению оценки по данным литературы
Ключевые слова: вертикальный нистагм, вестибулярная дисфункция, вестибулоокулярный рефлекс, видеоокулография, центральные вестибулярные нарушения.
Для цитирования: Вавилова А.А. Вертикальный нистагм: диагностическое значение и требования к проведению оценки по данным литературы. РМЖ. 2018;10(II):79-83.
Vertical nystagmus: diagnostic value and requirements for evaluation according to the literature data
A.A.Vavilova
Nikiforov All-Russian Center for Emergency and Radiation Medicine, Saint Petersburg
The article is devoted to the study of vertical nystagmus as a sign of central vestibular disorders in neurological and otorhinolaryngological practice. Vertical nystagmus is believed to indicate central vestibular disorders. The modern models that explain its mechanism are outlined. Based on the literature data, the requirements for the evaluation of this pathology are discussed.
Own observations of vertical nystagmus in 5 patients, obtained during the examination of 60 patients with complaints of dizziness, which were conducted in the departments of otorhinolaryngology and maxillofacial surgery of Nikiforov All-Russian Center for Emergency and Radiation Medicine, are given. Registration of spontaneous nystagmus in the course of an otoneurological examination was carried out using video-oculography.
It is noted that vertical nystagmus was rarely detected in the examined patients (in 5 out of 60), which can be explained by the fact that patients with peripheral vestibular pathology dominate in otorhinolaryngological practice. It was detected only in the dark and was detected in patients with central vestibular disorders. It is discussed that the common factors of its change in positional samples (when placed on the back, turning in this position of the head to the side, etc.) for problems of topical diagnosis require further study. The article is addressed to the attention of neurologists and otorhinolaryngologists.
Key words: vertical nystagmus, vestibular dysfunction, vestibuloocular reflex, videooculography, central vestibular disorders.
For citation: Vavilova A.A. Vertical nystagmus: diagnostic value and requirements for evaluation according to the literature data // RMJ. 2018. № 10(II). P.79 –83.
Статья посвящена вопросам исследования вертикального нистагма как признака центральных вестибулярных нарушений в неврологической и оториноларингологической практике. Обсуждаются требования к оценке данной патологии.

Введение
Вертикальный нистагм (ВН) — вид спонтанного нистагма с ритмическим подергиванием глазных яблок в вертикальной плоскости, при котором быстрый компонент направлен вверх или вниз. Считается, что ВН свидетельствует о вестибулярных нарушениях центрального характера.
Патогенез ВН
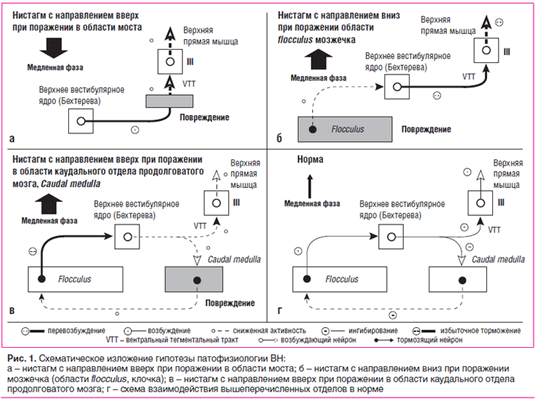
В большом числе работ показано, что направленный вверх нистагм (в англоязычной литературе: upbeat nystagmus или upbeating nystagmus — бьющий вверх нистагм) возникает при поражениях на уровне моста, среднего мозга, реже — каудальной части ствола [1, 2].
Он возникает в результате нарушения передачи импульса от верхнего вестибулярного ядра в области моста к глазодвигательным ядрам (III пара черепных нервов), расположенным в среднем мозге. Предполагается, что эта передача осуществляется посредством волокон ventral tegmental tract, проходящих в вентральной области покрышки среднего мозга [3]. АвторамиC.Pierrot-Deseilligny и D.Milea (2005) предложена гипотеза, которая объясняет механизм ВН вниз следующим образом: при поражении в этой зоне происходит гипоактивация передаваемого импульса, что приводит к снижению активности мотонейронов, действующих на мышцы, поднимающие глазное яблоко. Это вызывает появление медленного компонента нистагма, направленного вниз, его прерывает быстрый компонент вверх, генерируемый саккадической системой (иллюстрация этого механизма, представленная в статье C.Pierrot-Deseilligny и D.Milea (2005), приводится на рис. 1а).
Повреждение в области вентрального тегментального тракта (ventral tegmental tract), идущего от верхнего вестибулярного ядра (Superior vestibular nucleus, ядра Бехтерева) к глазодвигательному ядру (III пара), приводит к гипоактивности мотонейронов мышцы, поднимающей глазное яблоко, что приводит к медленной фазе движений глаз вниз (см. рис. 1а).
В норме мозжечок подавляет верхнее вестибулярное ядро, повреждение в мозжечке приводит к дезингибиции верхнего вестибулярного ядра и в конечном итоге к гиперактивности мотонейронов мышцы, поднимающей глазное яблоко, что приводит к медленной фазе движений глаз вверх (рис. 1б). Продолговатый мозг может получать коллатеральную ветвь от верхнего вестибулярного ядра и оказывать в норме ингибирующее действие на флокулярную зону мозжечка. При повреждении же (рис. 1в) в продолговатом мозге происходят нарушение ингибирующего влияния мозжечка, гиперактивация верхнего вестибулярного ядра и медленное движение глаз вниз, как в случае, представленном на рисунке 1а.
Схема взаимодействия вышеперечисленных отделов в норме (рис. 1г) получена из клинических результатов, наблюдаемых в случаях, показанных на рис. 1а, 1б и 1в, и экспериментальных данных при опытах на кошках и обезьянах. По мнению авторов, схема применима в восходящей вестибулярной системе и, по-видимому, не имеет эквивалента в нисходящей системе.
По данным МРТ у пациентов с направленным вверх нистагмом причинами нарушений в указанных зонах ствола головного мозга наиболее часто были: ишемический инсульт [1], реже — геморрагический инсульт, очаги рассеянного склероза [4]. Нистагм вверх также может наблюдаться при мигрени, энцефалите, энцефалопатии Вернике, интоксикациях [2]. Сообщают о появлении нистагма с направлением вверх как побочного действия применения транквилизаторов группы селективных ингибиторов обратного захвата серотонина [5].
Нистагм с быстрым компонентом вниз (downbeat nystagmus — бьющий вниз нистагм), по имеющимся данным, обусловлен различными поражениями мозжечка — они могут локализоваться во флокуло-нодулярной зоне, в парафлокулярной зоне и в области язычка. Механизм ВН вниз объясняют следующим образом. В норме мозжечок оказывает ингибирующее действие на вестибулярные ядра. При поражении мозжечка его подавляющая функция ослабевает [6]. Дезингибиция приводит к гиперактивности вестибулярных ядер и усилению импульса мотонейронов к мышцам, поднимающим глазное яблоко, а в результате — к вестибулоокулярному рефлексу с медленным компонентом вверх, прерываемым быстрым компонентом вниз [3]. (Схематическое изображение этой гипотезы, представленное в статье C.Pierrot-Deseilligny и D.Milea (2005), приведено на рис. 1б).
Как показало сопоставление данных нистагмометрии и МРТ, у пациентов с нистагмом вниз мозжечковые нарушения наиболее часто были вызваны краниоцервикальной аномалией (аномалией Арнольда — Киари I типа), мозжечковой дегенерацией [3], опухолью, полинейропатией [7]. Причинами нистагма вниз также могут быть диффузное заболевание (например, энцефалит), рассеянный склероз, интоксикации (алкоголем, препаратами лития, противоэпилептическими, антиаритмическими препаратами) [8, 9].
Оценка ВН
Описание исследования вертикального нистагма
Материал и методы
С учетом перечисленных выше позиций мы проанализировали данные вестибулометрии 60 пациентов в возрасте от 21 до 79 лет (34 женщины и 26 мужчин), которые были обследованы вестибулологом-оториноларингологом в связи с жалобами на головокружение амбулаторно и в стационаре в отделениях оториноларингологическом и челюстно-лицевой хирургии ВЦЭРМ им. А.М.Никифорова. У большинства пациентов имелась вестибулярная дисфункция периферического характера (вследствие вестибулярного нейронита, отолитиаза, болезни Меньера, хронического среднего отита и др.); у меньшей части выявлялись центральные вестибулярные нарушения (вследствие сосудистых нарушений, заболеваний шейного отдела позвоночника, рассеянного склероза); у некоторых пациентов имелись смешанные вестибулярные нарушения. Всем пациентам проводились традиционные отоневрологические тесты (визуальная оценка глазодвигательных реакций, оценка координации, равновесия, исследование функции других черепных нервов), осмотр ЛОР-органов, исследование слуха. Пациентам, у которых предполагались центральные вестибулярные нарушения, выполнялись дополнительные исследования: МРТ головного мозга, ангиография сосудов головного мозга, проводилась консультация невролога. Для регистрации различных видов нистагма использовалась видеоокулография (видеоокулограф производства Interacoustics, Дания). С помощью видеоокулографии выполнялась оценка спонтанного нистагма на свету и в темноте в положении сидя, нистагма с поворотом головы на 90° вправо и влево, проводилась проба Дикса — Холлпайка и позиционные тесты: запись нистагма в положении лежа на спине и с последующими поворотами головы вправо и влево. Некоторым пациентам в связи с выраженностью вестибулярной дисфункции объем исследования ограничивали исследованием спонтанного нистагма в положении сидя и лежа.
Результаты и обсуждение
Как видно из таблицы 1, наиболее часто у пациентов выявлялся горизонтальный спонтанный нистагм (у 36 из 60), в подавляющем большинстве случаев он выявлялся в темноте (в дополнение к данным, указанным в таблице, отметим, что «шейный» нистагм в положении сидя при поворотах головы на 90° вправо или влево выявлен у 3 пациентов; вертикально-ротаторный нистагм в тесте Дикса — Холлпайка, подтверждающий доброкачественное пароксизмальное позиционное головокружение, отмечен у 8 пациентов).
ВН, соответствующий указанным выше требованиям к исследованию ВН и его оценке в пунктах 1 и 5, обнаруживался только у 5 пациентов из 60 — у 4 пациентов он был направлен вверх и у 1 пациента — вниз. Во всех случаях ВН был выявлен только в темноте, головокружением не сопровождался. В положении лежа на спине у 4 пациентов с ВН вверх интенсивность нистагма возрастала, как, например, у пациента Ж. (рис. 2), и это не сопровождалось головокружением. У пациента с нистагмом вниз отмечалось усиление нистагма в положении на спине с поворотом головы вправо.
У 3 из 5 пациентов с ВН, помимо вертикального компонента, имелся менее интенсивный горизонтальный компонент нистагма (рис. 3), и это делало направление нистагменных ударов при просмотре видеозаписей визуально более похожим на диагональные движения.
У 4 пациентов с ВН вверх, по данным МРТ, отсутствовали очаговые изменения головного мозга, однако по совокупности данных анамнеза, отоневрологического осмотра и исследования сосудов головного мозга их состояние было расценено как хроническая вестибулопатия (у 3 пациентов) и затянувшаяся вестибулопатия (у 1 пациента) центрального характера сосудистого генеза. Опираясь на имеющиеся в литературе представления о генезе ВН вверх, можно предположить, что сосудистые нарушения у этих 4 пациентов затрагивали область ствола головного мозга. У 1 пациента с ВН вниз за 7 дней до обследования проведена операция на шейном отделе позвоночника (шейная дискэктомия, корпородез С5/С6), и возникновение нистагма вниз можно было объяснить с позиций возможного ухудшения кровоснабжения в бассейне мозжечковых артерий в послеоперационном периоде.
Заключение
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:
