Методы лучевой терапии при раке ротоглотки
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Методы лучевой терапии при раке гортани
а) Лучевая терапия складочного отдела гортани. Новообразования голосовых складок ранних стадий имеют низкую метастатическую активность, поэтому зачастую они могут быть успешно устранены использованием лишь одного метода лечения. На ранних стадиях применяется либо хирургическое, либо лучевое лечение; распространенные формы рака требуют комбинации хирургического, лучевого и химиотерапевтического воздействия.
При распространенных опухолях мультидисциплинарный подход позволяет достичь максимального излечения, сохранить функцию пораженного органа, ограничить регионарное распространение, а также гораздо проще приспособиться к сопутствующим заболеваниями пациента и его индивидуальным предпочтениям.
Избирательное облучение гортани, не затрагивающее регионарные лимфоузлы, позволяет минимизировать повреждение крупных слюнных желез, нижней челюсти, ротоглотки и полости рта. Важны длительность курса и общая доза облучения. Оптимальная продолжительность курса составляет менее шести недель. У пациентов с опухолью стадии Т2 и с нарушением подвижности голосовой складки улучшить контроль над местным ростом опухолевой ткани можно посредством гиперфракционированного облучения (однако возрастает и общая токсичность).
Опухоли стадии Т2, поражающие надскладочный отдел гортани, могут потребовать селективного воздействия на лимфоузлы шеи. Подавления опухолевого роста можно добиться более чем в 90% случаев на стадии Т1, и более чем в 80% на стадии Т2.
При распространенном раке гортани стандартом лечения остается тотальная ларингэктомия с последующей лучевой терапией. Министерством по делам ветеранов США было организовано исследование эффективности лечения больных с раком гортани (Department of Veterans Affairs (VA) Laryngeal Cancer Study). Согласно его результатам, добиться сохранения функции гортани удалось у 2/3 пациентов, которым проводилась индукционная терапия тремя курсами 5-фторурацила/цисплатина с последующей лучевой терапией.
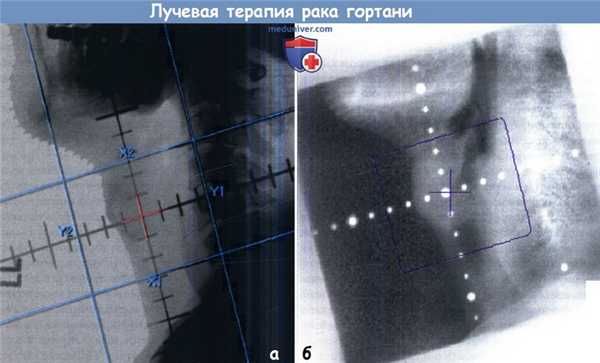
Рак гортани ранней стадии, локализующийся в области голосовой щели.
Двухмерная техника с использованием противоположных латеральных полей. Верхняя и нижняя границы устанавливаются с учетом подвижности гортани, которая будет отмечаться во время лечения.
Обратите внимание на то, что лимфоузлы не облучаются.
В качестве контрольной группы были выбраны пациенты, которым выполнялась тотальная ларингэктомия с последующей послеоперационной лучевой терапией. Разницы в выживаемости между двумя группами получено не было. Последующее крупное рандомизированное международное исследование сравнило курс лечения министерства по делам ветеранов (VA) с химиолучевой терапией и с изолированной лучевой терапией. Согласно его результатам, химиолучевая терапия позволяет добиться большей вероятности сохранения гортани, чем курс министерства (с 75% до 88%), поэтому на данный момент химиолучевая терапия является стандартом лечения.
Статистически значимой разницы в выживаемости между тремя группами получено не было (из-за высокой частоты выполнения ларингэктомий в качестве «терапии отчаяния»).
Следовательно, для пациентов с хорошим функциональным статусом гортани рекомендуется проведение семинедельной лучевой терапии с общей дозой в 70 Гр в сочетании с тремя курсами цисплатина в высоких дозах (100 мг/м 2 ). В качестве альтернативы может использоваться индукционная трехкомпонентная (TPF) химиотерапия с последующей лучевой терапией, данная схема также позволяет добиваться высокой частоты сохранения гортани. Две эти схемы лечения рака гортани не сравнивались в рандомизированных исследованиях.
У ослабленных пациентов, которые не могут перенести стандартный курс химиотерапии, может использоваться либо изолированная лучевая терапия, либо лучевая терапия в сочетании с биологической терапией (моноклональные антитела против ЭФР).
У пациентов, получающих изолированную лучевую терапию, можно использовать либо курс модифицированного фракционного облучения (либо с гиперфракционированием, либо ускоренным курсом), поскольку превосходство двух этих схем над стандартной однодневной схемой облучения была продемонстрирована в исследовании RTOG 90-03.
Из названных выше исследований исключались пациенты, у которых опухоль прорастала в хрящи гортани и/или окружающие мягкие ткани. В данной группе стандартом лечения является ларингэктомия с последующей адъювантной лучевой терапией и, возможно, химиотерапией.
б) Лучевая терапия надскладочного отдела гортани. Пациенты с опухолями надскладочного отдела нуждаются в терапии лимфоузлов шеи даже на ранних стадиях заболевания, поскольку риск их вовлечения крайне высок. Первичная опухоль может распространяться в окологортанное пространство, вызывая фиксацию голосовых складок; в преднадгортанное пространство с поражением корня языка; через щитовидный хрящ проникать в мягкие ткани шеи; при латеральном распространении возможно поражение горганоглотки.
Опухоли Т1/Т2 надскладочного отдела требуют лечения первичного очага и лимфатических узлов уровней II—IV. Как и при раннем раке голосовых складок, в данном случае можно использовать какой-то один метод лечения. При лучевой терапии используют дозу 66-70 Гр для первичного очага и 50-54 Гр для элективного лечения лимфоузлов шеи. При использовании традиционных схем возможно избежать облучения околоушных слюнных желез и верхнего констриктора глотки.
При распространенных опухолях у пациентов с исходным хорошим функциональным статусом гортани и удовлетворительным общим состоянием используется химиолучевая терапия. При значительном нарушении функции гортани и/или распространении опухоли за пределы органа прибегают к ларингэктомии с последующей адъювантной лучевой терапией.
в) Лучевая терапия подскладочного отдела гортани. Опухоли, расположенные под голосовыми складками, встречаются крайне редко. Визуализировать их сложно даже с использованием эндоскопического оборудования, часто для этого требуется общая анестезия. Из-за своего скрытого расположения данные новообразования часто диагностируются уже на поздних стадиях, когда опухоль распространяется в трахею и мягкие ткани шеи.
Они способны метастазировать в нижние шейные лимфоузлы и верхние лимфоузлы средостения. Комбинированное хирургическое лечение показано при опухолях Т4 стадии, в остальных случаях прибегают к лучевой терапии, захватывающей и первичный очаг опухоли, и пути лимфатического оттока.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Рак гортани III стадии
Рак гортани III стадии характеризуется распространенностью опухоли с поражением 1-3 ее анатомических отделов, без выхода за пределы органа, а также с/без поражением одного л/узла шеи (с его увеличением не более 3см). Исходя из вышеизложенного, основным признаком рака гортани третьей стадии является паралич одной или обеих голосовых складок, что может сопровождаться осиплостью или потерей голоса , а при двухстороннем поражении голосовые складки могут полностью перекрывать просвет гортани, не позволяя пациенту адекватно дышать (вплоть до асфиксии, из-за чего еще до начала лечения может выполняться трахеостомия).
При поражении же лимфатического узла шеи пациент может сам заметить появление «припухлости» на шее, которое более ничем не беспокоит (узел , как правило, безболезненный).
Дополнительными специфическими симптомами, на которые пациент может обратить внимание врача, могут быть:
- ощущение комка в горле при глотании,
- поперхивание, кашель ( в мокроте могут определяться прожилки крови)
- боль в горле в покое и при глотании
- неприятный (гнилостный) запах изо рта
Общими симптомами для многих онкологических заболеваний и , в частности, для рака гортани являются:
- повышенная до субфебрильных и фебрильных (при присоединении бактериальной инфекции) значений температура тела
- постоянное недомогание;
- анемия
- снижение массы тела
- быстрая утомляемость
- апатия, сонливость
Диагностика рака на III стадии
Для проведения диагностики рака на третьей стадии врач тщательно собирает анамнез болезни со слов больного, ориентируясь в первую очередь на его жалобы.
Далее, исходя из данных анамнеза и физикального осмотра (внешний осмотр и пальпация), назначается план обследования. Основными пунктами этого плана являются следующие методы обследования:
- Непрямая и Прямая ларингоскопия (фиброларингоскопия). Последняя позволяет произвести осмотр всех отделов гортани с максимальной четкостью. Введение инструмента в гортань не причиняет какого-либо вреда больному, позволяя выполнить высококачественную фото и видеосьёмку.
- Во время фиброларингоскопии выполняется биопсия опухоли и полученные образцы тканей отправляются на гистологическое (включая иммуногистохимическое) и цитологическое исследования для постановки морфологического диагноза (чтобы понять какого строения опухоль, степень ее дифференцировки)
- УЗИ шеи и органов брюшной полости ( для исключения или определения метастазов, их локализации и размеров)
- Рентгенография органов грудной клетки ( для исключения метастазов в легких)
Современная медицина дает возможность не только диагностировать заболевание, но и выявить его особенности.
Если полученных данных врачу недостаточно для постановки диагноза или определения операбельности, то прибегают к назначению уточняющих или дополнительных методов диагностики:
- компьютерная томография (КТ) шеи, органов грудной клетки
- магнитно-резонансная томография (МРТ) шеи, органов грудной клетки, органов брюшной полости)
- Радиоизотопное исследование костей скелета
- определение связи опухоли с наличием HPV (ВПЧ) – инфекции (ВПЧ – Вирус Папилломы Человека)
- молекулярно-генетическая диагностика опухолевой ткани ( при планировании таргетной или иммунной терапии)
Вышеперечисленные диагностические методы необходимы для правильной постановки диагноза и назначения соответствующего лечения.

Лечение рака на III стадии
Среди всех больных раком гортани, обращающихся за помощью в медицинские учреждения, пациенты с III стадией составляют самую многочисленную и разнообразную по распространенности группу. В связи с чем эти пациенты являются самыми сложными в диагностике и выборе тактики лечения. Именно поэтому для борьбы с раком на третьей стадии чаще всего применяется комплексная терапия (сочетание хирургического, лучевого и лекарственного лечения). Только своевременное начало и правильное сочетание всех вышеуказанных видов лечения, как правило, позволяет добиться максимального эффекта, т.е. излечения от данного заболевания.
Хирургическое лечение
Наиболее радикальным видом лечения рака гортани продолжает оставаться хирургическое (ларингэктомия/резекция гортани + шейная лимфодиссекция). Но больше всего данное положение относится к складочной локализации опухолевого процесса и при четких границах первичной опухоли. Далее, при условии радикально выполненной операции, эффект может быть закреплен лучевой терапией. Существующие в настоящее время голосовые протезы, устанавливаемые одномоментно с удалением гортани, позволяют в максимально короткие сроки (от 2-х недель спустя от дня операции) вернуться пациенту к достойному качеству жизни без потери голоса.
Химиотерапия
При инфильтративных опухолях и распространении на надскладочный отдел наиболее эффективным признано начало лечения с химиотерапии (неоадъювантная) или сочетанного химиолучевого лечения. Стандартной схемой первой линии является TPF (таксаны, препараты платины, 5-фторурацил). Проведение одного курса занимает 4-5 дней в условиях стационара. Цикл 21 день (это означает , что от первого дня первого курса химиотерапии до первого дня второго курса должно пройти 3 недели). После 2-3 курсов назначается контрольное обследование, оценивается эффект и консилиумом определяется дальнейшая тактика. При сочетанном химиолучевом лечении во время лучевой терапии еженедельно вводятся препараты платины. Схема полихимиотерапии, дозировки препаратов и режимы введения определяются химиотерапевтом индивидуально для каждого больного, исходя из его общего состояния, показателей обследования, а также из вида и распространенности опухоли.
В ряде случаев, при условии высокой чувствительности опухоли (это выясняется в процессе лечения), излечение может наступить и без выполнения операции.

Лучевая терапия
Лучевая терапия, как и химиотерапия, в моноварианте не применяется при раке гортани III стадии. В сочетании с химиотерапией, при условии высокой чувствительности опухоли, применяется в виде радикального курса (с доведением суммарной очаговой дозы до 65-70 Гр). Лечение проводится в режиме 5 дней в неделю по РОД 2Гр/день, соответственно длится около семи рабочих недель. Режим послеоперационной лучевой терапии радиолог определяет индивидуально, исходя из факторов прогноза (определяются по данным гистологического исследования операционного материала).
Диета
Питание больного раком гортани должно препятствовать усугублению изначальных симптомов заболевания и побочных эффектов лечения, а также истощению организма. Пищу необходимо хорошо термически и механически обрабатывать, дабы она не травмировала глотку и быстро усваивалась. Температура продуктов перед употреблением должна быть близка к комнатной. Употребляемые продукты тщательно измельчаются и принимаются небольшими порциями 5-6 раз в сутки. Объем потребляемой воды не менее 2-х литров.
- слизистые протертые супы, сваренные на нежирном мясном бульоне;
- полувязкие крупяные каши, сваренные на воде пополам с молоком;
- отварные блюда из рыбы, измельченные с помощью блендера;
- овощные пюре из картофеля, моркови, тыквы, свеклы и капусты;
- фруктовые, овощные свежевыжатые соки ( исключить кислые)
- кисломолочные продукты, включая йогурты, кефир и ряженку.
Обязательно следует учесть, что пища не должна быть жареной, острой, содержать специи и приправы. Также следует отказаться от кофе, крепкого чая и алкогольных напитков.
Прогноз
Если диагноз был поставлен правильно, а лечение начато своевременно, то пятилетняя выживаемость пациентов, у которых диагностирован рак гортани на третьей стадии, составляет около 50-80%. Пациенту нужно помнить , что это зависит не только от множества вышеперечисленных факторов, включая опыт и уровень профессионализма врача, технического и медикаментозного обеспечения клиники, но и от собственного желания пациента вылечиться. Тщательное следование рекомендациям врача до, во время и после лечения не менее важны в достижении позитивного результата в борьбе с заболеванием.
Лучевая терапия при раке гортани
Лучевая терапия при раке гортани - один из способов борьбы патологией. Обычно метод применяют в комплексе с хирургическим вмешательством и химиотерапией. Это позволяет добиться наиболее эффективного результата.
Метод безболезненный. Пациент не ощущает излучение. Для него процедура схожа с воздействием рентгена. Врачи настраивают оборудование так, чтобы облучению подвергалось только злокачественное новообразование, а другие ткани попадали под воздействие минимально. В результате происходит разрушение клеток опухоли, и её размер постепенно уменьшается.
Метод применяют как перед, так и после операции. Способ используют в качестве подготовки к хирургическому вмешательству, применяют для предотвращения рецидивов. Однако полностью исключить вероятность воздействия на окружающие ткани невозможно. Поэтому возможно возникновение ряда побочных эффектов, о которых следует знать заранее. Назначая химиотерапию, врачи оценивают возможный вред и пользу, затем подбирают оптимальный способ, позволяющий добиться положительного результата с минимальными последствиями для пациента.
Место лучевой терапии в лечении при раке горла
Часто лечение рака гортани лучевой терапией используют в качестве первичного методы борьбы с проблемой. Если заболевание находится на начальной стадии, воздействие излучения позволяет полностью излечиться, в последующем потребуется лишь тщательный контроль для своевременного выявления рецидивов. Метод позволяет предотвратить рост новообразований, а также сохранить голос.
Целесообразность применения способа оценивают, исходя из индивидуальных особенностей ситуации. Во внимание принимают:
· место локализации опухоли;
· глубина прорастания в ткани органов.
Если заболевание находится на ранней стадии, облучение проводят порядка 5 раз в неделю. Обычно его выполняют по рабочим дням. Затем делают перерыв на выходные. Курс лечения составляет 3-7 недель. Во внимание принимают общий объём дозы. Её рассчитывают на весь курс. Чтобы пациент легче перенес воздействие, её делят на фракции. В результате удается минимизировать риск возникновения нежелательных побочных эффектов.
Если выявлен рак гортани, и новообразование не успело распространиться за пределы первичного очага поражения, используют или лучевую терапию, или оперативное вмешательство. В ином случае появляется потребность в обучении и проведении сопутствующей химиотерапии. Однако оценивают индивидуальный клинический сценарий. Возможно проведение хирургической операции и последующее использование химиотерапии и лучевой терапии.
Порядок действий напрямую зависит от особенностей проблемы. Если в соответствии с планом лечения предусмотрено только воздействие на первичный очаг поражения, осуществляется дополнительная обработка близлежащих зон. Иногда присутствует потребность в хирургическом удалении лимфоузлов. Метод применяют, если патология успела затронуть их, раковые клетки в вышеуказанных зонах после завершения лучевой терапии погибают.
Проведение операции возможно как до, так и после облучения. В большинстве случаев метод воздействия используют после хирургического вмешательства. Процедуру применяют, чтобы не допустить появление опухоли, а также разрушить все оставшиеся злокачественные клетки. Во время операции невозможно удалить всю опухолевую ткань.
Иногда опухоль настолько разрастается, что проведение операции не представляется возможным. В этом случае лучевую терапию используют в качестве метода первоначальной подготовки. Она позволяет уменьшить размер опухоли, сделав её операбельной. После этого возможно оперативное вмешательство.
Виды лучевой терапии при раке гортани
Разбираясь, как проходит лучевая терапия при раке горла, следует уделить внимание её видам. Эта особенность влияет на нюансы выполнения процедуры. В целом метод делят на:
1. Дистанционную лучевую терапию при раке горла. Суть процедуры состоит в использовании мощного протонного или рентгеновского луча. Его направляют в ту зону, где локализована опухоль. Предварительно детально выясняют место локализации новообразования. При этом генерация лучей происходит вне организма пациента. Обычно используют линейный ускоритель. Он создаёт рентгеновское или фотонное излучение. Иногда применяют циклотрон или синхротрон. Они генерируют протонный пучок. Излучение направляют на место локализацию опухоли, в результате происходит уничтожение раковых клеток. Если оборудование настроено грамотно, первичная диагностика проведена правильно, что позволило точно выявить место локализации опухоли, создаётся минимальное воздействие на здоровые ткани. В результате они практически не повреждаются во время процедуры.
Разбираясь, сколько длится курс лучевой терапии при раке гортани, следует учитывать, когда назначают процедуру. Так, метод нередко применяют после операции. Такой способ лечения называют адъювантной терапией. Он позволяет минимизировать риск возникновения рецидивов. Лечение проводят ежедневно с понедельника по пятницу. Общая продолжительность курса составляет 4-6 недель.
Возможно проведение протонной терапии. Она позволяет оказать воздействие непосредственно на опухоль, минимизируя вред, с которыми могут столкнуться здоровые ткани. В результате в некоторых случаях удается улучшить контроль над заболеванием, минимизировать вероятность возникновения побочных эффектов.
Возможно совмещение лучевой терапии и химиотерапии или с биологической терапией. Метод применяют в случае выявления рака гортани 3-4 стадии. Иногда вышеуказанные методы лучше работают в комплексе. В результате можно добиться лучшего контроля над заболеванием или уменьшить величину опухоли.
Радиотерапия способна минимизировать симптоматику болезни. Такой способ применяют, если проведение хирургической операции невозможно. Метод называют паллиативным. Опухоль может создавать трудности при глотании, вызывать боли, мешать в процессе дыхания. Радиотерапия ослабляет проявление болезни, замедляет рост новообразования, уменьшает его размер. Количество процедур м их продолжительность в этом случае зависит от особенностей ситуации.
Как проходит лучевая терапия рака горла
Разбираясь, сколько длится курс лучевой терапии при раке гортани, следует принимать во внимание все особенности выполнения процедуры. Так, в рамках первичного посещения врача-онколога, предстоит пройти консультацию и медицинский осмотр. Специалист попросит рассказать обо всех особенностях заболевания. Затем назначают дополнительную консультацию. К процессу лечения рака могут быть привлечены:
На основании рекомендаций специалиста будет составлен план дальнейшего лечения. Все действия согласуются с пациентом. Ему объясняют, для чего необходима та или иная процедура, а затем спрашивает разрешения на её проведение. Затем проходит планирование перед лечением рака гортаноглотки лучевой терапией. Специалист назначит определенную дату. Пациенту предстоит пройти так называемую симуляцию. Во время неё применяют возможности компьютерной томографии или рентгенографии. Данные полученных исследований позволят запланировать возможное направление радиационных лучей и тип воздействия. Дополнительно будет определена область, на которую будут оказывать влияние. Курс терапии начинается через 1-2 дня после первичной консультации и планирования. Это делают, чтобы не терять время.
Когда планирование завершено, стартуют сеансы. Их продолжительность длится 1-2 часа. Большие сеансы приходятся на первые 2 дня планирования и начала лечения. Затем они будут занимать значительно меньше времени. Однако всё зависит от особенностей процедуры. Во время нее пациенту предстоит лежать в определенной позе. Он не будет ощущать дискомфорта.
Побочные эффекты после лучевой терапии
Рак горла после лучевой терапии в большинстве случаев замедляет течение, размер опухоли постепенно уменьшается. Однако всё зависит от особенностей ситуации. Необходимо помнить о том, что метод воздействия способен привести к возникновению ряда побочных эффектов. Они проявляются через 2 недели после регулярных сеансов. Пациент может столкнуться с:
· ощущение сухости кожи;
· появление сухости во рту;
· потеря чувства вкуса;
· трудности при глотании или изжога;
Большинство побочных эффектов обратимо и исчезает после завершения процедуры. Врач может назначить дополнительное лечение после лучевой терапии рака гортани. Во внимание принимают состояние пациента, его реакцию на процедуру.
Согласно исследованиям, лечение Радием-223 повышает срок жизни пациентов и качество жизни. Пациенты живут в среднем на 3-4 месяца дольше, отмечается уменьшение боли, восстановление способности свободно двигаться. Кроме того, снижается шанс переломов костей и риск возникновения костных осложнений в принципе.
Благодаря маленькому радиусу излучения, Ксофиго значительно снижает выраженность побочных эффектов от химиотерапии. Препарат почти не оказывает токсичного влияния на печень, почки и другие внутренние органы. Среди частых побочных явлений отмечены только нарушения в работе моторики ЖКТ и нарушения показателей крови. Все это, как правило, проходит ко времени следующей инъекции, то есть в течение 4-6 недель.
Методы лучевой терапии при раке ротоглотки
Методы лучевой терапии при раке носоглотки
Поскольку носоглотку отличает крайне обильная сеть лимфатических сосудов, рак носоглотки может легко распространяться в заглоточные и шейные лимфатические узлы (как с одной стороны, так и с обеих).
Из-за своего расположения в скрытой от простого осмотра анатомической области, опухоли данной локализации часто диагностируются только при поражении окружающих анатомических структур (основания черепа, околоносовых пазух, черепных нервов и мягкотканных пространств). Основным компонентом лечения остается лучевая терапия, поскольку в поле ее действия легко включаются области возможного местно-регионарного распространения инфекции.
В последние годы добиться значительного улучшения выживаемости и качества жизни удалось благодаря внедрению лучевой терапии с модулированной интенсивностью (ЛТМИ) и новых технологий визуализации, сочетанному использованию химиотерапии, стандартизации использующихся систем классификации, мультдисциплинарному подходу к лечению и международному обмену опытом.
Как правило, на ранних стадиях заболевания добиться местно-регионарного контроля опухолевого роста можно за счет использования лишь одной лучевой терапии. При опухолях Т III—IV или значительном поражении лимфоузлов требуется дополнительное проведение химиотерапии, поскольку при использовании только лучевой терапии не удается достичь удовлетворительного местно-регионарного контроля и предотвратить развитие отдаленных метастазов.

Пациенты с ранними стадиями заболевания составляют лишь около 10% всех случаев рака носоглотки, в этой группе возможно использование изолированной лучевой терапии. Традиционное фракционирование или двухмерное облучение позволяют достичь хорошего местно-регионарного контроля опухолевого роста при ранних стадиях заболевания, но при местно-распространенных опухолях их эффективность недостаточна.
При проведении традиционной лучевой терапии местного контроля удается достичь в 75-95% опухолей Т1-Т2, но лишь в 44-80% опухолей Т3-Т4. Повысить показатели эффективности можно либо добавлением брахитерапии, либо повышением конформности. При использовании более конформных методов лечения также удается достичь лучшего сохранения функции слюнных желез, органа слуха, повышается общее качество жизни пациентов.
В США стандартом лечения является сочетанная хи-миолучевая терапия с цисплатином, за которой следуют три курса адъювантной химиотерапии 5-фторурацилом и цисплатином.
В основе данной схемы лечения лежат результаты исследования третьей фазы Intergroup Study 0099, установившее, что по сравнению с изолированной лучевой терапией, добавление трех курсов CDDP (цис-диамминдихлороплатина) к лучевой терапии с последующим курсом адъювантной химиотерапии CDDP/5-фторурацилом улучшает трехлетний местно-регионарный контроль и снижает частоту развития отдаленных метастазов.
Это приводит к 10% увеличению трехлетней общей выживаемости и выживаемости без прогрессирования заболевания. В группе химиолучевой терапии чаще развивались лейкопетия и рвота 3-4 степени. Соблюдение предписанного режима лечения было неполным, т.к. только 2/3 пациентов могли перенести все три курса цисплатина,а 1/4 пациентов не могли перенести два курса. Только 60% пациентов получили два или три последовательных курса лечения.
Другие схемы лечения, использующиеся за пределами США, подразумевают еженедельное введение цисплатина (40 мг/м 2 ) с последующей лучевой терапией без адъювантной химиотерапии, либо использование индукционной химиотерапии с последующей химиолучевой терапией.
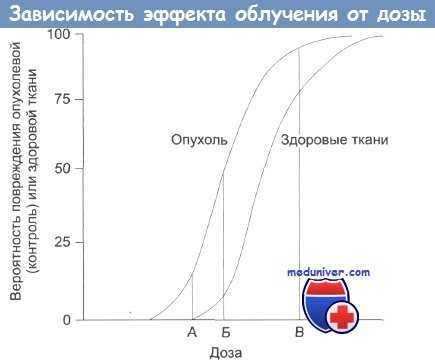
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
Лучевая терапия
Лучевая терапия — это один из ведущих методов противоопухолевого лечения, основанный на использовании ионизирующего излучения. Может применяться как самостоятельный вид терапии, так и в рамках комбинированного/комплексного лечения (совместно с другими методами), в качестве радикальной, нео- и адъювантной, консолидирующей, профилактической и паллиативной терапии.
Эффективность данного метода основана на повреждении ДНК. Существуют различные механизмы, позволяющие более эффективно разрушать опухолевые клетки в сравнении с нормальными. Во-первых, опухолевые клетки более активно делятся, соответственно, их ДНК чаще находится в «рабочем» режиме, когда она менее устойчива к воздействию ионизирующего излучения. По той же причине большая часть острых лучевых реакций представлена мукозитами, то есть воспалением слизистых, которым также свойственно активное деление. Во-вторых, окружающие здоровые клетки способствуют восстановлению поврежденных, подвергшихся лучевому воздействию. Поэтому важно сделать так, чтобы в объём облучения попало как можно меньше здоровой ткани. В-третьих, современное оборудование для лучевой терапии, управляемое командой грамотных специалистов, позволяет подвести максимально высокие дозы прямо в мишень, существенно снижая дозу ионизирующего излучения, приходящуюся к окружающим здоровым органам и тканям.

Виды лучевой терапии
Уже несколько десятилетий человечество изучает воздействие ионизирующего излучение на организм человека. При этом акцентируется внимание как на положительном, так и отрицательном эффекте, возникающем при его применении. Разрабатываются новые методы, которые позволяют добиваться максимального лечебного эффекта при снижении отрицательного действия на организм. Улучшается оборудование для проведения лучевой терапии, появляются новые технологии облучения.
Сейчас классификация методов лучевой терапии довольно обширна. Мы остановимся только на самых распространенных методиках.
Контактная лучевая терапия
При контактной лучевой терапии источник излучения вводится непосредственно в опухоль или прилегает к ее поверхности. Это позволяет прицельно облучать новообразование с минимумом воздействия на окружающие его ткани.
К контактным видам лучевой терапии относятся:
- Аппликационная лучевая терапия. Применяется при лечении поверхностно расположенных опухолей, например, новообразований кожи, слизистых оболочек гениталий. В этом случае используются индивидуально изготовленные аппликаторы, которые накладываются непосредственно на поверхность новообразования.
- Внутриполостная лучевая терапия. Источник ионизирующего излучения вводится в просвет полого органа, например, в пищевод, мочевой пузырь, прямую кишку, полость матки или влагалища. Для облучения используются специальные аппликаторы (их называют эндостатами), которые заполняются радионуклидами.
- Внутритканевое облучение. Источник ионизирующего излучения вводится непосредственно в ткань опухоли. Для этого используются интростаты, которые могут иметь вид игл, шариков, трубочек, заполненных источником излучения.
Кроме того, существует такой вид лечения, как радионуклидная терапия. В этом случае используются открытые источники излучения в виде растворов радионуклидов (радиофармацевтический препарат — РФП), которые при попадании в организм прицельно накапливаются в опухолевых очагах и уничтожают их. Чаще всего РФП вводится внутривенно. Наибольшее распространение получили следующие виды радионуклидной терапии:
- Терапия радиоактивным йодом. Используется для лечения ряда видов рака щитовидной железы, поскольку йод избирательно накапливается в тиреоидной ткани.
- Применение остеотропных РФП используется для лечения метастазов в костях или костных опухолей.
- Радиоиммунотерапия — радионуклиды присоединяют на моноклональные антитела, чтобы добиться прицельного воздействия на опухолевую ткань.
Дистанционная лучевая терапия
При дистанционной лучевой терапии источник излучения находится на расстоянии от тела пациента, при этом на пути его прохождения могут лежать здоровые ткани, которые в процессе проведения терапии также подвергаются облучению, что приводит к развитию осложнений разной степени выраженности. Чтобы их минимизировать, разрабатываются различные технологии, позволяющие сконцентрировать максимальную дозу ионизирующего излучения непосредственно на в мишени (опухоли). С данной целью используются:
- Короткофокусная рентгенотерапия. При облучении используется рентгеновское излучение малой и средней мощности, которое способно проникать в ткани на глубину до 12 мм. Метод назван так из-за того, что источник располагается на коротком расстоянии от облучаемой поверхности. Таким способом лечат неглубокие опухоли кожи, вульвы, конъюнктивы и век, ротовой полости.
- Гамма-терапия. Этот вид излучения имеет большую проникающую способность, поэтому может использоваться для лечения более глубоко расположенных опухолей, нежели рентген-терапия. Однако сохраняющаяся большая нагрузка на окружающие органы и ткани приводят к ограничению возможности использования данного метода в современной онкологии.
- Фотонная терапия. Именно этим видом излучения проводится лучевое лечение большинства онкологических пациентов в современном мире. Достаточно высокая проникающая способность в сочетании с высокотехнологичными способами подведения дозы (IMRT и VMAT), достаточно совершенные системы планирования позволяют очень эффективно использовать этот вид излучения для лечения пациентов с приемлемыми показателями токсичности.
- Применение корпускулярного излучения (электроны, протоны, нейтроны). Эти элементарные ядерные частицы получают на циклотронах или линейных ускорителях. Электронное излучение используют для лечения неглубоких опухолей. Большие надежды возлагаются на протонную терапию, с помощью которой можно максимально прицельно подводить высокие дозы излучения к глубоко расположенным опухолям при минимальном повреждении здоровых тканей за счет выделения радиационной дозы на определённом отрезке пробега частиц, однако пока эти виды излучения играют сравнительно небольшую роль в лечении онкологических заболевания из-за своей высокой стоимости и ряда не до конца решённых технологических аспектов реализации метода.
Этапы лучевой терапии
Весь процесс проведения лучевой терапии делят на три этапа:
- Предлучевая подготовка (КТ-симуляция), этап выбора объёмов облучения и критических структур, этап дозиметрического планирования, верификации плана лучевой терапии.
- Этап облучения.
- Постлучевой этап.
Этап планирования
Как правило, этап планирования занимает несколько дней. В это время проводятся дополнительные исследования, которые призваны дать возможность врачу более точно оценить границы опухоли, а также состояние окружающих ее тканей. Это может повлиять на выбор вида лучевой терапии, режима фракционирования, разовой и суммарной очаговых доз. Основой же данного этапа является выполнение так называемой КТ-симуляции, то есть компьютерной томографии необходимого объёма с определёнными параметрами и в определённом положении тела пациента. Во время КТ-симуляции на кожу пациента и/или его индивидуальные фиксирующие устройства наносятся специальные метки, призванные помочь правильно укладывать пациента в дальнейшем, а также облегчить задачу навигации по время проведения сеансов облучения.
Затем врач-радиотерапевт рисует объёмы облучения и критических структур (тех, на которые будет предписано ограничение дозы) на полученных срезах КТ с учётом данных других диагностических модальностей (МРТ, ПЭТ). Далее формируется задача для медицинского физика, включающая определение доз, которые должны быть подведены к мишени, мишеням или отдельным её частям, а также тех, которые не должны быть превышены в объёмах здоровых органов и тканей. Медицинский физик разрабатывает дозиметрический план в соответствии с заданными параметрами, при соблюдении которых и успешной верификации данного плана на фантоме, можно считать пациента готовым к лучевой терапии.
На этапе подготовки к лучевой терапии пациенту рекомендуется придерживаться нескольких правил:
- Отказаться от средств, раздражающих кожу.
- Если на коже в месте воздействия имеются повреждения или элементы сыпи, следует проконсультироваться с врачом.
- Если предполагается лучевая терапия в челюстно-лицевой области, требуется санация полости рта.
- Воздержаться от загара.
- Главное правило на любом этапе: обсудить все нюансы предстоящих подготовки и лечения с лечащим врачом-радиотерапевтом и строго придерживаться полученных рекомендаций!
Этап облучения
Проведение этапа облучения будет зависеть от выбранного метода лучевой терапии.
Проведение дистанционной лучевой терапии
Продолжительность курса дистанционной лучевой терапии зависит от выбранного режима фракционирования, а также цели лечения. Паллиативные курсы, как правило, короче неоадъювантных и адъювантных, а те, в свою очередь, менее продолжительны, чем радикальные. Однако подведение радикальной дозы возможно и за один-несколько сеансов в зависимости от клинической ситуации. В таком случае курс дистанционной лучевой терапии называется стереотаксической радиотерапией или радиохирургией. Варьирует и кратность сеансов в день и в неделю: чаще всего используются схемы с пятью сеансами в неделю, однако могут быть предложены и 2-3 сеанса в день (гиперфракционирование) и схемы с 1-4 и 6 сеансами в неделю.
Во время облучения пациент в подавляющем большинстве случаев располагается лежа на столе специальной установки. Крайне необходимо соблюдать полную неподвижность во время сеанса облучения. Для достижения этого могут использоваться специальные фиксирующие устройства и системы иммобилизации.
Перед тем как включить установку, медперсонал покидает помещение, и дальнейшее наблюдение осуществляется через мониторы или окно. Общение с пациентом осуществляется по громкой связи. Во время выполнения сеанса, части аппарата и стол с пациентом совершают движения по заданной траектории. Это может создавать шум и беспокойство у больного. Однако бояться этого не стоит, поскольку вся процедура контролируется.
Сам сеанс лучевой терапии может длиться как 5-10, так и 60-120 минут, чаще — 15-30 минут. Само воздействие ионизирующего излучения не вызывает никаких физических ощущений. Однако в случае ухудшения самочувствия пациента во время сеанса (выраженной боли, судороги, приступа тошноты, паники), следует позвать медицинский персонал заранее оговоренным способом; установку сразу отключат и окажут необходимую помощь.
Контактная лучевая терапия (брахитерапия)
Брахитерапия проводится в несколько этапов:
- Введение в облучаемую зону неактивных проводников — устройств, в которые затем имплантируют источник ионизирующего излучения. При внутриполостной лучевой терапии используются приспособления, называемые эндостатами. Их устанавливают непосредственно в полость облучаемого органа и рядом с ним. При внутритканевой лучевой терапии используются интростаты, которые устанавливаются непосредственно в ткань опухоли по заранее просчитанной схеме. Для контроля их установки, как правило, используются рентгенологические снимки.
- Перемещение источника излучения из хранилища в интро- и эндостаты, которые будут облучать опухолевую ткань. Время облучения и особенности поведения пациента будут зависеть от вида брахитерапии и используемого оборудования. Например, при внутритканевой терапии, после установки источника ионизирующего излучения пациент может покинуть клинику и прийти на повторную процедуру через рекомендуемый промежуток времени. Весь этот период в его организме будет находиться интростат с радионуклидами, которые будут облучать опухоль.
Проведение внутриполостной брахитерапии будет зависеть от используемых установок, которые бывают двух типов:
- Установки низкой мощности дозы. В этом случае один сеанс облучения длится около 2-х суток. Под наркозом имплантируются эндостаты. После контроля правильности их установки и введения радионуклидов, пациент переводится в специальное помещение, где должен будет находиться все время, пока длится процедура, соблюдая строгий постельный режим. Разрешается только немного поворачиваться на бок. Вставать категорически запрещено.
- Установки высокой мощности дозы. Время облучения составляет несколько минут. Для установки эндостатов наркоза не требуется. Но во время процедуры все равно необходимо лежать абсолютно неподвижно. Внутриполостная лучевая терапия установкой высокой мощности проводится несколькими сеансами с интервалами от одного дня до одной недели.
Радионуклидная терапия
При радионуклидной терапии пациент принимает радиофармпрепараты внутрь в виде жидкого раствора, капсул или инъекций. После этого он помещается в специальную палату, имеющую изолированную канализацию и вентиляцию. По истечении определенного срока, когда мощность дозы снизится до приемлемого уровня, проводится радиологический контроль, пациент принимает душ и переодевается в чистую одежду. Для контроля результатов лечения проводится сцинтиграфия, после чего можно покинуть клинику.
Как вести себя во время лучевой терапии
Лучевая терапия является серьезным стрессом для организма. У многих пациентов в этот период ухудшается самочувствие. Чтобы его минимизировать рекомендуется придерживаться следующих правил:
- Больше отдыхать. Минимизируйте физическую и интеллектуальную нагрузку. Ложитесь спать, когда почувствуете в этом необходимость, даже если она возникла в течение дня.
- Постарайтесь сбалансировано и полноценно питаться.
- Откажитесь на время проведения терапии от вредных привычек.
- Избегайте плотной обтягивающей одежды, которая бы могла травмировать кожу.
- Следите за состоянием кожи в месте облучения. Не трите и не расчесывайте ее, используйте средства гигиены, которые вам порекомендует врач.
- Защищайте кожу от воздействия солнечных лучей — используйте одежду и головные уборы с широкими полями.

Побочные эффекты лучевой терапии
Лучевая терапия, как и другие методы противоопухолевого лечения, вызывает ряд осложнений. Они могут быть общими или местными, острыми или хроническими.
Острые (ранние) побочные эффекты развиваются во время проведения радиотерапии и в ближайшие недели после неё, а поздние (хронические) лучевые повреждения — через несколько месяцев и даже лет после ее окончания.
Общие реакции
Угнетенное эмоциональное состояние
Подавляющее большинство пациентов, проходящих лечение по поводу злокачественного новообразования, испытывают тревожность, страх, эмоциональное напряжение, тоску и даже депрессию. По мере улучшения общего состояния, эти симптомы стихают. Чтобы облегчить их, рекомендуется чаще общаться с близкими людьми, принимать участие в жизни окружающих. При необходимости рекомендуется обратиться к психологу.
Чувство усталости
Чувство усталости начинает нарастать через 2-3 недели от начала терапии. На это время рекомендуется оптимизировать свой режим дня, чтобы не подвергаться ненужным нагрузкам. В то же время нельзя полностью отстраняться от дел, чтобы не впасть в депрессию.
Изменение крови
При необходимости облучения больших зон, под воздействие радиации попадает костный мозг. Это в свою очередь приводит к снижению уровня форменных элементов крови и развитию анемии, повышению риска кровотечения и развития инфекций. Если изменения выражены сильно, может потребоваться перерыв в облучении. В ряде случаев могут назначать препараты, стимулирующие гемопоэз (кроветворение).
Снижение аппетита
Обычно лучевая терапия не приводит к развитию тошноты или рвоты, но снижение аппетита наблюдается довольно часто. Вместе с тем, для скорейшего выздоровления требуется полноценное высококалорийное питание с высоким содержанием белка.
Локальные осложнения
Побочные реакции со стороны кожи
Вероятность развития кожных реакций и их интенсивность зависят от индивидуальных особенностей пациента. В большинстве случаев через 2-3 недели в области воздействия возникает покраснение. После окончания лечения оно сменяется пигментированием, напоминающим загар. Чтобы предотвратить чрезмерные реакции, могут назначаться специальные кремы и мази, которые наносятся после окончания сеанса. Перед началом следующего их необходимо смыть теплой водой. Если реакция выражена сильно, делают перерыв в лечении.
Реакции со стороны полости рта и горла
Если облучают область головы и шеи, могут развиться лучевой стоматит, который сопровождается болью, сухостью во рту, воспалением слизистых, а также ксеростомия вследствие нарушения функции слюнных желез. В норме эти реакции проходят самостоятельно в течение месяца после окончания лучевой терапии. Ксеростомия может беспокоить пациента в течение года и более.
Осложнения со стороны молочной железы
При прохождении лучевой терапии по поводу рака молочной железы могут возникать следующие реакции и осложнения:
- Покраснение кожи груди.
- Отек груди.
- Боль.
- Изменение размера и формы железы из-за фиброза (в некоторых случаях эти изменения остаются на всю жизнь).
- Уменьшение объема движения в плечевом суставе.
- Отек руки на стороне поражения (лимфедема).
Побочное действие на органы грудной клетки
- Воспаление слизистой пищевода, которое приводит к нарушению глотания.
- Кашель.
- Образование мокроты.
- Одышка.
Последние симптомы могут свидетельствовать о развитии лучевого пневмонита, поэтому при их возникновении следует немедленно обратиться к вашему врачу.
Побочные реакции со стороны прямой кишки/петель кишечника
- Расстройство стула — диарея или наоборот, запоры.
- Боли.
- Кровянистые выделения из заднего прохода.
Побочные действия со стороны мочевого пузыря
- Учащенное болезненное мочеиспускание.
- Наличие примеси крови в моче иногда может быть настолько выраженным, что моча приобретает кроваво-красный цвет.
- Наличие патологических примесей в моче — кристаллы, хлопья, гнойное отделяемое, слизь.
- Уменьшение емкости мочевого пузыря.
- Недержание мочи.
- Развитие везиковагинальных или везикоректальных свищей.
Побочные эффекты при облучении опухолей забрюшинного пространства, печени, поджелудочной железы
- Тошнота и рвота.
- Ознобы после сеансов.
- Боли в эпигастрии.
Химиолучевая терапия
Лучевая терапия довольно редко проводится в качестве самостоятельного лечения. Чаще всего она сочетается с каким-либо другим видом лечения: хирургическим, а чаще всего — с лекарственным. Это может быть как вариант одновременной химиолучевой терапии, так и последовательной, а также варианты сочетания лучевой терапии с иммунотерапией, таргетной и гормональной терапии. Такие виды лечения могут иметь ощутимо более высокую противоопухолевую эффективность, однако необходимо тщательно оценить риски совместных побочных эффектов, поэтому принятие решения о любом объёме лечения с онкологической патологией должен принимать мультидисциплинарный онкологический консилиум.
Читайте также:
- Избирательность в подходе к консервативному ведению ранений живота.
- Лабораторная диагностика сиклемии (серповидноклеточной анемии) - анализы
- Причины дыхательного и метаболического ацидоза. Причины дыхательного алкалоза
- Причины продольной эритронихии
- Показания и методика торакоскопического удаления лейомиомы пищевода
