Методы обследования артериовенозной фистулы трансплантата почки
Добавил пользователь Алексей Ф. Обновлено: 30.01.2026
Методы обследования стеноза почечной артерии трансплантата почки
а) Терминология:
1. Аббревиатура:
• Стеноз почечной артерии трансплантата (СПАТ)
2. Определения:
• Сужение почечной артерии трансплантата (ПАТ)
б) Визуализация:
1. Общая характеристика:
• Важнейшие диагностические критерии:
о Локальное повышение пиковой систолической скорости (ПСС) с постстенотическим турбулентным током
• Локализация:
о Чаще всего в области артериального анастомоза
о Может возникать на любом участке артерии трансплантата; возможно диффузное поражение
о В подвздошной артерии, проксимальнее трансплантата почечной артерии (псевдо-СПАТ)
• Хирургическая анатомия:
о Чаще всего: конец артерии трансплантата в бок наружной подвздошной артерии:
- При трансплантации как от живых, так и от умерших доноров
о Участок аорты донора вместе с одной или несколькими почечными артериями анастомозируют с наружной подвздошной артерией реципиента:
- Только от умерших доноров
о Редко: конец артерии трансплантата в конец внутренней подвздошной артерии или ее ветви:
- От живых или умерших доноров
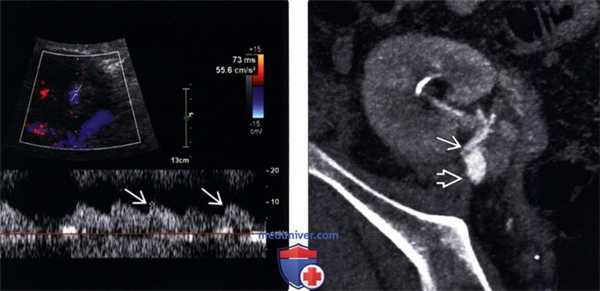
(Левый) При допплерографии сегментарной артерии нижнего полюса трансплантата почки со стенозом почечной артерии визуализируется медленная малая волна со сниженным индексом ускорения =55,6 см/с 2 .
(Правый) КТ артериография, выполненная после выявления медленной малой волны при допплерографии трансплантата от живого неродственного донора. Имеется перекрутв проксимальном отделе почечной артерии. Подвздошная артерия не изменена. При операции произошел избыточный поворот почки.
3. Сцинтиграфия:
• Изотопная ренография: более низкая чувствительность (75%) и специфичность (67%) в отношении СПАТ
• Удлиненное время прохождения препарата МАГЗ
4. КТ при стенозе почечной артерии трансплантата почки:
• КТА:
о Комплексное исследование сосудов, в том числе подвздошных артерий и аорты.
о Трехмерные изображения с высоким пространственным разрешением, возможность поворота для оптимальной проекции
о Точный, неинвазивный метод
о Ограничения: нефротоксичность, артефакты от металлов в виде полос
5. МРТ при стенозе почечной артерии трансплантата почки:
• МРА:
о Комплексное исследование сосудов
о Трехмерные изображения с возможностью поворота для оптимальной проекции
о Высокая чувствительность (67-100%) и высокая специфичность (75-100%)
о Отсутствие ионизирующего излучения и нефротоксичного йодированного контраста:
- Ограниченное использование вследствие риска нефрогенного системного фиброза при нарушении функции почки
о Артефакты от хирургических скоб и металлических протезов могут привести к гипердиагностике стеноза или неинформативности исследования
• МРА без контрастирования позволяют повысить диагностическую ценность и точность:
о Для пациентов со сниженной скоростью клубочковой фильтрации, у которых лучше избегать введения контраста с гадолинием
6. Ангиография:
• Золотым стандартом считается стандартная антиография, однако это инвазивный метод с возможными осложнениями
• Подтверждение стеноза (стенозы >50% при ангиографии считаются значимыми)
• Градиент обратного давления в стенозе >10-20 мм рт. ст. указывает на выраженный стеноз
• Ангиография углекислым газом используется для уменьшения нагрузки йодированный контрастом
• Возможно выполнение эндоваскулярного вмешательства
7. Рекомендации по визуализации:
• Важнейшие методы визуализации:
о Цветовая, энергетическая, спектральная допплерография -методы выявления стеноза почечной артерии трансплантата (СПАТ)
• Рекомендации по исследованию:
о Для правильного измерения ПСС требуется точный угол при допплерографии
о Требуется оптимизация частоты повторения импульсов и регулировки усиления
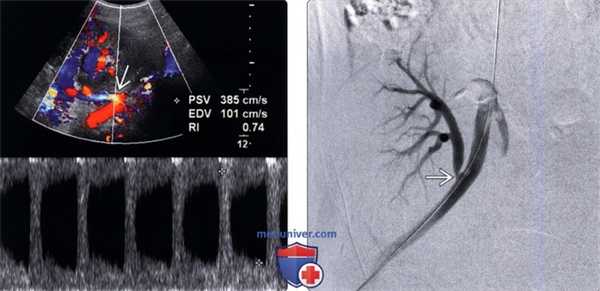
(Левый) Допплерографический срез через анастомоз почечной артерии у пациента с острым повреждением почки через год после трансплантации от умершего донора. В анастомозе визуализируется цветовой дефект наложения с пиковыми скоростями, превышающими 385 см/с.
(Правый) При цифровой субтракционной ангиографии у этого же пациента подтвержден выраженный стеноз (>90%) в области анастомоза S3, скорректированный путем ангиопластики.
в) Дифференциальная диагностика стеноза почечной артерии трансплантата почки:
1. Резкие изгибы и кинкинг почечной артерии:
• Изгибы и кинкинг могут увеличивать пиковую скорость при отсутствии стеноза
• Поворот почки или неправильное положение трансплантата могут привести к функциональному артериальному стенозу
• КТА или MPA могут быть методами первоначального обследования
• Однако для определения функционального значения может потребоваться ангиография
• Не торопитесь диагностировать стеноз с ограничением потока при отсутствии постстенотического турбулентного тока
2. Псевдостеноз почечной артерии:
• Стеноз проксимальнее почечной артерии, вызывающий снижение кровотока
• Диффузный атеросклероз в аорте, общей или наружной подвздошной артерии
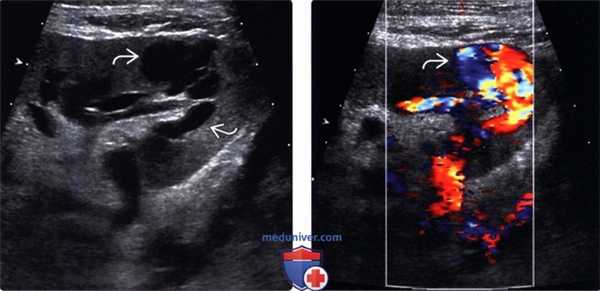
3. Артериовенозная фистула трансплантата:
• В типичных случаях - участок в почке с артефактом наложения и вибрированием тканей.
• Высокоскоростная спектрограмма с низкой резистентностью
• После биопсии
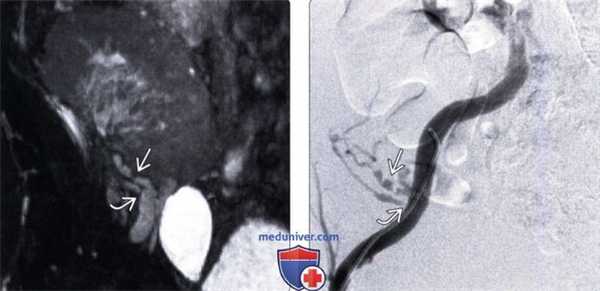
(Левый) Фронтальный срез при МРА без контрастирования, выполненной при подозрении на стеноз почечной артерии поданным допплерографии у пациента с отсроченной функцией трансплантата и гипертензией, развившейся через три месяца после трансплантации от умершего донора. Визуализируется две почечные артерии с выраженным стенозом в устье нижней артерии и диффузной неровностью контуров в верхней артерии .
(Правый) При цифровой субтракционной ангиографии у этого же пациента подтверждено диффузное поражение верхней артерии с чередованием стенозов и расширений, а также более локализованный стеноз нижней артерии.
г) Патология:
1. Общая характеристика:
• Этиология:
о Хирургическое повреждение во время изъятия органа или трансплантации:
- Технические сложности наложения анастомоза, реакция н, шовный материал, повреждение зажимами
- Угловое отклонение, кинкингили перекрут
- Механическое сдавливание, приводящее к турбулентному потоку
о Антителоопосредованное повреждение сосудов при отторжении
о Гиперплазия интимы
о Стеноз почечной артерии чаще встречается у пожилых доноров почек
о Часто встречается в трансплантатах от живых доноров: отсутствует участок донорской аорты
о К предрасполагающим факторам у реципиента относятся атеросклероз, сахарный диабет, ожирение, пожилой возраст
2. Макроскопические и хирургические особенности:
• Склероз артериальной стенки → сужение просвета
• Распространенное поражение артерий при клеточном отторжени
3. Микроскопия:
• Хирургическое повреждение, воспаление, склероз артериально стенки, тромб
д) Клинические особенности:
1. Проявления стеноза почечной артерии трансплантата:
• Основные симптомы:
о В любом периоде после трансплантации, максимальная распространенность в 6 месяцев и обычно в течение трех лет:
- Основной симптом-гипертензия: развившаяся de novo, прогрессирующая или резистентная к лечению
- Острое повреждение почек
- Прогрессирующее снижение функции почек:
Почечная недостаточность после назначения ингибиторов АПФ
- Экхимоз в области трансплантата/подвздошной артерии
- Сердечная недостаточность
- Перегрузка объемом
- Острый отек легких
2. Эпидемиология:
о Наиболее частое поражение сосудов трансплантата
- 2-10% случаев
3. Течение и прогноз:
• Основная причина потери трансплантата при современной эффективной иммуносупрессивной терапии
• Повышенная заболеваемость и смертность пациентов при отсутствии лечения
• Благоприятный прогноз при успешном лечении стеноза/хирургической ревизии
4. Лечение стеноза почечной артерии трансплантата:
• Чрескожная транслюминальная ангиопластика:
о С/без стентирования:
- Частота осложнений: 5-10%
• Хирургическая коррекция-второстепенный метод
• Лечение стеноза подвздошной артерии также возможно путем ангиопластики и стентирования
е) Диагностическая памятка:
1. Следует учесть
• Изгибы и кинкинг имитируют стеноз почечной артерии трансплантата
2. Советы по интерпретации изображений:
• Ищите локальное повышение пиковой скорости кровотока в почечной артерии по сравнению со скоростью в подвздошной артерии и постстенотический турбулентный поток
Артериовенозная фистула
МКБ-10
Общие сведения
Артериовенозная фистула представляет собой прямое соустье артерии с веной, пропускающее кровь, минуя капилляры. Это достаточно редкое заболевание – частота патологических почечных шунтов не превышает 1 случая на 1000 человек, спинальные фистулы встречаются еще реже (1 на 100 тыс.). Однако среди сосудистых мальформаций мозга на долю фистульных образований приходится 60–80%, распространенность периферических вариантов достигает 20%. Патологические соустья бедренной артерии составляют 12–30%, сонной и подключичной – до 25% от общего числа подобных дефектов. Женщины страдают артериовенозными дисплазиями в 2–3 раза чаще мужчин.
Причины
Возникновение фистул опосредовано повреждением артериальной и венозной стенок под воздействием внешних или внутренних факторов. Наряду со структурными дефектами и заболеваниями, все большую роль в этиологии артериовенозных шунтов приобретают ятрогенные факторы. В сосудистой хирургии выделяют следующие группы причин:
- Врожденные аномалии. Большинство врожденных мальформаций являются результатом нарушений эмбриогенеза между 4 и 10 неделями гестации. Предполагается влияние внутриутробных инфекций, интоксикаций, артериальной гипертензии у матери и приема некоторых лекарств во время беременности.
- Наследственные заболевания. Трансформация мелких сосудов в артериовенозные шунты и аневризмы наблюдается при наследственной патологии – болезни Рандю-Ослера-Вебера (семейной геморрагической телеангиэктазии), синдроме «голубого пузырчатого невуса». Прослеживается связь с генными мутациями, нарушающими нормальный ангиогенез (PTEN, RASA 1).
- Хроническая патология. Отмечена связь пульмональных фистул с хроническими легочными инфекциями и паразитарными инвазиями (туберкулезом, шистосомозом, актиномикозом), метастазами рака щитовидной железы. Патология встречается при циррозе печени и врожденных пороках сердца.
- Механические травмы. Появление многих приобретенных дефектов связывают с механическим повреждением вены и артерии, расположенных рядом и плотно прилегающих друг к другу. Так обычно происходит при колющих, огнестрельных, реже - тупых ранениях, переломах основания черепа и длинных трубчатых костей со смещением отломков.
- Инвазивные вмешательства. Вероятность появления патологических соустий увеличивается при катетеризации сосудов (трансфеморальной аорто- и коронарографии, чрескожной чреспеченочной холангиографии), биопсии паренхиматозных органов (печени, почек). С подобной проблемой сталкиваются после эндопротезирования коленных суставов, операций на межпозвонковых дисках, нефростомии.
- Хирургические манипуляции. Искусственно созданное соустье между артериальным руслом и венозной системой необходимо при терминальной почечной недостаточности для облегчения процедуры гемодиализа. По сравнению с остальными видами сосудистого доступа, артифициальное соединение имеет более высокую долгосрочную проходимость с хорошей скоростью потока и низким риском осложнений.
В этиопатогенезе фистульных аномалий немаловажная роль отводится эрозиям и спонтанным разрывам артериальных аневризм в близлежащие вены. Значимыми и независимыми факторами риска патологических соустий являются прием антикоагулянтов (гепарина, варфарина), артериальная гипертензия, женский пол.
Патогенез
Точный патогенез артериовенозных мальформаций первичного характера неизвестен. В концевых артериальных петлях может возникнуть аномалия, приводящая к расширению тонкостенных капиллярных мешочков. По иным предположениям, дисплазии становятся результатом неполной резорбции сосудистых перегородок, разделяющих артериальное и венозное сплетение во внутриутробном периоде развития плода. Предполагается, что небольшие фистулы возникают при нарушении формирования капилляров.
Травматическим шунтам предшествует образование аневризмы и гематомы. Сращение сосудов происходит по типу заживления раны первичным натяжением. Кровь, вылившаяся в окружающие ткани и частично рассосавшаяся, организуется с формированием трубчатого хода, сообщающего артерию с веной. Стенки патологического шунта укрепляют гладкомышечные, соединительнотканные элементы и эндотелий, проникающие со стороны поврежденных ветвей. Постоянный кровоток через свищевой ход предотвращает его заращение.
Шунтирование крови по патологическим соустьям провоцирует обкрадывание тканей, расположенных дистальнее. При изменении давления и характеристик кровотока по обе стороны дефекта возникают турбулентные потоки, создающие условия для дальнейшего повреждения сосудистой стенки и дегенеративных процессов. В периферических тканях наблюдаются явления артериальной ишемии и венозной гипертензии, компенсаторно развивается сеть коллатералей. Крупные свищи провоцируют увеличение объема циркулирующей крови, нарушение сердечной деятельности, венозную недостаточность.
Классификация
Артериовенозные фистулы входят в структуру сосудистых мальформаций. На изолированную форму (прямое соединение) приходится 11% случаев, а смешанный шунт (с наличием клубка измененных ветвей) характерен для 53% пациентов. В клинической ангиологии такие соустья классифицируются на основании следующих критериев:
- По происхождению. Первичные фистулы имеют врожденный характер, вторичные являются приобретенными. Последние разделяются на травматические, ятрогенные и спонтанные. Врожденные всегда возникают изолированно, без связи с другими факторами. Травматические фистулы на верхних и нижних конечностях встречаются одинаково часто (20%), доля внутригрудных и внутрибрюшных составляет около 4%.
- По локализации. Исходя из расположения, различают центральные (церебральные, спинальные) и периферические шунты (легочные, коронарные, почечные, печеночные, подкожные). В зоне головы и шеи встречаются экстрацеребральные (дуральные, каротидно-кавернозные соустья), интрацеребральные (пиальные), экстракраниальные (магистральных сосудов шеи), эктра-интракраниальные (артерио-югулярные) образования.
- По распространенности. Аномальные соединения между артериями и венами бывают ограниченными и диффузными, единичными и множественными. Распространенные формы имеют четкую генетическую обусловленность и могут входить в клиническую структуру синдромов Кобба, Клиппеля-Треноне, Паркса-Вебера.
- По размеру. Градация артериовенозных фистул по величине дефекта является одним из определяющих критериев, влияющих на выбор лечебной тактики. Учитывая диаметр вены, выделяют несколько разновидностей аномальных соустий: малые (от 1 до 3 мм), средние (3–6 мм), крупные (более 6 мм).
Существует ангиографическая классификация фистул, применимая к подкожным образованиям, расположенным в области туловища и конечностей. Рассматривая морфологию шунта, выделяют три типа поражения: I – артериовенозный, II - артериоловенозный, III – артериоловенулярный.
Симптомы артериовенозной фистулы
Характер симптоматики определяется локализацией шунтов и их размерами. Небольшие образования на конечностях, в легких, почках и головном мозге обычно протекают бессимптомно и бывают случайной диагностической находкой. Врожденная патология проявляется еще в раннем детстве или в более старшем возрасте. Клиническая картина посттравматических свищей развивается сразу после повреждения либо спустя несколько недель, месяцев.
Подкожный сосудистый свищ заметен по расширению вены, пальпаторной и визуальной пульсации, локальной отечности. Врожденные процессы зачастую сопровождаются изменением кожной окраски на красно-багровую. Над фистульным образованием локальная температура повышена, в дистальных отделах наблюдаются признаки ишемии: похолодание, бледность, сухость кожи. При аускультации над пульсирующей аномалией выслушивается систолический и диастолический шум. Если сильно прижать образование пальцем, то происходит замедление частоты сердечных сокращений (феномен Бранхама-Николадони).
Значительный сброс крови из артериального в венозное русло при больших свищах ведет к возникновению признаков гиперкинетического кровотока: тахикардии, увеличения систолического и пульсового давления, снижения толерантности к физическим нагрузкам. Каротидно-кавернозные свищи могут проявляться пульсирующим экзофтальмом, односторонним покраснением склеры и конъюнктивы, двоением в глазах, снижением остроты зрения, шумом в ушах. Церебральные мальформации провоцируют развитие судорожного синдрома, головных болей, явлений неврологического дефицита (речевых нарушений, мышечной слабости, координаторных и чувствительных расстройств, снижения памяти и внимания).
Начальные симптомы спинальных образований неспецифичны, включают трудности при подъеме по лестнице, нарушение походки, сегментарные сенсорные расстройства (парестезии, гипо-, анестезию), корешковые боли в конечностях. Неврологические симптомы постепенно прогрессируют и имеют восходящий характер. На поздних стадиях наблюдаются нарушения мочеиспускания, дефекации, эрекции. Иногда заболевание имеет острое начало и прогрессирующие развитие с промежуточными ремиссиями.
Осложнения
Длительно существующие сосудистые шунты сопровождаются повышением давления в отводящих венах, что провоцирует их варикозное расширение с тромбозом и трофическими нарушениями. Сброс большого объема крови мимо капилляров приводит к перегрузке сердца, кардиомегалии, развитию хронической циркуляторной недостаточности и эндокардита. Серьезные последствия фистул связаны с их разрывом и возникающим внутренним кровотечением.
Очаг в веществе головного мозга осложняется геморрагическим инсультом с развитием стойкого неврологических расстройств и инвалидизацией пациента. Почечные аномалии сопровождаются внутрибрюшным и забрюшинным кровотечением, а разрыв магистральных стволов может иметь самые неблагоприятные последствия, вплоть до летального исхода.
Диагностика
Распознавание врожденных и приобретенных артериовенозных свищей в большинстве случаев осуществляется средствами инструментальной диагностики. Клиническими методами можно выявить лишь периферическую аномалию (на туловище, конечностях) или по совокупности симптомов заподозрить ее присутствие в каком-либо органе. Точную визуализацию сосудистого образования обеспечивают следующие диагностические процедуры:
Диагностическая программа составляется сосудистым хирургом или более узкими специалистами. В дополнение к описанным исследованиям, назначают КТ или МРТ головы, позвоночника, внутренних органов. Учитывая локализацию патологии, может потребоваться консультация нейрохирурга, пульмонолога, уролога и других врачей. К общей патологии, с которой следует дифференцировать артериовенозную фистулу, относят схожие мальформации (капиллярные, плексиформные), сосудистые аневризмы, гемангиомы, варикозную болезнь.
Лечение артериовенозной фистулы
Целью лечения является закрытие патологического соустья с сохранением проходимости основных сосудов. В основу положен принцип изоляции и разрушения аномальной связи артериального русла с венозным. Выбор оптимальной тактики проводится с учетом локализации, размера и типа соустья, динамики кровотока, особенностей дистальных участков. На практике применяют несколько способов коррекции дефекта:
Аномальные шунты небольших размеров, не являющиеся гемодинамически значимыми, подлежат наблюдению. Являясь косметическим дефектом, они могут удаляться лазерной коагуляцией. Крупные подкожные свищи требуют открытого хирургического доступа с реконструкцией сосудов. При доброкачественных фистулах назначают консервативную терапию (компрессионный трикотаж, нестероидные противовоспалительные средства, ангиопротекторы). Есть данные об успешном медикаментозном лечении врожденных артериовенозных дисплазий ингибиторами металлопротеиназ и некоторыми иммунодепрессантами.
Прогноз и профилактика
Известны случаи спонтанного регресса первичных артериовенозных фистул. При длительно сохраняющихся шунтах риск разрыва и сердечной декомпенсации делает прогноз неблагоприятным. Но после радикальной коррекции удается полностью избавиться от сосудистого дефекта, нормализовав гемодинамику и восстановив функцию пораженной области. Меры профилактики приобретенных соустий включают предупреждение травматизма, соблюдение техники выполнения инвазивных вмешательств, своевременное лечение хронических заболеваний. Риск врожденных мальформаций можно снизить при исключении негативного влияния на плод в период беременности.
1. Современные концепции лечения артериовенозных ангиодисплазий (мальформаций). Согласительный документ/ Покровский А.В. и др.// Ангиология и сосудистая хирургия - 2015 - №29.
2. Клинические рекомендации по диагностике и лечению артериовенозных мальформаций центральной нервной системы/ Парфенов В.Е., Свистов Д.В., Элиава Ш.Ш., Яковлев С.Б., Тиссен Т.П., Иванов А.Ю.,Иванов П.И. - 2014.
3. Рентгенэндоваскулярные методы диагностики и лечения цереброваскулярной патологии: Автореферат диссертации/ Боломатов Н.В. - 2014.
4. Артериовенозные фистулы головы и шеи. Клиника, ангиоархитектоника, эндоваскулярное лечение: Автореферат диссертации/ Яковлев С.Б. - 2008.
Отторжение почечного трансплантата ( Отторжение пересаженной почки )
Отторжение почечного трансплантата — это иммунная реакция организма реципиента на чужеродные антигены донорской почки. При остром течении проявляется гриппоподобным синдромом, олигоанурией, уплотнением и болезненностью пересаженного органа, артериальной гипертензией. Хроническое отторжение до появления ХПН обычно определяется только лабораторно. Патология диагностируется при помощи лабораторных анализов, УЗИ, УЗДГ, пункционной биопсии трансплантата. В ходе лечения применяют пульс-курсы кортикостероидов, противотимоцитарные глобулины, плазмаферез, плазмообмен. В тяжелых случаях требуется нефротрансплантатэктомия, ЗПТ, повторная трансплантация почки.
Пересадка почки — самая распространенная трансплантологическая операция, в проведении которой нуждается не менее 40 пациентов с ХПН на 1 млн. населения, однако дефицит донорских органов не позволяет удовлетворить эту потребность. Ситуация усугубляется риском потери пересаженного органа из-за различия антигенных структур реципиента и донора.
В основе патологического процесса лежит иммунный ответ организма на антигены донорского органа. Поскольку абсолютная антигенная совместимость тканей существует только у однояйцевых близнецов, во всех остальных случаях аллотрансплантации наблюдается повреждение элементов пересаженной почки факторами иммунитета. В современной урологии, нефрологии, трансплантологии определены следующие причины отторжения нефротрансплантата:
- Несовместимость тканей донора и реципиента. Еще до проведения трансплантации в организме реципиента могут присутствовать антитела к тканям донора. Индикаторами риска отторжения являются AB0-несовместимость, тканевая несовместимость, определяемая методом HLA-типирования, пресенсибилизация реципиента: титр предсуществующих антител (PRA) выше 30, наличие донор-специфических антител (DSA), повторная трансплантация.
- Повышенная иммуногенность трансплантата. Вероятность отторжения увеличивается при наличии изменений из-за неправильной консервации или длительной транспортировки донорской почки, полученной от трупа. Фактором риска считается период холодовой ишемии дольше 24 часов. Повышение иммуногенности связано с деструкцией тканей и высвобождением антигенов. Зачастую в таких случаях отмечается отсроченная реакция пересаженного органа.
- Некорректная иммуносупрессорная терапия. Важным условием приживления трансплантированной почки является превентивная иммуносупрессия при выявлении несовместимости тканей и прием иммунодепрессивных препаратов после операции. Кризы отторжения чаще возникают при ведении пациента без назначения индукционного агента, использовании циклоспорин-азатиопринового протокола (вместо такролимус-мофетилового) или протокола без стероидов.
Факторами риска считаются пожилой возраст донора почки, молодой возраст реципиента и его принадлежность к этническим афроамериканцам, отсроченное функционирование почечного трансплантата. Возникновение первого эпизода отторжения повышает вероятность повторных кризисов. Предпосылками к гиперергическому иммунному эффекту являются наличие аутоиммунной и атопической патологии, склонность к аллергическим реакциям.
Механизм отторжения почечного трансплантата основан на развитии реакций гуморального и клеточного иммунитета. При сверхострых и ускоренных кризах чужеродные антигенные структуры подвергаются атаке уже существующих антител, которые путем комплимент-зависимого лизиса повреждают капиллярный эндотелий нефронов пересаженной почки. Возможно быстрое развитие иммунокомплексного воспаления с осаждением в тканях почечного трансплантата комплексов антиген-антитело и активацией системы комплимента. Результатом ответа становятся гемокоагуляционные нарушения с тромбированием сосудов почечного аллотрансплантата, прекращением кровотока и отмиранием тканей вследствие ишемии.
Ключевую роль в развитии острой трансплантационной иммунной реакции играет Т-клеточный ответ. После распознавания донорских HLA-антигенов лимфоцитами реципиента возникает прямой быстрый эффект в виде созревания специфических Т-киллеров, разрушающих чужеродные клетки, и более поздняя дифференциация B-лимфоцитов в плазматические клетки, секретирующие иммуноглобулины. Вначале происходит очаговая клеточная инфильтрация почечного трансплантата лимфоцитами и плазмоцитами, в последующем пересаженный орган тотально инфильтрируется зрелыми лимфоцитарными клетками, на завершающем этапе отторжения в воспалительном процессе участвуют сегментоядерные клетки и макрофаги.
Патогенез хронического отторжения представлен гуморальной иммунной реакцией, при которой циркулирующие антитела реципиента связываются с HLA-антигенами донорских тканей. В воспалительный процесс вовлекаются преимущественно артерии, артериолы, капилляры клубочков и канальцев трансплантата, эндотелий которых подвергается альтерации с последующей постепенной облитерацией просвета. Возникающая ишемия приводит к отмиранию функциональной ткани почки, ее замещению соединительнотканными фиброзными волокнами, прогрессированию почечной недостаточности.
Критериями для систематизации вариантов отторжения почки-трансплантата служат сроки возникновения и патогенетические особенности иммунного ответа. По скорости развития отторжение бывает сверхострым (происходящим на операционном столе или в первые часы после пересадки), ускоренным (спустя 12-72 часа после начала кровотока в пересаженном органе), острым (от 3 дней до 3 месяцев после операции), хроническим (развившимся по окончании острого периода). В международной морфологической классификации Banff-2007 нормальное приживление трансплантата определяется как реакция I типа, выделяются следующие сомнительные и патологические состояния:
- ТипII — антитело-опосредованные изменения. При отсутствии признаков активного отторжения сопровождается отложением Т-хелперов, наличием в сыворотке DSA. Иммунный ответ может проявляться острым канальцевым некрозом, поражением гломерулярных и перитубулярных капилляров, артериитом и фибриноидным некрозом.
- ТипIII— пограничные изменения. Служат маркером возможной Т-клеточной реакции отторжения. В биоптате почки отсутствуют признаки сосудистого поражения. У 7% пациентов выявляется тубулит без воспалительных изменений в интерстиции либо интерстициальное воспаление без значительного повреждения канальцев.
- ТипIV— Т-клеточно-опосредованное отторжение. Умеренное (1А) или тяжелое (1Б) тубулоинтерстициальное воспаление определяется у 51-52% реципиентов с отторжением трансплантата. В 10-11% случаев обнаруживается слабый, умеренный (2А) или тяжелый (2Б) артериит, в 1-2% — трансмуральный артериит, фибриноидный некроз.
II-IV типы реакций соответствуют сверхострым и острым расстройствам. Хроническое отторжение с атрофией канальцев и интерстициальным фиброзом отнесено к типу V. Тип VI включает другие изменения, возникающие при кризах отторжения почечного аллотрансплантата. Использование классификации Banff позволяет подобрать эффективную патогенетическую терапию иммунной реакции.
Симптомы
Клиника зависит от времени возникновения криза. При ускоренных и острых формах отторжения общее состояние ухудшается резко: нарастает слабость, общее недомогание, нарушается сон, возникают мышечные и суставные боли, при тяжелом течении обнаруживается кашель, тошнота, рвота, кожный зуд. Температура повышается до 38° С и более, отмечаются ознобы. Существенно, вплоть до полного прекращения мочевыделения, сокращается диурез.
В области почечного трансплантата определяется болезненное припухание или уплотнение. Повышается артериальное давление. Реакция позднего отторжения длительное время протекает бессимптомно и устанавливается преимущественно лабораторно. При значительном склерозировании паренхимы трансплантата могут наблюдаться быстрая утомляемость, снижение работоспособности, появление утренних отеков на лице, артериальная гипертензия, уменьшение объема суточной мочи.
Острая воспалительная деструкция или постепенное склерозирование паренхимы завершаются развитием почечной недостаточности и нарастанием признаков уремии. Интоксикация организма продуктами разрушения тканей трансплантата в сочетании с нарушением ренин-ангиотензиновой регуляции давления и коагулопатическими расстройствами может спровоцировать возникновение интоксикационного шока, ДВС-синдрома, тромбозов крупных сосудов (тромбоэмболии легочной артерии и др.), сердечной недостаточности с отеком легких, асцитом.
На фоне проводимой иммуносупрессорной терапии возможно усугубление иммунной реакции инфекционно-воспалительным процессом. Основными последствиями позднего синдрома отторжения являются стойкая артериальная гипертензия, анемия, остеопороз.
Диагностический поиск у пациентов с подозрением на отторжение почечного трансплантата направлен на верификацию иммуновоспалительного процесса. Проще диагностируются острые варианты трансплантологического кризиса, возникающие сразу либо в первые месяцы после операции. При хроническом синдроме отторжения в связи с отсутствием выраженной симптоматики требуется высокая диагностическая настороженность при оценке динамики лабораторных показателей. Рекомендованными методами обследования являются:
- Биохимический анализ крови. Признаками синдрома отторжения служат нарастание уровня креатинина, высокие концентрации мочевины, калия. Обычно увеличивается содержание лактатдегидрогеназы, С-реактивного белка. В пробе Реберга выявляется снижение скорости клубочковой фильтрации. Результаты исследования крови дополняют данными нефрологического комплекса.
- УЗИ трансплантата. При остром процессе пересаженная почка увеличена в размерах, чашечно-лоханочная система и мочеточник расширены. В паранефрии определяется выпот. Паренхима гипоэхогенна, характерен симптом «выделяющихся пирамид». Хроническое отторжение проявляется уменьшением размера почечного аллотрансплантата, гиперэхогенностью вследствие склероза.
- УЗДГ почечных сосудов. У пациента с острой реакцией снижается линейная скорость кровотока или обнаруживается его полное отсутствие. Индекс сопротивления превышает 0,7, выявляются аваскулярные зоны размерами более 0,3 см. Артериальный диастолический кровоток существенно уменьшен или отсутствует. При тяжелом отторжении возможен реверсивный кровоток в диастоле.
- Расширенное комплексное иммунологическое исследование. Позволяет определить отдельные субпопуляции лимфоцитов, их активность, содержание циркулирующих иммунных комплексов, иммуноглобулинов. Дополняется исследованием уровня комплемента и общим анализом крови, в котором отмечается лейкоцитоз (реже — лейкопения), эозинофилия, тромбоцитопения, ускорение СОЭ.
- Пункционная биопсия почечного трансплантата. Наиболее достоверный метод диагностики кризиса отторжения - биопсия почки. В полученном материале при остром воспалении обнаруживается инфильтрация лимфоцитами, плазматическими клетками, признаки поражения интимы сосудов. При позднем процессе выявляется тубулоинтерстициальный нефрит, фибропролиферативный эндартериит, гломерулосклероз.
Дополнительное проведение нефросцинтиграфии почечного трансплантата позволяет оценить функциональный резерв органа. Начавшийся эпизод ускоренного или острого отторжения дифференцируют с сохраняющейся отстроченной функцией нефротрансплантата, тромботической микроангиопатией, мочевым затеком, острым тубулонекрозом, другими хирургическими, сосудистыми, урологическими причинами дисфункции пересаженной почки. После исключения других видов почечной патологии проводят дифференциацию между острыми гуморальным и клеточным отторжениями.
При хроническом течении исключают возвратный гломерулонефрит, волчаночную нефропатию, пиелонефрит, полиомавирусное поражение почек, нефротоксичное действие ингибиторов кальциневрина. По назначению трансплантолога, врача-нефролога или уролога пациента консультирует анестезиолог-реаниматолог, гематолог, инфекционист, иммунолог, ревматолог.
Лечение отторжения почечного трансплантата
Врачебная тактика определяется клинико-морфологической формой трансплантационного криза. Диагноз сверхострого отторжения является основанием для проведения нефротрансплантатэктомии. При подозрении на ускоренную либо острую реакцию обеспечивается динамический мониторинг жизненных показателей, кислотно-щелочного состояния, водно-электролитного баланса, функциональной состоятельности почек. С учетом патогенеза патологического процесса назначают:
- При ускоренном отторжении. Требуется экстренная многокомпонентная антикризовая терапия. Для подавления иммунной реакции применяются кортикостероиды, антитимоцитарный глобулин, осуществляется плазмаферез. При отсутствии эффекта пораженный почечный трансплантат удаляется.
- При остром клеточном отторжении. Рекомендовано усиление или конверсия базовых иммуносупрессорных препаратов, пульс-терапия кортикостероидами, проведение 1-3 процедур плазмафереза или плазмообмена. При стероидной резистентности вводятся антитимоцитарные глобулины.
- При остром гуморальном отторжении. Назначается до 3-5 процедур плазмообмена или плазмафереза. После укороченной стероидной пульс-терапии и при гормональной резистентности показаны повторные курсы истощающих моноклональных и поликлональных антилимфоцитарных антител.
- При хроническом отторжении. Корректируется дозировка иммунодепрессивных средств, применяется пульс-терапия глюкокортикостероидами коротким курсом. Для снижения повышенного АД используются гипотензивные препараты. При нарастании ХПН возобновляется ЗПТ, возможна повторная трансплантация.
Исход зависит от своевременности и адекватности терапии. Прогноз всегда считается серьезным. С помощью высокодозной пульс-терапии ГКС удается купировать до 75-80% эпизодов отторжения. Эффективное применение противотимоцитарных антител возможно при 5 и более первых трансплантационных кризах. Проведение повторных курсов истощающих антител обеспечивает сохранение почечного трансплантата у 40-50% реципиентов с острым гуморальным отторжением.
Для профилактики необходимо тщательное обследование реципиента на гистосовместимость с донором, выполнение предоперационной десенсибилизации при выявлении AB0-несовместимости, соблюдение правил забора органа, выбор подходящего режима индукционной и поддерживающей иммуносупрессорной терапии с периодическим биопсийным контролем состояния почечного трансплантата.
1. Причины дисфункции почечного трансплантата по данным нефробиопсии/ Дмитриев М.М.// 70-я Международная научно-практическая конференция студентов и молодых ученых «Актуальные проблемы современной медицины и фармации – 2016».
2. Подходы к лечению позднего острого и активного хронического отторжения почечного трансплантата: Диссертация/ Артюхина Л.Ю. – 2016.
4. Диагностика острой реакции отторжения почечного трансплантата на фоне отсутствия начальной функции: Автореферат диссертации/ Арзуманов С.В. – 2005.
Осложнения трансплантации почки
Осложнения трансплантации почки — это расстройства, этиологически связанные с пересадкой нефротрансплантата. В раннем периоде проявляются гипертермией, олигоанурией, артериальной гипертензией, болью в области трансплантата. Поздние осложнения длительно протекают бессимптомно, в последующем превалируют признаки почечной недостаточности и нарушений в работе других органов. Патология диагностируется с помощью исследований крови и мочи, УЗИ, УЗДГ, МРТ почек, пункционной биопсии. Для лечения применяют иммуносупрессоры, антибиотики, антиагреганты, антикоагулянты, проводят хирургическую ревизию раны, оперативные вмешательства на мочеточниках, нефротрансплантатэктомию.
Выживаемость пациентов, перенесших трансплантацию почки, на протяжении первого послеоперационного года достигает 94-98%, однако развитие осложнений существенно влияет на функциональность пересаженного органа и качество жизни реципиентов. В раннем и позднем посттрансплантационном периоде могут возникать как урологические заболевания, так и повреждения других органов, способные спровоцировать гибель пациента.
По результатам наблюдений, 33,2% смертей после трансплантации почек вызваны кардиальными причинами, из них 11,3% — острым инфарктом миокарда, 17,8% — инфекционными заболеваниями, 11,9% — опухолевым процессом, 6,9% — нарушением мозгового кровообращения, 30,3% — другими факторами. В течение первых 12 месяцев после вмешательства отторгается от 6 до 12% нефротрансплантатов, что требует возобновления заместительной почечной терапии и проведения повторной пересадки. До 36% реципиентов переносят инфекционные заболевания мочевыделительных органов и оппортунистические инфекции.
Несмотря на накопленный опыт и внедрение эффективных стандартов проведения операции, техническая сложность ее выполнения и использование аллотрансплантата повышают риск осложненного течения послеоперационного периода. Специалисты в сфере современной урологии, нефрологии и трансплантологии выделяют следующие группы причин, провоцирующих возникновение осложнений после нефротрансплантации:
- Возраст и состояние здоровья реципиента. Кроме абсолютных противопоказаний, при которых проведение трансплантации в большинстве случаев завершается неблагоприятным исходом, существуют относительные, существенно повышающие вероятность осложнений. В группу риска входят пациенты старше 65-70 лет, а также страдающие рядом сопутствующих заболеваний — активным гепатитом, циррозом печени, СКВ, васкулитом, гемолитико-уремическим синдромом, системными заболеваниями в активной фазе, сахарным диабетом, острыми инфекционными процессами, ХСН IIБ ст.
- Особенности трансплантируемой почки. Осложнения чаще возникают при AB0 и HLA-несовместимости тканей, пресенсибилизации реципиента. Приживление органа ухудшается при длительной (более 24 ч) холодовой ишемии почки, по результатам некоторых наблюдений этот фактор оказывается более значимым, чем гистосовместимость. Функциональность трупной почки зависит от причин смерти донора, электролитных нарушений, степени и длительности гипотонии, других особенностей агонального периода. На течение посттрансплантационного периода также влияет техника забора органа.
- Медицинские факторы. Исход трансплантации зависит от полноты предоперационного обследования реципиента и прижизненного донора, правильности оценки выявленных противопоказаний, проведения предтрансплантационной подготовки при обнаружении гистологической несовместимости тканей. На качество приживления почки оказывают влияние техническая точность пересадки, соблюдение требований асептики и антисептики, профилактика ишемического повреждения органа, качество наблюдения за пациентом, выбор оптимального режима иммуносупрессии (ИСТ).
- Иммунодефицит. Ряд постнефротрансплантационных осложнений связан с медикаментозным угнетением иммунитета реципиента. Назначение иммуносупрессивных препаратов — важное условие профилактики отторжения трансплантата. Однако на фоне иммунодефицита повышается вероятность возникновения ранних и отдаленных инфекционных заболеваний. Кроме того, иммуносупрессия является фактором риска онкогенеза. У части пациентов нарушения гуморального и клеточного иммунитета стимулируют возникновение аллергических и аутоиммунных реакций.
Механизм развития осложнений трансплантации почек зависит от этиологических факторов, спровоцировавших патологическое состояние. Зачастую в основе расстройства лежит иммунное или инфекционное воспаление. В первом случае наблюдается отторжение нефротрансплантата вследствие Т-клеточного ответа или гуморальной реакции типа антиген-антитело. При попадании в рану инфекционных агентов воспалительная деструкция тканей происходит под действием бактериальных эндо- и экзотоксинов.
Ситуация часто усугубляется ишемическими нарушениями, возникшими на фоне расстройств микроциркуляции, артериальной окклюзии, венозного тромбоза. Отдельную роль в патогенезе постнефротрансплантационных осложнений играет иммуносупрессия, снижающая или извращающая нормальную защитную реакцию организма на действие повреждающих факторов. В отдаленные сроки преобладают процессы склерозирования почечной паренхимы.
Систематизация вариантов осложнений после трансплантации почки создана с учетом времени возникновения, причин, механизма развития и клинической симптоматики расстройства. Такой подход соответствует принципам своевременной диагностики и адекватной этиопатогенетической терапии постнефротрансплантационных нарушений. Осложнения при нефротрансплантации могут быть ранними, возникшими остро в ходе операции или в первые месяцы после пересадки, и поздними, с постепенным нарастанием симптомов. Различают следующие формы патологии:
Ранние острые нарушения обычно отличаются бурной клинической картиной. Вскоре после трансплантации у пациента возникает ярко выраженный интоксикационный синдром с высокой температурой, ознобом, суставными и мышечными болями, тошнотой, рвотой, кожным зудом, резкой слабостью. При внутреннем кровотечении наблюдается головокружение, бледность кожных покровов, возможна потеря сознания.
У большинства реципиентов о появлении осложнений свидетельствует значительное уменьшение мочеотделения вплоть до его полного прекращения в сочетании с высоким артериальным давлением. В области трансплантированной почки может пальпироваться болезненное уплотнение. Распространенным признаком инфекционного воспаления является наличие обильного раневого отделяемого. При вовлечении в воспалительный процесс брюшины и развитии перитонита возникает резкая боль в брюшной полости, живот становится напряженным, доскообразным, отмечается учащение пульса, резкое падение АД, часто отсутствует стул.
Проявлением поздних осложнений обычно становится прогрессирующее снижение фильтрационной способности почек. Клиническая симптоматика длительное время отсутствует. В последующем пациент начинает предъявлять жалобы на быструю утомляемость, снижение работоспособности. Уменьшается суточный диурез. Утром на лице преимущественно в области век появляются отеки, которые по мере развития почечной недостаточности сохраняются в течение дня и распространяются на другие части тела. Часто повышается артериальное давление.
Возникают и нарастают симптомы уремии — заторможенность, апатичность, бледность и сероватый оттенок кожи, интенсивный кожный зуд, жажда, нарушения сна, низкая температура тела, отсутствие аппетита, тошнота, рвота, диарея. При сочетанном поражении других органов и систем отмечается соответствующая симптоматика. Из-за угнетения иммунитета реципиенты часто болеют ОРВИ, у них развиваются тяжелые длительные бронхиты, пневмонии. Возможны различные формы пиодермий.
Нарушение всасывания кальция приводит к остеопорозу, гиперплазии паращитовидных желез. Из-за недостаточного синтеза эритропоэтинов часто формируется анемия. У пациентов, длительно принимающих иммуносупрессоры, могут диагностироваться онкологические заболевания. При этом преобладают новообразования предположительно вирусного происхождения — плоскоклеточная (сквамозная) и базальноклеточная карциномы, лимфопролиферативная болезнь (преимущественно В-клеточная неходжкинская лимфома), аногенитальные неоплазии, в том числе рак шейки матки, саркома Капоши.
Диагностический поиск при подозрении на осложнение трансплантации почки направлен на уточнение характера расстройства, оценку жизнеспособности и функциональной состоятельности почечного трансплантата, выявление критических органных и метаболических нарушений, угрожающих жизни реципиента. Наиболее информативными методами обследования являются:
- Общий анализ крови. Вероятное развитие острых осложнений подтверждается значительным повышением уровня лейкоцитов, падением содержания тромбоцитов, ускорением СОЭ. В отдаленном периоде часто наблюдается снижение концентрации эритроцитов, гемоглобина, на фоне иммуносупрессии возможно возникновение лейкопении.
- УЗИ почечного трансплантата. Эхография почки является безопасным скрининговым методом, позволяющим выявить изменение размеров пересаженного органа, деструкцию паренхимы, наличие патологических изменений в паранефральном пространстве. Исследование дополняют УЗДГ почечных сосудов для комплексной оценки состояния кровотока.
- Биохимический анализ крови. О нарушении фильтрационной функции клубочков свидетельствует нарастание уровней креатинина, остаточного азота, мочевины, калия. Поражение гломерулярного аппарата подтверждается данными пробы Реберга, нефрологического комплекса. Характерен высокий уровень ЛДГ, С-реактивного белка.
В зависимости от типа осложнения в общем анализе мочи может обнаруживаться повышение или снижение удельной плотности, наличие эритроцитов, лейкоцитов, цилиндров, бактерий. Для исключения отторжения нефротрансплантата рекомендовано проведение расширенного комплексного иммунологического исследования, пункционной биопсии с последующим гистологическим анализом полученного материала. Исследования с введением рентгеновского контраста (экскреторная урография, КТ, МСКТ почек) производятся с осторожностью из-за возможного усугубления клинической ситуации за счет развития контраст-индуцированной нефропатии.
В качестве дополнительных методов может назначаться МРТ для выявления возможных структурных нарушений в тканях трансплантата и нефросцинтиграфия, позволяющая уточнить функциональность пересаженной почки. Для мониторинга состояния пациента в раннем посттрансплантационном периоде оценивают волемический статус (гемогидробаланс, уровень ЦВД), электролитное состояние (уровни калия, натрия, кислотно-щелочного равновесия), коагулограмму, обеспечивают контроль диуреза, суточное мониторирование АД, регулярно выполняют ЭКГ.
Дифференциальную диагностику обычно проводят между различными видами осложнений. При поздних урологических последствиях трансплантации исключают развитие возвратного гломерулонефрита, рецидивирующей волчаночной нефропатии, пиелонефрита, гидронефроза. По назначению врача-нефролога или уролога пациента консультирует трансплантолог, анестезиолог-реаниматолог, абдоминальный хирург, инфекционист, ревматолог, иммунолог, онколог.
Лечение осложнений трансплантации почки
Основными врачебными задачами являются скорейшая коррекция возникших расстройств и поддержание основных жизненных функций реципиента. При отсутствии острых хирургических осложнений лечение обычно представлено комплексной медикаментозной терапией. С учетом выявленных нарушений пациентам, перенесшим трансплантацию почки, назначаются:
- Коррекция иммуносупрессорной терапии. Применение пульс-методов, изменение дозировки ингибиторов кальциневрина, антиметаболитов, глюкокортикоидов, ингибиторов интерлейкинов, биологических антилимфоцитарных агентов, замена одних препаратов другими зачастую позволяет купировать эпизод отторжения. Коррекция назначений также может потребоваться при связи осложнений с принимаемыми иммунодепрессантами.
- Лечение ишемии пересаженной почки. При возникновении сосудистых и тромботических нарушений используются дезагреганты, антикоагулянты, антигипоксанты, цитопротекторы, синтетические простагландины. С их помощью удается эффективно улучшить почечный кровоток, микроциркуляцию, перфузию тканей. Для увеличения кислородной емкости крови может назначаться гипербарическая оксигенация.
- Антибактериальные препараты. Показанием к проведению активной антибиотикотерапии служит наличие инфекционно-воспалительных осложнений. Предпочтительны противобактериальные средства с минимальным риском нефротоксического эффекта — хинолоны, комбинации диаминопиримидинов с синтетическими сульфаниламидами. При лечении оппортунистических инфекций учитывается чувствительность микроорганизмов.
Инфузионная терапия под контролем диуреза проводится при возникновении острых, угрожающих жизни состояний, метаболических расстройств. С учетом клинической картины реципиенту почки могут вливаться коллоидные и кристаллоидные растворы, отдельные электролиты, цельная кровь и ее компоненты. При нарастании признаков почечной недостаточности возобновляется заместительная терапия (гемодиализ, перитонеальный диализ, гемофильтрация, гемодиафильтрация). Лечение заболеваний, спровоцированных трансплантацией почки, осуществляется согласно протоколам для соответствующей патологии.
Оперативные методы лечения требуются при выявлении хирургических осложнений, деструкции мочеточника или почечного трансплантата. Объем вмешательств зависит от особенностей осложнения. Может выполняться ревизия и дренирование раны, ушивание поврежденных сосудов, лапароскопическая марсупиализация лимфоцеле. При повреждении мочеточника возможно проведение эндоскопического рассечения уретероцеле, уретеропластики, уретерокутанеостомии, наложение неоуретероцистоанастомоза. Необратимая деструкция трансплантированной почки служит показанием для нефротрансплантатэктомии с последующим назначением ЗПТ и возможной повторной пересадкой органа.
Возникновение осложнений ощутимо ухудшает показатели выживаемости пациентов, однако своевременное выявление и грамотная коррекция расстройств делают прогноз более благоприятным. Профилактика возможных осложнений начинается с комплексного обследования больного перед операцией для определения всех абсолютных и относительных противопоказаний, оценки гистосовместимости с донором. При предстоящей AB0-несовместимой трансплантации требуется проведение предоперационной десенсибилизации. По показаниям на предтрансплантационном этапе может назначаться превентивная антибиотикотерапия.
С учетом вероятной компрометации заживления раны на фоне иммуносупрессивной терапии важна прецизионная хирургическая техника, повышенное внимание к деталям, строгое соблюдение правил асептики, тщательный гемостаз. После трансплантации ключевую роль играет правильный выбор индукционной и поддерживающей ИСТ, послеоперационный мониторинг состояния реципиента.
2. Инфекции после трансплантации почки (Обзор литературы)/ Кабулбаев К.А.// Нефрология и диализ. – 2009 – Т.11, №4.
3. Инфекционные осложнения раннего послеоперационного периода у пациентов после трансплантации почки/ Барканова О.Н., Перлин Д.В., Шепелева Ю.Б., Реброва Е.В., Ильченко О.В. // Вестник Волгоградского государственного медицинского университета. – 2016.
4. Этиология возбудителей инфекционных осложнений после трансплантации печени и почек и их резистентность к антибиотикам/ Габриэлян Н.И.// Российский медицинский журнал. – 2016.
Читайте также:
- Предвестники внезапной сердечной смерти. Диагностика внезапной сердечной смерти.
- Реакция на прикосновение гусеницы кошачьей моли
- Инфекционные осложнения послеоперационного периода. Оксигенотерапия в послеоперационном периоде
- Зависимость эффекта лекарства от концентрации
- Онкоцитарная аденома или аденома из клеток Гюртля. Постбронхиальный рак Гецовой
