Методы обследования сегментарного инфаркта сальника
Добавил пользователь Валентин П. Обновлено: 23.01.2026
ВГН — верхняя граница нормы
ИМ — инфаркт миокарда
КШ — коронарное шунтирование
ОИМ — острый инфаркт миокарда
ОКС — острый коронарный синдром
ПИМОТ — первый инфаркт миокарда с отрицательным тестом на тропонин в крови
ПИМПТ — первый инфаркт миокарда с положительным тестом на тропонин в крови
Предпосылки к проведению исследования
Определение концентрации тропонина в крови стало стандартным подходом к установлению диагноза острого инфаркта миокарда (ОИМ) в ранние сроки после его развития; кроме того, этот тест позволяет получить важную информацию о прогнозе [1—3]. Учитывая все более частое использование моделей для определения риска развития инфаркта миокарда (ИМ) без подъема сегмента ST и внелабораторного (так называемого прикроватного, или экспресс-теста) определения концентрации тропонина в крови в отделениях неотложной помощи, было выполнено исследование, включавшее группу больных ИМ без подъема сегмента ST, у которых в момент госпитализации в крупный региональный медицинский центр были отрицательными результаты теста на тропонин в крови. Поскольку до последнего времени информация о таких больных была недостаточной, была предпринята попытка оценить их характеристики в момент госпитализации, а также тактику лечения и исходы во время пребывания в стационаре и прогноз в течение 6 мес наблюдения [4, 5].
Цель исследования
Проверить гипотезу о том, что у больных с первым инфарктом миокарда с отрицательным тестом на тропонин в крови (ПИМОТ) менее вероятно применение активной тактики лечения и более вероятен неблагоприятный исход, поскольку тактика лечения часто основывается на результатах лабораторных анализов.
Структура исследования
Ретроспективное обсервационное исследование.
Материал и методы исследования
В анализ включены данные о больных, которые были госпитализированы в Мичиганский университетский медицинский центр (Анн-Арбор, штат Мичиган) или переведены в этот центр из других лечебных учреждений в период с января 1999 г. по июнь 2006 г. с предполагаемым диагнозом острого коронарного синдрома (ОКС). На основании диагноза при выписке из анализа были исключены данные о больных с ИМ с подъемом сегмента ST и нестабильной стенокардией. Для включения в анализ больные должны были госпитализироваться или переводиться в медицинский центр в течение 24 ч после развития ИМ без подъема сегмента ST. В анализ включали данные о больных, характеристики которых соответствовали следующим критериям: наличие симптомов ОКС и повышение концентрации кардиоспецифических биомаркеров (повышение уровня фракции МВ креатинфосфокиназы — КФК более чем в 2 раза по сравнению с верхней границей нормы — ВГН и/или тропонина I более 0,39 нг/мл для больных, госпитализированных в Мичиганский университетский медицинский центр, и от 0,10 до 2,00 нг/мл для больных, переведенных из других лечебных учреждений). Промежуточные концентрации тропонина не учитывались. Клинические характеристики, данные о возрасте и поле больных, а также о терапии и клинических исходах получали из медицинских карт. В анализ включали информацию о таких сопутствующих заболеваниях, как ранее перенесенные заболевания сердца, стенокардия, застойная сердечная недостаточность и ИМ, а также о выполнении коронарного шунтирования (КШ) и чрескожных вмешательств на коронарных артериях, сахарном диабете, курении, гиперлипидемии и артериальной гипертонии. Регистрировали также данные о патологических изменениях на электрокардиограмме (ЭКГ) и результаты исходных лабораторных анализов. Кроме того, получали документы, подтверждающие выполнение вмешательств и развитие осложнений в период пребывания в стационаре по поводу ОКС. Затем связывались по телефону с больными, данные о которых были включены в анализ, или анализировали медицинскую документацию, отражающую состояние больного примерно через 6 мес после выписки из стационара. В такие сроки после выписки оценивали развившиеся неблагоприятные клинические исходы и степень соблюдения предписанного режима терапии.
Все больные с ИМ без подъема сегмента ST были разделены на группу с ПИМОТ (n=659) и группу с первым инфарктом миокарда с положительными результатами теста на тропонин в крови (ПИМПТ; n=1196). Сравнение между группами выполняли с помощью критерия χ 2 Пирсона или точного критерия Фишера для качественных признаков и с помощью t-критерия Стьюдента для непрерывных данных.
Оценку независимости связи между клиническими характеристиками больных и развитием неблагоприятных клинических исходов во время пребывания в стационаре и в течение 6 мес после выписки из стационара выполняли с помощью логистических регрессионных моделей. Учитывали такие неблагоприятные клинические исходы, развившиеся во время пребывания в стационаре, как смерть, повторный ИМ, инсульт, кардиогенный шок, отек легких, остановка кровообращения, фибрилляция и/или трепетание предсердий, а также оценивали частоту развития клинических исходов, включенных в комбинированный показатель частоты развития таких тяжелых осложнений заболевания сердца, как смерть, инсульт или повторный ИМ. Повторный ИМ диагностировали при превышении ВГН концентрации фракции МВ КФК или тропонина либо при повышении на 50% по сравнению с предыдущим уровнем и более. Инсульт (эмболический и/или геморрагический) диагностировали в случае развития очаговых неврологических симптомов (например, потеря или нарушения речи) и подтверждении результатами компьютерной или магнитно-резонансной томографии. Повторную ишемию миокарда диагностировали при возобновлении симптомов ишемии более чем через 24 ч после госпитализации в сочетании с развитием патологических изменений на ЭКГ и/или повышении кардиоспецифических ферментов более чем в 2 раза по сравнению с ВГН. Кардиогенный шок диагностировали при наличии отека легких и признаках гипоперфузии, которая характеризовалась снижением систолического артериального давления менее 80 мм рт.ст. Кроме того, сравнивали между группами частоту развития таких неблагоприятных клинических исходов, как смерть, повторный ИМ, выполнение незапланированной реваскуляризации, инсульт в течение 6 мес после выписки из стационара, а также оценивали комбинированный показатель, включающий частоту развития любого из таких исходов в течение этого же периода. Все виды статистического анализа проводили с помощью пакета программ SPSS 15 (SPSS, Inc., Чикаго, штат Иллинойс, США).
Результаты
В исследование были включены 3624 больных, последовательно госпитализированных с диагнозом ОКС, из которых у 1855 больных был ПИМОТ. Из 1855 больных с ПИМОТ у 659 (35,5%) результат первого анализа уровня тропонина был отрицательным, но повторный анализ становился положительным. Из 1704 больных с ИМ без подъема сегмента ST у 704 (56,8%), у которых были получены результаты двух анализов уровня тропонина, ИМ диагностировали на основании повышенной концентрации тропонина, если концентрация фракции МВ КФК увеличивалась менее чем в 2 раза по сравнению с ВГН. В группе больных с ПИМОТ было больше мужчин, а в анамнезе чаще имелось указание на преходящее нарушение мозгового кровообращения и застойную сердечную недостаточность. Кроме того, у больных с ПИМОТ реже отмечалась инверсия зубцов Т на исходной ЭКГ и регистрировалось более высокое диастолическое АД в момент госпитализации. До госпитализации больные с ПИМОТ чаще применяли антагонисты кальция и реже принимали клопидогрел. Не отмечено статистически значимых различий между группами по продолжительности периода между развитием клинических проявлений ИМ и госпитализацией.
Группы статистически значимо не различались по частоте катетеризации сердца в период пребывания в стационаре, но частота выполнения КШ при ПИМПТ была выше, чем при ПИМОТ.
Фармакотерапия во время пребывания в стационаре, в момент выписки и через 6 мес после выписки различалась между группами. Результаты анализа терапии, применявшейся во время пребывания в стационаре, свидетельствовали о том, что у больных с ПИМOТ чаще использовали нефракционированный гепарин и реже — статины. При выписке больные с ПИМOТ реже принимали клопидогрел и статины. Через 6 мес наблюдения в группе ПИМOТ применялся клопидогрел.
В течение 6 мес наблюдения в группе ПИМOТ по сравнению с группой ПИМПТ в 2 раза больше была частота развития повторного ИМ (у 12,0 и 6,6% больных соотв.; p=0,001). Однако в течение 6 мес не отмечено статистически значимых различий между группами по частоте развития таких исходов, как смерть, инсульт или повторная госпитализация. В течение этого периода комбинированный показатель общей смертности в течение 6 мес, частоты развития ИМ, инсульта и частоты повторной госпитализации был выше в группе ПИМOТ по сравнению с группой ПИМПТ (исходы, включенные в этот показатель, развились у 47,7 и 40,9% больных соотв.; p=0,017), но оно в основном было обусловлено более высокой частотой развития повторного ИМ в группе ПИМOТ. Следует отметить, что в период с 1999 по 2006 г. снижалась доля больных с ПИМOТ по сравнению с долей больных с ПИМПТ и в целом с ИМ без подъема сегмента ST.
Вывод
У больных с ПИМOТ применяется менее активная тактика лечения, и у них в 2 раза выше вероятность развития повторного ИМ в течение 6 мес наблюдения. ПИМOТ встречаются достаточно часто, а тактика лечения больных с ПИМОТ должна быть более активной.
Комментарий
Результаты представленного ретроспективного исследования свидетельствуют о достаточно большом числе больных ИМ без подъема сегмента ST, у которых в момент госпитализации по поводу ОКС отмечается нормальный уровень тропонина в крови. Следует отметить, однако, одинаковую частоту выполнения катетеризации сердца у больных с ПИМOТ и ПИМПТ, что может быть обусловлено несколькими факторами. Во-первых, вполне вероятно, что решение о выполнении катетеризации сердца у больных ИМ без подъема сегмента ST не принимается до получения результатов анализа уровня тропонина через 6 и 12 ч после госпитализации. Во-вторых, больные наблюдались с 1999 г., когда уже были получены результаты нескольких исследований, подтверждающих обоснованность использования моделей для оценки риска с ранним выполнением вмешательства после получения результатов анализа, указывающих на повышение концентрации тропонина в крови [6—10]. В-третьих, решение врача о выполнении катетеризации могло не основываться на результатах оценки риска с помощью специальных моделей и результатах анализа уровня тропонина в крови. Наоборот, предварительная оценка вероятности развития ИМ на основании анализа данных анамнеза, физикального обследования, а также остроты развития клинических симптомов заболевания могли играть большую роль в принятии решения о выполнении коронарографии.
Ранее также было выполнено несколько исследований, включавших больных с ПИМOТ. В исследовании TIMI IIIB (Thrombolysis in Myocardial Infarction IIIB trial) у 25% больных результаты первого анализа уровня тропонина в крови были отрицательными, но через 12 ч отмечалось увеличение концентрации тропонина I (более 0,4 нг/мл) [4]. В то же время в части исследования GUSTO-IIb (Global Use of Strategies to Open Occluded Coronary Arteries) у 55% больных ИМ без подъема сегмента ST в момент госпитализации отмечался отрицательный тест на тропонин в крови [5].
Выполнение коронарографии у больных, включенных в представленный анализ, можно отнести к его преимуществам. Результаты коронарографии позволяют отчасти объяснить некоторые различия между группой ПИМOТ и группой ПИМПТ. У больных с ПИМОТ была более высокая вероятность выявления изменений коронарного кровотока, соответствующих 2-й степени по шкале TIMI, или лишь пограничного снижения коронарного кровотока, в то время как у больных с ПИМПТ была более высокая вероятность выявления изменений коронарного кровотока, соответствующих 0 и 1-й степени по шкале TIMI, т.е. при минимальном кровотоке или в его отсутствие. Различия по степени нарушений коронарного кровотока по классификации TIMI позволяют предполагать наличие принципиальных различий по состоянию коронарных сосудов у больных с ПИМОТ и ПИМПТ. Различие между группами могло быть и по морфологическим характеристикам атеросклеротических бляшек или степени активации тромбоцитов, которые обусловливают высокий риск развития тромбоза [11—13]. Более высокая частота выполнения КШ при ПИМПТ позволяет предположить более распространенное поражение коронарных артерий у таких больных. Однако не удалось выявить статистически значимых различий между группами по частоте выявления поражения трех коронарных артерий.
Следует отметить, что у больных с ПИМОТ в 2 раза чаще отмечалось развитие повторного ИМ в течение 6 мес наблюдения, что могло быть обусловлено несколькими причинами. Во-первых, лекарственная терапия различалась между группами. Больные с ПИМОТ статистически значимо реже принимали статины в период пребывания в стационаре и в момент выписки из стационара, несмотря на то что через 6 мес частота применения препаратов, относящихся к этому классу, оказалась одинаковой. Результаты нескольких клинических испытаний свидетельствовали о том, что применение интенсивного режима терапии статинами приводит к уменьшению выраженности свободнорадикального окисления и снижению уровня маркеров воспаления в крови, которые связаны с нестабильным состоянием атеросклеротической бляшки [9, 10, 14—19]. Во-вторых, через 6 мес наблюдения больные с ПИМОТ статистически значимо реже принимали клопидогрел, несмотря на более высокую частоту выполнения чрескожных вмешательств на коронарных артериях во время пребывания в стационаре. Более частое применение двухкомпонентной антиагрегантной терапии в группе ПИМПТ могло обусловить меньшую частоту развития тромбозов и повторного ИМ в этой группе [20—24]. В-третьих, менее высокая частота выполнения КШ в группе ПИМОТ могла стать причиной высокой частоты развития повторной ишемии миокарда [25].
Можно выделить несколько факторов, объясняющих выявленную тенденцию к снижению с каждым годом числа больных с ПИМОТ. Во-первых, частота применения клопидогрела и ингибиторов тромбоцитарных гликопротеиновых рецепторов IIb/IIIa, а также высоких доз статинов в период выполнения исследования увеличивалась, так что у меньшего числа больных при повторном обследовании определялся положительный тест на тропонин в крови и у таких больных диагностировали не ИМ, а нестабильную стенокардию. Во-вторых, с 2002 г. в исследовательском центре стали использоваться более чувствительные реактивы для оценки концентрации тропонина в крови. Соответственно, при использовании более чувствительного реактива у большего числа больных диагностировался ПИМПТ. Это должно было сопровождаться увеличением числа больных с ПИМПТ и уменьшением числа больных с ПИМОТ в период с 2002 по 2003 г. Кроме того, уменьшалось в целом и число больных ИМ без подъема сегмента ST в ходе выполнения исследования. Результаты ранее выполненных исследований свидетельствовали о снижении числа больных ИМ с подъемом сегмента ST на фоне увеличения частоты применения более активной профилактической терапии [26]. Такие данные позволяют предположить, что в целом доля больных с нестабильной стенокардией увеличивается по сравнению с больными ИМ как с подъемом, так и без подъема сегмента ST.
Следует отметить несколько ограничений данного исследования. Во-первых, оно представляет собой ретроспективный анализ данных, полученных в ходе выполнения когортного исследования. Во-вторых, различия в исходных характеристиках больных могли повлиять на результаты исследования. Так, больные, которые ранее переносили преходящее нарушение мозгового кровообращения, могли иметь более распространенное сосудистое заболевание или более высокий риск развития тромбоза. Наличие в анамнезе застойной сердечной недостаточности могло свидетельствовать о включении в исследование больных, которые реже соблюдали предписанный режим лекарственной терапии и/или мероприятий по изменению образа жизни. В ходе выполнения исследования стали шире применяться такие препараты, как клопидогрел и ингибиторы тромбоцитарных гликопротеиновых рецепторов IIb/IIIa, что также могло повлиять на результаты исследования. В-третьих, отсутствие унифицированного реактива для определения концентрации тропонина в крови, а также уменьшение числа больных с ПИМОТ ограничивают возможность обобщения полученных результатов.
Как бы там ни было, в ходе анализа результатов исследования возникли вопросы, на которые в дальнейшем следует получить ответы. Помимо вопроса о причинах различий по лекарственной терапии у больных, необходимо уточнить причину увеличения частоты развития повторных эпизодов ишемии миокарда, менее выраженных нарушений коронарного кровотока по классификации TIMI, а также более высокую частоту развития повторного ИМ в течение 6 мес наблюдения в группе ПИМОТ по сравнению с группой ПИМПТ. Выявленные в ходе исследования тенденции могут стать дополнительным основанием для усовершенствования лекарственной терапии с целью снижения в будущем частоты развития ИМ.
Результаты исследования, по мнению авторов, могут иметь большое практическое значение, поскольку настороженность персонала отделений неотложной помощи и кардиологов нередко становится меньше после получения отрицательного результата первого теста на тропонин в крови. Однако в случаях, когда в ходе дальнейшего наблюдения результаты определения уровня тропонина в крови становились положительными, в 2 раза увеличивался риск развития повторной ишемии миокарда во время пребывания в стационаре и развития ИМ в течение последующих 6 мес.
Таким образом, больные с ПИМОТ имеют повышенный риск развития неблагоприятного исхода и, по-видимому, тактика лечения в таких случаях должна быть более активной, а не менее активной, чем у больных с ПИМПТ. В то же время полученные в ходе анализа данные свидетельствуют о том, что отрицательный результат первого теста на тропонин в крови оказывает отрицательное влияние на тактику применения лекарственной терапии.
Методы обследования сегментарного инфаркта сальника
а) Определения:
• Первичным (идиопатическим) инфарктом сальника называется сосудистая катастрофа сальника ± перекрут
• Вторичный инфаркт сальника может развиваться при перекруте вследствие: (а) фиксации сальника к приобретенному образованию (например, операционному рубцу или новообразованию), (б) травмы или (в) ущемления в грыжевом мешке
б) Визуализация:
1. Общая характеристика:
• Основные диагностические признаки:
о Овоидное/блиновидное образование сальника, имеющее преимущественно плотность жира/коэффициент ослабления жира
• Локализация:
о Локализуется между брюшной стенкой и ободочной кишкой, обычно с правой стороны:
- 82% в нижнем и 15% в верхнем квадранте
• Размеры:
о Обычно >5 см (3,5-10 см)
2. Рекомендации по визуализации:
• Оптимальный метод визуализации:
о Зачастую решающими для диагностики являются результаты КТ с контрастным усилением, не зависящие от оператора; метод позволяет получать качественные изображения и детальные описания
о Также диагноз может ставиться на основании типичной картины, выявляемой при прицельном ультразвуковом исследовании высокого разрешения в зоне максимальной болезненности
о Часто диагноз не предполагается клинически, и ультразвуковое исследование как метод первичной диагностики выполняется для исключения других патологических состояний (например, аппендицита или холецистита)
3. КТ при сегментарном инфаркте сальника:
• КТ с контрастным усилением:
о Измененная жировая клетчатка локализуется между прямыми мышцами живота и ободочной кишкой
- Может выявляться очаговое затенение жировой клетчатки или, чаще, крупное (>5 см) неконтрастируемое гетерогенное образование сальника в сочетании с исчерченностью жировой клетчатки
о Может наблюдаться симптом центральной точки (центральный очаг с высоким коэффициентом ослабления, представляющий собой центральный застойный или тромбированный сосуд/кровоизлияние)
о Соседние ободочная кишка, желчный пузырь и червеобразный отросток не изменены
о Реже наблюдается скопление свободной жидкости и минимальное реактивное утолщение ободочной кишки
4. УЗИ при сегментарном инфаркте сальника:
• Серошкальное исследование:
о Несжимаемое очаговое эхогенное уплотнение жировой клетчатки, напоминающее объемное образование, лежащее непосредственно под брюшной стенкой в зоне максимальной болезненности
о При допплерографии видно, что в объемном образовании отсутствует сосудистая сеть:
- Может наблюдаться периферическая гиперемия
о В ткани гиперэхогенного объемного образования определяются узловые или линейные гипоэхогенные бессосудистые зоны с нечеткими контурами
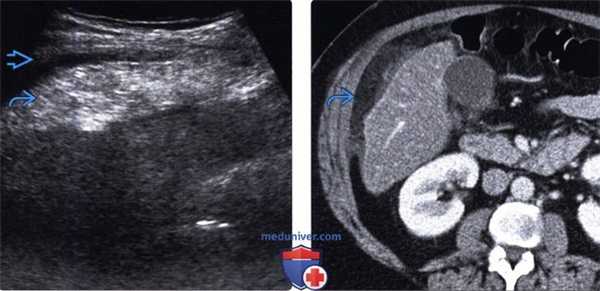
(Левый) Пациент с жалобами на острые боли в правой верхней части живота. При УЗИ брюшной полости в верхнем правом квадранте живота под передней брюшной стенкой определяется эхогенное эллипсоидное образование. Прилегающий желчный пузырь выглядит не измененным (не показан).
(Правый) У этого же пациента при КТ с контрастным усилением на аксиальной томограмме в правом верхнем квадранте живота определяется затенение жировой клетчатки сальника, что соответствует изменениям, выявленным при УЗИ. Обратите внимание на отсутствие видимых изменений прилегающего тонкостенного желчного пузыря.
в) Дифференциальная диагностика сегментарного инфаркта сальника:
1. Острый аппендицит:
• Расширенный несжимаемый червеобразный отросток (>6 мм) + аппендиколит
• Другие признаки: исчерченность периаппендикулярной жировой клетчатки, реактивное утолщение слепой кишки/терминального отдела подвздошной кишки, свободная жидкость, + аппендикулярный абсцесс
2. Острый холецистит:
• Толстостенный желчный пузырь в сочетании с перипузырным отеком/свободной жидкостью
3. Правосторонний дивертикулит:
• Наличие правостороннего дивертикула в сочетании с утолщением ободочной кишки
4. Воспаление сальниковых отростков ободочной кишки (аппендажит):
• Фокальное образование (• Наличие ободка с высоким коэффициентом ослабления, представляющего собой воспаленную висцеральную брюшину; при инфаркте сальника такой ободок отсутствует
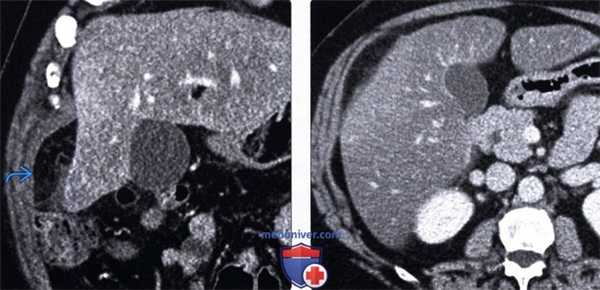
(Левый) У этого же пациента при многоплоскостной реконструкции на корональной томограмме определяется затененная жировая клетчатка сальника, симулирующая картину объемного образования. Обратите внимание на неизмененный тонкостенный желчный пузырь.
(Правый) Контрольное исследование три месяца спустя. Определяется медленное постепенное разрешение рентгенологических изменений.
г) Клинические особенности:
1. Проявления:
• Наиболее частые симптомы/жалобы:
о Постоянные неиррадиирующие боли по правому фланку/в нижней части живота, постепенно усиливающиеся в течение нескольких дней
о Локальный перитонизм ± пальпируемое объемное образование
о Рентгенологические изменения сохраняются и после клинического улучшения
• Другие жалобы/симптомы:
о Обычно не сопровождается повышением температуры, небольшой лейкоцитоз
2. Эпидемиология:
• Возраст:
о Преобладают взрослые; 15% случаев развивается среди детей
• Пол:
о Преобладают мужчины (2:1)
• Провоцирующие факторы:
о Первичный инфаркт сальника:
- Ожирение (неравномерное отложение жировой клетчатки сальника), анатомические особенности сальника (в том числе добавочный и двойной сальник, узкое основание сальника)
о Вторичный инфаркт сальника:
- Грыжа, новообразование, спайки, травма или послеоперационные изменения
3. Лечение сегментарного инфаркта сальника:
• Консервативное, применяются нестероидные препараты
КТ, УЗИ инфаркта сальника
а) Определение:
• Жировой некроз, обусловленный нарушением артериального кровотока в сальнике
1. Общая характеристика инфаркта сальника:
• Лучший диагностический критерий:
о Объемное образование неоднородной плотности в сальниковой клетчатке с наличием признаков воспаления в окружающих тканях
• Размеры:
о Вариабельны: от 3,5 до 15 см
о Массивные инфаркты чаще всего связаны с оперативным вмешательством
• Морфология:
о Фокальное неоднородное объемное образование, состоящее из воспаленного сальникового жира ± кровоизлияния
о Обычно имеет четко очерченные края, треугольную, овоидную форму или вид «пирожка»
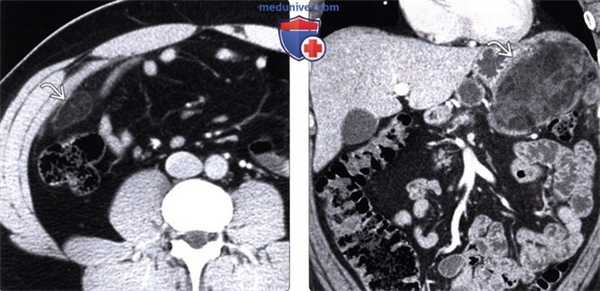
(Слева) На аксиальной КТ с контрастным усилением определяется небольшое, содержащее жир объемное образование с гиперденсным «ободком» и воспалительными изменениями прилежащих тканей в правом нижнем квадранте сальника: «классический» внешний вид и локализация изменений при инфаркте.
(Справа) На корональной КТ с контрастированием у пациента после эндоскопической дистальной панкреатэктомии визуализируется содержащее жир объемное образование в левом верхнем квадранте сальника, представляющее собой массивный инфаркт. Инфаркты сальника после оперативного вмешательства могут быть весьма массивными.
2. КТ при инфаркте сальника:
• Неоднородное инкапсулированное объемное образование в сальнике между передней брюшной стенкой и ободочной кишкой:
о Может иметь различную плотность, но обычно выглядит как очаг жировой плотности (от -20 до -50 ед. Хаунсфилда)
о Края образования обычно четкие, имеется гиперденсный «ободок» по периферии, возникающий, в частности, после оперативного вмешательства:
- Инфаркты на ранних стадиях могут выглядеть расплывчатыми: определяются как плохо отграниченные участки помутнения жировой клетчатки без наличия отдельно лежащего объемного образования
о Не определяется симптом «центрального пятна», как при ап-пендагите
о Патологическая извитость сосудов, питающих сальник, нарушение проходимости которых может привести к инфаркту
• Часто сочетается с воспалительными изменениями окружающих тканей и помутнением жировой клетчатки ± с наличием малого количества жидкости
• Может вызывать образование спаек и с ободочной кишкой, и с париетальной брюшиной:
о Крайне редко провоцирует реактивное утолщение стенки ободочной кишки
о Редко обусловливает реактивное утолщение прилежащих отделов передней брюшной стенки
• Типичная локализация: правые нижние отделы сальника, особенно при идиопатическом процессе
о Если возникает в связи с оперативным вмешательством, локализуется в тканях в зоне операции
3. УЗИ при инфаркте сальника:
• Серошкальное УЗИ:
о Гиперэхогенное, несмещаемое, несдавливаемое, фиксированное объемное образование в брыжейке:
- Сочетается с локальной болезненностью при дозированном надавливании датчиком в определенной точке
- Эхогенная жировая клетчатка, окружающая объемное образование (рефлекторное воспаление) ± малое количество жидкости
• Цветовое допплеровское исследование:
о Уменьшение или отсутствие кровотока внутри эхогенного объемного образования
4. Радионуклидная диагностика:
• ПЭТ/КТ:
о Инфаркт сальника может проявляться повышенным захватом ФДГ, что позволяет предположить опухоль (если, к тому же, на КТ не определяется изменений, типичных для инфаркта сальника)
5. Рекомендации по визуализации:
• Лучший метод визуализации:
о КТ с контрастным усилением
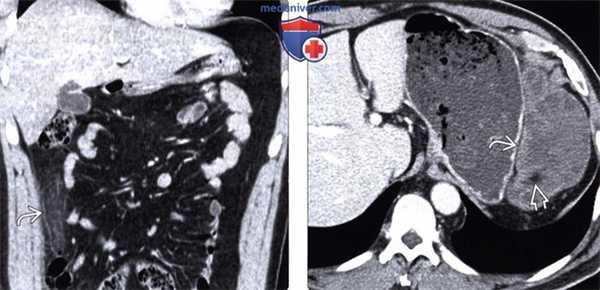
(Слева) На корональной КТ с контрастным усилением у пациента с болевой симптоматикой определяется инкапсулированное, содержащее жир объемное образование в правом нижнем квадранте сальника с помутнением окружающей жировой клетчатки, что характерно для инфаркта.
(Справа) На аксиальной КТ с контрастом у пациента после экстренной дистальной панкреатэктомии выявлено большое объемное образование с четкими контурами в левом верхнем квадранте сальника. Обратите внимание на наличие включений с плотностью жира в структуре образования. Инфаркты сальника, как в этом случае, могут иметь весьма большие размеры и симулировать опухоль (липосаркома) или канцероматоз.
в) Дифференциальная диагностика инфаркта сальника:
1. Острый аппендицит:
• Клинически может проявляться так же, как инфаркт сальника, однако отличия легко обнаруживаются при послойной томографии
• Растянутый аппендикс с утолщением стенки, полнокровием слизистой, помутнением периаппендикулярного жира, воспалением, наличием свободной жидкости
о Может определяться реактивное утолщение стенки слепой кишки или дистальных отделов подвздошной кишки
о Скопление жидкости, абсцесс, эктопический газ в связи с перфорацией
о Аппендиколит может определяться в 10-15% случаев
• Несжимающийся аппендикс (шириной больше либо равный 7 мм) при дозированной компрессии; аппендикс при цветовом доплеровском исследовании часто выглядит гиперваскулярным
2. Аппендагит:
• Доброкачественное самоотграничивающееся заболевание: у 1 % пациентов с острой болью в нижнем правом квадранте (живота)
о Чаще всего заболевание первичное и обусловлено тромбозом или перекрутом сальникового отростка (подвеска), реже вторичное в результате воспаления расположенных рядом органов (аппендицит, дивертикулит и т. д.)
• Может проявляться так же, как инфаркт сальника, различия несущественны, в обоих случаях показано консервативное лечение
• КТ: небольшое жиросодержащее объемное образование с гиперденсным «ободком», прилежащее к ободочной кишке, с легким помутнением расположенной возле него жировой клетчатки:
о Часто выявляется симптом «центрального пятна», обусловленный тромбозом сосудов, в отличие от инфаркта сальника
о Иногда может вызывать реактивное утолщение стенки ободочной кишки и утолщение париетальной брюшины
о Наиболее частая локализация: нижний левый квадрант (ректосигмоидный отдел) в отличие от инфаркта сальника, поражение при котором локализуется в нижнем правом квадранте
3. Липосаркома:
• Инфаркт сальника больших размеров может выглядеть так же, как объемное образование из жировой ткани (липосаркома)
• Различия заключаются в клинических проявлениях (инфаркт сальника сопровождается острой болью) и изменениях во времени (опухоль увеличивается со временем, в то время как инфаркт имеет тенденцию к уменьшению размеров)
4. Панкреатит и некроз перипанкреатической жировой клетчатки:
• Локальное или диффузное увеличение поджелудочной железы с наличием жидкости по ее контуру, помутнением перипанкреатической жировой клетчатки ± скопления жидкости
• Высвобождение ферментов поджелудочной железы в перипанкреатическую жировую клетчатку может стать причиной ее некроза:
о Очаговый жировой некроз может симулировать инфаркт сальника или опухоль
5. Фиброзирующий/склерозирующий мезентерит:
• Мягкотканное объемное образование с лучистыми контурами, чаще всего выявлемое в основании брыжейки тонкой кишки:
о В структуре образования могут определяться обызвествления, как при метастазах рака в брыжейке
• Нередко приводит к утолщению, инфильтрации, смещению и сужению просвета прилежащих петель кишечника
• Чаще всего изменения локализуются в левом верхнем квадранте брыжейки (не в сальнике)
6. Канцероматоз брюшины:
• Метастазы по брюшине выглядят чаще всего как солидные узлы:
о Канцероматоз на ранних стадиях может проявляться наличием узлов с нечеткими контурами и помутнением жировой клетчатки в сальнике, что можно принять за инфаркт
• Метастазы обычно представлены множественными очагами, в то время как при инфаркте сальника поражение единичное
• Рак яичника, органов ЖКТ и т. д. в анамнезе
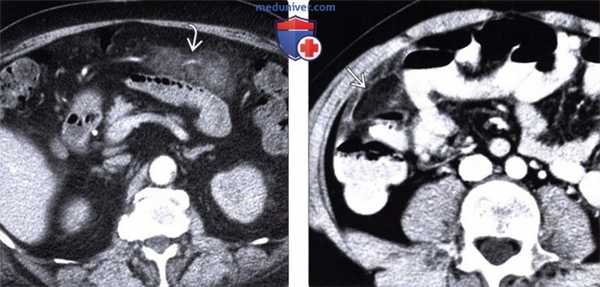
(Слева) На аксиальной КТ у пациента с узелковым полиартериитом и болью в животе определяется помутнение жировой клетчатки в передних отделах сальника, соотносящееся с локализацией боли. Это проявление инфаркта сальника, вероятно, обусловлено васкулитом.
(Справа) На аксиальной КТ с контрастным усилением у одиннадцатилетнего мальчика с жалобами на боли в правом нижнем квадранте (живота) визуализируется четко очерченное, овоидной формы, жировой плотности объемное образование в правом нижнем сегменте, с помутнением прилежащей жировой клетчатки. Лечащий врач склонялся к диагнозу аппендицита, при оперативном вмешательстве был обнаружен инфаркт сальника.
г) Патология:
2. Микроскопия:
• Жировой некроз с воспалительной инфильтрацией:
о Преобладание плазмоцитов, лимфоцитов и гистиоцитов
• Коллагеновый рубец в хронической стадии
д) Клинические особенности:
1. Проявления инфаркта сальника:
• Наиболее частые признаки/симптомы:
о Подострая боль в правом нижнем квадранте живота:
- Правосторонняя локализация в 90% случаев
о Может симулировать острый аппендицит или (реже) острый холецистит
о Лихорадка, тошнота, рвота, диарея и другие конституциональные симптомы нетипичны (в отличие от аппендицита), но иногда могут иметь место:
- У детей конституциональные симптомы возникают чаще, чем у взрослых
• Другие признаки/симптомы:
о Лабораторные данные: нормальные значения лейкоцитов и СОЭ либо незначительное их повышение
о Физикальное исследование:
- Положительный симптом Щеткина-Блюмберга в правом нижнем квадранте (живота) ± наличие пальпируемого образования
2. Демография:
• Возраст:
о Пожилые люди с избыточной массой тела (85% случаев)
о Реже страдают дети (15% случаев)
• Пол:
о М:Ж = 2:1
• Эпидемиология:
о Крайне редкое состояние (в 250 раз реже по сравнению с аппендицитом)
о Взрослые (85%)
о Дети (15%):
- Первичный инфаркт превалирует у детей
3. Течение и прогноз:
• Доброкачественное самоотграничивающееся заболевание
• Осложнения (крайне редко):
о Абсцесс
о Спаечная болезнь, которая может привести к обструкции кишечника
• Прогноз:
о Самоотграничивающийся процесс, спонтанно разрешающийся в течение 1-4 месяцев
• Хирургического вмешательства можно избежать, если инфаркт сальника проспективно дифференцирован от других патологических состояний с помощью методов визуализации
4. Лечение инфаркта сальника:
• Консервативное:
о Купирование болевого синдрома при помощи НПВС
о Если диагноз проспективно подтвержден при помощи КТ, хирургическое лечение не показано
• Возможна эндоскопическая резекция в случаях, когда пациент изначально ошибочно был взят на лапароскопическую аппендэктомию:
о При лапароскопии изменения могут быть не замечены, если сальник исследован недостаточно тщательно
о Теоретически эндоскопическое вмешательство может снизить риск спаечной болезни и предотвратить обструкцию кишечника
е) Диагностическая памятка:
1. Следует учесть:
• Нужно внимательно анализировать изображения на предмет инфаркта сальника у пациентов с подозрением на аппендицит и не измененным аппендиксом на КТ
2. Советы по интерпретации изображений:
• Неоднородное инкапсулированное объемное образование, содержащее жир, в правом нижнем квадранте сальника с помутнением окружающей жировой клетчатки, воспалительной реакцией и небольшим количеством свободной жидкости
Методы обследования аппендажита (воспаления сальниковых привесков ободочной кишки)
а) Терминология:
1. Сокращения:
• Аппендажит (epiploic appendagitis — ЕА)
2. Синонимы:
• Appendicitis epiploicae
3. Определения:
• Первичным аппендажитом называется ишемический инфаркт сальникового привеска вследствие его перекрута или спонтанного тромбоза центральной дренирующей вены
• Вторичный аппендажит провоцируется воспалением соседних структур
1. Общая характеристика:
• Основные диагностические признаки:
о Содержащая жировую клетчатку овоидная структура, фиксированная к стенке ободочной кишки и окруженная исчерченной жировой клетчаткой брыжейки
• Локализация:
о Ректосигмоидное соединение (57%)
о Илеоцекальная зона (26%)
о Восходящая ободочная кишка (9%)
о Поперечная ободочная кишка (6%)
о Нисходящая ободочная кишка (2%)
• Морфология:
о Сальниковые привески представляют собой мелкие (длина 0,5-5 см, толщина 1-2 см), содержащие жировую клетчатку выпячивания брюшины, локализующиеся на свободной (противоположной брыжеечной) поверхности ободочной кишки
о При остром аппендажите сальниковый привесок становится отечным, его средний диаметр увеличивается до 1,5-3,5 см
2. УЗИ при аппендажите:
• Серошкальное исследование:
о Фиксированное к ободочной кишке несжимаемое гиперэхогенное образование овальной формы в зоне максимальной болезненности
о Гиперэхогенный ободок воспаленной висцеральной брюшины (93%)
о Может содержать центральный гипоэхогенный участок-зону геморрагических изменений
о Прилегающая стенка кишки не изменена или наблюдается ее минимальное утолщение, создающее эффект наличия объемного образования
• Цветовая допплерография:
о Кровоток по центральным сосудам отсутствует (важный дифференциальный признак от вторичного аппендажита)
• УЗИ с контрастным усилением:
о В артериальную фазу наблюдается высококонтрастный периферический ободок
о Центральные неконтрастируемые гипоэхогенные участки
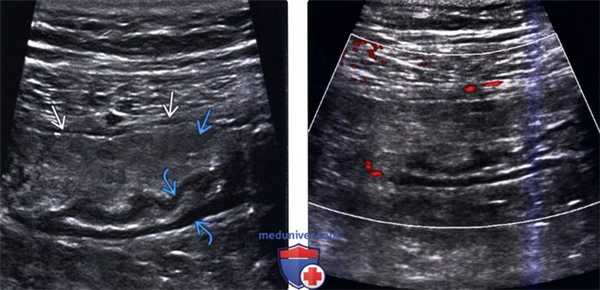
(Левый) При УЗИ в черно-белом режиме определяется четко отграниченное эхогенное образование с гипоэхогенным ободком утолщенной висцеральной брюшины и нечеткими гипоэхоген-ными очагами в центре. Обратите внимание на отсутствие изменений гипоэхогенных слоев, представляющих собой собственную мышечную оболочку сигмовидной кишки.
(Правый) При цветовой допплерографии отмечается отсутствие сосудистой сети образования.
3. КТ при аппендажите:
• КТ с контрастным усилением:
о Овоидное образование одинаковой плотности с околоободочной жировой клетчаткой размерами о Оказывает местный эффект объемного образования на прилегающую стенку кишки
о Симптом центральной точки: центральный очаге повышенным коэффициентом ослабления, представляющий собой центральный застойный или тромбированный сосуд и/или зону центрально кровоизлияния
о Симптом пояска с высоким коэффициентом ослабления: окружающий овоидное образование ободок повышенной плотности шириною 2-3 мм, представляющий собой воспаленную висцеральную брюшину
о Воспалительные изменения окружающих тканей: исчерчен-ность жировой клетчатки, утолщение париетальной брюшины и легкое локальное утолщение прилегающей кишечной стенки
4. Рекомендации по визуализации:
• Оптимальный метод визуализации:
о При подозрении о диагнозе на основании клинической картины предпочтительным методом визуализации, особенно у детей, является прицельное ультразвуковое исследование высокого разрешения:
- В неотложной ситуации, когда диагноз на основании клинической картины установить не удается, часто выполняют КТ
о КТ выполняется при неясной УЗ-картине
о КТ способствует дифференцировке от других патологических состояний и диагностике осложнений
• Рекомендации по методике проведения исследования:
о Прицельное ультразвуковое исследование высокого разрешения в точке максимальной болезненности: следует искать несжимаемое бессосудистое гиперэхогенное овальное образование с гипоэхогенным ободком
о Стандартная КТ с контрастным усилением в портальную венозную фазу
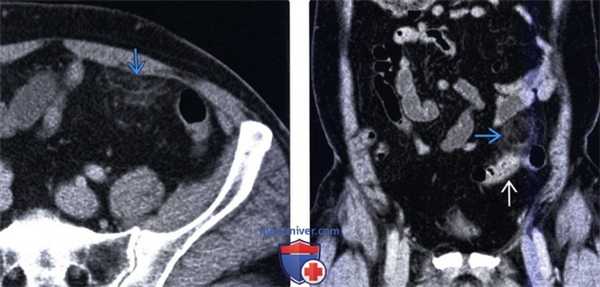
(Левый) У этого же пациента при КТ с контрастным усилением на аксиальной томограмме определяется типичная рентгенологическая картина аппендажита с исчерченностью окружающей жировой клетчатки. Обратите внимание на отсутствие изменений прилегающей сигмовидной кишки.
(Правый) При мульти планарной реконструкции в соответствующей корональной плоскости определяется воспаленный сальниковый при весок; видна его тесная связь с неизмененной прилегающей сигмовидной кишкой.
в) Дифференциальная диагностика аппендажита:
1. Сегментарный инфаркт сальника:
• Очаговый инфаркт большого сальника вследствие перекрута, травмы или окклюзии центральной вены
• Поражение локализуется в центре сальника, преимущественно в правом верхнем квадранте
• Более крупное очаговое образование (средний диаметр: 7 см)
• Отсутствие ободка с высоким коэффициентом ослабления
• Может наблюдаться симптом центральной точки
• Может встречаться и среди детей (15%)
2. Аппендицит:
• Выявление измененного несжимаемого воспаленного червеобразного отростка с утолщенной контрастной стенкой
• ± кальцинированный аппендиколит
• Перицекальное воспаление
• При допплерографии - признаки усиления кровотока
3. Дивертикулит:
• Может наблюдаться вторичное воспаление сальниковых привесков
• Большая протяженность утолщения стенки ободочной кишки
• Чаще формируется абсцесс
• Может вызывать толстокишечную непроходимость
• Большинство пациентов относятся к старшей возрастной группе (>50лет)
• Чаще наблюдается лейкоцитоз
4. Склерозирующий мезентерит:
• Деформация и утолщение корня брыжейки тонкой кишки
• Изменения не достигают стенки ободочной кишки
• Симптом жирового кольца: пересекающие брыжейку сосуды окружены кольцом сохранной жировой клетчатки
• Точечные кальцинаты (редко) и небольшие размеры (обычно
5. Первичные опухоли и метастазы в брыжейке ободочной кишки:
• Множественные нечетко отграниченные очаги:
о Обычно наблюдаются гипоэхогенные новообразования
• Сосредотачиваются на сальнике, могут фиксироваться к вентральной поверхности ободочной кишки
• В анамнезе имеются данные о первичной опухоли, при манифестации острые боли в животе отсутствуют
6. Воспалительные заболевания таза:
• Обычно развиваются у женщин детородного возраста
• Двусторонние тубоовариальные образования
• Может наблюдаться реактивное воспаление околотонкокишечной и околоободочной жировой клетчатки
• Обычно сопровождается системной симптоматикой
• Связаны с наличием внутриматочного контрацептивного средства
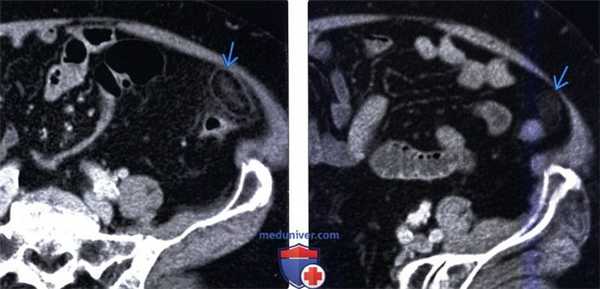
(Левый) У пациента с подозрением на дивертикулит при КТ с контрастным усилением определяется образование, содержащее жировую клетчатку, периферия образования характеризуется повышенным коэффициентом ослабления (симптом кольца), в центре визуализируется линейный участок повышенной плотности (эквивалент симптома центральной точки в проекции еп face). Обратите внимание на исчерченность окружающей жировой клетчатки.
(Правый) Этот же пациент. Контрольное КТ с контрастным усилением восемь месяцев спустя. Отмечается улучшение, но рентгенологические изменения все еще сохраняются. Этот случай иллюстрирует медленное разрешение рентгенологических изменений при аппендажите.
1. Общая характеристика:
• Этиология:
о Перекруг сальникового привеска по его длинной оси, вызывающий нарушение кровоснабжения и впоследствии венозный тромбоз
о Спонтанный тромбоз центральной вены, приводящий к некрозу (также возможен)
2. Макроскопические и хирургические особенности:
• Острый инфаркт с воспалением, некрозом жировой клетчатки, сосудистым тромбозом и кровоизлиянием в ткань
• Во время операции перекруг наблюдается редко
1. Проявления аппендажита:
• Наиболее частые симптомы/жалобы:
о Внезапное начало очень четко локализованной боли в животе, чаще всего в левом нижнем квадранте; боли обычно спонтанно разрешаются в течение 3-10 дней
о Пальпируемое объемное образование (10-30%)
о Установлены факторы риска: ожирение и чрезмерные физические нагрузки
• Другие жалобы/симптомы:
о Системные жалобы и симптомы слабо выражены или отсутствуют вовсе
• Результаты лабораторных исследований:
о Количество лейкоцитов остается нормальным или слегка повышается
2. Демография:
• Возраст:
о 4-е-5-е десятилетие жизни
• Пол:
о Преобладают мужчины (М:Ж = 4:1)
3. Эпидемиология:
о Точная заболеваемость не установлена, но она не превышает 1%
4. Течение и прогноз:
• Прогноз:
о Обычно процесс купируется самостоятельно, клиническое выздоровление наступает в течение 10 дней
о Изменения при КТ могут сохраняться дольше шести месяцев:
- В течение длительного времени может сохраняться кальцинированный подвижный «камень» в нижних карманах брюшины
• Редкие осложнения включают в себя:
о Формирование абсцесса
о Спайки
о Кишечная непроходимость
о Инвагинация
о Перитонит
5. Лечение аппендажита:
• Консервативное лечение включает в себя пероральный прием противовоспалительных средств
• Антибиотики обычно не показаны
е) Диагностическая памятка. Советы по интерпретации изображений:
• Несжимаемое бессосудистое гиперэхогенное овальное образование, прилегающее к ободочной кишке, в зоне максимальной болезненности
• Стенка ободочной кишки не изменена или отмечается ее легкое локальное асимметричное утолщение
• Периферический 2-3 мм гипоэхогенный/с повышенным коэффициентом ослабления поясок воспаленной висцеральной брюшины
• Центральный гипоэхогенный/со сниженным коэффициентом ослабления очаг (застойный или тромбированный центральный сосуд и/или зона центрального кровоизлияния)
Инфаркт сальника имитирущий аппендицит
По данным публикации в Международном журнале Хирургических случаев (International Journal of Surgery Case Reports) за апрель 2019 - Idiopathic segmental infarction of the omentum mimicking acute appendicitis: A case report / Идиопатический сегментарный инфаркт сальника, имитирующий острый аппендицит: клиническое наблюдение - внешняя ссылка
26-летний мужчина с жалобами на острую боль в правой подвздошной области, связанную с тошнотой и рвотой в течение 4 дней. При клиническом осмотре присутствовало напряжение в правой подвздошной области. Исследования крови были в пределах нормы. УЗИ показало наличие небольшого количества свободной жидкости в правой подвздошной области. Червеобразный отросток не был визуализирован. На контрастно-усиленной компьютерной томографии брюшной полости и малого таза отмечалось наличие свободной жидкости в правой подвздошной области с утолщением правой латероканальной фасции и скоплением сальникового жира. Просвет аппендикса был пустой, а верхушка аппендикса утолщенной. На основании этих результатов был поставлен клинический диагноз острого аппендицита, и пациенту была запланирована лапароскопическая аппендэктомия.
Инфаркт сальника редко встречается в клинической практике из-за его богатой васкуляризации. Однако, если это происходит, то он может быть как первичным, так и вторичным. В большинстве случаев он является вторичным по отношению к идентифицируемой причине, такой как сдавленная паховая или вентральная грыжа, сосудистый тромбоз, новообразования и воспалительные состояния. Первичный инфаркт сальника встречается редко, в литературе сообщается о 400 случаях. Ожирение является важным фактором риска развития сальникового инфаркта. Он может быть сегментарным или включать весь сальник. Правая сторона сальника является наиболее часто поражаемой частью сальника, как в настоящем случае. Вероятная причина преобладания правой стороны заключается в том, что сальник на правой стороне имеет большую длину и большую подвижность, по сравнению с левой стороной.
Традиционно первичный идиопатический инфаркт сальника подлежит хирургическому удалению. Но с увеличением числа случаев, диагностируемых по радиологическим изображениям, было установлено, что это самоограничивающееся заболевание, и в большинстве случаев его можно лечить медикаментозной терапией. Однако может быть реадмиссия(*т.е операция) при рецидивирующей или продолжающейся боли в 25% случаев. Кроме того, у некоторых пациентов на медикаментозной терапии может развиться сальниковый абсцесс, требующий хирургического вмешательства. Лапароскопическое иссечение является процедурой выбора в случае неудачи медикаментозного лечения и в тех случаях, когда предварительная операция выполняется из-за диагностической дилеммы, как это видно в данном случае.
Идиопатический сальниковый инфаркт является редкой причиной болей в животе у молодых людей. Он должен быть включен в дифференциальные диагнозы при лечении пациентов с острым животом.
*Также в публикации присутствуют снимки КТ и интраоперационный снимок.
*Желающие могут посмотреть, как инфаркт сальника выглядит на УЗИ - внешняя ссылка
Читайте также:
