Мезенхимальная гамартома печени. Врожденные билиарные кисты.
Добавил пользователь Дмитрий К. Обновлено: 27.01.2026
Пренатально обнаруженные образования в брюшной полости и тазу обычно имеют кистозную природу и обычно выявляются при УЗИ во втором триместре. Эти поражения обычно возникают из различных органов и структур брюшной полости и таза.
Пренатальная сонография высокочувствительна при обнаружении кистозных образований в брюшной полости, но ей не хватает специфичности, и поставить окончательный диагноз часто сложно. Постнатальная сонография часто позволяет определить этиологию кистозных поражений, иногда дополняя ее МРТ.
Сонография является предпочтительным методом в этих условиях, учитывая ее портативность, отсутствие ионизирующего излучения, низкую стоимость и высокое разрешение у маленьких пациентов.
Дифференциальный диагноз кистозных образований в брюшной полости и малом тазу у новорожденных широк и может быть сужен за счет подхода к поражениям в зависимости от их анатомической локализации: внутрибрюшинные, ворота печени/печеночные, почечные/забрюшинные, селезеночные или тазовые. Кроме того, отличительные сонографические признаки, если они присутствуют, помогают в постановке правильного диагноза. Точный диагноз имеет решающее значение, так как лечение этих кистозных поражений сильно различается.
Внутрибрюшинные кистозные образования
Кисты яичников
Кисты яичников являются наиболее распространенными новообразованиями брюшной полости у новорожденных девочек. Неонатальные кисты яичников имеют преимущественно фолликулярное происхождение, предположительно возникающее в результате нарушения фолликулогенеза.
Чрезмерная стимуляция яичников плода как плацентарными, так и материнскими гормонами считается ключевым фактором в развитии кист. Снижение гормональной стимуляции после рождения связано со спонтанной регрессией большинства мелких кист; однако кисты диаметром 5 см и более связаны с повышенным риском перекрута. Отмечается повышенная частота кист у детей от матерей с сахарным диабетом, токсемией или резус-иммунизацией, предположительно из-за гиперсекреции плацентарного хорионического гонадотропина человека (ХГЧ) или повышенной проницаемости плаценты для ХГЧ.
Неонатальные кисты яичников подразделяются на простые и осложненные; последний тип возникает на фоне перекрута и в основном развивается антенатально. Они чаще всего односторонние, обнаруживаются в любом месте брюшной полости у новорожденных, даже контралатерально, из-за длинной неонатальной ножки яичника. Более крупные кисты могут занимать почти всю брюшную полость.
При УЗИ простые кисты яичников однокамерные, круглые, анэхогенные, с тонкой стенкой, возможно, с одной перегородкой. Признак «дочерней кисты» (рис. 1, 2А), высокоспецифичный для кист яичников, обозначает небольшое округлое тонкостенное анэхогенное образование, примыкающее к стенке кисты яичника.
Перекрут яичника имеет различные сонографические проявления в зависимости от степени внутреннего кровоизлияния, отека стромы и инфаркта. Перекрут яичника неизменно содержит уровень жидкости, ретрагирующийся сгусток, перегородки или область, полностью заполненную эхогенными сигналами, создающими вид твердой массы (рис. 2B, C, 3). Эти сложные кисты часто имеют эхогенные стенки в результате дистрофического обызвествления, связанного с инфарктом. Отсутствие внутреннего кровотока при цветовой допплерографии позволяет отличить солидный перекрут яичника от редкого твердого внутрибрюшинного образования.
Рисунок 1 : Простая киста правого яичника у 5-недельной девочки.
Постнатальная трансабдоминальная сонография в градациях серого выявляет тонкостенную, однокамерную, анэхогенную кисту в правой части брюшной полости (стрелка), соответствующую простой кисте правого яичника. Вдоль нижнего края кисты видны два небольших круглых тонкостенных анэхогенных очага (указаны стрелками), которые представляют собой «дочерние кисты».
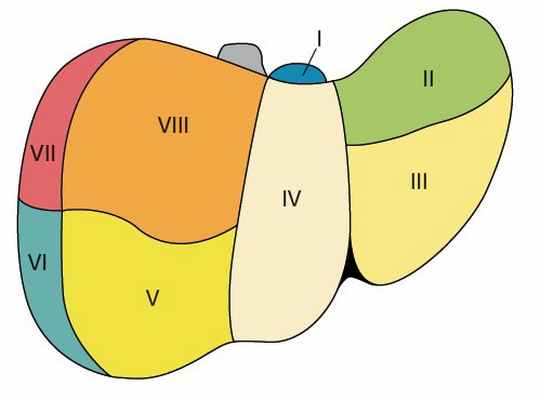
Рисунок 2 : Перекрут левого яичника у 6-недельной девочки.
А. Пренатальная сонограмма в оттенках серого на сроке беременности 33 недели показывает четко очерченную анэхогенную кисту в левой части живота (стрелка), содержащую дочернюю кисту (острие стрелки). B. Последующая пренатальная сонограмма в 36 недель гестационного возраста показывает наслоение эхогенного мусора на зависимой части кисты (стрелки), вероятно, связанное с кровотечением из-за перекрута яичника. C. Постнатальная продольная сонограмма показывает кисту (стрелка) со слоем жидкости и мусора (стрелки) и отсутствием кровотока (не показано).
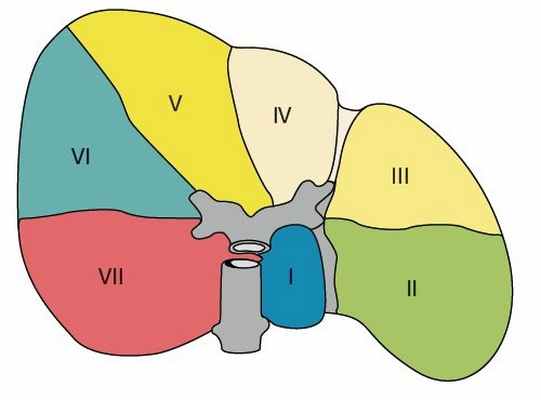
Рисунок 3 : Двухсторонний перекрут яичника у 2-недельной девочки.
А. Пренатальная сонограмма в градациях серого в третьем триместре показывает два четко очерченных очага смешанной эхогенности справа (стрелки) и слева (стрелки) в брюшной полости. B. Правостороннее поражение на постнатальной сонограмме имеет сетчатый вид, состоящий из толстых эхогенных перегородок, смешанных с небольшими кистозными пространствами (стрелки). Полумесяц жидкости виден в верхней части поражения (звездочка). C. Очаг поражения слева имеет вид твердого образования (стрелки) с ободком жидкости (звездочки).
Осложнения больших кист яичников включают разрыв, вызывающий геморрагический асцит, перитонит или кишечную непроходимость; сдавление грудной клетки, приводящее к легочной гипоплазии; обструкция мочевыводящих путей; и ущемление массы яичника в пределах паховой грыжи. Большинство небольших простых кист яичников рассасываются спонтанно. Простые кисты яичников диаметром более 5 см требуют тщательного наблюдения с помощью серии УЗИ. Перекрут яичника требует тщательной оценки и консультации хирурга; если требуется хирургическое вмешательство, целью должно быть сохранение ткани яичника. Консервативное лечение сложных кист яичников рекомендуется, если состояние новорожденного стабильно.
Кишечно-дупликативные кисты
Кишечно-дупликативные кисты представляют собой врожденные кисты неизвестной этиологии, возникающие в любом месте желудочно-кишечного тракта от рта до ануса. Эти кисты соприкасаются с сегментом кишки, имеют общий мышечный слой и артериальное кровоснабжение с соседней кишкой. В брюшной полости они чаще всего встречаются в илеоцекальной области, возникают на брыжеечном крае кишки.
Большинство дупликационных кист не сообщаются с просветом кишечника, за исключением тубулярного типа. В некоторых случаях может присутствовать эктопическая слизистая оболочка желудка, которая может проявляться внутриочаговым кровоизлиянием.
На УЗИ большинство кишечно-дупликативных кист имеют круглую форму, а тубулярный тип составляет 20%. Они анэхогенные с толстой четко очерченной стенкой. Они имеют характерный «кишечный признак» или признак «двойной стенки», который представляет собой внутренний гиперэхогенный слой слизистой оболочки и периферическую гипоэхогенную мышечную стенку (рис. 4).
Иногда с помощью высокочастотных датчиков можно визуализировать пять слоев кишечной сигнатуры. Редко признак двойной стенки можно увидеть при кистах яичников, дивертикулах Меккеля, лимфатических мальформациях (ЛМ) или кистозных тератомах. Сообщалось об отсутствии признака двойной стенки в дупликативных кистах, и считается, что это связано с кистозной инфекцией и эрозией слизистой оболочки.
Выявление признака «расщепленной стенки», который состоит из гипоэхогенной мышечной оболочки, разделенной в месте прикрепления между кистой и прилежащей кишкой, или перистальтики стенки кисты, повышает специфичность в постановке этого диагноза. Могут присутствовать перегородки, внутренние эхосигналы или мусор, связанные с белковым материалом, элементами крови или инфекцией. Удвоение кист может привести к инвагинации и сегментарному завороту; поэтому лечение – хирургическая резекция.
Рисунок 4 : Дупликационная киста у 2-недельного мальчика.
А. На пренатальной сонограмме в сроке гестации 38 недель выявляется четко очерченная круглая анэхогенная киста с правой стороны живота (стрелка) с толстой эхогенной стенкой (острие стрелки). B, C. Послеродовые поперечные (B) и продольные (C) сонограммы показывают круглое кистозное образование в правом квадранте (стрелки) с характерным « признаком кишечника», состоящим из внутреннего гиперэхогенного слоя слизистой оболочки (стрелки) и периферической гипоэхогенной мышечной стенки ( пунктирные стрелки). Печень частично визуализируется рядом с дупликативной кистой (звездочка).
Псевдокисты мекония
Мекониевые псевдокисты редко встречаются у новорожденных и часто сосуществуют с мекониевым перитонитом, который возникает на фоне внутриутробной перфорации кишечника. Пренатальная перфорация кишечника может быть вызвана атрезией кишечника, сегментарным заворотом кишечника, мекониевым илеусом или спонтанной перфорацией. Вытекание содержимого кишечника в брюшину вызывает сильное воспаление со спайками и может привести к развитию псевдокист, отражающих нормальный процесс заживления, ограничивающий интраабдоминальную перфорацию.
Рисунок 5 : Мекониальная псевдокиста у 2-дневного мальчика.
А. На пренатальной сонограмме в сроке гестации 22 недели выявляется округлое гетерогенное образование с толстой эхогенной кальцифицированной стенкой (стрелка), ассоциированное с умеренным асцитом (стрелки). B. Пренатальная последующая эхограмма в 32 недели гестационного возраста вновь демонстрирует сложное кистозное поражение с толстой кальцифицированной стенкой (стрелки) и акустической тенью. Визуализируются перитонеальные кальцинаты (стрелка), асцит разрешился. C. Постнатальная сонограмма выявляет правоквадрантную сложную кистозную массу с кальцифицированной стенкой (стрелки) с акустической тенью и перитонеальными кальцификациями (стрелки). D. Постнатальная рентгенограмма брюшной полости в положении лежа показывает округлое кальцифицированное образование в правом квадранте (стрелка) с сопутствующими очагами кальцификации брюшины (наконечник стрелки).
Лимфатические мальформации
ЛМ состоят из расширенных лимфатических каналов и пространств со стенками, выстланными зрелым эндотелием. Этиология неизвестна; гипотезы включают неспособность эмбриональных лимфатических пространств развивать нормальные соединения и дренаж в венозную систему, а также доброкачественную пролиферацию эктопических лимфатических сосудов, секвестрированных из венозной системы.
У ЛМ нет половых предпочтений. Голова и шея являются наиболее распространенными местами поражения, в то время как брюшная полость поражается реже, и эти пороки развития могут возникать из брыжейки тонкой кишки, сальника и забрюшинного пространства. Они могут протекать бессимптомно или проявляться кишечной непроходимостью, сегментарным заворотом, кровоизлиянием, разрывом, инфекцией и перекрутом очага поражения.
ЛМ состоят из кистозных структур различного размера. Макрокистозный тип обычно возникает в брюшной полости. При УЗИ макрокистозные поражения выглядят как тонкостенные, одно- или многокамерные анэхогенные поражения, часто с тонкими перегородками. Внутренние эхосигналы или уровни жидкости могут быть связаны с кровоизлиянием или инфекцией. При цветном допплеровском исследовании кровоток не определяется, хотя можно визуализировать васкуляризацию перегородки, поскольку она часто окружает соседние мезентериальные сосуды. Может присутствовать асцит, часто хилезный. Лечение может включать чрескожную склеротерапию, хирургическую резекцию или их комбинацию. Прогноз, как правило, хороший, с низкой частотой рецидивов.
Porta Hepatis и печеночные кистозные образования
Кисты холедоха
Кисты холедоха, представляющие собой веретенообразные или мешковидные расширения желчных протоков, относятся к наиболее частым врожденным гепатобилиарным аномалиям.
Система классификации Тодани используется для классификации этих аномалий на пять типов в зависимости от их этиологии, патогенеза, внешнего вида и проявления. Предполагается, что кисты холедоха I типа возникают из-за порока развития протоковой пластинки и обструкции дистального желчного протока и/или рефлюкса панкреатических ферментов в билиарное дерево из-за аномального панкреатобилиарного соединения.
Округлое или тубулярное кистозное образование в правом верхнем квадранте, отделенная от желчного пузыря, видна при кистах холедоха I, II и IV типов при УЗИ (рис. 6). Кисты III типа (холедохоцеле) могут вызывать эффект сдавливания в фатеровой ампуле.
Множественные внутрипеченочные кистозные дилатации наблюдаются при кистах типа IVA и типа V. Присутствует нормальный желчный пузырь, обычно примыкающий к расширенному общему протоку (рис. 6В). В расширенных протоках можно увидеть сладж или камни. Кисты холедоха можно отличить от кистозной атрезии желчных путей при сонографии на основании аномалий желчного пузыря, нерасширенных желчных протоков, кисты меньшего размера (20 мм или менее) и отсутствия сладжа или камней, которые являются характерными признаками атрезии желчных путей.
Рисунок 6 : Киста холедоха у 4-недельной девочки.
Пренатальная сонограмма в третьем триместре показывает четко очерченную простую кисту в средней части живота (указатели). B. Постнатальная сонограмма показывает анэхогенное кистозное поражение ворот печени (стрелка) с нормальным желчным пузырем (стрелка). C. На цветном доплеровском изображении внутренний кровоток отсутствует (стрелка).
МРТ с холангиопанкреатографией является методом выбора для определения типа кисты, длины пораженного протока, наличия и расположения белковых пробок или конкрементов, а также длины общего канала.
Осложнения могут включать конкременты, холангит, панкреатит или холангиокарциному. Хирургическое иссечение с гепатикоеюноанастомозом на выборной основе является окончательным лечением.
Кистозная билиарная атрезия
Кистозная атрезия желчевыводящих путей является редким вариантом атрезии желчевыводящих путей, проявляющимся кистозной структурой внутри облитерированного внепеченочного желчного протока. Билиарная атрезия — воспалительное фиброзно-облитерирующее заболевание, поражающее как внутрипеченочные, так и внепеченочные желчные протоки различной длины. Это частая причина неонатального холестаза и частое показание к трансплантации печени у детей.
На УЗИ кистозная билиарная атрезия представлена небольшой кистой (20 мм или меньше), расположенной в воротах печени (рис. 7A-D). Размер кисты имеет тенденцию оставаться стабильным, тогда как кисты холедоха могут увеличиваться в размерах. Аномалии желчного пузыря, такие как отсутствие желчного пузыря, маленький желчный пузырь (длина 4 мм эхогенной ткани впереди воротной вены) являются высокоспецифичными для диагностики кистозной атрезии желчных путей на УЗИ (рис. 7Д, Е).
Другими важными находками являются отсутствие общего желчного протока, нерасширенные желчные протоки, расширение печеночной артерии (>1,5 мм) и наличие печеночного субкапсулярного кровотока. Точность диагностики билиарной атрезии может быть улучшена до 98% при объединении результатов. Диагноз билиарной атрезии может быть подтвержден интраоперационной холангиограммой и биопсией печени.
Кистозную атрезию желчевыводящих путей необходимо дифференцировать от кисты холедоха, поскольку эти два состояния имеют совершенно разные подходы к лечению и прогнозы. Если не лечить, первый прогрессирует до терминальной стадии заболевания печени и смерти в течение первых 3 лет жизни. Лечение кистозной атрезии желчевыводящих путей – неотложная операция по методу Касаи.
Рисунок 7 : Кистозная атрезия желчевыводящих путей у 5-дневной девочки.
А. Пренатальная сонограмма в 25 недель гестационного возраста показывает четко очерченное анэхогенное поражение ворот печени (стрелка). B. При цветной допплерографии поток отсутствует (стрелка). C. Постнатальная сонограмма показывает круглую хорошо очерченную кисту в воротах (стрелка). D. При допплеровском исследовании васкуляризация отсутствует (указатель стрелки). E. Визуализируется полоса эхогенной ткани (стрелка) кпереди от правой воротной вены (острие стрелки), представляющая собой признак треугольного шнура. F. Стенка желчного пузыря неровная (стрелки).
Врожденные простые кисты печени
Врожденные простые кисты печени встречаются редко. Постулируется, что эти кисты возникают в результате аберрантного развития желчевыводящих путей внутриутробно с обструкцией, приводящей к скоплению жидкости, расширению протоков и потере связи с нормальными желчевыводящими путями. Они также могут возникать после закупорки перибилиарных желез вследствие врожденного порока развития или другого болезненного процесса.
Мезенхимальная гамартома
Мезенхимальная гамартома — одна из наиболее частых доброкачественных опухолей печени у детей. Она возникает в результате примитивной мезенхимальной пролиферации и несколько чаще поражает мальчиков, чем девочек.
Гистологически она состоит из неупорядоченной, примитивной, заполненной жидкостью мезенхимы, печеночной паренхимы и желчных протоков в дополнение к стромальным кистам переменного размера без капсулы. Уровни альфа-фетопротеина обычно в норме.
Мезенхимальные гамартомы обычно представляют собой мультикистозные гетерогенные массы с перегородками различной толщины, чаще всего возникающие в правой доле печени (рис. 9А-С). Они, как правило, одноочаговые и показывают небольшой кровоток при допплеровском исследовании. Когда кисты крошечные, поражение гиперэхогенно и имитирует солидное поражение. Кальцификаты и кровоизлияния встречаются редко.
Рисунок 9 : Мезенхимальная гамартома у 2-дневной девочки.
А. Пренатальная сонограмма в 33 недели гестационного возраста показывает дольчатое кистозное поражение с эхогенными перегородками переменного размера (стрелки). B. При допплеровском исследовании в перегородках виден слабый кровоток (стрелки). C. Постнатальная сонограмма выявляет многосептированное кистозное образование печени (стрелки). D. Постнатальная магнитно-резонансная томография показывает большое мультисептированное гиперинтенсивное кистозное образование в печени (стрелки). E. Аксиальное постконтрастное Т1-взвешенное изображение показывает гипоинтенсивное кистозное образование с умеренным периферическим и септальным усилением и без твердого усиливающего компонента (стрелки).
Мезенхимальная гамартома печени. Врожденные билиарные кисты.
Мезенхимальная гамартома печени. Врожденные билиарные кисты.
Мезенхимальная гамартома (гигантская кавернозная лимфангиома, фиброаденома желчных протоков) доброкачественное образование, представленное различными сочетаниями рыхлой соединительной ткани и эпителиальных элементов. Встречается преимущественно у детей в возрасте до 2 лет, чаще у мальчиков. В большинстве случаев локализуется в правой доле печени, тричем приблизительно в 1/3 наблюдений свисает в брюшную полость на ножке, прикрепляющейся к нижней поверхности печени.
Макроскопически обычно имеет вид солитарного, четко отграниченного от окружающей ткани печени узла диаметром 10-15 см. На разрезе видны кисты, располагающиеся среди отечной соединительной ткани и заполненные желеобразным содержимым или прозрачной желтоватой жидкостью.
Микроскопически мезенхимальная гамартома состоит из рыхлой соединительной ткани, различной степени зрелости, оплетающей в виде муфт хаотично расположенные кровеносные и лимфатические сосуды, желчные протоки, островки зрелых печеночных клеток с трабекулярным рисунком строения, кисты, выстланные кубическим, цилиндрическим или уплощенным эпителием. Часто встречаются островки гемопоэза и участки ангиоматоза. ультраструктурные исследования свидетельствуют о фибробластической природе клеток мезенхимального компонента и о высокой степени дифференцировки гепатоцитов и выстилающего протоки эпителия.
Дифференциальная диагностика мезенхиальной гамартомы печени обычно не вызывает трудностей и основана на сочетании хаотично расположенных сосудистых, протоковых и кистозных структур, окруженных муфтами рыхлой волокнистой или гиалинизированной соединительной ткани и островков зрелых гепатоцитов. Следует учитывать, что мезенхимальную гамартому может симулировать «эмбриональная саркома» печени, которую считают злокачественным аналогом мезенхимальной гамартомы. Она нередко имеет сходное кистозное строение, однако при микроскопическом исследовании характеризуется большей клеточностъю и выраженным полиморфизмом клеточных элементов мезенхимального компонента.
Билиарная гамартома (микрогамартома) крайне редко встречающееся доброкачественное образование, представленное скоплением желчных протоков, расположенных в фиброзной, иногда гиалинизированной строме. Часто носит мультинодулярный характер. Образование диаметром до 0,5 см нередко располагается вблизи капсулы печени. Протоки выстланы кубическим эпителием, могут быть кистозно-расширенными, содержать желчь. Описаны отдельные наблюдения сочетания билиарной гамартомы с холангиокарциномой.
Врожденные билиарные кисты (врожденные кисты, поликистоз печени) могут быть солитарными или множественными, причем последний тип может быть проявлением поликистоза, сочетающегося с поликистозом почек и других органов. Кисты обычно мелкие, но могут иметь крупные размеры, приводят к гепатомегалии. Просветы кист заполнены прозрачной жидкостью. При микроскопическом исследовании видны кисты, выстланные кубическим эпителием; можно обнаружить наличие внутри- и внеклеточной слизи.
В соединительной ткани вокруг кист иногда отмечают лимфоидную инфильтрацию. Описаны редкие наблюдения возникновения рака желчных протоков на фоне врожденных билиарных кист.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Кисты и опухоли печени
В большинстве своем доброкачественные опухоли — клинически малосимптомные или бессимптомные новообразования печени, исходящие либо из эпителиальной ткани (гепатоцеллюлярная аденома и др.), либо из стромальных и сосудистых элементов.
Классификация доброкачественных опухолей печени
К доброкачественным опухолям печени относятся гемангиомы, лимфангиомы, фибромы, липомы и смешанные опухоли — гамартомы (тератомы). Логично отнести к доброкачественным новообразованиям печени также и непаразитарные кисты. Среди них выделяют истинные кисты (дермоидные, ретенционные цистаденомы) и поликистоз печени (более чем у половины больных он сочетается с кистозными изменениями других органов- почек, поджелудочной железы, яичников). Нередко наблюдаются также ложные кисты (травматические, воспалительные). Истинные кисты, как правило, одиночные; ложные могут быть как одиночными, так и множественными. Объем множественных кист обычно составляет несколько миллилитров, в то время как объем солитарных (истинных и ложных) кист может достигать 1000 мл и более.
Диагностика доброкачественных образований печени
Общими являются два важных признака: 1) отсутствие повышения концентраций альфа-фетопротеина, карциноэмбрионального антигена СА — 199 сыворотки крови; 2) отсутствие отчетливого повышения активности аспарагиновой и аланиновой аминотрансфераз (АсАТ и АлАТ), щелочной фосфатазы (ЩФ), гамма- глутамилтрансферазы (ГГТФ) и лактатдегидрогеназы (ЛДГ).
Эти признаки надежны только в случаях отсутствия хронических или острых диффузных заболеваний печени, которые сами по себе могут вызывать изменения вышеприведенных тестов. Существенную помощь оказывает использование УЗИ и КТ (или ЯМР) с болюсным контрастированием, обладающие высокой разрешающей способностью.
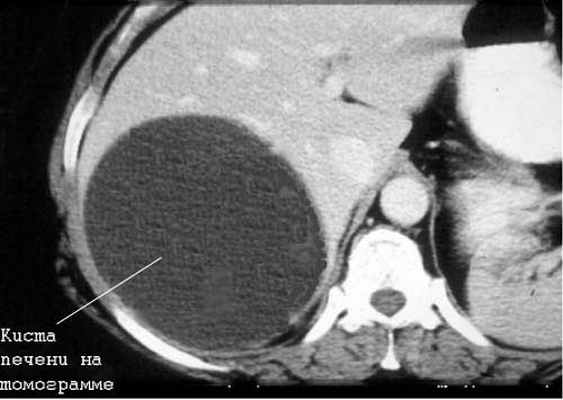
Киста печени
Чаще встречаются непаразитарные кисты. Учитывается возможность поликистозной болезни, а также солитарных и множественных истинных и ложных кист печени.
Большинство кист небольшие (диаметром 1-5 см), чаще встречаются у женщин. Значительная часть их имеет бессимптомное течение. У ряда больных отмечаются боли в правом подреберье, у одних — постоянные, у других — периодические. Существенную помощь оказывает использование УЗИ и КТ (или ЯМР), обладающие высокой разрешающей способностью. Необходимо учитывать возможность поликистоза печени.
Дифференциальная диагностика простых кист проводится также с паразитарными кистами печени (эхинококкоз). В пользу последних говорят положительные реакции с эхинококковым антигеном и Кацони, а также обнаружение в зоне опухолевидного образования обызвествлений, хотя и гемангиомы изредка могут обызвествляться.
Лечение кисты печени
Часть непарзитарных кист печени также подлежит оперативному лечению в связи с реальной возможностью их разрыва, инфицирования и кровоизлияния в просвет кисты. Кроме того, быстро растущие крупные кисты приводят к нарушению функций печени вследствие атрофии и замещения печеночной паренхимы кистозным образованием. Среди операций наиболее часто используют резекцию печени, перицистэктомию и вылущивание кисты.
В последние годы широкое распространение получили транспариетальные пункции кист под контролем УЗИ или КТ. После аспирации содержимого в просвет кисты вводят 96*раствор этилового спирта для склерозирования внутренней оболочки кисты. Эта операция эффектина приразмере кисты до 5 см. Если нет эффекта от данных способов лечения или киста имеет больший размер, показана операция — лапароскопическое иссечение участка кисты с последующей деэпителизацией внутренней оболочки кисты аргонусиленной плазмой или расфокусированным лучом лазера. Аналогичная тактика используется и при поликистозе печени. При осложненном поликистозе печени (нагноение, кровотечение, озлокачествление, сдавление крупными кистами желчных путей, воротной или полой вены) показано оперативное лечение. Обычно выполняют фенестрацию (вскрытие выступающих над поверхностью печени кист) с последующей деэпителизацией внутренней оболочки кисты.
Гепатоцеллюлярная аденома
Клинически это малосимптомная доброкачественная опухоль печени, имеющая признаки аденомы, развивающейся из гепатоцитов, нередко отграничена капсулой. Чаще поражает женщин, обычно в связи с длительным приемом эстрогенпрогестативных противозачаточных средств. Реже возникает при длительном приеме анаболических стероидов. Аденома развивается достаточно редко: у 3-4 человек на 100 000 длительно пользующихся контрацептивами.
Как правило (90%), она бывает одиночной. Обнаруживается чаще в правой доле, субкапсулярно. Если располагается в передненижних отделах, то пальпируется в виде гладкого неплотного образования. Более «агрессивным» течением отличаются аденомы, развившиеся на фоне приема анаболических стероидов. Изредка наблюдаются осложнения в виде интраперитонеальных кровотечений. Очень редко аденома перерождается в злокачественную опухоль.
Очаговая (фокальная) узелковая гиперплазия
Клинически это малосимптомная доброкачественная опухоль, не имеющая капсулы. Центральная часть опухоли предсталена рубцовой соединительной тканью, а периферическая — узелково трансформированной гепатоцеллюлярной тканью. Чаще расположена субкапсулярно. Нередко в опухоли наблюдаются очаги некроза и кровоизлияний. Как правило, развивается не в цирротически измененной печени, поэтому иногда именуется «фокальным циррозом». Обычно бывает одиночной. Это редкое доброкачественное новообразование печени, наблюдается преимущественно у женщин, принимающих пероральные противозачаточные средства.
Узелковая регенераторная гиперплазия
Эта опухоль напоминает очаговую узелковую гиперплазию печени, а иногда и сочетается с ней. В отличие от последней существенно меньше представлены элементы соединительной ткани. Может рассматриваться как предстадия гепатоцеллюлярной карциномы. Иногда при росте клеточных элементов этой опухоли происходит сдавление крупных желчных протоков или крупных ветвей воротной вены. Как правило, выявляется не в цирротически измененной печени. Иногда развивается на фоне злокачественных заболеваний внепеченочной локализации (миелопролиферативные процессы, саркомы и др.).
Все эти виды доброкачественных опухолей печени- малосимптомные заболевания, в большинстве случаев их обнаружение можно отнести к случайным находкам. Печень у большинства таких больных не увеличена.
Радионуклидная сцинтиграфия обычно выявляет очаговый процесс размером 3-5 см. Если опухоль расположена в краевых зонах печени, то могут выявлятся образования и меньших размеров.
Близкие к этим данным бывают получены при УЗИ и КТ, а также с помощью селективной ангиографии и ядерно-магнитного резонанса (ЯМР). Поэтому значительная часть опухолей небольших размеров просматривается. Уточнить характер этих трех видов опухолей позволяют лишь морфологические методы. Материал для этих исследований обычно получают при помощи пункционной биопсии иглами Шиба под контролем УЗИ или КТ.
Больные гепатоциллюлярной аденомой, очаговой (фокальной) узелковой гиперплазией и узелковой регенератоной гиперплазией печени в лекарственном лечении не нуждаются. Хирургическое лечение применяется нечасто. Показанием к нему являются либо сдавление желчных путей или кровеносных сосудов, либо появление болей. Операция проводится при развитии любого осложнения и быстром росте опухоли.
При впервые обнаруженной опухоли обследования проводятся 3-6-9-12 месяцев и далее 1 раз в год. Кроме обычного осмотра с определением размеров печени по Курлову, выполняются исследования содержания билирубина, активности аминотрансфераз, ЩФ, ГГТФ, альфа-фетопротеина, карциноэмбрионального антигена и антигена СА 19-9. Проводится также УЗИ печени.
Гемангиома
Клинически это малосимптомная доброкачественная опухоль, происходящая из сосудистых, главным образом венозных элементов печени. Она представлена двумя вариантами: кавернома, представляющая собой как бы расширенные кровеносные сосуды, и истинная гемангиома, развивающаяся из сосудистой эмбриональной ткани. Располагается чаще субкапсулярно, в правой доле, нередко обладает ножкой. Часто покрыта фиброзной капсулой, которая может кальцинироваться.
Спонтанные разрывы очень редки, но жизнеопасны. Четкие клинические проявления наблюдаются лишь в 5-10% опухолей. Как правило, в этих случаях диаметр опухоли превышает 5 см.
Во многих случаях обнаружение гемангиомы, как и других ДОП, относится к случайным находкам. При больших размерах и соответствующей локализации иногда появляются симптомы сдавления желчевыводящих путей или, реже, симптомы портальной гипертензии. Иногда больной обращается к врачу в связи с болями в верхней половине живота.
Важную информацию дают инструментальные исследования. Радионуклидная сцинтиграфия печени выполняется, как обычно, при подозрении на объемный процесс в печени в двух проекциях. Благодаря этому методу, как правило, можно обнаружить опухоль диаметром 4-5 см. При гемангиомах диаметром 4-5 см и более опухоль выявляется у 70-80% обследованных. УЗИ при наличии гемангиомы позволяет выявить гиперэхогенное, хорошо очерченное образование. Подобную же информацию представляет ЯМР. Нередко, особенно в менее массивной левой доле, отчетливо видна сосудистая ножка. Гемангиомы диаметром 3-5 см и более выявляются при УЗИ у 70-80% обследованных. Иногда отмечаются в гемангиомах участки обызвествления.
КТ позволяет получить данные, близкие к результатам УЗИ, хотя нередко приносит и существенную дополнительную диагностическую информацию. Эта дополнительная информация в первую очередь касается состояния окружающих ткаей и органов. Целиакография при распознавании гемангиом позволяет получить наиболее точные данные. Обычно хорошо видны гиперваскуляризованные участки с четкими границами, позволяющие обнаружить гемангиому диаметром 2-3 см и более у 80-85% обследованных.
Непрямая радионуклидная ангиография, выполняемая с помощью гамма-камеры, приносит близкие, но менее точные по сравнению с целиакографией, результаты. Существенную информацию приносит нередко ЯМР.
При постановке диагноза — гемангиома исключаются злокачественные опухоли печени. В последние годы объектом дифференциальной диагностики все чаще становится своеобразная очаговая жировая дистрофия печени, особенно в тех случаях, когда на фоне очаговой жировой дистрофии встречаются округлые участки интактной печени. Эти участки имеют разную с жировой дистрофией плотность, и эта разница достаточно четко регистрируется при УЗИ и КТ. Эти псевдоопухолевые образования обычно не видны при радионуклидной сцинтиграфии печени. Однако этот дифференциально-диагностический признак не очень надежен. Решающую роль в выявлении очаговых жировых дистрофий играет прицельная биопсия печени.
Лечение гемангиом печени. При гемангиомах небольших размеров без тенденции к росту в медикаментозном и хирургическом лечении пациенты, как правило, не нуждаются. При крупных опухолях, сдавливающих желчные ходы или сосуды, появляются показания к резекции соответствующих сегментов печени. Чаще это правило касается гемангиом диаметром более 5 см.
Лимфангиомы печени встречаются крайне редко, по клинической картине они трудноотличимы от гемангиом. Подозрение на лимфангиому возникает лишь при наличии внепеченочного расположения опухоли в средостении и на шее.
Крайне редко встречаются ф и б р о м ы, м и к с о м ы, л и п о м ы, н е в р и н о м ы печени, которым присущи черты доброкачественных опухолей: медленное развитие, четкие границы, нормальная СОЭ. Отсутствие маркеров опухолей и повышения активности таких ферментов сыворотки крови, как АсАТ, АлАТ, ЩФ, ГГТП, ЛДГ.
Лечебная тактика аналогична таковой при гемангиомах.
Методы вторичной профилактики и система наблюдения в основном такие же, как и при описанных выше доброкачественных опухолях
Гепатоцеллюлярная карцинома
Это злокачественная опухоль, развивающаяся из гепатоцитов. Относится к первичным карциномам печени. У 60-80% больных она связана с персистированием вирусов гепатита В и С, у 70-85% больных в развитых странах развивается на фоне цирроза печени.
В основном предложены морфологические классификации ГЦК. Наиболее распространено деление ГЦК на узловую, массивную и диффузную формы. Используется также система TNM.
Лечение гепатоцеллюлярной карциномы
Во всех случаях, когда это возможно, производится хирургическое лечение опухолей. Чаще резекция выполнима при опухолях левой доли. Отдаленные результаты хирургического лечения малоутешительны. В связи с этим контрольные обследования больных после резекций рекомендуется делать каждые 3 мес.
У сравнительно небольшой части больных осуществляется пересадка печени. Она выполняется у лиц моложе 60 лет, при отсутствии метастазов и тяжелых внепеченочных заболеваний. Отдаленные результаты неблагоприятные.
При невозможности хирургического лечения у части больных проводится химиотерапия.
Метастатическая карцинома печени (МКП)
Первичный очаг МКП расположен вне печени — в легком, желудке, толстой кишке и других органах. Относится к вторичным опухолям печени.
Частота метастазирования опухолей различной первичной локализации в печень различна.
Опухоли желчного пузыря метастазируют в печень в 75% случаев, поджелудочной железы — в 70%, толстой кишки, молочной железы, яичников, а также меланобластомы — в 50%, желудка и легких- в 40%. Однако сами первичные опухоли встречаются с различной частотой. Поэтому врач наблюдает наиболее часто метастазы в печени, исходящие из толстой кишки, желудка и легких, а у женщин — также из молочной железы и яичников.
Для подтверждения или исключения метастатического характера злокачественной опухоли печени проводится тщательное обследование ряда органов. При некоторых локализациях это имеет особенно важное значение.
В план обследования включают:
- исследование сыворотки крови (АПФ, карциноэмбриональный антиген, антиген СА — 199, кислая фосфотаза);
- рентгенографию грудной клетки;
- гастроскопию;
- колоноскопию или ректороманоскопию в сочетании с ирригоскопией;
- УЗИ поджелудочной железы, почек, яичников, предстательной железы;
- осмотр молочных желез и маммографию у женщин;
- консультация гинеколога и уролога.
Особое внимание уделяется возможности первичной локализации опухоли в толстой кишке, в предстательной железе (у мужчин) и в яичниках (у женщин), так как метастазы этих локализаций представляются у части больных относительно курабельными.
Государственная клиническая больница №29 им. Н.Э.Баумана – это современная многопрофильная высокотехнологичная больница с уникальной полуторавековой историей и традицией, оказывающая высококачественную медицинскую помощь в круглосуточном режиме.
Гигантская цистаденома печени. Описание клинического случая
Для цитирования: Оганезова И. А., Скворцова Т. Э. Гигантская цистаденома печени. Описание клинического случая // Доктор.Ру. 2018. № 7 (151). С. 14–17.
Цель статьи: актуализировать данные о редком заболевании — билиарной цистаденоме и описать клинический случай, отражающий течение гигантской цистаденомы печени.
Основные положения: билиарная цистаденома — образование печени с высоким потенциалом малигнизации. В работе представлены данные литературы об этиологии, патофизиологии, клинической картине, диагностике и возможностях лечения данной патологии. Приведено собственное наблюдение, отражающее стремительное неблагоприятное течение заболевания.
Заключение: типичными клиническими особенностями цистаденомы печени являются бессимптомное начало заболевания, быстрый рост образования с формированием признаков внутрипеченочного холестаза, озлокачествление опухоли.
Цистаденома печени (билиарная или гепатобилиарная цистаденома) — это доброкачественное образование, располагающееся во внутрипеченочных желчных протоках и представляющее собой истинную кисту. Размер образования может варьировать от 1,5 до 15 см в диаметре, а ее вес иногда может достигать 6 кг. Заболевание достаточно редкое — оно составляет не более 4–5% всех новообразований печени и желчных протоков. Наблюдается преимущественно у женщин (80–85% случаев), средний возраст пациентов к моменту диагностики равен 40–55 годам [1] .
Патофизиологически цистаденома печени представляет собой многокамерную кисту, окруженную гладкой плотной фиброзной капсулой. Образование содержит многочисленные внутренние перегородки и внутрипросветные папиллярные выступы, которые выстланы кубическим или цилиндрическим эпителием, секретирующим муцин. Этот эпителий иногда окружен плотной мезенхимальной стромой, содержащей гладкомышечные клетки. Свободный слой коллагенсодержащих кровеносных сосудов, нервов и желчных протоков дополнительно окружает область цистаденомы. Описаны два типа печеночных цистаденом: муцинозный и серозный. Муцинозная цистаденома является преобладающим типом (около 95% случаев), обнаруживается обычно во внутрипеченочной области (84%), реже в общем желчном протоке (6%), печеночных протоках (4%) и желчном пузыре (2%) [2, 3] .
Точная этиология цистаденомы печени неизвестна. Традиционно считается, что цистаденомы происходят из эпителия желчных протоков, возможно, из врожденного аберрантного желчного протока. Сходство эмбриональных структур, таких как желчный пузырь и желчные протоки, происходящие из каудального зачатка печеночного мешка первичной передней кишки, позволяет предположить, что цистаденомы могут возникать из эктопических остатков. Существует также возможность того, что цистаденомы возникают непосредственно из эмбриональных клеток первичной передней кишки или перибилиарных эндокринных клеток. Тот факт, что цистаденомы описаны уже в первом десятилетии жизни, поддерживает эти теории. Значимую роль могут играть факторы окружающей среды, поскольку большинство опухолей появляется во второй половине жизни. Учитывая заметное преобладание женщин, можно предположить роль гормонального воздействия [4, 5] .
Клиническая картина. В начальной стадии развития цистаденомы печени пациенты жалоб не предъявляют. Несколько позже возникают неспецифические жалобы, такие как дискомфорт в правом подреберье, тошнота, отрыжка воздухом, горький привкус во рту. По мере роста опухоли могут появляться симптомы, обусловленные увеличением размеров печени, формированием печеночной недостаточности, сдавлением соседних структур: боли в правом подреберье и эпигастрии, желтушность кожи и склер, увеличение живота, снижение аппетита, снижение массы тела. Клиническая картина острого живота является редким проявлением и может быть вызвана разрывом стенки кисты, внутренним кровотечением или перекрутом кисты [6] .
К основным осложнениям заболевания относятся кровотечение из стенки кисты в ее полость, нагноение кисты, разрыв кисты, механическая желтуха, формирование печеночной недостаточности, малигнизация опухоли, экзоорганная обструкция выходного отдела желудка, сдавление нижней полой вены, асцит. При длительном течении заболевания возможно злокачественное перерождение цистаденомы печени в цистаденокарциному (по некоторым данным, частота таких случаев составляет до 30%) с дальнейшим стремительным ростом и летальным исходом. Учитывая злокачественный потенциал цистаденомы, своевременная диагностика и радикальное хирургическое вмешательство — это предпочтительная тактика, что отличает цистаденому от ряда распространенных доброкачественных образований печени, таких как очаговая нодулярная гиперплазия, аденома и гемангиома, где возможно длительное динамическое наблюдение [7] .
Диагностика. Лабораторные тесты позволяют получить общее представление о функции печени, но выявляемые отклонения неспецифичны для цистаденомы. Признаки цитолиза, холестаза, нарушения белково-синтетической функции печени зависят от размеров, локализации и количества опухолевых узлов, а также от степени нарушения магистрального кровотока и оттока желчи. Цистаденомы часто выявляются случайно во время обычного осмотра или в процессе исследования такими методами, как УЗИ или КТ [8] .
При УЗИ цистаденомы печени визуализируются в виде анэхогенных образований с внутренними перегородками. Локальные гиперэхогенные включения в пределах опухоли могут быть участками фиброза стенки, внутрикистозными кровоизлияниями или папиллярными разрастаниями. На КТ-снимках опухоль проявляется в виде очагов жидкостной плотности с локальным накоплением контрастного препарата. Часто визуализируются перегородки и пристеночные узлы. Характерными признаками цистаденом печени, отличающими их от простых кист, являются васкуляризация перегородок внутри кисты, а также наличие папиллярных разрастаний стенок [9] .
При проведении МРТ цистаденома выявляется в виде гиперинтенсивных образований на Т2-взвешенных изображениях и гипоинтенсивных — на T1-взвешенных изображениях, иногда с периопухолевым понижением интенсивности сигнала на Т2-взвешенных изображениях.
Методы объективной визуализации (мультифазная контрастная КТ, динамическая контрастная МРТ) позволяют оценить сосудистый профиль объемного образования, выявить типичные для озлокачествления особенности васкуляризации: усиление в артериальную фазу и вымывание в портальную фазу. В отличие от окружающей неизмененной паренхимы печени, которая питается из системы портальной вены, злокачественные опухоли кровоснабжаются преимущественно из системы печеночной артерии, поэтому в типичных случаях они характеризуются диффузным, гетерогенным усилением в артериальную фазу (как при КТ, так и при МРТ) с последующим вымыванием контрастного препарата в венозную и отсроченные фазы, что считается классическим отображением онкопроцесса. Предварительные инструментальные методы визуализации должны сопровождаться биопсией печени, которая может помочь получить важную информацию о природе опухолевого поражения [10, 11] .
Лечение. Как правило, медикаментозное лечение цистаденомы не проводится. Исключение составляют подготовительный период перед оперативным вмешательством и ярко выраженная симптоматика. Благоприятный прогноз печеночных цистаденом обеспечивает только полная хирургическая резекция образования. Такие способы лечения, как марсупиализация, наложение внутренних или чреcкожных дренажей, пункционная алкоголизация, сопряжены с высокой частотой рецидивов заболевания. Операция должна выполняться по типу анатомической резекции, что продиктовано высокой частотой малигнизации цистаденом и развитием рецидивов при сохранении части эпителиальной выстилки кисты [12] .
Симптоматическая терапия при цистаденомах печени направлена на снижение проявлений внутрипеченочного холестаза, коррекцию портальной гипертензии и печеночно-клеточной недостаточности.
Наиболее эффективным средством для лечения холестатических заболеваний является урсодезоксихолевая кислота (УДХК). УДХК — конкурент токсичных желчных кислот при абсорбции в тонкой кишке, а также на мембране гепатоцитов и холангиоцитов. Считается, что положительное влияние УДХК на течение хронического холестаза прежде всего связано со снижением повреждения холангиоцитов токсичными желчными кислотами (за счет подавления их секреции и уменьшения пула путем снижения их всасывания в подвздошной кишке). Кроме того, УДХК стимулирует транспорт желчных кислот и органических анионов в гепатоцитах и холангиоцитах. Она влияет на ряд процессов, связанных с белками-транспортерами гепатоцита (их транскрипционную регуляцию; включение в апикальную мембрану; фосфорилирование и дефосфорилирование в местах действия), а также воздействует на процессы экзоцитоза (путем активации кальцийзависимой альфа-протеинкиназы) и на экспрессию транспортных систем в билиарном эпителии (бикарбонатный холерез). Собственно цитопротективное действие УДХК при холестазе определяется ее способностью, образуя двойные молекулы, взаимодействующие с липофильными мембранными структурами, встраиваться в клеточную мембрану и тем самым повышать устойчивость к токсическим воздействиям гепатоцитов, холангиоцитов и эпителиоцитов ЖКТ [13] .
Согласно рекомендациям Российской гастроэнтерологической ассоциации и Российского общества по изучению печени, добавление к УДХК S-аденозил-L-метионина (SAMe) снижает клиническую симптоматику и улучшает биохимические показатели у пациентов с внутрипеченочным холестазом [14] . SAMe представляет собой природное вещество, производное L-метионина и аденозинтрифосфорной кислоты, которое синтезируется в печени. Это вещество воздействует на основные звенья развития и прогрессирования внутрипеченочного холестаза. SAMe участвует в трех наиболее важных метаболических процессах: трансметилировании, транссульфурировании и аминопропилировании, — в которых выступает либо как донор метильной группы, либо как индуктор ферментов. Участие SAMe в процессах сульфатирования, в том числе желчных кислот и таурина, приводит к уменьшению пула токсичных свободных желчных кислот, что улучшает выведение последних из гепатоцитов и способствует их элиминации почками. Участие SAMe в синтезе структурных белков и фосфолипидов обеспечивает стабилизацию мембран клеток и митохондрий, благодаря чему улучшается функционирование транспортных систем. Имеются экспериментальные данные о том, что SAMe уменьшает апоптоз, индуцированный желчными кислотами, хотя и в меньшей степени, чем УДХК. Таким образом, применение лекарственных средств на основе SAMe можно считать, по сути, заместительной терапией дефицита SAMe, который наблюдается у пациентов с хроническими заболеваниями печени. Немаловажным преимуществом таких препаратов является доказанное наличие противоастенического и антидепрессивного эффектов [15] .
Для иллюстрации приведенного обзора продемонстрируем собственное клиническое наблюдение.
Пациентка Н., 60 лет, 20.05.2013 обратилась в Медико-санитарную часть ГУП «Водоканал Санкт-Петербурга» с жалобами на рези в животе, тяжесть в правом подреберье. При пальпации живота выявлена увеличенная в размерах за счет правой доли, болезненная, плотная печень, выступавшая из-под реберной дуги на 4–5 см.
В анализах крови: функциональные пробы печени, раково-эмбриональный антиген, альфа-фетопротеин — в пределах референсных значений; СОЭ увеличена до 47 мм/ч.
По данным УЗИ от 06.06.2013: печень увеличена, передне-задний косой размер правой доли — 189 мм; по передней поверхности правой доли печени в S4–5 лоцируется тканевое образование с неровными контурами, гетерогенной структуры, с зонами повышенной и пониженной эхогенности, размерами не менее 87 × 67 мм; желчный пузырь оттеснен описанным образованием кзади, не напряжен, стенки его уплотнены, контуры ровные, содержимое однородное, конкрементов не содержит.
На КТ органов брюшной полости от 21.06.2013 в S4–5 и умеренно в S6 определено образование с четкими неровными контурами, неоднородной структуры, которое распространялось за границы печени до передней брюшной стенки, оттесняя желудок, двенадцатиперстную кишку, желчный пузырь. Размеры образования — 115 × 75 × 124 мм. Плотность нативно +18–45 HU, в артериальную фазу плотность образования неоднородно повышалась до +115 HU, в венозную — до +100 HU, в отсроченную фазу она составляла +45–60 HU. В S2 определялся гиподенсный очаг (+50–55 HU), визуализировавшийся в венозную фазу, размером 9 мм.
Пациентка была направлена на консультацию в городской онкологический центр, где ей провели биопсию печени. Гистологическое заключение: гепатобилиарная цистаденома; по результатам иммуногистохимического исследования — аденома из желчного протока. При ангиографии сосудов печени в VIa–VII сегментах печени выявлено крупное патологическое конгломератное образование со смешанной васкуляризацией размерами 125,2 × 157,0 × 142,5 мм, расположенное кпереди от воротной вены.
Таким образом, пациентке был установлен диагноз цистаденомы печени. Учитывая локализацию и размеры образования, от хирургического лечения было решено воздержаться, рекомендовалось динамическое наблюдение.
13.01.2014 пациентка обратилась для контрольного обследования, активных жалоб на момент обращения не предъявляла. При биохимическом анализе крови обнаружены признаки внутрипеченочного холестаза: повышение уровня щелочной фосфатазы до 407 Ед/л, гамма-глутамилтранспептидазы — до 531 Ед/л. По данным УЗИ органов брюшной полости выявлен рост образования до 106 × 94 × 99 мм. На серии МРТ брюшной полости от 31.01.2014: печень увеличена в размерах за счет объемного образования неоднородной дольчатой структуры с неровным контуром размером 185 × 170 × 130 мм; образование муфтообразно охватывает желчевыводящие протоки без признаков инвазии и компрессии последних, оттесняет каудально правую почку. Кроме того, во II сегменте печени определялся аналогичный по сигнальным характеристикам очаг размером до 11 мм в диаметре.
Учитывая биохимические признаки внутрипеченочного холестаза, пациентке был рекомендован прием УДХК в дозировке 750 мг/сут.
В связи со значительным ростом образования больная была направлена для выполнения позитронно-эмиссионной томографии. По результатам обследования от 03.03.2014 выявлены признаки метаболически активного объемного образования в печени, злокачественная природа которого представлялась наиболее вероятной. 31.03.2014 была выполнена лапароскопия с биопсией опухоли печени. Гистологическое заключение: билиарная аденома без признаков малигнизации. 10.04.2014 были проведены верхняя мезентерикография, целиакография, селективная ангиография и химиоэмболизация. Заключение: ангиографическая картина может соответствовать первичной опухоли печени. Пациентке рекомендован прием тамоксифена.
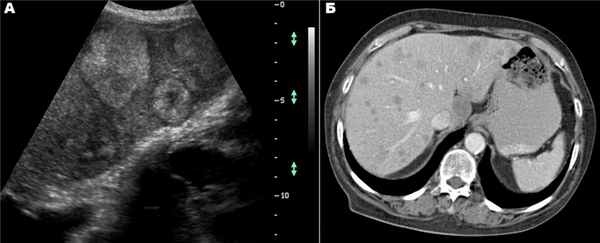
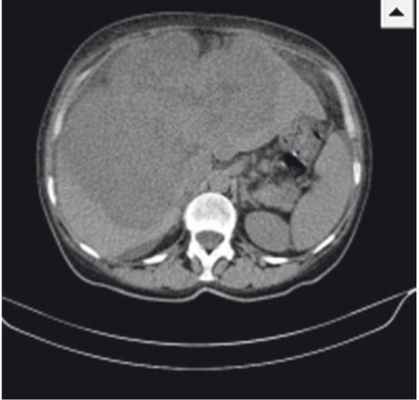
Результаты контрольной КТ от 12.05.2014: печень увеличена в размерах, деформирована, имеет крупнобугристый контур; паренхима обеих долей печени субтотально (около 70%) заменена объемным мультифокусным образованием размерами 208 × 127 × 185 мм (рост) с неровными бугристыми контурами и неоднородной гиподенсной плотности (рис.). При проведении ангиографии обнаружено, что образование активно, выраженно неравномерно, преимущественно по периферии, накапливает контрастное вещество до +130 HU с сохранением зон отсутствия контрастирования (некрозы).
Рис. Компьютерно-томографическая картина гигантской цистаденокарциномы печени. Фото авторов
При осмотре от 10.06.2014 отмечены жалобы на боли в правом подреберье, пожелтение кожи, склер, кожный зуд. Объективно: кожный покров желтушный, обычной влажности, склеры иктеричные; язык обложен желтоватым налетом, влажный; живот не вздут, мягкий, увеличен в размерах за счет гепатомегалии; печень значительно увеличена в размерах, безболезненная, плотная, выступает из-под реберной дуги на 8–10 см; стул периодически гипохоличный. В анализах крови — повышение уровня СА 19-9 до 897 Ед/мл. По данным УЗИ: вся брюшная полость, включая боковые фланки и позадиматочное пространство, заполнена свободной жидкостью с небольшим количеством мелкодисперсной взвеси — асцит; печень увеличена (краниокаудальный размер — 225 мм), деформирована, имеет крупнобугристый контур; паренхима обеих долей печени субтотально (свыше 70%) заменена объемным мультифокусным образованием с неровными бугристыми контурами размерами 218 × 151 × 193 мм; аналогичное по плотностным характеристикам образование визуализируется в S8 (20 × 22 × 22 мм), появилось новое аналогичное образование в S3 (12 × 12 мм).
Дополнительно к УДХК пациентке был рекомендован прием SAMe в дозировке 1200 мг/сут. Больная находилась под наблюдением еще в течение года, получала симптоматическую поддерживающую терапию. Летальный исход наступил на фоне тяжелой полиорганной недостаточности.
Приведенный клинический пример иллюстрирует типичные клинические особенности течения цистаденомы печени: бессимптомное начало заболевания, стремительный рост образования с формированием признаков внутрипеченочного холестаза, портальной гипертензии и гепатодепрессии, озлокачествление опухоли, неблагоприятный исход.
ЗАКЛЮЧЕНИЕ
Гепатобилиарная цистаденома составляет не более 4–5% всех новообразований печени и желчных протоков. Наблюдается преимущественно у женщин трудоспособного возраста и представляет собой многокамерную кисту, окруженную гладкой плотной фиброзной капсулой. Медико-социальная значимость данной патологии обусловливается ее длительным бессимптомным течением с последующим стремительным развитием осложнений, злокачественным перерождением и летальным исходом. Редкость гепатобилиарной цистаденомы в структуре новообразований, отсутствие специфичных для нее диагностических признаков и эффективных способов радикального лечения делают актуальным накопление данных о клинических особенностях заболевания.
Читайте также:
