Микробиологическая диагностика стрептококка. Диагностика стрептококковой инфекции. Выявление стрептококка. Выделение стрептококка.
Добавил пользователь Дмитрий К. Обновлено: 24.01.2026
При изучении антибиотикограмм сопутствующей микрофлоры стрептококковых инфекций выявлен антибиотик, обладающий бактерицидным действием на сопутствующую микрофлору, но не снижающий репродуктивную активность стрептококков. На основании проведенных исследований предложен способ получения изолированных колоний стрептококков, заключающийся в следующем: для выделения аэробных стрептококков проводят посев исследуемого материала на 5% кровяной МПА, а затем на поверхность питательной среды с посевом наносят диски с гентамицином в количестве 8–9 штук. Через 18–20 часов роста бактерий при температуре 37°С на поверхности плотной питательной среды вокруг дисков с гентамицином наблюдается рост изолированных колоний стрептококков. Для выделения стрептококков, обладающих анаэробными свойствами, предварительно делали посев исследуемого материала на печеночный бульон Китта-Тароцци, а затем через 18–20 часов проводили пересев на 5% кровяной МПА для получения изолированных колоний стрептококков. Предложенный способ позволяет повысить процент выделения стрептококков из исследуемого материала, сократить время проведения микробиологических исследований по выделению изолированных колоний стрептококков.
2. Клиническая лабораторная аналитика. Т. IV. Частные аналитические технологии в клинической лаборатории / под ред. В.В. Меньшикова. – М.: Медицинское информационное агентство, 2004. – 691 с.
3. Лабинская А.С.. Микробиология с техникой микробиологических исследований. – М.: Медицина, 1978. – 394 с.
4. Медицинская микробиология / под ред. В.И. Покровского, О.К. Поздеева. – М.: ГЭОТАР Медицина, 1999. – 1200 с.
6. Медицинская микробиология, вирусология и иммунология / под ред. А.А. Воробьева. – М.: Медицинское информационное агентство, 2004. – 691 с.
7. Национальная концепция профилактики инфекций, связанных с оказанием медицинской помощи. – М.: Минздрав России, 2011. – 22 с.
Стрептококковые инфекции продолжают оставаться в числе наиболее острых проблем здравоохранения во всех странах мира. Бактерии рода Streptococcus классифицируют по антигенным свойствам (на основании имеющихся полисахаридов), выделяя серогруппы, изучают биохимические и гемолитические свойства. Наиболее патогенным для человека является Streptococcus pyogenes группы А, вызывающий у человека гнойно-воспалительные и инфекционно-аллергические заболевания. Диагностика стрептококковых инфекций включает использование бактериоскопического метода, определение стрептококковых антигенов в патологическом материале с помощью ИФА или латекс-агглютинации, бактериологического метода идентификации возбудителей инфекции и серологического метода по определению антител к стрептококкам группы А. В последнее время широко распространен метод ПЦР, позволяющий установить диагноз заболевания в 3 раза чаще по сравнению с классическими бактериологическими методами исследований [1, 2, 4]. Эти данные свидетельствуют о необходимости совершенствования микробиологической диагностики стрептококковых инфекций. Стрептококки колонизируют кожные покровы, слизистые оболочки, носоглотку, желудочно-кишечный тракт и влагалище [5]. Для возбудителей инфекции характерна множественность механизмов и факторов передачи, но наиболее характерен воздушно-капельный механизм передачи. У школьников в холодный сезон года носительство стрептококков в носоглотке достигает 25% [6].
В большинстве случаев возникновение стрептококковых инфекций связано с оказанием медицинской помощи (ИСМП). Причинами роста заболеваемости гнойно-воспалительными стрептококковыми инфекциями являются селекция и формирование госпитальных штаммов, обладающих высокой вирулентностью и множественной лекарственной устойчивостью, что требует совершенствования систем надзора и контроля за ИСМП [7].
Описан общепринятый способ получения чистой культуры стрептококков [6], который имеет следующие недостатки: изолированные колонии можно получить только на 3-й день микробиологического исследования, в процессе культивирования бактерий не удаляется посторонняя сопутствующая микрофлора слизистых оболочек зева и миндалин, на 2-й день пересева материала на кровяной мясопептонный агар (МПА) не всегда удается определить микробы, подозрительные на стрептококк, и поэтому приходится делать пересев на кровяной МПА бактерий, не относящихся к стрептококкам, что требует большего расхода питательных сред для выделения изолированной колонии стрептококков. Известно также, что гемолитические свойства стрептококков не являются диагностическим тестом для выявления патогенных стрептококков. Патогенные стрептококки под влиянием антибиотиков и факторов внешней среды могут утратить гемолитическую активность, что существенно затрудняет выделение стрептококков из исследуемого материала.
Согласно Приказу Минздрава СССР от 22.04.1985 г. №535 «Об унификации микробиологических методов исследований, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений» изолированные колонии стрептококков получают по результатам посева исследуемого материала со слизистых оболочек носоглотки методом штриха с использованием тампона на чашки Петри с 5% кровяным МПА. Через 20 часов роста в условиях термостата при 37°С проводят учет выросших бактерий. Затем бактериологической петлей из разных точек питательной среды с ростом бактерий берут материал из колоний и делают пересев бактерий на сектора чашек Петри с 5% кровяным МПА методом штриха, а затем через 20 часов определяют наличие колоний стрептококка по культуральным свойствам. Основные недостатки предложенного способа: большой расход питательных сред, малая вероятность выделения стрептококков, что не позволяет установить роль стрептококков в возникновении внутрибольничной инфекции.
Итак, сложность лабораторной диагностики и эпидемиологические предпосылки циркуляции стрептококков в лечебно-профилактических учреждениях (ЛПУ) дают основания для совершенствования методов лабораторной диагностики стрептококковых инфекций.
Цель исследования - повышение эффективности выделения возбудителей стрептококковых инфекций из исследуемого материала при возникновении ИСМП.
Задача исследования. На основании изучения антибиотикограмм сопутствующей микрофлоры стрептококковым инфекциям выявить антибиотик, обладающий бактерицидным действием на сопутствующую микрофлору, но не влияющим на снижение репродуктивной активности стрептококков. Добавление данного антибиотика в питательную среду для роста стрептококков позволит разработать способ получения изолированных колоний стрептококков.
Материал и методы исследования
В период с 1997 по 2011 г. обследовано 5300 больных. В содержимом из зева выделена сопутствующая микрофлора стрептококковой инфекции. Для определения чувствительности выделенной сопутствующей микрофлоры к антибиотикам использовали диско-диффузионный метод. В опытах использовано 16-20 часовых культур бактерий. Концентрацию бактерий доводили по стандарту мутности до 0,5 ед. по McFarland на физиологическом растворе хлорида натрия (рН 7,2-7,4). Приготовленную взвесь вносили на чашки Петри с 5% кровяным МПА в количестве 0,2 мл и равномерно распределяли на поверхности питательной среды. Через 15 минут на поверхность питательной среды наносили диски с антибиотиками. Посевы инкубировали при 37°С в течение 24 часов с последующим определением задержки роста бактерий вокруг дисков с антибиотиками. Использовали следующие диски с антибиотиками: стрептомицин, эритромицин, гентамицин, амикацин, линкомицин, бензилпенициллин, олеандомицин, цефаклор, цефуроксим, цефатоксим, цефалексин.
Предложенный способ получения изолированных колоний стрептококков поясняется графическим материалом. На рисунке представлена схема получения изолированных колоний стрептококков.
Схема получения изолированных колоний стрептококков. Обозначения: 1 - сбор исследуемого материала от больного (слизь из зева и с миндалин), 2-5% кровяной МПА, 3 - среда Кита-Тароцци для выращивания бактерий с анаэробным типом дыхания, 4 - диски с гентамицином, 5 - выросшие изолированные колонии стрептококков на кровяном МПА, обладающих аэробными и анаэробными свойствами
Способ выделения изолированных колоний стрептококков апробирован на базе бактериологической лаборатории Тюменского филиала ФГУЗ «Центр гигиены и эпидемиологии по железнодорожному транспорту». Выделены госпитальные штаммы стрептококков серогруппы А (тип 8, 10, 13) и серогруппы С (тип 20, 21).
По материалам проведенных исследований оформлена заявка на изобретение №2012100122 от 10.01.2012 г. «Способ получения изолированных колоний стрептококков». В настоящее время заявка рассматривается на стадии экспертизы по существу.
Результаты исследований и их обсуждение
По сравнению с традиционными методами микробиологической диагностики стрептококковых инфекций предложенный способ позволяет уменьшить расход питательных сред, повысить процент выделения стрептококков из исследуемого материала, что позволяет своевременно и в более полном объеме проводить противоэпидемическое расследование и осуществлять мероприятия, направленные на предупреждение возникновения ИСМП стрептококковой этиологии.
Следует отметить, что сложность и низкая эффективность выделения стрептококков из исследуемого материала при диагностике инфекционных заболеваний связана с тем, что сопутствующая микрофлора по сравнению со стрептококками более устойчива во внешней среде, неприхотлива к питательным средам, как правило, обладает антагонистическими свойствами и поэтому при инфекционных заболеваниях выделенную микрофлору от больных часто выделяют и идентифицируют преимущественно из группы условно-патогенной сопутствующей микрофлоры. При обследовании ожоговых больных в популяциях сопутствующей микрофлоры наиболее часто определялся эпидермальный стафилококк.
Итак, стрептококки, в отличие от условно-патогенной микрофлоры и стафилококков, менее устойчивы во внешней среде, часто обладали анаэробными свойствами и медленнее размножались на питательных средах. Поэтому не всегда удается выделять чистую культуру стрептококков традиционными микробиологическими методами.
Предложенный способ позволил повысить процент выделения стрептококков из исследуемого материала, сократить время проведения микробиологических исследований по выделению изолированных колоний стрептококков, уменьшить количество ложноотрицательных результатов исследований и снизить расход питательных сред в процессе лабораторной диагностики стрептококковых инфекций. Сокращение сроков проведения лабораторных исследований позволяет в ранние сроки и в более полном объеме проводить противоэпидемические мероприятия при возникновении ИСМП, вызываемых стрептококками.
Шаповалов П.Я., д.м.н., профессор, зав. кафедрой гигиены с основами экологии ГБОУ ВПО «Тюменская государственная медицинская академия Минздравсоцразвития России», г. Тюмень;
Мефодьев В.В., д.м.н., профессор кафедры медико-профилактического дела ФПК и ППС ГБОУ ВПО «Тюменская государственная медицинская академия Минздравсоцразвития России», г. Тюмень.
Микробиологическая диагностика стрептококка. Диагностика стрептококковой инфекции. Выявление стрептококка. Выделение стрептококка.
Негемолитические стрептококки. Зеленящие стрептококки. Патогенез и клиника поражений зеленящими стрептококками. Микробиологическая диагностика негемолитических стрептококков. Выделение зеленящих стрептококков.
Негемолитические стрептококки представлены гетерогенной группой бактерий, дающих а-гемолиз (неполный). Они также лишены групповых Аг, но значительно отличаются от пневмококков. Поскольку большая их часть вызывает позеленение кровяных сред, они также известны как зеленящие стрептококки. Бактерии входят в состав микробных ценозов полости рта (составляют 30—60% всей микрофлоры) и кишечника человека.
Патогенез и клиника поражений зеленящими стрептококками
Негемолитические стрептококки отличает низкая вирулентность; вызываемые ими системные поражения можно в определённой степени рассматривать как оппортунистические .
Основную их часть составляют бактериальные эндокардиты, развивающиеся после проникновения негемолитических стрептококков в кровоток при травмировании слизистых оболочек (например, после чистки зубов, пережёвывании грубой пищи). Эндокардиты носят злокачественный характер и сопровождаются поражением сердечных клапанов. Способность вызывать эндокардиты обусловлена особенностями структуры гликанов (декстранов) клеточной стенки бактерий, облегчающих адгезию стрептококков к агрегатам тромбоцитов и фибрина на поврежденных клапанах. Для поражений характерны эмболии периферических сосудов: в ЦНС их отмечают в 30% случаев, в селезёнке — в 40% (данные аутопсий), в кожных покровах и глазах — в 20-40%.
Вторая по значимости, но несравненно более частая, патология — кариозное поражение зубов, вызываемое зеленящими стрептококками биогруппы mutans. Микроорганизмы содержат поверхностный белок, связывающий гликопротеины слюны, и (совместно с другими бактериями) образуют бактериальные бляшки на поверхности зубов. Бактерии разлагают сахарозу, поступающую с пищей, до молочной кислоты, вызывающей деминерализацию зубной эмали.
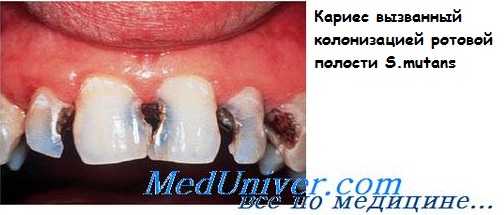
Микробиологическая диагностика зеленящих стрептококков
Микробиологическая диагностика негемолитических стрептококков аналогична мероприятиям, провидимым для выделения и идентификации прочих стрептококков. На наличие возбудителей указывает появление мелких (диаметром около 0,5 мм) колоний, окружённых зоной а-гемолиза. Дальнейшую дифферешш-ровку обычно проводят по отсутствию способности расти в жидких средах, содержащих 6,5% NaCl, и гидролизовать эскулин в присутствии солей жёлчных кислот (могут быть положительны у 10% изолятов); также дифференцирующим признаком считают отсутствие чувствительности к оптохину (последний не ингибирует рост бактерий). Дополнительным признаком служит высокая чувствительность большинства изолятов к пенициллину.
Лечение инфекций вызванных негемолитическими стрептококками
Лечение инфекций вызванных зеленящими стрептококками принципиально не отличается от проводимого при других стрептококковых инфекциях.
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Основу микробиологической диагностики стрептококковой инфекции составляют выделение и идентификация возбудителя. При этом обычно биохимические характеристики изолятов не изучают. Прочие методы диагностики стрептококковой инфекции имеют различные ограничения.
Через 24 ч на КА стрептококки группы А образуют блестящие вязкие колонии (рис. 2, см. цветную вклейку). В жидких средах бактерии дают придонный, иногда поднимающийся вверх рост. Весьма информативные методы раннего выявления стрептококков — определение чувствительности к антимикробным агентам методом дисков.
Наиболее часто их используют для идентификации стрептококков в мазках из зева. Для дифференцировки стрептококков группы А от прочих b-гемолитических стрептококков применяют тест чувствительности к бацитрацину. Более чем в 99% случаев изоляты стрептококков группы А чувствительны к бацитрацину, тогда как представители других серогрупп обычно устойчивы (рис. 12-8). Также можно применить тест чувствительности к триметоприм-сульфаметоксазолу.

Стрептококки групп А и В обычно чувствительны к действию антимикробного агента.
По сравнению с чувствительностью к бацитрацину более специфичен тест гидролиза пиррол идонил-b-нафтиламида (ПИР-тест). S. pyogenes — единственный стрептококк, дающий положительную реакцию. Для этого в пробирки вносят полоски фильтровальной бумаги, пропитанные ПИР. Под действием бактериальных пептидаз ПИР расщепляется до b-нафтиламида, и после внесения 0,01% раствора p-диметиламиноциннамальальдегида полоски окрашиваются в вишнёво-красный цвет.
Стрептококки группы А легко можно выявить в мазках из зева, используя коммерческие наборы; групповой А-Аг экстрагируют химическими реагентами или ферментами и идентифицируют в реакциях латекс-агглютинации, коагглютинации или ИФА. Для экспресс-диагностики ревматического процесса и гломерулонефрита можно определять AT к стрептолизину О или стрептодорназе; серологические исследования также позволяют выявить носителей. Следует помнить, что AT к стрептолизину О не образуются при кожных инфекциях, вызываемых стрептококками группы А.
Лечение стрептококковой инфекции
Основу лечения стрептококковой инфекции составляет адекватная антибактериальная химиотерапия. Лечение ревматизма проводят пенициллинами короткого действия, профилактику — пенициллинами длительного действия (бициллин-5), причём антибиотикопрофилактику предпочтительно проводить круглогодично.
Стрептококки группы А. Streptococcus pyogenes. Пиогенные стрептококки. Инфекции вызываемые стрептококками. Эпидемиология стрептококков. Патогенез поражений стрептококками.
У стрептококков группы А существуют некоторые особенности структуры клеточной стенки, отличающие их от других стрептококков (рис. 12~7). Большинство известных изолятов принадлежит к виду S. pyogenes, поэтому оба названия часто рассматривают как синонимы. Заболевания, вызываемые бактериями, известны с глубокой древности, но пика заболеваемости они достигли в XVIII—XIX веке. На этот период приходятся известные эпидемии скарлатины, фарингитов, нередко заканчивавшихся пневмониями, ревматизмом и гломерулонефритами. Постоянными спутниками войн были часто фатальные инфекции кожи и мягких тканей. Жертвами , послеродового сепсиса, печально известного как «родильная горячка», стали сотни тысяч матерей. Пионером борьбы с этим недугом стал австрийский акушер Земмельвайс, доказавший, что наиболее эффективная мера профилактики этого заболевания — соблюдение элементарных гигиенических норм.
Эпидемиология стрептококков
Стрептококки группы А обнаруживают повсеместно. Они часто колонизируют кожные покровы и слизистые оболочки человека, а в холодный сезон частота носительства в носоглотке у школьников может достигать 25%. Резервуаром служит больной человек или носитель; основные пути передачи — контактный (с заносом в рот грязными руками) и воздушно-капельный, а также через инфицированные пищевые продукты, хранящиеся при комнатной температуре (например, молоко).

Инфекции вызываемые стрептококками
Патогенез поражений стрептококками
Первый этап инфекционного процесса — адгезия микроорганизма к эпителию слизистых оболочек. Основные адгезины — липотейхоевые кислоты, покрывающие поверхностные фимбрии. Не менее важную роль в прикреплении к субстратам играют гиалуронидаза, стрептокиназа и стрептодорназа.
Белок М стрептококков [от англ. mucoid, слизистый, так как колонии штаммов-продуцентов имеют слизистую консистенцию] по структуре напоминает фимбрии грамотрицательных бактерий. Белок М— основной фактор вирулентности и типоспецифтеский Аг. AT к нему обеспечивают длительную невосприимчивость к повторному заражению, однако выделяют более 80 сероваров белка М, что значительно снижает эффективность гуморальных защитных реакций. Белок М ингиби-рует фагоцитарные реакции, непосредственно действуя на фагоциты либо маскируя рецепторы для компонентов комплемента и опсонинов, адсорбируя на своей поверхности фибриноген, фибрин и продукты его деградации. Белок также проявляет свойства суперантигена, вызывая поликлональную активацию лимфоцитов и образование AT с низким аффинитетом. Подобные свойства играют существекную роль в нарушении толерантности к тканевым изоантигенам и развитии аутоиммунной патологии.
Капсула стрептококков — второй по значимости фактор вирулентности. Она защищает бактерии от антимикробного потенциала фагоцитов и облегчает адгезию к эпителию. Капсула образована гиалуроновой кислотой, аналогичной входящей в состав соединительной ткани. Соответственно капсула проявляет минимальную иммуногенную активность и не распознаётся как чужеродный агент. Интерес представляет способность бактерий самостоятельно разрушать капсулу при инвазии в ткани за счёт синтеза гиалуронидазы. Роль гиалуронидазы в патогенезе поражений изучена плохо: с одной стороны, она участвует в разрушении соединительнотканной стро-мы, с другой — имеет сходство со многими аутоантигенами и, возможно, участвует в запуске аутоиммунных реакций.
С5а-пептидаза стрептококков — третий фактор патогенности, подавляющий активность фагоцитов. Фермент расщепляет и инактивирует С5а компонент комплемента, выступающий мощным хемо-аттрактантом.
Стрептолизин О стрептококков[от англ. oxygen sensitive, чувствительный к кислороду] проявляет свойства гемолизина, разрушая эритроциты в анаэробных условиях. Проявляет иммуногенные свойства, титры AT к нему имеют прогностическое значение. Стрептолизин S [от англ. stable, устойчивый] резистентен к кислороду, не несёт антигенной нагрузки и вызывает поверхностный гемолиз на кровяных средах. Оба фермента разрушают не только эритроциты, но и другие клетки; например, стрептолизин О вызывает повреждение кардиомиоцитов, а стрептолизин S — фагоцитов, поглотивших бактерии.
Эритрогенные (пирогенные) токсины стрептококков весьма схожи с токсинами стафилококков. Имму-нологически их разделяют на три типа (А, В и С); способность к образованию токсинов детерминирована заражением бактериальной клетки умеренным фагом, несущим ген токсинообразо-вания. Эритрогенные токсины проявляют свойства суперантигенов: оказывают митогенное действие на Т-клетки, а также стимулируют секрецию макрофагами ИЛ-1 и ФНО.
Кардиогепатический токсин стрептококков синтезируют некоторые штаммы стрептококков группы А. Он вызывает поражения миокарда и диафрагмы, а также образование гигантоклеточных гранулём в печени.
Прочие экзоферменты стрептококков. Стрептокиназа (фибринолизин) активирует плазминоген, что приводит к образованию плазмина и растворению фибриновых волокон (фермент не проявляет прямой фибринолитической активности). Гиалуронидаза облегчает перемещение бактерий по соединительной ткани. Роль ДНКазы (стрептодорназа) и НАДаз изучена плохо, но выявление AT к стрептодорназе В используют в диагностике различных осложнений, вызванных стрептококками группы А. Медицинское применение нашла очищенная смесь стрептокиназы, стрепто-дорназы и других протеолитических ферментов стрептококков (стрсптокиназа-стрептодорназа), используемая для рассасывания тромбов, фибринозных и гнойных экссудатов.
Стрептококковая инфекция: диагностика и лечение
У каждого инфекционного заболевания есть возбудители — патогенные или условно-патогенные микроорганизмы. Первые вторгаются в организм извне, вторые принадлежат к малочисленной части естественной микрофлоры и активизируются только при благоприятных для размножения условиях.
Этиологию инфекции определяют по ее принадлежности к группе — вирусам, бактериям, протозойным микроорганизмам, грибкам, глистам или простейшим паразитам. Среди большого количества бактерий к категории особо опасных относятся стрептококки. Они провоцируют тяжелые патологии — вплоть до токсического шока с высокой вероятностью летального исхода. Об особенностях стрептококковой инфекции, методах лечения и профилактики расскажем в статье.
Стрептококковые инфекции
Источник инфекции — зараженный ребенок или взрослый. Пути передачи стрептококка:
- аэрогенный — во время близкого общения с больным человеком, включая бессимптомное носительство инфекции;
- пищевой — через зараженную еду — молочные, кисломолочные продукты;
- контактно-бытовой — через предметы, обсемененные бактериями;
- интранатальный — если половая система женщины поражена стрептококковой инфекцией.
Из-за высокой контагиозности возбудителей существует риск эпидемии среди социально-организованных детей.
Классификация стрептококков
Streptococcus — грамположительные бактерии факультативно-аэробного вида. В мизерном количестве они обитают на коже, в ЖКТ, на слизистых рта и органов мочеполовой системы. Бактериальное семейство насчитывает 83 представителя. Причинно-значимыми являются:
- A-гемолитический Streptococcus — вызывает гнойные инфекции, воспалительные патологии сердца, пневмококковую пневмонию.
- B-гемолитический Streptococcus — включает пять групп опасных возбудителей (A, B,C, D, F, G). Самым активным считается Streptococcus pyogenes группы А, провоцирующий болезни ЛОР-органов, дыхательной системы, острые воспаления сердца, почек, тяжело излечимые поражения кожи.
Бактерии достаточно устойчивы к факторам окружающей среды. Они выдерживают температуру до 60℃, в течение четверти часа способны противостоять антисептикам, санитайзерам. В засохшей мокроте, гное сохраняют жизнеспособность в течение нескольких месяцев.
Факторы вирулентности
Стрептококкам свойственна высокая вирулентность — способность быстро захватить и погубить атакованный организм. Основными факторами служат умения микроорганизмов:
- оперативно колонизироваться и диссеминировать;
- обходить иммунную защиту;
- мгновенно связываться со специфическими рецепторами для вхождения в клетки организма.
Патогены вырабатывают вещества, разрушающие ткани, а также экзотоксины, которые провоцируют развитие цитокинового шторма. Это главная причина токсического шока и летального исхода. Проникая через слизистые ротоглотки или повреждения на коже, возбудитель образует бактериально-активный очаг, в который включается и условно-патогенная микрофлора. Стрептококки выделяют в кровь ядовитые вещества, вызывающие системный иммунный ответ — выброс цитокинов, гистамина, синтез иммуноглобулинов. При значительной бактериальной нагрузке, ослабленном иммунитете организм не может дать возбудителю достойный отпор. Течение болезни может быть крайне тяжелым, лечение — длительным, а риск постинфекционных осложнений — высоким.
Болезни, вызываемые стрептококками
Активный β-гемолитический Streptococcus группы А вызывает болезни с разной симптоматикой и течением. Клиническая картина стрептококковой инфекции зависит от локализации воспалительного очага, бактериальной нагрузки, преморбидного фона пациента. Из-за «живучести» достаточно сложно подобрать эффективное лекарство от инфекционного заболевания.
Стрептококковый фарингит
Воспаление локализуется на задней стенке глотки — в слизистой оболочке. Инкубационный период длится 2-3 дня, затем появляются острые симптомы — боль при проглатывании слюны, увеличение и болезненность шейных лимфоузлов, гипертермия. Примерно у 20% пациентов в инфекционный процесс вовлекается лимфаденоидная ткань миндалин, развивается фаринготонзиллит. Болезнь характеризуется высокой температурой, образованием серозно-гнойных пробок на слизистой миндалин, нестерпимой болью в горле. Осложнением может стать паратонзиллярный абсцесс.
Скарлатина
Острое воспаление ротоглотки часто диагностируется у детей дошкольного возраста. Скарлатина дебютирует высокой температурой, признаками интоксикации организма. Характерные симптомы — отекший ярко-малиновый язык, мелкоточечные папулезные высыпания, локализующиеся преимущественно на лице и верхней части тела. При легких формах болезни разрешено амбулаторное лечение. Маленьких детей госпитализируют из-за риска гнойно-воспалительных осложнений.
Инфекции кожи
У детей часто встречается стрептодермия, у взрослых — рожистое воспаление или стрептококковая флегмона. Первые признаки стрептодермии — кожные фликтены, наполненные серозной жидкостью. Они трансформируются в гнойные пузырьки, после которых на коже образуются плотные корочки. Дети часто расчесывают зудящие высыпания, перенося стрептококк на здоровые участки кожного покрова, из-за чего лечение усложняется. Ускорить выздоровление помогает принудительное вскрытие фликтен с последующей обработкой кожи Фукорцином, антибактериальными мазями.
Рожистое воспаление — поверхностное воспаление кожи, флегмона — глубокое воспалительное поражение, распространяющееся на подкожно-жировую клетчатку. Заболевания сопряжены с головной болью, лихорадкой, бессонницей, регионарным лимфаденитом.
Некротизирующий фасциит
Гнойное воспаление соединительной ткани, сопряженное с отмиранием клеток кожи и подкожно-жирового слоя на пораженном участке. Характеризуется высокой скоростью развития, тяжестью течения, частыми осложнениями, рисками летальности. Патогенез тесно связан с тромбозом сосудов, из-за которого возникает дефицит кислорода, поступающего к мягким тканям.
Синдром токсического шока (СТШ)
Большая часть случаев СТШ связна с применением суперабсорбирующих гигиенических тампонов во время месячных. Крайне тяжелое соматическое состояние вызывается гиперцитокинемией — перепроизводством цитокинов в ответ на поражение организма токсинами стрептококков. Это приводит к разрыву информационных связей между Т-лимфоцитами, в результате чего они атакуют клетки собственного организма. Резко увеличивается проницаемость сосудов, падает давление, межклеточное пространство заполняется плазмой, развивается полиорганная недостаточность. Страдают легкие, сердце, затем отказывают почки, печень.
Поздние осложнения
Механизм развития поздних осложнений не изучен. К основным патологиям относятся гломерулонефрит, сепсис, некротический миозит, ревматическая лихорадка.
Диагностика
Идентифицировать возбудителя активной формы болезни или выявить носительство инфекции можно с помощью лабораторных исследований биоматериала (соскоба с кожи, мазка из горла). Для диагностики применяют бактериологический посев. При обнаружении колоний стрептококка дополнительно выполняют антибиотикограмму — определение резистентности к разным видам антибиотиков.
Лечение
Препараты для этиотропной терапии детям и взрослым подбирают по результатам лабораторной диагностики. Многие бактерии гемолитического стрептококка проявляют чувствительность к антибиотикам пенициллиновой группы. При неэффективности лечения пенициллины заменяют макролидами — Сумамедом, Азитромицином, Кларитромицином. Для предотвращения дисбаланса микрофлоры параллельно назначают пробиотики и пребиотики. Дополнительно проводят лечение симптомов исходя из клинической картины заболевания. Из современных препаратов рекомендуется использовать Бактериофаг стрептококковый — раствор для орошений слизистых, аппликаций, клизм, спринцевания.
Читайте также:
- ВИЧ-миелопатия. Диагностика вич миелопатии. Лечение вич миелопатии.
- Проба с физической нагрузкой в кардиологии. Физиология физических нагрузок
- Операция при эндометриальной стромальной саркоме матки и ее прогноз
- Методы лучевого обследования почек и почечных лоханок
- Дооперационная диагностика рака желудка. Мультицентрический рак желудка
