Микрофлора полости рта. Микрофлора при кариесе зубов
Добавил пользователь Alex Обновлено: 20.01.2026
2. Байрамов Г.Р. Исследование пародонтопатогенной микрофлоры и ее этиологическая значимость в формировании разных клинических форм воспалительных заболеваний пародонта // Клиническая стоматология. – 2010. – № 2 (54). – С. 84-86.
3. Баяхметова А.А., Смагулова Е.Н., Мангытаева Б.Б., Баскакова И.В. Характеристика микрофлоры корневых каналов при хроническом периодонтите // НАУКА И МИР. – 2015. – Т. 9. - №4 (20). – С. 81-84.
4. Брофман И.Д., Созаева А.Ю., Жанимова Л.Р., Карданова К.Х., Алиев А.У. Изменение микрофлоры полости рта при пародонтите различной степени тяжести // Успехи современной науки. – 2016. – Т. 10. - № 11. – С. 39-42 .
7. Зорина О.А, Аймадинова Н.К., Борискина О.А., Басова А.А., Ребриков Д.В. Основные изменения нормальной микрофлоры пародонта при хроническом генерализованном пародонтите, выявленные с помощью метагеномного секвенирования// Российская стоматология. – 2017. – Т 10, № 2. – С. 41-48.
8. Когина Э.Н., Герасимова Л.П., Кабирова М.Ф., Усманова И.Н. Микробиологическое исследование содержимого корневых каналов при хроническом апикальном периодонтите // Современные проблемы науки и образования. – 2015. – № 5. – С. 328.
9. Колчанова Н.Э. Роль микрофлоры и ее способность формировать биопленку в патогенезе хронического периодонтита // Вестник витебского государственного медицинского унверситета. – 2017. – Т 16, № 5. – С. 127-135.
10. Крамарь В.О., Усатова Г.Н., Крамарь О.Г., Климова Т.Н. Пространственная структура и экологическая значимость микрофлоры полости рта и особенности ее изменений при кариесе // Фундаментальные исследования. – 2014. – № 2. – С. 85 - 89.
11. Кукушкин В.Л., Дутова А.А., Кукушкина Е.А., Смирницкая М.В. Микрофлора биопленки эндодонта при хроническом апикальном периодонтите // Актуальные проблемы и перспективы развития стоматологии в условиях Севера. – 2017. – С. 57-59.
12. Мозговая Л. А., Задорина И. И., Быкова Л. П. Микрофлора корневых каналов зубов в динамике лечения хронических форм апикального периодонтита // Саратовский научно-медицинский журнал. – 2013. – Т. 9, № 3. – С. 447-449.
13. Николаева Е. Н., Царев В. Н., ИпполитовЕ.В. Пародонтопатогенные бактерии — индикаторы риска возникновения и развития пародонтита// Стоматология для всех. – 2011. – №1. – С. 4-7.
15. Пашкова Г.С., Галиева Д.Т., Исаджанян К.Е., Никитин В.В., Попова В.М., Жиленков Е.Л. Особенности микрофлоры полости рта у пациентов с воспалительными заболеваниями пародонта // Лечение и профилактика. – 2013. – № 4 (8). - С. 74-80 .
16. Тамарова Э. Р., Баймиев А. Х., Швец К. Ю., Мавзютов А. Р. Молекулярно-генетическая характеристика видового состава микробиоты слюны и десневых карманов при пародонтите // Клиническая лабораторная диагностика. – 2015. - № 60(12). – С. 56–59.
17. Хашумов А. А. Микрофлора полости рта у больных кариесом // Молодой ученый. — 2018. — №32. — С. 26-28.
18. Царев В.Н., Ипполитов Е.В., Шулаков В.В., Никитин И.В. Первый опыт детекции молекулярных маркеров пародонтопатогенных видов 1 – го и 2 – го порядка при одонтогенных гнойно-воспалительных процессах челюстно-лицевой области с применением разных диагностических систем // Российская стоматология. – 2014. – № 7 (2) – С. 43-46.
В составе микрофлоры полости рта принято различать облигатные (резидентные) виды микроорганизмов, постоянно обитающие в полости рта и факультативные (непостоянные), которые обнаруживаются редко. Длительному пребыванию непостоянной микрофлоры препятствуют неспецифические факторы защиты ротовой полости и антагонизм с другими видами бактерий.
Также микрофлора полости рта делится на нормальную (не вызывает заболевания), условно-патогенную (способна вызывать заболевание при определенных условиях) и патогенную (всегда ведет к развитию заболевания).
Нормальная облигатная микрофлора полости рта включает аэробов, факультативных анаэробов и анаэробов. Аэробы и факультативные анаэробы представлены различными видами Streptococcus (100%) и Staphylococcus (80%), Neisseria (100%), Lactobacillus (90%), Diphtheroids (80%), Hemophilus (60%) и др. Среди анаэробов присутствуют Veillonella (100%), Peptostreptococcus (100%), Bacteroides (100%), Fusobacterium (75%), Actinomycetes и Diphtheroids (100%) и другие.
Факультативная нормофлора полости рта представлена такими аэробами и факультативными анаэробами как Klebsiella (15%), Escherichia (2%) и другими. Среди анаэробов не очень часто определяются Clostridium. Грибы рода Candida в норме отсутствуют или встречаются в небольших количествах [6].
Важно отметить, что среди нормофлоры присутствуют бактерии, снижение содержания которых тесно связано с развитием заболевания. К таким бактериям относятся Lactobacillus, Bifidobacterium и некоторые виды Streptococcus (Str. salivarius, Str. sanguis, Str. mitis) [10].
При заболеваниях состав микрофлоры патологического очага меняется как качественно, так и количественно, анализ этих данных может иметь большое значение при диагностике и лечении соответствующих заболеваний.
Различия в частоте выявления патогенов можно объяснить особенностями формирования групп, возможной (иногда запланированной) штаммоспецифичностью, а также разной чувствительностью используемых тест-систем [7].
При кариесе доминирующими остаются Streptococcus, однако их количество снижается (78%) и происходит изменение видового состава - снижается численность Str. Salivarius (45,4%), Str. Sanguis (38,2%), при этом доминирующими становятся Str. Mutans (18,2%), Str. Mitis (76,4%). Снижается содержание Lactobacillus sp. (63,6%) и Bifidumbacteriumsp. (67,3%), примечательно, что их количество уменьшается по мере прогрессирования кариозного процесса. Также из резидентной флоры отмечается увеличение колонизации Neisseria (16,4 %) и грибов рода Candida (21,8%). В полости рта у больных кариесом появляется транзиторная флора - Enterobacteriaceae (E. Coli (7,3%), Klebsiella (3,6%), Enterobacter (5,4%), Citrobacter (1,8%), Peptostreptococcus (21,8%). Таким образом, при кариесе регистрируется изменение в качественном и количественном составе микрофлоры полости рта [10, 17].
Согласно научным исследованиям, при хронических формах периодонтита в корневых каналах зубов спектр микробного пейзажа представлен достаточно широко. При этом доминируют патогенные стрептококки Str. tigurinus (91,7%), Str.vestibularis (45,8%), Str. bovis (37,5%), Str. milleri (33,3%) и Str. intermedius (16,7%), Str. mutans (9,7%), присутствуют и Str. sanguis (29%), Str. mitis (3,2%) [8].
Необходимо отметить, что известна взаимосвязь Str. tigurinus с инфекционными эндокардитами и менингитами, Str.milleri и Str.intermedius с абсцессами головного мозга и легких, Str. vestibularis и Str. bovis с бактериемией и абсцессами. Описан клинический случай спондилодисцита и инфекционного эндокардита, причинным микробным фактором которых являлся Str.vestibularis [3].
По данным других исследований в микробном пейзаже доминируют Streptococcus (50%), а также представители рода Staphylococcus (62,5%), анаэробные бактерии (58,3%), бактерии рода Lactobacillus (41,7%), Neisseria (16,7%), Enterococcus и Enterobacteriumпоровну (8,3%), грибы рода Candida (4,2% - 24,5%). Среди Staphylococcus в наибольшем количестве обнаружен S. epidermidis. Анаэробные бактерии в большинстве случаев представлены кокками рода Peptococcus (42,8%), Peptostreptococcus (21,4%), семейством Bacteroides (21,4%), бактериями рода Fusobacterium и Prevotella поровну (7,1%) [11, 12].
Кроме того, при хроническом периодонтите были выделены пародонтопатогены 1 порядка –Aggregatibacteractinomycetemcomitans (52,4%), Porphyromonasgingivalis (23,8%), Tannerellaforsythia (4,8%); 2 порядка –Fusobacteriumnucleatum (15,5%), Prevotellaintermedia (13,1%), Porphyromonasendodontalis (10,7%), Treponemadenticola (4,8%). Из ассоциаций чаще обнаруживаются комбинации анаэробов (70,5%), реже анаэробов со Streptococcus, Enterococcus, Staphylococcus (12,8%) [1].
В случае обострения хронического периодонтита пейзаж микрофлоры КК зубов претерпевает изменения. Лидирующее положение продолжают занимать Staphylococcus (55,5%). Значительно увеличивается роль Streptococcus (44,4%). Определяется увеличение количества Enterobacterium и Neisseria в равном количестве по 33,3%. Число анаэробных бактерий и представителей рода Lactobacillus снижается (22,2%). Грибы рода Candida чаще не обнаруживаются или составляют до 14,8% [11,12].
К пародонтопатогенам на сегодняшний день относят около 20 видов бактерий, относящихся по степени вирулентности к двум подгруппам. На Всемирном рабочем совещании клинических пародонтологов в 1996 г. в качестве специфических патогенных бактерий, обусловливающих заболевания пародонта, были названы три вида: A. actinomycetemcomitans, T. forsythus и Prevotella. Gingivalis. Это пародонтопатогены 1-го порядка, для которых выявлены строгие ассоциации с прогрессированием заболевания. Все эти бактерии являются грамотрицательными анаэробами, облигатными или факультативными. Все имеют выраженную тенденцию к внутриклеточному паразитированию в десневом эпителии и тканях пародонта. Наиболее агрессивным пародонтопатогеном является Porphyromonas gingivalis. К пародонтопатогенам 2-го порядка относятся бактерии, играющие второстепенную роль в развитии заболевания пародонта: Treponemadenticola, Prevotellaintermedia и другие. [13, 14].
Среди патогенной и условно-патогенной микрофлоры отмечается значительное увеличение распространенности Str. mutans (79,1%), Str. oralis (62,7%), Str. sobrinus (23% - 52,7%) [4, 16]. Candida albicans при разных степенях тяжести заболеваний пародонта - от 70,3 до 98,4% [2].
Достаточно высокая распространенность пародонтопатогенов 1-го порядка варьирует в пределах: P. gingivalis (35%,-50,5%), T. forsythensis (48,5%), A. actinomycetemcomitans (20,6%), 2-го порядка – F. nucleatum (40%), P. intermedia (32,9%), T. denticola (16% - 65,9%) [4, 9, 15, 18].
Выявлено, что с развитием заболевания наблюдается тенденция к увеличению распространенности пародонтопатогенов, однако многие исследователи отмечают данное увеличение не для всех видов [7, 9].
По данным ряда авторов, при пародонтите среди микрофлоры, связанной со здоровым пародонтом, уменьшается количество Veillonella в 4-5 раз. Обнаружено, что Treponema, Synergistaceae и Filifactor сильнее всего ассоциируются с пародонтитом, в то время как известные пародонтопатогены, такие как Porphyromonas и Tannerella, связаны с ним частично. Более того, колонизация пародонта родами P. intermedia и A. Actinomycetemcomitans оказалась никак не связана с воспалительными заболеваниями пародонта, хотя они часто считаются самыми опасными инфекционными возбудителями, напрямую ответственными за разрушение тканей пародонта. Возможно, объясняется это тем, что только определенные серотипы A. аctinomycetecomitans имеют пародонтопатогенность, в то время как другие серотипы этих видов, и особенно других видов рода Aggregatibacter, не связаны с хроническим пародонтитом [7].
Из недавно обнаруженных кандидатов в пародонтопатогены можно назвать представителей родов Campylobacter, Abiotrophia, Gemella, Capnocytophaga и Neisseria. Однако пока не ясно, насколько существенна их роль в развитии пародонтита [5].
Выводы: в нашей статье был проанализирован качественный и количественный состав микрофлоры при пародонтите, кариесе и периодонтите, были выявлены преобладающие виды патогенных микроорганизмов. В настоящее время в научных исследованиях большое внимание уделяется описанию микробиоценозов ротовой полости в норме и при патологии, имеющие большое значение при диагностике и лечении данных заболеваний. Необходимо подчеркнуть, что в существующей научной литературе либо описывается качественный состав сообществ, либо оценивается количество избранных патогенов по отношению друг к другу и к общей бактериальной массе, что ведет к накоплению информации лишь о наиболее значимой патогенной микрофлоре. В дальнейшем можно ожидать расширения списка патогенов благодаря совершенствованию методов диагностики. При количественных исследованиях микробиоценоза в рамках научного исследования необходимо учитывать большее разнообразие вероятных патогенов, чтобы выявить причинную микрофлору.
Микрофлора полости рта. Микрофлора при кариесе зубов
В полости рта человека постоянно обнаруживают типичных для этой области, сходных по культуральным и биохимическим свойствам микробов — стрептококков (73%), микокков (17%) и лактобактерйй (10%). Их количество в полости рта человека после рождения определяется множеством различных факторов, в первую очередь общим состоянием макроорганизма: у здоровых людей их меньше, чем у больных. В то же время микробов-антагонистов у здоровых лиц больше, что оказывает существенное влияние на общее количество микроорганизмов в ротовой полости [Демиховский И. Е., 1974].
Микрофлора полости рта в сочетании с местом ее обитания представляет собой весьма сложную экосистему, насчитывающую более 30 видов различных микроорганизмов — от спирохет и актиномицетов до кокков Барабаш Р. Д. и др., 1977]. Основным местом обитания микрофлоры является зубной налет, в котором содержится от 250 до 500 млн. микроорганизмов на 1 мг [Мизина И. К., 1980; Ritz H., 1967; Tacuciani J. E., 1974], составляющих до 70% массы этого образования, в то время как в 1 мл ротовой жидкости количество микробов у здоровых людей не превышает 5 млн. Особенно выражена микробная флора ротовой полости при отсутствии ее санации.
По данным С. М. Базарновой и П. И. Рощиной (1973), у лиц, имеющих кариозные зубы, а также страдающих хроническим рецидивирующим афтозным стоматитом, наблюдается наличие стрептостафилококковой флоры, которая в свою очередь может являться причиной бактериальной аллергии у данной группы стоматологических больных.
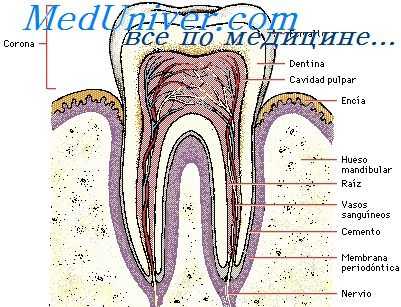
Значительная микробная обсемененность зубодесневых карманов стафилококками наблюдается при пародонтозе, что определяет их активное участие в развитии этого заболевания. На стадиях развившегося пародонтоза, особенно сопровождающихся абсцедированием, возрастают уровень и частота обсемененности патологических зубодесневых карманов и полости рта в целом разными видами стафилококков, что часто является причиной осложнений как местного, так и общего характера [Дяченко Ю. В. и др., 1981].
Г. А. Кожанова (1970) установила, что количество лактобактерий в полости рта при кариозных заболеваниях зубов достоверно уменьшается. Санация полости рта также снижает их содержание, однако в ряде случаев множественного кариеса оно остается высоким. С возрастом количество лактобактерий на поверхности зубов уменьшается.
Значение рН смешанной слюны у здоровых лиц с интактными зубами составляет 7,08±0,38, вязкость — 1,3 ед. по Оствальду, буферная емкость — 8,21±0,56 мэкв/л. При кариозных поражениях зубов, а также при наличии заболеваний желудочно-кишечного тракта эти показатели изменяются: рН и буферная емкость несколько уменьшаются, вязкость достоверно увеличивается. Биохимический состав ротовой жидкости и сыворотки крови практически идентичен, за исключением билирубина, который в ротовой жидкости отсутствует.
При кариозных поражениях зубов биохимический состав ротовой жидкости претерпевает существенные изменения [Кузьмина Э. М., 1980]. После санирования полости рта отмечается тенденция к уменьшению в смешанной слюне содержания общего кальция, неорганического фосфора, калия, хлоридов, активности щелочной фосфатазы, лактатдегидрогеназы, увеличению концентрации натрия. Б. А. Слимбаха (1980) отмечает снижение реминерализующей способности слюны и уровня физико-химического обмена при кариесе, приводящее к ухудшению механических свойств эмали и нарушению ее кристаллической решетки.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Стоматологическое
сообщество
Вашему вниманию предлагается публикация, посвященная важнейшей для стоматологии теме – этиологии кариеса зубов. В СССР и России эта тема всегда была сложной и часто рассматривалась односторонне, без учета мирового опыта. К сожалению, указанный подход касался даже учебников.
Ниже представлена статья, отражающая мировую точку зрения на кариес зубов как неспецифическое инфекционное заболевание. Сделаны попытки формулировок ряда понятий, связанных с кариесом зубов.
С уважением, академик
В.К. Леонтьев
ОБ ЭТИОЛОГИИ КАРИЕСА ЗУБОВ
Академик В.К. Леонтьев

Проблема этиологии кариеса зубов, одна из важнейших в стоматологии, в принципе признается в мире решенной и в основе ее признана микробная теория кариеса.
Однако в нашей стране до сих пор существует субъективное понимание этой проблемы. Речь идет о так называемой полиэтиологической теории кариеса зубов (А.И. Рыбаков), занимавшей значительное место в отечественных учебниках и программах по стоматологии.
Казалось бы, этот чисто теоретический вопрос не должен иметь большого практического значения, однако это не так. Дело в том, что инфекционная (микробная) этиология кариеса является всесторонне и многократно доказанной, подтвержденной тысячами экспериментов и опытом многих поколений специалистов. Особенно убедительным и серьезным подтверждением причинной роли микрофлоры при кариесе явились опыты Orlando (1954), доказавшие, что в безмикробной среде у стерильных животных, извлеченных из матки матерей и выращенных в безмикробной среде, ни при каких условиях, при любых диетах невозможно вызвать кариес. Микробная теория кариеса позволила вооружить стоматологов конкретными мерами борьбы с кариесом, многократно оправдавшими себя на практике во многих странах мира. Этому способствовал образ конкретного виновника кариеса зубов в лице микрофлоры полости рта, способной к существованию в жестких условиях, к усвоению и переработке рафинированных и других углеводов в полости рта. Вместе с тем так называемая «полиэтиологическая» теория кариеса не дает образа конкретного «врага» для борьбы, она размывает причину кариеса. Практически каждый патогенетический фактор - фтор, пища, макро- и микроэлементы, состояние организма, влияние внешней среды, зубной налет и т.д. признается этиологическим. Указанный подход объясняется тем, что в основе выдвижения полиэтиологической теории лежит полная путаница в понимании вопросов этиологии и патогенеза болезни (т.н. этиопатогенез), а также подмена одних понятий другими. Как в этом случае построить профилактику кариеса, как выделить ее основное звено, с чем или за что бороться для улучшения стоматологических аспектов здоровья пациентов? Полиэтиологическая теория кариеса давала на этот вопрос неопределенные, размытые, неконкретные рекомендации. Поэтому вопросы этиологии кариеса зубов имеют кроме важнейшего теоретического, не менее важное практическое значение, так как они вооружают практического стоматолога конкретным образом «противника» и, следовательно, мерами борьбы с ним.
Что же лежит в основе общепринятой в мире микробной теории кариеса? В принципе - это различные вариации химико-паразитарной теории Miller, выдвинутой им в 1905 году, и многократно уточненной и детализированной на протяжении последующего столетия.
Основные положения микробной этиологии кариеса и ее вариантов в современном понимании заключаются в следующем:
I. Этиологический фактор кариеса - микрофлора полости рта
При этом одним из основных виновников (но не единственным) возникновения кариеса называется Str.mutans. Ряд свойств этого микроорганизма - неприхотливость к питанию, высокая приспособленность к жизни в полости рта в условиях периодического приема пищи, изменения влажности, постоянного тока слюны, периодического и сравнительно кратковременного наличия пищи - позволило именно этому хорошо адаптированному к указанным условиям микроорганизму выполнять роль основного этиологического фактора кариеса зубов.
Практически реализация его кариесогенного влияния происходит путем колонизации им полости рта, осуществляемой в форме образования зубной бляшки, plague, (мягкого зубного налета), представляющей собой микробную колонию с различным составом микрофлоры. Такая форма существования микробов во рту целесообразна с позиций их жизнеобеспечения, так как в виде колоний легче обеспечивается процесс размножения микрофлоры, защита ее от вредных воздействий, осуществляется аккумуляция и депонирование пищи.
При приеме пищи, особенно легкоусвояемых рафинированных углеводов, происходит 2 процесса - быстрый их метаболизм путем гликолиза с образованием органических кислот, преимущественно молочной, и более медленный - образование полимеров глюкозы-декстрана и др. соединений, которые представляют собой депо углеводов (типа гликогена), запасаемых микрофлорой впрок для обеспечения периода своей жизнедеятельности между приемами пищи человеком-хозяином паразитирующей и сапрофитной микрофлоры. Для депонирования пищи используется созданная микрофлорой специализированная, генетически не обусловленная человеком приобретенная структура - зубная бляшка, способная в условиях полости рта существовать автономно. Она имеет свою структуру, обеспечивающую механизм прочной фиксации на поверхности зуба с помощью различных соединений типа гликогенов. Внутри бляшка имеет сетчатую структуру, наполненную микрофлорой и депонированными углеводами типа декстрана и левана. От полости рта она ограничена оболочкой, состоящей из глико- и полисахаридов, которые не поддаются разрушению амилазой слюны. Таким образом, бляшка зубного налета, прекрасно адаптирована к условиям существования в полости рта, является важнейшим причинным элементом в возникновении кариеса зубов. Каким же образом?
При приеме углеводной пищи происходит ее быстрое усвоение и метаболизм, преимущественно, путем гликолиза с образованием органических кислот, молочной, пировиноградной и др., путем своеобразного «метаболического взрыва», когда кислотопродукция в течение 5-15 минут возрастает в десятки и сотни раз. При этом некоторая часть кислот проникает из бляшки в слюну, а значительная часть их остается в бляшке, диффундируя из нее в поверхность эмали и вызывая ее растворение. Кислота, растворяя эмаль, постепенно приводит вначале к образованию деминерализованного пятна, а далее - к возникновению кариозной полости. После приема углеводов часть микрофлоры размножается, часть гибнет, но Str. mutans вне приема пищи прекрасно выживает, так как он обладает способностью приобретать в тяжелых условиях жизнедеятельности толстую оболочку, предохраняющую его от неблагоприятных воздействий. Жизнедеятельность микрофлоры бляшки также успешно поддерживается за счет метаболизма запасенных впрок полисахаридов, которые метаболизируются между приемами пищи, что обеспечивает существование микрофлоры и продуцирование ею кислот на поверхности эмали. Большое значение для выживания и жизнедеятельности микрофлоры имеют также остатки пищи, задерживающиеся во рту после каждого ее приема, так как они продлевают хорошие условия для жизнедеятельности микрофлоры. Таким образом, именно человек со своим ритмом жизни, нравами и привычками (периодическим приемом пищи, накоплением ее остатков во рту) создал неплохие условия для обеспечения жизни микрофлоры в полости рта. Поэтому основными этиологическими и этиотропнообоснованными методами борьбы с кариесом зубов должно стать устранение патогенной по отношению к кариесу микрофлоры из полости рта, снижение ее количества, кариесогенности, в основном, путем устранения зубной бляшки и остатков пищи.
II. Патогенетические факторы кариеса зубов
1. Резистентность зубов. Она обусловлена большим количеством факторов - от молекулярного уровня до популяционного, включая в себя генетическую предрасположенность к кариесу.
На молекулярном уровне резистентность зубов к кислотным воздействиям зависит от типа гидроксиапатита эмали, от наличия включений в составе гидроксиапатита - F, Mg, Co, Mn и др., от наличия вакансий в структуре кристаллов, неблагоприятных и благоприятных замещений в них, от правильности формирования и закладки белковой матрицы эмали, от степени ее минерализации, от взаимодействия белковой и минеральной фаз эмали. От всех этих факторов, а также от ряда других, в значительной мере, зависит как способность эмали к деминерализации (растворимость), так и обратный процесс - ее способность к восстановлению - реминерализации. Резистентность зубов к кариесу увеличивается с возрастанием количества ионов кальция в молекулах гидроксиапатита, снижения вакансий в его структере, от возрастания в молекулах гидроксиапатита гетероморфных замещений фтора.
На уровне ткани (субстанции) эмали зубов резистентность к действию кислотных факторов зависит от регулярности структуры эмали, от наличия и числа дефектов в ней, от формирования эмалевых волокон и их пучков, особенно при их выходе на поверхность эмали, от мозаичности заряда ткани, препятствующего или способствующего абсорбции микрофлоры на ее поверхности и др.
На уровне зуба как органа резистентность к кариесу зависит от строения поверхности эмали, формирования на ней пелликулы, ее взаимодействия с поверхностью зуба, от глубины и формы фиссур зубов.
На системном уровне (зубочелюстная система) резистентность к кариесу зубов зависит от типа строения черепа, лицевого скелета, челюстей, прикуса, от тесноты расположения зубов, величины межзубных промежутков и др.
На организменном уровне резистентность к кариесу зубов зависит от функционирования слюнных желез, от степени перенасыщенности слюны солями кальция и фосфата, ее рН, объема, вязкости, степени омывания и очищения с помощью слюны поверхности зубов, от концентрации и силы воздействия иммунологических и противомикробных факторов в ней, ряда психологических факторов - жевательной лености, пищевых особенностей и традиции диеты, состояния общего здоровья.
На групповом и популяционном уровне резистентность зубов к кариесу зависит от процесса проявления редукции зубочелюстной системы человека, от неблагоприятных воздействий отдельных факторов цивилизации (диета, приготовление пищи, внедрение углеводов и т.д.), гигиены полости рта и др.
Ряд из перечисленных выше факторов создают генетическую расположенность к кариесу зубов - степень выраженности редукции зубочелюстной системы, строение челюстей, зубов, прикуса, состав и строение их тканей.
2. Питание. Одним их важнейших и четко доказанных факторов патогенеза кариеса зубов является прием легкоусвояемых рафинированных углеводов, особенно сахара. Основная кариесогенная роль этого продукта (единственного из всего рациона современного человека) заключается в их способности метаболизироваться микрофлорой в полости рта, где для этого имеются все условия, созданные нравами и привычками человека, с интенсивным выделением органических кислот, как одного из главных конечных продуктов обмена углеводов. Кариесогенность углеводов связана с кислотопродукцией - результата их метаболизма, и образованием зубной бляшки как субстрата, успешно реализующего кариесогенное воздействие углеводов. Устранение из рациона углеводов или удаление зубной бляшки с поверхности зубов неизменно ведет к снижению либо устранению поражаемости кариесом как в условиях эксперимента, так и в жизни. Единственной причиной такого эффекта является исчезновение субстрата для кислото-продукции – глюкозы, сахара, крахмала и др.
Определенное значение имеют и другие факторы питания - белки, микроэлементы, минеральные вещества и др., но роль их в патогенезе кариеса зубов несравнима с таковой углеводов.
3. Слюна. Неоспоримая роль слюны в патогенезе кариеса зубов определяется двумя группами факторов:
- участием в процессах минерализации и очищения поверхности зубов и полости рта в целом, благодаря своим омывающим, иммунологическим, антимикробным и минерализующим свойствам;
- усилением процессов деминерализации в полости рта при функциональной недостаточности желез, нарушении вязкости, структурных свойств и состава слюны, ее минерализующего потенциала, что может быть обусловлено как состоянием организма в целом, так и условиями полости рта, свойствами слюнных желез.
Упрощенно все патогенетические факторы кариеса зубов можно разделить на воздействующие на процессы минерализации в полости рта или способствующие процессам деминерализации в ней, а прием углеводов рассматривать как разрешающий фактор в патогенезе кариеса.
Для возникновения кариеса зубов необходим этиологический фактор - кариесогенная микрофлора полости рта. Без нее ни при каких условиях кариес зубов возникнуть не может. При наличии кариесогенной микрофлоры развитие кариеса зубов может произойти лишь при наличии определенных условий и факторов (звенья патогенеза). Для этого должен быть обеспечен постоянный прием легкометаболизируемых углеводов и должна сформироваться зубная бляшка. Но и при этом условии кариес зубов образуется не обязательно - для этого в результате постоянной кислотопродукции должен произойти сдвиг равновесия процессов минерализации в полости рта в сторону деминерализации. В случае наличия такого сдвига возникновению кариеса зубов могут неопределенно долго противостоять резистентные к кариесу зубы и в этом случае кариес может возникнуть лишь в случае низкого уровня резистентности зубов.
Таким образом, при всей бесспорности этиологического фактора возникновения кариеса зубов - кариесогенной микрофлоры, патогенез кариеса и его основные звенья могут быть интерпретированы по-разному. Мы считаем основным звеном патогенеза кариеса зубов результативное нарушение динамического равновесия процессов де- и реминерализации в полости рта, которое может возникнуть из-за воздействия разрешающего фактора - приема углеводов, при преодолении кислотным фактором резистентности зубов, уровень которого строго индивидуален и зависит от многих экзо- и эндогенных факторов.
В свете изложенных фактов, в связи с четкой доказанностью и общепризнанностью микробной этиологии кариеса зубов, предлагается сохранить преподавание студентам «полиэтиологической теории» кариеса лишь как представляющую определенный исторический интерес. В этой связи все методы профилактики кариеса зубов, связанные с противодействием микробному фактору, целесообразно отнести к этиологическим (или этиотропным) методам профилактики, а воздействующие на звенья патогенеза кариеса - углеводные, слюнные, повышающие резистентность зубов и организма - к патогенетическим методам профилактики.
Таким образом, казалось бы, теоретический вопрос об этиологии и патогенезе кариеса зубов приобретает совершенно конкретную направленность через профилактику кариеса к самому широкому ее практическому воплощению. Поэтому четкое представление о современном понимании этиологии и патогенеза кариеса зубов необходимы каждому стоматологу как в его профилактической работе, так и для верной ориентировке во всей своей врачебной деятельности.
В плане представленных выше материалов об этиологии кариеса зубов хотелось бы попытаться сформулировать понятие о данном заболевании. Исходя из вышеизложенного кариес зубов – это неспецифическое инфекционное заболевание зубов, возникающее из-за нарушения гомеостаза в полости рта в сторону процессов бактериальной кислотопродукции и проявляющееся в виде очагов деминерализации эмали или полостей на зубах.
Отсюда начальный кариес (кариес эмали) – это видимые очаги деминерализации эмали, возникающие в результате нарушения в полости рта динамического равновесия процессов де- и реминерализации, проявляющиеся в устранении пелликулы, поверхностной и подповерхностной потери ткани, увеличении проницаемости эмали и межпризметического пространства. Наблюдается три исхода процесса – образования кариозной полости, либо приостановление развития деминерализации, либо ее выздоровление (реминерализация).
Начальный кариес всегда сопровождается кариесогенной ситуацией – состояние полости рта при нарушении гомеостаза из-за высокой бактериальной кислотопродукции, возникающей в результате неконтролируемого потребления легкоусвояемых углеводов, недостаточной гигиены полости рта, активного развития кариесогенной микрофлоры и зубного налета, пониженной резистентности тканей зубов, ведущих к возникновению и развитию кариеса.
Просмотрено 10201 Нравится 24 Мне нравится
Информация на этом сайте предназначена для профессионалов: врачей, ассистентов, зубных техников, гигиенистов
Биохимия начального кариеса. Кариозный процесс
В стадии начального кариеса в дентине и эмали происходит накопление тирозина, дальнейший распад которого приводит к образованию меланина, который придает твердым тканям зубов желто-коричневую окраску [Baer P. N., Morris M. JL., 1977]. В целом в участках кариозного поражения наблюдается повышенная концентрация белка, свободных углеводов, сульфата кальция, продуктов кислотного гидролиза мукополисахаридов — уксусной, глюкуроновой и серной кислот [Николишин А. К., 1975; Brannstrom M., 1961].
Затем происходит растворение дентина, в котором образуется так называемая просвечивающая зона, представляющая собой склерозированный дентин [Лукомский И. Г., 1955]. Кариозный дентин характеризуется наличием зон поражения овальной формы, постепенно переходящих без резких границ раздела в интактный дентин [Гранин А. В., 1967], а также облитерированных органическими субстанциями дентинных канальцев и накоплением органического вещества [Патрикеев В. К. и др., 1976; Karjalainen S., Larmas M., 1975]. Дезинтегрированный дентин содержит в ряде случаев значительное количество микроорганизмов, гиалин, зернистый материал. Бактериальные культуры обнаруживаются в размягченном препульпарном дентине при глубоком кариесе [Персиц М. М., 1970; Patterson R. С, Watts A., 1981].
Кариозный процесс захватывает не только твердые ткани зубов. В его начальных стадиях происходят определенные изменения в слое одонтобластов; они принимают округлую форму, уменьшается число их рядов. Происходит также расширение кровеносных сосудов в субодонтобластическом слое, а в коронковой пульпе обнаруживаются очаговые кровоизлияния и в отдельных местах краевое стояние лейкоцитов [Новиков Л. Л., 1972].
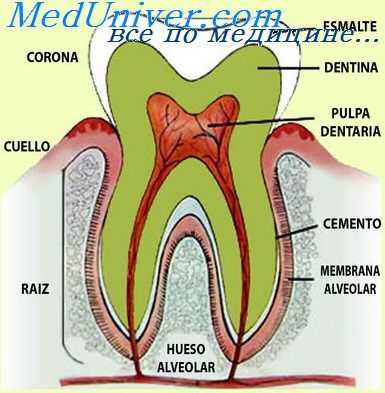
При глубоком кариесе, когда эмаль уже полностью разрушена и в процесс вовлечены поверхностные слои дентина, в пульпе наблюдаются еще более глубокие морфологические изменения. Многорядный слой одонтобластов истончается и превращается в однорядный, отмечается атрофия одонтобластов или их дистрофические изменения. Количество клеток в одонтобластическом слое также резко уменьшается, их цитоплазма содержит различные по размерам вакуоли, ядро подвергнуто лизису. В результате прогрессирующей вакуолизации слоя одонтобластов в нем при слиянии отдельных вакуолей образуются обширные кисты. Происходят глубокие нарушения минерального, белкового и углеводного обмена в пульпе, являющегося отражением общего обмена веществ в организме [Александрова Е. В., 1965].
Как отмечает М. Бушан и соавт. (1979), при кариесе тканей зубов можно выделить две фазы его развития. В первой происходит нарушение строгой ориентации кристаллов в эмали в результате разрушения межкристаллических связей, разрушение и разрыхление коллагеновых воколон дентина, грубые изменения отростков одонтобластов. На второй стадии заметно изменяются величина и форма кристаллов твердых тканей зуба, в дентинных канальцах усиливается и ускоряется накопление гранулирующего осадка, продолжаются изменение и дезорганизация коллагеновых структур. В зоне кариозного дентина обнаруживается закупорка дентинных канальцев и отложение в них минеральных солей.
Развитие кариозного процесса сопровождается дистрофией зубных тканей различной степени выраженности в виде нарушения соотношения процессов минерализации, деминерализации и реминерализации с преобладанием деминерализации. Кариозный процесс поражает пульпу, эмаль, дентин, а в редких случаях — и цемент. Применение методов электронной микроскопии, рентгеноструктурного анализа и др. позволило описать патоморфологию зубных тканей практически на всех уровнях: субклеточном, надмолекулярном и молекулярном. Указанные изменения предшествуют морфологическим изменениям, которые в конечном счете могут быть оценены и невооруженным глазом, что является клиническим признаком кариеса.
Микрофлора полости рта у больных кариесом
Статья посвящена изучению микрофлоры ротовой полости людей, больных кариесом. У людей больных кариесом наблюдается увеличение количества микроорганизмов во всех изученных локалитетах ротовой полости. Установлено, что количество микроорганизмов увеличивается даже в таких малонаселенных участках, как слизистая оболочка неба. При кариесе регистрируется изменение в качественном и количественном составе микрофлоры полости рта и наблюдается определенная сопряженность таксонов.
Ключевые слова: микрофлора, ротовая полость, кариес, стафилококки, структурная перестройка.
Экологическая обстановка, которая складывается в мире в настоящее время оказывает серьезное влияние на состояние здоровья населения, понижается резистентность организма к различного рода патогенам. Активно развивается и распространяется бактериальная флора. Бактерии и вирусы вырабатывают резистентность к фармакологическим препаратам, тем самым приводя, к развитию более сложных форм болезней.
Особенный интерес представляет микрофлора полости рта, так как она является начальным участком переднего отдела пищеварительной системы, тесно связанным с внутренней средой организма и внешним окружением. Микрофлора полости рта включает представителей различных таксономических групп микроорганизмов, вступающих в биохимические, иммунологические и другие взаимодействия как макроорганизмом, так и друг с другом.
По мнению Луцкой, развитию многочисленных аэробных и анаэробных микроорганизмов в полости рта способствует благоприятные условия: наличие питательных веществ, оптимальная температура, влажность, условия жизни, щелочная реакция слюны [2].
Поэтому число микроорганизмов в ротовой полости, как по количеству видов, так и по плотности микробного загрязнения, уступает только толстой кишке. При этом нормальная микрофлора играет важную роль в метаболизме, является своеобразным барьером для патогенных бактерий.
Целью нашего исследования было изучение основных представителей резидентной микрофлоры и особенности локализации бактерий в ротовой полости. Забор материала производили по методике В. С. Крамарь (1989), в соответствии с которой были взяты пробы со слизистой оболочки щеки, неба, с поверхности языка, из кариозной полости и зубной налет. Использовали бумажные диски, изготовленные из фильтровальной бумаги диаметром 0,6 см, площадью 0,28 см 2 . Зубной налет и содержимое кариозной полости брали с помощью стерильного двустороннего стоматологического экскаватора. Материал разбавляли физиологическим раствором от 1:100 до 1:1000, а затем высевали на 5 % мясопептонном агаре с гемином / мендадином и последующей анаэробной культивацией. Продолжительность исследования составляла 1–2 недели, включая идентификацию [3].
При проведении анализа учитывали численность и видовой состав лактобактерий, стрептококков, стафилококков, энтеробактерий, грибов рода Candida по методу H. Haenel. Для каждой группы в соответствии с методикой использовали разные среды.
Всего нами было обследовано 15 человек с кариесом. Из всех обследованных преобладали люди возрастной группы от 26 до 45 лет. Был изучен видовой состав микрофлоры полости рта больных, страдающих кариесом (Таблица, 1).
Микрофлора полости рта больных, страдающих кариесом, имеющих всвоем составе стафилококки при различном типе носительства,% М±т, КОЕ/ ед.суб.
Читайте также:
- Рефрактерность сердца. Абсолютная рефрактерность миокарда
- Параганглиома средостения на КТ, МРТ
- Диагностика сальмонеллеза. Микробиологическая диагностика сальмонелл. Выделение возбудителей сальмонеллеза. Феномен валообразования.
- Строение микротрубочек и их функции
- Лечение туберкулеза бронхов. Туберкулезный плеврит.
