Моноклональная гаммапатия неясного генеза
Добавил пользователь Алексей Ф. Обновлено: 24.01.2026
ММ — множественная миелома
ТЦ — тяжелые цепи
ХЛЛ — хронический лимфолейкоз
MGUS — моноклональная гаммапатия неясного генеза
MW — макроглобулинемия Вальденстрема
Моноклональные гаммапатии (МКГП) характеризуются появлением в крови моноклональных иммуноглобулинов (Ig) или их фрагментов (парапротеинов), синтезируемых пулом аномальных В-лимфоцитов или чаще плазматических клеток костного мозга. Эти клетки происходят от одной родоначальной клетки и, таким образом, составляют единый клон (семью) клеток. Важнейшим признаком клональности этих клеток является продукция ими Ig одного класса, чаще G или A, с одним типом легких цепей (ЛЦ) — либо λ, либо κ, может отмечаться и гиперпродукция только ЛЦ — λ или κ.
Такие секретирующие клоны В-лимфоцитов или плазматических клеток называют «секретирующие лимфоплазмоклеточные дискразии (ЛПКД)», при этом МКГП (парапротеинемии) являются отличительным клиническим признаком этих дискразий.
Среди секретирующих вариантов ЛПКД к злокачественным неоплазиям относят множественную миелому (ММ), макроглобулинемию Вальденстрема (MW). Относительно более доброкачественными вариантами считают тлеющую миелому, хронический лимфолейкоз (ХЛЛ). Начальные стадии ЛПКД обозначают термином «моноклональная гаммапатия неясного генеза» (MGUS). MGUS привлекает в последние годы пристальное внимание клиницистов не только как предопухолевое клональное заболевание, практически всегда предшествующее развитию ММ и другим В-лимфоцитарным опухолям, но, что не менее важно, и как состояние, ассоциирующееся с заболеваниями терапевтического профиля, в частности болезнями почек. Поскольку повреждения тубулоинтерстициальной ткани и клубочков почек могут быть патогенетически связаны с моноклональным белком, который в большинстве случаев по объему отвечает критериям MGUS и, более того, представлен свободными ЛЦ Ig (FLC), то больных с MGUS в клинике внутренних болезней выявляют обычно нефрологи. Впервые R. Kyle и соавт. в 1978 г. ввели термин MGUS после того, как на основании большого клинического материала (1384 пациента) отметили, что пациенты с наличием в сыворотке крови небольшого количества моноклонального белка (М-протеина) в отсутствие симптомов имеют более высокий риск развития ММ, MW, AL-иммуноглобулинового амилоидоза [1]. В настоящее время установлено, что MGUS возникает примерно у 4,2% взрослых людей старше 50 лет, т. е. ее распространенность среди населения значительно выше, чем overt-плазма-В-лимфоцитарных неоплазм вместе взятых [2]. В течение многих лет MGUS может клинически не проявляться и не подвергаться злокачественной трансформации. Переход в миелому у пациентов с MGUS составляет примерно 1% новых случаев в год [3]. В настоящее время на новом методическом уровне показана возможность более детального прогнозирования дальнейшей злокачественной прогрессии этой начальной стадии ЛПКД.
Так, S. Rajkumar и соавт. [4] показали, что если уровень секреции моноклональных Ig не превышает 15 г/л и при этом секретируются IgG и не секретируются в избытке моноклональные свободные ЛЦ, то злокачественная трансформация в течение ближайших 20 лет произойдет лишь у 5% больных. Если наблюдается отклонение одного из представленных показателей (например, моноклональная секреция превышает 15 г/л или секретируются IgМ либо моноклональные свободные ЛЦ), то риск трансформации увеличивается в 5 раз, если двух показателей — то в 10 раз, отклонение же всех 3 показателей приведет через 20 лет к злокачественной трансформации в миелому у 58% носителей MGUS.
Из-за отсутствия высокочувствительных методов диагностики МКГП проблема MGUS длительно оставалась в тени проблемы ММ. В дальнейшем стали накапливаться данные о потенциальной патогенности моноклональных Ig и их фрагментов, составляющих основу MGUS, что обусловливает повреждение органов-мишеней с развитием прогрессирующей органной дисфункции. К заболеваниям, не принадлежащим к гематологическим опухолям, в ассоциации с олигосекреторной МКГП описаны иммуноглобулиновый AL/AH-амилоидоз, болезнь отложения моноклональных Ig и их фрагментов, чаще легких цепей (LCDD), криоглобулинемия I и II типов и другие заболевания почек — гломерулопатии и тубулопатии. Различают следующие варианты поражения почек при МКГП.
Гломерулопатии:
1. Болезни отложения: AL-амилоидоз; болезнь отложения ЛЦ (БОЛЦ); болезнь отложения ТЦ и ЛЦ; болезнь отложения ТЦ.
2. Иммуновоспалительные гломерулопатии: микротубулярный (иммунотактоидный) гломерулонефрит (ГН) с депозитами моноклональных Ig: ГН с неорганизованными моноклональными иммунными комплексами (различные морфологические варианты); зависимый от компонента С3-комплемента ГН (мезангиокапиллярный с плотными депозитами); ГН при MW; криоглобулинемический ГН.
Тубулопатии: синдром Фанкони, ассоциированный с внутрицитоплазматическими кристаллами ЛЦ; cast-нефропатия.
Перечень ассоциированных с MGUS почечных (и не только почечных, нередко системных) заболеваний все более расширяется, в связи с чем скрининговые обследования больных для выявления МКГП начинают рассматривать как обязательный в практике нефролога.
Несмотря на то что причины тканевой токсичности и тропности моноклональных белков к отдельным тканям и органам, например к почкам, недостаточно расшифрованы, накопленные к настоящему времени, главным образом в эксперименте, данные позволяют приблизиться к пониманию некоторых механизмов, лежащих в их основе. Показано, что моноклональные Ig различных классов в растворенном состоянии могут быть крайне нестабильными, при этом ЛЦ, реже — тяжелые цепи (ТЦ) способны образовывать агрегаты, в том числе в виде фибрилл, отложение которых в тканях и составляет сущность системного первичного иммуноглобулинового амилоидоза. Стало ясно, что AL/AH-амилоидоз может быть самостоятельным вариантом олигосекреторной плазмоклеточной дискразии с вовлечением многих органов или ассоциированным с любым другим типом секретирующих ЛПКД (ММ, MW и др.). Поскольку развитие AL/AH-амилоидоза исключительно связано с физико-химической нестабильностью самого амилоидогенного моноклонального Ig, то этот тип амилоидоза (AL/AH) правильнее считать ассоциированным состоянием, а не осложнением миеломы или другой ЛПКД.
LCDD наиболее часто ассоциируется с моноклональными κ-ЛЦ (тип I и IV). Это конго-отрицательные депозиты, которые в почках локализованы преимущественно вдоль почечных базальных мембран (канальцевых и колбочковых), имеют вид аморфных (в отличие от фибрилл амилоида), электронно-плотных включений. Особенностью тканевого повреждения является накопление склеротической ткани (лобулярный склероз) в клубочках почек и других органах.
Обычно подозрение на наличие МКГП возникает при обнаружении признаков диспротеинемии по СОЭ или протеинурии переполнения (выраженная протеинурия при нормальных уровнях в сыворотке крови альбумина, обнаружение белка Бенс-Джонса). Применение в этом случае электрофоретических методов позволяет обнаружить аномальные фракции белков в крови и нередко моче. Проведение реакции иммунопреципитации с антителами к различным Ig дает возможность подтвердить моноклональный характер этих белковых фракций. Однако с помощью традиционных методов электрофореза выявляют лишь большое количество моноклонального Ig (не менее 500 мг/л). К более эффективным методам относится иммунофиксация, чувствительность которой составляет приблизительно 150 мг/л. Но возможности этого метода также существенно ограничены при диагностике олигосекреторных вариантов МКГП, таких как MGUS, включая первичные формы AL/AH-амилоидоза, который в 42% характеризуется МКГП только из свободных ЛЦ [5]. В целом методом иммунофиксации можно обнаружить лишь половину случаев MGUS (A.R. Bradwell, 2006).
Основные проблемы в диагностике MGUS связаны с трудностями выделения моноклональных белков среди поликлональных. Кроме того, независимо от типа основного моноклонального Ig аномальный клон лимфоплазматических клеток, как правило, синтезирует определенные количества свободных ЛЦ, которые принадлежат одному из типов — k или l, т. е. также характеризуются моноклональностью. Чтобы обнаружить свободные ЛЦ, нужно уметь отличать их от ЛЦ, связанных с ТЦ в составе интактных Ig. В настоящее время появился метод нефелометрического определения свободных ЛЦ, основанный на антителах к скрытым эпитопам Л.Ц. Метод лицензирован под названием Freelite. Важным достоинством метода является возможность проводить количественную оценку продукции ЛЦ. В результате сформулированы критерии абсолютной нормы продукции свободных ЛЦ, впервые появился чувствительный, технически несложный (нефелометрия) метод для мониторинга течения МКГП, в том числе олигосекреторных, сформулированы критерии молекулярной ремиссии ЛПКД.
Применение этого метода впервые позволило показать, что частота MGUS составляет 95% случаев всех МКГП [4]. В США метод включен в список скрининговых методов определения моноклональной секреции при первичном обращении больных наряду с традиционными общеклиническими методами исследования крови и мочи. Применение метода Freelite в рамках профилактических скрининговых программ показало, что МКГП и соответственно ЛПКД относятся к проблеме популяционного уровня, близкой по своей значимости к проблеме язвенной болезни, бронхиальной астмы и других широко распространенных заболеваний.
Изучение различных вариантов поражения почек, ассоциированных с МКГП, позволило рассматривать олигосекреторные МКГП как большую нефрологическую проблему.
Среди описанных в ассоциации с олигосекреторной МКГП форм поражения почек кроме AL/AH-амилоидоза и болезни отложения Ig наиболее известна тубулярная (цилиндровая) нефропатия, часто осложняющая течение множественной миеломы (у 50% больных), характеризующаяся образованием в просвете канальцев электронно-плотных цилиндров. Высокая продукция ЛЦ и соответственно их высокая концентрация в почечных канальцах в условиях резких колебаний содержания воды в процессе реабсорбции и изменений рН мочи являются факторами образования агрегатов ЛЦ в почечных канальцах. Большое значение в генезе цилиндровой нефропатии имеют также взаимодействие с белком Тамма—Хорсфалла, гиперкальциемия (вследствие остеолизиса, характерного для миеломы), инфекция мочевых путей, предшествующий интерстициальный фиброз. Агрегаты Л.Ц. и белка Тамма—Хорсфалла блокируют ток мочи, что приводит к острой почечной недостаточности. Эту форму нефропатии чаще всего именуют миеломной почкой.
Возможны и другие формы ассоциированной с MGUS тубулопатии. Хорошо известно, что ЛЦ способны подвергаться реабсорбции и кристаллизации в цитоплазме канальцевого эпителия с развитием различных дисфункций канальцев — парциальных или по типу синдрома Фанкони. Кристаллизация Л.Ц. является фактором трансформации канальцевого эпителия в клетки макрофагального ряда с развитием гистиоцитоза (рис. 1). Однако следует отметить, что такая кристаллизация происходит во многих тканях и связана с тем, что лизосомальный аппарат резидуальных макрофагов оказывается неспособным полностью лизировать ЛЦ. У пациентов в этом случае нередко развивается генерализованный гистиоцитоз. Способность канальцевого эпителия почек трансдифференцироваться в клетки макрофагального ряда хорошо известна, это свойство является важным механизмом фиброза в почках у больных с протеинурией. Способность к трансдифференциации, по-видимому, связана с единством происхождения канальцевого эпителия и макрофагов из одного и того же эмбрионального листка — мезодермы.
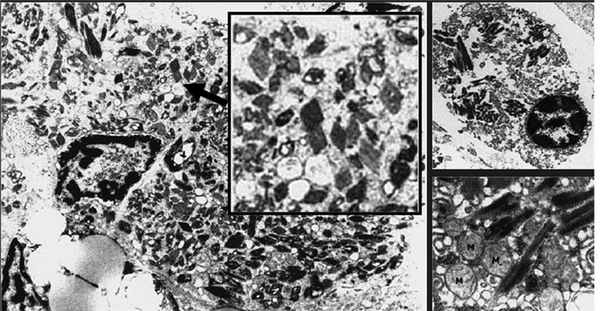
Рис. 1. Гистиоцитоз с внутриклеточными кристаллами (A. Lebeau, E. Zeindl-Eberhart, 2002).
Высокая частота поражения канальцев с развитием острой почечной недостаточности у больных миеломой позволила многим исследователям использовать термин канальцевая «нефротоксичность ЛЦ». Однако в настоящее время накоплено достаточно данных о более широком спектре патологических эффектов ЛЦ, часто без канальцевой нефротоксичности и без развития ургентных состояний. Поэтому более правильно применять термин «патогенность ЛЦ».
Как и при амилоидной, при неамилоидной депозиции ЛЦ (БОЛЦ) в почках поражаются клубочки, в связи с чем нередко (у 40% больных) наблюдают развитие протеинурии нефротического уровня, как это бывает при амилоидозе [6]. Однако можно предположить, что амилоидный тип депозиции ЛЦ позволяет «замыкать» агрессивную биохимическую активность ЛЦ внутри амилоида, в результате чего при амилоидозе почечная недостаточность развивается позже, чем при БОЛЦ. В отличие от амилоидоза при БОЛЦ образуются гранулярные депозиты с генерализованным поражением базальных мембран — внутриклубочковых и перитубулярных. Уремия у пациентов с БОЛЦ развивается в среднем в течение 3 лет, а через 5 лет уремию диагностируют почти у 2/3 больных [6]. Как и амилоидоз, БОЛЦ является системным заболеванием с поражением сердца (у 21% больных), печени (у 19%), селезенки (у 8%), периферической нервной системы (у 8%). Следовательно, болезнь представляет собой общетерапевтическую проблему и, по-видимому, распространена более широко, чем принято считать, ввиду высокой частоты выявления MGUS в популяции, а также экспериментальных данных, свидетельствующих, что моноклональные ЛЦ реализуют свои патогенные свойства в 85% случаев [7, 8].
Как показано ранее для моноклональных Ig [9], патологические эффекты ЛЦ связаны с исходными свойствами самих ЛЦ. В настоящее время имеются надежные экспериментальные данные о различных эффектах разных типов Л.Ц. Так, по свидетельству J. Teng и соавт. [9], амилоидогенные ЛЦ подвергаются эндоцитозу мезангиальными клетками с последующим слиянием нагруженных ЛЦ эндосомальных вакуолей и лизосом. При этом мезангиоцит приобретает молекулярные маркеры (CD68) макрофагов. Но именно внутримакрофагальное взаимодействие различных белков — предшественников амилоида с лизосомальными ферментами приводит к синтезу ускоряющей амилоидоз субстанции, которая служит главным фактором активации амилоидогенеза в тканях. Установлено, что ЛЦ при БОЛЦ не подвергаются эндоцитозу и остаются фиксированными на мембране мезангиоцита (рис. 2). При этом мезангиоцит экспрессирует молекулярные маркеры (α-гладкомышечный актин и др.), характерные для миофибробласта, и становится продуцентом внеклеточного матрикса (фиброза) в почке, что при БОЛЦ сочетается с синтезом тенасцина, закрепляющего необратимость фиброза почки.
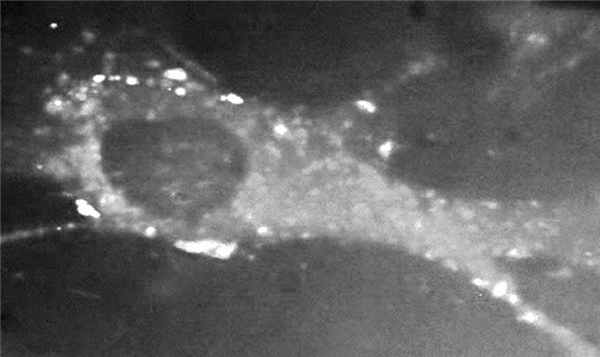
Рис. 2. Фиксация неамилоидогенных ЛЦ на мембране мезангиоцитов.
В некоторых случаях эндоцитоз ЛЦ завершается образованием параллельных рядов микротубулярных структур в цитоплазме мезангиоцита, которые в отличие от амилоидной фибриллы, имеющей толщину 10 нм, характеризуются бо́льшим диаметром (30—40 нм) и не обладают свойством двойного лучепреломления. Клинические проявления этого так называемого иммунотактоидного, или микротубулярного, нефрита напоминают проявления обычно тяжелых мезангиальных форм ГН (выраженная протеинурия, эритроцитурия, артериальная гипертония, нередко почечная недостаточность). Уже в дебюте иммунотактоидный ГН отличается неблагоприятным течением с возможностью быстрого формирования «полулуний».
Существует еще одна своеобразная форма гломерулопатии, ассоциированная с MGUS, — фибриллярная нефропатия. Однако при фибриллярной нефропатии молекулярной основой фибрилл, близких по электронно-микроскопической структуре амилоиду, но не обладающих двойным лучепреломлением при окраске конго красным, являются поликлональные IgG, по-видимому, в соединении с коллагеном. Поликлональность Ig, который подвергается отложению, указывает на очень сложный патогенез в данном случае, при этом роль МКГП остается невыясненной.
Обсуждая механизмы поражения почек при МКГП, следует также обратить внимание, что моноклональные Ig могут быть и факторами иммунной агрессии. Ярким примером этого механизма является криоглобулинемический васкулит, при котором криоглобулинемия служит прогностическим фактором развития МКГП. Аутоиммунные патогенные свойства криоглобулинов формируются и проявляются клинически задолго до развития моноклональной В-клеточной опухоли. Тем не менее наличие моноклонального компонента в составе криоглобулина помогает обосновать подходы к лечению этой патологии, в частности анти-CD20-агентами (ритуксимаб).
Кроме того, существуют многочисленные описания различных морфологических форм ГН, ассоциированных с MGUS, — мезангиопролиферативного, мезангиокапиллярного, мембранозного. Связь нефрита с MGUS доказывается в этих случаях отложением в структурах почки (клубочках) моноклональных иммунных комплексов, идентичных Ig в составе МКГП.
Однако на примере мезангиокапиллярного ГН показано, что причинно-следственная ассоциация нефрита с МКГП не всегда сопровождается отложением моноклональных Ig в клубочках. Моноклональные Ig, в первую очередь ЛЦ, могут взаимодействовать с антигенными детерминантами С3-конвертазы, что блокирует механизмы элиминации активированных компонентов комплемента и запускает альтернативный путь активации комплемента с реализацией эффекторных механизмов мембраноатакующего комплекса. В этом случае в биоптате почки обнаруживают только депозиты комплемента, но не выявляют моноклональные Ig. При этом для доказательства связи нефрита с МКГП необходимо использовать нестандартные методы протеомного анализа. В частности, для получения собственно депозитов компонента С3-комплемента необходимо использовать лазерную микродиссекцию (под контролем микроскопа) с последующим анализом полученного материала методом матриксной лазерной десорбции/ионизации (MALDI-TOF), способной идентифицировать разные белки в материалах неизвестного состава. Имеются наблюдения, в которых применение комбинации этих методов позволяло выявлять ассоциацию моноклональных ЛЦ с компонентами депозитов С3-комплемента. Все описанные наблюдения такой ассоциации МКГП и нефрита демонстрировали на светооптическом и электронно-микроскопическом уровне мезангиокапиллярный нефрит с электронно-плотными депозитами.
Таким образом, в настоящее время хорошо обосновано, что МКГП являются важнейшим прогностически значимым фактором развития заболеваний почек, в том числе Г.Н. Выявление связи нефропатии с олигосекреторной гаммапатией имеет принципиальное значение, так как лечение таких больных обусловливает необходимость применения особых схем химиотерапии, направленных на элиминацию патологического клона лимфоцитов или плазмоцитов. Без элиминации этого клона органное поражение будет рецидивировать с развитием органной недостаточности. Принципы такой терапии в настоящее время хорошо отработаны на примере AL-амилоидоза, показали свою эффективность и относительно низкую токсичность.
Следует также напомнить, что проблема МКГП пока недостаточно исследована в кардиологии и других областях клинической медицины.
Клиническое наблюдение парапротеин М-ассоциированной полинейропатии со стойким ответом на терапию ритуксимабом
Для цитирования: Потапенко В.Г., Киселев В.Н. Клиническое наблюдение парапротеин М-ассоциированной полинейропатии со стойким ответом на терапию ритуксимабом. Клиническая онкогематология. 2019;12(4):434–7.
РЕФЕРАТ
Установление диагноза моноклональной гаммапатии неясного генеза сопряжено с широким диагностическим поиском, т. к. секреция парапротеина встречается при различных заболеваниях. Одним из вариантов полинейропатии, связанной с парапротеинемией М, является демиелинизирующая полинейропатия с антителами к миелин-ассоциированному гликопротеиду (ДПАМ). В первой линии лечения при этом заболевании используется преднизолон, внутривенный иммуноглобулин. У пациентов с резистентными формами стандартная терапия второй линии не определена. Мы приводим клиническое наблюдение пациентки с ДПАМ, которой ранее проводилось лечение преднизолоном, азатиоприном, выполнялись процедуры плазмафереза, однако длительный эффект достигнут только после применения ритуксимаба.
Ключевые слова: парапротеин, моноклональная гаммапатия неясного генеза (МГНГ), миелин-ассоциированный гликопротеид (МАГ), полинейропатия, ритуксимаб.
Получено: 22 января 2019 г.
Принято в печать: 5 сентября 2019 г.
Читать статью в PDF
Kyle RA, Therneau TM, Rajkumar SV, et al. A long-term study of prognosis in monoclonal gammopathy of undetermined significance. N Engl J Med. 2002;346(8):564–9. doi: 10.1056/NEJMoa01133202.
Гинзберг М.А., Варламова Е.Ю., Рыжко В.В. и др. Клинико-нейрофизиологическое исследование хронической демиелинизирующей полиневропатии, ассоциированной с моноклональной секрецией. Медицинский совет. 2015;10:93–6.
[Ginzberg MA, Varlamova EYu, Ryzhko VV, et al. Clinical and neurophysiological study of chronic demyelinating polyneuropathy associated with monoclonal secretion. Meditsinskii sovet. 2015;10:93–6. (In Russ)]
European Federation of Neurological Societies/Peripheral Nerve Society Guideline on management of chronic inflammatory demyelinating polyradiculoneuropathy: Report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society – First Revision. J Peripher Nerv Syst. 2010;15(1):1–9. doi: 10.1111/j.1529-8027.2010.00245.x.
Dalakas MC, Rakocevic G, Salajegheh M. Placebo-controlled trial of rituximab in IgM anti-myelin associated glycoprotein antibody demyelinating neuropathy. Ann Neurol. 2009;65(3):286–93. doi: 10.1002/ana.21577.
Супонева Н.А., Павлов Э.В. Диагностика и базовая терапия хронических полиневропатий. Врач. 2009;4:43–4.
[Suponeva NA, Pavlov EV. Diagnosis and basic therapy of chronic polyneuropathies. Vrach. 2009;4:43–4. (In Russ)]
Lunn MP, Nobile-Orazio E. Immunotherapy for IgM anti-myelin-associated glycoprotein paraprotein-associated peripheral neuropathies. Cochrane Database Syst Rev. 2006;2:CD002827. doi: 10.1002/14651858.cd002827.pub2.
Leger JM, Viala K, Nicolas G, et al. Placebo-controlled trial of rituximab in IgM anti-myelin-associated glycoprotein neuropathy. Neurology. 2013;80(24):2217–25. doi: 10.1212/WNL.0b013e318296e92b.
Gazzola S, Delmont E, Franques J, et al. Predictive factors of efficacy of rituximab in patients with anti-MAG neuropathy. J Neurol Sci. 2017;377:144–8. doi: 10.1016/j.jns.2017.04.015.
Niermeijer JMF, Fischer K, Eurelings M, et al. Prognosis of polyneuropathy due to IgM monoclonal gammopathy: a prospective cohort study. Neurology. 2010;74(5):406–12. doi: 10.1212/wnl.0b013e3181ccc6b9.
Nobile-Orazio E, Meucci N, Baldini L, et al. Long-term prognosis of neuropathy associated with anti-MAG IgM M-proteins and its relationship to immune therapies. Brain. 2000;123(4):710–7. doi: 10.1093/brain/123.4.710.
Edwards JC, Szczepanski L, Szechinski J, et al. Efficacy of B-cell-targeted therapy with rituximab in patients with rheumatoid arthritis. N Engl J Med. 2004;350(25):2572–81. doi: 10.1056/nejmoa032534.
Роль микроокружения костного мозга в прогрессии множественной миеломы из моноклональной гаммапатии неясного генеза
Множественная миелома – опухоль из плазматических клеток, одно из наиболее распространенных злокачественных заболеваний крови. Ей предшествует стадия, называемая моноклональной гаммапатией неясного генеза, из которой лишь в небольшом проценте случаев развивается полноценная множественная миелома. Было принято считать, что этот процесс связан с накоплением генетических мутаций, но в последние годы появляется все больше доказательств того, что ключевую роль в прогрессии играет микроокружение костного мозга и именно оно может стать мишенью для терапии, предупреждающей развитие миеломы. В обзоре рассмотрена роль мезенхимальных стволовых клеток, клеток иммунной системы, эндотелиоцитов, фибробластов, адипоцитов, остеокластов и остеобластов в прогрессии множественной миеломы, а также влияния симпатической нервной системы и состава микробиома.
Ключевые слова
Об авторах
Александра Станиславовна Худовекова
214019 Смоленск, ул. Крупской, 28
ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России; ОГБУЗ «Смоленский областной институт патологии»
Россия
214019 Смоленск, ул. Крупской, 28,
214018 Смоленск, проспект Гагарина, 27
ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России; ОГБУЗ «Смоленский областной институт патологии»
Россия
214019 Смоленск, ул. Крупской, 28,
214018 Смоленск, проспект Гагарина, 27
Список литературы
1. Moser-Katz T., Nisha S.J., Madhav V.D. et al. Game of bones: how myeloma manipulates its microenvironment. Front Oncol 2021;10:625199. DOI: 10.3389/fonc.2020.625199.
3. Lomas O.C., Tarek H.M., Sabrin T. et al. Monoclonal Gammopathy of Undetermined Significance (MGUS) – not so asymptomatic after all. Cancers (Basel) 2020;12(6):1554. DOI: 10.3390/cancers12061554.
4. Менделеева Л.П., Вотякова О.М., Рехтина И.Г. и др. Множественная миелома. Современная онкология 2020;22(4):6–28. DOI: 10.26442/18151434.2020.4.200457.
5. Hewett D.R., Vandyke R., Lawrence D.M. et al. DNA barcoding reveals habitual clonal dominance of myeloma plasma cells in the bone marrow microenvironment. Neoplasia 2017;19(12):972–81. DOI: 10.1016/j.neo.2017.09.004.
7. Hideshima T., Anderson K.C. Signaling pathway mediating myeloma cell growth and survival. Cancers (Basel) 2021;13(2):216. DOI: 10.3390/cancers13020216.
9. Артюхина З.Е., Семенова Н.Ю., Балашова В.А. и др. Кроветворная ткань и стромальное микроокружение больных множественной миеломой. Вестник гематологии 2017;13(1):15–8.
10. Ругаль В.И., Бессмельцев С.С., Семенова Н.Ю. и др. Характеристика микроокружения костного мозга при множественной миеломе до и после терапии. Сибирский научный медицинский журнал 2019;39(1):112–8. DOI: 10.15372/SSMJ20190116.
11. Чубарь А.В., Енукашвили Н.И. Мезенхимные стромальные клетки: роль в формировании гематоонкологической ниши. Цитология 2020;62(11): 763–72 DOI: 10.31857/S0041377120110024.
12. Garcia-Gomez A., Li T., de la CalleFabregat C. et al. Targeting aberrant DNA methylation in mesenchymal stromal cells as a treatment for myeloma bone disease. Nat Commun 2021;12(1):1–15. DOI: 10.1038/s41467-020-20715-x.
14. Семенова Н.Ю., Чубарь А.В., Енукашвили Н.И. и др. Перестройка ключевых элементов стромального микроокружения костного мозга при множественной миеломе. Вестник гематологии 2020;16(1):15–21.
15. Ito S., Sato T., Maeta T. Role and therapeutic targeting of SDF-1α/CXCR4 axis in multiple myeloma. Cancers (Basel) 2021;13(8):1793. DOI:10.3390/cancers13081793
17. Бутолина М.А., Ветошкин К.А., Минаева Н.В и др. Изучение цитокин-продуцирующей способности мезенхимальных клеток стромы костного мозга при множественной миеломе. Вестник гематологии 2019;15(4):31.
18. Slomp A., Peperzak V. Role and regulation of pro-survival BCL-2 proteins in multiple myeloma. Front Oncol 2018;8:533. DOI: 10.3389/fonc.2018.00533.
19. Chen Z., Orlowski R.Z., Wang M. et al. Osteoblastic niche supports the growth of quiescent multiple myeloma cells. Blood 2014;123(14):2204–8. DOI: 10.1182/blood-2013-07-517136
20. Ostrand-Rosenberg S., Fenselau C. Myeloid-derived suppressor cells: immune-suppressive cells that impair antitumor immunity and are sculpted by their environment. J Immunol 2018;200(2):422–31. DOI: 10.4049/jimmunol.1701019.
21. Lewinsky H., Gunes E.G., David K. et al. CD84 is a regulator of the immunosuppressive microenvironment in multiple myeloma. JCI Insight 2021;6(4):e141683. DOI: 10.1172/jci.insight.141683.
23. Leone P., Solimando A.G., Malerba E. et al. Actors on the scene: immune cells in the myeloma niche. Front Oncol 2020;10:599098. DOI: 10.3389/fonc.2020.599098.
25. Wu S., Kuang H., Ke J. et al. Metabolic reprogramming induces immune cell dysfunction in the tumor microenvironment of multiple myeloma. Front Oncol 2021;10:591342. DOI: 10.3389/fonc.2020.591342.
26. Saitoh T., Oda T. DNA damage response in multiple myeloma: the role of the tumor microenvironment. Cancers (Basel) 2021;13(3):504. DOI: 10.3390/cancers13030504.
28. Zhang L., Tai Y.T., Ho M. et al. Regulatory B cell-myeloma cell interaction confers immunosuppression and promotes their survival in the bone marrow milieu. Blood Cancer J 2017;7(3):e547. DOI: 10.1038/bcj.2017.24.
29. Leone P., Berardi S., Frassanito M.A. et al. Dendritic cells accumulate in the bone marrow of myeloma patients where they protect tumor plasma cells from CD8+ T-cell killing. Blood 2015;126(12):1443–51. DOI: 10.1182/blood-2015-01-623975.
30. Botta C., Cucè M., Pitari M.R. et al. MiR-29b antagonizes the pro-inflammatory tumor-promoting activity of multiple myeloma-educated dendritic cells. Leukemia 2018;32(4):1003–15. DOI: 10.1038/leu.2017.336.
31. Chen T., Moscvin M., Bianchi G. Exosomes in the pathogenesis and treatment of multiple myeloma in the context of the bone marrow microenvironment. Front Oncol 2020; 10:608815. DOI: 10.3389/fonc.2020.608815.
33. De Veirman K., Rao L., De Bruyne E. et al. Cancer associated fibroblasts and tumor growth: focus on multiple myeloma. Cancers (Basel) 2014;6(3):1363–81. DOI: 10.3390/cancers6031363.
34. Hofmann J.N., Landgren O., Landy R. et al. A prospective study of circulating chemokines and angiogenesis markers and risk of multiple myeloma and its precursor. JNCI Cancer Spectr 2019;4(2): pkz104. DOI: 10.1093/jncics/pkz104.
35. Rapanotti M.C., Franceschini L., Viguria T.M.S. et al. Molecular expression of bone marrow angiogenic factors, cellcell adhesion molecules and matrixmetallo-proteinases in plasmacellular disorders: a molecular panel to investigate disease progression. Mediterr J Hematol Infect Dis 2018;10(1):e2018059. DOI: 10.4084/MJHID.2018.059.
38. Thordardottir M., Lindqvist E.K., Lund S.H. et al. Obesity and risk of monoclonal gammopathy of undetermined significance and progression to multiple myeloma: a population-based study. Blood Adv 2017;1(24):2186–92. DOI: 10.1182/bloodadvances.2017007609.
39. Medinger M., Passweg J. Role of tumour angiogenesis in haematological malignancies. Swiss Med Wkly 2014;144:w14050. DOI: 10.4414/smw.2014.14050.
40. Morris E.V., Suchacki K.J., Hocking J. et al. Myeloma cells down-regulate adiponectin in bone marrow adipocytes via TNF-alpha. J Bone Miner Res 2020;35(5):942–55. DOI: 10.1002/jbmr.3951.
41. Ragbourne S.C., Maghsoodi N., Streetly M. et al. The association between metabolic syndrome and multiple myeloma. Acta Haematol 2021;144(1):24–33. DOI: 10.1159/000505992.
42. Ichii M., Hosen N. Current understanding of myelomatous mesenchymal stromal cells extended through advances in experimental methods. Cancers (Basel) 2020;13(1):25. DOI: 10.3390/cancers13010025.
44. Mansour A., Wakkach A., Blin-Wakkach C. Emerging roles of osteoclasts in the modulation of bone microenvironment and immune suppression in multiple myeloma. Front Immunol 2017;8:954. DOI: 10.3389/fimmu.2017.00954.
45. Tai Y., Cho S.F., Anderson K.C. Osteoclast immunosuppressive effects in multiple myeloma: role of programmed cell death ligand 1. Front Immunol 2018;9:1822. DOI: 10.3389/fimmu.2018.01822.
46. Capp J.P., Bataille R. Multiple myeloma as a bone disease? The tissue disruptioninduced cell stochasticity (TiDiS) theory. Cancers (Basel) 2020;12(8):2158. DOI: 10.3390/cancers12082158.
47. Lawson M.A., McDonald M.M., Kovacic N. et al. Osteoclasts control reactivation of dormant myeloma cells by remodelling the endosteal niche. Nat Commun 2015;6:8983. DOI: 10.1038/ncomms9983.
49. Capp J.P., Bataille R. Multiple myeloma exemplifies a model of cancer based on tissue disruption as the initiator event. Front Oncol 2018;8:355. DOI: 10.3389/fonc.2018.00355.
51. Cheng Y., Sun F., D’Souza A. et al. Autonomic nervous system control of multiple myeloma. Blood Rev 2021;46:100741. DOI: 10.1016/j.blre.2020.100741.
52. Elefteriou F., Campbell P., Ma Y. Control of bone remodeling by the peripheral sympathetic nervous system. Calcif Tissue Int 2014;94(1):140–51. DOI: 10.1007/s00223-013-9752-4.
53. Pepeljugoski A.C., Morgan G., Braunstein M. Analysis of intestinal microbiome in multiple myeloma reveals progressive dysbiosis compared to MGUS and healthy individuals. Blood 2019;134(1):3076. DOI: 10.1182/blood-2019-130643.
54. Peled J.U., Devlin S.M., Staffas A. et al. Intestinal microbiota and relapse after hematopoietic-cell transplantation. J Clin Oncol 2017;35(15):1650–59. DOI: 10.1200/JCO.2016.70.3348.
55. Alkharabsheh O., Sidiqi M.H., Aljama M.A. et al. The human microbiota in multiple myeloma and proteasome inhibitors. Acta Haematol 2020;143(2):118–23. DOI: 10.1159/000500976.
Моноклональная гаммапатия неясного генеза
Моноклональными гаммапатиями называют увеличение концентрации моноклонального парапротеина (М-протеина) в плазме крови или моче. Чаще всего увеличивается концентрация IgG, следом по частоте возникновения идет повышение IgA, IgM или IgD. При отсутствии заболевания, лежащего в основе такого роста концентрации иммуноглобулинов, говорят о моноклональной гаммапатии неясного генеза (МГНГ, monoclonal gammopathy of undetermined significance, MGUS), что служит окончательным диагнозом, не является (пока что) признаком злокачественного заболевания и поэтому не требует лечения.
Вероятность возникновения МГНГ-заболеваний увеличивается с каждым годом жизни человека. Заболеваемость среди людей старше 50 лет составляет 1–3 %, а среди 85-летних — до 7,5 %. Мужчины заболевают немного чаще женщин. В настоящее время проводятся многочисленные исследования по выявлению причин возникновения моноклональных гаммапатий (рис. 1).
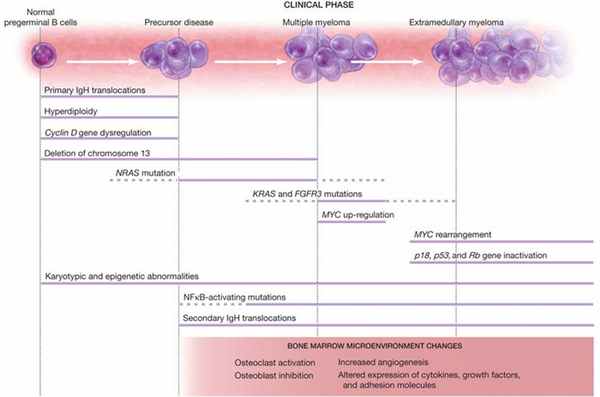
Рисунок 1 | Причины возникновения моноклональных гаммапатий
Их злокачественная трансформация может быть связана со многими патологическими процессами. При этом не все из представленных выше причин считаются обязательными для озлокачествления МГНГ. Например, гипердиплоидия клеток встречается только в 50 % случаев. Как можно увидеть на изображении, если такая трансформация происходит, то она остается на протяжении всего заболевания.
На ранних этапах особую роль играют транслокации IgH — обычно t(4;14), t(14;16), t(6;14), t(11;14) и t(14;20) — и гипердиплоидия клеток. Одна из этих трансформаций чаще всего встречается в комбинации с делецией 13-й хромосомы. В 80–90 % случаев делеция происходит при транслокации IgH t(4;14), t(14;16) и t(14;20). Также часто происходит дисрегуляция в гене циклина D. Активирующие мутации в системах NRAS и KRAS наблюдаются в 15 % случаев множественной миеломы; NRAS-мутации при этом больше характерны для МГНГ.
Постоянная активация ядерного фактора (nuclear factor κB — NFκB) является мутацией, приводящей к прогрессии заболевания; также причиной этому может стать инактивация или делеция генов, кодирующих белки p53 и p18, что чаще всего происходит в случаях внутрикостной и экстрамедуллярной множественной миеломы. Зависимость клеток от микроокружения костного мозга определяется стадией заболевания. Экстрамедуллярные опухолевые клетки, в свою очередь, приобрели в процессе мутаций свойства, делающие их независимыми от микроокружения опухоли.
Предполагается, что изменения в составе костного мозга происходят еще до возникновения гаммаглобулинемии. В предыдущих исследованиях ученым удалось доказать, что иммунная система способна распознавать нарушения гомеостаза еще на ранних стадиях, что приводит к снижению риска прогрессии заболевания. Иммуномодуляторы, такие как леналидомид и помалидомид, используемые при терапии множественной миеломы, способны предотвращать злокачественную трансформацию.
Считается, что в патологических процессах, предшествующих развитию МГНГ, принимают участие так называемые врожденные лимфатические клетки (innate lymphoid cells — ILCs). Им приписывают участие в регуляции различных процессов, в том числе аутоиммунных, защите от патогенов, поддержании тканевого гомеостаза. ILC1 способны вырабатывать большое количество Ikzf316 — белка, связывающего ДНК, что играет роль в злокачественных процессах, делая эти клетки возможной мишенью для терапии. Ученым удалось обнаружить, что у больных МГНГ количество этих клеток в костном мозге действительно увеличивается, что нельзя сказать о циркулирующей фракции этих клеток.
Диагностика МГНГ
Для диагностики МГНГ в первую очередь проводят сбор анамнеза и осмотр больного: могут быть жалобы на костные боли, частые инфекционные заболевания, симптомы анемии, пенящуюся мочу (признак протеинурии), отеки конечностей, симптомы и признаки сердечной недостаточности.
После этого начинается клиническое обследование с использованием лабораторных методов исследования. В плазме крови определяют концентрацию общего белка, альбумина, креатинина, мочевины, натрия, калия и кальция, а также проводят качественный анализ крови и мочи на иммуноглобулины IgG, IgA, IgM и свободные легкие цепи κ и λ.
Важно провести дифференциальную диагностику МГНГ с множественной миеломой, AL-амилоидозом, макроглобулинемией Вальденстрема, неходжкинскими лимфомами и солитарной плазмоцитомой. Необходимо учитывать, что при ВИЧ-инфекции и гепатите С также встречается криоглобулинемия. Похожая клиническая картина может быть у некоторых аутоиммунных заболеваний, цитомегаловирусной инфекции и лейшманиозов.
Для постановки диагноза необходимо определить в сыворотке крови наличие моноклонального пика (М-градиента) бета- или гамма-фракций глобулинов при одновременном уменьшении или отсутствии других глобулиновых фракций. После электрофореза проводится иммунофиксация иммуноглобулинов в сыворотке крови — количественный анализ посредством их инкубации с антителами, направленными против них самих (определяется количество IgG, IgA, IgM и κ- или λ-легких цепей, а также их соотношение).
Для диагностики также важно количественное определение иммуноглобулинов и их цепей в моче. Патологические низкомолекулярные белки из моноклональных легких цепей иммуноглобулинов (например, κ- или λ-цепей), которые в избыточном количестве продуцируются плазматическими клетками и выводятся почками, называются белками Бенс-Джонса и служат маркером многих иммунологических заболеваний, в том числе множественной миеломы.
Обычно проводят определение только вышеуказанных иммуноглобулинов и их частей, но при неоднозначных результатах можно выполнить анализ с помощью анти-IgD и анти-IgE антител. Количественный анализ проводится с помощью нефелометрического метода.
В противном случае рекомендуется проведение следующих дополнительных диагностических процедур:
- количественное определение протеинов и легких цепей Ig в суточной моче;
- определение β2-микроглобулина и ЛДГ (LDH) в плазме крови;
- пункция костного мозга, цитологическое и гистологическое исследование полученного аспирата, цитогенетическое исследование клеток методом проточной цитометрии;
- при наличии симптомов со стороны органов и тканей — биопсия;
- рентгенологическая диагностика в соответствии с парижской схемой (череп, позвоночник, таз, длинные кости конечностей, грудная клетка в двух проекциях). Альтернативой является проведение остео-КТ без использования контрастных веществ (преимущества: оценка стабильности, высокое разрешение). Возможно проведение МРТ (особенно при солитарной плазмоцитоме или поражении мягких тканей при множественной миеломной болезни);
- ЭХО-КГ с целью исключения кардиального амилоидоза.
Диагноз МГНГ впервые был предложен International Myeloma Working Group (IMWG) в 2015 году. Тогда же были определены следующие критерии для его постановки:
Моноклональная гаммапатия неясного генеза (МГНГ)
Моноклональная гаммапатия неясного генеза (МГНГ) характеризуется продукцией М-протеина неопухолевыми плазматическими клетками при отсутствии других признаков, типичных для множественной миеломы.
Частота встречаемости моноклональной гаммапатии неясного генеза (МГНГ) повышается с возрастом (от 1% среди лиц до 25 лет до > 5% среди лиц старше 70 лет). МГНГ может быть ассоциирована с другими заболеваниями (см. таблицу Классификация плазмоклеточных заболеваний Классификация плазмоклеточных заболеваний ), при которых антитела синтезируют большое количество М-протеинов (моноклональных иммуноглобулиновых белков, которые могут состоять из тяжелых и легких цепей, или только из легких цепей) в ответ на длительное антигенное воздействие.
МГНГ обычно протекает бессимптомно, но может развиться периферическая нейропатия, и повышен риск чрезмерной потери костной массы и развития переломов. Хотя чаще всего заболевание изначально имеет доброкачественный характер, наблюдается до 25% случаев (1%/год) его прогрессирования с развитием миеломы Множественная миелома Множественная миелома является злокачественной плазмоклеточной опухолью, продуцирующей моноклональные иммуноглобулины, которые внедряются в прилежащую костную ткань и разрушают ее. К характерным. Прочитайте дополнительные сведения или лимфомы Обзор лимфомы (Overview of Lymphoma) Лимфомы представляют собой гетерогенную группу заболеваний, происходящих из клеток ретикулоэндотелиальной и лимфатической системы. Основные варианты лимфом – лимфома Ходжкина и неходжкинские. Прочитайте дополнительные сведения .
Подозрение на МГНГ, как правило, возникает при случайном выявлении М-протеина в крови или моче во время рутинного обследования. Характерен низкий уровень М-протеина в сыворотке крови ( 3 г/дл) или в моче ( 200 мг/24 часа). Дифференциальная диагностика с злокачественными плазмоклеточными заболеваниями основана на сохранении низкого уровня М-протеина, отсутствии литических костных поражений, анемии, почечной дисфункции. Из-за риска развития переломов, исходно необходимо обследовать кости скелета (т.е. провести обзорную рентгенографию черепа, длинных трубчатых костей, позвоночника, костей таза, ребер) и денситометрию. Для костного мозга характерен легкий плазмоцитоз ( 10% ядерных клеток).
Официально рекомендованное противоопухолевое лечение отсутствует. Тем не менее, современные исследования свидетельствуют о том, что у пациентов с МГНГ, ассоциированной с потерей костной ткани (остеопения или остеопороз Остеопороз Остеопороз – прогрессирующее метаболическое заболевание кости, при котором происходит снижение ее минерализации (массы костной ткани на единицу объема), сопровождающееся нарушением ее структуры. Прочитайте дополнительные сведения , которым проводят ежемесячное лечение. Каждые 6-12 месяцев необходимо проводить клиническое обследование и электрофорез белков сыворотки и мочи, чтобы выявить прогрессирование заболевания.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Читайте также:
