Морфология эпителия кишечника при лучевой болезни. Кишечная смерть и синдром
Добавил пользователь Дмитрий К. Обновлено: 23.01.2026
Морфология эпителия кишечника при лучевой болезни. Кишечная смерть и синдром
В течение первых суток после облучения ворсины бывают покрыты эпителиальными клетками, которые перед облучением были уже зрелыми. Затем такие клетки заменяются клетками, бывшими в момент облучения в стадии деления. Позже появляются клетки, возникшие уже в момент облучения (W-клетки). Они отличаются очень большим ядром, увеличенным соотношением РНК/ДНК в результате накопления РНК в их цитоплазме.
При облучении в дозах, превышающих 1500 Р, фаза абортивного восстановления эпителия сменяется прогрессивным слущиванием W-клсток и обнажением ворсинок, что приводит к гибели организма от обезвоживания и потери электролитов [Лебедева Г. А., 1972; Daburon F. et ai., 1972], хотя, по данным J. Gits, G. Gerber (1973), причиной гибели животных при желудочно-кишечном синдроме является не только потеря электролитов, но и интоксикация. Например, хорошо известно, что перевязка общего желчного протока предотвращает гибель облученных животных от кишечного синдрома.
При меньших дозах облучения W-клетки сохраняются на ворсинках более длительное время и отторгаются постепенно. В этих случаях смерть облученного организма происходит на 5—7-е сутки от бактериемии, обусловленной кишечной флорой.
Принято считать, что морфологические изменения кишечного эпителия, возникающие в течение первых суток после облучения в дозах более 1 крад, являются результатом непосредственного влияния ионизирующего излучения на клетки и другие структурные элементы желудочно-кишечного тракта. Однако исследования «а субклеточном уровне позволяют высказать предположение, что раннее повреждение эпителия и время радиационного блока пролиферирующих клеток крипт зависит от ультраструктурных изменений, возникающих в капиллярах, расположенных непосредственно под эпителиальным покровом ворсинок, и в перикапиллярной соединительной ткани [Паршков Е. М., Бродский Р. А., 1975].
Вероятно, существенную роль при этом также играет накопление в соединительнотканной строме слизистой оболочки продуктов распада блуждающих элементов и других клеток [Паршков Е. М., 1977].
Так называемая кишечная смерть, по-видимому, может быть обусловлена не только ранней гибелью кишечного эпителия после облучения в больших дозах. Бактериемия, интоксикация, потеря жидкости и электролитов могут быть связаны и с рядом других, не менее грубых нарушений, возникающих обычно в кишечнике даже при равномерном облучении в минимальной смертельной дозе.
Образование язвенных дефектов слизистой оболочки на месте кровоизлияний, гибель кишечного эпителия вследствие грубого нарушения гемо- и лимфообращение в кишечной стенке и местного воздействия кишечной флоры, паралитическая непроходимость или инвагинация кишечника в результате поражения интрамурального нервного аппарата — это, по-видимому, не полный перечень причин, которые могут вызвать развитие бактериемии, всасывание из кишечника токсических продуктов, обезвоживание организма, выведение электролитов и привести организм к гибели на 2-й неделе или в более поздние сроки после облучения.
Поэтому смертельный исход при наличии кишечного синдрома не обязательно должен совпадать с фазой оголения слизистой оболочки тонкого кишечника, как это считают некоторые исследователи на основании экспериментальных данных [Горизонтов П. Д., 1971; Лебедева Г. А., 1971]. Установлено, что у мышей, облученных а дозе 1300 Р, при клинически выраженном кишечном синдроме не наблюдается гибели кишечного эпителия и оголение ворсинок [Монастырская Б. И. и др., 1978].
Морфологические изменения в слизистой оболочке кишечника могут варьировать от полного оголения ворсинок до сохранения эпителия в криптах и на поверхности ворсинок в зависимости от характера облучения. Например, при протяженном облучении у-лучами в течение 18 ч и более в суммарной дозе от 875 до 3500 Р непрерывность эпителиального покрова, как правило, сохраняется [Кознова Л. Б., Лебедева Г. А., 1978].
Все описанное выше свидетельствует о том, что понятие «кишечный синдром», по-видимому, не должно ограничиваться представлением о прогрессивном оголении слизистой оболочки тонкого кишечника. Данный вариант является только одной из форм проявления «кишечного синдрома», присущей тяжелой степени острого лучевого поражения всего организма или изолированного облучения кишечника в массивных дозах.
- Вернуться в оглавление раздела "гистология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лучевой проктит
Лучевой проктит - это воспаление прямой кишки, развивающееся на фоне радиационной терапии рака тазовых органов. Местные симптомы включают болезненность в проекции прямой кишки, слизистые, гнойные или кровянистые выделения из анального отверстия. Кроме локальных проявлений лучевой проктит может сопровождаться общими симптомами: повышением температуры тела и выраженной слабостью. Для диагностики заболевания используется общий анализ крови, ректоскопия и исследование мазка со стенки прямой кишки. Лечение заключается в проведении местных противовоспалительных процедур, назначении антибактериальной терапии, антигистаминных препаратов и витаминотерапии.
МКБ-10
Общие сведения
Лучевой проктит представляет собой неспецифический воспалительный процесс, развивающийся в слизистой оболочке прямой кишки. Основной причиной заболевания является воздействие ионизирующей радиации при проведении лучевой терапии по поводу рака органов малого таза. Лучевой проктит является наиболее распространенной формой радиационного поражения кишечника, встречающейся в клинической проктологии. Поскольку около 60% пациентов с онкопатологией органов малого таза получают лучевую терапию, распространенность поражения прямой кишки у данной группы больных очень высока: лучевой проктит диагностируют примерно у 12% лиц, получающих радиационное лечение. Основная проблема, с которой приходится сталкиваться проктологам, наблюдающим таких пациентов, это частое развитие постлучевых стриктур прямой кишки, требующих оперативного вмешательства.
Причины
Лучевой проктит всегда является осложнением радиационной терапии онкопатологии органов малого таза. Чаще всего данное состояние развивается после проведения контактной гамма-терапии рака шейки и рака тела матки с использованием изотопов тория, реже – при применении чистого радия. Также лучевой проктит может быть следствием рентгенотерапии и дистанционной гамма-терапии рака органов малого таза. Радиационное повреждение прямой кишки возникает в том случае, когда суммарная очаговая доза излучения превышает 50 Гр (это толерантная доза, при которой частота поздних осложнений составляет около 5%). Вероятность патологии напрямую коррелирует с дозой облучения: риск развития лучевого проктита возрастает до 50% уже при показателе 65 Гр.
Воздействие радиационного излучения приводит к нарушению процессов пролиферации и созревания эпителия прямой кишки, к десквамации и атрофии клеток. Развивается неспецифическое воспаление слизистой и подслизистого слоя, в процесс может быть вовлечен и мышечный слой. Спустя несколько месяцев после лучевой терапии формируется воспалительный процесс в артериолах прямой кишки, приводящий к хроническому нарушению кровообращения в данной области, трофическим изменениям и рубцовому стенозированию. Недостаточная микроциркуляция часто становится причиной некрозов, язв, которые могут осложниться кровотечением, перфорацией, формированием свищей прямой кишки.
Классификация
В зависимости от сроков развития лучевой проктит классифицируют на ранний (возникает в первые 3 месяца после радиотерапии) и поздний (возникает позднее указанного срока). По характеру морфологических изменений, происходящих в прямой кишке, различают катаральный, эрозивно-десквамативный, некротический и инфильтративно-язвенный процесс. Отдельно выделяются такие осложнения лучевого проктита, как рубцовый стеноз, ректовезикальные и ректовагинальные свищи.
Симптомы лучевого проктита
Основным проявлением ранней формы заболевания являются болезненные позывы на дефекацию. Боль носит приступообразный характер и усиливается после опорожнения кишечника. Также пациентов может беспокоить зуд и дискомфорт в области заднего прохода. Из прямой кишки зачастую выделяется слизь, что является признаком воспаления слизистой оболочки кишечника. Иногда имеют место кровянистые выделения, указывающие на тяжелое течение заболевания. Помимо местных симптомов, лучевой проктит сопровождается общими клиническими проявлениями, такими как слабость и повышение температуры тела. Все симптомы ранней формы патологии обычно регрессируют спустя несколько дней после окончания противоопухолевой терапии. Однако через определенное время лучевой проктит может рецидивировать, а клиническая симптоматика часто возвращается в прежнем объеме.
Поздние лучевые поражения кишечника развиваются примерно в 10% случаев. При этом латентный период (промежуток времени между облучением и возникновением симптоматики) может длиться от нескольких недель до 5-10 лет. Характерны постоянные боли в области прямой кишки, частый стул небольшими порциями, а также развитие стеноза с явлениями частичной непроходимости. Возможно малосимптомное течение поздней формы лучевого проктита. В таком случае заболевание проявляется наличием слизи в кале и периодическим болевым синдромом в левой подвздошной области и в проекции прямой кишки.
На фоне лучевого проктита могут развиваться различные осложнения: кишечное кровотечение, язвы и эрозии, стеноз прямой кишки. Именно стриктура кишечника считается наиболее грозным и неблагоприятным осложнением с точки зрения прогноза. Если на фоне лучевой терапии рака органов малого таза у больного появляются слизистые или кровянистые выделения из анального отверстия, сопровождающиеся тенезмами и болью в области прямой кишки, это позволяет заподозрить лучевой проктит.
Диагностика
При появлении признаков лучевого проктита на фоне проведения радиотерапии пациента сразу же направляют к врачу-проктологу. Для диагностики данного заболевания используются клинические, лабораторные и инструментальные методы. Обследование начинается с объективного осмотра и выяснения жалоб. При лучевом проктите всегда прослеживается связь с проведением лучевой терапии. Из лабораторных методов применяется общий анализ крови, в котором, как правило, отмечаются воспалительные изменения, такие как лейкоцитоз, ускорение СОЭ и палочкоядерный сдвиг влево. Лабораторные диагностические методики позволяют определить степень тяжести воспаления, но они не могут применяться непосредственно для постановки диагноза лучевого проктита.
Ключевую роль в диагностике заболевания играет эндоскопия. Наиболее простым, доступным и информативным методом считается ректороманоскопия. При проведении этого исследования врач обнаруживает покраснение, отек слизистой и гиперпродукцию слизи в прямой кишке. Кроме того, методика позволяет выявить изменения, характерные для таких осложнений, как кровотечение, абсцедирование, образование язв. Язвы, как правило, локализуются на передней стенке прямой кишки; в ряде случае они могут приводить к формированию свищей. При ректоскопии обязательно проводится биопсия слизистой оболочки прямой кишки. Она дает возможность уточнить степень тяжести воспалительных и атрофических изменений слизистой. С целью определения наличия инфекционного агента проводится бактериологическое исследование мазка из прямой кишки.
Вследствие того, что симптомы лучевого проктита имеют много общего с неспецифическим язвенным колитом, основная дифференциальная диагностика должна проводиться между этими двумя заболеваниями. В пользу проктита свидетельствует факт проведения лучевой терапии в анамнезе. Кроме того, лучевой проктит отличает наличие язв на передней стенке и в средней трети прямой кишки. В то же время, при этом заболевании крайне редко поражается задняя стенка и нижняя часть прямой кишки. При неспецифическом язвенном колите воспалительные изменения являются диффузными и поражают весь ректальный отдел кишечника. Для окончательной дифференциальной диагностики между этими двумя заболеваниями используется биопсия.
Лечение лучевого проктита
При лечении лучевого проктита важно уменьшить негативное влияние ионизирующего излучения, которое приводит к запуску лучевых реакций. Больным назначают витамин С, витамины группы В, а также антигистаминные препараты, такие как хифенадин, клемастин, лоратадин и другие. При наличии выраженного воспаления и идентификации инфекционного возбудителя проводят антибактериальную и противовоспалительную терапию (в том числе, с использованием сульфаниламидных средств, глюкокортикоидов и облепихового масла).
Местная терапия является важным компонентом комплексного лечения лучевого проктита. Данный вид помощи в первую очередь предусматривает очищение кишечника и ликвидацию локальных воспалительных процессов: в период обострения пациентам показаны клизмы с раствором колларгола или отваром ромашки. Эффективными считаются масляные микроклизмы на основе рыбьего жира или винилина. Эти процедуры проводят после использования слабительных средств или очистительных клизм. Хороший эффект при лечении лучевого проктита дает теплый душ в области прямой кишки или сидячие ванны с использованием перманганата калия. Также целесообразно местное лечение глюкокортикостероидами, ректальными суппозиториями с месалазином и анестетиками.
В комплексной терапии лучевого проктита важную роль играет правильное питание. Диета при данном заболевании предусматривает полное исключение острой, соленой и кислой пищи, а также алкоголя, ограничение растительной пищи и сладких продуктов. Пищевой рацион при лучевом проктите должен содержать нежирное мясо, супы на бульонах без жира и кисломолочные продукты. Если симптомы заболевания регрессируют на фоне эффективного лечения, то диета может быть расширена. При развитии осложнений, таких как формирование свищей и сужений кишечника, используются хирургические методы лечения, в том числе реконструктивные вмешательства на прямой кишке.
Прогноз и профилактика
При лучевом проктите прогноз в основном благоприятный. Тяжелое течение патологии отмечается при сочетании поражения нескольких отделов кишечника, развитии осложнений в виде свищей, кровотечений. Своевременное комплексное лечение позволяет уменьшить вероятность возникновения обострений. Профилактика лучевого проктита заключается в использовании современных методик и протоколов лечения онкозаболеваний органов малого таза, которые оказывают меньший негативный эффект на здоровые ткани.
1. Лучевые ректиты при комплексном лечении рака органов малого таза (обзор литературы) / Клименко К.А., Цаллагова З.С. // Вестник Российского научного центра рентгенорадиологии Минздрава России - 2014-
2. Лучевые повреждения прямой кишки и мочевого пузыря у больных раком шейки матки / Жариков Г.М., Винокуров В.Л., Заикин Г.В. // Мир медицины - 2000 - №7-8
3. Радиационные (лучевые) поражения кишечника / Бурковская В.А. // Гастроэнтерология Санкт-Петербурга - 2013 - №3-4
Лучевой энтероколит
Лучевой энтероколит — это воспалительное поражение кишечника, связанное с радиационными воздействиями. Проявляется диареей, запорами, другими диспепсическими явлениями, патологическими примесями в кале, болями в животе, снижением веса, астенией. Диагностируется с помощью рентгеноконтрастного исследования тонкой, толстой кишки, колоноскопии, копрограммы, дыхательных тестов. Для лечения используют кортикостероиды, препараты 5-АМК, прокинетики, ингибиторы опиатных рецепторов, анионообменные смолы, антибиотики, пробиотики, ферментные средства, регенеранты в сочетании с диетотерапией. Оперативное лечение проводится при возникновении хирургических осложнений.
Впервые характерные изменения кишечника после проведенной радиотерапии злокачественного новообразования были описаны в 1917 г. К.Францем и Дж.Ортом. По мере расширения показаний к проведению лучевой терапии, как радикального и паллиативного метода лечения онкологических заболеваний, совершенствования применяемых методик, число пациентов, получающих радиотерапию, увеличилось до 60% всех онкобольных. По результатам наблюдений специалистов в сфере практической проктологии, гастроэнтерологии и онкологии, у 3-17% больных, получивших радиационную нагрузку, развиваются ранние (острые) и поздние (хронические) формы лучевого энтероколита. Неятрогенное повреждение кишечника ионизирующими излучениями в настоящее время фиксируется крайне редко.
Причины лучевого энтероколита
Пострадиационное воспаление кишечника обычно развивается у пациентов, принимающих радиотерапию по поводу злокачественных новообразований брюшной полости, забрюшинного пространства, малого таза. Прямое повреждающее воздействие на различные участки тонкой и толстой кишки возникает вследствие лучевого лечения рака желудка, поджелудочной железы, шейки матки, яичников, предстательной железы, яичек, мочевого пузыря, прямой кишки, почечных карцином, опухолей надпочечников, ретроперитонеальных лимфом и пораженных метастазами лимфоузлов. Радиационная толерантность тонкого кишечника достигает 35 Гр, толстого — 40 Гр. При более высокой лучевой нагрузке наступают отсроченные патологические изменения. Острая обратимая реакция в процессе терапии ионизирующим излучением может развиться и при меньших дозах.
Вероятность возникновения радиационного энтероколита повышается при наличии воспалительных заболеваний кишечника, послеоперационных спаек, ограничивающих подвижность петель тонкой кишки, у лиц пожилого возраста, пациентов, которым назначена химиотерапия. Дополнительными факторами риска являются сопутствующие заболевания (артериальная гипертензия, сахарный диабет), астеническое телосложение, использование устаревшей радиационной техники, неправильный расчет лучевой нагрузки, несоблюдение техники облучения. Развитие клиники радиационного энтероколита возможно в рамках острой лучевой болезни при равномерном внешнем облучении дозой более 20 Гр во время ядерных катастроф, при халатном отношении к технике безопасности во время работы с источниками ионизирующих излучений.
Патогенез
Механизм развития лучевого энтероколита зависит от времени возникновения заболевания. Раннее радиационное поражение, возникающее непосредственно в процессе радиотерапии или в течение первых трех месяцев после курса лечения, основано на цитотоксическом действии ионизирующего излучения. Десквамация, преходящая атрофия, гибель энтероцитов и колоноцитов сочетаются с неспецифической воспалительной реакцией. Укорочение ворсинок, отек, гиперемия, выраженная нейтрофильная инфильтрация собственной пластинки кишки нарушают пристеночное пищеварение, процессы расщепления нутриентов, всасывания воды, усиливают или угнетают перистальтику кишечника. Благодаря быстрому делению оставшихся эпителиальных клеток слизистая кишки полностью восстанавливается, явления энтероколита купируются.
При сверхвысоких дозах лучевой нагрузки развиваются стойкие поздние поражения, обусловленные патоморфологическими изменениями мелких подслизистых сосудов. Нарушение кровообращения в кишечной стенке, вызванное микротромбированием и гиалинозом артериол, приводит к развитию хронической ишемии и связанной с ней гипорегенераторной атрофии кишечных эпителиоцитов. При значительном истончении слизистой уплощается ее рельеф, повышается кишечная проницаемость, замедляется моторика, нарушается абсорбция основных питательных веществ, желчных кислот, возникают участки язв и эрозий, в тяжелых случаях происходит некротическая деструкция. Ситуацию усугубляет гипоксический реактивный фиброз мышечного слоя, осложняющийся рубцовым стенозированием просвета кишечника.
Систематизация форм лучевого энтероколита учитывает время возникновения расстройства, выраженность и локализацию патоморфологических изменений кишечной стенки. Такой подход позволяет более точно спрогнозировать исход и подобрать адекватное лечение. Выделяют следующие варианты лучевого повреждения кишечника:
- По времени возникновения: ранние и поздние поражения кишечника. Острые формы лучевого воспаления возникают во время курса радиотерапии или на протяжении 3 месяцев после завершения лечения. В большинстве случаев они полностью обратимы. Для позднего лучевого повреждения, развивающегося спустя 4 и более месяцев после облучения, характерны хроническое течение, выраженные деструктивные изменения кишечника, менее благоприятный прогноз.
- По характеру патологических изменений: при оценке варианта энтероколита учитывается глубина повреждения кишечной стенки. Наиболее легкой формой является поверхностное катаральное воспаление. Для эрозивно-десквамативного и инфильтративно-язвенного лучевого воспалительного процесса, часто осложняющегося кишечными кровотечениями, характерен дефект слизистой вследствие полной атрофии эпителиоцитов. Самым тяжелым считается некротическое воспаление.
- По локализации воспаления: радиационный энтерит, колит. Хотя тонкая кишка более чувствительна к лучевой нагрузке, благодаря высокой мобильности она реже подвергается повреждению. Однако энтериты протекают тяжелее, чем колиты, и соответственно имеют более серьезный прогноз. При воспалении толстой кишки чаще возникают осложнения, требующие хирургического лечения. Заболевание протекает более тяжело при поражении обоих отделов кишечника.
Симптомы лучевого энтероколита
Клиническая картина острой формы заболевания сходна с признаками кишечного воспаления инфекционной этиологии. У пациентов наблюдается тошнота и рвота, потеря аппетита, учащенный стул с примесями слизи, боли в животе различной локализации. Значительное нарушение всасывания жиров проявляется выделением зловонных каловых масс светлого цвета с жирным блеском. При прогрессировании лучевой воспалительной реакции боли усиливаются, могут присоединяться ложные болезненные позывы к дефекации, в кале появляется кровь. Поздние радиационные энтероколиты характеризуются дискомфортом и умеренными болями в левой подвздошной области, других участках живота, чередованием запоров и диареи, потерей массы тела. Отмечаются нарушения общего состояния — головные боли, головокружения, слабость, снижение трудоспособности.
Осложнения
При язвенно-некротическом варианте лучевого энтероколита возникают потери крови с калом, которые со временем провоцируют формирование тяжелой железодефицитной анемии. Иногда развиваются профузные кровотечения, представляющие опасность для жизни больного. При лучевом энтероколите может происходить некроз всех слоев кишечной стенки, что приводит к перфорации и развитию местного или разлитого перитонита.
В случае хронического течения заболевания формируются рубцовые стриктуры, которые могут осложняться динамической или механической кишечной непроходимостью. Нарушение всасывания витаминов группы В сопровождается возникновением В12-дефицитной анемии, периферической полинейропатии. Ретиноловая недостаточность проявляется нарушением сумеречного зрения, слепотой, сухостью кожи и слизистых. При значительном недостатке эргокальциферола возможны остеопороз, кариес.
Постановка диагноза лучевого энтероколита не представляет затруднений при наличии в анамнезе сведений о радиационных воздействиях. Диагностический поиск направлен на тщательное обследование органов пищеварения с целью исключения других причин поражения кишечника. Наиболее информативными являются следующие инструментальные и лабораторные исследования:
- Рентгенологические методы. Рентгенография тонкого кишечника и ирригоскопия визуализируют признаки, характерные для лучевого поражения. Выявляются отсутствие гаустраций, сглаженность крипт слизистой, наличие язв или свищей, рубцовое сужение кишки. В сложных случаях выполняется МСКТ, МРТ брюшной полости.
- Колоноскопия. Введение эндоскопа через прямую кишку позволяет врачу осмотреть весь толстый кишечник. При энтероколите обнаруживаются очаги катарального воспаления слизистой, язвенные дефекты, точечные кровоизлияния, участки атрофии. Дополнительно выполняет биопсия кишечной стенки для гистологического анализа.
- Копрограмма. При анализе кала определяются типичные признаки лучевого воспаления: слизь, большое количество эритроцитов и лейкоцитов, примеси нейтральных жиров, непереваренных частиц пищи. Диагностика может дополняться бактериологическим посевом, который используется для выявления патогенной микрофлоры.
При хроническом воспалении с помощью мезентериальной ангиографии определяется поражение артериол, приводящее к ишемии. Для исключения других возможных причин энтероколита (непереносимости лактозы, СИБР) применяют функциональные Н2-дыхательные тесты. Для лучевого энтероколитического синдрома типично снижение количества гемоглобина и эритроцитов, микроцитоз, уменьшение содержания ретикулоцитов в клиническом анализе крови.
Дифференциальная диагностика проводится с воспалительными заболеваниями кишечника (терминальным илеитом, неспецифическим язвенным колитом), энтероколитами вирусной или бактериальной этиологии, амебиазом, целиакией, спру, первичной лактазной недостаточностью, синдромом избыточного бактериального роста (СИБР), злокачественными новообразованиями пищеварительного тракта. Кроме наблюдения у врача-проктолога или гастроэнтеролога, пациенту может потребоваться консультация онколога, радиолога, инфекциониста, гематолога, общего хирурга.
Лечение лучевого энтероколита
Терапевтическая тактика в целом напоминает схему ведения пациентов с болезнью Крона, язвенным колитом. Независимо от варианта энтероколитического лучевого синдрома, проводится коррекция питания. Больным рекомендован рацион с высоким содержанием белка (100-120 г/сут.), достаточным количеством углеводов, жиров, макро- и микроэлементов, витаминов. При тяжело протекающих поздних энтероколитах возможен перевод пациента на энтерально-зондовое и парентеральное питание. При умеренно выраженной симптоматике достаточным оказывается симптоматическое лечение. Пострадиационную диарею эффективно купируют анионообменные смолы и блокаторы опиоидных рецепторов.
Для стимуляции моторики применяют прокинетики, которые для редукции возросшего количества микроорганизмов комбинируют с нитроимидазолами и тетрациклинами. Слабительные могут назначаться при отсутствии кишечной обструкции. Чтобы стимулировать восстановление эпителия, используют нестероидные анаболики, регенеранты и репаранты. Назначение антагонистов H2-рецепторов или ингибиторов протонной помпы позволяет ускорить заживление участков с эрозиями и язвами. При нарушении процессов пищеварения показаны ферментные препараты. Для профилактика возможного дисбиоза используются пробиотики. При среднетяжелом и тяжелом течении оправдано проведение патогенетической медикаментозной терапии, включающей:
- Кортикостероиды. Противовоспалительная терапия глюкокортикоидами позволяет блокировать образование арахидоновой кислоты и некоторых других медиаторов воспаления, затормозить пролиферацию Т-хелперов, уменьшить содержание в крови моноцитов и за счет этого сократить количество тканевых макрофагов. Пациентам с энтероколитом обычно назначают прием преднизолона или метилпреднизолона.
- Производные 5-аминосалициловой кислоты. Их эффект основан на блокировании циклооксигеназного и липооксигеназного механизмов образования медиаторов воспаления — простагландинов, тромбоксанов, лейкотриенов. Лекарственные средства с 5-АСК угнетают продукции миофибробластами белка, тормозящего разрушение рубцовой ткани, что позволяет замедлить или предотвратить возникновение фиброза.
Терапевтическую резистентность тяжелого энтероколита позволяет снизить проведение гипербарической оксигенации. До 20-30% пациентов с поздним радиационным воспалением, выраженными стриктурами и стенозом нуждаются в оперативном лечении. В зависимости от ситуации проводятся сегментарная резекция тонкой кишки, энтероэнтеростомия, энтероколостомия, энтеростомия (еюностомия или илеостомия), резекции ободочной кишки, стомирование толстого кишечника, наложение различных типов толстокишечных анастомозов.
У большинства больных с острым воспалением наблюдается полное выздоровление с восстановлением целостности слизистой оболочки. У 70-80% пациентов с хроническим процессом удается добиться стойкой клинической ремиссии консервативными методами. Прогностически неблагоприятной является язвенно-некротическая форма лучевого энтероколита, которая может приводить к серьезным осложнениям и ограничению трудоспособности пациентов. Профилактика радиационных поражений кишечника заключается в индивидуальном подборе курсовой и разовой дозы облучения, соблюдении перерывов между сеансами лучевой терапии, применении радиопротекторов.
Желудок при острой лучевой болезни. Морфология желудка после облучения
Наиболее тяжелые изменения обнаруживаются в желудочно-кишечном тракте, различные отделы которого по степени поражения могут быть расположены в следующем порядке: проксимальный отдел двенадцатиперстной к тощей кишки—>дистальный отдел тонкого кишечника—>толстая кишка—>привратник желудка—>дно и тело желудка [Лебедева Г. А., 1972]. В развитии морфологических изменений желудочно-кишечного тракта можно выделить латентную фазу, фазу выраженных структурных да рушений и фазу восстановления.
В слизистой оболочке желудка очень рано наблюдается уменьшение числа митотически делящихся железистых клеток покровного эпителия , особенно слизистых клеток в шеечном отделе фундальных желез, В цитоплазме железистых клеток бывает уменьшено содержание РНК и гранул мукоидного секрета [Швейнов А. Ф., 1960], а в главных и обкладочных клетках фундальных желез обнаруживаются крупные вакуоли.
По мнению некоторых исследователей, следует различать неспецифическую и специфическую раннюю реакцию. К неспецифическим изменениям относятся признаки повышенной выработки мукоидного вещества в железистых клетках покровного эпителия к соответствующая перестройка его. Специфическая реакция проявляется в снижении митотической активности камбиальных клеток эпителия, укрупнении их ядер и появлении большого количества амитотически делящихся клеток, обеднении соединительнотканной основы слизистой оболочки блуждающими клетками и накоплении в ней нейтральных мукополисахаридов [Жукова Н. М., 1975].
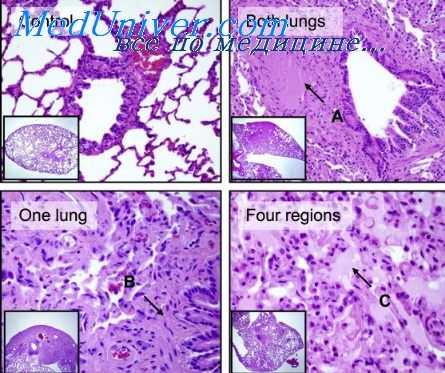
В скрытой фазе наблюдается некоторое восстановление эпителиального покрова и в то же время нарастают плазматическое пропитывание стенок кровеносных сосудов, отек стромы слизистой оболочки и других слоев стен'кн желудка, опустошение лимфатических фолликулов, изменения нервного аппарата. В конце скрытого периода типичной формы острой лучевой болезни и на высоте заболевания макроскопически, как правило, наблюдается отек слизистой оболочки желудка, множественные геморрагии на вершинах складок, преимущественно в области дна и пилорической части, образование острых язв на месте кровоизлияний.
Последние могут быть настолько распространенными к значительного размера, что в некоторых случаях служат причиной массивных смертельных кровотечений в полость желудка. Микроскопически в это время обнаруживается гибель и слущивакие железистых клеток эпителиальной выстилки, уменьшение в них гранул секрета, вакуолизация цитоплазмы и пикноз ядер, особенно в фундальных железах. Отмечается полнокровие кровеносных сосудов, плазматическое пропитывание их стенок, расширение лимфатических сосудов, отек стромы слизистой оболочки и подслизистого слоя; диапедезные кровоизлияния в них.
Большой степени достигает уменьшение количества и распад соединительнотканных клеток, опустошение лимфатических фолликулов и некробиотические изменения гладкомышечных клеток в мышечном слое слизистой оболочки и в наружной мышечной оболочке [Черных В. М., 1959]. Имеют место также реактивные изменения нервных образований в виде повышенной аргирофилии и хроматолиза [Африканова Л. А., 1952].
На месте кровоизлияний наблюдается гибель слизистой оболочки и образование острых язв, которые имеют тенденцию к распространению и углублению вследствие интенсивного аутолиза ткани и отсутствия отграничительной реакции [Краевский Н. А., 1957]. На границе очагов некроза микроскопически в этих случаях не обнаруживается признаков образования демаркационной клеточной зоны. Тем не менее в восстановительном периоде на месте язвенных дефектов можно видеть образование соединительнотканных рубцов.
Лучевая болезнь органов пищеварения. Ротовая полость и слюнные железы при лучевой болезни
В последние годы накопилось большое количество сведений, указывающих на важное значение в патогенезе и танатогенезе острой лучевой болезни изменений, возникающих в органах пищеварения и прежде всего, в желудочно-кишечном тракте. Поэтому в современных классификациях этого забо левания выделяется специально «кишечный синдром» и даже особая «кишечная» форма острой лучевой болезни.
После общего равномерного облучения в минимальной смертельной дозе в слизистой оболочке ротовой полости выраженные изменения обнаруживаются обычно в разгар заболевания. К этому времени наблюдается отек слизистой оболочки, множественные мелкие кровоизлияния и язвенные дефекты с ихорозными наложениями за счет инфицирования некротизированной ткани местной аутофлорой. Чаще всего изменения локализуются на деснах. Однако, чем тяжелее лучевое поражение и чем позже наступает смертельный исход, тем больше выражены признаки кровоточивости, обширнее зона изъязвлений слизистых оболочек и некроза.
В особенно тяжелых случаях или при неравномерном облучении с массивным воздействием на лицевую часть головы и шею могут возникнуть отек надгортанника и голосовых связок, некротически-язвенные дефекты слизистой оболочки языка и пищевода.
При микроскопическом исследовании обращает на себя внимание истончение эпителиального покрова, десквамация и гибель эпителиальных клеток, наличие некротических масс и микроорганизмов на значительных участках обнаженной слизистой оболочки. Отмечается также расширение кровеносных и лимфатических сосудов, кровоизлияния, отек и плазмоклеточная инфильтрация подслизистого слоя.
Миндалины обычно увеличены, рыхлые с грязно-зеленым налетом, а окружающие их ткани отечные, пропитаны кровью.

Микроскопически в них отмечаются гибель покровного эпителия, обширные скопления микроорганизмов в некротических массах, особенно в криптах, отек стромы, инфильтраты из плазматических клеток, резкое опустошение лимфатических фолликулов [Африканова Л. А. и др., 1973].
Как правило, наблюдаются не менее грубые нарушения и слюнных желез [Прохончуков А. А. и др., 1962; Памбучиан Г. и др., 1974], которые имеют обычно фазный характер. В раннем периоде лучевой болезни определяются признаки усиленной секреторной деятельности в виде набухания железистых клеток, увеличении в них количества гранул секрета, расширения и полнокровия кровеносных сосудов, отека межуточной ткани. В скрытом периоде и на высоте заболевания обнаруживается грубая вакуолизация цитоплазмы, полиморфизм, гиперхроматоз и пикноз ядер эпителиальных клеток, кистозное расширение концевых отделов и - протоков со скоплением в них секрета с примесью десквамированных клеток.
Причем в эпителиальных клетках, особенно концевых отделов желез, резко снижается содержание нуклеиновых кислот и общего белка и в то же время увеличивается содержание кислых и нейтральных мукополисахаридов, что, по-видимому, придает особую вязкость секрету. В, выводных протоках аналогичные изменения выявляются позже н бывают менее значительными, чем в секреторных отделах. В межуточной ткани наблюдаются отек, разволокнение и набухание коллагеновых волокон, плазматическое пропитывание стенок кровеносных сосудов. В восстановительном периоде лучевой болезни обычно появляются признаки регенерации слюнных желез.
Читайте также:
- Механизмы действия анестетиков. Холенцефалическое действие анестезии
- Подготовка к гистерорезектоскопии. Психопрофилактика перед гистерорезектоскопией
- Кинины. Лейкотриены. Простагландины. Белки острой фазы воспаления. Цитокины. Реакции воспаления. Патогенез воспаления.
- Идентификация психической боли. Лечение психогенной патологии
- Осложнения приема блокаторов рецепторов ангиотензина. Блокаторы бета-адренорецепторов
