Осложнения приема блокаторов рецепторов ангиотензина. Блокаторы бета-адренорецепторов
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Для цитирования: Маколкин В.И. Клинические аспекты применения блокаторов рецепторов ангиотензина II. РМЖ. 2004;5:347.
ММА имени И.М. Сеченова
И зучение в последнее десятилетие различных систем нейрогормональной регуляции сердечно–сосудистой системы позволило создать достаточно эффективные лекарственные препараты. Из всего массива выполненных исследований особенно следует выделить работы, дающие представление о функционировании ренин–ангиотензин–альдостероновой системы (РААС). Выявление роли ангиотензина II (AT II) и средств, снижающих его активность, открыло новые горизонты в лечении артериальной гипертензии (АГ) и хронической сердечной недостаточности (ХСН).
Как известно, ангиотензин II является конечным продуктом каскада реакций РААС и обладает весьма многообразными эффектами [1]. Избыточное действие АТ II на рецепторы первого типа (АТ1) вызывает негативные сдвиги во многих органах и системах, обусловливая развитие необратимых изменений в органах–мишенях. Условно можно выделить несколько видов эффектов АТ II: гемодинамические, пролиферативные и прочие. Повидимому, удельный вес перечисленных эффектов различен, тем не менее все они должны учитываться при анализе действия АТ II.
Гемодинамические эффекты заключаются в системной вазоконстрикции и росте АД, что зависит также и от стимулирующего действия АТ II на другие прессорные системы. Повышается сопротивление кровотоку преимущественно на уровне эфферентных артериол почечных клубочков, следствием чего является повышение гидравлического давления в клубочковых капиллярах. Кроме того, повышается проницаемость клубочковых капилляров (увеличение размеров клубочкового фильтра). Увеличивается сократимость миокарда.
Пролиферативные эффекты выражаются в гипертрофии и гиперплазии кардиомиоцитов, фибробластов, эндотелиальных и гладкомышечных клеток артериол, что сопровождается уменьшением их просвета. В почках происходит гипертрофия и гиперплазия мезангиальных клеток.
АТ II обусловливает высвобождение норадреналина из окончаний постганглионарных симпатических нервов, повышается активность центрального звена симпатической нервной системы. АТ II увеличивает синтез альдостерона, который вызывает задержку натрия и увеличение экскреции калия. Увеличивается также высвобождение вазопрессина, что ведет к задержке в организме воды. Существенно, что АТ II ингибирует активатор плазминогена и способствует высобождению мощнейшего прессорного агента – эндотелина I. Указывают и на цитотоксическое действие на миокард, и, в частности, увеличение образования супероксид–аниона, который может окислять липиды и инактивировать оксид азота. Таким образом, спектр действия АТ II весьма многообразен, в связи с чем возможности снижения его действия в организме (естественно, при повышенном образовании этой субстанции) имеют исключительно большое значение.
Известны два типа воздействия на АТ II – снижение образования этой субстанции с помощью ангиотензинпревращающего фермента (иАПФ) и блокада рецепторов к АТ II.
Снижение образования АТ II с помощью ингибиторов АПФ (иАПФ) нашло широкое применение в практике, однако эта возможность не затрагивает неАПФ–зависимые пути образования АТ II и является неполной. Кроме того, неселективно ослабляется действие АТ II на все типы рецепторов к этой субстанции. В частности, уменьшается действие АТ II на рецепторы АТ2 (рецепторы второго типа), через которые осуществляются совсем иные свойства АТ II (антипролиферативные и вазодилатирующие), оказывающие блокирующее действие в отношении патологического ремоделирования органов–мишеней. Как известно, выделяется несколько типов рецепторов к АТ II, значение которых ясно не до конца. Так, через рецепторы четвертого типа (АТ4) осуществляется влияние некоторых продуктов распада АТ II (ангиотензина 3–8) на процессы тромбообразования.
Известно, что при длительном применении иАПФ (как, впрочем, и иных антигипертензивных препаратов) возникает эффект «ускользания», выражающийся в снижении его действия на нейрогормоны (восстанавливается синтез альдостерона и ангиотензина), так как постепенно начинает активизироваться не АПФ–зависимый путь образования АТ II.
Другой путь снижения действия АТ II – селективная блокада рецепторов АТ1, что также стимулирует АТ2–рецепторы, при этом отсутствует действие на калликреин–кининовую систему (потенцирование действия которой определяет часть положительных эффектов иАПФ). Таким образом, если иАПФ осуществляют неселективную блокаду негативного действия АТ II, то блокаторы рецепторов АТ II (БРА II) осуществляют селективную (полную) блокаду действия АТ II на АТ1–рецепторы .
Кроме того, этот класс препаратов обладает высокой безопасностью, количество побочных эффектов вполне сравнимо с плацебо.
В настоящее время насчитывается по меньшей мере восемь препаратов данной группы: лозартан, валсартан, ирбесартан, кандесартан, телмисартан, эпросартан,тазосартан, олмесартан. В России наибольшее распространение получили первые шесть препаратов, в особенности валсартан (Диован) и лозартан. Валсартан более селективен, нежели лозартан (так если у лозартана сродство к рецепторам АТ1 в 3000 раз выше, чем к АТ2 рецепторам, то у валсартана показатель АТ1–селективности составляет 20000:1). Пик концентрации препарата в крови наступает через 2–4 ч после приема внутрь. Валсартан не вмешивается в метаболизм других антигипертензивных препаратов.
Данные многоцентровых исследований, а также отдельные небольшие исследования показали высокую эффективность препаратов этой группы при артериальной гипертонии (АГ), хронической сердечной недостаточности (ХСН), почечной патологии и некоторых других заболеваниях.
Эта группа препаратов вошла в международные и отечественные рекомендации по лечению АГ. Эксперты ВОЗ и Международного общества по изучению гипертонии относят БРА II к антигипертензивным препаратам первого ряда, которые пригодны для длительного лечения.
F.H. Messerly [2] объясняет антигипертензивный эффект БРА II по меньшей мере семью механизмами:
- ингибированием прямого вазоконстрикторного действия АТ II;
- снижением активности симпатической нервной системы;
- снижением канальцевой реабсорбции натрия;
- снижением выработки альдостерона;
- снижением активности РАС в мозгу;
- стимуляцией простациклина;
- антипролиферативным действием (обратное развитие ремоделированных сосудов).
Важным свойством различных антигипертензивных препаратов является возможность влиять на обратное развитие гипертрофии левого желудочка. Это в полной мере относится к препаратам рассматриваемой группы. Так, в исследовании LIFE убедительно продемонстрирована большая степень уменьшения гипертрофии левого желудочка при использовании БРА II (лозартана), нежели при назначении атенолола (при этом уровни снижения АД были вполне сравнимы).
БРА II вошли в Европейские и отечественные рекомендации по лечению хронической сердечной недостаточности (ХСН). В экспериментальных работах [8,9,10] показано благоприятное действие валсартана на гемодинамические параметры животных, у которых вызывалась острая или хроническая сердечная недостаточность. Недавно были завершены масштабные международные исследования, посвященные влиянию валсартана на общую смертность и развитие осложнений у больных ХСН (Val–HeFT) и больных острым инфарктом миокарда (VALIANT).
Преимущества валсартана особенно видны у больных, по тем или иным причинам не получавших иАПФ (снижение риска общей смертности составило 33,1%, снижение риска смертности и заболеваемости – 56,4%). Интересно отметить, что если больные получали b -адреноблокаторы, то различия в частоте госпитализаций не было, тогда как в группе больных, не получавших b -адреноблокаторы, частота госпитализаций снизилась на 26,3%.
Переносимость валсартана была хорошей. Частота случаев отмены исследуемой терапии в связи с нежелательными явлениями составила 9,9% в группе валсартана и – 7,2% в группе плацебо.
В исследовании VALIANT изучали эффект валсартана у больных острым инфарктом миокарда (ОИМ), осложненным сердечной недостаточностью и/или систолической дисфункцией левого желудочка. Всего в исследование было включено 14703 больных. Средний возраст 64,8 года. Исходными характеристиками были следующие: сниженная фракция выброса (35,3%), тромболизис (35,2%) и чрескожная балонная дилатация коронарных артерий (14,8%); АГ – 55,2%, сахарный диабет – 23,1%. Базовая терапия включала ацетилсалициловую кислоту (91,3%), иАПФ (39,6%), которые затем исключались при проведении рандомизации, b -адреноблокаторы (70,4%), диуретики (50,3%), статины (34,1%). Больные были рандомизированы в три группы: 4909 больных получали каптоприл в дозе 50 мг три раза в день, 4909 больных получали валсартан 160 мг два раза в день, 4885 больных получали каптоприл 150 мг и 160 мг валсартана. Первичная точка – все случаи смерти, вторичная точка – сердечно–сосудистая смерть , инфаркт миокарда, сердечная недостаточность. После наблюдения 36 мес. не было отмечено статистически значимых различий смертности во всех трех сравниваемых группах, точно так же не было различий в сердечно–сосудистой смертности, повторном инфаркте миокарда или появлении сердечной недостаточности. Побочные эффекты встречались существенно реже при приеме валсартана, нежели каптоприла, однако при комбинации этих препаратов частота побочных эффектов была выше. Исследование VALIANT убедительно доказало, что валсартан так же эффективен, как ингибитор АПФ каптоприл, в сохранении жизни больных острым инфарктом миокарда с высоким риском сердечно–сосудистых осложнений.
Еще один аспект благоприятного действия БРА II – влияние на поражение почек у больных сахарным диабетом. Так, еще в 1997 г. в мета–анализе [11], включающем 1594 больных (10 исследований) было показано, что БРА II более эффективно, нежели другие антигипертензивные средства, снижают вероятность развития терминальной почечной недостаточности при недиабетических поражениях почек. Показано, что назначение препаратов этой группы снижает протеинурию на 29–46% у больных гипертонической болезнью с клиническими признаками поражения почек [12]. В большом исследовании RENAAL было показано, что назначение лозартана больным сахарным диабетом 2 типа с нефропатией достоверно снижает риск развития терминальной почечной недостаточности в среднем на 28%. В проводимом рандомизированном исследовании ABCD–2V оценивается влияние валсартана на течение и исходы диабетической нефропатии у 772 больных сахарным диабетом 2 типа. В частности, сравнивается влияние умеренного и интенсивного контроля за величиной АД на такие исходы, как удвоение исходных уровней креатинина, развитие терминальной почечной недостаточности или смерть больного. Интенсивный контроль предполагает уровень АДдиаст равный 75 мм рт.ст., умеренный – 80–89 мм рт.ст.
В недавно закончившемся исследовании MARVAL [13] изучалось влияние валсартана на микроальбуминурию у больных сахарным диабетом 2 типа. В течение 24 недель 169 пациентов получали валсартан в дозе 80 мг/сут, 163 больных получали амлодипин в дозе 5 мг/сут. АГ у больных, получавших валсартан, отмечена в 63,3%, в группе амлодипина – 66,8%. Целевым АД было 135/85 мм рт.ст.; если оно не достигалось указанным лекарственным режимом, то добавляли диуретик (бендрофлуазид) или a–блокатор (доксазозин).
Альбуминурия в группе больных, получавших валсартан, после 24 недель лечения, снизилась на 44%, тогда как в группе, получавшей амлодипин, этот показатель составил 8% (p<0,001). Нормоальбуминурия была достигнута в 29,9% в группе валсартана против 14,5% в группе амлодипина (p=0,001). Следует отметить, что степень снижения АД в обеих группах была одинаковой.
Хотя с момента создания данного класса препаратов прошел сравнительно небольшой срок, тем не меннее, очевидно, что клиницисты получили в свои руки весьма действенные средства лечения АГ и ХСН. Дальнейшие исследования более точно определят «нишу» препаратов этого класса среди «океана» кардиологических средств.
1. Сидоренко Б.А., Преображенский Д.В. Блокаторы АТ1 –ангиотензиновых рецепторов. Москва, 2001, с.200.
2. 2. Messerly F.H. The ABCs of Antihypertensive Therapy. Second Edition. Lippincott Williams. 2000. p.325.
3. Conlin P.– цит. По Сидоренко Б.А., Преображенский Д.В. 2001.
4. Neutel J.,Weber M.,Pool J. et al. Valsartan, a new angiotensin II antagonist: antihypertensive effects over 24 hours.Clin.Ther. 1997; 19: 447–458.
5. Bremner AD, Baur M, Oddou–Stock P, et al. Valsartan: Long–term efficacy andtolerability compared to lisinopril in elderly patients with essential hypertension. Clin.Exp.Hypertens. 1997.
6. Mann J, Julius S. The Valsartan Antihypertensive Long–term Use Evaluation trial of cardiovascular events in hypertension. Blood Press 1998; 7:176–183.
7. Corea I, Cardoni O, Fogari R et al. Valsartan, a new angiotensin II antagonist for the treatment of essential hypertension: a comparative study of the efficacy and safety against amlodipine. Clin.Pharmacol. Ther. 1996; 60:341–346.
8, 9,10. цит. по Messerli F.H. 2000.
11. Giatras I, Lau J, Levey AS. Effect of ACE inhibitors on the progression of nondiabetic renal disease: a meta–analysis of randomized trials. Ann.Intern.Med. 1997; 127: 337–345.
12. Gansevoort RT, de Zeeuw, Shahinfar S. et al. Effect of the angiotensin II antagonist losartan in hypertensive patients with renal disease. J Hypertens Suppl 1994;12:S37–S42.
13. Viberti G, Wheeldon NM. Microalbuminuria reduction with valsartan in patients with type 2 diabetes mellitus. Circulation 2002; 6:672–678.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Лечение артериальной гипертонии: в фокусе – ингибиторы ангиотензинпревращающего фермента и β–адреноблокаторы
Для цитирования: Ершова А.К. Лечение артериальной гипертонии: в фокусе – ингибиторы ангиотензинпревращающего фермента и β–адреноблокаторы. РМЖ. 2011;4:268.
Артериальная гипертония (АГ) – это синдром повышенного артериального давления (АД), наблюдаемый при гипертонической болезни и симптоматических артериальных гипертензиях. АГ как в Российской Федерации, так и во всем мире является одной из наиболее значимых медико–социальных проблем. Распространенность АГ в России крайне высока и составляет около 40% среди взрослого населения [1]. При этом у лиц, страдающих данной патологией, повышается риск возникновения таких сердечно–сосудистых заболеваний, как инфаркт миокарда и мозговой инсульт.
Необходимость снижения повышенного АД не вызывает сомнений, и этот факт был доказан во многих масштабных исследованиях: так, снижение систолического АД всего на 2 мм рт.ст. снижает риск смерти от ишемической болезни сердца (ИБС) на 7%, а смерти от мозгового инсульта на 10%, снижение же АД на 20/10 мм рт.ст. обеспечивает уменьшение сердечно–сосудистой смертности почти в 2 раза [2]!
Основной целью лечения больных АГ является адекватный контроль АД, т.е. достижение его целевого уровня, за который принимают АД Современная антигипертензивная терапия воздействует на различные системы, с помощью которых происходит регуляция АД в организме человека: симпато–адреналовую систему, ренин–ангиотензин–альдостероновую систему (РААС), обмен кальция и натрия [3]. В настоящее время рекомендованы пять основных классов препаратов:
• ингибиторы ангиотензинпревращающего фермента (АПФ);
• β–адреноблокаторы (β–АБ);
• блокаторы рецепторов AT1;
• антагонисты кальция;
• диуретики.
К дополнительным классам препаратов для комбинированной терапии относятся α–адреноблокаторы и агонисты имидазолиновых рецепторов [4].
Количество назначаемых препаратов зависит от исходной величины АД и наличия сопутствующих заболеваний. Так, например, при АГ 1 степени и отсутствии сердечно–сосудистых осложнений возможно применение монотерапии, а при АГ 2 и 3 степеней и наличии поражения органов–мишеней в большинстве случаев необходима комбинация из 2 или 3 препаратов. Возможно использование двух стратегий стартовой терапии АГ: монотерапии у больных с небольшим повышением АД и низким или средним риском и низкодозовой комбинированной терапии с последующим увеличением количества или доз лекарственного средства у больных АГ 2–3 степеней с высоким или очень высоким риском осложнений.
Согласно результатам крупных рандомизированных исследований четыре класса антигипертензивных препаратов, воздействующих на различные системы – ингибиторы АПФ, диуретики, β–АБ и блокаторы кальциевых каналов показали одинаковую эффективность в отношении снижения АД и профилактики развития сердечно–сосудистых событий. Вместе с тем в каждой конкретной клинической ситуации необходимо учитывать особенности действия различных медикаментов.
К сожалению, на практике монотерапия оказывается не всегда эффективной: в этом случае помощь оказывает комбинированная терапия АГ. Использование комбинации из двух, трех и более препаратов обладает некоторыми преимуществами, такими как: усиление антигипертензивного эффекта за счет разнонаправленного действия лекарств на патогенетические механизмы развития АГ; уменьшение частоты возникновения побочных эффектов как за счет меньших доз комбинируемых препаратов, так и за счет взаимной нейтрализации этих эффектов; обеспечение наиболее эффективной органопротекции, и уменьшение риска и числа сердечно–сосудистых осложнений [5–7].
Комбинации гипотензивных препаратов делят на рациональные (эффективные), возможные и нерациональные. К рациональным комбинациям относятся:
• ингибитор АПФ + диуретик;
• блокатор рецепторов AT + диуретик;
• ингибитор АПФ + антагонист кальция;
• блокатор рецепторов AT + антагонист кальция;
• дигидропиридиновый антагонист кальция + β–АБ;
• антагонист кальция + диуретик;
• β–АБ + диуретик;
• β–АБ + α–АБ.
К возможным комбинациям относятся сочетания:
• дигидропиридинового и недигидропиридинового антагониста кальция;
• ингибитора АПФ + β–АБ;
• блокатора рецепторов AT + β–АБ;
• ингибитора АПФ + блокатора рецепторов AT;
• α–АБ с ингибитором АПФ, блокатором рецепторов AT, антагонистом кальция, диуретиком.
К нерациональным комбинациям, при использовании которых не происходит потенцирования антигипертензивного эффекта препаратов и/или усиливаются побочные эффекты при их совместном применении, относятся сочетания разных лекарственных средств, относящихся к одному классу:
• β–АБ + недигидропиридиновый антагонист кальция;
• ингибитор АПФ + калийсберегающий диуретик;
• β–АБ + препарат центрального действия [4].
В реальной клинической практике больные АГ в большинстве случаев страдают также ИБС и/или хронической сердечной недостаточностью и применение одновременно ингибитора АПФ и β–АБ встречается очень часто. Что касается ингибиторов АПФ, то препараты этой группы являются несомненными лидерами в замедлении темпа прогрессирования поражения органов–мишеней и возможности регресса их патологических изменений. Они доказали свою эффективность в плане уменьшения выраженности гипертрофии левого желудочка, а также значимого уменьшения выраженности микроальбуминурии, протеинурии и предотвращения снижения функции почек.
Ингибиторы АПФ снижают активность РААС, нарушают превращение ангиотензина I в ангиотензин II и разрушение брадикинина до неактивных продуктов. Ангиотензин II – мощный вазопрессор, брадикинин – мощный вазодилататор. Соответственно, дефицит ангиотензина II и избыток брадикинина приводят к расширению сосудов и снижению системного артериального давления [8]. Также ингибиторы АПФ снижают активность симпато–адреналовой системы, что проявляется снижением содержания адреналина, норадреналина, вазопрессина и натрийуретического гормона. В результате всех перечисленных эффектов расширяются артерии, что ведет к снижению общего периферического сопротивления сосудов и уменьшению АД [9].
Одним из наиболее часто используемых в клинической практике иАПФ является лизиноприл. Лизиноприл выпускают в виде таблеток, назначаемых 1 раз в сутки. Это выгодно отличает его от других ингибиторов АПФ, назначаемых несколько раз в сутки. Лизиноприл поступает в организм в виде активного вещества, в то время как некоторые другие ингибиторы АПФ попадают в организм в виде пролекарства, требующего активации в печени, что недопустимо при ее патологии.
Применение лизиноприла приводит к снижению сердечно–сосудистой смертности (фатальный инсульт, инфаркт миокарда и др.) и частоты развития других осложнений артериальной гипертензии [10–12]
Таким образом, лизиноприл является одним из лучших ингибиторов АПФ, доступных на мировом рынке, и может быть рекомендован к широкому использованию в практической деятельности врача.
Другим важным аспектом в практическом применении любого антигипертензивного препарата является фармакоэкономическая характеристика, которую необходимо учитывать врачу в современных условиях. Так, максимально приемлемое соотношение цены и качества на российском фармацевтическом рынке для этого препарата демонстрирует фармацевтическая компания «Биохимик», выпускающая препарат под торговым названием «Лизиноприл» в таблетках по 5, 10 и 20 мг, что крайне удобно при подборе дозы. Следует особо подчеркнуть, что ОАО «Биохимик», является одним из ведущих производителей лекарственных средств в России, которое было основано в 1959 году. В настоящее время ОАО «Биохимик» производит более 200 наименований лекарственных средств и, что наиболее важно, здесь внедряются современные международные стандарты качества при производстве препаратов.
Также для лечения АГ широко используются β–АБ, в особенности при сочетании АГ с ИБС и/или хронической сердечной недостаточностью. β–АБ отведена особая роль в лечении сердечно–сосудистых заболеваний, т.к. они совмещают в себе антигипертензивную, антиишемическую и антиаритмическую активность [13,14]. Основной механизм действия этих препаратов заключается в блокаде адренорецепторов и подавлении активности симпато–адреналовой системы, что препятствует действию на них медиатора – норадреналина, а также циркулирующих в крови катехоламинов. Также β–блокаторы оказывают влияние на РААС, ингибируя высвобождение ренина путем блокады β1–рецепторов в юкстагломерулярном аппарате почек. β–АБ снижают частоту сердечных сокращений и оказывают антигипертензивное действие. Препараты этой группы обладают выраженной кардиопротективной активностью, что сопровождается улучшением прогноза при сердечно–сосудистых заболеваниях и увеличением продолжительности жизни [15].
В качестве примера хорошо зарекомендовавшего себя кардиоселективного β–АБ рассмотрим метопролол, выпускаемый в виде двух лекарственных форм – метопролола тартрата и метопролола сукцината (более пролонгированное действие). При лечении АГ метопрололом достигается стабильный антигипертензивный эффект, без избыточно быстрого снижения и резких колебаний АД. У пациентов с ИБС метопролол снижает количество приступов стенокардии и потребность в сублингвальном нитроглицерине, повышает толерантность к физической нагрузке [16,17].
Препарат «Метопролол», также выпускаемый фармацевтической компанией «Биохимик», является оптимальным по соотношению цена/качество. Он производится в виде таблеток по 50 и 100 мг, действующее вещество метопролола тартат, для достижения стабильного антигипертензивного эффекта эту лекарственную форму необходимо применять 2 раза в сутки (утром и вечером). Гипотензивный эффект при приеме Метопролола развивается быстро (систолическое АД снижается через 15 мин, максимально – через 2 ч) и продолжается в течение 6 ч, а диастолическое АД изменяется медленнее: стабильное снижение наблюдается после нескольких недель регулярного приема.
Таким образом, в настоящее время необходимость своевременного и постоянного лечения АГ не вызывает сомнения и комплексный подход к этой проблеме необходим не только среди пациентов и врачей, но и среди фармацевтических компаний. Благодаря ОАО «Биохимик» применение таких незаменимых гипотензивных препаратов, как Лизиноприл и Метопролол, стало доступно большинству населения.
Литература
1. Шальнова С.А., Баланова Ю.А., Константинов В.В. и др. Артериальная гипертония: распространенность, осведомленность, прием антигипертензивных препаратов и эффективность лечения среди населения Российской Федерации. РКЖ 2006; 4: 45–50.
2. Lewington S, Clarke R, Qizilbash N, et al. Prospective Studies Collaboration. Age–specific relevance of usual blood pressure to vascular mortality: a meta–analysis of individual data for one million adults in 61 prospective studies. Lancet 2002;360:1903–13.
3. Бойцов С.А. Комбинированная терапия артериальной гипертензии с позиций профилактики сердечно–сосудистых осложнений и патогенеза. Consilium Medicum 2004; Приложение, выпуск 2; 23–26.
4. Рекомендаций Российского медицинского общества по артериальной гипертонии и Всероссийского научного общества кардиологов. Диагностика и лечение артериальной гипертензии // Приложение 2 к журналу Кардиоваскулярная терапия и профилактика 2008; 7(6).
5. HanssonL, ZanchettiA, Carruthers SG, etal. Effects of intensive blood–pressure lowering and low–dose aspirin in patients with hypertension: principal results of the Hypertension Optimal Treatment (HOT) randomised trial. Lancet 1998; 351: 1755–62.
6. Чазова И.Е., Ратова Л.Г., исследователи «Клип–Аккорд». КЛИП–АККОРД: 4 года и 7796 пациентов – возможности полнодозовой комбинированной терапии артериальной гипертонии. Систгиперт 2008; 1: 4–9.
7. Чазова И.Е., Мартынюк ТВ., Колос И.П. Первые результаты Российской программы СТРАТЕГИЯ у пациентов с артериальной гипертензией: оценка эффективности Нолипрела при недостаточном контроле артериального давления. Cons med 2007; 9(5): 5–10.
8. Prabhu M., Palaian S., Malhotra A. et al. Therapeutic dimensions of ACE inhibitors – a review of literature and clinical trials // Kathmandu Univ. Med. J. – 2005. – Vol.3, №3.
9. Желнов В.В., Петровская Н.В., Комарова И.С. Ингибиторы АПФ в клинической практике // Русский медицинский журнал. – 2007. – Т. 15, №15. – С. 1135–1141.
10. Reisin E., Weir M.R., Falkner B. et al. Lisinopril versus hydrochlorothiazide in obese hypertensive patients: a multicenter placebo–controlled trial. Treatment in Obese Patients With Hypertension (TROPHY) Study Group // Hypertension. – 1997. – Vol.30, №1 (Pt. 1). – P.140–145.
11. Hansson L., Lindholm L.H., Ekbom T. et al. Randomised trial of old and new antihypertensive drugs in elderly patients: cardiovascular mortality and morbidity the Swedish Trial in Old Patients with Hypertension2 study // Lancet. – 1999. – Vol.354, №9192. – P.1751–1756.
12. Major outcomes in high–risk hypertensive patients randomized to angiotensin–converting enzyme inhibitors or calcium channel blocker vs diuretic. The Antihypertensive and Lipid–Lowering Treatment to Prevent Heart Attack Trial (ALLHAT) // Curr. Hypertens. Rep. – 2003. – Vol.5, №4. – P.293–294.
13. The Task Force on Beta–Blockers of the European Society of Cardiology. Expert consensus document on b–adrenergic receptor blockers. Eur Heart J 2004;25:1341–62.
14. Cruickshank J.M., Prichard B.N.C. Beta–adrenoreceptors. In: Cruickshank J.M., Prichard B.N.C., editors. Beta–blockers in clinical practice. London: Churchill Livingstone; 1996 – p. 9–86.
15. Levine HJ. Rest heart rate and life expectancy. J am coll cardiol 1997;30:1104–1106.
16. Egstrup et al. The antianginal efficacy and tolerability of controlled–release metoprolol once daily: a comparison with conventional metoprolol tablets twice daily. J Clin Pharmacol 1988; 33.
17. Остроумова О.Д., Рыкова А.М. и др. Выбор антигипертензивных препаратов у больных с сочетанием артериальной гипертензии и ишемической болезни сердца: фокус на b–блокаторы. Consilium Medicum 2007; 9 (5).
Осложнения приема блокаторов рецепторов ангиотензина. Блокаторы бета-адренорецепторов
Осложнения приема ингибиторов АПФ. Блокаторы рецепторов ангиотензина
Большинство побочных эффектов от приема ИАПФ связано с подавлением РАС. Снижение АД и легкую азотемию, часто наблюдаемые во время лечения, пациенты переносят в целом хорошо, и снижение дозировки ИАПФ не требуется. Однако, если гипотензия сопровождается головокружением или усиливается дисфункция почек, необходимо снизить дозу диуретика при отсутствии значительной задержки жидкости, а в противном случае снизить дозу ИАПФ.
Задержка калия также может быть проблемой, если пациент принимает калиевые добавки или калийсберегающий диуретик. Если задержка калия сохраняется несмотря на принятые меры, можем' потребоваться снижение дозы ИАПФ.
К побочным эффектам ИАПФ, связанным с потенцированием кининов, относятся непродуктивный кашель (10-15% пациентов) и отек Квинке (1% пациентов). Если пациент не переносит ИАПФ по этим причинам, рекомендуется назначить БРА. У пациентов с непереносимостью ИАПФ из-за гиперкалиемии или почечной недостаточности при приеме БРА, вероятно, будут присутствовать те же побочные эффекты. В этом случае рекомендуется комбинация ГИА и нитрата per os.
Блокаторы рецепторов ангиотензина
Блокаторы рецепторов ангиотензина хорошо переносят пациенты с непереносимостью ИАПФ из-за кашля, кожной сыпи и отека Квинке. Следовательно, БРА следует назначать пациентам с симптомами и без них при ФВ < 40% и не переносящим ИАПФ по другим причинам (исключая гиперкалиемию и почечную недостаточность).
Хотя ИАПФ и БРА ингибируют РАС, они обладают разными механизмами действия. ИАПФ блокирует энзимы, отвечающие за превращение AT I в AT II, а БРА блокирует действие AT II на рецепторы AT I — подтип рецепторов, отвечающий практически за все отрицательные биологические эффекты, влияющие на ремоделирование сердца и относящиеся к AT II.

Некоторые блокаторы рецепторов ангиотензина одобрены для лечения АГ и доступны для клиницистов. При СН тщательно изучали три таких препарата — лозартан, валсартан и кандесартан. Некоторые клинические исследования выявили, что БРА так же эффективно, как и ИАПФ, способствуют обратному ремоделированию ЛЖ, облегчают симптомы, предотвращают госпитализацию и продлевают жизнь пациента. Более того, некоторые исследования выявили, что добавление БРА к ИЛПФ у пациентов с ХСН обладает дополнительным терапевтическим эффектом.
Начинать применение блокаторы рецепторов ангиотензина следует с доз, указанных в справочниках, которые можно удваивать каждые 3-5 сут. Как и при приеме ИАПФ, АД, функцию почек и уровень калия следует проверять через 1-2 нед после начала лечения и повторять после изменения дозы.
У пациентов с симптомной сердечной недостаточностью, не переносящих ИАПФ, совокупные клинические данные показывают, что ВРА и ИАПФ одинаково эффективны в снижении заболеваемости и смертности от СН. В исследовании CHARM-Alternative (Candesartan in Heart Failure Assessment of Reduction in Mortality and Morbidity — Alternative) продемонстрировано, что кандесартан значительно снижает показатели ОС, смертности от сердечнососудистых причин или госпитализации с СП. Важно отметить, что кандесартан снижал показатели ОС независимо от приема ИАПФ и (3-АБ. Сходные данные были получены для валсартана, примененного у маленькой подгруппы людей, не принимавших ИАПФ, в многоцентровом исследовании Val-HeFT (Valsartan Heart Failure Trial).
Прямое сравнение ИАПФ и БРА было проведено в клиническом исследовании ELITE-II (Evaluation of Losartan in the Elderly II), в котором было отмечено, что лозартан не улучшает показатели выживаемости у пожилых пациентов с СН по сравнению с каптоприлом, но переносится значительно лучше. В двух исследованиях сравнивали ВРА с ИАПФ у пациентов с дисфункцией ЛЖ или признаками СН после ИМ. Прямое сравнение лозар-тана и каптоприла в исследовании VALIANT (Valsartan in Acute Myocardial Infarction Trial) показало, что лозартан немного улучшает показатели смертности от всех причин. Сочетание каптоприла и валсартана в этом исследовании не привело к дальнейшему снижению смертности, но число побочных эффектов возросло.
При добавлении БРА к ИАПФ в общих когортах пациентов с симптомной СН в ходе исследования CHARM-Added выяснилось, что ВРА дают умеренный положительный эффект. Однако добавление валсартана к ИАПФ в исследовании Val-HeFT не улучшило показатели смертности, хотя общая заболеваемость и ОС были значительно (13,2%) ниже для валсартана, чем для плацебо, из-за снижения числа пациентов, госпитализированных с СН.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Бета-адреноблокаторы и их побочные эффекты
β-адренолитики (β-блокаторы) — антагонисты норадреналина и адреналина на β-рецепторах, которые не имеют аффинитета к α-рецепторам. Все β-блокаторы имеют основную химическую структуру — боковую цепь β-симпатомиметиков, а также ароматический заместитель.
Первым β-блокатором, который стал использоваться в клинической практике, был пропранолол (1965 г.). В настоящее время в продаже находится примерно 25 химически разных β-блокаторов (аналогов). В зависимости от аффинитета к рецепторам β-блокаторы можно разделить на неселективные (блокируют как β1-, так и β2--рецепторы, например пропранолол) и селективные β1-антагонисты (метопро-лол, бисопролол, небиволол и атенолол).
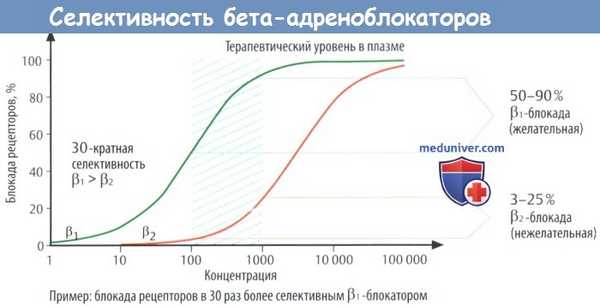
У большинства селективных β1-блокаторов коэффициент селективности β1/β2 составляет около 30-60. Это означает, что β1-опосредованные эффекты угнетаются при концентрации (или дозе), в 30-60 раз более низкой), чем β2-опосредованные эффекты (красный график).
Так, на рисунке ниже видно, что когда концентрация β1-блокатора в плазме находится в терапевтическом диапазоне, 50-90% β1-рецепторов блокированы, т. е. достаточно, чтобы, например, снизить ЧСС у пациента с ишемической болезнью сердца (ИБС). Однако при 30-кратной селективности и той же концентрации в плазме 3-25% β2-рецепторов тоже блокированы, что может привести к побочным эффектам.

Большинство терапевтических эффектов β-блокаторов достигается за счет блокады β1-рецепторов. У некоторых β-блокаторов свойства иные.
Карведилол также ингибирует α1-рецепторы, а небиволол, как считается, обладает сосудорасширяющим свойством за счет высвобождения оксида азота (NО).
Особое внимание в последнее время уделяется частичным антагонистам с внутренней симпатомиметической активностью. На сегодня такая активность считается отрицательным свойством β-блокаторов, по меньшей мере, в лечении сердечной недостаточности.
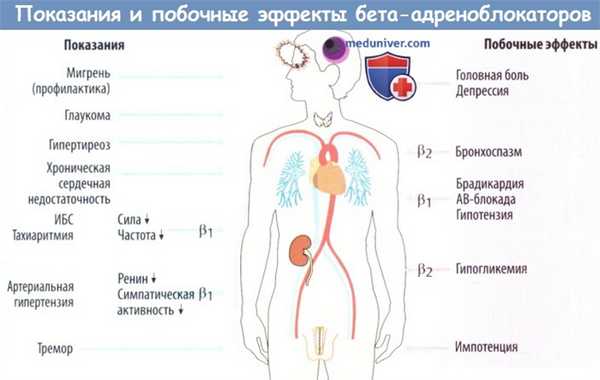
Терапевтические эффекты. β-блокаторы за счет блокады β1-рецепторов защищают сердце от повышенного потребления кислорода при усиленной активности симпатической нервной системы. Из сказанного следует, что возможно лишь частичное повышение работы сердца («движение с горы»). Этот эффект используйся при ИБС, чтобы предотвратить нагрузку на сердце, которая может спровоцировать приступ стенокардии.
β-блокаторы также применяются, чтобы снизить ЧСС при тахиаритмиях и защитить миокард при сердечной недостаточности от чрезмерной симпатической стимуляции. β-блокаторы помогают снизить АД при гипертензии: помимо уменьшения ЧСС и сократимости миокарда, они ослабляют центральный симпатический тонус и тормозят опосредованный β1-рецепторами выброс ренина в почках.
β-блокаторы также используются в терапии глаукомы (тимолол, который снижает продукцию водянистой влаги), для профилактики мигрени и тяжелого гипертиреоза (повышение чувствительности миокарда к норадреналину и адреналину). Большинство этих фармакологических эффектов достигается за счет β1-рецепторов. Напротив, β2-блокаторы играют важную роль в лечении эссенциального тремора.
Нежелательные реакции. Побочные эффекты развиваются преимущественно за счет блокады β2. рецепторов. У пациентов с бронхиальной астмой или хронической обструктивной болезнью легких (противопоказание) β2-блокаторы могут вызывать бронхоспазм с тяжелой, порой угрожающей жизнью одышкой.
У больных диабетом, принимающих β2-блокаторы, могут маскироваться начальные симптомы гипогликемии (тахикардия, тремор), а высвобождение глюкозы из печени, индуцированное адреналином, задерживается. Кроме того, блокада β2-рецепторов в сосудах ведет к вазоконстрикции с похолоданием кистей и стоп, а также к хроническим расстройствам кровообращения. К побочным эффектам, обусловленным блокадой β1-рецепторов, относятся брадикардия, гипотензия и атриовентрикулярная (АВ) блокада. β-блокаторы могут вызывать головную боль, депрессию и импотенцию.
Видео фармакологические, побочные эффекты бета-адреноблокаторов
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Применение блокаторов ангиотензиновых рецепторов при лечении артериальной гипертензии
В чем преимущество блокаторов ангиотензиновых рецепторов перед другими классами антигипертензивных препаратов, в частности перед ингибиторами АПФ? Какова сравнительная эффективность различных блокаторов ангиотензиновых рецепторов? На основании репрез
В чем преимущество блокаторов ангиотензиновых рецепторов перед другими классами антигипертензивных препаратов, в частности перед ингибиторами АПФ?
Какова сравнительная эффективность различных блокаторов ангиотензиновых рецепторов?
На основании репрезентативной выборки (1993) можно утверждать, что распространенность артериальной гипертензии (АГ) в России составляет среди мужчин 39,2%, среди женщин — 41,1%. При этом о наличии заболевания знают только 58,9% женщин и 37,1% мужчин, лечение получают 46,7% и 21,6% (в том числе эффективное — 17,5% и 5,7%) соответственно (первый доклад экспертов Научного общества по изучению артериальной гипертонии, Всероссийского научного общества кардиологов, Межведомственного совета по сердечно-сосудистым заболеваниям, 2000). Тактика ведения больных АГ в настоящее время регламентируется рекомендациями экспертов Всемирной Организации Здравоохранения (ВОЗ) и Международного общества по проблемам артериальной гипертензии (МОГ) (рекомендации ВОЗ-МОГ, 1999) и разработанными на этой основе Национальными рекомендациями по диагностике и лечению артериальной гипертензии (Всероссийское научное общество кардиологов, секция артериальной гипертензии, 2001). Согласно этим рекомендациям, целью лечения АГ является снижение общего риска сердечно-сосудистой заболеваемости и смертности, что предполагает снижение уровня АД до целевого (менее 140/90 мм рт. ст.), а также коррекцию всех выявленных факторов риска (например, адекватное лечение гиперхолестеринемии, сахарного диабета). Поскольку курсовое лечение АГ малоэффективно (в большинстве случаев АГ нельзя вылечить), пациент должен получать индивидуально подобранную гипотензивную терапию постоянно.
Для длительного лечения АГ в настоящее время используют b-адреноблокаторы, диуретики, ингибиторы ангиотензин-превращающего фермента (АПФ), блокаторы ангиотензиновых рецепторов, антагонисты кальция, a-адреноблокаторы. Как известно, в патогенезе артериальной гипертензии важнейшую роль играет ангиотензин II, обусловливающий вазоконстрикцию, стимуляцию синтеза альдостерона и его освобождение, реабсорбцию натрия в почках, рост сердечной мышцы, пролиферацию гладкомышечных клеток кровеносных сосудов, повышение периферической норадренергической активности и ряд других эффектов. Поэтому наиболее перспективными в медикаментозной коррекции АГ в настоящее время считаются ингибиторы ангиотензин-превращающего фермента (АПФ), препятствующие переходу ангиотензина I в ангиотензин II, и блокаторы ангиотензиновых рецепторов. Широко применяемые ингибиторы АПФ, хотя и высокоэффективны, обладают рядом побочных эффектов (включая кашель, ангиoневротический отек), обусловленных их влиянием на метаболизм брадикинина и субстанции Р [4].
Блокаторы ангиотензиновых рецепторов имеют ряд преимуществ перед ингибиторами АПФ — они более специфично и эффективно подавляют сердечно-сосудистые эффекты активации ренин-ангиотензиновой системы. В настоящее время эта наиболее «молодая» группа гипотензивных средств (первое из них — лосартан, синтезированный в 1988 году) представлена рядом препаратов, несколько отличающихся друг от друга по механизму действия, фармакокинетическим свойствам.
По химической структуре различают бифениловые производные тетразоля (лосартан, ирбесартан, кандесартан), небифениловые нететразоловые соединения (эпросартан, телмисартан) и негетероциклические соединения (вальсартан); в зависимости от наличия активного метаболита — пролекарства (лосартан, кандесартан) и активные лекарственные вещества (вальсартан, ирбесартан, телмисартан, эпросартан); в зависмости от типа антагонизма с ангиотензином II — конкурентные антагонисты (лосартан, эпросартан) и неконкурентные (вальсартан, ирбесартан, кандесартан, телмисартан). Основные характеристики различных блокаторов ангиотензиновых рецепторов приведены в табл. 1.
Гипотензивное действие блокаторов ангиотензиновых рецепторов в первую очередь связано с подавлением сосудосуживающего действия ангиотензина II, реализуемого через рецепторы стенок кровеносных сосудов. Кроме того, блокада рецепторов ангиотензина II приводит к снижению секреции альдостерона, уменьшению реабсорбции натрия и воды в проксимальном сегменте почечных канальцев.
Определенную роль в гипотензивном действии может играть стимуляция рецепторов ангиотензина второго типа при повышенном (вследствие блокады рецепторов первого типа) уровне ангиотензина II. Предполагается, что стимуляция рецепторов ангиотензина II второго типа может приводить к вазодилатации и подавлению пролиферативных процессов.
В то же время электрофизиологические исследования на животных показали, что ангиотензин II, активируя пресинаптические ангиотензиновые рецепторы норадренергических нейронов симпатической нервной системы, увеличивает высвобождение норадреналина. При изучении влияния различных антагонистов ангиотензиновых рецепторов (вальсартана, ирбесартана, лосартана, эпросартана) на симпатический выброс, стимулируемый у децерибрированных нормотензивных крыс раздражением спинного мозга, ингибирующий эффект отмечен только у эпросартана [6]. Таким образом, в клинической практике эпросартан (теветен) представляет собой единственный в своей группе препарат, способный в терапевтических дозах блокировать как пресинаптические рецепторы, так и рецепторы ангиотензина в кровеносных сосудах.
Блокаторы ангиотензиновых рецепторов, применяемые в терапевтических дозах, в среднем снижают систолическое артериальное давление на 10-20 мм рт. ст. и диастолическое — на 10-15 мм рт. ст., что показано в большом количестве исследований. Максимальное снижение АД достигается у большинства больных через 3-4 недели лечения.
Связь между дозой эпросартана и уровнем снижения АД оценена в многоцентровом, двойном слепом, параллельном, плацебо-контролируемом исследовании, в котором приняли участие 364 пациента с исходным уровнем диастолического АД 95-114 мм рт. ст. Оценивалась эффективность терапии эпросартаном в дозе 400, 600, 800, 1200 мг один раз в сутки по сравнению с плацебо, продолжительность лечения составляла 8 недель. Согласно полученным результатам, оптимальная начальная доза препарата составляла 600 мг в сутки [10].
В ходе 13-недельного двойного слепого, плацебо-контролируемого исследования с параллельными группами [4] 243 пациента получали эпросартан в суточной дозе 400-800 мг один-два раза в день. Доза препарата корригировалась в течение первых 9 недель до достижения оптимального гипотензивного эффекта, после чего терапия препаратом в эффективной дозе продолжалась еще 4 недели. Еще раз подтверждено гипотензивное действие эпросартана (диастолическое АД снизилось в группе лечения в среднем на 9 мм рт. ст. против 4 мм рт. ст. в группе плацебо), причем терапевтический эффект был одинаковым при приеме препарата один или два раза в сутки. Терапия эпросартаном (прием один раз в сутки) оказалась эффективной в 46,8% случаев.
В ряде исследований удалось показать, что по эффективности блокаторы ангиотензиновых рецепторов по меньшей мере не уступают ингибиторам АПФ (табл. 2). Например, проводимая в ходе 26-недельного двойного слепого, клинического (528 пациентов в возрасте 21-78 лет с артериальной гипертензией легкой и средней тяжести) исследования [2] терапия эпросартаном в дозе 400-600 мг в сутки оказалась эффективнее, чем лечение эналаприлом в дозе 5-20 мг в сутки. Пациентов, у которых гипотензивная терапия признана эффективной, оказалось больше в группе эпросартана (81,7%) по сравнению с группой эналаприла (73,4%). При анализе полученных результатов выяснилось, что в подгруппе больных старческого возраста частота случаев «ответа на лечение» оказалась такой же, как и у молодых пациентов [1]. Сходные результаты получены и в ходе другого исследования, посвященного сравнительной оценке гипотензивного действия эпросартана и эналаприла при артериальной гипертензии легкой и средней тяжести [7].
Сравнительная эффективность эпросартана (400-800 мг в сутки в два приема) и эналаприла (10-40 мг в сутки в один прием) при тяжелой артериальной гипертензии изучалась в ходе 10-недельного двойного слепого исследования с участием 118 пациентов (78% из них в возрасте старше 65 лет) [8]. Доза титровалась каждые две недели; при необходимости к терапии добавляли гидрохлоротиазид (гипотиазид по 25 мг в сутки). Терапия эпросартаном привела к более значимому снижению цифр систолического и диастолического АД по сравнению с эналаприлом; дополнительное назначение мочегонных средств потребовалось в обеих группах у почти одинакового числа пациентов (39% больных в группе эпросартана, 37% — в группе эналаприла). Таким образом, по сравнению с эналаприлом эпросартан более эффективно снижает повышенное систолическое АД при тяжелой артериальной гипертензии.
Значения коэффициента Т/Р для различных блокаторов ангиотензиновых рецепторов представлены в табл. 4.
С помощью амбулаторного мониторирования АД показано, что однократный прием блокаторов ангиотензиновых рецепторов обеспечивает контроль уровня АД на протяжении суток, в том числе в утренние часы, когда особенно велик риск развития сосудистых катастроф (инфарктов миокарда и инсультов); лишь лосартан в некоторых случаях приходится применять два раза в сутки. Наибольшие значения коэффициента Т/Р (т. е. наибольшая продолжительность эффективного гипотензивного действия) выявлены при использовании эпросартана, ирбесартана и кандесартана.
Высокая эффективность блокаторов ангиотензиновых рецепторов сочетается с хорошей переносимостью. Согласно данным, полученным в ходе плацебо-контролируемых клинических исследований, частота побочных эффектов на фоне терапии препаратами этой группы не отличается от этого показателя в группе плацебо. В частности, частота побочных эффектов на фоне терапии лосартаном составляет 15,3% против 15,5% в группе плацебо, на фоне терапии вальсартаном — 15,7% против 14,5%; частота побочных эффектов на фоне терапии эпросартаном приведена в табл. 5. Очень важно, что препараты этой группы в отличие от ингибиторов АПФ не вызывают и не усиливают кашель. Таким образом, блокаторы ангиотензиновых рецепторов достаточно безопасны; противопоказаниями к их применению являются только беременность, гиперкалиемия и двусторонний стеноз почечных артерий.
Согласно Национальным рекомендациям по диагностике и лечению артериальной гипертензии (2001), абсолютным показанием к применению блокаторов ангиотензиновых рецепторов является непереносимость ингибиторов АПФ (кашель при их применении), относительным показанием — застойная сердечная недостаточность. Последняя рекомендация связана с тем, что, как показали Pitt B. и соавт. (1997), лосартан способен увеличивать продолжительность жизни у больных хронической сердечной недостаточностью.
Следует, однако, отметить, что угнетение эпросартаном и симпатоадреналовой, и ангиотензин-альдостероновой систем приводит к существенному снижению систолического АД, поэтому применение этого препарата перспективно при изолированной систолической гипертензии, артериальной гипертензии после инсульта, ожирении, стресс-индуцированной, метаболической, алкогольной гипертензии (Кобалава Ж. Д., Моисеев В. С., 2000).
Читайте также:
- Гнойные болезни кисти. Диагностика и лечение
- Принципы лечения бактериальной инфекции
- Институциональная среда. Отчуждение больных шизофренией
- Добавочная треугольная кость таранной кости. Ушибы коленного сустава, осложненные гемартрозом (кровоизлиянием)
- Причины сепсиса и септического шока - возбудители
