Морфология легочной гипертензии. Частота легочной гипертензии при ВПС
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Авторы: Черкасов Н.С. 1 , Трунцова Е.С. 2 , Аверина И.А. 3
1 ФГБОУ ВО Астраханский ГМУ Минздрава России, Астрахань, Россия
2 ФГБОУ ВО Астраханский ГМУ Минздрава России, Астрахань
3 ГБУЗ АО «ОДКБ им. Н.Н. Силищевой», Астрахань
Легочная артериальная гипертензия (ЛАГ) — гетерогенное, часто многофакторное состояние, которое может быть как самостоятельной, изолированной патологией, так и осложнением большого спектра заболеваний, включая врожденные пороки сердца, обструктивную легочную патологию и др. У детей первых месяцев жизни, особенно рожденных с экстремально низкой массой тела, ведущее место занимает вторичная легочная гипертензия, которую часто недооценивают. Несмотря на оптимизацию сроков ИВЛ, рациональное использование сурфактанта, сохраняется высокий риск летальности, обусловленный среди прочего прогрессирующей легочной гипертензией. Более 30% случаев ЛАГ связано с патологией органов дыхания, прежде всего с бронхолегочной дисплазией. Одной из основных причин ЛАГ является артериальная гипоксемия вследствие гиповентиляции. Давление в легочной артерии зависит от изменений легочного кровотока из-за повреждения эндотелия легочных сосудов, что приводит к нарушению синтеза провоспалительных веществ и способствует вазоконстрикции, увеличению легочного сосудистого сопротивления. Целью работы является акцентирование внимания на этой проблеме педиатров, детских кардиологов и пульмонологов, т. к. диагностика ЛАГ в начальной стадии зависит от знаний специалистов об этой патологии, не имеющей ранних специфических проявлений. В статье приводится клинический случай тяжелой легочной гипертензии на фоне сочетания врожденного порока сердца и бронхолегочной дисплазии у ребенка с экстремально низкой массой при рождении. Своевременная диагностика ЛАГ и комплексный характер лечения привели к улучшению состояния здоровья ребенка и стабилизации ЛАГ с тенденцией к значительному снижению показателей.
Ключевые слова: дети, легочная артериальная гипертензия, бронхолегочная дисплазия, врожденный порок сердца, экстремально низкая масса тела.
Для цитирования: Черкасов Н.С., Трунцова Е.С., Аверина И.А. Особенности течения вторичной легочной гипертензии у ребенка с экстремально низкой массой тела при рождении. РМЖ. Медицинское обозрение. 2019;3(8):52-55.
N.S. Cherkasov 1 , E.S. Truntsova 1 , I.A. Averina 2
1 Astrakhan State Medical University
2 N.N. Silishcheva Regional Children’s Clinical Hospital, Astrakhan
Pulmonary arterial hypertension (PAH) is a heterogeneous, often multifactorial disease. PAH can be an individual disorder or aggravate multiple conditions including congenital heart disease, obstructive lung disease etc. Secondary pulmonary hypertension (which is often underestimated) has a leading role in babies in the first months of life, in particular, in those with extremely low birth weight. Despite optimal artificial lung ventilation time and adequate use of surfactant, these babies are at higher risk of death due to the progressive pulmonary hypertension. More than 30% of PAH cases are the result of respiratory disorders, first of all, bronchopulmonary dysplasia. Arterial hypoxemia resulting from hypoventilation is one of the most common causes of PAH. Pulmonary artery pressure depends on the altera tion of pulmonary blood flow due to the pulmonary vessel endothelial dysfunction which reduces the synthesis of anti-inflammatory substances, promotes vasoconstriction, and increases pulmonary vascular resistance. The aim of this paper is to highlight the importance of PAH to pediatricians, pediatric cardiologists and pulmonologists since early diagnosis of PAH is determined by expert’s knowledge of this disorder with no early specific manifestations. The paper describes case history of severe pulmonary hypertension in a baby with extremely low birth weight and combined congenital heart disease and bronchopulmonary dysplasia. Early diagnosis and complex treatment for PAH have improved baby health and parameters and stabilized PAH.
Keywords: children, pulmonary arterial hypertension, bronchopulmonary dysplasia, congenital heart disease, extremely low birth weight.
For citation: Cherkasov N.S., Truntsova E.S., Averina I.A. Secondary pulmonary hypertension in a baby with extremely low birth weight. RMJ. Medical Review. 2019;8:52–55.
В статье приводится клинический случай тяжелой легочной гипертензии на фоне сочетания врожденного порока сердца и бронхолегочной дисплазии у ребенка с экстремально низкой массой при рождении.
Актуальность
Легочная артериальная гипертензия (ЛАГ) — это гетерогенное, часто многофакторное состояние, которое может быть как самостоятельной, изолированной патологией, так и осложнением большого спектра заболеваний, включая врожденные пороки сердца, бронхолегочную дисплазию (БЛД), бронхиальную астму, генетические и хромосомные болезни, заболевания соединительной ткани и другую патологию. По различным оценкам, распространенность ЛАГ в детском возрасте редкая, примерно 2–16 случаев на 1 млн детского населения. Однако в некоторых группах риска эта патология встречается во много раз чаще [1, 2]. Значительная часть, более 30% случаев, ЛАГ связана с патологией органов дыхания, в т. ч. с БЛД [3, 4]. Следует признать, что распространенность легочной гипертензии часто недооценивают. Обычно она расценивается как продолжительный динамический процесс, который может проявиться только на поздних стадиях хронического бронхолегочного заболевания. Начальная стадия ЛАГ протекает с небольшим, часто интермиттирующим увеличением давления в легочной артерии, которое не требует значительного усиления работы правого желудочка и, как правило, не имеет ранних клинических проявлений [5, 6]. Поэтому диагностика ЛАГ в начальной стадии зависит от многих факторов, включая возраст пациента, тяжесть сопутствующей патологии, тип поражения сердца и, в первую очередь, от информированности специалистов об этой патологии, встречающейся в самом раннем детском возрасте.
У детей первых месяцев жизни ведущее место отводится вторичной легочной гипертензии [7]. Наиболее выраженные изменения легочной гемодинамики у младенцев, как правило, имеются при БЛД, хроническом бронхиолите и другой хронической обструктивной патологии легких [8–10].
У пациентов с БЛД легочная гипертензия может быть связана с перемежающейся хронической гипоксией, гиперкапнией, повреждением ткани легкого и воздухоносных путей, диастолической дисфункцией, задержкой роста сосудов и стенозом легочных вен [11]. Одной из основных причин является артериальная гипоксемия вследствие гиповентиляции. Давление в легочной артерии зависит от изменений легочного кровотока из-за повреждения эндотелия легочных сосудов. Дисфункция эндотелия этих сосудов приводит к нарушению синтеза простагландинов и простациклина, а также к выраженному повышению продукции тромбоксана и эндотелина-1 на фоне существенного уменьшения образования оксида азота. Эти нарушения способствуют дополнительной вазоконстрикции, увеличению легочного сосудистого сопротивления, и ЛАГ принимает хронический характер [12].
Как описали еще в прошлом веке W.J. Northway et al. (1967), БЛД может возникать после длительной искусственной вентиляции легких (ИВЛ) и кислородотерапии преимущественно у недоношенных новорожденных. Однако за последние годы на фоне успехов и достижений перинатологии проблема выхаживания недоношенных детей, особенно рожденных с экстремально низкой массой тела (ЭНМТ), стала еще более актуальной в силу высокой летальности в неонатальном периоде. В этом периоде у детей с низкой массой тела при рождении риск летальности усугублен развитием таких заболеваний, как сепсис, врожденные инфекции, пневмонии и БЛД, распространенность которой значительно варьирует, по данным различных источников, и составляет до 30% среди детей, получавших ИВЛ, особенно длительную [13]. Частота развития БЛД у новорожденных имеет обратную корреляцию с массой тела при рождении и зависит от сроков и режимов проведения ИВЛ и кислородотерапии. Хочется подчеркнуть, что у детей с ЭНМТ тяжесть изменений сердечно-сосудистой системы и БЛД, а также прогрессирование ретинопатии, как правило, являются звеньями одной цепи, в основе которой лежит глубокая морфофункциональная незрелость органов и систем [14, 15].
В современных условиях, несмотря на оптимизацию сроков ИВЛ, рациональное использование сурфактанта, сохраняется высокий риск летальности, обусловленный, в частности, прогрессирующей легочной гипертензией. Наряду с этим встречаются случаи ЛАГ, при которых можно достичь менее тяжелого течения заболевания и при своевременной корригирующей терапии получить исход в виде значительного улучшения или даже выздоровления. По-прежнему ощущается нехватка данных по индивидуальному подходу и оптимальному ведению детей с легочной гипертензией [1, 16]. Все это обусловливает актуальность проблемы ранней диагностики и адекватного лечения детей с ЛАГ на фоне БЛД и врожденных пороков сердца.
Клиническое наблюдение
С целью акцентирования внимания на этой проблеме педиатров, детских кардиологов и пульмонологов приводим интересный клинический случай течения ЛАГ на фоне сочетания БЛД и врожденного порока сердца у ребенка с ЭНМТ при рождении.
Ребенок А. женского пола, от 1-й беременности, протекавшей с угрозой прерывания в первой и второй половине, рожден от 1-х преждевременных родов на 26-й нед. гестации, путем операции «кесарево сечение», с массой 870 г и длиной 34 см, с оценкой по шкале Апгар 4/6 баллов.
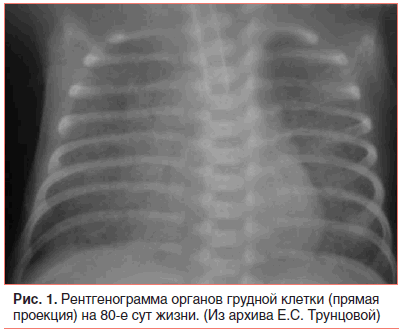
Был выставлен диагноз: Неонатальная пневмония, двусторонняя, очаговая, тяжелой степени тяжести, стадия инфильтрации. ДН III степени. Микробиологический посев из зева и эндотрахеального аспирата выявил Klebsiella pneumoniae. Кроме того, у ребенка с отягощенным акушерским анамнезом, артериитом и флебитом пупочных сосудов, анемией, пневмонией регистрировались признаки SIRS (тромбоцитопения, нарушение терморегуляции, воспалительные изменения в крови), которые предполагали ведение его как угрожаемого по неонатальному сепсису. В связи с множеством заболеваний девочка получала комплексную терапию (в т. ч. антибактериальную) и продолжала длительно находиться на ИВЛ (FiO2 0,45; f 40 в 1 мин; piр. 19 мм в. ст.; SaO2 90–92%). Периодически предпринимались попытки снизить параметры ИВЛ, однако из-за стойкой гиперкапнии (pCO2 55 мм рт. ст.) и гипоксии (рО2 24 мм рт. ст.), ацидоза, по данным кислотно-щелочного состава крови (лактат 1,1 ммоль/л; сНСО3 38,2 ммоль/л; ВЕ 12,3 ммоль/л), низких показателей сатурации кислорода экстубировать ребенка не удавалось.
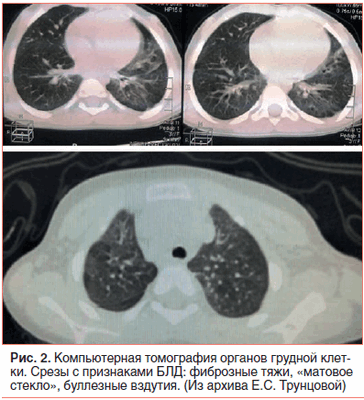
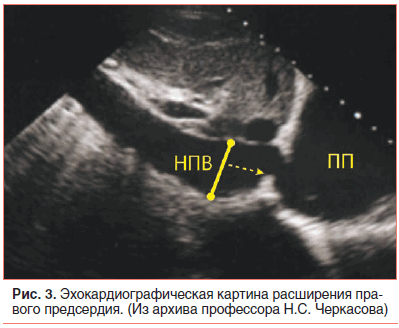
В возрасте 2,5 мес. жизни подтвержден диагноз: Врожденный порок сердца (ВПС): ОАП. На ЭХО-КГ: ОАП 3,5 мм со сбросом крови в легочную артерию с градиентом 4 мм рт. ст., аневризма межпредсердной перегородки (АМПП) и открытое овальное окно 3,5 мм со сбросом крови справа налево, высокая ЛАГ 89 мм рт. ст. с расширением правого предсердия (ПП) (рис. 3).
На ЭКГ выявлялись признаки перегрузки ПП. Рентгенографически: признаки расширения правых отделов сердца. В гемограмме: анемия Hb 90 г/л, Эр 3,88 × 10 12 /л, ЦП 0,9, лейкоцитарная формула без признаков воспаления. Глюкоза крови составляла 5,0 ммоль/л, креатинин 51,5 ммоль/л, АЛТ 0,5 мкмоль/л, АСТ 0,94 мкмоль/л. В возрасте 3,5 мес. в Федеральном центре сердечно-сосудистой хирургии (Астрахань) проведена операция по поводу ОАП (лигирование). Ранний послеоперационный период прошел без осложнений.
По поводу выявленной патологии ВПС + ЛАГ ребенок получал комплексную терапию, включающую кислородотерапию, диуретики (спиронолактон под контролем креатинина и калия), силденафил (в дозе 3,5 мг × 4 р./сут), дигоксин в поддерживающей дозе (10 мг/кг/сут), добутамин (1,5 мкг/кг/мин). Состояние ребенка стабилизировалось, одышка уменьшилась, улучшился аппетит, и девочка начала прибавлять в массе тела от 350 г и более за неделю.
Выставлен диагноз: Глубокая недоношенность (26 нед. гестации). БЛД недоношенных, новая форма, тяжелой степени тяжести, дыхательная недостаточность II степени. ВПС: ОАП, сердечная недостаточность IIА стадии, ФК II, малая аномалия развития сердца: открытое овальное окно. Последствия гипоксического поражения ЦНС, синдром угнетения. Ранняя анемия недоношенных средней степени тяжести. Ретинопатия сетчатки обоих глаз III стадии, активная фаза.
Далее на фоне лечения и положительной клинико-лабораторной динамики (прирост весоростовых показателей, отсутствие воспалительных изменений в гемограмме, отрицательные показатели СРБ и ПКТ, отсутствие патологических отклонений остальных биохимических показателей, улучшение показателя SaО2: 94–95%) на 65-й день жизни ребенок был экстубирован и переведен на самостоятельное дыхание. Ингаляционная терапия по поводу тяжелой БЛД ИГКС (будесонидом) была продолжена в прежнем объеме.
На фоне стабилизации состояния в возрасте 5 мес. проведено оперативное лечение ретинопатии недоношенных (в Санкт-Петербургском государственном педиатрическом медицинском университете Минздрава России, отделении патологии новорожденных и детей грудного возраста). После операции в динамике у ребенка сохранялась стойкая дыхательная недостаточность (ЧДД 42–44, при беспокойстве до 85 в минуту; SаО2 90–94%), с которой связана продолжительная кислородная поддержка, общая продолжительность получения воздушно-кислородной смеси составила около 6 мес.
Амбулаторно ребенок наблюдался у педиатра, пульмонолога, кардиолога с диагнозом: Бронхолегочная дисплазия недоношенных, новая форма, тяжелой степени тяжести, осложненная вторичной высокой легочной гипертензией (89 мм рт. ст.). Состояние после коррекции ВПС (лигирование ОАП, АМПП, открытое овальное окно, эктопическая хорда в полости левого желудочка). Парез левой голосовой связки. Последствия гипоксического поражения ЦНС. Задержка физического и моторного развития. Ретинопатия сетчатки обоих глаз III стадии, активная фаза (оперативное лечение: транспупиллярная лазеркоагуляция сетчатки). Анемия недоношенных средней степени. Белково-энергетическая недостаточность III степени.
На протяжении первого года жизни ребенок имел крайне низкое физическое развитие, дисгармоничное за счет дефицита массы (в 1 год масса 6,0 кг и длина тела 58 см) -6,2SD и -3,2SD по росту и массе соответственно [17]. Обращали на себя внимание повышенная слабость, утомляемость, сухой кашель в течение дня, периодически стридорозное дыхание, одышка в покое смешанного характера от 65 дыхательных движений в минуту в покое, ремиссии и до 82 в минуту в периоды обострения БЛД. Сатурация кислородом в периферической крови при пульсоксиметрии составляла 90–95%. За период наблюдения наиболее тяжелое ухудшение состояния отмечалось дважды в возрасте 6 мес. и 8 мес., что было связано с респираторными инфекциями.
Девочка получала базисную терапию БЛД препаратом будесонид в дозе 1,0 мг/сут с момента установления диагноза непрерывно в течение 6 мес., затем 0,5 мг 1 р./сут в течение 6 мес. В период обострения заболевания доза ИГКС увеличивалась до 2,0 мг/сут, для купирования одышки применялся ипратропия бромид в дозе 0,075 мг (до 6 капель).
При амбулаторном лечении по поводу легочной гипертензии был продолжен курс силденафила в дозе 4 мг/кг/сут × 4 р./сут в течение 2 нед., затем 1 мг/кг/сут в течение 6 мес., спиронолактон 2 мг/кг × 2 р./сут.
За время наблюдения в течение 1 года систолическое давление в легочной артерии (СДЛА) имело положительную динамику. На ЭКГ регистрировался синусовый ритм, миграция водителя ритма, электрическая ось сердца резко отклонена вправо, â=+150°, ЧСС 120–150 в минуту, PQ 0,1. На ЭХО-КГ отмечается: состояние после лигирования ОАП, проток закрыт герметично, пограничные размеры правых камер сердца (правый желудочек 1,77 см; ПП 1,76 см). Глобальная сократимость левого желудочка не нарушена. Фракция выброса SF 60%. Эктопическая хорда в полости левого желудочка. Митральная регургитация 0–I степени. Трикуспидальная регургитация I степени. Легочная артерия 1,46 см, СДЛА 46 мм рт. ст. Перикард без особенностей. Максимальный градиент давления на Ао 8,1 мм рт. ст. Сатурация О2 94%.
На фоне лечения отмечена положительная динамика СДЛА с 89 до 46 мм рт. ст., клинические признаки ЛАГ значительно уменьшились, сохраняются признаки БЛД и последствия гипоксического поражения ЦНС, задержки физического и психомоторного развития, перенесенной коррекции ВПС.
Заключение
Таким образом, данный клинический случай демонстрирует развитие легочной гипертензии на фоне БЛД и врожденного порока сердца у ребенка с экстремально низкой массой тела. Авторы пытались акцентировать внимание педиатров, детских кардиологов и пульмонологов на проблеме ЛАГ, которая расценивалась как вторичная, ассоциированная с двумя основными тяжело протекающими заболеваниями. На фоне комплексного адекватного лечения БЛД, своевременной коррекции ВПС (ОАП) и терапии ЛАГ (силденафилом) к концу первого года жизни наступила положительная динамика в течении БЛД, врожденного порока сердца, в физическом развитии ребенка, и ЛАГ приобрела стабильное течение с тенденцией к дальнейшему снижению СДЛА.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Морфология легочной гипертензии. Частота легочной гипертензии при ВПС
Легочная гипертензия при врожденном пороке сердца. Механизмы развития легочной гипертензии
Легочная гипертензия характеризуется стойким повышением давления в сосудах малого круга кровообращения. В клинике врожденных пороков сердца она играет важную роль при решении вопроса о показаниях к хирургическому лечению, предоперационной подготовке, послеоперационном ведении больных и прогнозе.
Как известно, давление в легочной артерии в норме (по данным Всемирной организации здравоохранения) равно 24,4 мм рт. ст. Уровень легочного артериального давления зависит от соотношения между легочно-сосудистым сопротивлением и объемом кровотока малого круга кровообращения.
Изучению патогенеза легочной гипертензии при врожденных пороках посвящено большое число работ отечественных и зарубежных авторов. Однако до настоящего времени этиология и патогенез ее остаются неясными.
Campbell (1955), Harris (1955) считают легочную гипертензию при врожденных пороках сердца врожденной, обусловленной аномалией развития легочных сосудов.
Wood (1956) различает три основных типа легочной гипертензии: 1) пассивную, вследствие высокого венозного давления при левожелудочковой недостаточности; 2) гиперкинетическую, развивающуюся в результате увеличенного легочного кровотока; 3) вазообструкционную, возникающую при закупорке легочных сосудов; последнюю он разделяет на обструкционную, развивающуюся при блокаде кровотока с внешней стороны легочных сосудов; облитеративную, возникающую при деструктивных изменениях в стенке легочных сосудов; вазоконструктивную, развивающуюся при функциональном спазме мышечных сосудов, и полигенетическую.
Godwin (1958) разделяет легочную гипертензию на связанную с избыточным кровенаполнением в легких и обусловленную увеличенным сосудистым сопротивлением.
У детей раннего возраста легочное кровообращение сохраняет ряд анатомо-физиологических особенностей, присущих кровообращению плода (Edwards, 1957). Наряду с этим включается ряд механизмов, обусловленных сбросом крови слева направо.
А. А. Вишневский с соавторами (1967) в возникновении легочной гипертензии выделяют пассивные и активные факторы; к первым относятся нарушение оттока из малого круга кровообращения, гиперволемия и первичные органические нарушения сосудов легких, ко вторым — сужение легочных сосудов и вторичные органические изменения в сосудистой стенке.
При врожденных пороках сердца, сопровождающихся сбросом крови слева направо, наблюдается гиперволемия сосудов малого круга, которая приводит к резкому растяжению и расширению сосудов, что вначале способствует разгрузке правого желудочка и предупреждает развитие легочной гипертензии.
А. А. Вишневский с соавторами установили, что давление в легочной артерии не повышается до тех пор, пока объем артериально-венозного сброса не превысит в 1,5 раза минутный объем большого круга кровообращения. Тогда наступает рефлекторный спазм сосудов, предупреждающий развитие отека легкого (В. В. Парин, 1946; Edwards, 1957, и др). При этом легочная гипертензия носит обратимый, функциональный характер. При длительном существовании ее наступают органические изменения сосудов легких (К. Л. Семенова, 1957; Л. Д. Крымский, 1962).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В морфологической картине легочных сосудов при выраженной легочной гипертензии изменения обусловлены прежде всего атеросклерозом легочной артерии и ее ветвей и сужением просвета сосудов, вследствие гипертрофии мышечной оболочки мелких артерий. Возможно прогрессированию легочной гипертензии способствуют воспалительные заболевания легких (И. X. Рабкин, 1962; Ф. И. Заргарли, 1962; Р. М. Гофман, 1968).
При врожденных пороках сердца «синего» типа с уменьшенным легочным кровотоком также выявлена легочная гипертензия (Ю.Д.Волынский, 1962; Л. Д. Крымский и Ю. Д. Волынский, 1965), обусловленная тяжелыми структурными изменениями в системе легочной apтерии.
Частота легочной гипертензии различна. По данным Л. В. Волколакова с соавторами (1966), она выявлена у 56% больных в возрасте от 2 дней до 3 лет. В. И. Бураковский с соавторами (1967) обнаружил ее у 71 из 200 (35,5%) больных до 3 лет, причем при дефекте межжелудочковой перегородки у 47 из 50 детей, при открытом артериальном протоке у 9 из 51, при дефекте межпредсердной перегородки у 4 из 6. Тяжелая легочная гипертензия у детей раннего возраста при дефекте межжелудочковой перегородки отмечена также Gebrode с соавторами (1964) и др.
Частота ее у детей старше 3 лет различна. При открытом артериальном протоке она наблюдается у 1,2—18% больных (Ellis с соавт., 1956; А. А. Кешишева, 1958; Hebgingen с соавт., 1958; Н. X. Кутушев, 1962, и др.). При дефекте межжелудочковой перегородки тяжелая легочная гипертензия в старшей возрастной группе наблюдается у 80—90% больных (Marguis, 1950; Keith, 1956, и др.). Gross—Brockhoff с соавторами считают, что она появляется в возрасте 8—10 лет. Schaede (1960) полагает, что она может возникнуть в любом возрасте, но не старше 18 лет.
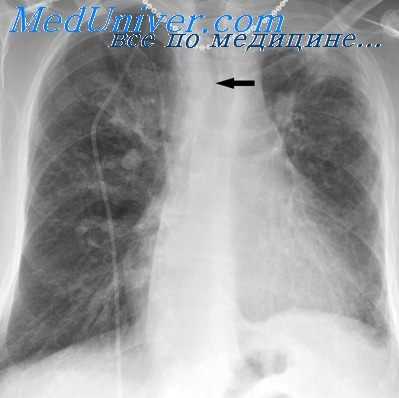
Сравнительно редко наблюдается легочная гипертензия при дефекте межпредсердной перегородки. Так, Harold с соавторами (1960) установили легочную гипертензию у 7% больных, Limon с соавторами (1953) —у 8%, Weidman с соавторами (1957) —у 11%.
Значительно чаще отмечена легочная гипертензия при комбинированных врожденных пороках сердца: сочетании дефекта межжелудочковой с дефектом межпредсердной перегородки или с открытым артериальным протоком, при первичном дефекте межпредсердной перегородки, атрио-вентрикулярной коммуникации, синдроме Лютембахера и др. (Weyn с соавт., 1965).
Предложено большое число классификаций легочной гипертензии, основанных на величине и направлении сброса, показателях легочного сосудистого сопротивления и давления в легочной артерии (А. А. Кешишева. 1957; Edwards, 1957; Ф. X. Кутушев, 1962), а также с. учетом этиопатогенетических факторов (И. X. Рабкин, 1967; А. А. Вишневский с соавт., 1967; Ф. Ф. Углов с соавторами, 1968).
А. А. Кешишева, И. X. Рабкин подразделяют легочную гипертензию на три степени: I — давление в легочной артерии 31—60 мм рт. ст., II —61 —100, III — более 100 мм рт. ст.
В Институте сердечно-сосудистой хирургии им. А. И. Бакулева принята следующая классификация легочной гипертензии: I — давление в легочной артерии 30—35 мм рт. ст.; II — 35—70 мм рт. ст. (умеренная легочная гипертензия); III — более 70% аортального (резкая легочная гипертензия).
Классификация легочной гипертензии. Клиника легочной гипертензии
Мы подразделяем легочную гипертензию на четыре степени (классификация Н. К. Таланкина): I — давление в легочной артерии от 30 мм рт. ст. до 70% системного; II — более 70% системного: а) сброс крови слева направо, б) переменный; III — сброс крови справа налево; IV—легочная гипертензия+сердечная недостаточность.
Подобная классификация учитывает характер сброса крови и выраженность декомпенсации кровообращения, что важно для определения показаний к операции. Так, для больных с открытым артериальным протоком высокая легочная гипертензия не является противопоказанием к операции так же, как и для больных раннего возраста с дефектом межжелудочковой перегородки.
Диагностика легочной гипертензии без применения катетеризации полостей сердца трудна. Однако имеются косвенные клинические симптомы ее при различных врожденных пороках сердца. У детей раннего возраста отмечаются выраженный двусторонний сердечный горб, разлитой сердечный толчок, акцент и раздвоение II тона над легочной артерией, передаточная пульсация эпигастральной области, склонность к повторным пневмониям, сердечная недостаточность, гипертрофия желудочков, отставание в росте и весе.
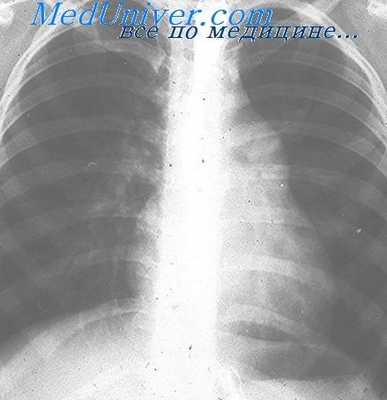
Диагноз подтверждается данными рентгенологического и инструментальных методов исследования: фонокардиографией, электрокимографией, реовазографией и катетеризацией полостей сердца (Rudolf, Cayler, 1958; В. И. Бураковский, Б. А. Константинов, 1964; Ю. Д. Волынский с соавт., 1967, и др.).
При умеренной легочной гипертензии I степени у больных старшего возраста сохраняется типичная клиническая картина, характерная для данного порока. Такие больные жалуются на одышку, возникающую при небольшой физической нагрузке. При обследовании у них отмечаются умеренно выраженная сердечная недостаточность (обычно IIА степени), акцент и расщепление II тона над легочной артерией, изменение на электрокардиограмме и фонокардиограмме.
При выраженной легочной гипертензии исчезают характерные симптомы порока, уменьшается или исчезает шум, появляется цианоз, сначала непостоянный, при физической нагрузке, а затем и в покое, увеличиваются симптомы сердечной недостаточности, нарушается газообмен в легких. Такие больные жалуются на быструю утомляемость, одышку при незначительной физической нагрузке, сердцебиение и боли в области сердца, головные боли. Периодически могут наблюдаться носовые или легочные кровотечения. В дальнейшем присоединяется тяжелая декомпенсация, протекающая по правожелудочковому типу.
При врожденных пороках сердца, осложненных легочной гипертензией, лечебная тактика различна в зависимости от характера ее, возраста больного, вида врожденного порока сердца и выраженности декомпенсации кровообращения.
Легочная гипертензия: как не упустить время

Легочная гипертензия – это группа заболеваний, которые характеризуются повышением давления легочной артерии. Постепенно прогрессирующая патология опасна осложнениями, одним из которых является сердечная недостаточность и, как следствие, смерть пациента. Практически бессимптомное развитие ЛГ на начальных стадиях приводит к тому, что примерно в 80% случаев диагностировать заболевание удается только после того, как изменения стали критическими.
– Наталья Анатольевна, какие формы включает данная группа заболеваний?
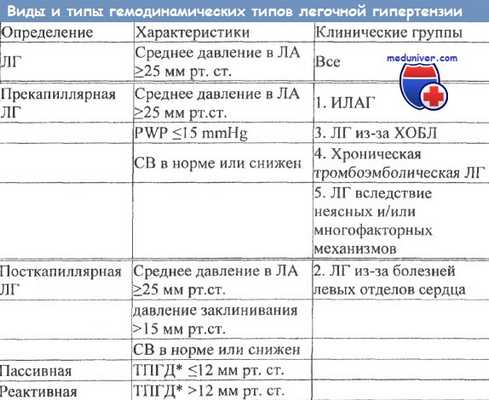
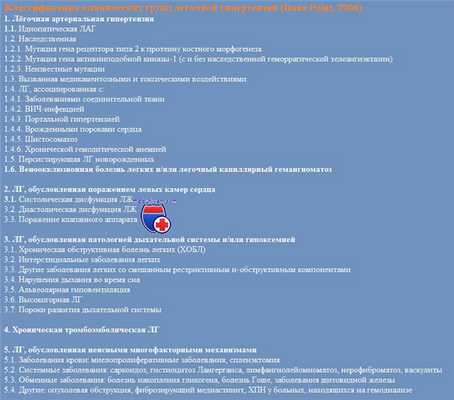
– Клиническая классификация легочной гипертензии менялась на протяжении многих лет. Cегодня на основании сходства патогенетических особенностей, клинической картины и подходов к лечению выделено пять групп: легочная артериальная гипертензия (ЛАГ), включающая идиопатическую и другие формы; ЛГ вследствие патологии левых отделов сердца; ЛГ, ассоциированная с патологией дыхательной системы и/или гипоксией; хроническая тромбоэмболическая ЛГ и другие обструкции легочной артерии; ЛГ с неясными и/или многофакторными механизмами.
– Учитывая такое многообразие причин, каким образом диагностируется заболевание?
– Мы всегда говорим, что легочная гипертензия – патология, которая требует постановки диагноза в экспертном центре. Это больные, которые требуют большой и сложной диагностической программы, иногда консультаций многих специалистов. Поэтому этим сложно заниматься в одиночку участковым докторам, вести таких пациентов должна мультидисциплинарная команда – кардиологи, пульмонологи, ревматологи как три основных специалиста. Еще, безусловно, кардиохирурги и реаниматологи, иногда генетики, когда прослеживаются семейные или наследственные формы.
Распознать на ранних стадиях болезнь достаточно трудно, потому что самый главный симптом – одышка – это такой неспецифический симптом, который может развиваться при очень многих болезнях. Почему и пациенты часто ходят между кардиологами, пульмонологами, другими специалистами по системным заболеваниям, прежде чем получить диагноз. Одышка всегда заставляет нас в первую очередь заподозрить болезнь сердца либо легких, но ответ дает более углубленное исследование.
– Кто входит в группы риска?
– Дело в том, что группы риска как таковые довольно сложно определить. Это больные, которые уже имеют заболевания, вследствие которых развивается ЛГ. Конечно, на первом месте стоит тромбоэмболия легочной артерии. Также, например, это больные с тяжелыми заболеваниями легких, с нарушением газообмена, гипоксией, что со временем может приводить к формированию легочной гипертензии.
Что касается идиопатической легочной гипертензии, она встречается у пациентов молодого возраста и не имеет четких причин. В ходе недавних исследований удалось выявить гены, которые кодируют легочную гипертензию. На первом этапе заподозрить болезнь бывает очень сложно, поэтому пристальное внимание необходимо обращать на молодых людей, жалующихся на одышку при отсутствии явных хронических заболеваний, и тщательно разбираться, откуда она взялась. Частота встречаемости идиопатической легочной гипертензии – от 5 до 6 случаев на 1 млн населения в год, это достаточно редкая патология. В 2013 году она была причислена к разряду орфанных, редких заболеваний. И это очень большой плюс, потому что дает право пациентам на бесплатное получение препаратов, которые стоят достаточно дорого.
А в целом возрастной диапазон пациентов с ЛГ достаточно велик, включая людей от 18 до 40–45 лет, то есть это люди работоспособные, востребованные в обществе. Поэтому мы боремся за то, чтобы как можно раньше выявлять заболевание, ставить диагноз и начинать лечение.
– Каковы сегодня подходы в терапии легочной гипертензии? Какая часть больных обеспечена необходимыми препаратами в полном объеме?
– Терапия должна назначаться как можно раньше, пациент сразу должен получать специфическую терапию. Тяжелому пациенту часто назначается не один, а два-три препарата. Нужно как можно быстрее схватить болезнь и начать лечение, а потом уже пересматривать его схему. Хотя в реалиях происходит по-разному. Например, что касается идиопатической легочной гипертензии, то практически все пациенты обеспечены лекарственной терапией в соответствии с рекомендациями экспертов и стандартами. То же можно сказать и о пациентах с хронической тромбоэмболической ЛГ.
Относительно регионального обеспечения, в Москве, например, ситуация относительно благополучная: у нас все пациенты получают назначенные препараты, некоторые – даже препараты из различных групп, одновременно два и даже три. Слава богу, тут никаких перебоев и проблем нет. Что касается в целом России, то ситуация очень разная. В регионах из-за недостаточного финансирования иногда складывается сложная обстановка с обеспечением лекарствами. Где-то пациенты быстро получают требуемые препараты, причем именно те препараты, которые рекомендует экспертный центр, в каких-то регионах приходится их заменять другими.
Этот вопрос уже неоднократно поднимался. Наверное, поможет принятие закона о праве пациента, который имеет диагноз, подтвержденный в экспертном центре, и рекомендации экспертов по приему лекарств, получать необходимые лекарства вне зависимости от места проживания.
– Если проблема ЛГ столь актуальна, должны ли применяться методики массового профилактического обследования граждан из групп риска?
Нам часто звонят коллеги: посмотрите пациента, вроде здоров, есть только жалобы на одышку, сделали эхо и обнаружили повышение давления в легочной артерии. Такого пациента берем на заметку и начинаем обследовать по программе ЛГ. Еще раз подчеркиваю, выявить ЛГ непросто, нужен большой вклад в обучение докторов, чтобы они могли вовремя заподозрить патологию и начали действовать в нужном алгоритме. Но, подчеркну, ситуация меняется, врачи теперь лучше осведомлены. Как я всегда говорю, пусть лучше будет гипердиагностика, чем упущенное для пациента время. Пусть лучше мы посмотрим больного и скажем, что можно жить спокойно. Лучше перестраховаться, чем пропустить этих пациентов.
– Можно ли утверждать, что при оказании надлежащей помощи многие пациенты с ЛГ проживут значительно дольше?
– Несмотря на то, что диагноз жизнеугрожающий, при назначении и получении лечения пациенты возвращаются к нормальной жизни. Лечение влияет не только на продолжительность жизни, но и на качество: уменьшается одышка, появляется мобильность, возможность обслуживать себя самостоятельно, работать, учиться, в общем, вести практически нормальный образ жизни.
Лет 8–10 назад продолжительность жизни пациентов с ЛГ составляла около 5 лет со времени постановки диагноза. В последние годы появились новые препараты, продолжительность жизни наших больных растет. Как нам сообщают наши коллеги – кардиологи, уже есть такие, которые наблюдаются и успешно лечатся на протяжении 15–17 лет. Поэтому мы надеемся донести до коллег информацию: ранняя диагностика и раннее назначение препаратов совершенно меняет течение болезни, прогноз, и продлевает пациентам жизнь.
Читайте также:
- Обезболивание слизистых новокаином. Препараты для местной анестезии
- Избирательность в подходе к консервативному ведению ранений живота.
- Олигурия - причины, диагностика
- Методика пункции резервуара для дренирования желудочков головного мозга
- Пример рецидивирующего инфаркта миокарда. ЭКГ при рецидивном инфаркте миокарда
