Морфология лучевого поражения печени. Гистология радиационных изменений печени
Добавил пользователь Валентин П. Обновлено: 28.01.2026
Гепатиты. Характерно для тяжелых случаев острых гепатитов снижение эхогенности печени, элементы воротной вены на этом фоне видны более ярко, определяется гепатомегалия. При хронических гепатитах эхогенность чаще повышена.
Как правило, при диффузных поражениях печени больше диагностических возможностей, по сравнению с другими методами визуализации, у радионуклидных технологий. При острых гепатитах основным и подчас единственным признаком является гепатомегалия, носящая равномерный характер.
Хронический гепатит – распределение радиоколлоида у 50-60 % больных носит неравномерный характер, одним из признаков которого является смещение области максимального накопления РФП из центра правой доли. У 50-60% больных размеры селезенки увеличиваются, возрастает накопление в ней радиоколлоида (10-15%), а при хроническом активном гепатите в 30% случаев накопление РФП превышает 15%.
Независимо от причин нарушения кровообращения и повышения давления в системе воротной вены сцинтиграфическое проявление его достаточно однонаправлено и характеризуется увеличением размеров селезенки с повышением захвата селезенки более 15%. Роль визуализации (УЗИ и радионуклидные методы) при диффузных поражениях печени обычно ограничивается подтверждением гепатомегалии или сморщивания органа. При гепатитах их используют в дифференциально-диагностических целях, для распознавания осложнений, для более объективной оценки динамики размеров печени при остром скоротечном гепатите (важно для прогноза); в диагностике цирроза печени – для уточнения спленомегалии и признаков портальной гипертензии.
Цирроз печени. УЗИ выявляет изменение размеров печени при циррозе, неровность контуров органа, повышение и неоднородность эхогенности печени, увеличение селезенки, расширение воротной вены (норма – менее 1,5 см), селезеночной вены (норма – менее 1,0 см), асцит. Следует отметить высокую эффективность УЗИ при диагностике асцита. Минимальное количество жидкости, которое можно определить УЗИ – 50 мл. В этом отношении УЗИ лишь немного уступает лапароскопии.
При статической сцинтиграфии вначале изменения мало чем отличаются от хронического гепатита. По мере снижения кровотока снижается контрастность изображения, появляется неоднородность распределения РФП. Внепеченочный захват РФП проявляется высоким накоплением его селезенкой (до 40-50%) и костным мозгом. КТ и МРТ выявляют очаги регенерации и цирроза в печени, расширение воротной и селезеночной вен, выпот в брюшной полости. Показано рентгенологическое исследование пищевода, выявляющее варикозное расширение вен пищевода, желудка.
Рак печени диагностируется на основании регистрации изменения эхогенности печеночной паренхимы, формы и размеров. Опухолевые узлы могут быть солитарными или множественными. При КТ регистрируется снижение плотности в гепатоме, при МРТ– изменение интенсивности МР-сигнала. Как правило, независимо от формы роста наблюдается расширение внутрипеченочных желчных протоков. Эти данные получают при УЗИ, КТ и МРТ.
Метастатические поражения печени при УЗИ исследовании могут быть различной эхогенности, диффузными и очаговыми. Изоэхогенные метастазы выявляются по косвенным признакам (деформация сосудистого рисунка, локальные выбухания контура), достигая размеров более 1-2 см. Общая чувствительность современного УЗИ при выявлении очаговых изменений печени (60-75%) оправдывает применение других методов при негативных результатах. При нативной КТ не выявляются очаги размером меньше 1 см, значительная часть их размером 1-2 см, а также более крупные очаги, изоденсивные печеночной ткани. Стандартная КТ нечасто дополняет квалифицированно проведенное УЗИ по чувствительности и специфичности. КТ выявляет при метастазах округлой или неправильной формы участки с низкой плотностью на фоне паренхимы. КА метастазов различен в зависимости от природы опухоли.
Диффузные поражения печени труднее диагностируются с помощью КТ, чем локальные. В ряде случаев при таких изменениях имеет преимущество радионуклидная диагностика.
Возможности современной МРТ при диагностике метастазов в печень сопоставимы с КТ.
Кисты печени. При УЗИ кисты обнаруживаются как округлые анэхогенные образования. Они имеют четкие, гладкие контуры и эхогенное усиление кзади от кисты. КТ и МРТ определяют кисту как жидкостное образование с четкими контурами.
Абсцесс печени. При УЗИ абсцесс печени проявляется гипоэхогенной или анэхогенной зоной с неровными контурами, непостоянно обнаруживается акустическое усиление за абсцессом. Печень вокруг абсцесса может быть гипоэхогенной. КТ показывает меньшее снижение плотности при абсцессе по сравнению с кистой.
Морфология лучевого поражения печени. Гистология радиационных изменений печени
Отдаленные последствия лучевого поражения печени. Почки при острой лучевой болезни
У животных, переживших острые периоды лучевой болезни, обычно наблюдается восстановление структуры печени. Причем признаки регенерации обнаруживаются уже в разгар заболевания. Выявляется большое количество митотиче-ски делящихся гепатоцитов. Однако процесс деления клеток не всегда заканчивается обычным образом, поэтому встречается множество двуядерных клеток.
Установлено, например, что после локального облучения в дозе 5000Р уровень хромосомных мутаций в гепатоцитах волнообразно изменяется. Вслед за повышением числа мутаций следует уменьшение поврежденных клеток за счет их элиминации. Тем не менее даже спустя год после облучения некоторые гепатоциты сохраняют изменения в своем геноме.
В отдаленные сроки после облучения отмечаются огрубение аргирофильного каркаса и увеличение коллагеновых волокон в строме, возникающие вначале в центральной части долек, гиалиноз стенок кровеносных сосудов, т. е. обнаруживаются обычные явления интерстициального склероза, свойственные, по-видимому, всем органам и тканям облученного организма в отдаленные сроки после перенесенного острого лучевого заболевания. Тем не менее результаты специальных исследовании свидетельствуют о способности гепатоцитов в этих условиях к восстановлению [Токин И. Б., 1971].
Как указывает Н. Л. Краевскни (1957), макроскопические изменения почек в раннем и скрытом периодах острой лучевой болезни отражают общее нарушение гемодинамики облученного организма. Поэтому при патологоанатомическом исследованни макроскопически наблюдаются в той или иной степени выраженные признаки острого венозного полнокровия и отека органа.
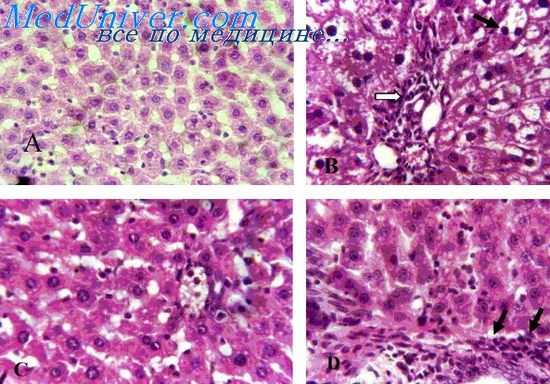
Микроскопически при этом обнаруживается расширение и полнокровие кровеносных сосудов и клубочковых капилляров, умеренная метахромазия мезангия клубочков, утолщение в них базалыюй мембраны за счет накопления ШИК-положительных веществ, наличие в просвете капсулы белковой жидкости, набухание эпителия извитых канальцев, отек межуточной тками. Такие же изменения наблюдаются и в случае ранней гибели организма от острейшей формы лучевой болезни и смерти «под лучом».
При смертельных исходах в разгар заболевания почки полнокровны и увеличены за счет набухания паренхимы. Корковое вещество утолщено, граница между ним и мозговым веществом нечеткая. Соответственно с тяжестью геморрагического диатеза во всем организме в почках наблюдаются также нарушения кровообращения и признаки повышенной проницаемости кровеносных сосудов в виде множественных геморрагии в корковом и мозговом веществе и в слизистой оболочке лоханок, а также полнокровие пирамид на границе с корковым слоем.
Кровоизлияния возможны и в стенке мочевого пузыря. Размеры кровоизлияний могут варьировать от крупноточечных до обширных апоплексии. В микроскопической картине, как правило, отмечается сочетание признаков расстройства кровообращения и повышенной проницаемости кровеносных сосудов с дистрофическими изменениями эпителия канальцев. Интерстициальные кровеносные сосуды и клубочковые капилляры, как лравило, расширены и переполнены кровью. Стенки кровеносных сосудов, особенно приносящих артериол клубочков, находятся в состоянии плазматического пропитывания.
Во многих клубочках капиллярные петли гомогенизированы вследствие набухания и гибели эндотелия, накопления в мезангии кислых мукополисахаридов и ШИК-положительных веществ. В просветах клубочков встречаются эритроциты и богатая белком жидкость, сдавливающая капиллярные петли.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Обращает на себя внимание переполнение кровью синусоидных капилляров и центральных вен за счет сброса в них артериальной крови по артериовенозным анастомозам [Мардынская В. П. и др., 1976], расширение лимфатических сосудов и желчных капилляров, отек пери'капиллярных пространств и стромы. Отмечаются дистрофические изменения в гепатоцнтах, большое количество двуядерных клеток с крупными ядрами неправильной формы. В цитоплазме ретикулоэндотелиоцитов выявляются большие капли жира и железосодержащий пигмент.
При облучении в массивных дозах (1000—30000Р) и гибели облученного организма в течение первых 3 сут явления острого нарушения гемоцнркуляции могут быть настолько значительными, что ткань печени принимает мускатный вид вследствие прекращения сброса крови в центральные вены. При микроскопическом исследовании в этом случае обнаруживается резкое расширение и переполнение кровью синусоидных капилляров, диапедезные кровоизлияния, вспенивание и вакуолизация цитоплазмы гепатоцитов, что придаст им большое сходство с состоянием гепатоцитов при шоке.
В период разгара заболевания развивается массивный отек, центральная часть большинства долек утрачивает обычное радиальное расположение гепатоцитов. В их цитоплазме снижается активность окислительно-восстановительных ферментов, кислой фосфатазы, повышается активность щелочной фосфатазы. Вновь уменьшается содержание гликогена. При электронно-микроскопическом исследовании обнаруживается дискомплексация цитоплазматическои сети и другие ультраструктурные изменения [Хамндов Д. X. и др., 1970].
В этот период заболевания выявляются признаки белковой и жировой дистрофии в виде крупно- и мелкокапельной жировой инфильтрации за счет нейтрального жира при низком содержании фосфолипидов. В гепатоцитах обнаруживается большое количество бурого пигмента, который не красится судаком, дает отрицательную реакцию на ионное железо, желчный и формалиновый пигменты. Ядра гепатоцитов или увеличены, содержат отдельные глыбки хроматина, или пикнотичны. На периферии долек гепатоциты сохраняют обычный вид и четкое радиальное расположение.
Встречаются мелкие участки центрального некроза, которые следует рассматривать как следствие нарушения гемодинамики. Массивных геморрагии, как в желудке, кишечнике н легких, в печени обычно не бывает, хотя при микроскопическом исследовании часто обнаруживаются диапедезные кровоизлияния.
В просветах капилляров и мелких сосудов нередко встречаются бактериальные эмболы без признаков воспаления в окружающей ткани.
Отчетливые изменения, как правило, обнаруживаются в строме в виде расплавления и фрагментации аргирофильных волокон, гомогенизации и метахромазии коллагеновых волокон. Грубые изменения возникают и в сосудах в результате плазматического пропитывания и фибриноидного некроза стенок.
К концу периода выраженных явлений количество липидов в цитоплазме гепатоцитов резко увеличивается, одновременно нарастает плазматическое пропитывание стенок кровеносных сосудов, вокруг которых встречаются наибольшие кровоизлияния. Уменьшается, количество звездчатых ретикулоэндотелиоцитов, а в сохранившихся обнаруживается большое количество фагоцитированного жира и бурого пигмента. Аналогичные морфологические изменения были обнаружены в печени людей, погибших от взрыва атомных бомб или после смертельного лучевого поражения в результате несчастных случаев [Краевский Н. А., Иванов А. Е., 1961; Hempelmann L. et al., 1952].
Тяжесть лучевого поражения печени. Острая лучевая болезнь печени
Кроме величины общей или локальной дозы облучения, тяжесть структурных изменений в кишечнике во многом зависит от вида излучения. В частности, при воздействии протонов высоких энергий, изменения в желудочно-кишечном тракте выражены меньше, чем после облучения в равных дозах рентгеновскими лучами [Рыжов А, И. 1970], а после облучения быстрыми нейтронами, наоборот, возникают более тяжелые и длительные поражения [Лебедева Г. А., 1965]. После нейтронного облучения в минимальной смертельной дозе кишечный синдром является непосредственной причиной смерти значительно чаще, чем после облучения рентгеновскими лучами в эквивалентных дозах [Симоненкова В. А., 1973].
Долгое время существовало представление о значительной радиорезистентности печени к действию ионизирующего излучения. На это было обращено внимание и при патологоанатомических исследованиях людей, погибших от взрывов атомных бомб в 1945 г. [Liebow A. et al., 1949], а также в случае патоморфологического изучения печени животных, облученных при экспериментальном взрыве у аттола Бикини [Tullis J., 1949]. Вместе с тем последующие экспериментальные исследования показали, что печень является органом в достаточной степени чувствительным к действию радиации [Иванов А. Е., 1956; Краевский Н. Л., 1957; Федоренко Б. С., 1971; Токин И. Б., 1971; Ярлова П. В., Пинчук Л. Б., 1976].
Однако следует заметить, что в силу физиологических особенностей органа и прежде всего больших компенсаторных возможностей выраженные морфологические изменения наблюдаются только после воздействия в дозе более 1000 рад, хотя на субклеточном уровне морфологические нарушения обнаруживаются сразу же после облучения и в меньших дозах [Корупу В. Я., 1964].
При облучении в дозах, вызывающих гибель организма на высоте заболевания (500—1000 Р), в первые часы после облучения отмечаются признаки острого нарушения кровотока в виде неравномерного расширения артерии, особенно сегментарных 3—4-го порядка. Электронно-микроскопически в гепатоцитах в это время обнаруживается просветление цитоплазматической сети, набухание и вакуолизация ее мембран, резкая осмнофилия, уменьшение гликогена [Корупу В. Я., 1964; Андрианов В. И. и др., 1975].
Гистохимическое изучение содержания нуклеиновых кислот также показывает, что уже в первые часы после облучения увеличено содержание РНК в цитоплазме гепатоцитов, причем она распределяется диффузно по клетке, а не в виде гранул, как это обычно бывает у здоровых животных. В то же время содержание ДНК в тех же клетках бывает сниженным. В дальнейшем имеет место уменьшение содержания обеих нуклеиновых кислот [Куршакова Н. Н., 1958, 1961]. Изменение нуклеиновых кислот сочетается с кратковременным повышением активности кислой фосфатаэы [Nevent P. et al., 1973], глюкозо-6-фосфат-дегидрогеназы [Васютинская Е. М. и др., 1974], сукцинат-дегидрогеназы и цитохромоксидазы [Иванов А. Е., Куршакова Н. Н., 1960, 1961].
Кроме того, происходит резкое снижение содержания гликогена [Иванов А. Е., Куршакова Н, Н., I960; Хамидов Д. X. и др., 1970], который при этом обнаруживается в небольшом количестве только в центральной части долек и, что существенно, в просветах внутридольковых капилляров и центральных вен. На этом основании можно думать, что в начале заболевания происходит усиленное вымывание гликогена в кровь. Подобное уменьшение содержания гликогена в печени наблюдается и при других стрессовых состояниях, не связанных с действием (ионизирующего излучения, и в то же время не наблюдается при поражении инкорпорированными радиоактивными веществами в остроэффективных дозах [Иванов А. Е., Куршакова Н. Н., 1960].
Поэтому резкое уменьшение содержания гликогена в печени сразу же после одномоментного массивного внешнего облучения, по-видимому, связано с неспецифической острой рефлекторной реакцией организма на лучевую травму. Одновременно с изменением содержания гликогена выявляются признаки нарушения липидного обмена. Уже в первые часы после облучения наблюдается повышение содержания нейтрального жира и фосфолнпидов, преимущественно в периферической зоне долек [Иванов А. Е., Куршакова Н. П., 1960, 1961]. Однако степень первоначального снижения биоэнергетических процессов во многом зависит не только от дозы, но и от вида ионизирующего воздействия. Так, например, при облучении плотноионизирующим излучением (быстрые нейтроны) значительно больше нарушается АТФ-азная активность ядерных компонентов гепатоцитов, тогда как при воздействии рентгеновских лучей преимущественно изменяется АТФ-азная активность в цитоплазме [Андрианов В. М. и др., 1975J. Через 1—2 суток после облучения, как правило, в гепатоцнтах содержание гликогена несколько восстанавливается. Он распределяется равномерно по всей дольке.
Радиационно-индуцированное поражение печени
Последнее время в общей структуре заболеваний значительную долю занимают патологии гепатобилиарной системы. Помимо токсических поражений отрицательное влияние на печень могут оказывать также другие неблагоприятные факторы, в частности, влияние ионизирующей радиации. Печень, которая в покое обладает небольшой пролиферативной активностью, традиционно относили к радиорезистентным органам, однако многочисленные исследования с использованием различных видов ионизирующих излучений в широком диапазоне доз показали не только чувствительность печени к лучевому воздействию, но и значительные нарушения регенерационных процессов.
Представление о радиационно-индуцированном поражении печени в основном основано на клинических наблюдениях и результатах гистопатологических исследований. На основе клинических наблюдений, многими авторами были разработаны экспериментальные модели для исследования механизма развития радиационно-индуцированного поражения печени. Создание экспериментальных моделей на животных имеет важное значение для лучшего понимания патогенеза и молекулярных механизмов развития патологии.
Печень – самая крупная железа позвоночных. У человека она составляет около 2,5% от массы тела и занимает центральное место в процессах углеводного, белкового, липидного, пигментного метаболизма, а также в процессах детоксикации многочисленных веществ, попадающих в организм, как извне, так и из кишечника и, в частности, путем их окисления, конъюгирования, декарбоксилирования.
В последнее время в общей структуре заболеваний значительную долю занимают патологии гепатобилиарной системы, заболевания печени стоят на восьмом месте среди причин смертности населения репродуктивного возраста в разных странах. Одной из наиболее распространенных причин данных заболеваний являются воздействия гепатотоксических агентов. К ксенобиотикам, поступающим в организм человека и животных и способным вызвать поражения печени, относятся производственные токсикаты, медикаментозные средства, алкоголь, вещества, загрязняющие окружающую среду [1, 2]. Помимо токсических поражений отрицательное влияние на печень могут оказывать также другие неблагоприятные факторы, в частности, влияние ионизирующей радиации.
Печень традиционно относили к радиорезистентным органам, однако многочисленные исследования с использованием различных видов ионизирующих излучений в широком диапазоне доз показали не только чувствительность печени к лучевому воздействию, но и значительные нарушения регенерационных процессов.
Острому радиационному воздействию ткань печени подвергается не только при лучевой терапии злокачественных новообразований гепатобилиарной системы, но и при лучевой терапии раковых заболеваний желудочно-кишечного тракта из-за ее близкого расположения и больших размеров [3, 4]. Печень также может подвергаться воздействию излучения во время подготовки к аллогенной трансплантации костного мозга или гемопоэтических стволовых клеток [5]. Радиационно-индуцированное поражение тканей печени связывают с многими осложнениями, встречающимися после лучевой терапии, при этом отмечается ухудшение способности к гепатоцеллюлярной регенерации и необратимая печеночная недостаточность [6]. Хотя патофизиологические характеристики радиационно-индуцированного поражения печени у людей относительно хорошо охарактеризованы, точные механизмы развития этой патологии остаются в значительной степени мало изученными. В результате отсутствуют эффективные терапевтические меры для предотвращения и терапии прогрессирования данной патологии.
Патогенез радиационно-индуцированного поражения печени включает комплексные и многоклеточные реакции, связанные с сосудистыми изменениями, усиление синтеза коллагена и последовательную активацию ключевых факторов роста и цитокинов, таких как фактор некроза опухолей альфа (TNF-α), трансформирующий фактор роста бета (TGF-β) и морфогенетический фактор – фактор hedgehog (Hh ), которые являются важными регуляторами в реакции восстановления на повреждение печени [7]. Радиационное воздействие вызывает острое или хроническое поражение печени. Ранние эффекты облучения включают повреждение ДНК, окислительный стресс и образование реактивных форм кислорода, приводящее к гепатоцеллюлярному апоптозу и острым воспалительным реакциям в облученных тканях [8]. Хотя гепатоциты считаются более радиорезистентными, чем непаренхимные клетки, индуцированное радиацией высвобождение TNF-α клетками Купфера увеличивает восприимчивость гепатоцитов к радиационно-индуцированному апоптозу и в конечном итоге индуцирует гепатоцеллюлярную смерть [9].
Массовая гибель гепатоцитов, вызванная повторными или однократным острым воздействием, также связана с компенсаторной пролиферацией миофибробластических звездчатых клеток печени, активация которых, является ключевым клеточным явлением, лежащим в основе фиброза печени [7]. При повреждении печени звездчатые клетки печени трансдифференцируются от покоящихся в активированные миофибробластические звездчатые клетки, основные коллагенообразующие клетки в печени. Активация миофибробластических звездчатых клеток также считается важным процессом в развитии радиационно-индуцированного поражения печени, поскольку эти клетки обладают высокой радиочувствительностью и накапливаются в печени пациентов после лучевой терапии. Так же в гистологических образцах печени человека после облучения, наблюдали повреждение и апоптоз синусоидных эндотелиальных клеток, что ведет к нарушениям микроциркуляторного кровотока, и как следствие – к повреждению гепатоцитов. Повреждение эндотелия печеночных сосудов активирует коагуляционный каскад и приводит к осаждению фибрина и образованию сгустков в центральных венах и печеночных синусоидах. Последующая гипоксия приводит к гибели гепатоцитов и атрофии внутренней печеночной пластинки, способствуя дисфункции печени [10]. На более поздних стадиях фиброзная реакция в синусоидах может привести к облитерации центральных вен, что приводит к веноокклюзионной болезни печени. Таким образом, при радиационно-индуцированном поражении печени происходит сложное и динамическое взаимодействие между различными типами клеток печени.
Представление о радиационно-индуцированном поражении печени в основном основано на клинических наблюдениях и результатах гистопатологических исследований. На основе клинических наблюдений, были разработаны экспериментальные модели для исследования механизма развития радиационно-индуцированного поражения печени. Создание экспериментальных моделей на животных имеет важное значение для лучшего понимания патогенеза и молекулярных механизмов развития патологии. Наиболее широко используются в подобных исследованиях лабораторные мыши и крысы, несколько в меньшей степени используются обезьяны, собаки и кролики. Однако экспериментальные модели на лабораторных животных в большинстве исследований не показали сходных патологических характеристик для радиационно-индуцированного поражения печени у человека. Кроме того, существует ряд трудностей при сравнении и обобщении данных полученных в экспериментах на животных: это не только значительные межвидовые различия, но и различная чувствительность линий лабораторных животных, исследователями используются разные способы и дозы облучения, разные комбинированные радиационно-химические воздействия, время наблюдения и так далее. Эти различия в проведении экспериментов приводят к различиям в результатах исследований, что препятствует пониманию механизма развития радиационно-индуцированного поражения печени [11].
Грызуны имеют много преимуществ в качестве экспериментальных моделей, таких как их анатомическое, физиологическое и генетическое сходство с людьми. Лабораторные крысы наиболее часто используются в экспериментальных исследованиях радиационно-индуцированного поражения печени. Наиболее распространенными линиями крыс являются Sprague-Dawley (SD) и крысы Wistar. При облучении крыс Wistar однократно в дозе 6 Гр общего облучения, было отмечено значительное увеличение в печени уровня ПОЛ и окислительного стресса, о чем свидетельствовало повышенное содержание малонового диальдегида, основного продукта перекисного окисления липидов и цитотоксического оксида азота в печени [12]. Но другими авторами было высказано замечание, что хотя облучение всего тела вызывает окислительный стресс в печени, неуместно исследовать радиационно-индуцированные печеночные реакции, потому что облучение всего тела может вызывать иммуносупрессию, эндокринную дисфункцию и множественную органную недостаточность, которые, в свою очередь, являются факторами риска поражения печени [13]. Поэтому в ряде исследований было применено локальное облучение печени, которое, по-видимому, более подходит для исследования радиационно-индуцированных эффектов в печени. При однократном облучении области брюшной полости SD-крыс в дозе 8 Гр, через 36 ч после воздействия отмечены кровоизлияния, расширение центральной вены, деструкция гепатоцитов с перинуклеарной вакуолизацией [13]. Однако, когда крыс Wistar подвергали однократному локальному облучению печени в дозе 25 Гр, через 24 и 48 ч. наблюдалось только умеренное гепатоцеллюлярное повреждение и стеатоз [14], что может свидетельствовать о разной радиочувствительности этих линий крыс.
Кроме того, доза облучения влияет на реакцию печени. Когда крысы линии SD были подвержены облучению печени в дозе 30 Гр, через 6 месяцев наблюдался радиационный фиброз печени [15]. Однако, когда крысы этой же линии подвергались облучению печени в дозе 60 Гр, фиброз печени был обнаружен уже через 8 недель после облучения. Эти наблюдения свидетельствуют о том, что фиброз печени увеличивается по мере увеличения дозы облучения.
Однако увеличение дозы облучения увеличивает вероятность летальности. Rave-Frank с соавторами [16] использовали фракционированное облучение, которое обычно используется в клинике при лучевой терапии, чтобы минимизировать поражение тканей. Когда крысы Wistar подвергались локальному облучению печени, в фракционированной дозе 2 Гр пять раз в неделю в течение 6 недель (общая доза составила 60 Гр), в облученной печени через 3 месяца отмечено повышенные уровни ALP без некроза, воспаления и фиброза. Тогда как другие авторы показали [17], что та же доза облучения SD-крыс путем однократного облучения вызывала дисфункцию печени, апоптоз гепатоцитов и фиброз через 8 недель после облучения. Эти данные свидетельствуют о том, что фракционированное облучение проявляет гораздо меньшую тканевую токсичность, чем однократное облучение. Однако для выяснения влияния однократного и фракционированного облучения на печень требуются повторные эксперименты в идентичных условиях по одному протоколу [11].
Мыши все чаще используются для создания экспериментальных моделей радиационно-индуцированного поражения печени, но в относительно меньшей степени по сравнению с крысами. При общем однократном облучении самок мышей линии C57BL/6 в дозе 20 Гр, через 1 неделю в печени животных наблюдали жировую инфильтрацию гепатоцитов, увеличение количества апоптотических клеток, а также был отмечен повышенный фиброз [18]. Другие авторы также отмечали жировую дистрофию, апоптоз клеток печени и фиброз у облученных самок в большей степени, чем у самцов мышей после общего однократного облучения в дозе 6 Гр [19]. Эта гендерная разница в радиочувствительности, влияет на результаты экспериментального радиационно-индуцированного поражения печени в моделях на животных.
У мышей, которые были подвергнуты облучению верхней области брюшной полости однократно в дозе 6 Гр, наблюдали повышенные уровни триглицеридов в печени, АЛТ, АСТ и апоптоз, жировую инфильтрацию и усиленный фиброз через 6 и 10 недель после облучения; однако у данных животных не было выявлено ни одной из гистопатологических особенностей радиационно-индуцированного поражения печени [20]. Другими авторами, при использовании локального фракционированного облучения в 6 Гр в неделю в течение 5 недель (общая доза 30 Гр) через 10 недель после курса облучения был отмечен поздний ответ, который проявлялся разрушением клеток паренхимы и значительным фиброзом, чего не было отмечено на ранних сроках [21]. Таким образом, при фракционированном локальном облучении у крыс наблюдались умеренные повреждения, тогда как в экспериментах на мышах отмечались серьезные повреждения с поздним ответом. Однако эти результаты тяжело сравнивать, поскольку виды, доза облучения, частота фракционированного излучения и последующие наблюдения, используемые интервалы времени были различны.
Хотя гепатоцеллюлярные повреждения и сопутствующий фиброз установлены и воспроизводимы при облучении крыс и мышей, но отмечено развития веноокклюзионной болезни печени и морфологических признаков радиационно-индуцированного поражения печени, которые свойственны радиационному повреждению печени у человека. Кроме того, большинство исследователей используют животных, не имеющих ни опухолей, ни хронических заболеваний или других патологий, что резко разнится с ситуацией в клинике для пациентов, получающих лучевую терапию.
Таким образом, для получения адекватных моделей радиационно-индуцированного поражения печени у грызунов должны быть установлены и оптимизированы условия эксперимента, такие как доза облучения, время экспозиции, однократное или фракционированное облучение и последующее время наблюдения. Для лучшего выяснения патогенеза радиационно-индуцированного поражения печени необходимы дальнейшие исследования в экспериментальных моделях на животных, которые бы сочетали не только радиационное воздействие, но и другие патологии.
Литература
- Ильченко, Л.Ю. Поражения печени у токсикоманов. / Л.Ю. Ильченко и др. // Гепатология — 2003. — № 2. — С. 22 — 26.
- Chow, J.H. The encyclopedia of hepatitis and other liver disesases. / J.H. Chow, C. Chow. – Facts On File, Inc., N.-York, U.S.A., — 2006. – 372 p.
- Benson R, Madan R, Kilambi R, Chander S. Radiation induced liverdisease: a clinical update. // J. Egypt Natl Canc Inst. – 2016; 28: 7–11.
- Li G, Wang J, Hu W, Zhang Z. Radiation-induced liver injury inthree-dimensional conformal radiation therapy (3D-CRT) for postoperativeor locoregional recurrent gastric cancer: risk factors and dose limitations. // PLoS ONE. – 2015; 10.
- Qiao J, Fu J, Fang T, Huang Y, Mi H, Yang N et al. Evaluation of the effectsof preconditioning regimens on hepatic veno-occlusive disease in mice afterhematopoietic stem cell transplantation. // Exp. Mol. Pathol. – 2015; 98: 73–78.
- Guha C, Sharma A, Gupta S, Alfieri A, Gorla GR, Gagandeep S et al.Amelioration of radiation-induced liver damage in partially hepatectomizedrats by hepatocyte transplantation. // Cancer Res. – 1999; 59: 5871–5874.
- Lee UE, Friedman SL. Mechanisms of hepatic fibrogenesis. // Best. Pract. Res.Clin.Gastroenterol. –2011; 25: 195–206.
- Robbins ME, Zhao W. Chronic oxidative stress and radiation-induced latenormal tissue injury: a review. // Int. J. Radiat. Biol. – 2004; 80: 251–259.
- Christiansen H, Saile B, Neubauer-Saile K, Tippelt S, Rave-Frank M, Hermann RM et al. Irradiation leads to susceptibility of hepatocytes to TNF-alpha mediated apoptosis. // Radiother Oncol. – 2004; 72: 291–296.
- DeLeve LD, Shulman HM, McDonald GB. Toxic injury to hepatic sinusoids: sinusoidal obstruction syndrome (veno-occlusive disease). // Semin. Liver. Dis. – 2002; 22: 27–42.
- Kim J., Jung Y. Radiation-induced liver disease: current understanding and future perspectives // Experimental & Molecular Medicine. – 2017. № 49. e359; doi:10.1038/emm.2017.85.
- Taysi S., Koc M., Buyukokuroglu M.E., Altinkaynak K., Sahin Y.N. Melatonin reduces lipid peroxidation and nitric oxide during irradiation-induced oxidative injury in the rat liver. // J. Pineal Res 2003; 34: 173–177.
- Ozyurt H, Ozden AS, Cevik O, Ozgen Z, Cadirci S, Elmas MA et al. Investigation into the role of the cholinergic system in radiation-induced damage in the rat liver and ileum. // J Radiat Res 2014; 55: 866–875.
- Christiansen H, Batusic D, Saile B, Hermann RM, Dudas J, Rave-Frank M et al. Identification of genes responsive to gamma radiation in rat hepatocytes and rat liver by cDNA array gene expression analysis. // Radiat Res 2006; 165: 318–325.
- Du SS, Qiang M, Zeng ZC, Zhou J, Tan YS, Zhang ZY et al. Radiation-induced liver fibrosis is mitigated by gene therapy inhibiting transforming growth factor-beta signaling in the rat. // Int J Radiat Oncol Biol Phys. – 2010; 78: 1513–1523.
- Rave-Frank M, Malik IA, Christiansen H, Naz N, Sultan S, Amanzada A et al. Rat model of fractionated (2 Gy/day) 60 Gy irradiation of the liver: long-term effects. // Radiat Environ Biophys 2013; 52: 321–338.
- Zhang J, Zhou S, Zhou Y, Feng F, Wang Q, Zhu X et al. Hepatocyte growth factor gene-modified adipose-derived mesenchymal stem cells ameliorate radiation induced liver damage in a rat model. // PLoS ONE 2014; 9: e114670.
- Wang S, Hyun J, Youn B, Jung Y. Hedgehog signaling regulates the repair response in mouse liver damaged by irradiation. // Radiat Res 2013; 179: 69–75.
- Wang S, Lee K, Hyun J, Lee Y, Kim Y, Jung Y. Hedgehog signaling influences gender-specific response of liver to radiation in mice. Hepatol Int 2013; 7: 1065–1074.
- Wang S, Lee Y, Kim J, Hyun J, Lee K, Kim Y et al. Potential role of Hedgehog pathway in liver response to radiation. PLoS ONE 2013; 8:
- Kim J, Wang S, Hyun J, Guy CD, Jung Y. Hedgehog signaling is associated with liver response to fractionated irradiation in mice. Cell Physiol Biochem 2016; 40: 263–276.

Веялкина Наталия Николаевна
© Наталия Веялкина, кандидат биологических наук, заведующая лабораторией экспериментальных биологических моделей
Читайте также:
