Мультицентрические множественные опухоли. Механизмы развития мультицентричных опухолей
Добавил пользователь Дмитрий К. Обновлено: 09.01.2026
Мультицентрические множественные опухоли. Механизмы развития мультицентричных опухолей
Особый интерес представляют многочисленные первично множественные злокачественные опухоли, относительно которых могут быть высказаны определенные суждения об их вероятной закономерной связи. Данные экспериментальной и клинической онкологии позволяют выделить так называемые мультицентрические первично множественные злокачественные опухоли.
Теория мультицентричности происхождения последних исходит из предположения, что тот или иной бластомогенный фактор (химические канцерогены, лучевые воздействия, вирусы и др.) часто воздействует на весь организм в целом или благодаря чисто анатомическим связям (желудочно-кишечный тракт, мочевыводящая система, дыхательные органы), или в результате определенной функциональной связи отдельных органов между собой.
Поэтому появление предопухолевых изменений, а затем и опухолей необязательно должно характеризоваться строгой локальностью и может одновременно или последовательно иметь место в различных участках человеческого организма.
Можно предполагать, что такой механизм канцерогенеза в первую очередь будет проявляться в какой-либо одной определенной ткани в результате снижения общей устойчивости и выражаться в виде образования опухолей одной гистологической структуры. Наиболее убедительна теория мультицентрнчности возникновения первично множественных злокачественных опухолей в тех случаях, когда они располагаются в одном органе и имеют единое тканевое происхождение и гистологическую структуру (множественные опухоли кожи, пищевода, желудка, различных отрезков кишечника, мочевого пузыря, легкого и т. п.).
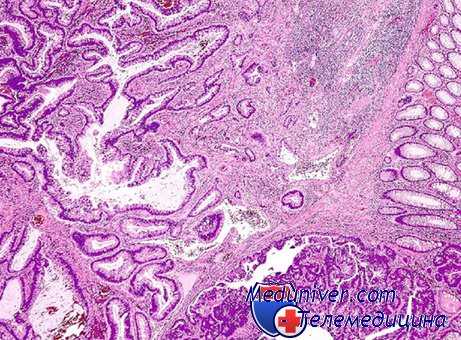
Подобное суждение вполне соответствует и экспериментальным данным, полученным при-воздействии химических канцерогенных веществ и иллюстрирующим возникновение опухолей одного гистологического строения в одном органе (Н. Н. Петров, 1947). Не менее убедительна также мультицентричность возникновения первично множественных злокачественных опухолей единой тканевой природы и гистологического строения в одной системе анатомически и функционально связанных органов (желудочно-кишечный тракт, мочевыводящие пути, женские половые органы и др.), в том числе парных (молочные железы, почки, яичники, яички и др.).
Определенные трудности возникают по отношению к множественным злокачественным опухолям единой тканевой и гистологической структуры, локализующимся в органах различных систем. Некоторые исследователи (Moertel с соавторами, 1961) не считают возможным рассматривать опухоли подобной локализации с позиции их мультицентричности. Мы считаем, что безоговорочное исключение указанных опухолей из разряда мультицентрических пока еще не является обоснованным.
Общность тканевого происхождения и гистоструктуры опухолевых поражений заставляет предполагать, что патологический процесс является проявлением какой-то общей реакции данной ткани всего организма независимо от ее расположения в той или иной системе. Можно допустить, что одни и те же канцерогенные воздействия вызывают подобную реакцию, которая в конечном счете завершается возникновением первично множественных опухолей мультицентрического генеза.
Это предположение в определенной мере согласуется с новыми экспериментальными данными, которые показывают, что у животных при патологических поражениях различных органов образуются аутоантитела, воздействующие на одноименные ткани всего организма в целом (Грин, 1961; Канано, 1962; И. Н. Майский, Г. П. Айрапетян, Ы. Л. Козлова, М. Н. Ниловский, Г. В. Суворова, С. В. Сухоруких и Л. Л. Хунданова, 1963).
Допустимо предположить, что и в жизни человека неоднократно возникают причины, ведущие к образованию аутоантител к определенным тканевым структурам организма, что приводит к ослаблению жизнедеятельности одноименной ткани различных систем, а это в свою очередь способствует развитию множественных патологических процессов вообще, в том числе быть может и мультицентрическнх опухолей.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Теория мультицентрического канцерогенеза. Гормональные причины мультицентричных опухолей
Наиболее подробные клинические данные о мультицентрических раках опубликованы Moertel с соавторами (1961), которые устанавливают 15 основных типов этой формы первично множественных злокачественных опухолей. Вместе с тем указанные авторы существенно ограничивают применение этой теории, настаивая на необходимости непрерывной анатомической тканевой связи органов, в которых развиваются злокачественные опухолевые процессы.
Следует отметить, что теория мультицентрического канцерогенеза находится в стадии разработки и многие ее вопросы остаются неясными и далеки от полного их разрешения. Мы считаем, что эта теория может быть использована при попытках объяснения канцерогенеза многих первично множественных злокачественных опухолей единой тканевой природы и одной гистологической структуры независимо от их локализации по органам и системам.
Дифференцированное статистическое изучение частоты первично множественных злокачественных опухолей позволило высказать определенное суждение о значении гормонального фактора как причины их возникновения; это относится, например, к симметричным поражениям половых желез (яичек и яичников), а также одновременным поражениям женских половых органов и молочных желез. Moore, TsuKada, Regelson, Pickren и Bross (1965) разработали специальный метод вычисления ожидаемой частоты возникновения синхронных первично множественных опухолей; при этом синхронными считали такие опухоли, которые диагностировали с интервалом не более чем 12 месяцев.
Статистическая обработка данных показала, что у женщин с локализацией обеих опухолей в гормонально зависимых органах (молочная железа, гениталии) наблюдаемая частота возникновения синхронных опухолей превышала ожидаемую, что, по мнению авторов, свидетельствует о наличии общих этиологических факторов в развитии синхронных первично множественных злокачественных опухолей этих органов. По-видимому, углубленное и детальное изучение данного вопроса позволит установить значение гормональных нарушений и при некоторых других локализациях первично множественных опухолевых поражений.
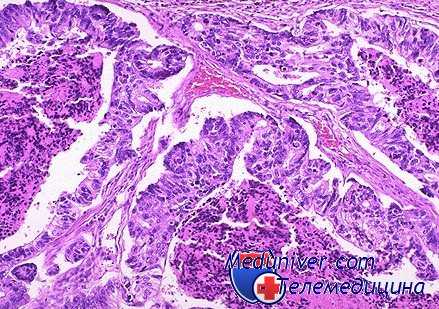
Известным обоснованием для такого предположения являются результаты экспериментальных исследований, проведенных в нашем институте (Д. М. Абдурасулов, И. Н. Димант, А. Г. Столярова, 1962; И. Н. Димант и Д. М. Абдурасулов, 1963). Изменением гормонального фона с одновременным воздействием канцерогенных веществ удалось получить истинные новообразования мозга и перевиваемые штаммы злокачественных опухолей головного мозга у крупных лабораторных животных (крысы, кролики, собаки), чего не удалось достигнуть до сих пор воздействием только одних канцерогенных веществ.
Непосредственное введение в мозг канцерогенных веществ вызывает, как правило, образование в нем опухолевого процесса, в который вовлекаются собственно ткани мозга и его оболочек. Лишь в одном случае нами (И. И. Димант, Д. М. Абдурасулов, 1963) наблюдалось развитие внечерепной фибросаркомы и внутримозгового новообразования (полиморфноклеточная глиобластома). Используя указанную методику (искусственного создания нарушений гормонального баланса), но при пероральном введении канцерогенных веществ (2 ФАА, мстилнитрозомочевина) сотрудниками нашего института (М. И. Ли, А. Г. Столярова, И. Н. Димант, 1966) были получены у крыс множественные опухоли различного тканевого происхождения, одновременно локализующиеся в головном мозгу и печени, головном мозгу и пищеводе, головном мозгу и кишечнике.
С. М. Слинчак (1966) в эксперименте также получил множественные опухоли молочной железы у крыс путем воздействия 9, 10-диметил-1,2-бснзантрацеиом (внутривенно по 10 мг в течение 6 недель) с последующим изменением гормонального фона (подопытным самцам крыс удаляли один яичник и большая часть второго). Контролем служили крысы, которые подвергались воздействию только канцерогенного вещества.
В этой группе из 50 крыс к концу введения канцерогена в живых остались 35, из них у 28 на 84-й день возникли опухоли молочной и цымбаловой желез, в том числе у 16 — поражение только молочной железы, из которых у 8 были множественные опухоли. В подопытной группе из 50 крыс к концу введения канцерогена в живых остались 48, а опухоли молочной и цымбаловой желез возникли на 53-й день опыта у 40 животных; в том числе у 35 — поражение локализовалось только в молочной железе, из которых у 30 крыс были множественные опухоли. В опытах С. М. Слинчака (1966) удаление опухоли молочной железы удлиняло жизнь крыс, но не предотвращало развитие последующих новых опухолей.
Таким образом, и в этих опытах изменение гормонального фона существенно повышало возникновение как одиночных, так и в особенности множественных опухолей молочной железы, значительно сокращало сроки их появления и не оказывало влияния на развитие последующих новых опухолей. Как утверждает С. М. Слинчак (1966), по-видимому, ненормальные гормональные влияния, вызванные как канцерогеном, так и субтотальной кастрацией, продолжают оставаться в организме в течение всей последующей жизни животного и способствовать или вызывать развитие все новых опухолей в молочных железах и других гормонозависимых органах.
Классификация множественных опухолей по Д.М. Абдурасулову и К.Е. Никишину. Принципы классификации множественного рака
Д.М. Абдурасулов и К.Е. Никишин разделяют первично множественные злокачественные опухоли прежде всего по времени их возникновения. Как было сказано, этот признак теоретически является условным, поскольку фактически он основан не на возникновении, а на выявлении опухоли. Однако он имеет большое клиническое значение, так как им в значительной степени определяются диагностика, лечение и прогноз заболевания.
Д.М. Абдурасулов и К.Е. Никишин считают необходимым подчеркнуть существование первично множественных злокачественных опухолей, при которых последовательность появления узлов опухоли носит смешанный характер: например, вначале одновременно (синхронно) выявляются две самостоятельные опухоли, а вслед за этим последовательно (метахронно) через больший или меньший интервал определяется узел новой опухоли; наблюдаются и обратные соотношения во времени появления опухолей. На эту важную в практическом отношении особенность в литературе недостасточно обращается внимания.
Каждая из этих трех основных групп первично множественных злокачественных опухолей, различающихся по последовательности выявления отдельных опухолей, в свою очередь делится на две подгруппы по признаку тканевой принадлежности. Это общепринятое для солитарных опухолей деление в отношении первично множественных форм имеет тот смысл, что в отдельных случаях (при различной тканевой принадлежности множественных опухолей) с полной убедительностью доказывает первичную множественность злокачественного опухолевого процесса.
Кроме того, тканевая принадлежность опухоли является одним из отправных пунктов при выборе метода лечения (оперативного, лучевого или комбинированного), а также и в установлении прогноза.
Опухоли одной тканевой принадлежности, в свою очередь, разделяются по их гистологической структуре. Существенное различие гистологической структуры узлов опухоли является важным критерием первично множественного характера опухолей. Обнаружение нескольких злокачественных опухолей одной гистологической структуры не исключает первичной множественности, но для доказательств:; этого требуется применение дополнительных критериев, позволяющих отвергнуть метастатический или рецидивный характер опухолевого процесса.
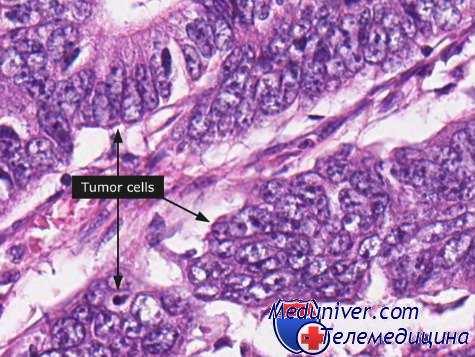
По всем указанным признакам первично множественные злокачественные опухоли разделяются на 9 групп, из которых каждая в дальнейшем делится по локализации опухолевого процесса.
Этот завершающий раздел классификации является важнейшим этапом группировки не только потому, что на этом звене концентрируются основные диагностические, лечебные и прогностические трудности клинической практики, но также потому, что именно здесь могут быть выявлены определенные данные об этиопатогеиезе первично множественных злокачественных опухолей. Д.М. Абдурасулов и К.Е. Никишин считают обоснованным выделение трех типов локализации первично множественных злокачественных опухолей.
Расположение узлов множественной опухоли в одном или парных органах заставляет предполагать и искать факторы для мультицентрического канцерогенеза. Первично множественные опухоли, локализующиеся в органах одной системы, являются материалом для суждения о возможности как мультицентрического, так и дисгормоналыюго этиопатогенеза. Что касается последней группы первично множественных злокачественных опухолей с локализацией их в органах различных систем, то в ней, по-видимому, часто реализуются закономерности случайных совпадений, однако и здесь при дальнейшем тщательном изучении возможно раскрытие иных соотношений.
Приведенная и рекомендуемая классификация не претендует на полное разрешение данной весьма сложной проблемы. Тем не менее она вносит известную систему в клиническое и морфологическое изучение каждого случая разбираемого заболевания, облегчает разрешение трудных задач диагностики и лечения первично множественных злокачественных опухолей и способствует накоплению полноценных и сравнимых материалов для статистических обобщений.
Предлагаемая классификация предусматривает тщательное клиническое изучение больных, применение современных специальных методов обследования, хорошо поставленную патологоанатомическую (в том числе и патогистологическую) службу и четко функционирующую систему диспансерного наблюдения, без которых нельзя разрешить не только теоретические, но и практические задачи, поставленные актуальной проблемой первично множественных злокачественных опухолей.
Дальнейшее изложение материала о первично множественных злокачественных опухолях мы приводим по общепринятому в современной клинической медицине принципу рассмотрения патологических процессов по отдельным анатомо-физиологическим системам человеческого организма. В пределах каждой системы и в соответствии с классификацией раздельно анализируются особенности первично множественных злокачественных опухолей в зависимости от их конкретной локализации — в одном и парных органах, разных органах разбираемой системы, а также при сочетаниях опухолевого поражения данной системы со злокачественными новообразованиями органов других систем.
Одновременно обращено внимание на последовательность выявления опухолевых узлов, их тканевую принадлежность, а также гистологическую структуру.
Первично-множественные опухоли
Первично множественные опухоли – неоплазии, возникающие одновременно или через определенный промежуток времени и не являющиеся метастазами друг друга. Могут быть доброкачественными или злокачественными, мультицентрически располагаться в одном органе, возникать в парных органах, локализоваться в пределах одной системы или нескольких систем. Возникают в результате соматических мутаций или наследственных генетических аномалий. Диагностируются на основании клинических симптомов, лабораторных и инструментальных исследований. Тактика лечения определяется типом, распространенностью, локализацией и степенью злокачественности новообразований.
Общие сведения
Первично множественные опухоли – две или более неоплазии различного генеза, одновременно либо последовательно развившиеся в одном или нескольких органах. В большинстве случаев диагностируются два новообразования. Три узла обнаруживаются у 5-8% пациентов. Случаи четырех и более неоплазий являются крайне редкими и рассматриваются как казуистические. В последние десятилетия отмечается резкое увеличение количества первично множественных опухолей, однако истинная частота их развития пока является предметом исследований.
Согласно статистическим данным, первично множественные опухоли выявляются у 13% пациентов с онкологическими заболеваниями, однако некоторые специалисты указывают, что эта цифра может быть заниженной из-за возможных диагностических ошибок (при определении независимого процесса, как метастаза первичного новообразования) и гибели некоторых больных до появления симптомов второй неоплазии. Лечение первично множественных опухолей осуществляют онкологи, гастроэнтерологи, эндокринологи, маммологи, гинекологи и специалисты в других сферах медицины (в зависимости от локализации новообразований).
Первое упоминание о множественных неоплазиях встречается в трудах Авиценны, который более тысячи лет назад описал двухсторонний рак молочных желез. В XIX веке описания первично множественных опухолей стали все чаще встречаться в специализированной литературе. Наиболее существенный вклад в определение понятия и изучение данной патологии внес немецкий хирург Бильрот. В частности, он первым дал определение подобным патологическим состояниям, отнеся к первично множественным опухолям новообразования различной структуры, локализующиеся в разных органах и дающие собственные метастазы.
В первой половине XX века формулировка Бильтота была пересмотрена. В настоящее время первично множественными опухолями считаются неоплазии, которые могут располагаться в одном или в разных органах. Основным условием отнесения заболеваний к этой категории является одновременное или последовательное появление в организме нескольких независимых друг от друга очагов трансформации клеток. Второе и последующие новообразования не должны возникать в результате контактного распространения, лимфогенного или гематогенного метастазирования.
Причины
Непосредственной причиной развития солитарных и первично множественных опухолей являются генетические мутации, обусловленные несколькими факторами. С учетом особенностей этиопатогенеза различают три основных типа неоплазий: возникшие в результате спонтанных соматических мутаций, образовавшиеся вследствие индуцированных соматических мутаций, являющиеся результатом передающихся по наследству генетических мутаций. Следует учитывать, что подобное разделение является достаточно условным. На практике, скорее, можно выделить преобладающую причину развития, которая сочетается с другими, менее значимыми факторами.
При первично множественных опухолях перечисленные мутации могут сочетаться. Возможны любые комбинации, например, первое новообразование развивается спонтанно, второе – в результате индукции; первое является наследственным, второе – индуцированным; оба рака имеют одну и ту же природу (наследственность, воздействие экзогенных факторов) и т. д. При этом у больных первично множественными опухолями отмечается преобладание индуцированных и наследственных мутаций.
В числе наиболее значимых факторов, индуцирующих развитие первично множественных опухолей, рассматривают курение, проживание в неблагоприятных экологических зонах, профессиональные вредности (контакт с химическими мутагенами на некоторых производствах, превышение установленных нагрузок у радиологов), многократные рентгенологические обследования, лучевую терапию и химиотерапию предшествующих онкологических заболеваний. Вероятность возникновения первично множественных опухолей также повышается при нарушениях питания, иммунодефицитных состояниях, гормональных расстройствах и некоторых эндемических заболеваниях.
В список наследственных синдромов, сопровождающихся облигатным развитием или повышенной вероятностью возникновения онкологических поражений, включают более 100 заболеваний. Первично множественные опухоли развиваются или могут развиться при трети таких заболеваний. Наиболее известными синдромами являются МЭН-1, МЭН-2 и МЭН-3, при которых выявляются множественные эндокринные неоплазии. Кроме того, первично множественные опухоли могут диагностироваться при синдроме Линча, синдроме Гарднера, болезни Гиппеля-Линдау, синдроме Пейтца-Егерса и других.
Классификация
Существует несколько классификаций, созданных на разных этапах изучения данной патологии. Современные специалисты обычно используют классификацию Бебякина, разработанную в 1974 году. Согласно этой классификации выделяют следующие типы первично множественных опухолей:
- С учетом сочетаний: все неоплазии имеют доброкачественный характер; выявляются доброкачественные и злокачественные новообразования; все опухоли протекают злокачественно.
- С учетом последовательности обнаружения: синхронные первично множественные опухоли (обнаруженные одновременно или практически одновременно), метахронные (диагностированные с интервалом 6 и более месяцев), метахронно-синхронные и синхронно-метахронные.
- С учетом функциональных взаимосвязей: гормональнозависимые, функциональнозависимые, несистематизированные.
- С учетом происхождения из определенной ткани: первично множественные опухоли одинакового происхождения и разного происхождения.
- С учетом гистологических особенностей: одинаковой гистологической структуры, разной гистологической структуры.
- С учетом локализации: расположенные в одном органе или парных органах; поражающие несколько органов одной системы; локализующихся в органах различных систем.
Диагностика
Основой успешной диагностики первично множественных неоплазий является комплексный подход, разработанный с учетом особенностей возникновения и течения этой группы заболеваний. Одной из наиболее распространенных проблем при обнаружении первично множественных опухолей является отсутствие четкой клинической картины, характерной для каждого новообразования. Проявления неоплазий могут накладываться друг на друга, симптомы одного из поражений могут быть слабо выраженными, маскироваться под неопухолевое заболевание или имитировать признаки отдаленных метастазов.
Хотя бы частично решить эту проблему позволяют продуманные планы первичного и последующих обследований, составленные с учетом возможности развития первично множественных опухолей. Так, при локализации солитарного новообразования в зоне молочной железы специалисты уделяют пристальное внимание состоянию второй молочной железы и внутренних женских половых органов, при расположении неоплазии в области желудка – состоянию толстого кишечника, кожи, яичников, матки и молочных желез и т. д. План обследования в каждом конкретном случае составляется индивидуально. Решающую роль при постановке диагноза обычно играют радиологические методики (рентгенография, КТ), УЗИ, МРТ и гистологические исследования.
Вероятность развития первично множественных опухолей у онкологических больных в 6 раз выше, чем в среднем по популяции. С учетом этого обстоятельства, все пациенты с такими заболеваниями после лечения должны находиться под диспансерным наблюдением и проходить регулярные обследования. Такая мера позволяет выявлять рецидивы первичной неоплазии и диагностировать метахронные первично множественные опухоли. Риск развития второго онкологического поражения увеличивается в возрасте 55-70 лет, что должно учитываться при планировании обследования пациентов.
Лечение первично множественных опухолей
Лечение синхронных неоплазий осуществляется одновременно. В зависимости от локализации новообразований и состояния больного хирургическое вмешательство может проводиться единовременно либо быть поэтапным. При планировании очередности операций при первично множественных опухолях учитывают степень распространенности каждого онкологического процесса. В ряде случаев по поводу одного новообразования может быть проведено радикальное лечение, по поводу другого – симптоматическое или паллиативное.
При выборе консервативных методик ориентируются на чувствительность каждой опухоли к радиотерапии и различным химиопрепаратам. Тактика лечения метахронных первично множественных опухолей соответствует тактике лечения солитарных новообразований аналогичных стадий и локализаций. Прогноз определяется видом, расположением, стадией и степенью злокачественности первично множественных опухолей. Отдаленные результаты лечения метахронных неоплазий примерно совпадают с результатами терапии одиночных образований. При синхронных процессах прогноз ухудшается.
Болезнь Кастлемана ( Ангиофолликулярная лимфоидная гиперплазия )
Болезнь Кастлемана – это лимфопролиферативное заболевание, которое поражает одну или несколько групп лимфатических узлов. Патология имеет невыясненную этиологию, среди факторов риска выделяют ВИЧ-инфекцию, аутоиммунные процессы, инфицирование герпесвирусами. Заболевание проявляется увеличением одного или нескольких лимфатических узлов, интоксикационным синдромом, диспепсическими и дизурическими явлениями. Для диагностики болезни Кастлемана проводится инструментальная визуализация (УЗИ, КТ, МРТ), биопсия лимфатических узлов. Лечение включает хирургическое удаление очагов гиперплазии, полихимиотерапию и иммунотерапию.
МКБ-10
Необычные клинические проявления были впервые описаны американским патологом В. Кастлеманом в 1954 году. Спустя 2 года на основе полученных данных выделена нозологическая единица, которая получила название болезнь Кастлемана (БК), или ангиофолликулярная лимфоидная гиперплазия. В 1972 году установлены морфологические особенности заболевания и произведено его разделение на гистологические типы. Предполагаемая частота встречаемости – 1 случай на 100 тыс. населения, всего в литературе описано около 400 больных. У 70% пациентов симптоматика развивается в возрасте до 35 лет.
При изучении медицинских историй пациентов с БК установлен ряд ассоциированных патологий, которые повышают вероятность лимфопролиферативного синдрома. Болезнь Кастлемана сочетается с аутоиммунными процессами, множественной миеломой, POEMS-синдромом (11-24% случаев) и заболеваниями кожных покровов (13%). Независимым фактором риска называют ВИЧ-инфекцию, особенно ее терминальную стадию при уменьшении уровня CD4-лимфоцитов менее 200 клеток/мкл.
Патогенез
Ключевым звеном формирования болезни Кастлемана называют гиперпродукцию интерлейкина-6 (IL-6). Вещество участвует в иммунном ответе, процессах кроветворения и развитии острофазовой воспалительной реакции. Интерлейкин вырабатывается разными типами клеток в гиперплазированных лимфатических узлах. С его эффектами на лимфоциты и кровеносные сосуды связывают общие симптомы интоксикации, которые возникают при мультицентрической форме БК.
Такими же механизмами объясняется вирусная этиология заболевания. HHV-8 выделяет вирусный интерлейкин-6, который может напрямую связываться с клеточными рецепторами и вызывать ряд неопластических изменений. Вирус стимулирует выработку сосудистого эндотелиального фактора роста, который отвечает за увеличение проницаемости капилляров и повышенный неоангиогенез.
По расположению очагов лимфатической гиперплазии разделяют локализованную и мультицентрическую формы. В зависимости от морфологии ранее выделяли два варианта болезни Кастлемана: гиалино-васкулярный (ГВВ) и плазмоклеточный (ПКВ). После уточнения причинных факторов заболевания была принята новая гистопатогенетическая классификация, согласно который признано существование 4-х варианта БК:

Симптомы болезни Кастлемана
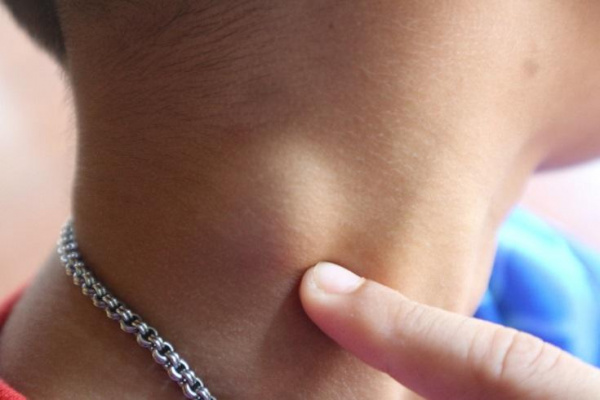
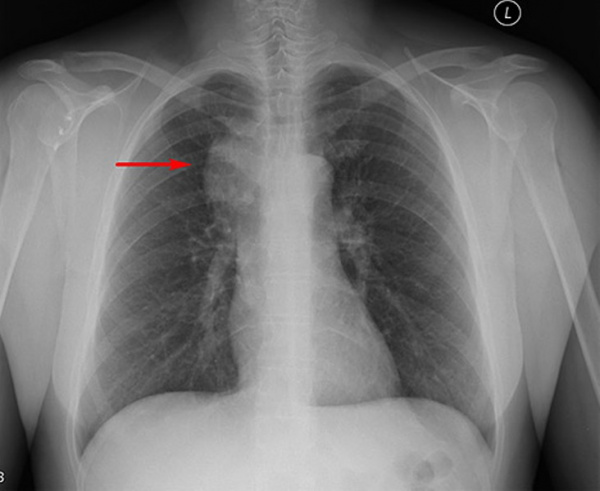
Чаще всего заболевание поражает лимфатические узлы средостения. К типичным локализациям гиперплазии также относят шейные, подмышечные и забрюшинные лимфоузлы. Лимфатический узел имеет диаметр 1-25 см, чаще всего диагностируются опухоли размером 6-7 см. Кожа над ним не изменена, субъективные неприятные ощущения отсутствуют, поэтому пациенты редко обращаются к врачу на раннем этапе.
Мультицентрический и плазмоклеточный варианты патологии зачастую вызывают системные нарушения здоровья. У больных возникает субфебрильная лихорадка, повышенная потливость, мышечная слабость. Аппетит снижается, поэтому пациенты постепенно худеют. Гепатомегалия возникает у 63% людей с болезнью Кастлемана, в 33-79% случаев она сочетается с увеличением селезенки.
На поздних стадиях заболевания клинические проявления зависят от локализации гиперплазированной лимфатической ткани. Поражение узлов средостения сопровождается охриплостью голоса, затруднением дыхания и глотания, болями в грудной клетке. Разрастание внутрибрюшных лимфоузлов вызывает боли в животе, диспепсические расстройства, нарушения мочеиспускания.
Осложнения
Наиболее опасной признана мультицентрическая форма, которая зачастую сопровождается полиорганной недостаточностью – основной причиной гибели пациентов с синдромом Кастлемана. Ситуация ухудшается при сочетании болезни с саркомой Капоши и ВИЧ-инфекцией, на фоне которых присоединяются оппортунистические инфекции. Общая 5-летняя выживаемость находится на уровне 55%.
При локальных формах основной проблемой остается нарушение функции соседних органов. Поражение внутрибрюшных узлов чревато развитием механической кишечной непроходимости, нарушением поступления желчи в 12-перстную кишку. При поражении средостения возможна дыхательная недостаточность. При этом показатели выживаемости намного лучше: 94,5% пациентов живут дольше 5 лет после постановки диагноза.
При болезни Кастлемана требуется консультация врача-онкогематолога. Сначала проводится сбор жалоб и анамнеза, далее выполняется физикальный осмотр, Визуально и пальпаторно определяется лимфаденопатия, причем узлы могут быть разной плотности – от мягкой до каменисто твердой. В программу расширенной лабораторно-инструментальной диагностики входят следующие методы:
- УЗИ лимфатических узлов. Ультразвуковая диагностика назначается на первом этапе обследования, чтобы дифференцировать воспалительные и опухолевые процессы. С помощью сонографии удается изучить размеры, контуры и внутреннюю структуру лимфоузла.
- КТ и МРТ. Инструментальная визуализация используется для выявления лимфоидной гиперплазии, определения размеров и локализации пораженных лимфоузлов. На снимках опухолевая масса выглядит как гомогенное новообразование с четкими контурами и интенсивным накоплением контрастного вещества.
- Биопсия лимфоузлов. Для изучения гистологической структуры опухоли и верификации диагноза назначается эксцизионная биопсия, поскольку тонкоигольная пункционная биопсия недостаточно информативна. Уточнить диагноз позволяет иммуногистохимическое исследование образца ткани.
- Анализы крови. В гемограмме обнаруживают лейкоцитоз, тромбоцитоз, анемию и повышение СОЭ. Характерно возрастание уровня С-реактивного белка и других острофазовых показателей. В иммунограмме выявляют повышение интерлейкина-6, при мультицентрическом варианте определяют высокий уровень иммуноглобулином А, М G.
Дифференциальная диагностика
Для постановки диагноза болезни Кастлемана выполняется сложная дифференциальная диагностика между разными лимфопролиферативными патологиями. Необходимо исключить:
- ходжкинские и неходжкинские лимфомы;
- саркоидоз;
- гранулематоз Вегенера;
- гистиоцитоз Х.
При выраженном интоксикационном синдроме исключают реактивные иммунолимфопролиферативные процессы при вирусных, бактериальных и паразитарных инвазиях.

Лечение болезни Кастлемана
Консервативная терапия
Медикаментозное лечение – метод выбора при мультицентрических формах патологии Ситуация осложняется отсутствием единых клинических рекомендаций, поэтому методы терапии подбираются онкогематологами в индивидуальном порядке с учетом клинических особенностей каждого случая. На современном этапе развития медицины назначают такие группы препаратов:
- Цитостатики. Чтобы остановить клеточную пролиферацию, при используются препараты алкилирующего действия, противоопухолевые антибиотики антрациклинового ряда, полусинтетические производные подофиллотоксина.
- Моноклональные антитела. Наиболее изучена активность анти-CD20-антител (ритусуксимаб), которые обеспечивают стойкую ремиссию у 71% пациентов с тяжелыми формами синдрома Кастлемана. К новым направлениям терапии относят прием анти-IL-6-антител.
- Ингибиторы протеосом. Медикаменты снижают уровень интерлейкина 6 в плазме крови, тем самым уменьшая выраженность клинических симптомов и усиливая ответ на комбинированную терапию.
- Противовирусные лекарства. При доказанной корреляции болезни Кастлемана с инфицированием герпесвирусами назначаются этиотропные препараты. ВИЧ-положительным пациентам обязательно проводится антиретровирусная терапия по одной из стандартных схем.
Хирургическое лечение
При локализованных формах заболевания рекомендовано радикальное оперативное вмешательство – удаление пораженного лимфоузла с последующей гистоморфологической диагностикой. Наилучших результатов достигают при гиалино-васкулярном типе опухоли, которая не дает рецидивов. При мультицентрическом процессе хирургическое лечение назначается для удаления особо крупных очагов, которые вызывают компрессию соседних органов.
Прогноз и профилактика
У большинства пациентов с локализованными формами болезни Кастлемана удается достичь полного излечения. При мультицентрических вариантах прогноз менее благоприятный, особенно в группе больных со сниженным иммунным статусом. После лечения пациенты находятся под диспансерным наблюдением врача в течение 3 лет. Поскольку этиологические факторы заболевания точно не установлены, специфических профилактических мероприятий не разработано.
3. Болезнь Кастлемана (обзор литературы)/ А.Л. Меликян, Е.К. Егорова// Онкогематология. – 2016. – №2.
4. Клинико-морфологические особенности различных вариантов болезни Кастлемана/ А.Л. Меликян, Е.К. Егорова, А.М. Ковригина, И.Н. Суборцева// Терапевтический архив. – 2015. – №7.
Читайте также:
